Method Article
Ex Vivo Análisis de transitorios de Ca2+ activados mecánicamente en células uroteliales
En este artículo
Resumen
Este protocolo describe una metodología para evaluar la función de los canales iónicos activados mecánicamente en células uroteliales nativas utilizando el sensor fluorescente de Ca2+ GCaMP5G.
Resumen
Los canales iónicos activados mecánicamente son transductores biológicos que convierten estímulos mecánicos como las fuerzas de estiramiento o cizallamiento en señales eléctricas y bioquímicas. En los mamíferos, los canales activados mecánicamente son esenciales para la detección de estímulos externos e internos en procesos tan diversos como la sensación táctil, la audición, la regulación del volumen de glóbulos rojos, la regulación de la presión arterial basal y la sensación de plenitud de la vejiga urinaria. Si bien la función de los canales iónicos activados mecánicamente se ha estudiado ampliamente en el entorno in vitro utilizando la técnica patch-clamp, evaluar su función en su entorno nativo sigue siendo una tarea difícil, a menudo debido al acceso limitado a los sitios de expresión de estos canales (por ejemplo, terminales aferentes, células de Merkel, barorreceptores y túbulos renales) o dificultades para aplicar la técnica patch-clamp (p. ej., las superficies apicales de las células paraguas uroteliales). Este protocolo describe un procedimiento para evaluar transitorios de Ca 2+ evocados mecánicamente utilizando el sensor fluorescente GCaMP5G en una preparación urotelial ex vivo, una técnica que podría adaptarse fácilmente para el estudio de eventos de Ca2+ evocados mecánicamente en otras preparaciones de tejidos nativos.
Introducción
Las células epiteliales en el tracto urinario están sujetas a fuerzas mecánicas a medida que el filtrado urinario viaja a través de las nefronas, y la orina se bombea fuera de la pelvis renal y viaja a través de los uréteres para almacenarse en la vejiga urinaria. Se ha reconocido desde hace mucho tiempo que las fuerzas mecánicas (por ejemplo, esfuerzo cortante y estiramiento) ejercidas por los fluidos sobre las células epiteliales que recubren el tracto urinario regulan la reabsorción de proteínas en el túbulo proximal y de solutos en la nefrona distal 1,2,3,4,5,6,7,8,9,10,11, 12,13, así como el almacenamiento de orina en la vejiga urinaria y micción14,15,16,17.
La conversión de estímulos mecánicos en señales eléctricas y bioquímicas, proceso denominado mecanotransducción, está mediada por proteínas que responden a la deformación de las estructuras celulares o de la matriz extracelular asociada 18,19,20,21. Los canales iónicos activados mecánicamente son únicos en el sentido de que pasan de un estado cerrado a un estado permeable abierto en respuesta a cambios en la tensión de la membrana, la presión o el esfuerzo cortante 18,19,20,21,22. Además, los transitorios de Ca 2+ pueden iniciarse por mecanotransducción mediada por integrina o por activación de sistemas de adhesión mecanosensibles en las uniones célula-célula23,24,25,26. La función del canal iónico generalmente se evalúa con la técnica patch-clamp, que implica la formación de un sello gigaohm entre la membrana celular y la pipeta del parche27. Sin embargo, las células ubicadas en capas de tejido profundo con una matriz extracelular densa (por ejemplo, túbulos renales) o rodeadas por una barrera física (por ejemplo, glicocalix) son difíciles de acceder con una micropipeta de vidrio. Del mismo modo, las células incrustadas o que son partes integrales de tejidos con poca estabilidad mecánica (por ejemplo, el urotelio) no se pueden estudiar fácilmente con la técnica de parche-pinza. Debido a que muchos canales iónicos activados mecánicamente son permeables al Ca 2+, un enfoque alternativo es evaluar su actividad mediante microscopía fluorescente utilizando un colorante sensible al Ca2+ o indicadores de calcio codificados genéticamente (GECI) como GCaMP. Los esfuerzos recientes en ingeniería de proteínas han aumentado significativamente el rango dinámico, la sensibilidad y la respuesta de los GECI28,29,30, y los avances en genética han permitido su expresión en poblaciones celulares específicas, lo que las hace ideales para estudiar la mecanotransducción.
El urotelio, el epitelio estratificado que cubre el interior de la vejiga urinaria, funciona como una barrera, evitando la difusión de solutos urinarios en el intersticio de la vejiga, pero también funciona como un transductor, detectando la plenitud de la vejiga y comunicando estos eventos a los nervios y la musculatura subyacentes16. Estudios previos han demostrado que la comunicación entre el urotelio y los tejidos subyacentes requiere los canales iónicos activados mecánicamente Piezo1 y Piezo231. Para evaluar los transitorios de Ca 2+ inducidos mecánicamente en células uroteliales, se desarrolló una nueva técnica descrita que utiliza la transferencia de genes adenovirales para expresar el sensor de Ca2+ GCaMP5G en células uroteliales. Esta técnica emplea una preparación de lámina mucosa que proporciona un fácil acceso a la capa celular paraguas más externa y un sistema asistido por computadora para la estimulación mecánica simultánea de células individuales con una micropipeta de vidrio cerrada y el registro de los cambios en la fluorescencia a lo largo del tiempo.
Protocolo
El cuidado y manejo de los animales se llevó a cabo de acuerdo con el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Pittsburgh. Para el presente estudio se utilizaron ratones hembra C57Bl/6J de 2-4 meses de edad. Los ratones se obtuvieron comercialmente (ver Tabla de Materiales).
1. Montaje y configuración del equipo
- Realice imágenes de Ca2+ con un microscopio vertical equipado con una cámara de alta resolución y una fuente de luz estable (consulte la Tabla de materiales).
- Adquiera las imágenes con un software compatible con microscopio que permite el control directo de la cámara, la fuente de luz y el actuador piezoeléctrico a través de un dispositivo de E/S digital USB (consulte la Tabla de materiales).
NOTA: La figura 1 representa un esquema de la configuración. GCaMP5G tiene una longitud de onda de excitación máxima de 470 nm y una longitud de onda de emisión máxima de 497 nm28. Utilice un cubo de filtro adecuado para imágenes GCaMP5G.
- Adquiera las imágenes con un software compatible con microscopio que permite el control directo de la cámara, la fuente de luz y el actuador piezoeléctrico a través de un dispositivo de E/S digital USB (consulte la Tabla de materiales).
- Para la estimulación de células uroteliales individuales en la preparación de la mucosa de la vejiga (ver paso 2), utilice un actuador piezoeléctrico controlado por un controlador piezoeléctrico de bucle abierto de un solo canal (ver Tabla de materiales). Monte el actuador piezoeléctrico en un micromanipulador.
- Monte las micropipetas de vidrio en un soporte de pipeta fijado al actuador piezoeléctrico (figura 1). Opere remotamente el controlador piezoeléctrico mediante un convertidor analógico/digital controlado por un programa de adquisición y análisis de datos electrofisiológicos (consulte la Tabla de materiales).
NOTA: Se utiliza un disparador externo, en forma de una señal lógica transistor-transistor (TTL) iniciada por el software de imágenes, para activar el protocolo de estimulación en el software de adquisición y análisis de datos de electrofisiología que mueve el actuador piezoeléctrico (Figura 1).
- Monte las micropipetas de vidrio en un soporte de pipeta fijado al actuador piezoeléctrico (figura 1). Opere remotamente el controlador piezoeléctrico mediante un convertidor analógico/digital controlado por un programa de adquisición y análisis de datos electrofisiológicos (consulte la Tabla de materiales).
- Asegúrese de que el software de imágenes (consulte Tabla de materiales) interactúe con el dispositivo de E/S digital. Configure un canal de salida digital en el dispositivo de E/S digital USB para entregar la señal TTL al convertidor analógico/digital, que iniciará el protocolo en el software de electrofisiología que mueve el actuador piezoeléctrico.
- Utilice un cable para conectar el puerto Start BNC del convertidor analógico/digital a tierra (GND) y un terminal de tornillo en el dispositivo de E/S digital USB.
- Configure el protocolo de grabación en el software de imágenes.
NOTA: Los pasos siguientes describen cómo generar un protocolo que enviará una señal TTL y comenzará a recopilar imágenes en intervalos de tiempo especificados.- Configure el protocolo de adquisición en el software de imágenes haciendo clic en el Administrador de experimentos y seleccionando Nuevo experimento. Se abrirá una nueva ventana.
- Seleccione el icono Time Lapse Loop y arrástrelo a la ventana recién abierta; Establezca el número de ciclos en 2 y el intervalo en el ajuste más rápido permitido en la configuración.
- Desde el icono Obturador transmitido/Obturador manual, seleccione el icono NI USB-6501 y arrástrelo a la ventana Bucle de lapso de tiempo, y luego configure el NI USB-6501 como cerrado. Arrastre un NI USB-6501 adicional desde el obturador transmitido/obturador manual a la ventana de bucle de lapso de tiempo y configúrelo como abierto. Para conectar los dos íconos de NI USB-6501, arrastre la punta de flecha en el costado del ícono cerrado de NI USB-6501 y tire hasta que toque el ícono abierto de NI USB-6501. Aparecerá una línea que conecta ambos iconos.
- Arrastre otro bucle de lapso de tiempo a la ventana del Administrador de experimentos y conéctelo al primero tirando de la punta de flecha. Establezca los parámetros para la grabación. Establezca el número de ciclos del nuevo bucle de lapso de tiempo en 2400.
- Desde el icono Adquisición de imágenes , arrastre el filtro GFP al bucle de lapso de tiempo abierto recientemente y establezca el tiempo de exposición en 100 ms.
- Establezca el tipo de imagen de la cámara en 8 bits, la resolución en 576 x 576 (Binning 4 x 4), el reloj de píxeles en 480 MHz y la corrección de píxeles en caliente en estándar.
NOTA: Los parámetros se pueden ajustar según el nivel de expresión del sensor fluorescente, la sensibilidad de la cámara y la configuración de configuración.
- Configure el banco de laboratorio en el software de electrofisiología (consulte la Tabla de materiales).
NOTA: Esto definirá la señal de salida en mV del convertidor analógico/digital.- Vaya al menú Configurar en el software de electrofisiología y seleccione Lab Bench. En la ventana Señales de salida resultante, seleccione Analog Out #1, presione Agregar señal y asígnele el nombre (por ejemplo, "Piezo"). Ajuste la unidad de señal a mV y el factor de escala (mV/V) a 1.
- Genere un protocolo de estimulación en el software de electrofisiología siguiendo los pasos a continuación.
- Para generar un nuevo protocolo de estimulación en el software de electrofisiología, vaya al elemento de menú Adquirir y seleccione Nuevo protocolo.
- Establezca el modo/velocidad en estimulación episódica, correr/ probar en 1, barrir/correr a 1 y duración (s) de barrido (s) a 150.
- En el menú Salidas , seleccione el canal #1 Piezo como Salida analógica.
- En el menú Trigger, establezca el trigger (Entrada de inicio del digitalizador) y Internal Timer (Disparador interno).
- En el menú Forma de onda, seleccione el canal #1 y Forma de onda analógica con épocas. Establezca el paso A en Paso, Primer nivel en 0, Nivel Delta en 0, Primera duración en 10000 y Duración Delta en 0.
- Establezca el paso B en Paso, el primer nivel en 10, el nivel Delta en 0, la primera duración en 1000 y la duración delta en 0. Establezca el paso C en Paso, Primer nivel en 0, Nivel Delta en 0, Primera duración en 130000 y Duración delta en 0.
- Guarde el protocolo y asígnele el nombre Protocolo de estimulación.
- Utilice un cable BNC para conectar la salida analógica #1 en el convertidor analógico/digital a la ENTRADA EXT en la parte frontal del controlador piezoeléctrico de bucle abierto de un solo canal (consulte la Tabla de materiales).
- Fabricar micropipetas de vidrio para la estimulación mecánica de células paraguas a partir de tubos de vidrio capilar siguiendo los pasos a continuación.
- Coloque el vidrio capilar en un extractor (consulte Tabla de materiales) y ajústelo con las perillas de retención capilares.
- Coloque la unidad del calefactor a su altura máxima. Ajuste el primer control deslizante de posición de terminación de tracción del tirador a 5.
- Ajuste la primera perilla del calentador a 76.7 y la segunda perilla a 52.7.
- Tire del capilar de vidrio en dos pasos presionando el botón de inicio.
- Cierre la punta de la micropipeta con una microforja (consulte la Tabla de materiales) con la perilla de ajuste del calentador ajustada a 60.
NOTA: Para el presente protocolo, el diámetro final de la punta de micropipeta utilizada para pinchar células individuales es ~1-3 μm.
- Compruebe que la micropipeta estimulante se mueve la distancia especificada en el protocolo de estimulación.
NOTA: Los siguientes pasos son para asegurarse de que 12,5 s después de iniciar el protocolo de estimulación en el software de electrofisiología, se genere un pulso de voltaje con una duración de 1 s, haciendo que el actuador piezoeléctrico se mueva 20 μm.- Monte una micropipeta en el soporte y conéctela al actuador piezoeléctrico.
- Coloque el actuador piezoeléctrico y la micropipeta conectada paralelos al centro de la platina del microscopio y dentro del área de visión.
- Concéntrese en la punta de la pipeta e inmovilice la varilla de montaje piezoeléctrica (consulte la Tabla de materiales) con cinta adhesiva. Bajo iluminación de campo brillante, ajuste los parámetros de la cámara para obtener una imagen clara de la punta de la pipeta.
- Abra el protocolo de estimulación en el software de electrofisiología y configúrelo para que se reproduzca.
NOTA: El protocolo de electrofisiología no se iniciará hasta que se reciba la señal TTL enviada desde el software de imágenes. - Desde Experiment Manager en el software de imágenes, presione Inicio para iniciar la adquisición de datos.
NOTA: Esto activará el protocolo en el software de electrofisiología, que impulsará el actuador piezoeléctrico. El protocolo en el software de imágenes generará un archivo con las imágenes del experimento.
- Verifique la distancia recorrida por la pipeta siguiendo los pasos a continuación.
- Para medir la distancia recorrida por la pipeta durante el protocolo de estimulación, seleccione el elemento Contar y medir en el software de imágenes.
- En el menú Medir , seleccione la opción Medición y ROI, y aparecerá una nueva ventana debajo de la ventana de la película.
- En el menú Medir , elija la línea arbitraria.
- En la ventana de película, dibuje una línea arbitraria que comience en la punta de la pipeta. Tenga en cuenta que el final de la línea arbitraria se ajustará más adelante.
- Haga clic con el botón derecho en la línea arbitraria para convertir la línea en una región de interés (ROI), que será visible en todos los fotogramas de la película.
- Inspeccione la película y ajuste el final de la línea arbitraria (ROI) a la posición final recorrida por la pipeta en respuesta al estímulo.
NOTA: La distancia recorrida por la pipeta en μm aparecerá en la ventana Medición y ROI . El protocolo de estimulación se puede modificar según las necesidades del usuario.
2. Transducción in situ y aislamiento de la mucosa vesical
- Transducir vejigas de ratón hembra in situ con un adenovirus que codifica el ADNc de CGaMP5G según el procedimiento descrito en el protocolo de transducción del virus31.
- Al transducir células uroteliales para experimentos de imágenes de Ca2+ , instilar las vejigas con 50 μL de la solución que contiene 2 x 107 partículas virales infecciosas (PIV).
NOTA: Esta técnica tiende a restringir la expresión de CGaMP5G a la capa de células paraguas. Alternativamente, se podrían realizar experimentos con vejigas urinarias cosechadas de ratones transgénicos que expresan CGaMP5G en células uroteliales (es decir, expresión de GCaMP5G impulsada por un promotor de uroplacina-2) o cualquier otro tipo de célula de interés.
- Al transducir células uroteliales para experimentos de imágenes de Ca2+ , instilar las vejigas con 50 μL de la solución que contiene 2 x 107 partículas virales infecciosas (PIV).
- 24-72 h después de la transducción, sacrificar a los ratones por asfixia deCO2 y realizar una toracotomía abriendo la cavidad torácica con tijeras para hacer colapsar los pulmones.
- Anular la uretra con un catéter de 24 G. Exponga la vejiga mediante una incisión abdominal de ~1.5 cm a través de la piel y el músculo, y use una sutura de 6.0 (consulte la Tabla de materiales) para asegurar el catéter a la uretra.
- Recolectar la vejiga y la uretra32 y fijarlas a una almohadilla de soporte de goma de silicona (ver Tabla de materiales) bañada en solución de registro que contiene (en mM): 135 NaCl, 5.0 KCl, 1 MgCl 2, 2.5 CaCl 2, 10 glucosa, 10 HEPES, pH 7.4, y burbujear con 100% O 2 (Figura 2A).
- Separar la mucosa vesical de la capa muscular subyacente con fórceps finos siguiendo informes publicados previamente32 (Figura 2B).
- Corte la mucosa de la vejiga y fíjela hacia abajo con el urotelio hacia arriba hasta un inserto de elastómero de silicona en el fondo de un plato cultivado de tejido de 35 mm de diámetro (Figura 2C).
3. Estimulación mecánica de células uroteliales individuales e imágenes de Ca2+
- Monte la placa de cultivo de tejido con la mucosa de la vejiga fijada en la etapa de microscopio equipada con una incubadora de placa de cultivo con elementos calefactores resistivos (Figura 2E). Perfundir (siguiendo las instrucciones del fabricante, ver Tabla de materiales) la placa de cultivo celular continuamente a una velocidad de 1,7 ml/min con solución de grabación calentada a ~37 °C con un calentador en línea.
- Mantenga la temperatura de la incubadora de platos de tejido y las soluciones a ~ 37 ° C con un modelo de controlador de temperatura bipolar de doble canal (consulte la Tabla de materiales). Equilibrar el tejido en la cámara con perfusión continua durante al menos 15 minutos antes de realizar más procedimientos experimentales.
- Para registrar transitorios de Ca2+ inducidos mecánicamente, sumerja la micropipeta en la solución bañando la mucosa de la vejiga fijada en la placa de tejido. Mueva la micropipeta al centro del campo con la ayuda de un objetivo de escaneo de bajo aumento (4x) utilizando iluminación de campo brillante.
- Mueva la micropipeta cerca de la superficie del tejido urotelial moviendo coordinadamente el micromanipulador en el plano vertical y ajustando el enfoque.
- Cambie el objetivo a uno con un aumento más alto (20x) adecuado para inmunofluorescencia con una apertura numérica alta (NA).
- Coloque el micromanipulador en Fino y mueva la micropipeta cerca de la parte superior de la celda objetivo.
- Cambie el campo de visión a la cámara y pulse Live en el software de imágenes.
NOTA: Esto debe encender el obturador reflejado y permitir la observación de la señal fluorescente que emite el tejido en la computadora. - Ajuste el enfoque para visualizar la parte superior de la celda y ajuste la posición de la pipeta si es necesario.
- Abra el protocolo de estimulación en el software de electrofisiología y configúrelo para que se reproduzca.
NOTA: El protocolo en el software de electrofisiología no se iniciará hasta que se reciba la señal TTL enviada desde el software de imágenes. - Desde Experiment Manager en el software de imágenes, presione Inicio para iniciar la adquisición de datos. Esto activará el protocolo en el software de electrofisiología, que impulsará el actuador piezoeléctrico y generará un archivo con las imágenes del experimento. El protocolo de estimulación se puede modificar según las necesidades del usuario.
4. Análisis de datos
- Cuantifique la intensidad de fluorescencia a lo largo del tiempo siguiendo los pasos a continuación.
- Abra el archivo de imagen en el software de imágenes y seleccione la ventana Contar y medir . Seleccione la herramienta polígono y dibuje un ROI en los límites de la celda que se pinchó.
- Vaya a la ventana Medida, seleccione Perfil de intensidad, establezca la medida en A lo largo del tiempo, Resultados en promedio, Resta de fondo en ninguno y, a continuación, presione Ejecutar. La intensidad media de fluorescencia se calculará a lo largo del tiempo (Figura 3).
- Para exportar los datos del perfil de intensidad, haga clic en el icono de Excel en la ventana Resultados del perfil de intensidad. Esto permitirá al usuario elegir la carpeta de destino y el nombre del archivo y guardar los datos en un formato .xlsx.
- Realice análisis de datos utilizando gráficos científicos y software de análisis de datos (consulte la Tabla de materiales).
NOTA: La amplitud del pico de Ca2+ evocado por el pinchazo se expresa como el cambio en la intensidad de fluorescencia (ΔF / F), donde F es la intensidad de fluorescencia de GCaMP5G en el momento 0, y ΔF es la diferencia entre los máximos de intensidad de fluorescencia y los basales en el tiempo 0. La disminución de la respuesta de Ca2+ también se puede calcular (no se muestra).
Resultados
El presente protocolo describe una técnica para evaluar transitorios de Ca 2+ evocados mecánicamente en células paraguas utilizando el sensor fluorescente de Ca2+ GCaMP5G. La transducción adenoviral se empleó para expresar GCaMP5G en células uroteliales debido a su alta eficiencia y porque produce un elevado nivel de expresión. Las imágenes fluorescentes de criosecciones teñidas de una vejiga transducida se muestran en la Figura 2D. Para estos experimentos, la expresión de GCaMP5G es más alta en la capa de células paraguas. Una secuencia de imágenes representativas capturadas durante un experimento en el que se pinchó una celda paraguas se muestra en la Figura 3A. La primera imagen de la figura 3A muestra una vista fluorescente de la pipeta estimulante colocada en la parte superior de una célula paraguas de una mucosa vesical que expresa GCaMP5G. La estimulación mecánica de la célula paraguas que expresa GCaMP5G provoca una deformación (ver imagen Figura 3A a 12,5 s), seguida de un rápido aumento de la emisión de fluorescencia (ver imagen Figura 3A a 13,5 s). El cambio en la fluorescencia se trazó en función del tiempo (Figura 3B). Como se informó anteriormente31, el pinchazo evoca una respuesta de Ca2+ en la mayoría de las células paraguas probadas en vejigas de ratones de control y de tipo salvaje transducidos con GCaMP5G. La eliminación de Piezo1 y Piezo2 de las celdas paraguas redujo la amplitud máxima de la respuesta Ca2+ 31. Al comparar el efecto de diferentes tratamientos o antecedentes genéticos en las respuestas de Ca2+ evocadas mecánicamente, es esencial estandarizar las condiciones experimentales, incluida la transducción de la vejiga, el montaje del tejido, el tamaño de la punta de la pipeta utilizada para la indentación, la duración y amplitud del estímulo mecánico y las condiciones de imagen.
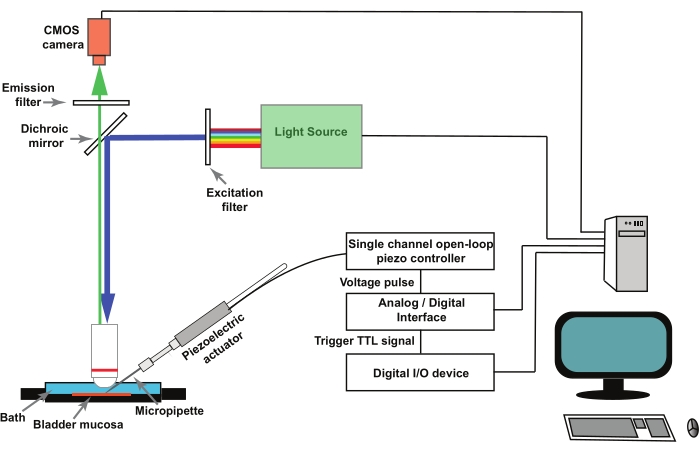
Figura 1: Configuración experimental para registrar transitorios de Ca2+ activados por mecanos en células uroteliales. El equipo consta de un microscopio vertical, fuente de luz fluorescente, filtros de excitación y emisión, y una cámara CMOS. El software de imágenes controla el sistema. Se utiliza un actuador piezoeléctrico controlado por un controlador piezoeléctrico de bucle abierto de un solo canal para mover la micropipeta de pinchazo. Las micropipetas de vidrio se montan en un soporte de pipeta fijado al actuador piezoeléctrico. El actuador piezoeléctrico y la micropipeta asociada están montados en un micromanipulador (no se muestra). El controlador piezoeléctrico de bucle abierto es operado remotamente por un convertidor analógico/digital y un software de electrofisiología. Un protocolo de grabación en el software de imágenes entrega una señal TTL a través de un dispositivo de E/S digital, y esto inicia el protocolo de estimulación en el software de electrofisiología que controla el piezoeléctrico y, posteriormente, la captura de imágenes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Aislamiento y montaje de la mucosa vesical para imágenes de Ca2+ . (A) Preparación de la lámina mucosa con un catéter adjunto. La mucosa de la vejiga fue despojada de la capa muscular subyacente con fórceps finos. (B) Imagen ampliada de la mucosa de la vejiga despojada que se muestra en el panel (A). (C) La mucosa se fijó con el urotelio hacia arriba con alfileres de insectos de 0,15 mm a un inserto de elastómero de silicona. (D) Imágenes de sección transversal de inmunofluorescencia confocal de la preparación de la lámina mucosa teñida con un anticuerpo contra GFP y un anticuerpo conjugado secundario anti-conejo burro (verde), rodamina-faloidina (rojo) y DAPI (azul). La preparación de la mucosa de la vejiga incluye parte de la lámina propia (LP). Las flechas indican la ubicación de la capa de celda paraguas (Ub). Barras de escala = 50 μm. (E) Fotografía de la configuración experimental. a, calentador en línea; B: actuador piezoeléctrico; c, elementos calefactores y controlador; d, soporte de pipeta y micropipeta; e, lámina mucosa unida al inserto de silicona en un plato cultivado de tejido y una incubadora de platos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Registro y análisis de transitorios de Ca2+ mecanoactivados en células uroteliales. (A) Secuencia de imágenes fluorescentes capturadas en diferentes puntos de tiempo durante el curso de un experimento. Tenga en cuenta que la estimulación mecánica de la célula paraguas causa una deformación seguida de un rápido aumento en la emisión de GCaMP5G (flecha). Los bordes de la célula estimulada (ROI) están marcados en rojo. (B) Cambio en la intensidad de fluorescencia (ΔF / F) a lo largo del tiempo para ocho células independientes estimuladas mecánicamente en una preparación de la mucosa de la vejiga de un ratón control. El tiempo de sangría (12,5 s) está marcado con una flecha azul. Los datos de (B) han sido modificados de Dalghi et al.31. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Todos los organismos, y aparentemente la mayoría de los tipos de células, expresan canales iónicos que responden a estímulos mecánicos 20,33,34,35,36,37. La función de estos canales activados mecánicamente se ha evaluado predominantemente con la técnica patch-clamp. Sin embargo, debido a problemas de accesibilidad, los estudios de patch-clamp de canales iónicos activados mecánicamente se han restringido en gran medida a células y líneas celulares disociadas. Dado que muchos canales iónicos activados mecánicamente son permeables al Ca2+, aprovechamos los avances recientes en microscopía, biodetección y micromanipulación para desarrollar un método de imagen para evaluar la función de los canales activados mecánicamente en una preparación urotelial ex vivo. En este protocolo, las células uroteliales se transducen con un adenovirus que codifica para GCaMP5G. Los vectores adenovirales son ideales para estudiar la señalización de Ca 2+ en el urotelio, ya que proporcionan una alta tasa de transducción y altos niveles de expresión de GCaMP5G en células uroteliales (Figura 2D). En estas condiciones, la fluorescencia de fondo es relativamente baja. Si la transducción adenoviral se utiliza para expresar un sensor de Ca2+ codificado genéticamente, se debe hacer especial hincapié en optimizar las condiciones, de modo que solo las células de interés expresen el sensor. Como alternativa, la expresión de indicadores de Ca2+ codificados genéticamente (GECI) podría lograrse cruzando ratones portadores de un transgén floxado que codifica para la proteína de interés (por ejemplo, GCaMP5G) y ratones que expresan Cre recombinasa bajo el control de un promotor adecuado. Este enfoque no requiere procedimientos quirúrgicos y tiene la ventaja de proporcionar una expresión dirigida e incluso niveles de expresión de proteínas en células que expresan Cre recombinasa.
El protocolo descrito aquí utiliza un microscopio vertical de campo amplio para evaluar los transitorios de Ca2+ activados mecánicamente en células paraguas estimuladas con una micropipeta cerrada pulida al fuego. El método podría adaptarse para estudiar la mecanotransducción en capas más profundas del urotelio o incluso células en la lámina propia con un microscopio confocal vertical o de dos fotones. El uso de un microscopio confocal puede proporcionar la resolución necesaria para definir los cambios subcelulares en el Ca2+ intracelular que ocurren en respuesta a la estimulación mecánica. Este protocolo emplea una micropipeta cerrada pulida al fuego para pinchar células paraguas individuales. La principal ventaja de utilizar una micropipeta para la estimulación es que la perturbación mecánica ejercida sobre el tejido es transitoria y limitada a la célula de interés y al área circundante. Mientras que los sistemas de estiramiento celular se pueden utilizar para estimular mecánicamente células cultivadas en membranas PDMS, las limitaciones inherentes impiden el uso de tales dispositivos para experimentos de imagen con preparaciones ex vivo . Estas limitaciones incluyen desafíos con el montaje y la obtención de imágenes de una vejiga de ratón y, dada la naturaleza plegada de la mucosa de la vejiga, dificultades para mantener el enfoque en las células de interés mientras se estira el tejido.
El protocolo para medir transitorios de Ca2+ activados mecánicamente en preparaciones uroteliales tiene algunas limitaciones. En primer lugar, la plataforma incluye componentes relativamente caros, y su montaje y configuración requieren experiencia con microscopios, micromanipuladores, convertidores analógico-digitales y software relativamente especializado. Al igual que la sujeción de parches, esta técnica requiere que el investigador aprenda a usar un micromanipulador y hacer micropipetas de vidrio para la estimulación mecánica. Sin embargo, a diferencia de la técnica patch-clamp, que implica la formación de un sello de alta resistencia entre la pipeta y la membrana, el procedimiento descrito aquí para medir transitorios de Ca2+ activados mecánicamente es relativamente simple y solo requiere que el investigador coloque la pipeta estimuladora cerca de la superficie de la célula a estimular. Por lo tanto, un investigador capacitado puede evaluar potencialmente la respuesta al pinchazo de 8-10 células en 1 hora, lo cual es inconcebible con la técnica de patch-clamp.
Dada la importancia que los canales iónicos activados mecánicamente tienen en la función normal del cuerpo y los estados de enfermedad, se necesitan nuevos métodos para estudiar estos canales en su entorno nativo. Como se describe en este protocolo, los métodos de imagen pueden proporcionar una visión única de cómo estos canales detectan los cambios en su entorno y generan respuestas fisiológicas. Dada la accesibilidad de la superficie mucosa de los órganos en forma de tubo o saco, el método descrito aquí podría adaptarse para estudiar la mecanotransducción en otros entornos, incluidos el intestino, el tracto urogenital, los vasos sanguíneos, etc. Por lo tanto, estudiar las respuestas mecánicas en el cuerpo puede ser ampliamente útil.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por las subvenciones de los NIH R01DK119183 (a G.A. y M.D.C.) y S10OD028596 (a G.A.) y por los Cell Physiology and Model Organisms Kidney Imaging Cores del Pittsburgh Center for Kidney Research (P30DK079307).
Materiales
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
Referencias
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14(2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170(2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984(2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558(2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055(2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados