Method Article
Ex Vivo Analyse des transitoires Ca2+ activés mécaniquement dans les cellules urothéliales
Dans cet article
Résumé
Ce protocole décrit une méthodologie pour évaluer la fonction des canaux ioniques activés mécaniquement dans les cellules urothéliales natives à l’aide du capteur fluorescent Ca2+ GCaMP5G.
Résumé
Les canaux ioniques activés mécaniquement sont des transducteurs biologiques qui convertissent des stimuli mécaniques tels que les forces d’étirement ou de cisaillement en signaux électriques et biochimiques. Chez les mammifères, les canaux activés mécaniquement sont essentiels pour la détection des stimuli externes et internes dans des processus aussi divers que la sensation de toucher, l’ouïe, la régulation du volume des globules rouges, la régulation de la pression artérielle basale et la sensation de plénitude de la vessie. Bien que la fonction des canaux ioniques activés mécaniquement ait été largement étudiée in vitro à l’aide de la technique de patch-clamp, l’évaluation de leur fonction dans leur environnement natif reste une tâche difficile, souvent en raison d’un accès limité aux sites d’expression de ces canaux (par exemple, les terminaisons afférentes, les cellules de Merkel, les barorécepteurs et les tubules rénaux) ou de difficultés à appliquer la technique de patch-clamp (par exemple, les surfaces apicales des cellules parapluies urothéliales). Ce protocole décrit une procédure pour évaluer les transitoires Ca 2+ évoqués mécaniquement à l’aide du capteur fluorescent GCaMP5G dans une préparation urothéliale ex vivo, une technique qui pourrait être facilement adaptée pour l’étude des événements Ca2+ évoqués mécaniquement dans d’autres préparations tissulaires natives.
Introduction
Les cellules épithéliales des voies urinaires sont soumises à des forces mécaniques lorsque le filtrat urinaire traverse les néphrons, et l’urine est pompée hors du bassinet du rein et traverse les uretères pour être stockée dans la vessie. Il est reconnu depuis longtemps que les forces mécaniques (p. ex., contrainte de cisaillement et étirement) exercées par les fluides sur les cellules épithéliales qui tapissent les voies urinaires régulent la réabsorption des protéines dans le tubule proximal et des solutés dans le néphron distal 1,2,3,4,5,6,7,8,9,10,11, 12,13, ainsi que le stockage de l’urine dans la vessie et la miction14,15,16,17.
La conversion de stimuli mécaniques en signaux électriques et biochimiques, un processus appelé mécanotransduction, est médiée par des protéines qui répondent à la déformation des structures cellulaires ou de la matrice extracellulaire associée 18,19,20,21. Les canaux ioniques activés mécaniquement sont uniques en ce sens qu’ils passent d’un état fermé à un état perméable ouvert en réponse aux changements de tension membranaire, de pression ou de contrainte de cisaillement 18,19,20,21,22. De plus, les transitoires Ca 2+ peuvent être initiés par mécanotransduction médiée par l’intégrine ou par activation de systèmes d’adhésion mécanoréactifs aux jonctions cellule-cellule23,24,25,26. La fonction du canal ionique est généralement évaluée avec la technique patch-clamp, qui implique la formation d’un joint gigaohm entre la membrane cellulaire et la pipette patch27. Cependant, les cellules situées dans des couches de tissus profonds avec une matrice extracellulaire dense (p. ex. tubules rénaux) ou entourées d’une barrière physique (p. ex. glycocalice) sont difficiles d’accès avec une micropipette en verre. De même, les cellules incorporées ou qui font partie intégrante de tissus à faible stabilité mécanique (par exemple, l’urothélium) ne peuvent pas être facilement étudiées avec la technique patch-clamp. Étant donné que de nombreux canaux ioniques activés mécaniquement sont perméables au Ca 2+, une autre approche consiste à évaluer leur activité par microscopie fluorescente à l’aide d’un colorant sensible au Ca2+ ou d’indicateurs de calcium génétiquement codés (GECI) tels que GCaMP. Les efforts récents en ingénierie des protéines ont considérablement augmenté la plage dynamique, la sensibilité et la réponse des GECI28,29,30, et les progrès de la génétique ont permis leur expression dans des populations cellulaires spécifiques, ce qui les rend parfaitement adaptés à l’étude de la mécanotransduction.
L’urothélium, l’épithélium stratifié qui recouvre l’intérieur de la vessie, fonctionne comme une barrière, empêchant la diffusion des solutés urinaires dans l’interstitium de la vessie, mais fonctionne également comme un transducteur, détectant la plénitude de la vessie et communiquant ces événements aux nerfs sous-jacents et à la musculature16. Des études antérieures ont montré que la communication entre l’urothélium et les tissus sous-jacents nécessite les canaux ioniques activés mécaniquement Piezo1 et Piezo231. Pour évaluer les transitoires Ca 2+ induits mécaniquement dans les cellules urothéliales, une nouvelle technique décrite qui utilise le transfert de gènes adénoviraux pour exprimer le capteur Ca2+ GCaMP5G dans les cellules urothéliales a été développée. Cette technique utilise une préparation de feuilles muqueuses qui permet un accès facile à la couche cellulaire parapluie la plus externe et un système assisté par ordinateur pour la stimulation mécanique simultanée de cellules individuelles avec une micropipette en verre fermée et l’enregistrement des changements de fluorescence au fil du temps.
Protocole
Les soins et la manipulation des animaux ont été effectués conformément au comité institutionnel de soin et d’utilisation des animaux de l’Université de Pittsburgh. Des souris C57Bl/6J femelles âgées de 2 à 4 mois ont été utilisées pour la présente étude. Les souris ont été obtenues commercialement (voir le tableau des matériaux).
1. Assemblage et configuration de l’équipement
- Effectuez une imagerie Ca2+ avec un microscope droit équipé d’une caméra haute résolution et d’une source lumineuse stable (voir Tableau des matériaux).
- Acquérir les images avec un logiciel compatible microscope qui permet un contrôle direct de la caméra, de la source lumineuse et de l’actionneur piézoélectrique via un périphérique d’E/S numériques USB (voir Tableau des matériaux).
Remarque : Figure 1 représente un schéma de la configuration. GCaMP5G a une longueur d’onde d’excitation de crête de 470 nm et une longueur d’onde d’émission de crête de 497 nm28. Utilisez un cube filtre adapté à l’imagerie GCaMP5G.
- Acquérir les images avec un logiciel compatible microscope qui permet un contrôle direct de la caméra, de la source lumineuse et de l’actionneur piézoélectrique via un périphérique d’E/S numériques USB (voir Tableau des matériaux).
- Pour la stimulation de cellules urothéliales individuelles dans la préparation de la muqueuse vésicale (voir étape 2), utilisez un actionneur piézoélectrique contrôlé par un contrôleur piézoélectrique à boucle ouverte à canal unique (voir le tableau des matériaux). Montez l’actionneur piézoélectrique dans un micromanipulateur.
- Montez les micropipettes en verre dans un support de pipette fixé à l’actionneur piézoélectrique (Figure 1). Commander à distance le contrôleur piézoélectrique par un convertisseur analogique/numérique contrôlé par un programme d’acquisition et d’analyse de données électrophysiologiques (voir le tableau des matériaux).
REMARQUE : Un déclencheur externe, sous la forme d’un signal logique transistor-transistor (TTL) initié par le logiciel d’imagerie, est utilisé pour déclencher le protocole de stimulation dans le logiciel d’acquisition et d’analyse de données électrophysiologiques qui déplace l’actionneur piézoélectrique (Figure 1).
- Montez les micropipettes en verre dans un support de pipette fixé à l’actionneur piézoélectrique (Figure 1). Commander à distance le contrôleur piézoélectrique par un convertisseur analogique/numérique contrôlé par un programme d’acquisition et d’analyse de données électrophysiologiques (voir le tableau des matériaux).
- Assurez-vous que le logiciel d’imagerie (voir le tableau des matériaux) s’interface avec le périphérique d’E/S numériques. Configurez un canal de sortie numérique dans le périphérique d’E/S numérique USB pour fournir le signal TTL au convertisseur analogique/numérique, qui lancera le protocole dans le logiciel d’électrophysiologie qui déplace l’actionneur piézoélectrique.
- Utilisez un câble pour connecter le port BNC de démarrage dans le convertisseur analogique/numérique à la terre (GND) et une borne à vis dans le périphérique d’E/S numériques USB.
- Configurez le protocole d’enregistrement dans le logiciel d’imagerie.
Remarque : Les étapes suivantes décrivent comment générer un protocole qui enverra un signal TTL et commencer à collecter des images à des intervalles de temps spécifiés.- Configurez le protocole d’acquisition dans le logiciel d’imagerie en cliquant sur le gestionnaire d’expériences et en sélectionnant Nouvelle expérience. Une nouvelle fenêtre s’ouvrira.
- Sélectionnez l’icône Time Lapse Loop et faites-la glisser vers la fenêtre nouvellement ouverte; Réglez le nombre de cycles sur 2 et l’intervalle sur le réglage le plus rapide autorisé dans la configuration.
- Dans l’icône Transmitted Shutter/Manual Shutter (Obturateur transmis/Obturateur manuel), sélectionnez l’icône NI USB-6501 et faites-la glisser dans la fenêtre Time Lapse Loop, puis définissez le NI USB-6501 comme fermé. Faites glisser un NI USB-6501 supplémentaire de l’obturateur transmis/de l’obturateur manuel vers la fenêtre Time Lapse Loop et définissez-le comme ouvert. Pour connecter les deux icônes NI USB-6501, faites glisser la pointe de flèche sur le côté de l’icône NI USB-6501 fermée et tirez jusqu’à ce qu’elle touche l’icône NI USB-6501 ouverte. Une ligne reliant les deux icônes apparaîtra.
- Faites glisser une autre boucle accélérée dans la fenêtre du Gestionnaire d’expériences et connectez-la à la première en tirant sur la pointe de flèche. Définissez les paramètres d’enregistrement. Définissez le nombre de cycles de la nouvelle boucle accélérée sur 2400.
- À partir de l’icône Acquisition d’images, faites glisser le filtre GFP dans la boucle accélérée récemment ouverte et définissez le temps d’exposition sur 100 ms.
- Définissez le type d’image de l’appareil photo sur 8 bits, la résolution sur 576 x 576 (Binning 4 x 4), l’horloge des pixels sur 480 MHz et la correction des pixels chauds sur standard.
REMARQUE: Les paramètres peuvent être ajustés en fonction du niveau d’expression du capteur fluorescent, de la sensibilité de la caméra et de la configuration de la configuration.
- Installez le laboratoire dans le logiciel d’électrophysiologie (voir Tableau des matériaux).
REMARQUE: Cela définira le signal de sortie en mV du convertisseur analogique / numérique.- Allez dans le menu Configurer du logiciel d’électrophysiologie et sélectionnez Lab. Dans la fenêtre Signaux de sortie qui s’affiche, sélectionnez Analog Out #1, appuyez sur le bouton Ajouter un signal et nommez-le (par exemple, « Piezo »). Réglez l’unité de signal sur mV et le facteur d’échelle (mV/V) sur 1.
- Générez un protocole de stimulation dans le logiciel d’électrophysiologie en suivant les étapes ci-dessous.
- Pour générer un nouveau protocole de stimulation dans le logiciel d’électrophysiologie, allez à l’élément de menu Acquérir et sélectionnez Nouveau protocole.
- Réglez Mode/Rate sur Stimulation épisodique, Run/Trial sur 1, Sweep/Run sur 1 et Sweep Duration(s) sur 150.
- Dans le menu Sorties , sélectionnez le canal #1 Piezo comme sortie analogique.
- Dans le menu Trigger , réglez le trigger sur Digitizer Start Input and Internal Timer.
- Dans le menu Forme d’onde, sélectionnez le canal #1 et Forme d’onde analogique avec époques. Définissez Étape A sur Étape, Premier niveau sur 0, Niveau Delta sur 0, Première durée sur 10000 et Durée Delta sur 0.
- Définissez Étape B sur Étape, Premier niveau sur 10, Niveau Delta sur 0, Première durée sur 1000 et Durée Delta sur 0. Définissez Étape C sur Étape, Premier Niveau sur 0, Niveau Delta sur 0, Première Durée sur 130000 et Durée Delta sur 0.
- Enregistrez le protocole et nommez-le Protocole de stimulation.
- Utilisez un câble BNC pour connecter la sortie analogique #1 du convertisseur analogique/numérique à l’ENTRÉE EXT située à l’avant du contrôleur piézoélectrique à boucle ouverte à canal unique (voir le tableau des matériaux).
- Fabriquer des micropipettes en verre pour la stimulation mécanique des cellules parapluies à partir de tubes en verre capillaire en suivant les étapes ci-dessous.
- Placez le verre capillaire dans un extracteur (voir le tableau des matériaux) et ajustez-le avec les boutons de retenue capillaires.
- Placez l’appareil de chauffage à sa pleine hauteur. Ajustez le curseur de la première position de terminaison de traction de l’extracteur sur 5.
- Réglez le premier bouton de chauffage sur 76,7 et le deuxième bouton sur 52,7.
- Tirez le capillaire en verre en deux étapes en appuyant sur le bouton de démarrage.
- Fermez la pointe de la micropipette à l’aide d’une microforge (voir le tableau des matériaux) avec le bouton de réglage de l’appareil de chauffage réglé à 60.
NOTE: Pour le présent protocole, le diamètre final de la pointe de la micropipette utilisée pour piquer des cellules individuelles est de ~1-3 μm.
- Vérifiez que la micropipette stimulante se déplace de la distance spécifiée dans le protocole de stimulation.
REMARQUE: Les étapes suivantes consistent à s’assurer que 12,5 s après le début du protocole de stimulation dans le logiciel d’électrophysiologie, une impulsion de tension d’une durée de 1 s est générée, faisant bouger l’actionneur piézoélectrique de 20 μm.- Montez une micropipette dans le support et fixez-la à l’actionneur piézoélectrique.
- Placez l’actionneur piézoélectrique et la micropipette fixée parallèlement au centre de la platine du microscope et dans la zone de vision.
- Concentrez-vous sur la pointe de la pipette et immobilisez la tige de montage piézoélectrique (voir Tableau des matériaux) avec du ruban adhésif. Sous un éclairage en champ lumineux, ajustez les paramètres de la caméra pour obtenir une image claire de la pointe de la pipette.
- Ouvrez le protocole de stimulation dans le logiciel d’électrophysiologie et réglez-le pour jouer.
REMARQUE: Le protocole d’électrophysiologie ne démarrera pas tant que le signal TTL envoyé par le logiciel d’imagerie n’aura pas été reçu. - À partir d’Experiment Manager dans le logiciel de création d’images, appuyez sur Démarrer pour lancer l’acquisition des données.
REMARQUE: Cela déclenchera le protocole dans le logiciel d’électrophysiologie, qui pilotera l’actionneur piézoélectrique. Le protocole du logiciel d’imagerie générera un fichier avec les images de l’expérience.
- Vérifiez la distance parcourue par la pipette en suivant les étapes ci-dessous.
- Pour mesurer la distance parcourue par la pipette pendant le protocole de stimulation, sélectionnez l’élément Compter et mesurer dans le logiciel d’imagerie.
- Dans le menu Mesurer , sélectionnez l’option Mesure et retour sur investissement, et une nouvelle fenêtre apparaîtra sous la fenêtre vidéo.
- Dans le menu Mesurer , choisissez la ligne arbitraire.
- Dans la fenêtre vidéo, tracez une ligne arbitraire commençant à la pointe de la pipette. Notez que la fin de la ligne arbitraire sera ajustée ultérieurement.
- Faites un clic droit sur la ligne arbitraire pour convertir la ligne en une région d’intérêt (ROI), qui sera visible dans toutes les images vidéo.
- Inspectez le film et réglez la fin de la ligne arbitraire (ROI) à la position finale parcourue par la pipette en réponse au stimulus.
REMARQUE: La distance parcourue par la pipette en μm apparaîtra dans la fenêtre Mesure et retour sur investissement . Le protocole de stimulation peut être modifié en fonction des besoins de l’utilisateur.
2. Transduction in situ et isolement de la muqueuse vésicale
- Transduire in situ des vessies de souris femelles avec un adénovirus codant pour l’ADNc du CGaMP5G selon la procédure décrite dans le protocole de transduction virale31.
- Lors de la transduction de cellules urothéliales pour des expériences d’imagerie Ca2+ , instiller dans la vessie 50 μL de la solution contenant 2 x 107 particules virales infectieuses (IVP).
Remarque : Cette technique tend à restreindre l’expression de CGaMP5G à la couche de cellule parapluie. Alternativement, des expériences pourraient être menées avec des vessies prélevées sur des souris transgéniques exprimant CGaMP5G dans des cellules urothéliales (c.-à-d. l’expression GCaMP5G entraînée par un promoteur uroplakine-2) ou tout autre type de cellule d’intérêt.
- Lors de la transduction de cellules urothéliales pour des expériences d’imagerie Ca2+ , instiller dans la vessie 50 μL de la solution contenant 2 x 107 particules virales infectieuses (IVP).
- 24-72 h après la transduction, euthanasier les souris par asphyxie au CO2 et effectuer une thoracotomie en ouvrant la cavité thoracique avec des ciseaux pour provoquer l’affaissement des poumons.
- Canuler l’urètre avec un cathéter de 24 G. Exposez la vessie par une incision abdominale de ~1,5 cm à travers la peau et les muscles, et utilisez une suture de 6,0 (voir le tableau des matériaux) pour fixer le cathéter à l’urètre.
- Prélever la vessie et l’urètre 32 et les fixer sur un tampon de support en caoutchouc de silicone (voir tableau des matières) baigné dans une solution d’enregistrement contenant (en mM) : 135 NaCl, 5,0 KCl, 1 MgCl2, 2,5 CaCl2, 10 glucose, 10 HEPES, pH 7,4, et bouillonner à 100% O2 (Figure 2A).
- Séparer la muqueuse de la vessie de la couche musculaire sous-jacente à l’aide d’une pince fine conformément aux rapports publiés précédemment32 (figure 2B).
- Coupez la muqueuse de la vessie et épinglez-la avec l’urothélium vers le haut jusqu’à un insert en élastomère de silicone dans le fond d’une capsule de culture tissulaire de 35 mm de diamètre (figure 2C).
3. Stimulation mécanique des cellules urothéliales individuelles et imagerie Ca2+
- Monter la capsule de culture tissulaire avec la muqueuse vésicale épinglée au stade microscope équipé d’un incubateur à boîtes de culture avec des éléments chauffants résistifs (Figure 2E). Perfuser (en suivant les instructions du fabricant, voir le tableau des matériaux) la capsule de culture cellulaire en continu à un débit de 1,7 mL/min avec une solution d’enregistrement chauffée à ~37 °C avec un chauffage en ligne.
- Maintenir la température de l’incubateur à vaisselle en tissu et des solutions à ~37 °C avec un modèle de régulateur de température bipolaire à double canal (voir Tableau des matériaux). Équilibrer le tissu dans la chambre avec une perfusion continue pendant au moins 15 minutes avant d’effectuer d’autres procédures expérimentales.
- Pour enregistrer les transitoires Ca2+ induits mécaniquement, immergez la micropipette dans la solution en baignant la muqueuse vésicale épinglée dans le plat tissu. Déplacez la micropipette vers le centre du champ à l’aide d’un objectif de balayage à faible grossissement (4x) en utilisant un éclairage en champ clair.
- Déplacez la micropipette près de la surface du tissu urothélial en déplaçant de manière coordonnée le micromanipulateur dans le plan vertical et en ajustant la mise au point.
- Basculez l’objectif vers un objectif avec un grossissement plus élevé (20x) adapté à l’immunofluorescence avec une ouverture numérique élevée (NA).
- Réglez le micromanipulateur sur Fine et déplacez la micropipette près du haut de la cellule cible.
- Changez le champ de vision en caméra et appuyez sur Live dans le logiciel d’imagerie.
REMARQUE: Cela doit allumer l’obturateur réfléchi et permettre l’observation du signal fluorescent émis par le tissu de l’ordinateur. - Ajustez la mise au point pour visualiser le haut de la cellule et ajustez la position de la pipette si nécessaire.
- Ouvrez le protocole de stimulation dans le logiciel d’électrophysiologie et réglez-le pour jouer.
REMARQUE: Le protocole dans le logiciel d’électrophysiologie ne démarre pas tant que le signal TTL envoyé par le logiciel d’imagerie n’est pas reçu. - À partir d’Experiment Manager dans le logiciel de création d’images, appuyez sur Démarrer pour lancer l’acquisition des données. Cela déclenchera le protocole dans le logiciel d’électrophysiologie, qui pilotera l’actionneur piézoélectrique et générera un fichier avec les images de l’expérience. Le protocole de stimulation peut être modifié en fonction des besoins de l’utilisateur.
4. Analyse des données
- Quantifier l’intensité de fluorescence au fil du temps en suivant les étapes ci-dessous.
- Ouvrez le fichier image dans le logiciel d’imagerie et sélectionnez la fenêtre Compter et mesurer . Sélectionnez l’outil polygone et dessinez un retour sur investissement sur les limites de la cellule qui a été insérée.
- Accédez à la fenêtre Mesurer, sélectionnez Profil d’intensité, définissez la mesure sur Au fil du temps, Résultats sur Moyenne, Soustraction d’arrière-plan sur aucune, puis appuyez sur Exécuter. L’intensité moyenne de fluorescence sera calculée au fil du temps (Figure 3).
- Pour exporter les données du profil d’intensité, cliquez sur l’icône Excel dans la fenêtre Résultats du profil d’intensité. Cela permettra à l’utilisateur de choisir le dossier de destination et le nom du fichier et d’enregistrer les données dans un format .xlsx.
- Effectuer des analyses de données à l’aide d’un logiciel de représentation graphique et d’analyse de données scientifiques (voir le tableau des matériaux).
NOTE: L’amplitude du pic Ca2+ évoqué par piqûre est exprimée comme le changement d’intensité de fluorescence (ΔF / F), où F est l’intensité de fluorescence de GCaMP5G au temps 0, et ΔF est la différence entre les maxima d’intensité de fluorescence et la base au temps 0. La désintégration de la réponse Ca2+ peut également être calculée (non représentée).
Résultats
Le présent protocole décrit une technique permettant d’évaluer les transitoires Ca 2+ évoqués mécaniquement dans les cellules parapluies à l’aide du capteur fluorescent Ca2+ GCaMP5G. La transduction adénovirale a été utilisée pour exprimer GCaMP5G dans les cellules urothéliales en raison de sa grande efficacité et parce qu’elle produit un niveau élevé d’expression. Des images fluorescentes de cryosections colorées provenant d’une vessie transduite sont présentées à la figure 2D. Pour ces expériences, l’expression GCaMP5G est la plus élevée dans la couche de cellule parapluie. Une séquence d’images représentatives capturées au cours d’une expérience où une cellule parapluie a été piquée est illustrée à la figure 3A. La première image de la figure 3A montre une vue fluorescente de la pipette stimulante positionnée au sommet d’une cellule parapluie d’une muqueuse vésicale exprimant GCaMP5G. La stimulation mécanique de la cellule parapluie exprimant GCaMP5G provoque une déformation (voir image Figure 3A à 12,5 s), suivie d’une augmentation rapide de l’émission de fluorescence (voir image Figure 3A à 13,5 s). Le changement de fluorescence a été tracé en fonction du temps (Figure 3B). Comme indiqué précédemment31, le piqûre évoque une réponse Ca2+ dans la plupart des cellules parapluies testées dans la vessie de souris témoins et de souris de type sauvage transduites avec GCaMP5G. La suppression de Piezo1 et Piezo2 des cellules parapluies a réduit l’amplitude maximale de la réponse Ca2+ 31. Lors de la comparaison de l’effet de différents traitements ou antécédents génétiques sur les réponses Ca2+ évoquées mécaniquement, il est essentiel de normaliser les conditions expérimentales, y compris la transduction de la vessie, le montage du tissu, la taille de la pointe de la pipette utilisée pour l’indentation, la durée et l’amplitude du stimulus mécanique et les conditions d’imagerie.
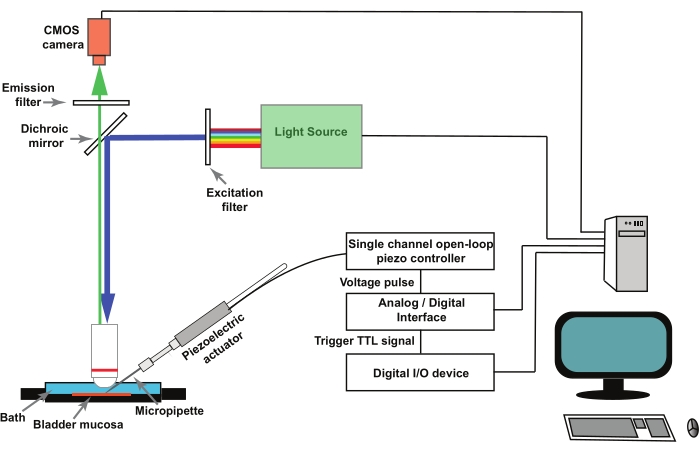
Figure 1 : Configuration expérimentale pour enregistrer les transitoires Ca2+ activés par mécano dans les cellules urothéliales. L’engin se compose d’un microscope vertical, d’une source de lumière fluorescente, de filtres d’excitation et d’émission et d’une caméra CMOS. Le logiciel d’imagerie contrôle le système. Un actionneur piézoélectrique contrôlé par un contrôleur piézoélectrique à boucle ouverte à canal unique est utilisé pour déplacer la micropipette de pique. Les micropipettes en verre sont montées dans un support de pipette fixé à l’actionneur piézoélectrique. L’actionneur piézoélectrique et la micropipette associée sont montés sur un micromanipulateur (non illustré). Le contrôleur piézoélectrique en boucle ouverte est commandé à distance par un convertisseur analogique/numérique et un logiciel d’électrophysiologie. Un protocole d’enregistrement dans le logiciel d’imagerie délivre un signal TTL via un dispositif d’E/S numérique, ce qui initie le protocole de stimulation dans le logiciel d’électrophysiologie qui contrôle la capture piézoélectrique et, par la suite, l’image. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Isolement et montage de la muqueuse vésicale pour l’imagerie Ca2+. A) Préparation de la feuille muqueuse avec un cathéter attaché. La muqueuse de la vessie a été retirée de la couche musculaire sous-jacente avec une fine pince. (B) Image agrandie de la muqueuse de la vessie dénudée montrée dans le panneau (A). (C) La muqueuse a été épinglée avec l’urothélium vers le haut avec des épingles à insectes de 0,15 mm à un insert en élastomère de silicone. (D) Images en coupe efficace d’immunofluorescence confocale de la préparation de la feuille muqueuse colorée avec un anticorps contre la GFP et un anticorps conjugué secondaire anti-lapin d’âne (vert), rhodamine-phalloïdine (rouge) et DAPI (bleu). La préparation de la muqueuse de la vessie comprend une partie de la lamina propria (LP). Les flèches indiquent l’emplacement de la couche de cellule parapluie (Ub). Barres d’échelle = 50 μm. (E) Photographie de l’installation expérimentale. a, chauffage en ligne; b, actionneur piézoélectrique; c, éléments chauffants et contrôleur; d, porte-pipette et micropipette; e, feuille muqueuse fixée à l’insert en silicone dans un plat de culture tissulaire et un incubateur à vaisselle. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 3. Enregistrement et analyse des transitoires Ca2+ mécano-activés dans les cellules urothéliales. (A) Séquence d’images fluorescentes capturées à différents moments au cours d’une expérience. Notez que la stimulation mécanique de la cellule parapluie provoque une déformation suivie d’une augmentation rapide de l’émission de GCaMP5G (flèche). Les bordures de la cellule stimulée (ROI) sont marquées en rouge. (B) Changement de l’intensité de fluorescence (ΔF/F) au fil du temps pour huit cellules indépendantes stimulées mécaniquement dans une préparation de muqueuse vésicale provenant d’une souris témoin. Le temps d’indentation (12,5 s) est marqué d’une flèche bleue. Les données de (B) ont été modifiées à partir de Dalghi et al.31. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Tous les organismes, et apparemment la plupart des types cellulaires, expriment des canaux ioniques qui répondent à des stimuli mécaniques 20,33,34,35,36,37. La fonction de ces canaux activés mécaniquement a été principalement évaluée avec la technique du patch-clamp. Cependant, en raison de problèmes d’accessibilité, les études patch-clamp des canaux ioniques activés mécaniquement ont été largement limitées aux cellules dissociées et aux lignées cellulaires. Étant donné que de nombreux canaux ioniques activés mécaniquement sont perméables au Ca2+, nous avons tiré parti des progrès récents de la microscopie, de la biodétection et de la micromanipulation pour développer une méthode d’imagerie permettant d’évaluer la fonction des canaux activés mécaniquement dans une préparation urothéliale ex vivo. Dans ce protocole, les cellules urothéliales sont transduites avec un adénovirus codant pour GCaMP5G. Les vecteurs adénoviraux sont parfaitement adaptés à l’étude de la signalisation Ca 2+ dans l’urothélium, car ils fournissent un taux élevé de transduction et des niveaux élevés d’expression de GCaMP5G dans les cellules urothéliales (Figure 2D). Dans ces conditions, la fluorescence de fond est relativement faible. Si la transduction adénovirale est utilisée pour exprimer un capteur Ca2+ génétiquement codé, un accent particulier doit être mis sur l’optimisation des conditions, de sorte que seules les cellules d’intérêt expriment le capteur. Comme alternative, l’expression d’indicateurs Ca2+ génétiquement codés (GECI) pourrait être obtenue en croisant des souris porteuses d’un transgène floxed codant pour la protéine d’intérêt (par exemple, GCaMP5G) et des souris exprimant Cre recombinase sous le contrôle d’un promoteur approprié. Cette approche ne nécessite pas d’interventions chirurgicales et présente l’avantage de fournir une expression ciblée et même des niveaux d’expression des protéines dans les cellules exprimant la Cre recombinase.
Le protocole décrit ici utilise un microscope à grand champ vertical pour évaluer les transitoires Ca2+ activés mécaniquement dans les cellules parapluies stimulées par une micropipette fermée polie au feu. La méthode pourrait être adaptée pour étudier la mécanotransduction dans les couches profondes de l’urothélium ou même les cellules de la lamina propria avec un microscope confocal droit ou à deux photons. L’utilisation d’un microscope confocal peut fournir la résolution nécessaire pour définir les changements subcellulaires dans le Ca2+ intracellulaire qui se produisent en réponse à une stimulation mécanique. Ce protocole utilise une micropipette fermée polie au feu pour piquer des cellules parapluies individuelles. Le principal avantage de l’utilisation d’une micropipette pour la stimulation est que la perturbation mécanique exercée sur le tissu est transitoire et limitée à la cellule d’intérêt et à la zone environnante. Alors que les systèmes d’étirement cellulaire peuvent être utilisés pour stimuler mécaniquement les cellules cultivées sur les membranes PDMS, les limitations inhérentes empêchent l’utilisation de tels dispositifs pour des expériences d’imagerie avec des préparations ex vivo . Ces limitations comprennent des défis avec le montage et l’imagerie d’une vessie de souris et, compte tenu de la nature pliée de la muqueuse de la vessie, des difficultés à maintenir la concentration sur les cellules d’intérêt tout en étirant le tissu.
Le protocole de mesure des transitoires Ca2+ activés mécaniquement dans les préparations urothéliales présente certaines limites. Tout d’abord, l’engin comprend des composants relativement coûteux, et son assemblage et sa configuration nécessitent une expertise avec des microscopes, des micromanipulateurs, des convertisseurs analogiques-numériques et des logiciels relativement spécialisés. Comme le patch-clamping, cette technique nécessite que l’investigateur apprenne à utiliser un micromanipulateur et à fabriquer des micropipettes en verre pour la stimulation mécanique. Cependant, contrairement à la technique patch-clamp, qui implique la formation d’un joint à haute résistance entre la pipette et la membrane, la procédure décrite ici pour mesurer les transitoires Ca2+ activés mécaniquement est relativement simple et nécessite seulement que l’investigateur positionne la pipette de stimulation près de la surface de la cellule à stimuler. Par conséquent, un chercheur qualifié peut potentiellement évaluer la réponse à la piqûre de 8 à 10 cellules en 1 heure, ce qui est inconcevable avec la technique du patch-clamp.
Compte tenu de l’importance des canaux ioniques activés mécaniquement dans le fonctionnement normal du corps et les états pathologiques, de nouvelles méthodes sont nécessaires pour étudier ces canaux dans leur milieu d’origine. Comme décrit dans ce protocole, les méthodes d’imagerie peuvent fournir un aperçu unique de la façon dont ces canaux détectent les changements dans leur environnement et génèrent des réponses physiologiques. Compte tenu de l’accessibilité de la surface muqueuse des organes en forme de tube ou de sac, la méthode décrite ici pourrait être adaptée pour étudier la mécanotransduction dans d’autres contextes, notamment l’intestin, le tractus urogénital, les vaisseaux sanguins, etc. Ainsi, l’étude des réponses mécaniques dans le corps peut être largement utile.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par les subventions NIH R01DK119183 (à G.A. et M.D.C.) et S10OD028596 (à G.A.) et par les noyaux d’imagerie rénale Cell Physiology and Model Organisms du Pittsburgh Center for Kidney Research (P30DK079307).
matériels
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
Références
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14 (2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2 (2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170 (2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984 (2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558 (2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055 (2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon