Method Article
אקס ויוו ניתוח של Ca2+ transients מופעל מכנית בתאי השתן
In This Article
Summary
פרוטוקול זה מתאר מתודולוגיה להערכת תפקודן של תעלות יונים המופעלות מכנית בתאי שתן טבעיים באמצעות חיישן Ca2+ פלואורסצנטי GCaMP5G.
Abstract
תעלות יונים המופעלות מכנית הן מתמרים ביולוגיים הממירים גירויים מכניים כגון כוחות מתיחה או גזירה לאותות חשמליים וביוכימיים. ביונקים, תעלות המופעלות באופן מכני חיוניות לאיתור גירויים חיצוניים ופנימיים בתהליכים מגוונים כמו תחושת מגע, שמיעה, ויסות נפח תאי הדם האדומים, ויסות לחץ הדם הבסיסי ותחושת מלאות בשלפוחית השתן. בעוד שתפקודן של תעלות יונים המופעלות באופן מכני נחקר בהרחבה בסביבה חוץ-גופית תוך שימוש בטכניקת מהדק הטלאים, הערכת תפקודן בסביבתן הטבעית נותרה משימה קשה, לעתים קרובות בגלל גישה מוגבלת לאתרי הביטוי של תעלות אלה (למשל, טרמינלים רגשיים, תאי מרקל, ברצפטורים וצינוריות כליות) או קשיים ביישום טכניקת מהדק הטלאים (למשל, המשטחים האפיקליים של תאי מטריה של השתן). פרוטוקול זה מתאר הליך להערכת מעברי Ca 2+ מעוררים מכנית באמצעות חיישן פלואורסצנטי GCaMP5G בהכנה אורותלית ex vivo, טכניקה שניתן להתאים בקלות לחקר אירועי Ca2+ מעוררים מכנית בתכשירים רקמתיים מקומיים אחרים.
Introduction
תאי אפיתל בדרכי השתן נתונים לכוחות מכניים כאשר סינון השתן עובר דרך הנפרונים, והשתן נשאב מאגן הכליה ועובר דרך השופכנים כדי להיאגר בשלפוחית השתן. זה זמן רב ידוע כי כוחות מכניים (למשל, לחץ גזירה ומתיחה) המופעלים על ידי נוזלים על תאי אפיתל המרפדים את דרכי השתן מווסתים את הספיגה מחדש של חלבון בצינורית הפרוקסימלית ושל מומסים בנפרון הדיסטלי 1,2,3,4,5,6,7,8,9,10,11, 12,13, וכן אחסון שתן בשלפוחית השתן והשתן14,15,16,17.
ההמרה של גירויים מכניים לאותות חשמליים וביוכימיים, תהליך המכונה מכנוטרנסדוקציה, מתווכת על ידי חלבונים המגיבים לעיוות של מבנים תאיים או מטריצה חוץ-תאיתקשורה 18,19,20,21. תעלות יונים המופעלות באופן מכני הן ייחודיות במובן זה שהן עוברות ממצב סגור למצב חדיר פתוח בתגובה לשינויים במתח הממברנה, לחץ או לחץ גזירה 18,19,20,21,22. בנוסף, Ca 2+ transients יכול להיות מופעל על ידי mechanotransduction בתיווך אינטגרין או על ידי הפעלה של מערכות הידבקות mechanoresponsive בצמתים תאתא 23,24,25,26. תפקוד תעלת היונים מוערך בדרך כלל בטכניקת מהדק טלאי, הכוללת היווצרות חותם ג'יגה-אוהם בין קרום התא לבין פיפטת התיקון27. עם זאת, תאים הממוקמים בשכבות רקמה עמוקות עם מטריצה חוץ-תאית צפופה (למשל, צינוריות כליות) או מוקפים במחסום פיזי (למשל, glycocalyx) קשה לגשת עם מיקרופיפטה זכוכית. כמו כן, תאים המשובצים או שהם חלקים אינטגרליים של רקמות עם יציבות מכנית ירודה (למשל, אורותל) לא ניתן לחקור בקלות עם טכניקת מהדק טלאי. מכיוון שתעלות יונים רבות המופעלות מכנית חדירות ל- Ca 2+, גישה חלופית היא להעריך את פעילותן על ידי מיקרוסקופ פלואורסצנטי באמצעות צבע רגיש ל- Ca2+ או מחווני סידן מקודדים גנטית (GECIs) כגון GCaMP. מאמצים אחרונים בהנדסת חלבונים הגדילו באופן משמעותי את הטווח הדינמי, הרגישות והתגובה של GECIs28,29,30, וההתקדמות בגנטיקה אפשרה את ביטוים באוכלוסיות תאים ספציפיות, מה שהופך אותם למתאימים באופן אידיאלי לחקר מכנוטרנסדוקציה.
האורוטל, האפיתל המרובד המכסה את פנים שלפוחית השתן, מתפקד כמחסום, מונע דיפוזיה של מומסים בשתן לתוך אינטרסטיציום שלפוחית השתן, אך מתפקד גם כמתמר, חש מלאות שלפוחית השתן ומתקשר אירועים אלה לעצבים ולשרירים הבסיסיים16. מחקרים קודמים הראו כי התקשורת בין השתן לבין הרקמות הבסיסיות דורשת את תעלות היונים המופעלות מכנית Piezo1 ו- Piezo231. כדי להעריך את מעברי Ca 2+ המושרים מכנית בתאי השתן, פותחה טכניקה חדשה שתוארה המשתמשת בהעברת גנים אדנו-ויראליים כדי לבטא את חיישן Ca2+ GCaMP5G בתאי השתן. טכניקה זו משתמשת בהכנת יריעה רירית המספקת גישה קלה לשכבת תאי המטריה החיצונית ביותר ומערכת בסיוע מחשב לגירוי מכני סימולטני של תאים בודדים עם מיקרופיפטה סגורה מזכוכית ורישום שינויים בפלואורסצנטיות לאורך זמן.
Protocol
הטיפול והטיפול בבעלי החיים בוצעו בהתאם לוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת פיטסבורג. נקבות עכברי C57Bl/6J בנות 2-4 חודשים שימשו במחקר הנוכחי. העכברים הושגו באופן מסחרי (ראו טבלת חומרים).
1. הרכבה והתקנה של ציוד
- בצע הדמיה Ca2+ עם מיקרוסקופ זקוף המצויד במצלמה ברזולוציה גבוהה ומקור אור יציב (ראה טבלת חומרים).
- רכוש את התמונות באמצעות תוכנה תואמת מיקרוסקופ המאפשרת שליטה ישירה במצלמה, במקור האור ובמפעיל piezo באמצעות התקן קלט/פלט דיגיטלי מסוג USB (ראה טבלת חומרים).
הערה: איור 1 מייצג סכימה של ההתקנה. ל- GCaMP5G אורך גל עירור שיא של 470 ננומטר ואורך גל פליטת שיא של 497 ננומטר28. השתמש בקוביית מסנן המתאימה להדמיית GCaMP5G.
- רכוש את התמונות באמצעות תוכנה תואמת מיקרוסקופ המאפשרת שליטה ישירה במצלמה, במקור האור ובמפעיל piezo באמצעות התקן קלט/פלט דיגיטלי מסוג USB (ראה טבלת חומרים).
- לגירוי תאי דרכי השתן הבודדים בהכנת רירית שלפוחית השתן (ראה שלב 2), השתמש במפעיל פיאזואלקטרי הנשלט על ידי בקר פיאזו בעל לולאה פתוחה חד-ערוצית (ראה טבלת חומרים). הר את המפעיל piezoelectric ב micromanipulator.
- הרכיבו את מיקרופיפטות הזכוכית במחזיק פיפטה המודבק למפעיל הפיזואלקטרי (איור 1). הפעל מרחוק את בקר Piezo באמצעות ממיר אנלוגי/דיגיטלי הנשלט על ידי תוכנית לאיסוף וניתוח נתונים אלקטרופיזיולוגיים (ראה טבלת חומרים).
הערה: טריגר חיצוני, בצורת אות לוגיקת טרנזיסטור-טרנזיסטור (TTL) המופעל על-ידי תוכנת ההדמיה, משמש להפעלת פרוטוקול הגירוי בתוכנת איסוף הנתונים והניתוח של אלקטרופיזיולוגיה שמזיזה את המפעיל הפיזואלקטרי (איור 1).
- הרכיבו את מיקרופיפטות הזכוכית במחזיק פיפטה המודבק למפעיל הפיזואלקטרי (איור 1). הפעל מרחוק את בקר Piezo באמצעות ממיר אנלוגי/דיגיטלי הנשלט על ידי תוכנית לאיסוף וניתוח נתונים אלקטרופיזיולוגיים (ראה טבלת חומרים).
- ודא שתוכנת ההדמיה (ראה רשימת חומרים) מתממשקת להתקן הקלט/פלט הדיגיטלי. הגדר ערוץ פלט דיגיטלי בהתקן הקלט/פלט הדיגיטלי USB כדי להעביר את אות TTL לממיר האנלוגי/דיגיטלי, אשר יפעיל את הפרוטוקול בתוכנת האלקטרופיזיולוגיה המזיזה את המפעיל הפיזואלקטרי.
- השתמש בכבל כדי לחבר את יציאת Start BNC בממיר האנלוגי/דיגיטלי לקרקע (GND) ובמסוף בורג בהתקן הקלט/פלט הדיגיטלי מסוג USB.
- הגדר את פרוטוקול ההקלטה בתוכנת ההדמיה.
הערה: השלבים הבאים מתארים כיצד ליצור פרוטוקול שישלח אות TTL ולהתחיל לאסוף תמונות במרווחי זמן שצוינו.- הגדר את פרוטוקול הרכישה בתוכנת ההדמיה על-ידי לחיצה על מנהל הניסויים ובחירה באפשרות ניסוי חדש. ייפתח חלון חדש.
- בחר את הסמל Time Lapse Loop וגרור אותו לחלון החדש שנפתח; הגדר את מספר המחזורים ל- 2 ואת מרווח הזמן להגדרה המהירה ביותר המותרת בהתקנה.
- מהסמל Transmit Shutter/Manual Shutter, בחר את הסמל NI USB-6501 וגרור אותו לחלון Time Lapse Loop ולאחר מכן הגדר את NI USB-6501 כסגור. גרור NI USB-6501 נוסף מהתריס המשודר/התריס הידני לחלון Time Lapse Loop והגדר אותו כפתוח. כדי לחבר את שני סמלי NI USB-6501, גרור את ראש החץ בצד הסמל הסגור של NI USB-6501 ומשוך עד שהוא ייגע בסמל הפתוח של NI USB-6501. יופיע קו המחבר בין שני הסמלים.
- גרור לולאת קיטועי זמן נוספת לחלון מנהל הניסויים וחבר אותה לחלון הראשון על-ידי משיכת ראש החץ. הגדר את הפרמטרים להקלטה. הגדר את מספר המחזורים של Time Lapse Loop החדש ל- 2400.
- מהסמל Image Acquisition , גרור את מסנן GFP לתוך Time Lapse Loop שנפתח לאחרונה והגדר את זמן החשיפה ל- 100ms.
- הגדר את סוג התמונה במצלמה ל - 8 סיביות, את הרזולוציה ל- 576 x 576 (Binning 4 x 4), את שעון הפיקסלים ל- 480 MHz ואת תיקון הפיקסלים החמים לסטנדרט.
הערה: ניתן לכוונן את הפרמטרים בהתאם לרמת הביטוי של חיישן הפלואורסצנט, רגישות המצלמה ותצורת ההתקנה.
- הגדר את ספסל המעבדה בתוכנת האלקטרופיזיולוגיה (ראה טבלת חומרים).
הערה: פעולה זו תגדיר את אות הפלט ב- mV של הממיר האנלוגי/דיגיטלי.- עבור לתפריט הגדר בתוכנת האלקטרופיזיולוגיה ובחר ספסל מעבדה. בחלון אותות פלט שנוצר, בחר יציאה אנלוגית #1, לחץ על הוסף אות ותן לו שם (לדוגמה, "Piezo"). הגדר את יחידת האות ל- mV ואת גורם קנה המידה (mV/V) ל- 1.
- צור פרוטוקול גירוי בתוכנת האלקטרופיזיולוגיה לפי השלבים הבאים.
- כדי ליצור פרוטוקול גירוי חדש בתוכנת האלקטרופיזיולוגיה, עבור אל פריט התפריט רכוש ובחר פרוטוקול חדש.
- הגדר מצב/קצב לגירוי אפיזודי, הפעלה/ניסיון ל- 1, טאטוא/הפעלה ל- 1 והמשך טאטוא (ים) ל- 150.
- בתפריט פלטים , בחר ערוץ #1 Piezo כיציאה אנלוגית.
- בתפריט גורם מפעיל , הגדר את הגורם המפעיל לקלט הפעלה של Digitizer ולטיימר פנימי.
- בתפריט צורת גל, בחר ערוץ #1 וצורת גל אנלוגית עם Epochs. הגדר שלב א' לשלב, רמה ראשונה ל- 0, רמת דלתא ל- 0, משך ראשון ל- 10000 ומשך דלתא ל- 0.
- הגדר שלב B לשלב, רמה ראשונה ל- 10, רמת דלתא ל- 0, משך ראשון ל- 1000 ומשך דלתא ל- 0. הגדר שלב C לשלב, רמה ראשונה ל- 0, רמת דלתא ל- 0, משך ראשון ל- 130000 ומשך דלתא ל- 0.
- שמור את הפרוטוקול וקרא לו פרוטוקול גירוי.
- השתמש בכבל BNC כדי לחבר פלט אנלוגי #1 בממיר האנלוגי/דיגיטלי לכניסת EXT בחזית בקר Piezo בלולאה פתוחה חד-ערוצית (ראה רשימת חומרים).
- לייצר מיקרופיפטות זכוכית לגירוי מכני של תאי מטריה מצינורות זכוכית נימיים בעקבות השלבים הבאים.
- הניחו את הזכוכית הנימית במושך (ראו טבלת חומרים) והתאימו אותה באמצעות ידיות התמך של הנימים.
- מקמו את יחידת החימום במלוא גובהה. התאם את מחוון מיקום סיום המשיכה הראשון של המושך ל- 5.
- כוונו את ידית המחמם הראשונה ל-76.7 ואת הידית השנייה ל-52.7.
- משוך את נימי הזכוכית בשני שלבים על ידי לחיצה על לחצן ההפעלה.
- סגור את קצה המיקרופיפטה עם מיקרופורג' (ראה טבלת חומרים) כאשר ידית הכוונון של המחמם מוגדרת על 60.
הערה: עבור הפרוטוקול הנוכחי, הקוטר הסופי של קצה המיקרופיפטה המשמש לחיטוט תאים בודדים הוא ~ 1-3 מיקרומטר.
- ודא שהמיקרופיפטה המגרה מזיזה את המרחק שצוין בפרוטוקול הגירוי.
הערה: השלבים הבאים הם להבטיח כי 12.5 שניות לאחר הפעלת פרוטוקול הגירוי בתוכנת האלקטרופיזיולוגיה, נוצר פולס מתח עם משך של 1 שניות, מה שהופך את המפעיל הפיזואלקטרי לנוע 20 מיקרומטר.- הר micropipette במחזיק ולחבר אותו מפעיל piezoelectric .
- מקם את המפעיל הפיזואלקטרי ואת המיקרופיפטה המחוברת במקביל למרכז שלב המיקרוסקופ ובתוך שטח הראייה.
- התמקדו בקצה הפיפטה ושתקו את מוט ההרכבה הפיזואלקטרי (ראו טבלת חומרים) בעזרת נייר דבק. תחת תאורת שדה בהירה, התאם את פרמטרי המצלמה כדי להשיג תמונה ברורה של קצה הפיפטה.
- פתח את פרוטוקול הגירוי בתוכנת האלקטרופיזיולוגיה והגדר אותו להפעלה.
הערה: פרוטוקול האלקטרופיזיולוגיה לא יופעל עד לקבלת אות TTL שנשלח מתוכנת ההדמיה. - מתוך מנהל הניסויים בתוכנת ההדמיה, הקש על התחל כדי ליזום איסוף נתונים.
הערה: פעולה זו תפעיל את הפרוטוקול בתוכנת האלקטרופיזיולוגיה, אשר תניע את המפעיל הפיזואלקטרי. הפרוטוקול בתוכנת ההדמיה ייצור קובץ עם תמונות הניסוי.
- ודא את המרחק שעבר פיפטה לפי השלבים הבאים.
- כדי למדוד את המרחק שעברה פיפטה במהלך פרוטוקול הגירוי, בחר בפריט ספירה ומדידה בתוכנת ההדמיה.
- בתפריט מדידה , בחר באפשרות מדידה והחזר השקעה, וחלון חדש יופיע מתחת לחלון הסרט.
- בתפריט ' מדידה ', בחרו 'קו שרירותי'.
- בחלון הסרט, ציירו קו שרירותי המתחיל בקצה הפיפטה. שים לב שסוף הקו השרירותי יותאם מאוחר יותר.
- לחץ לחיצה ימנית על הקו השרירותי כדי להמיר את הקו לאזור עניין (ROI), שיהיה גלוי בכל מסגרות הסרט.
- בדוק את הסרט והתאם את סוף הקו השרירותי (ROI) למיקום הסופי שנעה פיפטה בתגובה לגירוי.
הערה: המרחק שעברה פיפטה במיקרומטר יופיע בחלון מדידה והחזר השקעה . ניתן לשנות את פרוטוקול הגירוי בהתאם לצרכי המשתמש.
2. התמרה באתרו ובידוד של רירית שלפוחית השתן
- התמירו שלפוחיות עכבר נקבות באתרן עם אדנו-וירוס המקודד את cDNA של CGaMP5G בהתאם להליך המתואר בפרוטוקול התמרה של וירוסים31.
- בעת המרת תאי דרכי השתן לניסויי הדמיה Ca2+ , להחדיר לשלפוחית השתן 50 μL של תמיסה המכילה 2 x 107 חלקיקים נגיפיים זיהומיים (IVP).
הערה: טכניקה זו נוטה להגביל את הביטוי של CGaMP5G לשכבת תא המטריה. לחלופין, ניתן לערוך ניסויים עם שלפוחיות שתן שנקצרו מעכברים טרנסגניים המבטאים CGaMP5G בתאי דרכי השתן (כלומר, ביטוי GCaMP5G המונע על ידי פרומוטור אורופלקין-2) או כל סוג תא אחר של עניין.
- בעת המרת תאי דרכי השתן לניסויי הדמיה Ca2+ , להחדיר לשלפוחית השתן 50 μL של תמיסה המכילה 2 x 107 חלקיקים נגיפיים זיהומיים (IVP).
- 24-72 שעות לאחר הטרנסדוקציה, הרדימו את העכברים על ידי חנק CO2 ובצעו כריתת בית החזה על ידי פתיחת חלל החזה עם מספריים כדי לגרום לקריסת הריאות.
- לקנן את השופכה עם קטטר 24 גרם. יש לחשוף את שלפוחית השתן על ידי חתך בטני של ~1.5 ס"מ דרך העור והשריר, ולהשתמש בתפר 6.0 (ראה טבלת חומרים) כדי לאבטח את הצנתר לשופכה.
- יש לקצור את שלפוחית השתן והשופכה32 ולהצמיד לכרית מחזיק גומי סיליקון (ראו טבלת חומרים) שטופה בתמיסת הקלטה המכילה (במילימ): 135 NaCl, 5.0 KCl, 1 MgCl 2, 2.5 CaCl 2, 10 גלוקוז, 10 HEPES, pH 7.4, ומבעבע למעלה עם 100% O2 (איור 2A).
- הפרידו את רירית שלפוחית השתן מהשכבה השרירית שמתחתיה בעזרת מלקחיים עדינים בעקבות דוחות32 שפורסמו בעבר (איור 2B).
- חתכו את רירית שלפוחית השתן והצמידו אותה כלפי מטה כשהאורותל פונה כלפי מעלה לאלסטומר סיליקון בתחתית צלחת תרבית רקמה בקוטר 35 מ"מ (איור 2C).
3. גירוי מכני של תאי דרכי השתן בודדים והדמיית Ca2+
- הרכיבו את צלחת תרבית הרקמה עם רירית שלפוחית השתן המוצמדת בשלב המיקרוסקופ המצוידת באינקובטור צלחת תרבית עם גופי חימום התנגדותיים (איור 2E). מחורר (בהתאם להוראות היצרן, ראה טבלת חומרים) את צלחת תרבית התאים ברציפות בקצב של 1.7 מ"ל לדקה עם תמיסת הקלטה מחוממת ב~ 37 ° C עם תנור חימום מובנה.
- שמור על הטמפרטורה של אינקובטור צלחת הרקמה ותמיסות ב~ 37 ° C עם מודל בקר טמפרטורה דו-קוטבי דו-ערוצי דו-ערוצי (ראה טבלת חומרים). אזנו את הרקמה בתא עם זילוח רציף במשך 15 דקות לפחות לפני ביצוע הליכים ניסיוניים נוספים.
- כדי להקליט מעבר Ca2+ המושרה מכנית, טבלו את המיקרופיפטה בתמיסה השוטפת את רירית שלפוחית השתן המוצמדת בצלחת הרקמה. הזז את המיקרופיפטה למרכז השדה בעזרת מטרת סריקה בהגדלה נמוכה (4x) באמצעות תאורת שדה בהיר.
- הזז את המיקרופיפטה קרוב לפני השטח של רקמת השתן על ידי הזזת המיקרומניפולטור במישור האנכי והתאמת המיקוד.
- החלף את המטרה לאחת עם הגדלה גבוהה יותר (20x) המתאימה לאימונופלואורסנציה עם צמצם מספרי גבוה (NA).
- הגדר את המיקרומניפולטור לפיין והזז את המיקרופיפטה קרוב לחלק העליון של תא היעד.
- שנה את שדה הראייה למצלמה ולחץ על Live בתוכנת ההדמיה.
הערה: פעולה זו חייבת להפעיל את התריס המוחזר ולאפשר תצפית של האות הפלואורסצנטי הנפלט מהרקמה במחשב. - כוונן את המיקוד כדי להמחיש את החלק העליון של התא וכוונן את מיקום פיפטה במידת הצורך.
- פתח את פרוטוקול הגירוי בתוכנת האלקטרופיזיולוגיה והגדר אותו להפעלה.
הערה: הפרוטוקול בתוכנת האלקטרופיזיולוגיה לא יופעל עד לקבלת אות TTL שנשלח מתוכנת ההדמיה. - מתוך מנהל הניסויים בתוכנת ההדמיה, הקש על התחל כדי ליזום איסוף נתונים. זה יפעיל את הפרוטוקול בתוכנת האלקטרופיזיולוגיה, שתניע את המפעיל הפיזואלקטרי ותיצור קובץ עם תמונות הניסוי. ניתן לשנות את פרוטוקול הגירוי בהתאם לצרכי המשתמש.
4. ניתוח נתונים
- כמת את עוצמת הפלואורסצנטיות לאורך זמן לפי השלבים הבאים.
- פתחו את קובץ התמונה בתוכנת ההדמיה ובחרו בחלון ' ספירה ומדידה' . בחר בכלי מצולע וצייר החזר השקעה על גבולות התא שנדקר.
- עבור אל החלון מדידה, בחר פרופיל עוצמה, הגדר את המדידה כלאורך זמן, תוצאות לממוצע, חיסור רקע ללא ולאחר מכן הקש על ביצוע. עוצמת הפלואורסצנטיות הממוצעת תחושב לאורך זמן (איור 3).
- כדי לייצא את נתוני פרופיל העוצמה, לחץ על סמל Excel בחלון תוצאות פרופיל עוצמה. פעולה זו תאפשר למשתמש לבחור את תיקיית היעד ואת שם הקובץ ולשמור את הנתונים בתבנית .xlsx.
- ביצוע ניתוח נתונים באמצעות גרפים מדעיים ותוכנות ניתוח נתונים (ראה טבלת חומרים).
הערה: המשרעת של שיא Ca2+ המתעורר על ידי חיטוט מבוטא כשינוי בעוצמת הפלואורסצנטיות (ΔF/F), כאשר F היא עוצמת הפלואורסצנטיות של GCaMP5G בזמן 0, ו- ΔF הוא ההבדל בין עוצמת הפלואורסצנטיות המקסימלית לבין הבסיסית בזמן 0. ניתן גם לחשב את הדעיכה של תגובת Ca2+ (לא מוצגת).
תוצאות
הפרוטוקול הנוכחי מתאר טכניקה להערכת מעברי Ca 2+ מעוררים מכנית בתאי מטריה באמצעות חיישן Ca2+ פלואורסצנטי GCaMP5G. התמרה אדנו-ויראלית שימשה לביטוי GCaMP5G בתאי דרכי השתן בשל יעילותו הגבוהה ומשום שהוא מייצר רמת ביטוי גבוהה. תמונות פלואורסצנטיות של קריוקציות מוכתמות משלפוחית שתן מומרת מוצגות באיור 2D. עבור ניסויים אלה, ביטוי GCaMP5G הוא הגבוה ביותר בשכבת תא המטריה. רצף של תמונות מייצגות שצולמו במהלך ניסוי שבו נדקר תא מטריה מוצג באיור 3A. התמונה הראשונה באיור 3A מראה מראה פלואורסצנטי של פיפטה מעוררת הממוקמת בחלק העליון של תא מטריה של רירית שלפוחית השתן המבטאת GCaMP5G. גירוי מכני של תא המטריה המבטא GCaMP5G גורם לעיוות (ראו תמונה איור 3A ב-12.5 שניות), ואחריו לעלייה מהירה בפליטה הפלואורסצנטית (ראו תמונה איור 3A ב-13.5 שניות). השינוי בפלואורסצנטיות שורטט כפונקציה של זמן (איור 3B). כפי שדווח קודם לכן31, חיטוט מעורר תגובת Ca2+ ברוב תאי המטריה שנבדקו בשלפוחית השתן מקבוצת ביקורת ובעכברי בר שהותמרו באמצעות GCaMP5G. מחיקת Piezo1 ו-Piezo2 מתאי מטריה הפחיתה את משרעת השיא של תגובת Ca2+ 31. כאשר משווים את ההשפעה של טיפולים שונים או רקע גנטי על תגובות Ca2+ המעוררות מכנית, חיוני לתקנן את תנאי הניסוי, כולל התמרה של שלפוחית השתן, הרכבה של הרקמה, גודל קצה פיפטה המשמש להזחה, משך גירוי מכני ומשרעת, ותנאי הדמיה.
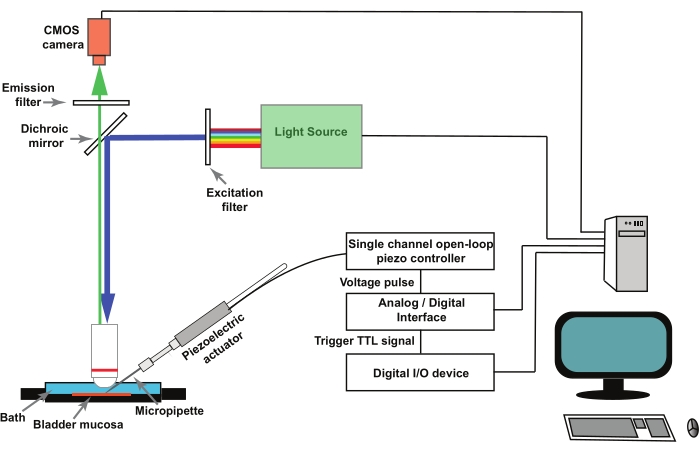
איור 1: מערך ניסויי לרישום מעברי Ca2+ המופעלים על ידי מכנו בתאי דרכי השתן. האסדה מורכבת ממיקרוסקופ זקוף, מקור אור פלואורסצנטי, מסנני עירור ופליטה ומצלמת CMOS. תוכנת ההדמיה שולטת במערכת. מפעיל פיאזואלקטרי הנשלט על ידי בקר פיאזו לולאה פתוחה בעל ערוץ יחיד משמש להזזת המיקרופיפטה החיטוטית. מיקרופיפטות זכוכית מותקנות במחזיק פיפטה המודבק למפעיל הפיזואלקטרי. המפעיל הפיזואלקטרי והמיקרופיפטה המשויכת אליו מותקנים על מיקרומניפולטור (לא מוצג). בקר הלולאה הפתוחה piezo מופעל מרחוק על ידי ממיר אנלוגי/דיגיטלי ותוכנת אלקטרופיזיולוגיה. פרוטוקול הקלטה בתוכנת ההדמיה מעביר אות TTL באמצעות התקן קלט/פלט דיגיטלי, וזה מתחיל את פרוטוקול הגירוי בתוכנת האלקטרופיזיולוגיה השולטת בפיזואלקטרית, ולאחר מכן בלכידת התמונה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: בידוד והרכבה של רירית שלפוחית השתן לצורך הדמיית Ca2+ . (A) הכנת יריעות רירית עם קטטר מחובר. רירית שלפוחית השתן הופשטה מהשכבה השרירית שמתחתיה בעזרת מלקחיים עדינים. (B) תמונה מוגדלת של רירית שלפוחית השתן המופשטת המוצגת בלוח (A). (C) הרירית הוצמדה כלפי מטה כשהאורותל פונה כלפי מעלה בסיכות חרקים בקוטר 0.15 מ"מ לתוספת אלסטומר סיליקון. (D) תמונות חתך קונפוקליות של הכנת יריעות רירית מוכתמות בנוגדן נגד GFP וחמור משני נגד ארנב מצומד (ירוק), רודמין-פלואידין (אדום) ו-DAPI (כחול). ההכנה לרירית שלפוחית השתן כוללת חלק מהלמינה פרופריה (LP). חצים מציינים את מיקום שכבת תא המטריה (Ub). פסי קנה מידה = 50 מיקרומטר. (E) תצלום של מערך הניסוי. א, תנור בטור; ב, מפעיל פיאזואלקטרי; ג, אלמנטים תנור ובקר; d, מחזיק פיפטה ומיקרופיפטה; E, יריעה רירית המחוברת לעלון הסיליקון בתבשיל תרבית רקמה ואינקובטור כלים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3. הקלטה וניתוח של מעברי Ca2+ המופעלים על ידי מכנו בתאי השתן. (A) רצף של תמונות פלואורסצנטיות שצולמו בנקודות זמן שונות במהלך ניסוי. שים לב כי גירוי מכני של תא המטריה גורם לעיוות ואחריו עלייה מהירה בפליטה של GCaMP5G (חץ). גבולות התא המגורה (ROI) מסומנים באדום. (B) שינוי בעוצמת הפלואורסצנטיות (ΔF/F) לאורך זמן עבור שמונה תאים עצמאיים שעוררו מכנית בהכנה רירית שלפוחית השתן מעכבר ביקורת. זמן הכניסה (12.5 שניות) מסומן בחץ כחול. הנתונים ב-(B) שונו מ-Dalghi et al.31. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
כל האורגניזמים, ולכאורה רוב סוגי התאים, מבטאים תעלות יונים המגיבות לגירויים מכניים 20,33,34,35,36,37. הפונקציה של תעלות מופעלות מכנית אלה הוערכה בעיקר עם טכניקת מהדק טלאי. עם זאת, בשל בעיות נגישות, מחקרי מהדק טלאי של תעלות יונים המופעלות מכנית הוגבלו במידה רבה לתאים וקווי תאים מנותקים. מאחר שתעלות יונים רבות המופעלות מכנית חדירותל-Ca+Ca 2, ניצלנו את ההתקדמות האחרונה במיקרוסקופיה, ביו-חישה ומיקרומניפולציה כדי לפתח שיטת הדמיה להערכת תפקודן של תעלות המופעלות מכנית בתכשיר אורותל ex vivo. בפרוטוקול זה, תאי השתן מומרים עם אדנווירוס המקודד עבור GCaMP5G. וקטורים אדנו-ויראליים מתאימים באופן אידיאלי לחקר איתות Ca 2+ באורותל, שכן הם מספקים קצב גבוה של התמרה ורמות גבוהות של ביטוי GCaMP5G בתאי השתן (איור 2D). בתנאים אלה, פלואורסצנטיות הרקע נמוכה יחסית. אם משתמשים בהתמרה אדנו-ויראלית כדי לבטא חיישן Ca2+ מקודד גנטית, יש לתת דגש מיוחד לאופטימיזציה של התנאים, כך שרק התאים המעניינים מבטאים את החיישן. כחלופה, ביטוי של אינדיקטורים Ca2+ מקודדים גנטית (GECIs) יכול להיות מושג על ידי חציית עכברים הנושאים טרנסגן floxed המקודד לחלבון המעניין (למשל, GCaMP5G) ועכברים המבטאים Cre recombinase תחת שליטה של פרומוטור מתאים. גישה זו אינה דורשת פרוצדורות כירורגיות ויש לה את היתרון של מתן ביטוי ממוקד ואף רמות ביטוי של חלבונים בתאים המבטאים Cre recombinase.
הפרוטוקול המתואר כאן משתמש במיקרוסקופ זקוף בעל שדה רחב כדי להעריך מעברים Ca2+ המופעלים מכנית בתאי מטריה המעוררים באמצעות מיקרופיפטה מלוטשת אש סגורה. השיטה יכולה להיות מותאמת לחקר מכנוטרנסדוקציה בשכבות עמוקות יותר של האורוטליום או אפילו תאים בלמינה פרופריה עם מיקרוסקופ קונפוקלי זקוף או שני פוטונים. שימוש במיקרוסקופ קונפוקלי עשוי לספק את הרזולוציה הדרושה כדי להגדיר שינויים תת-תאיים ב- Ca2+ תוך תאיים המתרחשים בתגובה לגירוי מכני. פרוטוקול זה משתמש במיקרופיפטה סגורה מלוטשת אש כדי לדקור תאי מטריה בודדים. היתרון העיקרי בשימוש במיקרופיפטה לגירוי הוא שההפרעה המכנית המופעלת על הרקמה היא חולפת ומוגבלת לתא העניין והסביבה. בעוד שניתן להשתמש במערכות מתיחה של תאים כדי לגרות באופן מכני תאים הגדלים על קרומי PDMS, מגבלות מובנות מעכבות את השימוש במכשירים כאלה לניסויי הדמיה עם תכשירים ex vivo . מגבלות אלה כוללות אתגרים בהרכבה ובהדמיה של שלפוחית השתן של עכבר, ובהתחשב באופי המקופל של רירית שלפוחית השתן, קשיים בשמירה על מיקוד בתאים המעניינים בעת מתיחת הרקמה.
לפרוטוקול למדידת מעברי Ca2+ המופעלים מכנית בתכשירי דרכי השתן יש כמה מגבלות. ראשית, האסדה כוללת רכיבים יקרים יחסית, והרכבתה והקמתה דורשות מומחיות במיקרוסקופים, מיקרומניפולטורים, ממירים אנלוגיים-דיגיטליים ותוכנות מיוחדות יחסית. בדומה להידוק טלאים, טכניקה זו דורשת מהחוקר ללמוד כיצד להשתמש במיקרומניפולטור ולייצר מיקרופיפטות זכוכית לגירוי מכני. עם זאת, בניגוד לטכניקת מהדק הטלאים, הכוללת היווצרות אטם בעל התנגדות גבוהה בין הפיפט לממברנה, ההליך המתואר כאן למדידת מעברי Ca2+ המופעלים מכנית הוא פשוט יחסית ורק דורש מהחוקר למקם את פיפטת הגירוי קרוב לפני השטח של התא כדי להיות מגורה. לכן, חוקר מיומן יכול להעריך את התגובה לחיטוט של 8-10 תאים תוך שעה, דבר שאינו מתקבל על הדעת בטכניקת מהדק טלאי.
בהתחשב בחשיבות שיש לתעלות יונים המופעלות באופן מכני בתפקוד תקין של הגוף ובמצבי מחלה, יש צורך בשיטות חדשות כדי לחקור תעלות אלה בסביבה הטבעית שלהן. כפי שמתואר בפרוטוקול זה, שיטות הדמיה יכולות לספק תובנה ייחודית לגבי האופן שבו ערוצים אלה חשים שינויים בסביבתם ומייצרים תגובות פיזיולוגיות. בהתחשב בנגישות של פני השטח הריריים של איברים בצורת צינור או שק, השיטה המתוארת כאן יכולה להיות מותאמת לחקר mechanotransduction בסביבות אחרות, כולל המעי, דרכי השתן, כלי הדם וכו '. לכן, חקר תגובות מכניות בגוף עשוי להיות שימושי באופן נרחב.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקי NIH R01DK119183 (ל- G.A. ו- MDC) ו- S10OD028596 (ל- G.A.) ועל ידי ליבות הדמיית הכליות של פיזיולוגיה של התא ואורגניזמים מודל של מרכז פיטסבורג לחקר הכליות (P30DK079307).
Materials
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
References
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14(2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170(2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984(2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558(2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055(2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved