Method Article
エクスビボ 尿路上皮細胞における機械的に活性化されたCa2+ トランジェントの解析
要約
このプロトコルは、蛍光Ca2+ センサーGCaMP5Gを使用して、天然尿路上皮細胞における機械的に活性化されたイオンチャネルの機能を評価する方法論を説明しています。
要約
機械的に活性化されたイオンチャネルは、伸張力やせん断力などの機械的刺激を電気的および生化学的信号に変換する生物学的トランスデューサです。哺乳類では、機械的に活性化されたチャネルは、触覚、聴覚、赤血球体積調節、基礎血圧調節、および膀胱充満感の感覚などの多様なプロセスにおける外部および内部刺激の検出に不可欠です。機械的に活性化されたイオンチャネルの機能は、パッチクランプ法を用いてin vitro設定で広く研究されてきましたが、多くの場合、これらのチャネルの発現部位(例えば、求心性末端、メルケル細胞、圧受容器、および尿細管)へのアクセスが制限されているため、またはパッチクランプ技術を適用することが困難であるため(例えば、 尿路上皮傘細胞の頂端表面)。このプロトコルは、ex vivo尿路上皮調製物における蛍光センサーGCaMP5Gを使用して機械的に誘発されたCa2+過渡現象を評価する手順を説明しており、他の天然組織調製物における機械的に誘発されたCa2+事象の研究に容易に適合できる技術である。
概要
尿路の上皮細胞は、尿路がネフロンを通って移動し、尿が腎盂から汲み出され、尿管を通って膀胱に貯蔵されるときに機械的な力を受けます。尿路を覆う上皮細胞に流体が及ぼす機械的力(せん断応力や伸張など)が、近位尿細管のタンパク質と遠位ネフロンの溶質の再吸収を調節することが長い間認識されてきました1,2,3,4,5,6,7,8,9,10,11、12,13、ならびに膀胱および排尿における尿の貯蔵14,15,16,17。
機械的刺激の電気的および生化学的シグナルへの変換は、メカノトランスダクションと呼ばれるプロセスであり、細胞構造の変形または関連する細胞外マトリックスに応答するタンパク質によって媒介される18、19、20、21。機械的に活性化されたイオンチャネルは、膜の張力、圧力、またはせん断応力の変化に応答して、閉じた状態から開いた透過性状態に遷移するという意味で独特です18、19、20、21、22。さらに、Ca2+トランジェントは、インテグリン媒介メカノトランスダクションによって、または細胞−細胞接合部23、24、25、26におけるメカノ応答性接着系の活性化によって開始され得る。イオンチャネル機能は、通常、細胞膜とパッチピペット27との間にギガオームシールを形成することを含むパッチクランプ技術を用いて評価される。しかしながら、緻密な細胞外マトリックスを有する深部組織層に位置する細胞(例えば、腎臓尿細管)または物理的障壁(例えば、グリコカリックス)によって囲まれている細胞は、ガラスマイクロピペットではアクセスが困難である。同様に、埋め込まれた細胞、または機械的安定性の悪い組織(尿路上皮など)の不可欠な部分である細胞は、パッチクランプ技術では容易に研究できません。機械的に活性化されたイオンチャネルの多くはCa2+を透過するため、別のアプローチは、Ca2+感受性色素またはGCaMPなどの遺伝的にコードされたカルシウム指示薬(GECI)を使用した蛍光顕微鏡法によってそれらの活性を評価することです。タンパク質工学における最近の取り組みにより、GECI 28,29,30のダイナミックレンジ、感度、および応答が大幅に向上し、遺伝学の進歩により、特定の細胞集団での発現が可能になり、メカノトランスダクションの研究に理想的になりました。
尿路上皮、膀胱の内部を覆う層状上皮は、バリアとして機能し、膀胱間質への尿中溶質の拡散を防ぎますが、トランスデューサーとしても機能し、膀胱の充満感を感知し、これらのイベントを基礎となる神経と筋肉組織に伝達します16。以前の研究では、尿路上皮とその下にある組織との間の通信には、機械的に活性化されたイオンチャネルPiezo1およびPiezo2が必要であることが示されています31。尿路上皮細胞において機械的に誘導されたCa2+一過性を評価するために、アデノウイルス遺伝子導入を使用して尿路上皮細胞においてCa2+センサーGCaMP5Gを発現させるという記載の新しい技術が開発された。この技術は、最も外側の傘細胞層に簡単にアクセスできる粘膜シート調製と、閉じたガラスマイクロピペットによる個々の細胞の機械的刺激と時間の経過に伴う蛍光の変化の記録を同時に行うコンピューター支援システムを採用しています。
プロトコル
動物の世話と取り扱いは、ピッツバーグ大学施設動物管理および使用委員会に従って実施されました。本研究では、生後2〜4か月のC57Bl / 6Jマウスの雌を使用しました。マウスは商業的に入手した( 材料表参照)。
1.機器の組み立てとセットアップ
- 高解像度カメラと安定した光源を備えた正立顕微鏡でCa 2+ イメージングを実行します( 材料表を参照)。
- USBデジタルI/Oデバイス を介して カメラ、光源、ピエゾアクチュエータを直接制御できる顕微鏡互換ソフトウェアを使用して画像を取得します( 材料表を参照)。
メモ: 図1 は、セットアップの回路図を表しています。GCaMP5Gは、470nmのピーク励起波長と497nmのピーク発光波長28を有する。GCaMP5Gイメージングに適したフィルターキューブを使用してください。
- USBデジタルI/Oデバイス を介して カメラ、光源、ピエゾアクチュエータを直接制御できる顕微鏡互換ソフトウェアを使用して画像を取得します( 材料表を参照)。
- 膀胱粘膜調製物中の個々の尿路上皮細胞の刺激(ステップ2を参照)には、単一チャネル開ループピエゾコントローラによって制御される圧電アクチュエータを使用します( 材料の表を参照)。圧電アクチュエータをマイクロマニピュレータに実装します。
- 圧電アクチュエータに取り付けられたピペットホルダーにガラスマイクロピペットを取り付けます(図1)。電気生理学データ収集および分析プログラムによって制御されるアナログ/デジタルコンバータによってピエゾコントローラをリモート操作します( 材料表を参照)。
注:イメージングソフトウェアによって開始されるトランジスタ-トランジスタロジック(TTL)信号の形式の外部トリガを使用して、圧電アクチュエータを動かす電気生理学データ収集および解析ソフトウェアの刺激プロトコルをトリガします(図1)。
- 圧電アクチュエータに取り付けられたピペットホルダーにガラスマイクロピペットを取り付けます(図1)。電気生理学データ収集および分析プログラムによって制御されるアナログ/デジタルコンバータによってピエゾコントローラをリモート操作します( 材料表を参照)。
- イメージングソフトウェア(「 材料表」を参照)がデジタルI/Oデバイスとインターフェースしていることを確認します。USBデジタルI/Oデバイスのデジタル出力チャンネルを構成して、TTL信号をアナログ/デジタルコンバータに配信すると、圧電アクチュエータを動かす電気生理学ソフトウェアのプロトコルが開始されます。
- ケーブルを使用して、アナログ/デジタルコンバーターの開始BNCポートをアース(GND)に接続し、USBデジタルI / Oデバイスのネジ留め式端子に接続します。
- イメージングソフトウェアで記録プロトコルを設定します。
注: 次の手順では、TTL 信号を送信し、指定した時間間隔でイメージの収集を開始するプロトコルを生成する方法について説明します。- イメージングソフトウェアで取得プロトコルを設定するには、実験 マネージャ をクリックし、[ 新しい実験]を選択します。新しいウィンドウが開きます。
- アイコンを選択します タイムラプスループ 新しく開いたウィンドウにドラッグします。サイクル数を 2 に設定し、間隔をセットアップで許可されている最速の設定に設定します。
- 送信シャッター/手動シャッターアイコンからNI USB-6501アイコンを選択してタイムラプスループウィンドウにドラッグし、NI USB-6501をクローズに設定します。追加のNI USB-6501を送信シャッター/手動シャッターからタイムラプスループウィンドウにドラッグし、オープンに設定します。2つのNI USB-6501アイコンを接続するには、NI USB-6501を閉じるアイコンの横にある矢印をドラッグし、NI USB-6501を開くアイコンに触れるまで引きます。両方のアイコンを結ぶ線が表示されます。
- 別のタイム ラプス ループを実験マネージャー ウィンドウにドラッグし、矢印を引いて最初のタイム ラプス ループに接続します。記録のパラメータを設定します。新しいタイムラプスループのサイクル数を2400に設定します。
- 画像取り込みアイコンから、GFPフィルターを最近開いたタイムラプスループにドラッグし、露出時間を100ミリ秒に設定します。
- カメラの画像タイプを 8ビット、解像度を 576 x 576 (ビニング4 x 4)、ピクセルクロックを 480 MHz、ホットピクセル補正を 標準に設定します。
注:パラメータは、蛍光センサーの表現レベル、カメラの感度、およびセットアップ構成に応じて調整できます。
- 電気生理学ソフトウェアでラボベンチをセットアップします(材料の表を参照)。
注:これにより、アナログ/デジタルコンバータの出力信号がmVで定義されます。- 電気生理学ソフトウェアの[構成]メニューに移動し、[ラボベンチ]を選択します。表示された出力信号ウィンドウで、アナログ出力#1を選択し、信号の追加を押して、名前を付けます(例:「ピエゾ」)。信号単位をmVに、スケール係数(mV / V)を1に設定します。
- 以下の手順に従って、電気生理学ソフトウェアで刺激プロトコルを生成します。
- 電気生理学ソフトウェアで新しい刺激プロトコルを生成するには、メニュー項目 [取得 ]に移動し、[ 新しいプロトコル]を選択します。
- モード/レートをエピソード刺激に、実行/試行を1に、スイープ/実行を1に、スイープ持続時間を150に設定します。
- [出力]メニューで、[アナログ 出力 ]としてチャンネル#1 ピエゾ を選択します。
- トリガー メニュー で、トリガーを デジタイザー開始入力 と 内部タイマーに設定します。
- 波形メニューで、チャンネル#1とエポック付きアナログ波形を選択します。ステップ A をステップに、第 1 レベルを 0 に、デルタ レベルを 0 に、最初の期間を 10000 に、[デルタ期間] を 0 に設定します。
- ステップ B をステップに、[第 1 レベル] を 10 に、[デルタ レベル] を 0 に、[最初の期間] を 1000 に、[デルタ期間] を 0 に設定します。 ステップ c をステップに、第 1 レベルを 0、デルタレベルを 0 に、[最初の期間] を 130000 に、[デルタ期間] を 0 に設定します。
- プロトコルを保存し、 刺激プロトコルという名前を付けます。
- BNCケーブルを使用して、アナログ/デジタルコンバーターのアナログ出力#1をシングルチャネルオープンループピエゾコントローラーの前面にあるEXT入力に接続します(材料の表を参照)。
- 以下の手順に従って、キャピラリーガラスチューブからアンブレラセルを機械的に刺激するためのガラスマイクロピペットを製造します。
- キャピラリーガラスをプラーに入れ( 材料の表を参照)、キャピラリー保持ノブで調整します。
- ヒーターユニットを完全な高さに配置します。プーラーの最初のプル終端位置スライダーを5に調整します。
- 最初のヒーターノブを76.7に設定し、2番目のノブを52.7に設定します。
- スタートボタンを押して、ガラスキャピラリーを2段階で引きます。
- マイクロピペットの先端をマイクロフォージ( 材料表を参照)で閉じ、ヒーター調整ノブを60に設定します。
注:現在のプロトコルでは、個々の細胞を突くために使用されるマイクロピペットチップの最終的な直径は~1-3μmです。
- 刺激マイクロピペットが刺激プロトコルで指定された距離を移動することを確認します。
注意: 次の手順は、電気生理学ソフトウェアで刺激プロトコルを開始してから12.5秒後に、持続時間が1秒の電圧パルスが生成され、圧電アクチュエータが20μm動くようにするためのものです。- ホルダーにマイクロピペットを取り付け、圧電アクチュエータに取り付けます。
- 圧電アクチュエータと付属のマイクロピペットを顕微鏡ステージの中央に平行に、視野内に配置します。
- ピペットの先端に焦点を合わせ、圧電取り付けロッド( 材料表を参照)をテープで固定します。明視野照明下で、カメラのパラメータを調整して、ピペットチップの鮮明な画像を実現します。
- 電気生理学ソフトウェアで 刺激プロトコル を開き、再生するように設定します。
注意: 電気生理学プロトコルは、イメージングソフトウェアから送信されたTTL信号を受信するまで開始されません。 - イメージング ソフトウェアの実験マネージャー で、[ 開始 ] を押してデータ取り込みを開始します。
注意: これにより、電気生理学ソフトウェアのプロトコルがトリガーされ、圧電アクチュエータが駆動されます。イメージングソフトウェアのプロトコルは、実験の画像を含むファイルを生成します。
- 以下の手順に従って、ピペットの移動距離を確認します。
- 刺激プロトコル中にピペットが移動した距離を測定するには、イメージングソフトウェアで カウントと測定 項目を選択します。
- [測定]メニューから[測定とROI]オプションを選択すると、ムービーウィンドウの下に新しいウィンドウが表示されます。
- [計測] メニューから、[任意の行] を選択します。
- ムービーウィンドウで、ピペットの先端から任意の線を引きます。任意の行の終わりは後で調整されることに注意してください。
- 任意の行を右クリックして、線を関心領域(ROI)に変換し、すべてのムービーフレームに表示されます。
- 動画を検査し、刺激に応答してピペットが移動する最終位置に任意のライン(ROI)の端を調整します。
注意: ピペットの移動距離(μm)が[ 測定とROI ]ウィンドウに表示されます。刺激プロトコルは、ユーザーのニーズに応じて変更できます。
2.膀胱粘膜の その場 形質導入と単離
- CGaMP5GのcDNAをコードするアデノウイルスを用いて、ウイルス形質導入プロトコル31に記載の手順に従って、雌マウス膀胱をin situで形質導入する。
- Ca2+イメージング実験のために尿路上皮細胞を形質導入する場合は、2 x 107感染性ウイルス粒子(IVP)を含む50 μLの溶液を膀胱に注入します。
注:この手法は、CGaMP5Gの発現をアンブレラ細胞層に制限する傾向があります。あるいは、尿路上皮細胞(すなわち、ウロプラキン-2プロモーターによって駆動されるGCaMP5G発現)または他の任意の細胞型においてCGaMP5Gを発現するトランスジェニックマウスから採取した膀胱を用いて実験を実施することができる。
- Ca2+イメージング実験のために尿路上皮細胞を形質導入する場合は、2 x 107感染性ウイルス粒子(IVP)を含む50 μLの溶液を膀胱に注入します。
- 形質導入の24〜72時間後、CO2 窒息によってマウスを安楽死させ、ハサミで胸腔を開いて肺を崩壊させることによって開胸術を行う。
- 24 Gカテーテルで尿道をカニューレします。皮膚と筋肉を通して~1.5cmの腹部切開によって膀胱を露出させ、6.0縫合糸( 材料の表を参照)を使用してカテーテルを尿道に固定します。
- 膀胱および尿道32を採取し、(単位:mM)を含む記録溶液に浸したシリコーンゴムホルダーパッド(材料の表を参照)に貼り付ける:135NaCl、5.0KCl、1MgCl2、2.5CaCl2、10グルコース、10HEPES、pH 7.4、および100%O2で泡立てた(図2A)。
- 以前に発表された報告32 (図2B)に従って、細かい鉗子で膀胱粘膜を下にある筋肉層から分離します。
- 膀胱粘膜を切り開き、直径35 mmの組織培養皿の底にあるシリコーンエラストマーインサートに尿路上皮を向けて固定します(図2C)。
3.個々の尿路上皮細胞の機械的刺激とCa2+ イメージング
- 抵抗発熱体を備えた培養皿インキュベーターを備えた顕微鏡ステージに、ピン留めされた膀胱粘膜を備えた組織培養皿をマウントします(図2E)。細胞培養皿を1.7 mL/minの速度で連続的に灌流し、記録液をインラインヒーターで~37°Cに温めます。
- デュアルチャンネルバイポーラ温度コントローラーモデルを使用して、ティッシュディッシュインキュベーターと溶液の温度を~37°Cに維持します( 材料の表を参照)。さらなる実験手順を行う前に、チャンバー内の組織を少なくとも15分間連続灌流で平衡化します。
- 機械的に誘発されたCa2+ 過渡現象を記録するには、マイクロピペットを溶液に浸し、ピン留めされた膀胱粘膜を組織皿に浸します。明視野照明を使用して、低倍率のスキャン対物レンズ(4x)を使用して、マイクロピペットをフィールドの中心に移動します。
- マイクロマニピュレーターを垂直面内で協調的に動かし、焦点を調整することにより、マイクロピペットを尿路上皮組織の表面近くに移動します。
- 対物レンズを高開口数(NA)の免疫蛍光に適した高倍率(20倍)のものに切り替えます。
- マイクロマニピュレーターを Fine に設定し、マイクロピペットをターゲットセルの上部近くに移動します。
- 視野をカメラに変更し、イメージングソフトウェアで Live を押します。
注意: これにより、反射シャッターがオンになり、コンピューター内の組織から放出される蛍光信号を観察できるようにする必要があります。 - フォーカスを調整してセルの上部を視覚化し、必要に応じてピペットの位置を調整します。
- 電気生理学ソフトウェアで 刺激プロトコル を開き、 再生するように設定します。
注意: 電気生理学ソフトウェアのプロトコルは、イメージングソフトウェアから送信されたTTL信号を受信するまで開始されません。 - イメージング ソフトウェアの実験マネージャー で、[ 開始 ] を押してデータ取り込みを開始します。これにより、電気生理学ソフトウェアのプロトコルがトリガーされ、圧電アクチュエータが駆動され、実験の画像を含むファイルが生成されます。刺激プロトコルは、ユーザーのニーズに応じて変更することができます。
4.データ分析
- 以下の手順に従って、経時的な蛍光強度を定量化します。
- イメージングソフトウェアで画像ファイルを開き、[ カウントと測定 ]ウィンドウを選択します。 ポリゴン ツールを選択し、突かれたセルの境界にROIを描画します。
- [測定] ウィンドウに移動し、[ 強度プロファイル]を選択し、測定を[ 経時的]、[ 結果 ]を[ 平均]、[ バックグラウンド減算 ]を [なし]に設定し、[ 実行]を押します。平均蛍光強度は経時的に計算されます(図3)。
- 強度プロファイルデータをエクスポートするには、[強度プロファイル結果]ウィンドウのExcelアイコンをクリックします。これにより、ユーザーは宛先フォルダーとファイル名を選択し、データを.xlsx形式で保存できます。
- 科学グラフ作成およびデータ分析ソフトウェアを使用してデータ分析を実行します( 材料表を参照)。
注:突っ込みによって誘発されるCa2+ ピークの振幅は、蛍光強度の変化(ΔF / F)として表され、Fは時間0におけるGCaMP5Gの蛍光強度、ΔFは時間0における蛍光強度の最大値と基底の差です。Ca2+ 応答の減衰も計算することができる(図示せず)。
結果
本プロトコルは、蛍光Ca2+センサーGCaMP5Gを用いてアンブレラ細胞における機械的に誘発されたCa2+過渡現象を評価する技術を記載する。アデノウイルス形質導入は、その高い効率と高レベルの発現を生じるため、尿路上皮細胞でGCaMP5Gを発現するために採用されました。形質導入された膀胱からの染色された凍結切片の蛍光画像を図2Dに示す。これらの実験では、GCaMP5G発現はアンブレラ細胞層において最も高い。傘細胞を突いた実験中に撮影された一連の代表的な画像を図3Aに示す。図3Aの第1の画像は、GCaMP5Gを発現する膀胱粘膜の傘細胞の上部に位置する刺激ピペットの蛍光図を示す。GCaMP5Gを発現するアンブレラ細胞の機械的刺激は変形を引き起こし(12.5秒の画像図3Aを参照)、続いて蛍光発光が急速に増加します(13.5秒の画像図3Aを参照)。蛍光の変化を時間の関数としてプロットした(図3B)。以前に報告されたように31、突くことは、GCaMP5Gで形質導入された対照および野生型マウスからの膀胱で試験されたほとんどの傘細胞においてCa2+応答を呼び起こす。アンブレラセルからPiezo1およびPiezo2を削除すると、Ca2+応答31のピーク振幅が減少した。機械的に誘発されたCa2+応答に対するさまざまな治療または遺伝的背景の効果を比較する場合、膀胱の導入、組織の取り付け、くぼみに使用されるピペットの先端のサイズ、機械的刺激の持続時間と振幅、およびイメージング条件を含む実験条件を標準化することが不可欠です。
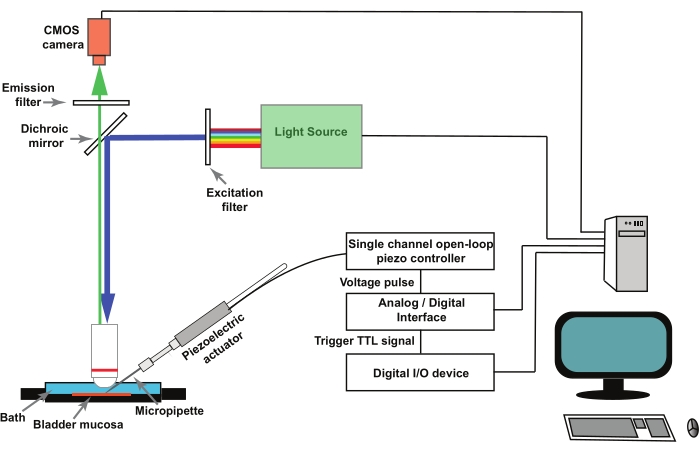
図1:尿路上皮細胞におけるメカノ活性化Ca2+ トランジェントを記録するための実験セットアップ。 リグは、正立顕微鏡、蛍光光源、励起および発光フィルター、CMOSカメラで構成されています。イメージングソフトウェアがシステムを制御します。単一チャネルの開ループピエゾコントローラによって制御される圧電アクチュエータを使用して、ポーキングマイクロピペットを移動させます。ガラスマイクロピペットは、圧電アクチュエータに取り付けられたピペットホルダーに取り付けられています。圧電アクチュエータおよび関連するマイクロピペットは、マイクロマニピュレータ(図示せず)に取り付けられる。ピエゾオープンループコントローラは、アナログ/デジタルコンバータと電気生理学ソフトウェアによってリモート操作されます。イメージングソフトウェアの記録プロトコルは、デジタルI/Oデバイス を介して TTL信号を配信し、これにより、圧電とその後の画像キャプチャを制御する電気生理学ソフトウェアの刺激プロトコルが開始されます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:Ca2+ イメージングのための膀胱粘膜の分離と取り付け。 (a)カテーテルを装着した粘膜シート製剤。膀胱粘膜は、細かい鉗子で下にある筋肉層から剥ぎ取られました。(B)パネル(A)に示す剥離膀胱粘膜の拡大像。(C)粘膜は、尿路上皮を上に向けて、0.15 mmの昆虫ピンでシリコーンエラストマーインサートに固定しました。(D)GFPに対する抗体および二次ロバ抗ウサギ結合抗体(緑)、ローダミン-ファロイジン(赤)、およびDAPI(青)で染色された粘膜シート製剤の共焦点免疫蛍光断面画像。膀胱粘膜製剤は、固有層(LP)の一部を含む。矢印は、アンブレラセル層(Ub)の位置を示す。スケールバー = 50 μm。 (E)実験セットアップの写真。a、インラインヒーター;b、圧電アクチュエータ;c、ヒーターエレメントおよびコントローラー。d、ピペットホルダーおよびマイクロピペット;e、組織培養ディッシュおよびディッシュインキュベーター内のシリコーンインサートに付着した粘膜シート。 この図の拡大版を表示するには、ここをクリックしてください。

図 3.尿路上皮細胞におけるメカノ活性化Ca2+ 一過性物質の記録と解析。 (A)実験の過程で異なる時点で撮影された蛍光画像のシーケンス。アンブレラ細胞の機械的刺激は、GCaMP5Gの放出の急速な増加に続く変形を引き起こすことに留意されたい(矢印)。刺激された細胞(ROI)の境界は赤でマークされています。(B)対照マウスからの膀胱粘膜調製物中の8つの独立した機械的刺激細胞の蛍光強度(ΔF / F)の経時的な変化。インデントの時間(12.5秒)は青い矢印でマークされています。(B)のデータは、Dalghiら31から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
すべての生物、そして一見ほとんどの細胞型は、機械的刺激に応答するイオンチャネルを発現する20、33、34、35、36、37。これらの機械的に活性化されたチャネルの機能は、主にパッチクランプ技術で評価されています。しかし、アクセシビリティの問題により、機械的に活性化されたイオンチャネルのパッチクランプ研究は、解離した細胞と細胞株に大きく制限されてきました。機械的に活性化されたイオンチャネルの多くはCa2+を透過するため、顕微鏡、バイオセンシング、マイクロマニピュレーションの最近の進歩を利用して、ex vivo尿路上皮製剤における機械的に活性化されたチャネルの機能を評価するイメージング法を開発しました。このプロトコルでは、尿路上皮細胞は、GCaMP5Gをコードするアデノウイルスで形質導入される。アデノウイルスベクターは、尿路上皮細胞におけるGCaMP5Gの高い形質導入速度と高レベルの発現を提供するため、尿路上皮におけるCa2+シグナル伝達の研究に最適です(図2D)。これらの条件下では、バックグラウンド蛍光は比較的低い。アデノウイルス形質導入を使用して遺伝的にコードされたCa2+センサーを発現する場合、目的の細胞のみがセンサーを発現するように、条件を最適化することに特に重点を置く必要があります。代替として、遺伝的にコードされたCa2+指示薬(GECI)の発現は、目的のタンパク質(例えば、GCaMP5G)をコードするフロックス導入遺伝子を有するマウスと、適切なプロモーターの制御下でCreリコンビナーゼを発現するマウスとを交配することによって達成され得る。このアプローチは外科的処置を必要とせず、Creリコンビナーゼを発現する細胞におけるタンパク質の標的発現および均一な発現レベルを提供するという利点を有する。
ここで説明するプロトコルでは、正立広視野顕微鏡を使用して、閉じたファイアポリッシュマイクロピペットで刺激されたアンブレラ細胞内の機械的に活性化されたCa2+ トランジェントを評価します。この方法は、尿路上皮のより深い層、さらには正立共焦点または2光子顕微鏡を用いた固有層内の細胞におけるメカノトランスダクションの研究に適応させることができます。共焦点顕微鏡を用いることは、機械的刺激に応答して起こる細胞内Ca2+ の細胞内変化を定義するのに必要な分解能を提供し得る。このプロトコルは、個々の傘細胞を突くために閉じた火で磨かれたマイクロピペットを使用します。刺激にマイクロピペットを使用する主な利点は、組織にかかる機械的摂動が一時的なものであり、関心のある細胞とその周辺領域に限定されることです。細胞伸張系は、PDMS膜上で増殖した細胞を機械的に刺激するために使用することができるが、固有の制限は、 ex vivo 調製物を用いたイメージング実験のためのそのような装置の使用を妨げる。これらの制限には、マウスの膀胱の取り付けとイメージングに関する課題や、膀胱粘膜の折り畳まれた性質を考えると、組織を伸ばしながら目的の細胞に焦点を合わせ続けることの難しさが含まれます。
尿路上皮製剤中の機械的に活性化されたCa2+ 過渡を測定するためのプロトコルには、いくつかの制限があります。まず、リグには比較的高価なコンポーネントが含まれており、その組み立てとセットアップには、顕微鏡、マイクロマニピュレーター、アナログ-デジタルコンバーター、および比較的特殊なソフトウェアに関する専門知識が必要です。パッチクランプと同様に、この技術では、研究者はマイクロマニピュレーターの使用方法と機械的刺激用のガラスマイクロピペットの作り方を学ぶ必要があります。ただし、ピペットとメンブレンの間に高抵抗シールを形成するパッチクランプ技術とは異なり、機械的に活性化されたCa2+ 過渡現象を測定するためにここで説明する手順は比較的簡単で、研究者は刺激ピペットを刺激される細胞の表面の近くに配置するだけで済みます。したがって、訓練を受けた研究者は、パッチクランプ技術では考えられない、1時間で8〜10個の細胞の突っ込みに対する反応を潜在的に評価することができます。
機械的に活性化されたイオンチャネルが正常な身体機能および疾患状態において重要であることを考えると、これらのチャネルを本来の環境で研究するための新しい方法が必要である。このプロトコルに記載されているように、イメージング法は、これらのチャネルが環境の変化をどのように感知し、生理学的応答を生成するかについての独自の洞察を提供することができます。管状または嚢状の器官の粘膜表面のアクセシビリティを考えると、ここで説明する方法は、腸、泌尿生殖路、血管などを含む他の環境でのメカノトランスダクションを研究するために適応させることができます。したがって、体内の機械的応答を研究することは広く役立つかもしれません。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、NIH助成金R01DK119183(GAおよびMDCへ)およびS10OD028596(G.A.へ)、およびピッツバーグ腎臓研究センターの細胞生理学およびモデル生物腎臓イメージングコア(P30DK079307)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
参考文献
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14 (2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2 (2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170 (2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984 (2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558 (2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055 (2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved