Method Article
Ex Vivo Analisi di transitori di Ca2+ attivati meccanicamente in cellule uroteliali
In questo articolo
Riepilogo
Questo protocollo descrive una metodologia per valutare la funzione dei canali ionici attivati meccanicamente nelle cellule uroteliali native utilizzando il sensore fluorescente Ca2+ GCaMP5G.
Abstract
I canali ionici attivati meccanicamente sono trasduttori biologici che convertono stimoli meccanici come forze di allungamento o taglio in segnali elettrici e biochimici. Nei mammiferi, i canali attivati meccanicamente sono essenziali per la rilevazione di stimoli esterni e interni in processi diversi come la sensazione tattile, l'udito, la regolazione del volume dei globuli rossi, la regolazione della pressione sanguigna basale e la sensazione di pienezza della vescica urinaria. Mentre la funzione dei canali ionici attivati meccanicamente è stata ampiamente studiata in vitro utilizzando la tecnica patch-clamp, valutare la loro funzione nel loro ambiente nativo rimane un compito difficile, spesso a causa dell'accesso limitato ai siti di espressione di questi canali (ad esempio, terminali afferenti, cellule di Merkel, barocettori e tubuli renali) o difficoltà nell'applicare la tecnica patch-clamp (ad esempio, le superfici apicali delle cellule ombrello uroteliali). Questo protocollo descrive una procedura per valutare i transitori Ca 2+ evocati meccanicamente utilizzando il sensore fluorescente GCaMP5G in una preparazione uroteliale ex vivo, una tecnica che potrebbe essere facilmente adattata per lo studio di eventi di Ca2+ evocati meccanicamente in altre preparazioni tissutali native.
Introduzione
Le cellule epiteliali nel tratto urinario sono soggette a forze meccaniche mentre il filtrato urinario viaggia attraverso i nefroni e l'urina viene pompata fuori dalla pelvi renale e viaggia attraverso gli ureteri per essere immagazzinata nella vescica urinaria. È stato a lungo riconosciuto che le forze meccaniche (ad esempio, sforzo di taglio e stiramento) esercitate dai fluidi sulle cellule epiteliali che rivestono le vie urinarie regolano il riassorbimento delle proteine nel tubulo prossimale e dei soluti nel nefrone distale 1,2,3,4,5,6,7,8,9,10,11, 12,13, così come la conservazione delle urine nella vescica urinaria e la minzione14,15,16,17.
La conversione di stimoli meccanici in segnali elettrici e biochimici, un processo denominato meccanotrasduzione, è mediata da proteine che rispondono alla deformazione delle strutture cellulari o della matrice extracellulare associata 18,19,20,21. I canali ionici attivati meccanicamente sono unici nel senso che passano da uno stato chiuso a uno stato permeabile aperto in risposta a cambiamenti nella tensione della membrana, nella pressione o nello sforzo di taglio 18,19,20,21,22. Inoltre, i transitori di Ca 2+ possono essere iniziati mediante meccanotrasduzione integrina-mediata o mediante attivazione di sistemi di adesione meccano-responsivi alle giunzioni cellula-cellula23,24,25,26. La funzione del canale ionico viene solitamente valutata con la tecnica patch-mord, che comporta la formazione di un sigillo gigaohm tra la membrana cellulare e la pipetta patch27. Tuttavia, le cellule situate in strati di tessuto profondo con una matrice extracellulare densa (ad esempio, tubuli renali) o circondate da una barriera fisica (ad esempio, glicocalice) sono difficili da accedere con una micropipetta di vetro. Allo stesso modo, le cellule incorporate o che sono parti integranti di tessuti con scarsa stabilità meccanica (ad esempio, l'urotelio) non possono essere facilmente studiate con la tecnica patch-clamp. Poiché molti canali ionici attivati meccanicamente sono permeabili al Ca 2+, un approccio alternativo consiste nel valutare la loro attività mediante microscopia fluorescente utilizzando un colorante sensibile al Ca2+ o indicatori di calcio geneticamente codificati (GECI) come GCaMP. I recenti sforzi nell'ingegneria proteica hanno aumentato significativamente la gamma dinamica, la sensibilità e la risposta dei GECI28,29,30, e i progressi nella genetica hanno permesso la loro espressione in specifiche popolazioni cellulari, rendendoli ideali per studiare la meccanotrasduzione.
L'urotelio, l'epitelio stratificato che ricopre l'interno della vescica urinaria, funge da barriera, impedendo la diffusione di soluti urinari nell'interstizio della vescica, ma funziona anche come trasduttore, rilevando la pienezza della vescica e comunicando questi eventi ai nervi e alla muscolatura sottostanti16. Studi precedenti hanno dimostrato che la comunicazione tra l'urotelio e i tessuti sottostanti richiede i canali ionici attivati meccanicamente Piezo1 e Piezo231. Per valutare i transitori di Ca 2+ indotti meccanicamente nelle cellule uroteliali, è stata sviluppata una nuova tecnica descritta che utilizza il trasferimento genico adenovirale per esprimere il sensore Ca2+ GCaMP5G nelle cellule uroteliali. Questa tecnica impiega una preparazione del foglio di mucosa che fornisce un facile accesso allo strato più esterno della cellula dell'ombrello e un sistema assistito da computer per la stimolazione meccanica simultanea delle singole cellule con una micropipetta di vetro chiusa e la registrazione delle variazioni di fluorescenza nel tempo.
Protocollo
La cura e la gestione degli animali sono state effettuate in conformità con il Comitato istituzionale per la cura e l'uso degli animali dell'Università di Pittsburgh. Per il presente studio sono stati utilizzati topi femmina C57Bl/6J di 2-4 mesi. I topi sono stati ottenuti commercialmente (vedi Tabella dei materiali).
1. Assemblaggio e configurazione dell'attrezzatura
- Eseguire l'imaging Ca2+ con un microscopio verticale dotato di una fotocamera ad alta risoluzione e di una sorgente luminosa stabile (vedere Tabella dei materiali).
- Acquisire le immagini con un software compatibile con il microscopio che consente il controllo diretto della telecamera, della sorgente luminosa e dell'attuatore piezoelettrico tramite un dispositivo I/O digitale USB (vedere Tabella dei materiali).
Nota : la Figura 1 rappresenta uno schema dell'installazione. GCaMP5G ha una lunghezza d'onda di eccitazione di picco di 470 nm e una lunghezza d'onda di emissione di picco di 497 nm28. Utilizzare un cubo filtro adatto per l'imaging GCaMP5G.
- Acquisire le immagini con un software compatibile con il microscopio che consente il controllo diretto della telecamera, della sorgente luminosa e dell'attuatore piezoelettrico tramite un dispositivo I/O digitale USB (vedere Tabella dei materiali).
- Per la stimolazione delle singole cellule uroteliali nella preparazione della mucosa vescicale (vedere fase 2), utilizzare un attuatore piezoelettrico controllato da un controller piezoelettrico ad anello aperto a canale singolo (vedere Tabella dei materiali). Montare l'attuatore piezoelettrico in un micromanipolatore.
- Montare le micropipette di vetro in un portapipette fissato all'attuatore piezoelettrico (Figura 1). Azionare a distanza il controllore piezoelettrico tramite un convertitore analogico/digitale controllato da un programma di acquisizione e analisi dei dati elettrofisiologici (vedere Tabella dei materiali).
NOTA: Un trigger esterno, sotto forma di un segnale logico transistor-transistor (TTL) avviato dal software di imaging, viene utilizzato per attivare il protocollo di stimolazione nel software di acquisizione e analisi dei dati elettrofisiologici che muove l'attuatore piezoelettrico (Figura 1).
- Montare le micropipette di vetro in un portapipette fissato all'attuatore piezoelettrico (Figura 1). Azionare a distanza il controllore piezoelettrico tramite un convertitore analogico/digitale controllato da un programma di acquisizione e analisi dei dati elettrofisiologici (vedere Tabella dei materiali).
- Assicurarsi che il software di imaging (vedere Tabella dei materiali) si interfacci con il dispositivo di I/O digitale. Configurare un canale di uscita digitale nel dispositivo I/O digitale USB per fornire il segnale TTL al convertitore analogico/digitale, che avvierà il protocollo nel software di elettrofisiologia che muove l'attuatore piezoelettrico.
- Utilizzare un cavo per collegare la porta Start BNC nel convertitore analogico/digitale a terra (GND) e un terminale a vite nel dispositivo I/O digitale USB.
- Impostare il protocollo di registrazione nel software di imaging.
NOTA: i passaggi seguenti descrivono come generare un protocollo che invierà un segnale TTL e inizierà a raccogliere immagini a intervalli di tempo specificati.- Impostare il protocollo di acquisizione nel software di imaging facendo clic su Gestione esperimenti e selezionando Nuovo esperimento. Si aprirà una nuova finestra.
- Selezionare l'icona Time Lapse Loop e trascinarla nella finestra appena aperta; Impostare il numero di cicli su 2 e l'intervallo sull'impostazione più veloce consentita nella configurazione.
- Dall'icona Transmitted Shutter/Manual Shutter, selezionare l'icona NI USB-6501 e trascinarla nella finestra Time Lapse Loop, quindi impostare NI USB-6501 come chiuso. Trascinare un NI USB-6501 aggiuntivo da Transmitted Shutter/Manual Shutter nella finestra Time Lapse Loop e impostarlo come aperto. Per collegare le due icone NI USB-6501, trascinare la punta della freccia sul lato dell'icona chiusa NI USB-6501 e tirare fino a toccare l'icona di apertura di NI USB-6501. Apparirà una linea che collega entrambe le icone.
- Trascina un altro loop Time Lapse nella finestra di Gestione esperimenti e collegalo al primo tirando la punta della freccia. Impostare i parametri per la registrazione. Impostare il numero di cicli del nuovo Time Lapse Loop su 2400.
- Dall'icona Acquisizione immagini , trascinare il filtro GFP nel Time Lapse Loop aperto di recente e impostare il tempo di esposizione su 100 ms.
- Impostare il tipo di immagine della fotocamera su 8 bit, la risoluzione su 576 x 576 (Binning 4 x 4), il pixel clock su 480 MHz e la correzione hot pixel su standard.
NOTA: i parametri possono essere regolati in base al livello di espressione del sensore fluorescente, alla sensibilità della fotocamera e alla configurazione di configurazione.
- Configurare il banco da laboratorio nel software di elettrofisiologia (vedere Tabella dei materiali).
NOTA: questo definirà il segnale di uscita in mV del convertitore analogico/digitale.- Andare al menu Configura nel software di elettrofisiologia e selezionare Lab Bench. Nella finestra Segnali di uscita risultante, selezionare Uscita analogica #1, premere il pulsante Aggiungi segnale e assegnargli un nome (ad esempio, "Piezo"). Impostare l'unità di segnale su mV e il fattore di scala (mV/V) su 1.
- Generare un protocollo di stimolazione nel software di elettrofisiologia seguendo i passaggi seguenti.
- Per generare un nuovo protocollo di stimolazione nel software di elettrofisiologia, andare alla voce di menu Acquisisci e selezionare Nuovo protocollo.
- Impostare Modalità/Frequenza su Stimolazione episodica, Corsa/Prova su 1, Sweep/Run su 1 e Durata sweep su 150.
- Nel menu Outputs , selezionare il canale #1 Piezo come uscita analogica.
- Nel menu Trigger , impostare il trigger su Digitizer Start Input e Internal Timer.
- Nel menu Forma d'onda, selezionate il canale #1 e Forma d'onda analogica con epoche. Impostare il passaggio A su Passo, Primo livello su 0, Livello delta su 0, Prima durata su 10000 e Durata delta su 0.
- Impostare il passaggio B su Step, First level su 10, Delta level su 0, First Duration su 1000 e Delta Duration su 0. Impostare il passaggio C su step, First Level su 0, Delta Level su 0, First Duration su 130000 e Delta Duration su 0.
- Salvare il protocollo e denominarlo Protocollo di stimolazione.
- Utilizzare un cavo BNC per collegare l'uscita analogica #1 nel convertitore analogico/digitale all'EXT INPUT nella parte anteriore del controller piezoelettrico ad anello aperto a canale singolo (vedere Tabella dei materiali).
- Fabbricare micropipette di vetro per la stimolazione meccanica delle celle a ombrello da tubi di vetro capillari seguendo i passaggi seguenti.
- Posizionare il vetro capillare in un estrattore (vedere Tabella dei materiali) e regolarlo con le manopole di fissaggio capillare.
- Posizionare l'unità riscaldante alla sua piena altezza. Regolare il primo cursore della posizione di terminazione di trazione dell'estrattore su 5.
- Impostare la prima manopola del riscaldatore su 76,7 e la seconda manopola su 52,7.
- Tirare il capillare di vetro in due passaggi premendo il pulsante di avvio.
- Chiudere la punta della micropipetta con una microforgia (vedere Tabella dei materiali) con la manopola di regolazione del riscaldatore impostata su 60.
NOTA: Per il presente protocollo, il diametro finale della punta della micropipetta utilizzata per colpire le singole cellule è ~1-3 μm.
- Verificare che la micropipetta stimolante si muova alla distanza specificata nel protocollo di stimolazione.
NOTA: I seguenti passaggi servono a garantire che 12,5 s dopo l'avvio del protocollo di stimolazione nel software di elettrofisiologia, venga generato un impulso di tensione con una durata di 1 s, facendo muovere l'attuatore piezoelettrico di 20 μm.- Montare una micropipetta nel supporto e collegarla all'attuatore piezoelettrico.
- Posizionare l'attuatore piezoelettrico e la micropipetta collegata parallelamente al centro dello stadio del microscopio e all'interno dell'area di vista.
- Concentrarsi sulla punta della pipetta e immobilizzare l'asta di montaggio piezoelettrica (vedere Tabella dei materiali) con del nastro adesivo. Sotto l'illuminazione a campo chiaro, regolare i parametri della telecamera per ottenere un'immagine chiara della punta della pipetta.
- Apri il protocollo di stimolazione nel software di elettrofisiologia e impostalo per la riproduzione.
NOTA: il protocollo di elettrofisiologia non verrà avviato fino a quando non verrà ricevuto il segnale TTL inviato dal software di imaging. - Da Experiment Manager nel software di imaging, premere Start per avviare l'acquisizione dei dati.
NOTA: Questo attiverà il protocollo nel software di elettrofisiologia, che guiderà l'attuatore piezoelettrico. Il protocollo nel software di imaging genererà un file con le immagini dell'esperimento.
- Verificare la distanza percorsa dalla pipetta attenendosi alla seguente procedura.
- Per misurare la distanza percorsa dalla pipetta durante il protocollo di stimolazione, selezionare la voce Conta e misura nel software di imaging.
- Dal menu Misura , seleziona l'opzione Misurazione e ROI e verrà visualizzata una nuova finestra sotto la finestra del filmato.
- Dal menu Misura , scegliete Linea arbitraria.
- Nella finestra del filmato, tracciare una linea arbitraria a partire dalla punta della pipetta. Si noti che la fine della riga arbitraria verrà modificata in seguito.
- Fare clic con il pulsante destro del mouse sulla linea arbitraria per convertire la linea in una regione di interesse (ROI), che sarà visibile in tutti i fotogrammi del filmato.
- Ispezionare il filmato e regolare la fine della linea arbitraria (ROI) sulla posizione finale percorsa dalla pipetta in risposta allo stimolo.
NOTA: la distanza percorsa dalla pipetta in μm verrà visualizzata nella finestra Misurazione e ROI . Il protocollo di stimolazione può essere modificato in base alle esigenze dell'utente.
2. Trasduzione in situ e isolamento della mucosa vescicale
- Trasdurre vescice di topo femmina in situ con un adenovirus che codifica il cDNA di CGaMP5G secondo la procedura descritta nel protocollo di trasduzione del virus31.
- Quando si trasducono cellule uroteliali per esperimenti di imaging Ca2+ , instillare nelle vesciche 50 μL della soluzione contenente 2 x 107 particelle virali infettive (IVP).
NOTA: Questa tecnica tende a limitare l'espressione di CGaMP5G allo strato di cella dell'ombrello. In alternativa, gli esperimenti potrebbero essere condotti con vesciche urinarie raccolte da topi transgenici che esprimono CGaMP5G in cellule uroteliali (cioè espressione di GCaMP5G guidata da un promotore uroplakin-2) o qualsiasi altro tipo di cellula di interesse.
- Quando si trasducono cellule uroteliali per esperimenti di imaging Ca2+ , instillare nelle vesciche 50 μL della soluzione contenente 2 x 107 particelle virali infettive (IVP).
- 24-72 ore dopo la trasduzione, eutanasia dei topi mediante asfissia CO2 ed eseguire una toracotomia aprendo la cavità toracica con le forbici per causare il collasso dei polmoni.
- Canulare l'uretra con un catetere da 24 G. Esporre la vescica con un'incisione addominale di ~ 1,5 cm attraverso la pelle e il muscolo e utilizzare una sutura 6.0 (vedere Tabella dei materiali) per fissare il catetere all'uretra.
- Raccogliere la vescica e l'uretra32 e fissarle su un cuscinetto di gomma siliconica (vedi Tabella dei materiali) immerso in una soluzione di registrazione contenente (in mM): 135 NaCl, 5,0 KCl, 1 MgCl 2, 2,5 CaCl 2, 10 glucosio, 10 HEPES, pH 7,4 e bollire con 100% O2 (Figura 2A).
- Separare la mucosa della vescica dallo strato muscolare sottostante con una pinza fine seguendo i rapporti32 precedentemente pubblicati (Figura 2B).
- Tagliare la mucosa della vescica e fissarla con l'urotelio rivolto verso l'alto fino a un inserto in elastomero siliconico sul fondo di una capsula di coltura in tessuto di 35 mm di diametro (Figura 2C).
3. Stimolazione meccanica delle singole cellule uroteliali e imaging Ca2+
- Montare il piatto coltivato in tessuto con la mucosa della vescica appuntata nello stadio del microscopio dotato di un incubatore di piatti di coltura con elementi riscaldanti resistivi (Figura 2E). Perfondere (seguendo le istruzioni del produttore, vedere Tabella dei materiali) il piatto di coltura cellulare in modo continuo ad una velocità di 1,7 ml / min con soluzione di registrazione riscaldata a ~ 37 ° C con un riscaldatore in linea.
- Mantenere la temperatura dell'incubatore di piastre tissue e delle soluzioni a ~37 °C con un modello di regolatore di temperatura bipolare a doppio canale (vedere Tabella dei materiali). Equilibrare il tessuto nella camera con perfusione continua per almeno 15 minuti prima di condurre ulteriori procedure sperimentali.
- Per registrare i transitori Ca2+ indotti meccanicamente, immergere la micropipetta nella soluzione bagnando la mucosa della vescica bloccata nel piatto di tessuto. Spostare la micropipetta al centro del campo con l'aiuto di un obiettivo di scansione a basso ingrandimento (4x) utilizzando l'illuminazione a campo luminoso.
- Spostare la micropipetta vicino alla superficie del tessuto uroteliale spostando coordinatamente il micromanipolatore sul piano verticale e regolando la messa a fuoco.
- Passare l'obiettivo a uno con un ingrandimento maggiore (20x) adatto per l'immunofluorescenza con un'elevata apertura numerica (NA).
- Impostare il micromanipolatore su Fine e spostare la micropipetta vicino alla parte superiore della cella target.
- Modificare il campo visivo sulla fotocamera e premere Live nel software di imaging.
NOTA: Questo deve accendere l'otturatore riflesso e consentire l'osservazione del segnale fluorescente emesso dal tessuto nel computer. - Regolare la messa a fuoco per visualizzare la parte superiore della cella e, se necessario, regolare la posizione della pipetta.
- Apri il protocollo di stimolazione nel software di elettrofisiologia e impostalo per la riproduzione.
NOTA: il protocollo nel software di elettrofisiologia non verrà avviato fino a quando non viene ricevuto il segnale TTL inviato dal software di imaging. - Da Experiment Manager nel software di imaging, premere Start per avviare l'acquisizione dei dati. Ciò attiverà il protocollo nel software di elettrofisiologia, che guiderà l'attuatore piezoelettrico e genererà un file con le immagini dell'esperimento. Il protocollo di stimolazione può essere modificato in base alle esigenze dell'utente.
4. Analisi dei dati
- Quantificare l'intensità della fluorescenza nel tempo seguendo i passaggi seguenti.
- Aprire il file di immagine nel software di imaging e selezionare la finestra Conteggio e misura . Selezionare lo strumento poligono e disegnare un ROI sui confini della cella che è stata colpita.
- Vai alla finestra Misura, seleziona Profilo di intensità, imposta la misurazione su Nel tempo, Risultati su Media, Sottrazione di sfondo su Nessuno e quindi premi Esegui. L'intensità media della fluorescenza sarà calcolata nel tempo (Figura 3).
- Per esportare i dati del profilo di intensità, fare clic sull'icona Excel nella finestra Risultati profilo intensità. Ciò consentirà all'utente di scegliere la cartella di destinazione e il nome del file e salvare i dati in un formato .xlsx.
- Eseguire l'analisi dei dati utilizzando software di grafici e analisi dei dati scientifici (vedi Tabella dei materiali).
NOTA: L'ampiezza del picco di Ca2+ evocato dal poking è espressa come variazione dell'intensità di fluorescenza (ΔF/F), dove F è l'intensità di fluorescenza di GCaMP5G al tempo 0 e ΔF è la differenza tra i massimi di intensità di fluorescenza e il basale al tempo 0. Il decadimento della risposta Ca2+ può anche essere calcolato (non mostrato).
Risultati
Il presente protocollo descrive una tecnica per valutare i transitori Ca 2+ evocati meccanicamente in celle ombrello utilizzando il sensore fluorescente Ca2+ GCaMP5G. La trasduzione adenovirale è stata impiegata per esprimere GCaMP5G nelle cellule uroteliali grazie alla sua elevata efficienza e perché produce un elevato livello di espressione. Le immagini fluorescenti delle criosezioni colorate da una vescica trasdotta sono mostrate nella Figura 2D. Per questi esperimenti, l'espressione di GCaMP5G è più alta nello strato cellulare dell'ombrello. Una sequenza di immagini rappresentative catturate durante un esperimento in cui è stata colpita una cellula ombrello è mostrata nella Figura 3A. La prima immagine in Figura 3A mostra una vista fluorescente della pipetta stimolante posizionata sulla parte superiore di una cellula ombrello di una mucosa vescicale che esprime GCaMP5G. La stimolazione meccanica della cellula ombrello che esprime GCaMP5G provoca una deformazione (vedi immagine Figura 3A a 12,5 s), seguita da un rapido aumento dell'emissione di fluorescenza (vedi immagine Figura 3A a 13,5 s). La variazione della fluorescenza è stata tracciata in funzione del tempo (Figura 3B). Come riportato in precedenza31, il poking evoca una risposta Ca2+ nella maggior parte delle cellule ombrello testate nelle vesciche da topi di controllo e wild-type trasdotti con GCaMP5G. L'eliminazione di Piezo1 e Piezo2 dalle celle ombrello ha ridotto l'ampiezza di picco della risposta Ca2+ 31. Quando si confronta l'effetto di diversi trattamenti o background genetici sulle risposte Ca2+ evocate meccanicamente, è essenziale standardizzare le condizioni sperimentali, tra cui la trasduzione della vescica, il montaggio del tessuto, le dimensioni della punta della pipetta utilizzata per l'indentazione, la durata e l'ampiezza dello stimolo meccanico e le condizioni di imaging.
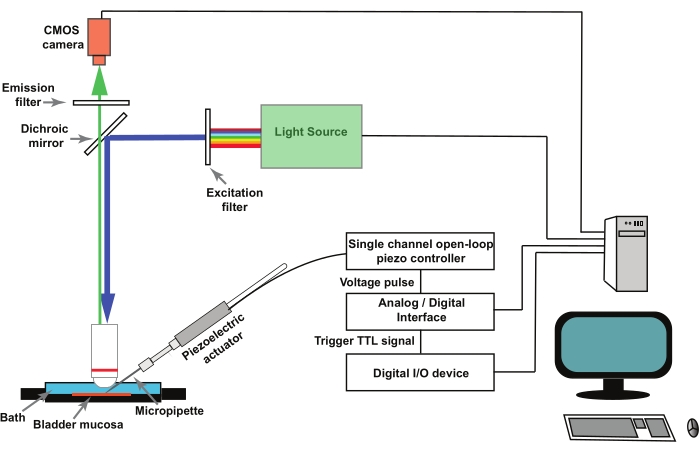
Figura 1: Configurazione sperimentale per registrare transitori di Ca2+ attivati dalla meccanoa in cellule uroteliali. Il carro è costituito da un microscopio verticale, una sorgente luminosa fluorescente, filtri di eccitazione ed emissione e una telecamera CMOS. Il software di imaging controlla il sistema. Un attuatore piezoelettrico controllato da un controller piezoelettrico ad anello aperto a canale singolo viene utilizzato per spostare la micropipetta di colpo. Le micropipette in vetro sono montate in un portapipette fissato all'attuatore piezoelettrico. L'attuatore piezoelettrico e la micropipetta associata sono montati su un micromanipolatore (non mostrato). Il controller piezoelettrico ad anello aperto è gestito a distanza da un convertitore analogico/digitale e da un software di elettrofisiologia. Un protocollo di registrazione nel software di imaging fornisce un segnale TTL tramite un dispositivo I/O digitale e questo avvia il protocollo di stimolazione nel software di elettrofisiologia che controlla l'acquisizione piezoelettrica e, successivamente, l'acquisizione di immagini. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Isolamento e montaggio della mucosa vescicale per l'imaging Ca2+ . (A) Preparazione del foglio mucoso con un catetere attaccato. La mucosa della vescica è stata strappata dallo strato muscolare sottostante con una pinza fine. (B) Immagine ingrandita della mucosa vescicale spogliata mostrata nel pannello (A). (C) La mucosa è stata fissata con l'urotelio rivolto verso l'alto con perni di insetti da 0,15 mm su un inserto di elastomero siliconico. (D) Immagini in sezione trasversale di immunofluorescenza confocale della preparazione del foglio mucoso colorato con un anticorpo contro GFP e un anticorpo secondario coniugato anti-coniglio dell'asino (verde), rodamina-falloidina (rosso) e DAPI (blu). La preparazione della mucosa vescicale comprende parte della lamina propria (LP). Le frecce indicano la posizione dello strato della cella dell'ombrello (Ub). Barre della scala = 50 μm. (E) Fotografia del setup sperimentale. a, riscaldatore in linea; b, attuatore piezoelettrico; c, elementi riscaldanti e controller; d, portapipette e micropipetta; e, foglio di mucosa attaccato all'inserto in silicone in un piatto coltivato in tessuto e in un'incubatrice per piatti. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3. Registrazione e analisi di transitori di Ca2+ meccano-attivati in cellule uroteliali. (A) Sequenza di immagini fluorescenti catturate in diversi punti temporali nel corso di un esperimento. Si noti che la stimolazione meccanica della cellula dell'ombrello provoca una deformazione seguita da un rapido aumento dell'emissione di GCaMP5G (freccia). I bordi della cellula stimolata (ROI) sono contrassegnati in rosso. (B) Variazione dell'intensità di fluorescenza (ΔF/F) nel tempo per otto cellule indipendenti stimolate meccanicamente in una preparazione della mucosa vescicale da un topo di controllo. Il tempo di indentazione (12,5 s) è contrassegnato da una freccia blu. I dati in (B) sono stati modificati da Dalghi et al.31. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Tutti gli organismi, e apparentemente la maggior parte dei tipi di cellule, esprimono canali ionici che rispondono agli stimoli meccanici 20,33,34,35,36,37. La funzione di questi canali attivati meccanicamente è stata valutata prevalentemente con la tecnica patch-mors. Tuttavia, a causa di problemi di accessibilità, gli studi patch-clamp dei canali ionici attivati meccanicamente sono stati in gran parte limitati alle cellule dissociate e alle linee cellulari. Poiché molti canali ionici attivati meccanicamente sono permeabili a Ca2+, abbiamo approfittato dei recenti progressi nella microscopia, nel biorilevamento e nella micromanipolazione per sviluppare un metodo di imaging per valutare la funzione dei canali attivati meccanicamente in una preparazione uroteliale ex vivo. In questo protocollo, le cellule uroteliali sono trasdotte con un adenovirus che codifica per GCaMP5G. I vettori adenovirali sono ideali per lo studio della segnalazione Ca 2+ nell'urotelio in quanto forniscono un alto tasso di trasduzione e alti livelli di espressione di GCaMP5G nelle cellule uroteliali (Figura 2D). In queste condizioni, la fluorescenza di fondo è relativamente bassa. Se la trasduzione adenovirale viene utilizzata per esprimere un sensore Ca2+ geneticamente codificato, particolare enfasi dovrebbe essere data all'ottimizzazione delle condizioni, in modo che solo le cellule di interesse esprimano il sensore. In alternativa, l'espressione di indicatori Ca2+ geneticamente codificati (GECI) potrebbe essere ottenuta incrociando topi portatori di un transgene floxed codificante per la proteina di interesse (ad esempio, GCaMP5G) e topi che esprimono Cre ricombinasi sotto il controllo di un promotore adatto. Questo approccio non richiede procedure chirurgiche e ha il vantaggio di fornire un'espressione mirata e persino livelli di espressione delle proteine nelle cellule che esprimono Cre ricombinasi.
Il protocollo qui descritto utilizza un microscopio verticale a largo campo per valutare i transitori Ca2+ attivati meccanicamente in cellule ombrello stimolate con una micropipetta chiusa lucidata a fuoco. Il metodo potrebbe essere adattato per studiare la meccanotrasduzione negli strati più profondi dell'urotelio o anche nelle cellule della lamina propria con un microscopio confocale verticale o a due fotoni. L'uso di un microscopio confocale può fornire la risoluzione necessaria per definire i cambiamenti subcellulari nel Ca2+ intracellulare che si verificano in risposta alla stimolazione meccanica. Questo protocollo impiega una micropipetta chiusa lucidata a fuoco per colpire le singole celle dell'ombrello. Il vantaggio principale dell'utilizzo di una micropipetta per la stimolazione è che la perturbazione meccanica esercitata sul tessuto è transitoria e limitata alla cellula di interesse e all'area circostante. Mentre i sistemi di allungamento cellulare possono essere utilizzati per stimolare meccanicamente le cellule cresciute sulle membrane PDMS, le limitazioni intrinseche impediscono l'uso di tali dispositivi per esperimenti di imaging con preparati ex vivo . Queste limitazioni includono sfide con il montaggio e l'imaging di una vescica di topo e, data la natura piegata della mucosa della vescica, difficoltà nel mantenere la concentrazione sulle cellule di interesse mentre si allunga il tessuto.
Il protocollo per misurare i transitori di Ca2+ attivati meccanicamente in preparati uroteliali presenta alcune limitazioni. In primo luogo, il carro include componenti relativamente costosi e il suo assemblaggio e configurazione richiedono esperienza con microscopi, micromanipolatori, convertitori analogico-digitali e software relativamente specializzato. Come il patch-clamping, questa tecnica richiede che il ricercatore impari come utilizzare un micromanipolatore e realizzare micropipette di vetro per la stimolazione meccanica. Tuttavia, a differenza della tecnica patch-mors, che prevede la formazione di un sigillo ad alta resistenza tra la pipetta e la membrana, la procedura qui descritta per misurare i transitori Ca2+ attivati meccanicamente è relativamente semplice e richiede solo che lo sperimentatore posizioni la pipetta stimolatoria vicino alla superficie della cellula da stimolare. Pertanto, un ricercatore addestrato può potenzialmente valutare la risposta al pungiglione di 8-10 cellule in 1 ora, il che è inconcepibile con la tecnica patch-mord.
Data l'importanza che i canali ionici attivati meccanicamente hanno nella normale funzione corporea e negli stati patologici, sono necessari nuovi metodi per studiare questi canali nel loro ambiente nativo. Come descritto in questo protocollo, i metodi di imaging possono fornire una visione unica di come questi canali percepiscono i cambiamenti nel loro ambiente e generano risposte fisiologiche. Data l'accessibilità della superficie mucosa degli organi a forma di tubo o sacco, il metodo qui descritto potrebbe essere adattato per studiare la meccanotrasduzione in altri contesti, tra cui l'intestino, il tratto urogenitale, i vasi sanguigni, ecc. Pertanto, studiare le risposte meccaniche nel corpo può essere ampiamente utile.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalle sovvenzioni NIH R01DK119183 (a G.A. e M.D.C.) e S10OD028596 (a G.A.) e dal Cell Physiology and Model Organisms Kidney Imaging Cores del Pittsburgh Center for Kidney Research (P30DK079307).
Materiali
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
Riferimenti
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14(2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170(2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984(2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558(2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055(2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon