Method Article
Ex Vivo (생체 외 ) 요로상피세포에서 기계적으로 활성화된Ca2+ 과도 현상 분석
요약
이 프로토콜은 형광Ca2+ 센서 GCaMP5G를 사용하여 천연 요로상피 세포에서 기계적으로 활성화된 이온 채널의 기능을 평가하는 방법론을 설명합니다.
초록
기계적으로 활성화된 이온 채널은 스트레치 또는 전단력과 같은 기계적 자극을 전기 및 생화학적 신호로 변환하는 생물학적 변환기입니다. 포유류에서 기계적으로 활성화된 채널은 촉각 감각, 청각, 적혈구 부피 조절, 기초 혈압 조절 및 방광 충만 감각과 같은 다양한 과정에서 외부 및 내부 자극을 감지하는 데 필수적입니다. 기계적으로 활성화된 이온 채널의 기능은 패치 클램프 기술을 사용하여 시험관 내 설정에서 광범위하게 연구되었지만, 이러한 채널의 발현 부위에 대한 접근이 제한되어 있기 때문에 기본 환경에서 그 기능을 평가하는 것은 여전히 어려운 작업입니다(예: 구심성 말단, 메르켈 세포, 압수용기 및 신장 세뇨관) 또는 패치 클램프 기술 적용의 어려움(예: 요로상피 우산 세포의 정점 표면). 이 프로토콜은 생체 외 요로상피 제제에서 형광 센서 GCaMP5G를 사용하여 기계적으로 유발된 Ca 2+ 과도 현상을 평가하는 절차를 설명하며, 이는 다른 천연 조직 제제에서 기계적으로 유발된 Ca2+ 사건의 연구에 쉽게 적용할 수 있는 기술입니다.
서문
요로의 상피 세포는 요로 여과액이 네프론을 통과할 때 기계적 힘을 받고 소변은 신장 골반에서 펌핑되어 요관을 통해 이동하여 방광에 저장됩니다. 요로를 둘러싸고 있는 상피 세포의 체액에 의해 가해지는 기계적 힘(예: 전단 응력 및 스트레치)이 근위 세뇨관의 단백질과 원위 네프론 1,2,3,4,5,6,7,8,9,10,11의 용질의 재흡수를 조절한다는 것은 오랫동안 인식되어 왔습니다. 12,13, 방광 및 배뇨에 소변 저장14,15,16,17.
기계적 자극을 전기적 및 생화학적 신호로 변환하는 과정, 즉 메카노트랜스덕션(mechanotransduction)으로 지칭되는 과정은 세포 구조 또는 관련 세포외 기질(18,19,20,21)의 변형에 반응하는 단백질에 의해 매개된다. 기계적으로 활성화된 이온 채널은 막 장력, 압력 또는 전단 응력(18,19,20,21,22)의 변화에 반응하여 폐쇄 상태에서 개방 투과성 상태로 전환한다는 점에서 독특합니다. 또한,Ca2+ 과도현상은 인테그린-매개 기계형질도입 또는 세포-세포 접합부(23,24,25,26)에서의 기계반응성 접착 시스템의 활성화에 의해 개시될 수 있다. 이온 채널 기능은 일반적으로 패치-클램프 기법으로 평가되며, 이는 세포막과 패치 피펫(27) 사이에 기가옴 시일의 형성을 수반한다. 그러나 조밀한 세포외 기질(예: 신장 세뇨관)이 있거나 물리적 장벽(예: 글리코칼릭스)으로 둘러싸인 깊은 조직층에 위치한 세포는 유리 마이크로피펫으로 접근하기 어렵습니다. 마찬가지로, 기계적 안정성이 좋지 않은 조직의 필수적인 부분(예: 요로상피)에 묻혀 있거나 필수적인 세포는 패치 클램프 기술로 쉽게 연구할 수 없습니다. 많은 기계적으로 활성화된 이온 채널이 Ca 2+에 투과되기 때문에, 대안적인 접근법은 Ca2+-민감성 염료 또는 GCaMP와 같은 유전적으로 인코딩된 칼슘 지표 (GECI)를 사용하여 형광 현미경으로 이들의 활성을 평가하는 것이다. 단백질 공학에 대한 최근의 노력은 GECI28,29,30의 동적 범위, 민감도 및 반응을 크게 증가시켰고, 유전학의 발전으로 특정 세포 집단에서 발현이 가능해져 기계 형질도입 연구에 이상적으로 적합하게 되었습니다.
요로 상피(urothelium)는 방광의 내부를 덮고 있는 층상 상피로, 방광 간질로 요로용질이 확산되는 것을 막는 장벽 역할을 할 뿐만 아니라, 방광 충만도를 감지하여 이러한 사건을 기저 신경과 근육계에 전달하는 변환기의 역할도 한다16. 이전 연구에 따르면 요로상피와 하부 조직 사이의 통신에는 기계적으로 활성화된 이온 채널인 Piezo1과 Piezo2가 필요합니다31. 요로상피 세포에서 기계적으로 유도된 Ca2+ 일시적인 현상을 평가하기 위해, 요로상피 세포에서Ca2+ 센서 GCaMP5G를 발현하기 위해 아데노바이러스 유전자 전달을 사용하는 새로운 기술이 개발되었다. 이 기술은 가장 바깥쪽 우산 세포층에 쉽게 접근할 수 있는 점막 시트 준비와 닫힌 유리 마이크로피펫으로 개별 세포를 동시에 기계적 자극하고 시간 경과에 따른 형광 변화를 기록하기 위한 컴퓨터 지원 시스템을 사용합니다.
프로토콜
동물의 관리 및 취급은 University of Pittsburgh Institutional Animal Care and Use Committee에 따라 수행되었습니다. 암컷, 2-4개월 된 C57Bl/6J 마우스를 본 연구에 사용하였다. 마우스를 상업적으로 입수하였다 ( 재료 표 참조).
1. 장비 조립 및 설정
- 고해상도 카메라와 안정적인 광원이 장착된 정립 현미경으로 Ca2+ 이미징을 수행합니다( 재료 표 참조).
- USB 디지털 I/O 디바이스를 통해 카메라, 광원 및 피에조 액추에이터를 직접 제어할 수 있는 현미경 호환 소프트웨어로 이미지를 수집합니다( 재료 표 참조).
알림: 그림 1 은 설정의 개략도를 나타냅니다. GCaMP5G는 470 nm의 피크 여기 파장 및 497 nm의 피크 방출 파장을 갖는다28. GCaMP5G 이미징에 적합한 필터 큐브를 사용하십시오.
- USB 디지털 I/O 디바이스를 통해 카메라, 광원 및 피에조 액추에이터를 직접 제어할 수 있는 현미경 호환 소프트웨어로 이미지를 수집합니다( 재료 표 참조).
- 방광 점막 준비에서 개별 요로상피 세포를 자극하려면(2단계 참조) 단일 채널 개방 루프 압전 컨트롤러로 제어되는 압전 액추에이터를 사용하십시오( 재료 표 참조). 압전 액츄에이터를 마이크로 매니퓰레이터에 장착합니다.
- 압전 액추에이터에 부착된 피펫 홀더에 유리 마이크로피펫을 장착합니다(그림 1). 전기 생리학 데이터 수집 및 분석 프로그램에 의해 제어되는 아날로그/디지털 변환기로 피에조 컨트롤러를 원격으로 작동합니다( 재료 표 참조).
참고: 이미징 소프트웨어에서 시작된 TTL(트랜지스터-트랜지스터 로직) 신호 형태의 외부 트리거는 압전 액추에이터를 움직이는 전기생리학 데이터 수집 및 분석 소프트웨어에서 자극 프로토콜을 트리거하는 데 사용됩니다(그림 1).
- 압전 액추에이터에 부착된 피펫 홀더에 유리 마이크로피펫을 장착합니다(그림 1). 전기 생리학 데이터 수집 및 분석 프로그램에 의해 제어되는 아날로그/디지털 변환기로 피에조 컨트롤러를 원격으로 작동합니다( 재료 표 참조).
- 이미징 소프트웨어( 재료 표 참조)가 디지털 I/O 디바이스와 인터페이스하는지 확인하십시오. USB 디지털 I/O 디바이스에서 디지털 출력 채널을 구성하여 TTL 신호를 아날로그/디지털 컨버터에 전달하면, 압전 액추에이터를 움직이는 전기생리학 소프트웨어에서 프로토콜이 시작됩니다.
- 케이블을 사용하여 아날로그/디지털 컨버터의 시작 BNC 포트를 접지(GND)에 연결하고 USB 디지털 I/O 장치의 나사 터미널을 연결합니다.
- 이미징 소프트웨어에서 레코딩 프로토콜을 설정합니다.
참고: 다음 단계에서는 TTL 신호를 보내고 지정된 시간 간격으로 이미지 수집을 시작하는 프로토콜을 생성하는 방법을 설명합니다.- 이미징 소프트웨어에서 실험 관리자를 클릭하고 새 실험을 선택하여 수집 프로토콜을 설정합니다. 새 창이 열립니다.
- 아이콘을 선택하십시오 타임랩스 루프 새로 열린 창으로 드래그합니다. 주기 수를 2 로 설정하고 간격을 설정에서 허용되는 가장 빠른 설정으로 설정합니다.
- 전송 셔터/수동 셔터 아이콘에서 NI USB-6501 아이콘을 선택하고 타임랩스 루프 창으로 드래그한 다음 NI USB-6501을 닫힌 상태로 설정합니다. 추가 NI USB-6501을 전송 셔터/수동 셔터에서 타임랩스 루프 창으로 드래그하고 열림으로 설정합니다. 두 개의 NI USB-6501 아이콘을 연결하기 위해 NI USB-6501 닫힘 아이콘의 측면에 있는 화살촉을 드래그하고 NI USB-6501 열기 아이콘이 닿을 때까지 당깁니다. 두 아이콘을 연결하는 선이 나타납니다.
- 다른 타임랩스 루프 를 실험 관리자 창으로 드래그하고 화살촉을 당겨 첫 번째 루프에 연결합니다. 녹음을 위한 매개변수를 설정합니다. 새로운 타임랩스 루프 의 사이클 수를 2400으로 설정합니다.
- 이미지 획득 아이콘에서 GFP 필터를 최근에 열었던 타임랩스 루프로 드래그하고 노출 시간을 100ms로 설정합니다.
- 카메라 이미지 유형을 8비트로, 해상도를 576 x 576 (비닝 4 x 4)으로, 픽셀 클럭을 480MHz로, 핫 픽셀 보정을 표준으로 설정합니다.
알림: 매개변수는 형광 센서의 표현 수준, 카메라 감도 및 설정 구성에 따라 조정할 수 있습니다.
- 전기생리학 소프트웨어에서 실험실 벤치를 설정합니다( 재료 표 참조).
알림: 이것은 아날로그/디지털 변환기의 출력 신호를 mV 단위로 정의합니다.- 전기생리학 소프트웨어의 구성 메뉴로 이동하여 Lab Bench를 선택합니다. 결과 출력 신호 창에서 아날로그 출력 #1을 선택하고 신호 추가를 누른 다음 이름을 지정합니다(예: "Piezo"). 신호 단위를 mV로 설정하고 축척 계수(mV/V)를 1로 설정합니다.
- 아래 단계에 따라 전기생리학 소프트웨어에서 자극 프로토콜을 생성합니다.
- 전기생리학 소프트웨어에서 새 자극 프로토콜을 생성하려면 획득 메뉴 항목으로 이동하여 새 프로토콜을 선택합니다.
- Mode/Rate(모드/속도)를 Episodic Stimulation(일시적 자극)으로, Run/Trial(실행/시도)을 1로, Sweep/Run(스윕/실행)을 1로, Sweep Duration(s)(스윕 지속 시간)을 150으로 설정합니다.
- 출력 메뉴에서 채널 #1 피에조를 아날로그 출력으로 선택합니다.
- 트리거 메뉴에서 트리거를 디지타이저 시작 입력 및 내부 타이머로 설정합니다.
- 파형 메뉴에서 채널 #1 및 Epoch가 있는 아날로그 파형을 선택합니다. 단계 A를 단계로, 첫 번째 수준을 0으로, 델타 수준을 0으로, 첫 번째 기간을 10000으로, 델타 기간을 0으로 설정합니다.
- 단계 B를 단계로, 첫 번째 수준을 10으로, 델타 수준을 0으로, 첫 번째 기간을 1000으로, 델타 기간을 0으로 설정합니다. 단계 C를 단계로, 첫 번째 수준을 0으로, 델타 수준을 0으로, 첫 번째 기간을 130000으로, 델타 기간을 0으로 설정합니다.
- 프로토콜을 저장하고 이름을 Stimulation protocol로 지정합니다.
- BNC 케이블을 사용하여 아날로그/디지털 변환기의 아날로그 출력 #1을 단일 채널 개방 루프 피에조 컨트롤러 전면의 EXT INPUT 에 연결합니다( 재료 표 참조).
- 아래 단계에 따라 모세관 유리관에서 우산 세포의 기계적 자극을 위한 유리 마이크로피펫을 제작하십시오.
- 모세관 유리를 풀러( 재료 표 참조)에 놓고 모세관 고정 손잡이로 조정합니다.
- 히터 장치를 전체 높이에 배치합니다. 풀러의 첫 번째 당기기 종료 위치 슬라이더를 5로 조정합니다.
- 첫 번째 히터 노브를 76.7로 설정하고 두 번째 노브를 52.7로 설정합니다.
- 시작 버튼을 눌러 유리 모세관을 두 단계로 당깁니다.
- 히터 조정 손잡이가 60으로 설정된 상태에서 마이크로포지( 재료 표 참조)로 마이크로피펫의 끝을 닫습니다.
참고: 현재 프로토콜의 경우 개별 세포를 찌르는 데 사용되는 마이크로피펫 팁의 최종 직경은 ~1-3μm입니다.
- 자극 마이크로피펫이 자극 프로토콜에 지정된 거리만큼 이동하는지 확인합니다.
알림: 다음 단계는 전기 생리학 소프트웨어에서 자극 프로토콜을 시작한 후 12.5초, 볼륨이tage 지속 시간이 1초인 펄스가 생성되어 압전 액추에이터가 20μm 이동합니다.- 홀더에 마이크로피펫을 장착하고 압전 액추에이터에 부착합니다.
- 압전 액추에이터와 부착된 마이크로피펫을 현미경 중앙과 평행하게 배치tage 영역 내에서 view.
- 피펫의 팁에 초점을 맞추고 압전 마운팅 로드( 재료 표 참조)를 테이프로 고정합니다. 명시야 조명 하에서 카메라 파라미터를 조정하여 파이펫 팁의 선명한 이미지를 얻을 수 있습니다.
- 전기생리학 소프트웨어에서 자극 프로토콜을 열고 재생하도록 설정합니다.
알림: 전기 생리학 프로토콜은 이미징 소프트웨어에서 보낸 TTL 신호가 수신될 때까지 시작되지 않습니다. - 이미징 소프트웨어의 실험 관리자 에서 시작을 눌러 데이터 수집을 시작합니다.
알림: 이것은 압전 액추에이터를 구동할 전기 생리학 소프트웨어의 프로토콜을 트리거합니다. 이미징 소프트웨어의 프로토콜은 실험 이미지가 포함된 파일을 생성합니다.
- 아래 단계에 따라 피펫이 이동한 거리를 확인하십시오.
- 자극 프로토콜 동안 피펫이 이동한 거리를 측정하려면 이미징 소프트웨어에서 Count and Measure 항목을 선택합니다.
- 측정 메뉴에서 측정 및 ROI 옵션을 선택하면 동영상 창 아래에 새 창이 나타납니다.
- Measure( 측정 ) 메뉴에서 Arbitrary Line(임의 라인)을 선택합니다.
- 동영상 창에서 파이펫 끝에서 시작하는 임의의 선을 그립니다. 임의의 줄의 끝은 나중에 조정됩니다.
- 임의의 라인을 마우스 오른쪽 버튼으로 클릭하여 라인을 모든 동영상 프레임에서 볼 수 있는 관심 영역(ROI)으로 변환합니다.
- 동영상을 검사하고 임의 라인의 끝(ROI)을 자극에 대한 반응으로 피펫이 이동한 최종 위치로 조정합니다.
참고: 피펫이 이동한 거리(μm)가 측정 및 ROI 창에 나타납니다. 자극 프로토콜은 사용자의 필요에 따라 수정할 수 있습니다.
2. 방광 점막의 제자리 형질도입 및 분리
- 바이러스 형질도입 프로토콜31에 기재된 절차에 따라 CGaMP5G의 cDNA를 코딩하는 아데노바이러스로 암컷 마우스 방광을 제자리에서 형질도입시킨다.
- Ca2+ 이미징 실험을 위해 요로상피 세포를 형질도입할 때, 2 x 107 감염성 바이러스 입자 (IVP)를 함유하는 용액 50 μL를 방광에 주입한다.
참고: 이 기술은 CGaMP5G의 발현을 우산 세포층으로 제한하는 경향이 있습니다. 대안적으로, 요로상피 세포에서 CGaMP5G를 발현하는 형질전환 마우스로부터 채취한 방광(즉, 우로플라킨-2 프로모터에 의해 구동되는 GCaMP5G 발현) 또는 임의의 다른 관심 세포 유형으로 실험을 수행할 수 있다.
- Ca2+ 이미징 실험을 위해 요로상피 세포를 형질도입할 때, 2 x 107 감염성 바이러스 입자 (IVP)를 함유하는 용액 50 μL를 방광에 주입한다.
- 형질도입 후 24-72시간 후에CO2 질식으로 마우스를 안락사시키고 가위로 흉강을 열어 폐를 허탈시켜 개흉술을 시행합니다.
- 24G 카테터로 요도를 캐뉼라냅니다. 피부와 근육을 통해 ~1.5cm의 복부 절개로 방광을 노출시키고 6.0 봉합사( 재료 표 참조)를 사용하여 카테터를 요도에 고정합니다.
- 방광 및 요도(32)를 채취하고, (mM 단위로)을 함유하는 기록 용액에 목욕된 실리콘 고무 홀더 패드(재료 표 참조)에 부착하고, 135 NaCl, 5.0 KCl, 1 MgCl2, 2.5 CaCl2, 10 글루코스, 10 HEPES, pH 7.4, 100%O2로 버블링하였다(도 2A).
- 이전에 발표된 보고서32 (그림 2B)에 따라 미세한 집게를 사용하여 밑에 있는 근육층에서 방광 점막을 분리합니다.
- 방광 점막을 잘라내고 요로상피가 35mm 직경의 조직 배양 접시 바닥에 있는 실리콘 엘라스토머 삽입물을 향하도록 고정합니다(그림 2C).
3. 개별 요로상피세포의 기계적 자극 및Ca2+ 이미징
- 저항성 발열체가 있는 배양 접시 배양기가 장착된 현미경 단계에서 고정된 방광 점막이 있는 조직 배양 접시를 장착합니다(그림 2E). 인라인 히터로 ~37°C에서 데워진 기록 용액을 사용하여 세포 배양 접시를 1.7mL/분의 속도로 연속적으로 관류합니다(제조업체의 지침에 따라 재료 표 참조).
- 이중 채널 양극성 온도 컨트롤러 모델을 사용하여 조직 접시 인큐베이터 및 용액의 온도를 ~37°C로 유지합니다( 재료 표 참조). 추가 실험 절차를 수행하기 전에 최소 15분 동안 연속 관류로 챔버 내의 조직을 평형화합니다.
- 기계적으로 유도된Ca2+ 과도 현상을 기록하기 위해, 마이크로피펫을 용액에 담그고 조직 접시에 고정된 방광 점막을 목욕시킵니다. 명시야 조명을 사용하는 저배율 스캐닝 대물렌즈(4x)를 사용하여 마이크로피펫을 필드 중앙으로 이동합니다.
- 수직면에서 미세 조작기를 조화롭게 움직이고 초점을 조정하여 요로 상피 조직의 표면 근처에서 마이크로 피펫을 이동하십시오.
- 대물렌즈를 높은 개구수(NA)를 가진 면역형광에 적합한 더 높은 배율(20x)의 대물렌즈로 전환합니다.
- 마이크로매니퓰레이터를 미세 로 설정하고 마이크로피펫을 대상 셀의 상단 근처로 이동합니다.
- 시야를 카메라로 변경하고 이미징 소프트웨어에서 라이브 를 누릅니다.
알림: 반사된 셔터를 켜고 컴퓨터의 조직에서 방출되는 형광 신호를 관찰할 수 있어야 합니다. - 초점을 조정하여 셀의 상단을 시각화하고 필요한 경우 파이펫의 위치를 조정합니다.
- 전기생리학 소프트웨어에서 자극 프로토콜을 열고 재생하도록 설정합니다.
알림: 전기생리학 소프트웨어의 프로토콜은 이미징 소프트웨어에서 보낸 TTL 신호가 수신될 때까지 시작되지 않습니다. - 이미징 소프트웨어의 실험 관리자 에서 시작을 눌러 데이터 수집을 시작합니다. 이렇게 하면 전기생리학 소프트웨어에서 프로토콜이 트리거되어 압전 액추에이터를 구동하고 실험 이미지가 포함된 파일이 생성됩니다. 자극 프로토콜은 사용자의 필요에 따라 수정할 수 있습니다.
4. 데이터 분석
- 아래 단계에 따라 시간 경과에 따른 형광 강도를 정량화합니다.
- 이미징 소프트웨어에서 이미지 파일을 열고 카운트 및 측정 창을 선택합니다. 다각형 도구를 선택하고 찌른 셀의 경계에 ROI를 그립니다.
- Measure(측정) 창으로 이동하여 Intensity Profile(강도 프로파일)을 선택하고 측정을 Over time(경과 시간)으로 설정하고 Results(결과)를 Average(평균)로 설정하고 Background Subtraction(배경 빼기)을 없음(none)으로 설정한 다음 Execute(실행)를 누릅니다. 평균 형광 강도는 시간이 지남에 따라 계산됩니다(그림 3).
- 강도 프로파일 데이터를 내보내려면 강도 프로파일 결과 창에서 Excel 아이콘을 클릭합니다. 이렇게 하면 사용자가 대상 폴더와 파일 이름을 선택하고 데이터를 .xlsx 형식으로 저장할 수 있습니다.
- 과학적 그래프 및 데이터 분석 소프트웨어를 사용하여 데이터 분석을 수행합니다( 재료 표 참조).
참고: 포킹에 의해 유발된 Ca2+ 피크의 진폭은 형광 강도의 변화(ΔF/F)로 표현되며, 여기서 F는 시간 0에서 GCaMP5G의 형광 강도이고, ΔF는 시간 0에서 형광 강도 최대값과 기저 사이의 차이입니다. Ca2+ 반응의 감쇠가 또한 계산될 수 있다 (도시되지 않음).
결과
본 프로토콜은 형광Ca2+ 센서 GCaMP5G를 사용하여 우산 세포에서 기계적으로 유발된Ca2+ 과도 현상을 평가하는 기술을 기술한다. 아데노바이러스 형질도입은 요로상피 세포에서 GCaMP5G를 발현하기 위해 사용되었는데, 그 이유는 GCaMP5G의 높은 효율과 높은 수준의 발현을 생성하기 때문입니다. 형질도입된 방광에서 염색된 극저온 절편의 형광 이미지는 그림 2D에 나와 있습니다. 이러한 실험에서 GCaMP5G 발현은 우산 세포층에서 가장 높습니다. 우산 셀을 찌르는 실험 중에 캡처된 일련의 대표 이미지가 그림 3A에 나와 있습니다. 그림 3A의 첫 번째 이미지는 GCaMP5G를 발현하는 방광 점막의 우산 세포 상단에 위치한 자극 피펫의 형광 보기를 보여줍니다. GCaMP5G를 발현하는 우산 세포의 기계적 자극은 변형을 일으키고(12.5초에서 그림 3A 이미지 참조) 형광 방출이 급격히 증가합니다(13.5초에서 그림 3A 참조). 형광의 변화는 시간의 함수로서 표시되었다(도 3B). 이전에 보고된 바와 같이(31), 찌르기는 대조군 및 GCaMP5G로 형질도입된 야생형 마우스로부터의 방광에서 시험된 대부분의 우산 세포에서Ca2+ 반응을 유발한다. 우산 세포로부터 Piezo1 및 Piezo2를 삭제하면Ca2+ 응답31의 피크 진폭이 감소하였다. 기계적으로 유발된Ca2+ 반응에 대한 다양한 치료 또는 유전적 배경의 효과를 비교할 때 방광의 형질도입, 조직 장착, 압흔에 사용되는 피펫 팁의 크기, 기계적 자극 지속 시간 및 진폭, 이미징 조건을 포함한 실험 조건을 표준화하는 것이 필수적입니다.
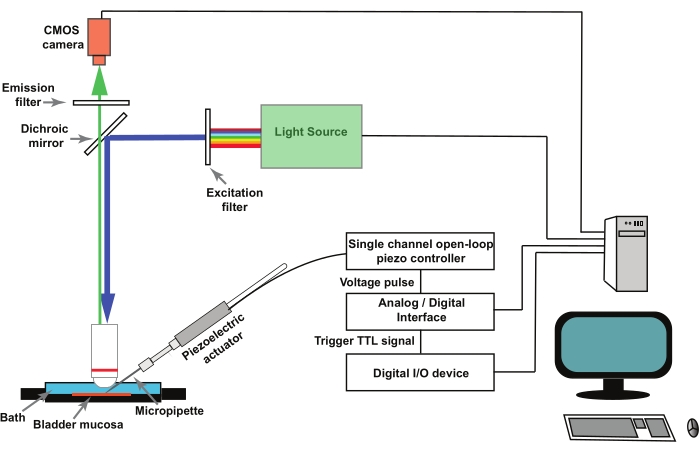
그림 1: 요로상피 세포에서 기계 활성화 Ca2+ 과도 현상을 기록하기 위한 실험 설정. 이 장비는 정립 현미경, 형광 광원, 여기 및 방출 필터, CMOS 카메라로 구성됩니다. 이미징 소프트웨어가 시스템을 제어합니다. 단일 채널 개방 루프 피에조 컨트롤러에 의해 제어되는 압전 액추에이터는 포킹 마이크로피펫을 이동하는 데 사용됩니다. 유리 마이크로피펫은 압전 액추에이터에 부착된 피펫 홀더에 장착됩니다. 압전 액츄에이터 및 관련 마이크로피펫은 마이크로매니퓰레이터(도시되지 않음)에 장착된다. 피에조 개방 루프 컨트롤러는 아날로그/디지털 컨버터 및 전기생리학 소프트웨어에 의해 원격으로 작동됩니다. 이미징 소프트웨어의 레코딩 프로토콜은 디지털 I/O 디바이스를 통해 TTL 신호를 전달하며, 이는 압전 및 이후 이미지 캡처를 제어하는 전기생리학 소프트웨어에서 자극 프로토콜을 시작합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: Ca2+ 이미징을 위한 방광 점막의 분리 및 장착. (A) 카테터가 부착된 점막 시트 준비. 방광 점막은 미세한 집게로 밑에 있는 근육층에서 벗겨졌습니다. (B) 패널 (A)에 표시된 벗겨진 방광 점막의 확대 이미지. (C) 요로상피가 실리콘 엘라스토머 삽입물에 0.15mm 곤충 핀이 위를 향하도록 점막을 고정했습니다. (D) GFP에 대한 항체 및 2차 당나귀 항-토끼 접합 항체(녹색), 로다민-팔로이딘(빨간색) 및 DAPI(파란색)로 염색된 점막 시트 제제의 공초점 면역형광 단면 이미지. 방광 점막 제제는 고유판 (LP)의 일부를 포함합니다. 화살표는 우산 세포층(Ub)의 위치를 나타낸다. 스케일 바 = 50 μm. (E) 실험 설정 사진. a, 인라인 히터; b, 압전 액츄에이터; c, 히터 요소 및 컨트롤러; d, 피펫 홀더 및 마이크로피펫; e, 조직 배양 접시 및 접시 배양기에 실리콘 삽입물에 부착된 점막 시트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3. 요로상피 세포에서 기계 활성화Ca2+ 과도 현상의 기록 및 분석. (A) 실험 과정 동안 서로 다른 시점에서 캡처된 형광 이미지의 시퀀스. 우산 셀의 기계적 자극은 변형을 일으킨 후 GCaMP5G의 방출을 급격히 증가시킵니다(화살표). 자극 세포(ROI)의 경계는 빨간색으로 표시됩니다. (B) 대조군 마우스의 방광 점막 제제에서 8개의 독립적인 기계적 자극 세포에 대한 시간 경과에 따른 형광 강도(ΔF/F)의 변화. 들여쓰기 시간(12.5초)은 파란색 화살표로 표시됩니다. (B)의 데이터는 Dalghi et al.31에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
모든 유기체, 그리고 겉보기에 대부분의 세포 유형은 기계적 자극에 반응하는 이온 채널을 발현합니다 20,33,34,35,36,37. 이러한 기계적으로 활성화된 채널의 기능은 주로 패치 클램프 기술로 평가되었습니다. 그러나 접근성 문제로 인해 기계적으로 활성화된 이온 채널에 대한 패치 클램프 연구는 해리된 세포와 세포주로 제한되었습니다. 기계적으로 활성화된 많은 이온 채널이 Ca2+를 투과할 수 있기 때문에 현미경, 생체 감지 및 미세 조작의 최근 발전을 활용하여 생체 외 요로상피 제제에서 기계적으로 활성화된 채널의 기능을 평가하는 이미징 방법을 개발했습니다. 이 프로토콜에서 요로상피 세포는 GCaMP5G를 암호화하는 아데노바이러스로 형질도입됩니다. 아데노바이러스 벡터는 요로상피 세포에서 GCaMP5G의 높은 형질도입 속도와 높은 수준의 발현을 제공하기 때문에 요로상피에서Ca2+ 신호전달을 연구하는 데 이상적입니다(그림 2D). 이러한 조건에서 배경 형광은 상대적으로 낮습니다. 아데노바이러스 형질도입이 유전적으로 암호화된Ca2+ 센서를 발현하기 위해 사용되는 경우, 관심 세포만이 센서를 발현하도록 조건을 최적화하는 데 특별한 중점을 두어야 합니다. 대안으로서, 유전적으로 코딩된Ca2+ 지표 (GECIs)의 발현은 관심있는 단백질 (예를 들어, GCaMP5G)을 암호화하는 플록싱된 이식유전자를 운반하는 마우스와 적합한 프로모터의 제어 하에 Cre 재조합효소를 발현하는 마우스를 교배시킴으로써 달성될 수 있다. 이 접근법은 외과적 시술을 필요로 하지 않으며, Cre 재조합효소를 발현하는 세포에서 단백질의 표적 발현 및 심지어 발현 수준을 제공하는 이점이 있다.
여기에 설명된 프로토콜은 직립 광시야 현미경을 사용하여 폐쇄형 파이어 폴리싱 마이크로피펫으로 자극된 우산 세포에서 기계적으로 활성화된 Ca2+ 과도 현상을 평가합니다. 이 방법은 직립 공초점 또는 이광자 현미경을 사용하여 요로상피의 더 깊은 층 또는 고유판의 세포에서 기계 형질도입을 연구하는 데 적용할 수 있습니다. 공초점 현미경을 사용하는 것은 기계적 자극에 반응하여 발생하는 세포내Ca2+ 의 세포하 변화를 정의하는데 필요한 해상도를 제공할 수 있다. 이 프로토콜은 폐쇄형 파이어 폴리싱 마이크로피펫을 사용하여 개별 우산 셀을 찌릅니다. 자극을 위해 마이크로 피펫을 사용하는 주요 이점은 조직에 가해지는 기계적 섭동이 일시적이며 관심있는 세포와 주변 영역으로 제한된다는 것입니다. 세포 스트레칭 시스템은 PDMS 멤브레인에서 성장한 세포를 기계적으로 자극하는 데 사용할 수 있지만, 내재된 한계는 생체 외 준비를 사용한 이미징 실험에 이러한 장치의 사용을 방해합니다. 이러한 한계에는 마우스 방광을 장착하고 이미징하는 데 어려움이 있으며, 방광 점막의 접힌 특성을 감안할 때 조직을 늘리면서 관심 세포에 초점을 유지하는 데 어려움이 있습니다.
요로상피 제제에서 기계적으로 활성화된 Ca2+ 과도 현상을 측정하기 위한 프로토콜에는 몇 가지 제한 사항이 있습니다. 첫째, 장비에는 상대적으로 고가의 부품이 포함되어 있으며 조립 및 설정에는 현미경, 마이크로 매니퓰레이터, 아날로그-디지털 변환기 및 비교적 전문화된 소프트웨어에 대한 전문 지식이 필요합니다. 패치 클램핑과 마찬가지로 이 기술은 조사자가 미세 매니퓰레이터를 사용하고 기계적 자극을 위한 유리 마이크로피펫을 만드는 방법을 배워야 합니다. 그러나, 피펫과 멤브레인 사이에 고저항 밀봉의 형성을 포함하는 패치-클램프 기술과는 달리, 기계적으로 활성화된Ca2+ 과도 현상을 측정하기 위해 여기에 설명된 절차는 비교적 간단하며, 단지 연구자가 자극 피펫을 자극될 세포의 표면 가까이에 위치시키기만을 요구한다. 따라서 훈련된 조사자는 패치 클램프 기술로는 상상할 수 없는 8-10개의 세포를 1시간 안에 찌르는 것에 대한 반응을 잠재적으로 평가할 수 있습니다.
기계적으로 활성화된 이온 채널이 정상적인 신체 기능과 질병 상태에서 갖는 중요성을 감안할 때, 이러한 채널을 본래의 환경에서 연구하기 위해서는 새로운 방법이 필요합니다. 이 프로토콜에 설명된 바와 같이, 이미징 방법은 이러한 채널이 환경의 변화를 감지하고 생리적 반응을 생성하는 방법에 대한 고유한 통찰력을 제공할 수 있습니다. 관 또는 주머니 모양의 장기의 점막 표면의 접근성을 감안할 때, 여기에 설명된 방법은 장, 비뇨생식기, 혈관 등을 포함한 다른 환경에서 기계 형질도입을 연구하는 데 적용될 수 있습니다. 따라서 신체의 기계적 반응을 연구하는 것이 광범위하게 유용 할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 NIH 보조금 R01DK119183(GA 및 MDC에) 및 S10OD028596(GA에)과 Pittsburgh Center for Kidney Research(P30DK079307)의 세포 생리학 및 모델 유기체 신장 이미징 코어의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
참고문헌
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14(2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170(2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984(2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558(2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055(2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유