Method Article
离体 尿路上皮细胞中机械活化的CA2+ 瞬变分析
摘要
该协议描述了一种使用荧光Ca2 + 传感器GCaMP5G评估天然尿路上皮细胞中机械激活离子通道功能的方法。
摘要
机械激活离子通道是将机械刺激(如拉伸力或剪切力)转换为电和生化信号的生物换能器。在哺乳动物中,机械激活通道对于检测触觉、听觉、红细胞体积调节、基础血压调节和膀胱充盈感等各种过程中的外部和内部刺激至关重要。虽然机械激活离子通道的功能已在体外环境中使用膜片钳技术进行了广泛研究,但评估它们在天然环境中的功能仍然是一项艰巨的任务,通常是因为这些通道表达位点(例如,传入末端、Merkel 细胞、压力感受器和肾小管)的访问受限或难以应用膜片钳技术(例如 尿路上皮伞细胞的顶端表面)。该协议描述了一种在离体尿路上皮制剂中使用荧光传感器GCaMP5G评估机械诱发的Ca 2 +瞬变的程序,该技术可以很容易地适用于研究其他天然组织制剂中的机械诱发Ca2 +事件。
引言
当尿滤液通过肾单位时,尿道中的上皮细胞受到机械力,尿液被泵出肾盂并通过输尿管储存在膀胱中。人们早就认识到,液体对泌尿道上皮细胞施加的机械力(例如剪切应力和拉伸)调节近端肾小管中蛋白质和远端肾单位中溶质的重吸收1,2,3,4,5,6,7,8,9,10,11,12,13,以及尿液在膀胱中的储存和排尿14,15,16,17。
机械刺激转化为电和生化信号的过程称为机械转导,由响应细胞结构变形或相关细胞外基质变形的蛋白质介导18,19,20,21。机械激活离子通道的独特之处在于,它们响应膜张力、压力或剪切应力的变化从封闭状态转变为开放渗透状态18,19,20,21,22。此外,Ca 2+瞬变可以通过整合素介导的机械转导或通过激活细胞-细胞连接处的机械响应粘附系统23,24,25,26来启动。离子通道功能通常使用膜片钳技术进行评估,该技术涉及在细胞膜和贴片移液器27之间形成千兆欧密封。然而,位于具有致密细胞外基质(例如肾小管)或被物理屏障(例如糖萼)包围的深层组织层中的细胞很难用玻璃微量移液器进入。同样,嵌入的细胞或作为机械稳定性差的组织组成部分的细胞(例如尿路上皮)不能轻易地用膜片钳技术进行研究。由于许多机械激活的离子通道可渗透到Ca 2+,因此另一种方法是使用Ca2+敏感染料或遗传编码钙指示剂(GECIs)如GCaMP)通过荧光显微镜评估其活性。最近在蛋白质工程方面的努力显着增加了GECIs28,29,30的动态范围,灵敏度和响应,遗传学的进步使其在特定细胞群中表达,使其非常适合研究机械转导。
尿路上皮是覆盖膀胱内部的分层上皮,起到屏障的作用,防止尿溶质扩散到膀胱间质中,但也起到换能器的作用,感知膀胱充盈并将这些事件传达给下面的神经和肌肉组织16。先前的研究表明,尿路上皮和下层组织之间的通信需要机械激活的离子通道Piezo1和Piezo231。为了评估尿路上皮细胞中机械诱导的Ca 2+瞬变,开发了一种新技术,该技术使用腺病毒基因转移在尿路上皮细胞中表达Ca2+传感器GCaMP5G。该技术采用粘膜片制备,可轻松进入最外层的伞状细胞层和计算机辅助系统,用于用封闭的玻璃微量移液管同时机械刺激单个细胞并记录荧光随时间的变化。
研究方案
动物的护理和处理是根据匹兹堡大学机构动物护理和使用委员会进行的。雌性,2-4个月大的C57Bl / 6J小鼠用于本研究。小鼠是商业获得的(见 材料表)。
1. 设备组装与设置
- 使用配备高分辨率相机和稳定光源的正置显微镜进行Ca2+ 成像(参见 材料表)。
- 使用显微镜兼容软件采集图像,该软件允许通过USB数字I / O设备 直接 控制相机,光源和压电陶瓷促动器(参见 材料表)。
注: 图1 为设置示意图。GCaMP5G的峰值激发波长为470 nm,峰值发射波长为497 nm28。使用适用于GCaMP5G成像的滤光片立方体。
- 使用显微镜兼容软件采集图像,该软件允许通过USB数字I / O设备 直接 控制相机,光源和压电陶瓷促动器(参见 材料表)。
- 为了刺激膀胱粘膜制剂中的单个尿路上皮细胞(见步骤2),请使用由单通道开环压电控制器控制的压电致动器(见 材料表)。将压电致动器安装在显微操纵器中。
- 将玻璃微量移液器安装在固定在压电致动器的移液器支架中(图1)。通过由电生理学数据采集和分析程序控制的模拟/数字转换器远程操作压电控制器(参见 材料表)。
注意:由成像软件启动的晶体管-晶体管逻辑 (TTL) 信号形式的外部触发器用于触发移动压电致动器的电生理学数据采集和分析软件中的刺激协议(图 1)。
- 将玻璃微量移液器安装在固定在压电致动器的移液器支架中(图1)。通过由电生理学数据采集和分析程序控制的模拟/数字转换器远程操作压电控制器(参见 材料表)。
- 确保成像软件(参见 材料表)与数字I/O设备接口。在 USB 数字 I/O 设备中配置数字输出通道,将 TTL 信号传送到模拟/数字转换器,模拟/数字转换器将在电生理学软件中启动移动压电致动器的协议。
- 使用电缆将模拟/数字转换器中的启动 BNC 端口连接到接地 (GND) 和 USB 数字 I/O 设备中的螺丝端子。
- 在成像软件中设置记录协议。
注意:以下步骤介绍如何生成将发送TTL信号并以指定时间间隔开始收集图像的协议。- 在成像软件中设置采集方案,方法是单击实验 管理器 并选择 新建实验。将打开一个新窗口。
- 选择图标 延时循环 并将其拖动到新打开的窗口中;将周期数设置为 2 ,将间隔设置为设置中允许的最快设置。
- 从 透射快门/手动快门 图标 中, 选择 NI USB-6501 图标 并将其拖 到 延时 循环 窗口, 然后将 NI USB-6501 设置为 关闭。将 附加 的 NI USB-6501 从 透射快门/手动快门 拖 到 延时 循环 窗口 中, 并 将其 设为 打开。要连接两个NI USB-6501图标,请拖动NI USB-6501关闭图标侧面的箭头并拉动,直到其触摸NI USB-6501打开图标。将出现连接两个图标的线。
- 将另一个 延时摄影循环 拖到 实验管理器 窗口中,然后通过拉动箭头将其连接到第一个时间循环。设置录制参数。将新 延时摄影循环 的周期数设置为 2400。
- 从 图像采集 图标中,将 GFP滤镜 拖到最近打开的 延时摄影循环 中,并将曝光时间设置为 100毫秒。
- 将相机图像类型设置为 8 位,将分辨率设置为 576 x 576 (合并 4 x 4),将像素时钟设置为 480 MHz,将热像素校正设置为 标准。
注意:可以根据荧光传感器的表达水平、相机灵敏度和设置配置调整参数。
- 在电生理学软件中设置实验室工作台(参见 材料表)。
注意: 这将定义模拟/数字转换器的输出信号(以 mV 为单位)。- 转到电生理学软件中的"配置"菜单,然后选择"实验室工作台"。在生成的输出信号窗口中,选择模拟输出#1,按添加信号,并将其命名(例如,"压电")。将信号单位设置为 mV,将比例因子 (mV/V) 设置为 1。
- 按照以下步骤在电生理学软件中生成刺激方案。
- 要在电生理学软件中生成新的刺激方案,请转到菜单项 获取 并选择 新方案。
- 将 模式/速率 设置为 情节刺激,将 运行/试用设置为 1,将扫描 /运行 设置为 1, 将扫描持续时间 设置为 150。
- 在输出菜单中,选择通道#1压电作为模拟输出。
- 在"触发器"菜单中,将 触发器 设置为" 数字化仪启动输入 "和 "内部计时器"。
- 在"波形"菜单中,选择通道 #1 和"带纪元的模拟波形"。将步骤 A 设置为步骤,将第一级设置为 0,将增量级别设置为 0,将第一个持续时间设置为 10000,将增量持续时间设置为 0。
- 将步骤 B 设置为步骤,将第一个级别设置为 10,将增量级别设置为 0,将第一个持续时间设置为 1000,将增量持续时间设置为 0。 将步骤 C 设置为步骤,将第一级设置为 0,将增量级别设置为 0,将第一个持续时间设置为 130000,将增量持续时间设置为 0。
- 保存协议并将其命名为 刺激协议。
- 使用 BNC 电缆将模拟/数字转换器中的 模拟输出 #1 连接到单通道开环压电控制器前面的 EXT 输入 (参见 材料表)。
- 按照以下步骤制造玻璃微量移液器,用于从毛细管玻璃管机械刺激伞状细胞。
- 将毛细管玻璃放入拉拔器中(见 材料表),并用毛细管固定旋钮进行调整。
- 将加热器单元置于其全高。将拉拔器的第一个拉动端接位置滑块调整为 5。
- 将第一个加热器旋钮设置为 76.7,将第二个旋钮设置为 52.7。
- 按开始按钮分两步拉动玻璃毛细管。
- 用微锻件(参见 材料表)关闭微量移液器的尖端,加热器调节旋钮设置为60。
注意:对于本协议,用于戳单个细胞的微量移液器吸头的最终直径为~1-3μm。
- 验证刺激微量移液器是否移动刺激方案中指定的距离。
注意:以下步骤是为了确保在电生理学软件中启动刺激方案后12.5秒,产生持续时间为1秒的电压脉冲,使压电致动器移动20μm。- 在支架中安装微量移液器并将其连接到压电致动器。
- 将压电致动器和连接的微量移液器平行于显微镜载物台的中心并在视野范围内放置。
- 聚焦在移液器的尖端,并用胶带固定压电安装杆(参见 材料表)。在明场照明下,调整相机参数以获得移液器吸头的清晰图像。
- 在电生理学软件中打开 刺激协议 并将其设置为播放。
注意:在收到从成像软件发送的TTL信号之前,电生理学方案不会启动。 - 从成像软件的 实验管理器 中,按 开始 启动数据采集。
注意:这将触发电生理学软件中的协议,该软件将驱动压电致动器。成像软件中的协议将生成一个包含实验图像的文件。
- 按照以下步骤验证移液器行驶的距离。
- 要测量移液器在刺激方案期间行进的距离,请在成像软件中选择计数 和测量 项目。
- 从 " 测量"菜单中,选择 "测量和投资回报率 "选项,电影窗口下方将出现一个新窗口。
- 从" 度量 "菜单中,选择 "任意线"。
- 在影片窗口中,从移液器尖端开始绘制一条任意线。请注意,稍后将调整任意行的末尾。
- 右键单击任意行以将该 行 转换为感兴趣区域 (ROI),该区域将在所有电影帧中可见。
- 检查视频并将任意线的末端(ROI)调整到移液器响应刺激而行进的最终位置。
注意:移液器行进的距离(以μm为单位)将显示在 "测量和ROI "窗口中。刺激方案可根据用户需要修改。
2.膀胱黏膜原 位 转导和分离
- 根据病毒转导方案31中描述的程序,用编码CGaMP5G的cDNA的腺病毒原位转导雌性小鼠膀胱。
- 当转导尿路上皮细胞进行Ca 2 +成像实验时,向膀胱内滴注含有2 x 107 感染性病毒颗粒(IVP)的50μL溶液。
注意:这种技术倾向于将CGaMP5G的表达限制在伞状细胞层。或者,可以使用从尿路上皮细胞中表达CGaMP5G的转基因小鼠(即由尿路蛋白-2启动子驱动的GCaMP5G表达)或任何其他感兴趣的细胞类型收获的膀胱进行实验。
- 当转导尿路上皮细胞进行Ca 2 +成像实验时,向膀胱内滴注含有2 x 107 感染性病毒颗粒(IVP)的50μL溶液。
- 转导后24-72小时,通过CO2 窒息对小鼠实施安乐死,并通过用剪刀打开胸腔使肺部塌陷来进行开胸术。
- 用 24 G 导管插入尿道。通过皮肤和肌肉~1.5cm的腹部切口暴露膀胱,并使用6.0缝合线( 材料表)将导管固定在尿道上。
- 收获膀胱和尿道32,并贴在硅橡胶支架垫(见材料表)上,该垫沐浴在含有(mM)的记录溶液中:135 NaCl,5.0 KCl,1 MgCl 2,2.5 CaCl 2,10葡萄糖,10 HEPES,pH 7.4,并用100%O 2鼓泡(图2A)。
- 按照先前发表的报告32 (图2B),用细镊子将膀胱粘膜与下面的肌肉层分开。
- 切开膀胱粘膜并将其固定,尿路上皮面向35毫米直径组织培养皿底部的有机硅弹性体插入物(图2C)。
3. 单个尿路上皮细胞的机械刺激和 Ca2+ 成像
- 将带有固定膀胱粘膜的组织培养皿安装在配备带有电阻加热元件的培养皿培养箱的显微镜载物台中(图2E)。灌注(按照制造商的说明,参见 材料表)细胞培养皿以1.7mL / min的速率连续,记录溶液在~37°C下用在线加热器加热。
- 使用双通道双极温度控制器模型将组织培养箱和溶液的温度保持在~37°C(参见 材料表)。在进行进一步的实验程序之前,用连续灌注平衡腔室中的组织至少15分钟。
- 为了记录机械诱导的Ca2 + 瞬变,将微量移液器浸入溶液中,将固定的膀胱粘膜沐浴在组织培养皿中。借助低倍率扫描物镜(4x)使用明场照明将微量移液器移动到视场中心。
- 通过在垂直平面上协调移动显微操纵器并调整焦点,将微量移液器移动到尿路上皮组织表面附近。
- 将物镜切换到具有更高放大倍率(20倍)的物镜,适用于具有高数值孔径(NA)的免疫荧光。
- 将显微操纵器设置为 精细 ,并将微量移液器移动到目标细胞顶部附近。
- 将视野更改为相机,然后在成像软件中按 实时 。
注意:这必须打开反射快门,并允许观察计算机中组织发出的荧光信号。 - 调整焦点以可视化细胞顶部,并在必要时调整移液器的位置。
- 在电生理学软件中打开 刺激协议 并将其设置为 播放。
注意:在收到从成像软件发送的TTL信号之前,电生理学软件中的协议不会启动。 - 从成像软件的 实验管理器 中,按 开始 启动数据采集。这将触发电生理学软件中的协议,该软件将驱动压电致动器并生成包含实验图像的文件。刺激方案可以根据用户的需要进行修改。
4. 数据分析
- 按照以下步骤量化随时间推移的荧光强度。
- 在成像软件中打开图像文件,然后选择 计数和测量 窗口。选择 多边形 工具并在戳的单元格的边界上绘制 ROI。
- 转到"测量"窗口,选择"强度配置文件",将测量值设置为"随时间推移","结果"设置为"平均值",将"背景减法"设置为"无",然后按"执行"。平均荧光强度将随时间计算(图3)。
- 要导出强度配置文件数据,请单击强度配置文件结果窗口中的 Excel 图标。这将允许用户选择目标文件夹和文件名,并以.xlsx格式保存数据。
- 使用科学绘图和数据分析软件进行数据分析(见 材料表)。
注意:戳引起的Ca2+ 峰的振幅表示为荧光强度(ΔF / F)的变化,其中F是GCaMP5G在时间0处的荧光强度,ΔF是荧光强度最大值与时间0的基底之间的差异。还可以计算Ca2+ 响应的衰减(未显示)。
结果
本协议描述了一种使用荧光Ca 2 +传感器GCaMP5G评估伞形细胞中机械诱发的Ca2 +瞬变的技术。腺病毒转导用于在尿路上皮细胞中表达GCaMP5G,因为它的效率高,并且产生更高的表达水平。来自转导膀胱的染色冷冻切片的荧光图像如图2D所示。对于这些实验,GCaMP5G在伞细胞层中的表达最高。在戳伞细胞的实验中捕获的一系列代表性图像如图3A所示。图3A中的第一个图像显示了位于表达GCaMP5G的膀胱粘膜伞形细胞顶部的刺激移液器的荧光图。对表达GCaMP5G的伞形细胞进行机械刺激导致变形(在12.5秒时见图3A),随后荧光发射迅速增加(见图3A在13.5秒时)。将荧光的变化绘制为时间的函数(图3B)。如前31报道的那样,在对照组和用GCaMP5G转导的野生型小鼠的膀胱中测试的大多数伞形细胞中,戳戳会引起Ca2+反应。从伞形电池中删除压电1和压电2降低了Ca2+响应的峰值幅度31。在比较不同治疗或遗传背景对机械诱发的Ca2+反应的影响时,必须标准化实验条件,包括膀胱转导,组织安装,用于压痕的移液器尖端的大小,机械刺激持续时间和振幅以及成像条件。
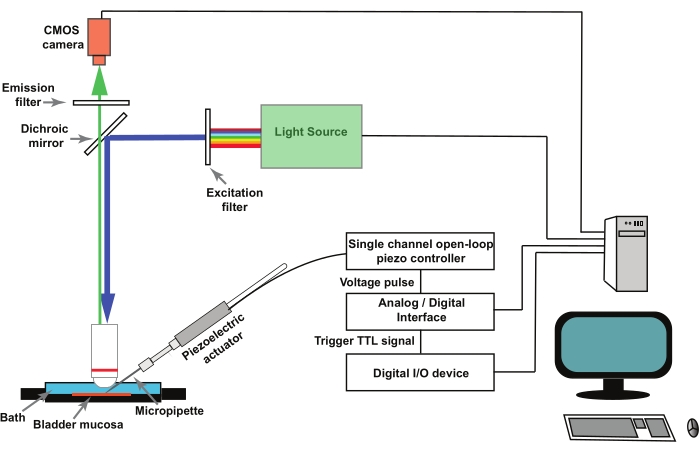
图 1:记录尿路上皮细胞中机械激活的 Ca2+ 瞬变的实验装置。 该装置由正置显微镜、荧光光源、激发和发射滤光片以及CMOS相机组成。成像软件控制系统。由单通道开环压电控制器控制的压电致动器用于移动戳微量移液器。玻璃微量移液器安装在固定在压电致动器的移液器支架中。压电致动器和相关的微量移液器安装在显微操纵器上(未示出)。压电开环控制器由模拟/数字转换器和电生理学软件远程操作。成像软件中的记录协议通过数字I / O设备 提供 TTL信号,这启动了电生理学软件中的刺激协议,该协议控制压电,随后控制图像捕获。 请点击此处查看此图的大图。

图 2:用于Ca 2+ 成像的膀胱粘膜的分离和安装。 (A)带有连接导管的粘膜片准备。用细镊子从下面的肌肉层剥离膀胱粘膜。(B)图(A)所示的剥离膀胱粘膜的放大图像。(C)将粘膜固定下来,尿路上皮朝上,用0.15毫米的昆虫针钉固定在有机硅弹性体插入物上。(D) 用抗 GFP 抗体和二级驴抗兔偶联抗体(绿色)、罗丹明-鬼笔环肽(红色)和 DAPI(蓝色)染色的粘膜片制剂的共聚焦免疫荧光横截面图像。膀胱粘膜制剂包括部分固有层(LP)。箭头指示伞状细胞层 (Ub) 的位置。比例尺 = 50 μm。 (E) 实验装置的照片。a、直列式加热器;b、压电执行器;c、加热器元件及控制器;d、移液器支架和微量移液器;e,粘膜片附着在硅胶插入组织培养皿和培养皿培养箱中。 请点击此处查看此图的大图。

图3.记录和分析尿路上皮细胞中机械激活的 Ca2+ 瞬变。 (A)在实验过程中不同时间点捕获的荧光图像序列。请注意,伞形电池的机械刺激会导致变形,然后GCaMP5G的发射迅速增加(箭头)。受刺激细胞 (ROI) 的边界标记为红色。(B)对照小鼠膀胱粘膜制剂中八个独立的机械刺激细胞的荧光强度(ΔF / F)随时间的变化。压痕时间(12.5 秒)用蓝色箭头标记。(B)中的数据已修改自Dagghi等人31。 请点击此处查看此图的大图。
讨论
所有生物体,似乎大多数细胞类型,都表达响应机械刺激的离子通道20,33,34,35,36,37。这些机械激活通道的功能主要通过膜片钳技术进行评估。然而,由于可及性问题,机械激活离子通道的膜片钳研究在很大程度上仅限于解离的细胞和细胞系。由于许多机械激活的离子通道可渗透到Ca2+,我们利用显微镜,生物传感和显微操作的最新进展来开发一种成像方法来评估离体尿路上皮制剂中机械激活通道的功能。在该协议中,尿路上皮细胞用编码GCaMP5G的腺病毒转导。腺病毒载体非常适合研究尿路上皮中的Ca 2+信号传导,因为它们在尿路上皮细胞中提供高转导率和高水平GCaMP5G表达(图2D)。在这些条件下,背景荧光相对较低。如果使用腺病毒转导来表达基因编码的Ca2+传感器,则应特别注意优化条件,以便只有感兴趣的细胞表达传感器。作为替代方案,可以通过在合适的启动子的控制下将携带编码目标蛋白质的絮状转基因(例如GCaMP5G)的小鼠和表达Cre重组酶的小鼠杂交来实现遗传编码的Ca2+指示剂(GECIs)的表达。这种方法不需要外科手术,并且具有在表达Cre重组酶的细胞中提供靶向表达和均匀水平的蛋白质表达的优点。
这里描述的方案使用正置宽视场显微镜来评估用封闭的火抛光微量移液器刺激的伞状细胞中的机械激活的Ca2+ 瞬变。该方法可用于使用正置共聚焦或双光子显微镜研究尿路上皮深层甚至固有层细胞的机械转导。使用共聚焦显微镜可以提供必要的分辨率来定义响应机械刺激而发生的细胞内Ca2+ 的亚细胞变化。该方案采用封闭的火抛光微量移液器来戳单个伞状细胞。使用微量移液器进行刺激的主要优点是施加在组织上的机械扰动是暂时的,并且仅限于感兴趣的细胞和周围区域。虽然细胞拉伸系统可用于机械刺激在PDMS膜上生长的细胞,但固有的局限性阻碍了此类设备用于 离体 制剂的成像实验。这些限制包括安装和成像小鼠膀胱的挑战,以及鉴于膀胱粘膜的折叠性质,在拉伸组织时难以保持对目标细胞的关注。
测量尿路上皮制剂中机械激活的Ca2+ 瞬变的方案有一些局限性。首先,该钻机包括相对昂贵的组件,其组装和设置需要显微镜,显微操纵器,模数转换器和相对专业的软件方面的专业知识。与膜片钳一样,这种技术要求研究人员学习如何使用显微操纵器并制造用于机械刺激的玻璃微量移液器。然而,与膜片钳技术不同,膜片钳技术涉及在移液器和膜之间形成高电阻密封,这里描述的测量机械激活的Ca2+ 瞬变的过程相对简单,只需要研究人员将刺激性移液器放置在靠近要刺激的细胞表面。因此,训练有素的研究者可以在1小时内评估对8-10个细胞的戳伤的反应,这在膜片钳技术中是不可想象的。
鉴于机械激活离子通道在正常身体功能和疾病状态下的重要性,需要新的方法来研究这些通道在其天然环境中。如本协议所述,成像方法可以提供关于这些通道如何感知其环境中的变化并产生生理反应的独特见解。鉴于管状或囊状器官的粘膜表面的可及性,这里描述的方法可以适用于研究其他环境中的机械转导,包括肠道、泌尿生殖道、血管等。因此,研究体内的机械反应可能广泛有用。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NIH拨款R01DK119183(G.A.和MDC)和S10OD028596(G.A.)以及匹兹堡肾脏研究中心的细胞生理学和模式生物肾脏成像核心(P30DK079307)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
参考文献
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14(2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170(2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984(2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558(2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055(2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。