Method Article
Ex Vivo Análise de Transientes de Ca2+ Ativados Mecanicamente em Células Uroteliais
Neste Artigo
Resumo
Este protocolo descreve uma metodologia para avaliar a função de canais iônicos ativados mecanicamente em células uroteliais nativas usando o sensor fluorescente Ca2+ GCaMP5G.
Resumo
Canais iônicos ativados mecanicamente são transdutores biológicos que convertem estímulos mecânicos, como forças de estiramento ou cisalhamento, em sinais elétricos e bioquímicos. Em mamíferos, os canais ativados mecanicamente são essenciais para a detecção de estímulos externos e internos em processos tão diversos quanto a sensação de toque, audição, regulação do volume dos glóbulos vermelhos, regulação da pressão arterial basal e sensação de plenitude da bexiga urinária. Embora a função dos canais iônicos ativados mecanicamente tenha sido extensivamente estudada no cenário in vitro usando a técnica patch-pamp, avaliar sua função em seu ambiente nativo continua sendo uma tarefa difícil, muitas vezes devido ao acesso limitado aos locais de expressão desses canais (por exemplo, terminais aferentes, células de Merkel, barorreceptores e túbulos renais) ou dificuldades na aplicação da técnica patch-clamp (por exemplo, as superfícies apicais das células guarda-chuva uroteliais). Este protocolo descreve um procedimento para avaliar transientes de Ca 2+ evocados mecanicamente usando o sensor fluorescente GCaMP5G em uma preparação urotelial ex vivo, uma técnica que poderia ser prontamente adaptada para o estudo de eventos de Ca2+ evocados mecanicamente em outras preparações de tecidos nativos.
Introdução
As células epiteliais do trato urinário são submetidas a forças mecânicas à medida que o filtrado urinário viaja através dos néfrons, e a urina é bombeada para fora da pelve renal e viaja através dos ureteres para ser armazenada na bexiga urinária. Há muito se reconhece que as forças mecânicas (por exemplo, tensão de cisalhamento e estiramento) exercidas por fluidos nas células epiteliais que revestem o trato urinário regulam a reabsorção de proteínas no túbulo proximal e de solutos no néfron distal 1,2,3,4,5,6,7,8,9,10,11, 12,13, bem como o armazenamento de urina na bexiga urinária e micção14,15,16,17.
A conversão de estímulos mecânicos em sinais elétricos e bioquímicos, processo denominado mecanotransdução, é mediada por proteínas que respondem à deformação das estruturas celulares ou da matriz extracelular associada 18,19,20,21. Os canais iônicos ativados mecanicamente são únicos no sentido de que fazem a transição de um estado fechado para um estado permeável aberto em resposta a mudanças na tensão, pressão ou tensão de cisalhamento da membrana 18,19,20,21,22. Além disso, os transientes de Ca 2+ podem ser iniciados por mecanotransdução mediada por integrina ou por ativação de sistemas de adesão mecanorresponsivos em junções célula-célula23,24,25,26. A função do canal iônico é geralmente avaliada com a técnica patch-clamp, que envolve a formação de uma vedação gigaohm entre a membrana celular e a pipetapatch-27. No entanto, células localizadas em camadas profundas de tecido com uma matriz extracelular densa (por exemplo, túbulos renais) ou cercadas por uma barreira física (por exemplo, glicocálice) são de difícil acesso com uma micropipeta de vidro. Da mesma forma, células embutidas ou que são partes integrantes de tecidos com baixa estabilidade mecânica (por exemplo, o urotélio) não podem ser prontamente estudadas com a técnica patch-clamp. Como muitos canais iônicos ativados mecanicamente são permeáveis ao Ca 2+, uma abordagem alternativa é avaliar sua atividade por microscopia fluorescente usando um corante sensível ao Ca2+ ou indicadores de cálcio geneticamente codificados (GECIs), como o GCaMP. Esforços recentes em engenharia de proteínas aumentaram significativamente a faixa dinâmica, a sensibilidade e a resposta dos GECIs28,29,30, e os avanços na genética permitiram sua expressão em populações celulares específicas, tornando-as ideais para estudar a mecanotransdução.
O urotélio, epitélio estratificado que recobre o interior da bexiga urinária, funciona como uma barreira, impedindo a difusão de solutos urinários no interstício vesical, mas também funciona como transdutor, sentindo a plenitude vesical e comunicando esses eventos aos nervos e musculatura subjacentes16. Estudos prévios mostraram que a comunicação entre o urotélio e os tecidos subjacentes requer os canais iônicos ativados mecanicamente Piezo1 e Piezo231. Para avaliar transientes de Ca 2+ induzidos mecanicamente em células uroteliais, uma nova técnica descrita que usa transferência de genes adenovirais para expressar o sensor de Ca2+ GCaMP5G em células uroteliais foi desenvolvida. Esta técnica emprega uma preparação de folha mucosa que fornece fácil acesso à camada celular guarda-chuva mais externa e um sistema assistido por computador para a estimulação mecânica simultânea de células individuais com uma micropipeta de vidro fechada e registro de mudanças na fluorescência ao longo do tempo.
Protocolo
O cuidado e o manuseio dos animais foram realizados de acordo com o Comitê Institucional de Cuidados e Uso de Animais da Universidade de Pittsburgh. Camundongos C57Bl/6J fêmeas de 2-4 meses de idade foram utilizados para o presente estudo. Os camundongos foram obtidos comercialmente (ver Tabela de Materiais).
1. Montagem e configuração do equipamento
- Realize imagens Ca2+ com um microscópio vertical equipado com uma câmera de alta resolução e uma fonte de luz estável (consulte Tabela de materiais).
- Adquira as imagens com um software compatível com microscópio que permita o controle direto da câmera, da fonte de luz e do atuador piezo por meio de um dispositivo de E/S digital USB (consulte Tabela de materiais).
Observação : Figura 1 representa um esquema da instalação. GCaMP5G tem um comprimento de onda de excitação de pico de 470 nm e um comprimento de onda de emissão de pico de 497 nm28. Use um cubo de filtro adequado para imagens GCaMP5G.
- Adquira as imagens com um software compatível com microscópio que permita o controle direto da câmera, da fonte de luz e do atuador piezo por meio de um dispositivo de E/S digital USB (consulte Tabela de materiais).
- Para a estimulação de células uroteliais individuais na preparação da mucosa da bexiga (ver passo 2), utilize um atuador piezoelétrico controlado por um controlador piezo de circuito aberto de canal único (ver Tabela de Materiais). Monte o atuador piezoelétrico em um micromanipulador.
- Monte as micropipetas de vidro em um suporte de pipeta afixado ao atuador piezoelétrico (Figura 1). Operar remotamente o controlador piezo por um conversor analógico/digital controlado por um programa de aquisição e análise de dados eletrofisiológicos (consulte Tabela de Materiais).
NOTA: Um gatilho externo, na forma de um sinal de lógica transistor-transistor (TTL) iniciado pelo software de imagem, é utilizado para acionar o protocolo de estimulação no software de aquisição e análise de dados eletrofisiológicos que movimenta o atuador piezoelétrico (Figura 1).
- Monte as micropipetas de vidro em um suporte de pipeta afixado ao atuador piezoelétrico (Figura 1). Operar remotamente o controlador piezo por um conversor analógico/digital controlado por um programa de aquisição e análise de dados eletrofisiológicos (consulte Tabela de Materiais).
- Verifique se o software de geração de imagens (consulte Tabela de materiais) faz interface com o dispositivo de E/S digital. Configure um canal de saída digital no dispositivo de E/S digital USB para entregar o sinal TTL ao conversor analógico/digital, que iniciará o protocolo no software de eletrofisiologia que move o atuador piezoelétrico.
- Use um cabo para conectar a porta Start BNC no conversor analógico/digital ao aterramento (GND) e um terminal de parafuso no dispositivo de E/S digital USB.
- Configure o protocolo de gravação no software de imagem.
Observação : as etapas a seguir descrevem como gerar um protocolo que enviará um sinal TTL e iniciar a coleta de imagens em intervalos de tempo especificados.- Configure o protocolo de aquisição no software de imagem clicando no Gerenciador de Experimentos e selecionando Novo Experimento. Uma nova janela será aberta.
- Selecione o ícone Time Lapse Loop e arraste-o para a janela recém-aberta; defina o número de ciclos como 2 e o intervalo como a configuração mais rápida permitida na configuração.
- No ícone Obturador transmitido/obturador manual, selecione o ícone NI USB-6501 e arraste-o para a janela Time Lapse Loop e, em seguida, defina o NI USB-6501 como fechado. Arraste um NI USB-6501 adicional do obturador transmitido/obturador manual para a janela Time Lapse Loop e defina-o como aberto. Para conectar os dois ícones NI USB-6501, arraste a ponta de seta na lateral do ícone fechado NI USB-6501 e puxe até que ele toque no ícone aberto NI USB-6501. Uma linha que conecta os dois ícones será exibida.
- Arraste outro Time Lapse Loop para a janela do Gerenciador de Experimentos e conecte-o ao primeiro puxando a ponta da seta. Defina os parâmetros para gravação. Defina o número de ciclos do novo Time Lapse Loop como 2400.
- No ícone Aquisição de imagem , arraste o filtro GFP para o loop de lapso de tempo recém-aberto e defina o tempo de exposição para 100 ms.
- Defina o tipo de imagem da câmera como 8 bits, a resolução como 576 x 576 (Binning 4 x 4), o clock de pixels para 480 MHz e a correção de pixels quentes como padrão.
NOTA: Os parâmetros podem ser ajustados dependendo do nível de expressão do sensor fluorescente, da sensibilidade da câmera e da configuração da configuração.
- Configure o Lab Bench no software de eletrofisiologia (consulte Tabela de Materiais).
NOTA: Isso definirá o sinal de saída em mV do conversor analógico/digital.- Vá para o menu Configurar no software de eletrofisiologia e selecione Lab Bench. Na janela Sinais de Saída resultante, selecione Saída Analógica #1, pressione o sinal Adicionar e nomeie-o (por exemplo, "Piezo"). Defina a Unidade de Sinal como mV e o Fator de Escala (mV/V) como 1.
- Gerar um protocolo de estimulação no software de eletrofisiologia seguindo os passos abaixo.
- Para gerar um novo protocolo de estimulação no software de eletrofisiologia, vá para o item de menu Adquirir e selecione Novo Protocolo.
- Defina Modo/Taxa como Estimulação Episódica, Executar/Julgamento como 1, Varrer/Executar como 1 e Duração (s) da Varredura como 150.
- No menu Saídas , selecione o canal #1 Piezo como Saída analógica.
- No menu Acionador , defina o gatilho como Digitador Iniciar Entrada e Temporizador Interno.
- No menu Forma de onda, selecione o canal #1 e Forma de onda analógica com Épocas. Defina a Etapa A como Etapa, o Primeiro Nível como 0, o Nível Delta como 0, a Primeira duração como 10000 e a Duração Delta como 0.
- Defina a Etapa B como Etapa, o Primeiro nível como 10, o Nível Delta como 0, a Primeira Duração como 1000 e a Duração Delta como 0. Defina a Etapa C como Etapa, o Primeiro Nível como 0, o Nível Delta como 0, a Primeira Duração como 130000 e a Duração Delta como 0.
- Salve o protocolo e nomeie-o Protocolo de estimulação.
- Use um cabo BNC para conectar a Saída Analógica #1 no conversor analógico/digital à ENTRADA EXT na frente do controlador piezo de circuito aberto de canal único (consulte Tabela de Materiais).
- Fabricar micropipetas de vidro para a estimulação mecânica de células guarda-chuva a partir de tubos de vidro capilar seguindo os passos abaixo.
- Coloque o vidro capilar em um extrator (consulte Tabela de Materiais) e ajuste-o com os botões de retenção capilar.
- Posicione a unidade de aquecimento em toda a sua altura. Ajuste o primeiro controle deslizante de posição de terminação de tração do extrator para 5.
- Ajuste o primeiro botão do aquecedor para 76,7 e o segundo botão para 52,7.
- Puxe o capilar de vidro em duas etapas pressionando o botão Iniciar.
- Feche a ponta da micropipeta com uma microforja (ver Tabela de Materiais) com o botão de ajuste do aquecedor ajustado a 60.
NOTA: Para o presente protocolo, o diâmetro final da ponta da micropipeta usada para cutucar células individuais é de ~1-3 μm.
- Verifique se a micropipeta estimulante move a distância especificada no protocolo de estimulação.
NOTA: Os passos a seguir são para garantir que 12,5 s após o início do protocolo de estimulação no software de eletrofisiologia, um pulso de tensão com duração de 1 s seja gerado, fazendo com que o atuador piezoelétrico se mova 20 μm.- Monte uma micropipeta no suporte e prenda-a ao atuador piezoelétrico.
- Coloque o atuador piezoelétrico e a micropipeta anexada paralelamente ao centro do estágio do microscópio e dentro da área de visão.
- Concentre-se na ponta da pipeta e imobilize a haste de montagem piezoelétrica (consulte Tabela de materiais) com fita adesiva. Sob iluminação de campo brilhante, ajuste os parâmetros da câmera para obter uma imagem clara da ponta da pipeta.
- Abra o protocolo de estimulação no software de eletrofisiologia e configure-o para jogar.
NOTA: O protocolo de eletrofisiologia não será iniciado até que o sinal TTL enviado pelo software de imagem seja recebido. - No Gerenciador de experimentos no software de geração de imagens, pressione Iniciar para iniciar a aquisição de dados.
NOTA: Isso acionará o protocolo no software de eletrofisiologia, que acionará o atuador piezoelétrico. O protocolo no software de imagem irá gerar um arquivo com as imagens do experimento.
- Verifique a distância percorrida pela pipeta seguindo os passos abaixo.
- Para medir a distância percorrida pela pipeta durante o protocolo de estimulação, selecione o item Contar e Medir no software de imagem.
- No menu Medida , selecione a opção Medição e ROI e uma nova janela aparecerá abaixo da janela do filme.
- No menu Medida , escolha a Linha Arbitrária.
- Na janela do filme, desenhe uma linha arbitrária começando na ponta da pipeta. Observe que o final da linha arbitrária será ajustado posteriormente.
- Clique com o botão direito do mouse na linha arbitrária para converter a linha em uma região de interesse (ROI), que será visível em todos os quadros de filmes.
- Inspecione o filme e ajuste o final da linha arbitrária (ROI) para a posição final percorrida pela pipeta em resposta ao estímulo.
NOTA: A distância percorrida pela pipeta em μm aparecerá na janela Medição e ROI . O protocolo de estimulação pode ser modificado de acordo com as necessidades do usuário.
2. Transdução in situ e isolamento da mucosa vesical
- Transduzir bexigas de camundongos fêmeas in situ com um adenovírus que codifica o cDNA do CGaMP5G de acordo com o procedimento descrito no protocolo de transdução do vírus31.
- Ao transduzir células uroteliais para experimentos de imagem Ca2+ , instilar as bexigas com 50 μL da solução contendo 2 x 107 partículas virais infecciosas (PIV).
NOTA: Esta técnica tende a restringir a expressão de CGaMP5G para a camada de célula guarda-chuva. Alternativamente, experimentos poderiam ser conduzidos com bexigas urinárias colhidas de camundongos transgênicos expressando CGaMP5G em células uroteliais (ou seja, expressão de GCaMP5G impulsionada por um promotor de uroplacina-2) ou qualquer outro tipo de célula de interesse.
- Ao transduzir células uroteliais para experimentos de imagem Ca2+ , instilar as bexigas com 50 μL da solução contendo 2 x 107 partículas virais infecciosas (PIV).
- 24-72 h após a transdução, eutanasiar os ratos por asfixia por CO2 e realizar uma toracotomia, abrindo a cavidade torácica com tesoura para causar o colapso dos pulmões.
- Canular a uretra com cateter 24 G. Exponha a bexiga por uma incisão abdominal de ~1,5 cm através da pele e do músculo e use uma sutura de 6,0 (ver Tabela de Materiais) para fixar o cateter à uretra.
- Colhe-se a bexiga e a uretra32 e afixe uma almofada de suporte de borracha de silicone (ver Tabela de Materiais) banhada em solução de gravação contendo (em mM): 135 NaCl, 5,0 KCl, 1 MgCl 2,2,5 CaCl2, 10 glicose, 10 HEPES, pH 7,4 e borbulhada com 100% O2 (Figura 2A).
- Separe a mucosa vesical da camada muscular subjacente com pinça fina, seguindo relatos publicados anteriormente32 (Figura 2B).
- Abrir a mucosa da bexiga e fixá-la com o urotélio voltado para uma inserção de elastômero de silicone no fundo de um prato cultivado com tecido de 35 mm de diâmetro (Figura 2C).
3. Estimulação mecânica de células uroteliais individuais e imagens de Ca2+
- Monte o prato cultivado com a mucosa vesical fixada no estágio microscópico equipado com uma incubadora de prato de cultura com elementos de aquecimento resistivo (Figura 2E). Perfundir (seguindo as instruções do fabricante, ver Tabela de Materiais) a placa de cultura celular continuamente a uma taxa de 1,7 mL/min com solução de gravação aquecida a ~37 °C com um aquecedor em linha.
- Manter a temperatura da incubadora e das soluções de placas de tecido a ~37 °C com um modelo de controlador de temperatura bipolar de canal duplo (ver Tabela de Materiais). Equilibrar o tecido na câmara com perfusão contínua por pelo menos 15 minutos antes de realizar procedimentos experimentais adicionais.
- Para registrar os transientes de Ca2+ induzidos mecanicamente, submerja a micropipeta na solução banhando a mucosa da bexiga fixada no prato de tecido. Mova a micropipeta para o centro do campo com a ajuda de uma objetiva de varredura de baixa ampliação (4x) usando iluminação de campo brilhante.
- Mova a micropipeta para perto da superfície do tecido urotelial movendo coordenadamente o micromanipulador no plano vertical e ajustando o foco.
- Mude a objetiva para uma com maior ampliação (20x) adequada para imunofluorescência com alta abertura numérica (NA).
- Defina o micromanipulador como Fino e mova a micropipeta para perto da parte superior da célula alvo.
- Altere o campo de visão para câmera e pressione Live no software de imagem.
NOTA: Isso deve ligar o obturador refletido e permitir a observação do sinal fluorescente emitido pelo tecido no computador. - Ajuste o foco para visualizar a parte superior da célula e ajuste a posição da pipeta, se necessário.
- Abra o protocolo de estimulação no software de eletrofisiologia e configure-o para jogar.
NOTA: O protocolo no software de eletrofisiologia não será iniciado até que o sinal TTL enviado pelo software de imagem seja recebido. - No Gerenciador de experimentos no software de geração de imagens, pressione Iniciar para iniciar a aquisição de dados. Isso acionará o protocolo no software de eletrofisiologia, que acionará o atuador piezoelétrico e gerará um arquivo com as imagens do experimento. O protocolo de estimulação pode ser modificado de acordo com as necessidades do usuário.
4. Análise dos dados
- Quantifique a intensidade de fluorescência ao longo do tempo seguindo as etapas abaixo.
- Abra o arquivo de imagem no software de imagem e selecione a janela Contagem e Medida . Selecione a ferramenta de polígono e desenhe um ROI nos limites da célula que foi cutucada.
- Vá para a janela Medida, selecione Perfil de Intensidade, defina a medição como Ao longo do tempo, Resultados como Média, Subtração em segundo plano como nenhuma e pressione Executar. A intensidade média de fluorescência será calculada ao longo do tempo (Figura 3).
- Para exportar os dados do perfil de intensidade, clique no ícone do Excel na janela Resultados do Perfil de Intensidade. Isso permitirá que o usuário escolha a pasta de destino e o nome do arquivo e salve os dados em um formato .xlsx.
- Realizar análise de dados utilizando gráficos científicos e software de análise de dados (ver Tabela de Materiais).
NOTA: A amplitude do pico de Ca2+ evocado por cutucada é expressa como a mudança na intensidade de fluorescência (ΔF/F), onde F é a intensidade de fluorescência de GCaMP5G no tempo 0, e ΔF é a diferença entre os máximos de intensidade de fluorescência e o basal no tempo 0. O decaimento da resposta Ca2+ também pode ser calculado (não mostrado).
Resultados
O presente protocolo descreve uma técnica para avaliar transientes de Ca 2+ evocados mecanicamente em células guarda-chuva usando o sensor fluorescente de Ca2+ GCaMP5G. A transdução adenoviral foi empregada para expressar GCaMP5G em células uroteliais devido à sua alta eficiência e por produzir um nível elevado de expressão. Imagens fluorescentes de criosecções coradas de uma bexiga transduzida são mostradas na Figura 2D. Para esses experimentos, a expressão de GCaMP5G é maior na camada de células guarda-chuva. Uma sequência de imagens representativas capturadas durante um experimento em que uma célula guarda-chuva foi cutucada é mostrada na Figura 3A. A primeira imagem da Figura 3A mostra uma visão fluorescente da pipeta estimulante posicionada no topo de uma célula guarda-chuva de uma mucosa vesical expressando GCaMP5G. A estimulação mecânica da célula guarda-chuva que expressa GCaMP5G provoca uma deformação (ver imagem Figura 3A a 12,5 s), seguida de um rápido aumento na emissão de fluorescência (ver imagem Figura 3A a 13,5 s). A mudança na fluorescência foi plotada em função do tempo (Figura 3B). Como relatado anteriormente31, cutucar evoca uma resposta Ca2+ na maioria das células guarda-chuva testadas em bexigas de ratos de controle e do tipo selvagem transduzidos com GCaMP5G. A exclusão de Piezo1 e Piezo2 das células guarda-chuva reduziu a amplitude de pico da resposta Ca2+ 31. Ao comparar o efeito de diferentes tratamentos ou antecedentes genéticos nas respostas de Ca2+ evocadas mecanicamente, é essencial padronizar as condições experimentais, incluindo a transdução da bexiga, a montagem do tecido, o tamanho da ponta da pipeta usada para recuo, a duração e a amplitude do estímulo mecânico e as condições de imagem.
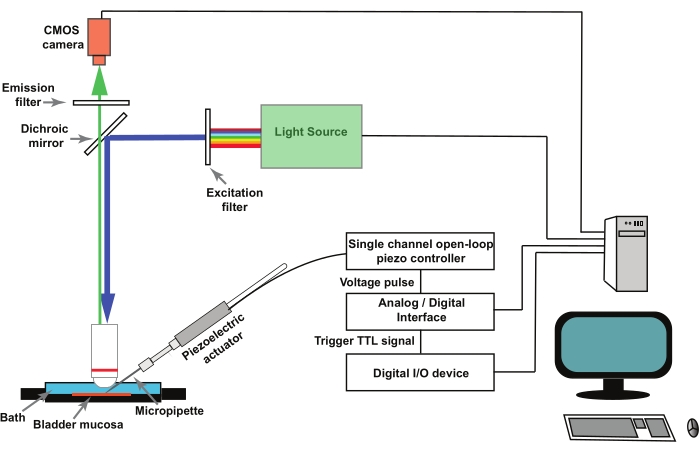
Figura 1: Configuração experimental para registrar transientes de Ca2+ ativados por mecano em células uroteliais. A carreta de perfuração consiste em um microscópio vertical, fonte de luz fluorescente, filtros de excitação e emissão e uma câmera CMOS. O software de imagem controla o sistema. Um atuador piezoelétrico controlado por um controlador piezo de circuito aberto de canal único é usado para mover a micropipeta de cutucada. As micropipetas de vidro são montadas em um suporte de pipeta afixado ao atuador piezoelétrico. O atuador piezoelétrico e a micropipeta associada são montados em um micromanipulador (não mostrado). O controlador de circuito aberto piezo é operado remotamente por um conversor analógico / digital e software de eletrofisiologia. Um protocolo de gravação no software de imagem fornece um sinal TTL através de um dispositivo de E/S digital, e isso inicia o protocolo de estimulação no software de eletrofisiologia que controla a captura piezoelétrica e, posteriormente, de imagem. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: Isolamento e montagem da mucosa vesical para imagem de Ca2 +. (A) Preparação da folha mucosa com cateter acoplado. A mucosa vesical foi retirada da camada muscular subjacente com pinça fina. (B) Imagem ampliada da mucosa vesical despojada mostrada no painel (A). (C) A mucosa foi fixada com o urotélio voltado para cima com pinos de insetos de 0,15 mm para uma inserção de elastômero de silicone. (D) Imagens de seção transversal de imunofluorescência confocal da preparação da folha mucosa corada com um anticorpo contra GFP e um anticorpo conjugado anti-coelho de burro secundário (verde), rodamina-faloidina (vermelho) e DAPI (azul). A preparação da mucosa vesical inclui parte da lâmina própria (PL). As setas indicam a localização da camada de célula guarda-chuva (Ub). Barras de escala = 50 μm. (E) Fotografia da configuração experimental. a, aquecedor em linha; b, atuador piezoelétrico; c, elementos do aquecedor e controlador; d, suporte de pipeta e micropipeta; e, folha mucosa presa à inserção de silicone em um prato cultivado com tecido e incubadora de louça. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3. Registro e análise de transientes de Ca2+ ativados por mecano em células uroteliais. (A) Sequência de imagens fluorescentes capturadas em diferentes pontos de tempo durante o curso de um experimento. Observe que a estimulação mecânica da célula guarda-chuva causa uma deformação seguida por um rápido aumento na emissão de GCaMP5G (seta). As bordas da célula estimulada (ROI) são marcadas em vermelho. (B) Alteração na intensidade de fluorescência (ΔF/F) ao longo do tempo para oito células independentes estimuladas mecanicamente em uma preparação da mucosa da bexiga de um camundongo controle. O tempo de recuo (12,5 s) é marcado com uma seta azul. Os dados em (B) foram modificados de Dalghi et al.31. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Todos os organismos, e aparentemente a maioria dos tipos celulares, expressam canais iônicos que respondem a estímulos mecânicos 20,33,34,35,36,37. A função desses canais ativados mecanicamente tem sido predominantemente avaliada com a técnica patch-praçad. No entanto, devido a problemas de acessibilidade, os estudos patch-clamp de canais iônicos ativados mecanicamente têm sido amplamente restritos a células dissociadas e linhas celulares. Como muitos canais iônicos ativados mecanicamente são permeáveis ao Ca2+, aproveitamos os recentes avanços em microscopia, biossensoriamento e micromanipulação para desenvolver um método de imagem para avaliar a função dos canais ativados mecanicamente em uma preparação urotelial ex vivo. Neste protocolo, as células uroteliais são transduzidas com um adenovírus codificando para GCaMP5G. Os vetores adenovirais são ideais para o estudo da sinalização Ca 2+ no urotelio, pois fornecem uma alta taxa de transdução e altos níveis de expressão de GCaMP5G em células uroteliais (Figura 2D). Nessas condições, a fluorescência de fundo é relativamente baixa. Se a transdução adenoviral for usada para expressar um sensor Ca2+ geneticamente codificado, ênfase especial deve ser dada à otimização das condições, de modo que apenas as células de interesse expressem o sensor. Como alternativa, a expressão de indicadores de Ca2+ (GECIs) geneticamente codificados poderia ser alcançada cruzando camundongos portadores de um transgene floxado codificando a proteína de interesse (por exemplo, GCaMP5G) e camundongos expressando Cre recombinase sob o controle de um promotor adequado. Esta abordagem não requer procedimentos cirúrgicos e tem a vantagem de fornecer expressão direcionada e até mesmo níveis de expressão de proteínas em células que expressam Cre recombinase.
O protocolo descrito aqui usa um microscópio vertical de campo largo para avaliar transientes de Ca2+ ativados mecanicamente em células guarda-chuva estimuladas com uma micropipeta fechada polida pelo fogo. O método poderia ser adaptado para estudar a mecanotransdução em camadas mais profundas do urotélio ou mesmo células na lâmina própria com um microscópio confocal vertical ou de dois fótons. O uso de um microscópio confocal pode fornecer a resolução necessária para definir alterações subcelulares no Ca2+ intracelular que ocorrem em resposta à estimulação mecânica. Este protocolo emprega uma micropipeta fechada polida a fogo para cutucar células guarda-chuva individuais. A principal vantagem de usar uma micropipeta para estimulação é que a perturbação mecânica exercida sobre o tecido é transitória e limitada à célula de interesse e à área circundante. Considerando que os sistemas de alongamento celular podem ser usados para estimular mecanicamente células cultivadas em membranas PDMS, limitações inerentes impedem o uso de tais dispositivos para experimentos de imagem com preparações ex vivo. Essas limitações incluem desafios com a montagem e a imagem de uma bexiga de camundongo e, dada a natureza dobrada da mucosa da bexiga, dificuldades em manter o foco nas células de interesse ao esticar o tecido.
O protocolo para medir transientes de Ca2+ ativados mecanicamente em preparações uroteliais tem algumas limitações. Primeiro, a carreta de perfuração inclui componentes relativamente caros, e sua montagem e configuração exigem experiência com microscópios, micromanipuladores, conversores analógico-digitais e software relativamente especializado. Como o patch-clamping, esta técnica requer que o investigador aprenda a usar um micromanipulador e fazer micropipetas de vidro para estimulação mecânica. No entanto, ao contrário da técnica patch-clamp, que envolve a formação de uma vedação de alta resistência entre a pipeta e a membrana, o procedimento descrito aqui para medir transientes de Ca2+ ativados mecanicamente é relativamente simples e requer apenas que o investigador posicione a pipeta estimulatória perto da superfície da célula a ser estimulada. Portanto, um investigador treinado pode potencialmente avaliar a resposta à cutucada de 8-10 células em 1 hora, o que é inconcebível com a técnica patch-pranch.
Dada a importância que os canais iônicos ativados mecanicamente têm na função normal do corpo e nos estados de doença, novos métodos são necessários para estudar esses canais em seu meio nativo. Conforme descrito neste protocolo, os métodos de imagem podem fornecer uma visão única de como esses canais detectam mudanças em seu ambiente e geram respostas fisiológicas. Dada a acessibilidade da superfície mucosa dos órgãos em forma de tubo ou saco, o método descrito aqui poderia ser adaptado para estudar a mecanotransdução em outros ambientes, incluindo o intestino, o trato urogenital, os vasos sanguíneos, etc. Assim, estudar as respostas mecânicas no corpo pode ser amplamente útil.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelas bolsas do NIH R01DK119183 (para G.A. e MDC) e S10OD028596 (para G.A.) e pelo Cell Physiology and Model Organism Kidney Imaging Cores do Pittsburgh Center for Kidney Research (P30DK079307).
Materiais
| Name | Company | Catalog Number | Comments |
| 20x Objective | Olympus | UMPlanFL N | |
| 24 G ¾” catheter | Medline | Suresite IV slide | |
| 4x Objective | Olympus | UPlanFL N | |
| Analog/digital converter | Molecular Devices | Digidata 1440A | |
| Anti-GFP antibody | Abcam | Ab6556 | |
| Beam splitter | Chroma | T495lpxr | |
| Bipolar temperature controller | Warner Instruments | TC-344B | |
| CaCl2 | Fluka | 21114-1L | 1 M solution |
| cellSens software | Olympus | Imaging software | |
| CMOS camera | Hamamatsu | ORCA fusion | |
| Donkey anti-rabbit conjugated to Alexa Fluor 488 | Jackson ImmunoResearch | 711-545-152 | |
| Excel | Microsoft Corporation | ||
| Filter | Chroma | ET470/40X | |
| Glass capillaries Corning 8250 glass | Warner Instruments | G85150T-4 | |
| Glucose | Sigma | G8270 | |
| HEPES | Sigma | H4034 | |
| Inline heater | Warner Instruments | SH-27B | |
| KCl | Sigma | 793590 | |
| Light source | Sutter Instruments | Lambda XL | |
| Manifold pump tubing | Fisherbrand | 14-190-510 | ID 1.52 mm |
| Manifold pump tubing | Fisherbrand | 14-190-533 | ID 2.79 mm |
| MgCl2 | Sigma | M9272 | |
| Mice | Jackson Lab | 664 | 2-4 months old female C57BL/6J |
| Microforge | Narishige | MF-830 | |
| Micromanipulator | Sutter Instruments | MP-285 | |
| Microscope | Olympus | BX51W | |
| Mounting media with DAPI | Invitrogen | S36964 | Slowfade Diamond Antifade with DAPI |
| NaCl | Sigma | S7653 | |
| pClamp software | Molecular Devices | Version 10.4 | Patch-clamp electrophysiology data acquisition and analysis software |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Piezoelectric actuator | Thorlabs | PAS005 | |
| Pipette holder | World Precision Instruments | ||
| Pipette puller | Narishige | PP-830 | |
| Quick exchange heated base with perfusion and adapter ring kit | Warner Instruments | QE-1 | Quick exchange platform fits 35 mm dish |
| Rhodamine-phalloidin | Invitrogen | R415 | |
| Sigma-Plot | Systat Software Inc | Version 14.0 | Scientific graphing and data analysis software |
| Silicone elastomer | Dow | Sylgard 184 | |
| Single channel open-loop piezo controller | Thorlabs | MDT694B | |
| Square grid holder pad | Ted Pella | 10520 | |
| Suture | AD Surgical | S-S618R13 | 6-0 Sylk |
| Teflon mounting rod | Custom made | Use to mount the piezoelectric actuator in the micromanipulator | |
| Tubing | Fisher Scientific | 14171129 | Tygon S3 ID 1/16 IN, OD 1/8 IN |
| USB Digital I/O device | National Instruments | NI USB-6501 |
Referências
- Kunau, R. T., Webb, H. L., Borman, S. C. Characteristics of the relationship between the flow rate of tubular fluid and potassium transport in the distal tubule of the rat. Journal of Clinical Investigation. 54 (6), 1488-1495 (1974).
- Engbretson, B. G., Stoner, L. C. Flow-dependent potassium secretion by rabbit cortical collecting tubule in vitro. American Journal of Physiology. 253 (5), 896-903 (1987).
- Satlin, L. M., Sheng, S., Woda, C. B., Kleyman, T. R. Epithelial Na(+) channels are regulated by flow. American Journal of Physiology Renal Physiology. 280 (6), 1010-1018 (2001).
- Woda, C. B., et al. Ontogeny of flow-stimulated potassium secretion in rabbit cortical collecting duct: functional and molecular aspects. American Journal of Physiology Renal Physiology. 285 (4), 629-639 (2003).
- Malnic, G., Berliner, R. W., Giebisch, G. Flow dependence of K+ secretion in cortical distal tubules of the rat. American Journal of Physiology. 256 (5), 932-941 (1989).
- Khuri, R. N., Strieder, W. N., Giebisch, G. Effects of flow rate and potassium intake on distal tubular potassium transfer. American Journal of Physiology. 228 (4), 1249-1261 (1975).
- Good, D. W., Wright, F. S. Luminal influences on potassium secretion: sodium concentration and fluid flow rate. American Journal of Physiology. 236 (2), 192-205 (1979).
- Wong, K. R., Berry, C. A., Cogan, M. G. Flow dependence of chloride transport in rat S1 proximal tubules. American Journal of Physiology. 269 (6), 870-875 (1995).
- Garvin, J. L. Glucose absorption by isolated perfused rat proximal straight tubules. American Journal of Physiology. 259 (4), 580-586 (1990).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of renal potassium excretion in the rat. American Journal of Physiology. 206 (4), 674-686 (1964).
- Malnic, G., Klose, R. M., Giebisch, G. Micropuncture study of distal tubular potassium and sodium transport in rat nephron. American Journal of Physiology. 211 (3), 529-547 (1966).
- Cabral, P. D., Garvin, J. L. Luminal flow regulates NO and O2(-) along the nephron. American Journal of Physiology. 300 (5), 1047-1053 (2011).
- Raghavan, V., Rbaibi, Y., Pastor-Soler, N. M., Carattino, M. D., Weisz, O. A. Shear stress-dependent regulation of apical endocytosis in renal proximal tubule cells mediated by primary cilia. Proceedings of the National Academy of Sciences. 111 (23), 8506-8511 (2014).
- Lewis, S. A., de Moura, J. L. Apical membrane area of rabbit urinary bladder increases by fusion of intracellular vesicles: an electrophysiological study. The Journal of Membrane Biology. 82 (2), 123-136 (1984).
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Dalghi, M. G., Montalbetti, N., Carattino, M. D., Apodaca, G. The urothelium: life in a liquid environment. Physiological Reviews. 100 (4), 1621-1705 (2020).
- Khandelwal, P., Abraham, S. N., Apodaca, G. Cell biology and physiology of the uroepithelium. American Journal of Physiology Renal Physiology. 297 (6), 1477-1501 (2009).
- Sachs, F. Stretch-activated ion channels: what are they. Physiology. 25 (1), 50-56 (2010).
- Martinac, B. Mechanosensitive ion channels: molecules of mechanotransduction. Journal of Cell Science. 117 (12), 2449-2460 (2004).
- Ranade, S. S., Syeda, R., Patapoutian, A. Mechanically activated ion channels. Neuron. 87 (6), 1162-1179 (2015).
- Cox, C. D., Bavi, N., Martinac, B. Biophysical principles of ion-channel-mediated mechanosensory transduction. Cell Reports. 29 (1), 1-12 (2019).
- Carattino, M. D., Sheng, S., Kleyman, T. R. Epithelial Na+ channels are activated by laminar shear stress. Journal of Biological Chemistry. 279 (6), 4120-4126 (2004).
- Ross, T. D., et al. Integrins in mechanotransduction. Current Opinion in Cell Biology. 25 (5), 613-618 (2013).
- Dieterle, M. P., Husari, A., Rolauffs, B., Steinberg, T., Tomakidi, P. Integrins, cadherins and channels in cartilage mechanotransduction: perspectives for future regeneration strategies. Expert Reviews in Molecular Medicine. 23, 14 (2021).
- Huveneers, S., de Rooij, J. Mechanosensitive systems at the cadherin-F-actin interface. Journal of Cell Science. 126, 403-413 (2013).
- Sun, Z., Guo, S. S., Fässler, R. Integrin-mediated mechanotransduction. Journal of Cell Biology. 215 (4), 445-456 (2016).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflügers Archiv. European Journal of Physiology. 391 (2), 85-100 (1981).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2 (2013).
- Sun, X. R., et al. Fast GCaMPs for improved tracking of neuronal activity. Nature Communications. 4, 2170 (2013).
- Dalghi, M. G., et al. Functional roles for PIEZO1 and PIEZO2 in urothelial mechanotransduction and lower urinary tract interoception. JCI Insight. 6 (19), 152984 (2021).
- Durnin, L., et al. An ex vivo bladder model with detrusor smooth muscle removed to analyse biologically active mediators released from the suburothelium. The Journal of Physiology. 597 (6), 1467-1485 (2019).
- Delmas, P., Coste, B. Mechano-gated ion channels in sensory systems. Cell. 155 (2), 278-284 (2013).
- Tavernarakis, N., Driscoll, M. Degenerins. At the core of the metazoan mechanotransducer. Annals of the New York Academy of Sciences. 940 (1), 28-41 (2001).
- Peyronnet, R., Tran, D., Girault, T., Frachisse, J. M. Mechanosensitive channels: feeling tension in a world under pressure. Frontiers in Plant Science. 5, 558 (2014).
- Blount, P., Iscla, I. Life with bacterial mechanosensitive channels, from discovery to physiology to pharmacological target. Microbiology and Molecular Biology Reviews. 84 (1), 00055 (2020).
- Booth, I. R., Miller, S., Müller, A., Lehtovirta-Morley, L. The evolution of bacterial mechanosensitive channels. Cell Calcium. 57 (3), 140-150 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados