Method Article
Метод очистки тканей для визуализации нейронов от мезоскопических до микроскопических масштабов
В этой статье
Резюме
Протокол предоставляет подробный метод визуализации нейронов в срезе мозга с использованием метода очистки тканей ScaleSF. Протокол включает в себя подготовку тканей головного мозга, осветление тканей, обработку очищенных срезов и конфокальную лазерную сканирующую микроскопическую визуализацию нейронных структур от мезоскопического до микроскопического уровней.
Аннотация
Здесь представлен подробный протокол для визуализации нейронных структур от мезоскопического до микроскопического уровней в тканях мозга. Нейронные структуры, начиная от нейронных цепей и заканчивая субклеточными нейронными структурами, визуализируются в срезах мозга мыши, оптически очищенных с помощью ScaleSF. Этот метод очистки является модифицированной версией ScaleS и представляет собой гидрофильный метод очистки тканей для срезов тканей, который обеспечивает мощную очищающую способность, а также высокий уровень сохранения флуоресцентных сигналов и структурной целостности. Настраиваемая трехмерная (3D)-печатная камера визуализации предназначена для надежного монтажа очищенных тканей мозга. Мозг мыши, которому вводили аденоассоциированный вирусный вектор, несущий усиленный ген зеленого флуоресцентного белка, фиксировали 4% параформальдегидом и разрезали на срезы толщиной 1 мм с помощью вибрирующего слайсера тканей. Срезы мозга очищали в соответствии с протоколом очистки, который включал последовательные инкубации в трех растворах, а именно: раствор scaleS0, фосфатный буферный физиологический раствор (-) и раствор ScaleS4, в общей сложности 10,5-14,5 ч. Очищенные срезы мозга были установлены на камере визуализации и встроены в 1,5% агарозный гель, растворенный в растворе ScaleS4D25(0). Получение 3D-изображения срезов осуществлялось с помощью конфокального лазерного сканирующего микроскопа, оснащенного мульти-погружным объективом большого рабочего расстояния. Начиная с мезоскопической нейрональной визуализации, нам удалось визуализировать тонкие субклеточные нейронные структуры, такие как дендритные шипы и аксональные бутоны, в оптически очищенных срезах мозга. Этот протокол облегчит понимание нейронных структур от схемы до субклеточных компонентных масштабов.
Введение
Методы очистки тканей улучшили глубинно-независимую визуализацию биологических и клинических образцов с помощью световой микроскопии, что позволяет извлекать структурную информацию на интактных тканях 1,2. Методы оптической очистки также могут потенциально ускорить и снизить стоимость гистологического анализа. В настоящее время существуют три основных подхода к очистке: гидрофильный, гидрофобный и гидрогелевой методы 1,2. Гидрофильные подходы превосходят в сохранении флуоресцентных сигналов и целостности тканей и менее токсичны по сравнению с двумя другими подходами 3,4.
Гидрофильный метод очистки, ScaleS, занимает отличительное положение с сохранением структурной и молекулярной целостности, а также мощной очищающей способностью (спектр очистки-сохранения)5. В предыдущем исследовании мы разработали протокол быстрой и изометрической очистки, ScaleSF, для срезов тканей (толщина ~ 1 мм), изменив процедуру очистки ScaleS6. Этот протокол очистки требует последовательных инкубаций срезов мозга в трех растворах в течение 10,5-14,5 ч. Метод отличается высоким спектром очистки-сохранения, который совместим даже с электронным микроскопическим (ЭМ) анализом (дополнительный рисунок 1), что позволяет создавать многомасштабную трехмерную (3D) визуализацию высокого разрешения с точной реконструкцией сигнала6. Таким образом, ScaleSF должен быть эффективен, особенно в головном мозге, где нейронные клетки развивают буйные процессы огромной длины и организуют специализированные тонкие субклеточные структуры для передачи и приема информации. Извлечение структурной информации с помощью шкал от контурного до субклеточного уровней на нейронных клетках весьма полезно для лучшего понимания функций мозга.
Здесь мы предоставляем подробный протокол для визуализации нейронных структур с масштабами от мезоскопического / схемы до микроскопического / субклеточного уровня с использованием ScaleSF. Протокол включает в себя подготовку тканей, осветление тканей, обработку очищенных тканей и конфокальную лазерную сканирующую микроскопию (CLSM) визуализацию очищенных тканей. Наш протокол фокусируется на опросе нейронных структур от схемы до субклеточных компонентных масштабов. Подробную процедуру приготовления растворов и стереотаксической инъекции векторов аденоассоциированного вируса (AAV) в мозг мыши см. в Miyawaki et al. 20167 и Okamoto et al. 20218, соответственно.
протокол
Все эксперименты были одобрены институциональными комитетами по уходу за животными и их использованию Университета Дзюнтендо (одобрение No 2021245, 2021246) и выполнены в соответствии с Фундаментальными руководящими принципами надлежащего проведения экспериментов на животных Научным советом Японии (2006). Здесь использовали самцов мышей C57BL/6J, которым вводили вектор AAV, несущий ген усиленного зеленого флуоресцентного белка (EGFP) и трансгенных мышей парвалбумина (PV)/миристоилирования-EGFP-рецептора липопротеинов низкой плотности C-концевой бактериальной искусственной хромосомы (BAC) трансгенных мышей (мыши PV-FGL)9 . Мыши PV-FGL поддерживались на фоне C57BL/6J. В отношении этого исследования не было обнаружено различий по признаку пола.
1. Тканевая подготовка
- Перфузионная фиксация
ПРИМЕЧАНИЕ: Выполните шаги 1.1.1-1.1.3 в вытяжном шкафу, чтобы ограничить воздействие параформальдегида (PFA).- Обезболить взрослых самцов мышей (8–16 недель) внутрибрюшинной инъекцией передозировки пентобарбитала натрия (200 мг/кг). Подтверждают адекватность анестезии отсутствием снятия пальцев ног и рефлексов моргания глаз.
- Откройте грудную полость и срежьте хирургическими ножницами правый предсердный придаток. Перфьминируйте мышей 20 мл ледяного фосфатного буферного раствора (PBS) с помощью иглы 23 Г, прикрепленной к шприцу объемом 20 мл, с последующей перфузией 20 мл ледяного холодного 4% PFA в 0,1 М фосфатном буфере (ПБ) с использованием другого шприца объемом 20 мл.
ВНИМАНИЕ: ПФА токсичен и тератогенен. Избегайте вдыхания или контакта с кожей, глазами и слизистой оболочкой. - Удалите ткани мозга из черепа пинцетом. Переложите ткани мозга в трубку объемом 15 мл, содержащую 4% PFA в 0,1 М ПБ, защитите образцы от света и осторожно качайте в течение ночи при 4 °C на шейкере при 50–100 об/мин.
- ПРИМЕЧАНИЕ: Собранные ткани мозга могут храниться в течение нескольких недель в 0,02% азида натрия (NaN3) в PBS при 4 °C.
ВНИМАНИЕ: NaN3 токсичен. Избегайте вдыхания или контакта с кожей, глазами и слизистой оболочкой. Поместите его внутрь вытяжного капюшона.
- Подготовка мозгового среза
- Приготовьте 4% агар в PBS, добавив 2 г агара к 50 мл PBS. Разогрейте смесь в микроволновой печи до полного растворения агара. Дайте раствору остыть до 40-45 °C.
ПРИМЕЧАНИЕ: Вязкое свойство, обеспечиваемое агаропектином, основным компонентом агара, улучшает легкость разрезания срезов ткани. - Добавьте 10 мл раствора агара в 6-луночную культуральную пластину. Погрузите мозговую ткань в раствор агара с помощью щипцов. Дайте агару затвердеть на льду.
- Извлеките внедренную мозговую ткань из колодца и обрежьте агар лезвием бритвы. Закрепите блок агара на дне вибратомной ванны с помощью суперклея и налейте 0,1 М ПБ в буферный лоток.
- Очистите другое лезвие бритвы, используя безворсовую папиросную бумагу, пропитанную этанолом, и прикрепите лезвие к держателю лезвия вибрирующего слайсера тканей.
- Установите скорость сечения 0,14 мм/с с амплитудой 1,4 мм и частотой 75–77 Гц. Разрежьте ткань мозга на кусочки толщиной 1 мм и соберите срезы в 6-луночную пластину клеточной культуры, содержащую PBS.
ПРИМЕЧАНИЕ: Срезы мозга могут храниться в течение нескольких недель в 0,02% NaN3 в PBS при 4 °C.
- Приготовьте 4% агар в PBS, добавив 2 г агара к 50 мл PBS. Разогрейте смесь в микроволновой печи до полного растворения агара. Дайте раствору остыть до 40-45 °C.
2. Осветление тканей
ПРИМЕЧАНИЕ: Композиции используемых растворов ScaleS перечислены в таблице 1. Образцы должны быть защищены от света, покрываясь фольгой. Этапы очистки показаны на рисунке 1A.
- Добавьте 8 мл раствора ScaleS0 в одну лунку 6-луночной клеточной культуральной пластины и добавьте 8 мл раствора ScaleS4 в другую лунку пластины и предварительно нагрейте до 37 °C в инкубаторе.
- Переложите срезы мозга в предварительно подогретый раствор ScaleS0 шпателем и высиживайте в течение 2 ч при 37 °C в встряхивающемся инкубаторе при 90 об/мин.
- Переложите пермеабилизированные срезы мозга в 8 мл PBS(–) в 6-луночную пластину для культивирования клеток шпателем и промывайте в течение 15 мин, держа в орбитальном шейкере при 40–60 об/мин. Повторите это дважды.
- Переложите кусочки мозга в предварительно разогретый 8 мл раствора ScaleS4 шпателем и очистите их путем инкубации в встряхивающем инкубаторе при 90 об/мин в течение 8–12 ч при 37 °C. Очищенные срезы мозга можно увидеть на рисунке 1.
3. Монтаж мозгового среза
ПРИМЕЧАНИЕ: Настраиваемая камера визуализации используется для надежного монтажа очищенных срезов мозга (рисунок 2)6. Камера состоит из рамы камеры и нижней крышки. Адаптеры ступени микроскопа также предназначены для установки камеры визуализации непосредственно на ступенях микроскопа (рисунок 2A, B). Каркас камеры и адаптеры ступени микроскопа могут быть напечатаны на 3D-принтере с использованием собственных или аутсорсинговых услуг 3D-печати. Данные 3D-автоматизированного проектирования (CAD) камеры визуализации представлены в Furuta et al. 20226.
- Для подготовки камеры прикрепите раму камеры к крышке с помощью чувствительного к давлению клея.
- Готовят 1,5% агарозу в растворе ScaleS4D25(0) (гель ScaleS4), добавляя 1,5 г агарозы в 100 мл раствора во флаконе. Хорошо перемешайте раствор, перемешав и разогрейте раствор в микроволновой печи до полного растворения агарозы. После этого дайте раствору остыть до 37 °C.
- Установите очищенный мозговой срез на нижнюю крышку камеры визуализации шпателем. Протрите лишний раствор с очищенного среза с помощью чистой папиросной бумаги без ворса.
- Добавьте гель ScaleS4 на срез мозга с помощью микропипетки, чтобы заполнить камеру визуализации. Поместите сверху еще одну крышку с щипцами и поместите кусок безворсовой папиросной бумаги и стеклянный слайд на крышку в указанном порядке.
- Перенесите камеру визуализации в холодильник при температуре 4 °C. Поместите металлические гири на стеклянную горку и оставьте их на 30 минут.
- Извлеките металлические гири, стеклянную горку, безворсовую папиросную бумагу и крышку из камеры визуализации и вытрите лишний гель (рисунок 2A, B).
- Поместите камеру визуализации в стеклянную чашку Петри диаметром 60 мм и прикрепите ободок камеры визуализации к чашке с помощью клея, похожего на давление. Прикрепите камеру в нескольких точках к чашке Петри.
- Вылейте раствор ScaleS4 в посуду и аккуратно встряхивайте в течение 1 ч при 20-25 °C на орбитальном шейкере при 40-60 об/мин. Замените свежим раствором и удалите пузырьки воздуха на поверхности геля, аккуратно соскребая поверхность с помощью наконечника пипетки объемом 200 мкл. Установите погруженную камеру визуализации на ступень микроскопа (рисунок 2C).
4. Визуализация CLSM
- Получайте изображения с помощью CLSM, оснащенного объективом с несколькими погружениями на большое рабочее расстояние (WD) (числовая диафрагма 16x/0,60 [NA], WD = 2,5 мм).
ПРИМЕЧАНИЕ: Объективы с высоким NA могут обеспечить высокое дифракционное разрешение. - Включите все необходимое оборудование для обработки изображений (рабочую станцию, микроскоп, сканер, лазеры и ртутную лампу) и запустите программное обеспечение для визуализации CLSM.
- Установите корректирующий воротник объектива с несколькими погружениями на 1,47. Раствор ScaleS4 имеет показатель преломления (RI) около 1,47 5,7. Аберрации, вызванные несоответствием RI, могут нарушить формирование изображения (рисунок 3).
- Погрузите объектив в раствор и позвольте ему медленно приблизиться к срезу. Удалите все пузырьки воздуха, захваченные на кончике объектива. Найдите интересующие области (ROI) в очищенных тканях с помощью эпифлуоресценции.
- Задайте параметры получения изображения, проверив соответствующие настройки.
- Определите битовую глубину для получения изображения. Размер данных изображения увеличивается с битовой глубиной.
- Задайте длину волны обнаружения. Отрегулируйте соответствующий затвор для детектора в соответствии со спектром излучения. Убедитесь, что длина волны обнаружения не покрывает лазерные линии.
- Установите разрешение xy . Большие форматы обеспечивают лучшее разрешение xy , но для сбора изображений требуется больше времени.
- Установите скорость сканирования. Более медленная скорость сканирования обеспечивает высокое отношение сигнал/шум. Тем не менее, это также увеличивает время выдержки пикселя и риск фотоотбеливания. Выбирайте соответственно.
- Отрегулируйте размер точечного отверстия. Размер точечного отверстия контролирует толщину оптического сечения. Меньший размер точечного отверстия создает более тонкое оптическое сечение и, следовательно, лучшее разрешение z , но уменьшает флуоресцентный сигнал. Увеличение размера точечного отверстия обеспечивает более толстый оптический участок с более сильным флуоресцентным сигналом.
- Установите мощность лазера, усиление детектора/усилителя и смещение. Постепенно увеличивайте мощность лазера и коэффициент усиления детектора/усилителя до получения подходящего изображения. Высокая мощность лазера несет в себе риск фотоотбеливания. Отрегулируйте смещение (контрастность) соответствующим образом, чтобы получить высокое отношение сигнал/шум.
- Определите необходимую площадь обработки почвы на основе размера ROI. Убедитесь, что вся длина и ширина ROI зафиксированы.
- Перемещайтесь по очищенным тканям во всех плоскостях и устанавливайте начальную и конечную точки стека. Установите размер z-шага в соответствии с требуемым z-разрешением.
- Собирайте изображения, когда вы удовлетворены настройками получения изображений, и записывайте захваченные изображения. Обрабатывайте изображения с помощью программного обеспечения для анализа изображений.
Результаты
Оптическая очистка среза мозга мыши толщиной 1 мм была достигнута с использованием этого протокола. Рисунок 1B представляет собой изображения передачи среза мозга мыши до и после очистки. Метод очистки тканей сделал срез мозга мыши толщиной 1 мм прозрачным. Незначительное расширение конечных размеров срезов мозга было обнаружено после инкубации в очищающем растворе в течение 12 ч (линейное расширение: 102,5% ± 1,3%). Сохранение флуоресценции и структурной целостности тканей оценивали с помощью целевой экспрессии EGFP в плазматической мембране у мышей PV-FGL (рисунок 1C). У этих мышей соматодендритный мембранно-целевой EGFP экспрессируется в PV-положительных нейронах9. Экспрессия EGFP, нацеленная на плазматическую мембрану в соматодендритической области, поддерживалась после лечения (рисунок 1С). Кроме того, предыдущее эм-исследование показывает хорошо сохранившуюся структурную целостность в тканях мозга, очищенных с помощью ScaleSF (дополнительный рисунок 1)6.
Аберрации, вызванные несоответствием RI, вызвали заметную потерю яркости и разрешения изображения (рисунок 3). Срез мозга PV-FGL толщиной 1 мм был очищен и визуализирован под CLSM, оснащенным объективом с несколькими погружениями длинного WD. Регулировка коррекционного воротника объектива в положение воды (RI 1.33) затрудняла четкую визуализацию EGFP-положительных нейронов, расположенных на глубинах 400 мкм и 800 мкм из-за низкой яркости и низкой контрастности. (Рисунок 3А,С). Эти нейроны были четко визуализированы с помощью того же CLSM, когда коррекционный ошейник был скорректирован в соответствии с раствором ScaleS4 (RI 1.47; Рисунок 3B,D). RI-соответствие между погружной жидкостью и объективом имеет решающее значение для точной 3D-визуализации в оптически очищенных тканях.
Наконец, мышиные неокортикальные нейроны были использованы для демонстрации осуществимости протокола. Мозг мыши, которому вводили AAV2/1-SynTetOff-EGFP вектор10 в первичную соматосенсорную кору (S1), фиксировали с 4% PFA в 0,1 М ПБ. Корональные срезы толщиной 1 мм готовили из мозга с помощью вибрирующего слайсера тканей. После очистки и монтажа на камере визуализации была проведена нейронная визуализация, нацеленная на неокортикальные нейроны (рисунок 4). 3D-реконструкция EGFP-меченых нейронов в срезе мозга толщиной 1 мм представлена на рисунке 4A. На изображении с более высоким увеличением показаны отдельные дендритные беседки, украшенные дендритными шипами (рисунок 4B). Далее мы показали терминальную арборизацию аксонов и аксональные бутоны в контралатеральной коре (рисунок 4C).
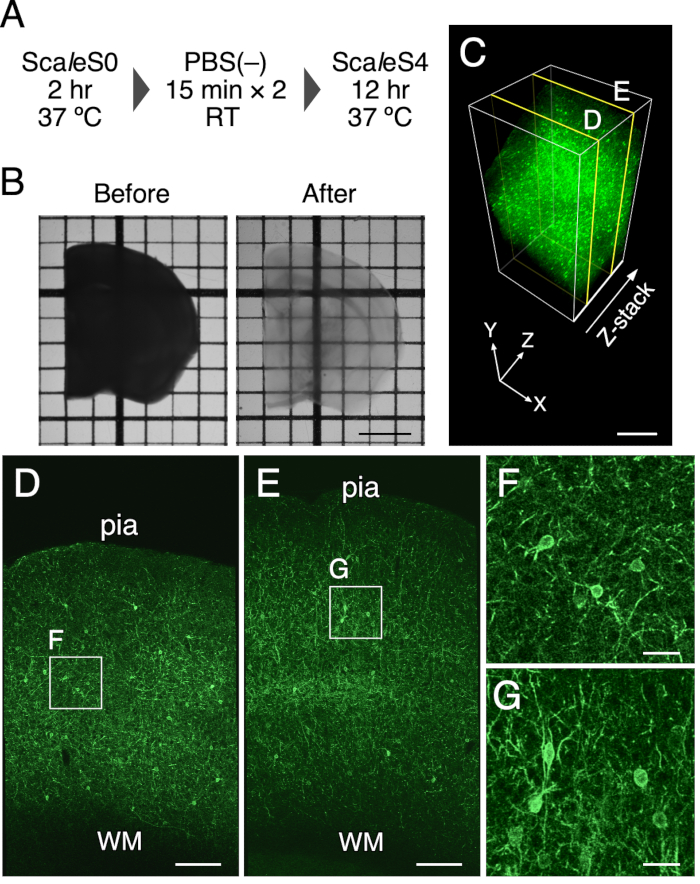
Рисунок 1: Оптическая очистка срезов мозга мыши толщиной 1 мм. (A) График очистки тканей ScaleSF. (B) Передача изображений срезов мозга толщиной 1 мм до (слева) и после (справа) лечения. (C) 3D-объемный рендеринг коры головного мозга мыши PV-FGL, очищенной с использованием метода очистки тканей. (Д,Д) изображения xy в (C) на глубинах 250 мкм (D) и 750 мкм (E). (Ф,Г) Увеличенное представление прямоугольников, указанных в пунктах (D) и (E). Изображения, появляющиеся в (C-G), деконволютируются перед процессом рендеринга. Сокращения: pia = pia mater, WM = белое вещество. Шкала: 2 мм в (B), 500 мкм в (C), 200 мкм в (D,E) и 40 мкм в (F,G). Эта цифра была изменена с Furata et al. 20226. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
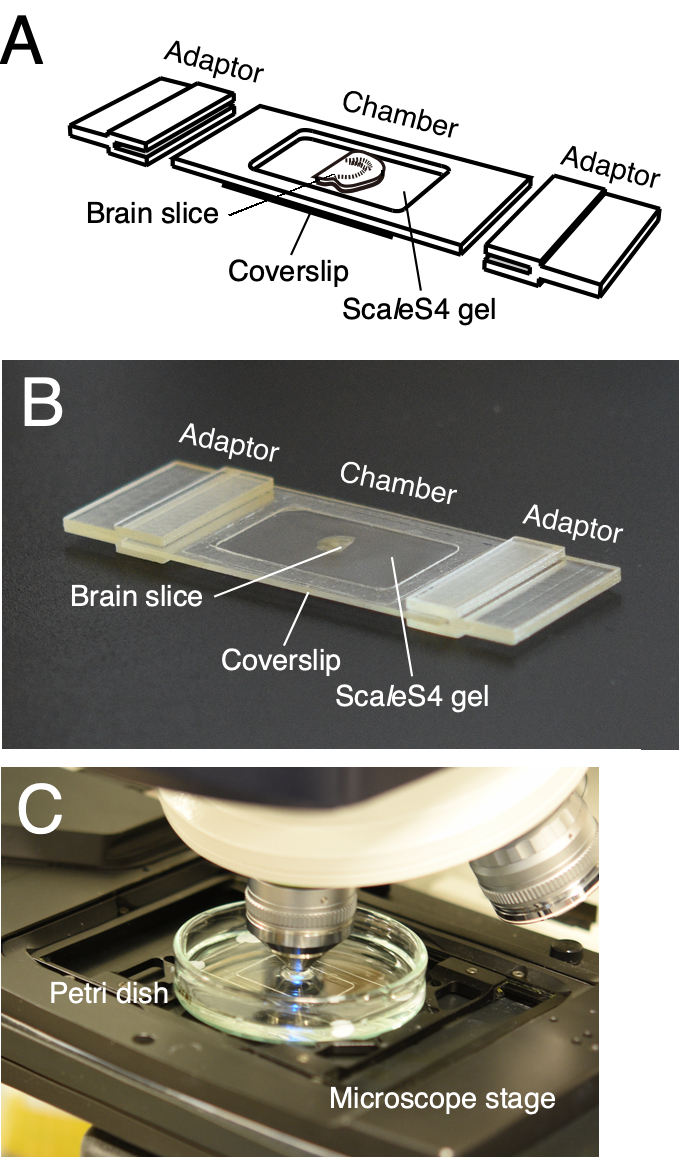
Рисунок 2: Настраиваемая 3D-печатная камера визуализации для визуализации среза ткани. (A,B) Схема (A) и изображение (B) настраиваемой 3D-печатной камеры визуализации. Камера визуализации состоит из каркаса камеры, нижнего покрова и адаптеров ступени микроскопа. Очищенные срезы ткани помещаются на нижнюю крышку и встраиваются в гель ScaleS4. Каркас камеры, нижняя крышка и адаптеры ступени микроскопа настраиваются в соответствии с размером и толщиной срезов ткани. (C) Установка визуализации с камерой визуализации. Камера визуализации погружена в раствор ScaleS4 в чашке Петри и установлена на ступени вертикального CLSM. Эта цифра была изменена с Furata et al. 20226. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Скомпрометированная глубокая визуализация, вызванная несоответствием RI между объективом ираствором Sc aleS4. (A-D) xy изображения коры головного мозга мыши PV-FGL на глубине 400 мкм (A,B) и 800 мкм (C,D). Коррекция воротника объектива с несколькими погружениями регулируется до 1,33 дюйма (A,C) и 1,47 дюйма (B,D). Изображения получаются с теми же параметрами, за исключением RI объектива. Шкала: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Нейронная визуализация в срезе мозга мыши толщиной 1 мм, очищенном с помощью ScaleSF. (A) 3D-объемный рендеринг меченых EGFP неокортикальных нейронов мыши в S1. Неокортикальные нейроны помечены вектором AAV2/1 SynTetOff-EGFP. (B) Дендритные беседки меченых EGFP неокортикальных нейронов. Представлено проекционное изображение максимальной интенсивности (MIP) с глубины от 39 мкм до 48 мкм. Наконечники стрел указывают на дендритные шипы. (C) Меченые EGFP аксонные терминали в контралатеральной коре. Представлено MIP-изображение с глубины от 481,5 мкм до 513 мкм. Наконечники стрел указывают на аксональные бутоны. Изображения, появляющиеся в пунктах (B) и (C), деконволютируются. Шкала: 300 мкм в (A) и 10 мкм в (C). Полоса в (C) также применима к (B). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Ультраструктура в срезах мозга, очищенных с помощью ScaleSF, CUBIC и PACT. (A-C) Передача ЭМ-изображений коры головного мозга мыши, очищенных с помощью ScaleSF (A), CUBIC (B) и PACT (C). Мозг мышей фиксируется с 4% PFA, содержащим 1% глутаральдегида. Ультратонкие срезы готовятся из очищенных срезов мозга. Мембранные структуры сильно повреждаются в срезах мозга, очищенных CUBIC (B) и PACT (C). Наконечники стрел указывают на постсинаптические мембраны. Шкала шкалы: 500 нм. Эта цифра была изменена с Furata et al. 20226. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
| Рецепты для решений ScaleS | |
| Решение ScaleS0 | |
| Реагент | Конечная концентрация |
| D-сорбит | 20% (с об/кв) |
| Глицерин | 5% (с об.) |
| Метил-β-циклодекстрин | 1 мМ |
| γ-циклодекстрин | 1 мМ |
| Диметилсульфоксид | 3% (об/об) |
| 10x PBS(–) | в 1 раз |
| Решение ScaleS4 | |
| Реагент | Конечная концентрация |
| Мочевина | 4 М |
| D-сорбит | 40% (об/д) |
| Глицерин | 10% (с об.) |
| Тритон Х-100 | 0,2% (мас./об.) |
| Диметилсульфоксид | 25% (об/об) |
| ScaleS4D25(0) solution | |
| Реагент | Конечная концентрация |
| Мочевина | 4 М |
| D-сорбит | 40% (об/д) |
| Глицерин | 10% (с об.) |
| Диметилсульфоксид | 25% (об/об) |
Таблица 1: Состав трех растворов ScaleS. Перечислены композиции растворов ScaleS0, ScaleS4 и ScaleS4D25(0). Подробную процедуру приготовления этих растворов см. в Miyawaki et al. 20167.
Обсуждение
Критические шаги в рамках протокола
В протоколе есть несколько критических шагов, которые следует выполнять с максимальной осторожностью для получения значимых результатов. Равномерная фиксация образцов необходима для 3D-визуализации в крупномасштабных тканях. Объектив, образец и иммерсионная жидкость должны иметь соответствующий RI. RI-несоответствие между ними приведет к сильно нарушенной визуализации EGFP-экспрессирующих клеток в очищенных срезах мозга (рисунок 3). Коррекционная регулировка объектива к иммерсионной жидкости сводит к минимуму сферические аберрации, вызванные глубиной, чтобы максимизировать сигнал, контрастность и пространственное разрешение в 3D-изображениях. RI подготовленных растворов можно измерить с помощью рефрактометра.
Поиск и устранение неисправностей техники
Более длительное хранение решений может повлиять на клиринговую способность и ее способность сохранять флуоресцентные сигналы и структурную целостность. Следует использовать свежеприготовленные растворы. Эти растворы могут храниться до 1 месяца при 4 °C. Изометричность имеет решающее значение для эффективной и действенной визуализации нейронов с точной реконструкцией сигнала. Хотя небольшое увеличение размеров выборки наблюдалось после инкубации в течение 12 ч (рис. 1В), расширение можно контролировать путем уменьшения инкубационного периода между 8-12 ч. Для более точного 3D-изображения глубины коррекционный воротник, возможно, потребуется отрегулировать в заданной плоскости из-за сферической аберрации, вызванной глубиной.
Модификации техники
В настоящем исследовании мы использовали ткани мозга мыши, чтобы продемонстрировать осуществимость протокола. Тем не менее, протокол, описанный здесь, также может быть использован для животных с большим мозгом, таких как приматы. Действительно, этот протокол был использован в тканях мозга обыкновенной игрунки (Callithrix jacchus) и преуспел в одновременной визуализации нейронной цепи и субклеточных структур ее кортикостриатальных цепей6. Адаптеры ступени микроскопа предназначены для установки камеры визуализации на ступенях микроскопа непосредственно6 (рисунок 2A,B). Очищенные срезы ткани можно наблюдать с помощью перевернутого микроскопа через нижний покров камеры визуализации. После восстановления очищенных тканей мозга с помощью PBS(-) (deScaling)5,11 мы можем подготовить участки тканей толщиной от 20-мкм до 50 мкм из тканей мозга, которые были очищены с помощью ScaleSF (повторное сечение)6. Субклеточные структуры, захваченные в очищенных тканях, могут быть снова визуализированы на повторных срезах с высокой объективом NA короткого WD. Очистка срезов мозга, перфузированных фиксаторами, содержащими глутаровый альдегид, была достигнута с использованием этого протокола, обеспечивая превосходную сохранность ультраструктуры6. ScaleSF достигает высокого уровня сохранения ультраструктуры, что позволяет проводить ЭМ-анализ в оптически очищенных тканях6 (дополнительный рисунок 1). ЭМ-совместимость этого метода особенно полезна для визуализации структур с масштабами от макроскопического до наноскопического уровня.
Ограничения техники
Описанный здесь протокол позволяет визуализировать нейронные структуры от схемы до субклеточных масштабов в срезах мозга толщиной 1 мм. Однако в протоколе сохраняются три ограничения. Во-первых, это клиринговая способность протокола клиринга. ScaleSF — это протокол очистки для срезов мозга, а не для всего мозга. Хотя срезы мозга толщиной 1 мм могут обеспечить хорошее знание дендритных и локальных аксональных беседок12, информация об аксональных проекциях, охватывающих весь мозг, фрагментарна и неполна в срезах 13,14,15,16. Во-вторых, это разрешение изображения. Используя протокол, описанный здесь, нам удалось визуализировать субклеточные нейронные структуры, такие как дендритные шипы и аксональные бутоны, в оптически очищенном срезе мозга (рисунок 4). Однако разрешение объектива, используемого в этом исследовании, разрешение xy 400-750 нм, недостаточно для разрешения более тонких структур нейрональных клеток. Учитывая, что объективы с высокой степенью NA обычно предназначены для погружения в масло (RI 1.52), ri-несоответствие с решениями (RI 1.47) может препятствовать получению изображений с высоким разрешением с помощью этих объективов. Третий — флуоресцентная белковая маркировка нейрональных клеток. Метод маркировки ограничивает широкое применение нашей техники визуализации. Гистохимические и/ или иммуногистохимические методы, которые маркируют крупномасштабные ткани при сохранении целостности тканей, значительно продвинули бы протокол, представленный здесь.
Значение в отношении существующих методов и будущего применения метода
В настоящем исследовании мы описываем подробный протокол визуализации нейронов от мезоскопических до микроскопических структур с использованием очистки тканей ScaleSF. Протокол, описанный здесь, позволяет визуализировать нейронные структуры от цепных до субклеточных уровней за разумное количество времени без специализированного оборудования, облегчая понимание нейронных структур от схемы до компонентных масштабов. Нейроны развивают буйные процессы огромной длины и организуют специализированные тонкие структуры для передачи и приема информации. Таким образом, нейронная визуализация требует метода очистки тканей, который обладает мощной очищающей способностью, а также высоким уровнем сохранения тканей для одновременной визуализации как крупных, так и мелкомасштабных структур. Тем не менее, методы очистки тканей, отличающиеся высокими очистительными способностями, агрессивно удаляют липиды и пигменты для обширного осветления тканей 3,4, ставя под угрозу целостностьтканей 5,6,17 (Дополнительный рисунок 1). Это резко контрастирует с используемым здесь протоколом очистки, который обеспечивает высокий уровень сохранения структуры6 (дополнительный рисунок 1). Таким образом, очистка тканей ScaleSF позволяет проводить эффективную и действенную визуализацию нейронов, которая требует многомасштабной 3D-визуализации с высоким разрешением с точной реконструкцией сигнала.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарят Йоко Исиду (Университет Дзюнтендо) за производство векторов AAV и Кисару Хосино (Университет Дзюнтендо) за техническую помощь. Это исследование было поддержано JSPS KAKENHI (JP20K07231 to K.Y.; JP21H03529 в Т.Ф.; JP20K07743 в М.К.; JP21H02592 в H.H.) и научные исследования по инновационной области «Резонанс био» (JP18H04743 to H.H.). Это исследование также было поддержано Японским агентством медицинских исследований и разработок (AMED) (JP21dm0207112 to T.F. и H.H.), Moonshot R&D от Японского агентства по науке и технике (JST) (JPMJMS2024 до H.H.), Fusion Oriented Research for disruptive Science and Technology (FOREST) от JST (JPMJFR204D to H.H.), Грантами в помощь от Научно-исследовательского института заболеваний пожилого возраста в Медицинской школе Университета Джунтендо (X2016 до K.Y.; X2001 - H.H.), и проект брендинга частных школ.
Материалы
| Name | Company | Catalog Number | Comments |
| 16x multi-immersion objective lens | Leica Microsystems | HC FLUOTAR 16x/0.60 IMM CORR VISIR | |
| Agar | Nacalai Tesque | 01028-85 | |
| Agarose | TaKaRa Bio | L03 | |
| Dimethyl sulfoxide | Nacalai Tesque | 13407-45 | |
| D-Sorbitol | Nacalai Tesque | 06286-55 | |
| γ-cyclodextrin | Wako Pure Chemical Industries | 037-10643 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Huygens Essential | Scientific Volume Imaging | ver. 18.10.0p8/21.10.1p0 64b | |
| Imaris | Bitplane | ver. 9.0.0 | |
| Leica Application Suite X | Leica Microsystems | LAS X, ver. 3.5.5.19976 | |
| Methyl-β-cyclodextrin | Tokyo Chemical Industry | M1356 | |
| Paraformaldehyde | Merck Millipore | 1.04005.1000 | |
| Phosphate Buffered Saline (10x; pH 7.4) | Nacalai Tesque | 27575-31 | 10x PBS(–) |
| Sodium azide | Nacalai Tesque | 31233-55 | |
| Sodium pentobarbital | Kyoritsu Seiyaku | N/A | |
| TCS SP8 | Leica Microsystems | N/A | |
| Triton X-100 | Nacalai Tesque | 35501-15 | |
| Urea | Nacalai Tesque | 35940-65 | |
| Vibrating tissue slicer | Dosaka EM | PRO7N |
Ссылки
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chemical Biology. 23 (1), 137-157 (2016).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annual Reviews of Cell and Developmental Biology. 32, 713-741 (2016).
- Ueda, H. R., et al. Whole-brain profiling of cells and circuits in mammals by tissue clearing and light-sheet microscopy. Neuron. 106 (3), 369-387 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews. Neuroscience. 21 (2), 61-79 (2020).
- Hama, H., et al. ScaleS: an optical clearing palette for biological imaging. Nature Neuroscience. 18 (10), 1518-1529 (2015).
- Furuta, T., et al. Multi-scale light microscopy/electron microscopy neuronal imaging from brain to synapse with a tissue clearing method, ScaleSF. iScience. 25 (1), 103601(2022).
- Miyawaki, A., et al. Deep imaging of cleared brain by confocal laser-scanning microscopy. Protocol Exchange. , (2016).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protocols. 2 (1), 100230(2021).
- Kameda, H., et al. Parvalbumin-producing cortical interneurons receive inhibitory inputs on proximal portions and cortical excitatory inputs on distal dendrites. The European Journal of Neuroscience. 35 (6), 838-854 (2012).
- Sohn, J., et al. A single vector platform for high-level gene transduction of central neurons: Adeno-associated virus vector equipped with the Tet-off system. PLoS One. 12 (1), 0169611(2017).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14 (11), 1481-1488 (2011).
- Stepanyants, A., Martinez, L. M., Ferecsko, A. S., Kisvarday, Z. F. The fractions of short- and long-range connections in the visual cortex. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3555-3560 (2009).
- Kuramoto, E., et al. Two types of thalamocortical projections from the motor thalamic nuclei of the rat: a single neuron-tracing study using viral vectors. Cerebral Cortex. 19 (9), New York, N.Y. 2065-2077 (2009).
- Matsuda, W., et al. Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nature Methods. 15 (12), 1033-1036 (2018).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6, 34331(2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены