Method Article
一种从介观尺度到微观尺度的神经元成像组织清除方法
摘要
该协议提供了使用组织清除方法ScaleSF在脑切片中进行神经元成像的详细方法。该方案包括脑组织制备,组织澄清,清除切片的处理以及从介观到微观水平的神经元结构的共聚焦激光扫描显微镜成像。
摘要
这里提供了一个详细的方案,以可视化脑组织中从介观到微观水平的神经元结构。从神经回路到亚细胞神经元结构的神经元结构在用ScaleSF光学清除的小鼠脑切片中可视化。这种清除方法是ScaleS的改进版本,是一种用于组织切片的亲水性组织清除方法,可实现强大的清除能力以及高水平的荧光信号保存和结构完整性。可定制的三维(3D)打印成像室设计用于可靠地安装已清除的脑组织。注射携带增强绿色荧光蛋白基因的腺相关病毒载体的小鼠大脑用4%多聚甲醛固定,并用振动组织切片机切成1-mm厚的切片。通过遵循清除方案清除脑切片,其中包括在三种溶液中的顺序孵育,即ScaleS0溶液,磷酸盐缓冲盐水(-)和ScaleS4溶液,共10.5-14.5小时。将清除的脑切片安装在成像室上,并嵌入溶解在ScaleS4D25(0)溶液中的1.5%琼脂糖凝胶中。切片的3D图像采集是使用共聚焦激光扫描显微镜进行的,该显微镜配备了长工作距离的多浸入物镜。从介观神经元成像开始,我们成功地在光学清除的脑切片中可视化精细的亚细胞神经元结构,如树突状棘和轴突。该协议将有助于理解从电路到亚细胞组分尺度的神经元结构。
引言
组织清除方法改进了光学显微镜对生物和临床样品的深度无关成像,允许提取完整组织的结构信息1,2。光学清除技术也可能潜在地加快速度,并降低组织学分析的成本。目前,有三种主要的清除方法可用:亲水,疏水和基于水凝胶的方法1,2。亲水方法在保持荧光信号和组织完整性方面超越了,并且与其他两种方法相比毒性更小3,4。
亲水性清除方法ScaleS以其保持结构和分子完整性以及强大的清除能力(清除 - 保存光谱)而具有独特的地位。在之前的一项研究中,我们通过修改ScaleS6的清除程序,为组织切片(〜1mm厚度)开发了一种快速等距清除方案ScaleSF。这种清除方案需要在三种溶液中连续孵育10.5-14.5小时的脑切片。该方法具有高清除保存光谱的特点,甚至与电子显微镜(EM)分析兼容(补充图1),允许多尺度高分辨率三维(3D)成像和准确的信号重建6。因此,ScaleSF应该有效,特别是在大脑中,神经元细胞精心设计了巨大的繁荣过程,并安排了用于传输和接收信息的专用精细亚细胞结构。从神经元细胞的回路到亚细胞水平提取具有尺度的结构信息对于更好地理解大脑功能非常有用。
在这里,我们提供了一个详细的方案,使用ScaleSF可视化神经元结构,其尺度从介观/电路到微观/亚细胞水平。该方案包括组织制备、组织澄清、清除组织的处理以及已清除组织的共聚焦激光扫描显微镜 (CLSM) 成像。我们的实验方案侧重于询问从电路到亚细胞组分量表的神经元结构。有关制备溶液和将腺相关病毒(AAV)载体注射到小鼠大脑中的详细程序,请分别参考Miyawaki等人20167 和Okamoto et al. 20218。
研究方案
所有实验均由顺天堂大学动物护理和使用委员会批准(批准号2021245,2021246),并根据日本科学理事会(2006年)的动物实验正确进行基本准则进行。这里,使用雄性C57BL / 6J小鼠注射携带增强绿色荧光蛋白(EGFP)基因的AAV载体和小白蛋白(PV)/肉豆蔻酰化-EGFP-低密度脂蛋白受体C端细菌人工染色体(BAC)转基因小鼠(PV-FGL小鼠)9 。PV-FGL小鼠维持在C57BL / 6J背景中。在这项研究中未发现基于性别的差异。
1. 组织制备
- 灌注固定
注意:在通风橱中执行步骤 1.1.1 至 1.1.3 以限制多聚甲醛 (PFA) 的暴露。- 通过腹腔注射过量的戊巴比妥钠(200mg / kg)麻醉成年雄性小鼠(8-16周龄)。通过无脚趾夹断和眨眼反射来确认麻醉的充分性。
- 打开胸腔,用手术剪刀切开右心耳。使用连接到20mL注射器的23G针头向小鼠灌注20mL冰冷磷酸盐缓冲盐水(PBS),然后使用另一个20mL注射器在0.1M磷酸盐缓冲液(PB)中灌注20mL冰冷的4%PFA。
注意:PFA是有毒和致畸的。避免吸入或接触皮肤、眼睛和粘膜。 - 用镊子从颅骨上取下脑组织。将脑组织转移到含有4%PFA的15 mL管中,0.1 M PB,保护样品免受光照,并在4°C下以50-100rpm的振荡器轻轻摇动过夜。
- 注意:收获的脑组织可以在4°C下在PBS中的0.02%叠氮化钠(NaN3)中储存数周。
注意:NaN3 是有毒的。避免吸入或接触皮肤、眼睛和粘膜。将其放在通风橱内。
- 脑切片制备
- 通过在50 mL PBS中加入2克琼脂,在PBS中制备4%琼脂。微波加热混合物,直到琼脂完全溶解。让溶液冷却至40-45°C。
注意:琼脂的主要成分菀果胶提供的粘性特性改善了组织切片的切割。 - 将10mL琼脂溶液加入6孔培养板中。使用镊子将脑组织浸没在琼脂溶液中。让琼脂在冰上凝固。
- 从井中取出嵌入的脑组织,并用剃须刀片修剪琼脂。用超级胶水将琼脂块固定在振动浴槽的底部,并将0.1 M PB倒入缓冲液托盘中。
- 使用浸泡在乙醇中的无绒薄纸清洁另一个剃须刀片,并将刀片连接到振动纸巾切片机的刀片架上。
- 将切片速度设置为0.14 mm / s,振幅为1.4 mm,频率设置为75-77 Hz。将脑组织切成1 mm厚的切片,并将切片收集在含有PBS的6孔细胞培养板中。
注意:脑切片可以在4°C下在PBS的0.02%NaN3 中储存数周。
- 通过在50 mL PBS中加入2克琼脂,在PBS中制备4%琼脂。微波加热混合物,直到琼脂完全溶解。让溶液冷却至40-45°C。
2. 组织澄清
注:所使用的ScaleS溶液的成分列于 表1中。应通过用箔覆盖来保护样品免受光照。清除步骤如图 1A所示。
- 将8mL ScaleS0溶液加入6孔细胞培养板的一个孔中,并将8mL ScaleS4溶液加入板的另一孔中,并在培养箱中预热至37°C。
- 用刮刀将脑切片转移到预热的ScaleS0溶液中,并在37°C下以90rpm在振荡培养箱中孵育2小时。
- 将透化的脑切片在8 mL PBS(–)中用刮刀在6孔细胞培养板中转移,并通过保持在40-60rpm的轨道振荡器中洗涤15分钟。重复两次。
- 用刮刀将脑切片转移到预热的8mL ScaleS4溶液中,并通过在37°C下以90rpm振荡培养箱中孵育8-12小时来清除它们。 清除的大脑切片如图 1所示。
3. 脑切片安装
注意:可定制的成像室用于可靠地安装清除的脑切片(图2)6。腔室由腔室框架和底部盖玻片组成。显微镜载物台适配器还设计用于将成像室直接安装在显微镜载物台上(图2A,B)。腔室框架和显微镜载物台适配器可以使用内部或外包的3D打印服务进行3D打印。成像室的3D计算机辅助设计(CAD)数据在Furuta等人中提供 20226.
- 对于腔室制备,使用压敏粘合剂将腔室框架连接到盖玻片上。
- 通过在瓶中加入1.5g琼脂糖到100mL溶液中,在Sca l eS4D25(0)溶液(ScaleS4凝胶)中制备1.5%琼脂糖。通过搅拌和微波加热溶液充分混合溶液,直到琼脂糖完全溶解。完成后,让溶液冷却至37°C。
- 用刮刀将清除的脑切片安装到成像室的底部盖玻片上。使用干净的无绒薄纸擦去已清除切片中多余的溶液。
- 使用微量移液管在脑切片上添加ScaleS4凝胶以填充成像室。用镊子将另一个盖玻片放在上面,并按此顺序在盖玻片上放置一块不起毛的薄纸和一张载玻片。
- 将成像室转移到4°C的冰箱中。 将金属砝码放在载玻片上,静置 30 分钟。
- 从成像室中取出金属砝码,载玻片,无绒薄纸和盖玻片,并擦去多余的凝胶(图2A,B)。
- 将成像室置于60mm玻璃培养皿中,并用腻子状压敏粘合剂将成像室的边缘连接到培养皿上。将腔室在多个点上连接到培养皿上。
- 将ScaleS4溶液倒入培养皿中,并在轨道振荡器上以40-60rpm在20-25°C下轻轻摇动1小时。用新鲜溶液代替,并使用200μL移液器吸头轻轻刮除凝胶表面上的气泡。将浸入式成像室安装在显微镜载物台上(图2C)。
4. 液晶屏成像
- 使用配备长工作距离(WD)(16x/0.60数值孔径[NA],WD = 2.5 mm)的多浸入式物镜的CLSM采集图像。
注:高数值孔径物镜可提供高衍射极限分辨率。 - 打开所有相关成像设备(工作站、显微镜、扫描仪、激光器和汞灯)并启动CLSM成像软件。
- 将多浸入式物镜的校正环设置为1.47。ScaleS4溶液的折射率(RI)约为1.475,7。RI失配引起的像差会干扰图像的形成(图3)。
- 将物镜浸入溶液中,让它慢慢接近切片。清除物镜尖端的所有气泡。使用落射荧光在清除的组织中查找感兴趣的区域 (ROI)。
- 通过测试适当的设置来设置图像采集参数。
- 确定图像采集的位深度。图像的数据大小随着位深度的增加而增加。
- 设置检测波长。根据发射光谱调整探测器的适当栅极。确保检测波长不覆盖任何激光线。
- 设置 xy 分辨率。格式越大, 可提供更好的 xy 分辨率,但收集图像需要更长的时间。
- 设置扫描速度。较慢的扫描速度可提供较高的信噪比。但是,它也增加了像素停留时间和光漂白的风险。相应地选择。
- 调整针孔大小。针孔尺寸控制光学截面厚度。较小的针孔尺寸会产生更薄的光学部分,从而获得更好的 z 分辨率,但会降低荧光信号。使针孔尺寸更大可提供更厚的光学部分和更强的荧光信号。
- 设置激光功率、检测器/放大器增益和偏移。逐渐增加激光功率和检测器/放大器增益,直到获得合适的图像。高激光功率会带来光漂白的风险。适当调整偏移(对比度)以获得高信噪比。
- 根据投资回报率的大小确定所需的耕作面积。确保捕获 ROI 的整个长度和宽度。
- 导航所有平面中已清除的组织,并设置堆栈的起点和终点。根据所需的 z 分辨率设置 z 步长。
- 在对图像采集设置感到满意时收集图像,并记录捕获的图像。使用图像分析软件处理图像。
结果
使用该协议实现1mm厚度的小鼠脑切片的光学清除。 图1B 表示清除治疗前后的小鼠脑切片的传输图像。组织清除方法使1毫米厚的小鼠脑切片透明。在清除溶液中孵育12小时后,发现脑切片的最终尺寸略有扩大(线性扩张:102.5%±1.3%)。在PV-FGL小鼠的质膜中,使用靶向EGFP表达评估组织的荧光和结构完整性的保存(图1C)。在这些小鼠中,体细胞突起膜靶向EGFP在PV阳性神经元中表达9。处理后,靶向体型树突区质膜的EGFP表达得以维持(图1C)。此外,先前的EM研究显示,用ScaleSF清除的脑组织中保留了良好的结构完整性(补充图1)6。
RI失配引起的像差导致图像亮度和分辨率明显下降(图3)。在配备长WD的多浸入物镜的CLSM下清除并成像1毫米厚的PV-FGL小鼠脑切片.由于亮度低和对比度低,将物镜的校正环调整到水位(RI 1.33)阻碍了位于400μm和800μm深度的EGFP阳性神经元的清晰可视化。(图3A,C)。当调整校正环以匹配ScaleS4溶液(RI 1.47; 图3B,D)。浸入液和物镜之间的RI匹配对于光学清除组织中的精确3D成像至关重要。
最后,利用小鼠新皮质神经元来证明该方案的可行性。在原发性躯体感觉皮层(S1)中注射AAV2 / 1-SynTetOff-EGFP载体10 的小鼠大脑在0.1 M PB中用4%PFA固定。用振动组织切片机从大脑中制备1mm厚度的冠状切片。在清除并安装在成像室上后,进行针对新皮质神经元的神经元成像(图4)。 图4A显示了1毫米厚的脑切片中EGFP标记神经元的3D重建。更高放大倍率的图像显示了装饰有树枝状棘的单个树枝状乔木(图4B)。我们进一步显示了对侧皮层中的轴突末端树化和轴突(图4C)。
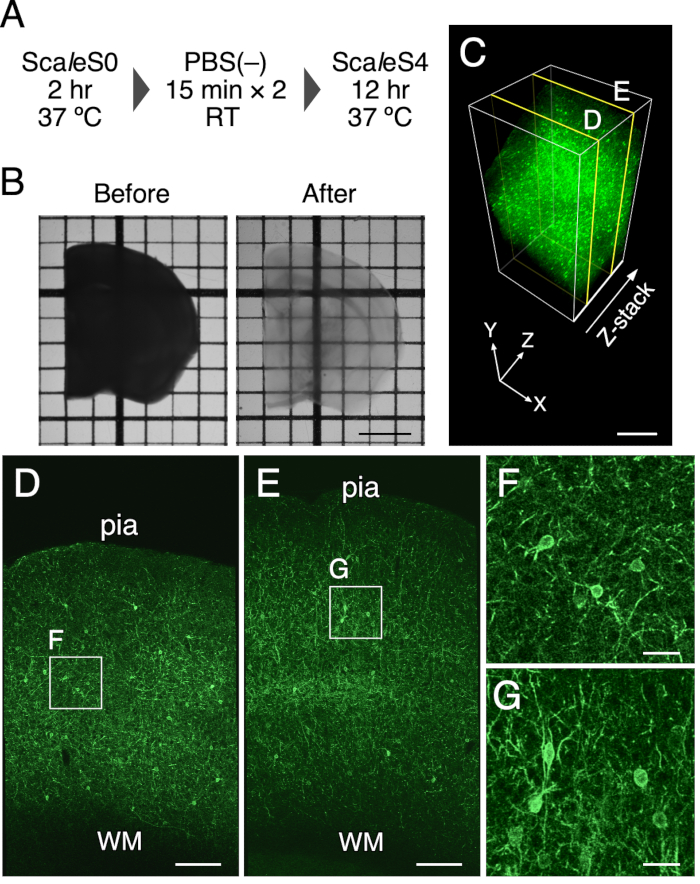
图1:1毫米厚的小鼠脑切片的光学清除。 (A)ScaleSF组织清除的时间表。(B)在(左)和(右)治疗前(右)传输1毫米厚的脑切片的图像。(C)使用组织清除方法清除PV-FGL小鼠大脑皮层的3D体积渲染。(D,E)(C) 中 250 μm (D) 和 750 μm (E) 深度的 xy 图像。(F,G)(D) 和 (E) 中概述的矩形的放大视图。出现在 (C-G) 中的图像在渲染过程之前进行反卷积。缩写:pia = pia mater,WM = 白质。比例尺:2 毫米英寸(B)、500 微米英寸(C)、200 微米英寸(D,E)和 40 微米英寸(F,G)。此数字已从Furata等人修改而来 20226. 请点击此处查看此图的大图。
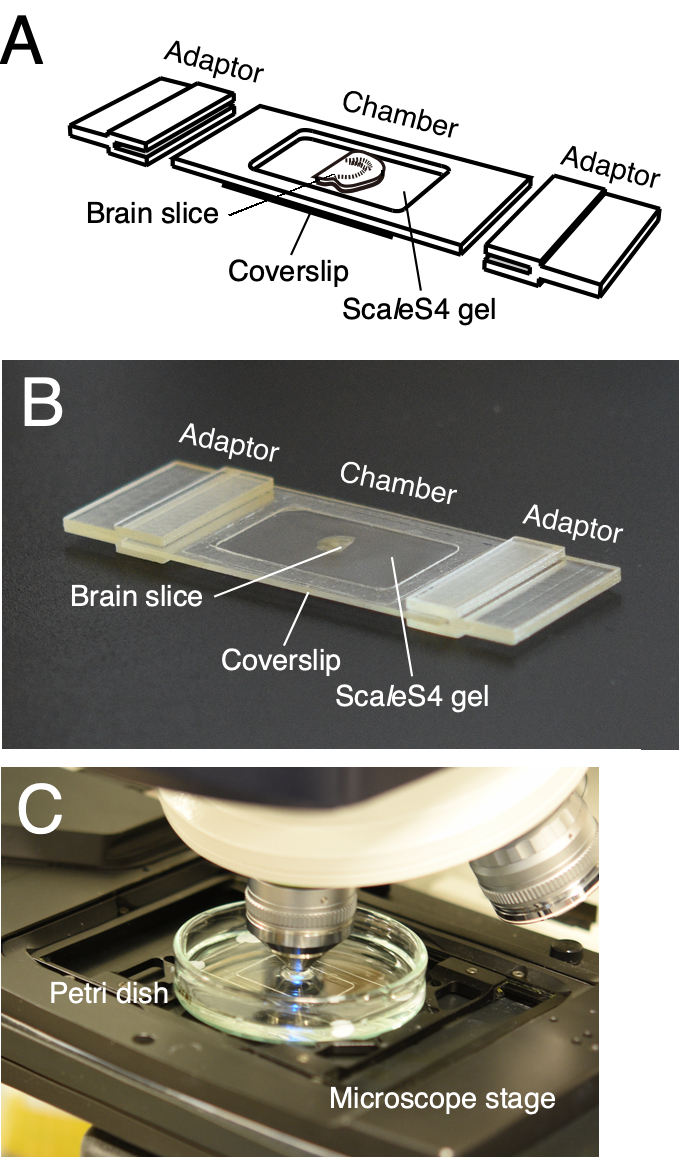
图 2:用于组织切片可视化的可自定义 3D 打印成像室。 (A,B) 可自定义 3D 打印成像室的模式图 (A) 和图片 (B)。成像室由腔室框架,底盖玻片和显微镜载物台适配器组成。将清除的组织切片放置在底部盖玻片上并嵌入ScaleS4凝胶中。腔室框架,底盖玻片和显微镜载物台适配器可根据组织切片的大小和厚度进行定制。(C)成像室的成像设置。成像室浸入培养皿中的ScaleS4溶液中,并安装在直立CLSM的载物台上。此数字已从Furata等人修改而来 20226. 请点击此处查看此图的大图。

图3:由物镜和ScaleS4溶液之间的RI不匹配引起的深度成像受损。(A-D)PV-FGL小鼠大脑皮层的xy图像在400μm(A,B)和800μm(C,D)的深度。多浸入式物镜的环的校正调整为1.33英寸(A,C)和1.47英寸(B,D)。除物镜的RI外,使用相同的参数采集图像。比例尺:50 μm。请点击此处查看此图的大图。

图4:用ScaleSF清除的1毫米厚小鼠脑切片中的神经元成像。 (A)S1中EGFP标记的小鼠新皮质神经元的3D体积渲染。新皮质神经元用AAV2 / 1 SynTetOff-EGFP载体标记。(B)EGFP标记的新皮质神经元的树突状树突。表示从39μm到48μm深度的最大强度投影(MIP)图像。箭头表示树突状棘。(C)对侧皮层中EGFP标记的轴突末端。表示深度为481.5 μm至513 μm的MIP图像。箭头表示轴突。出现在 (B) 和 (C) 中的图像将进行反卷积。比例尺:300 μm in (A) 和 10 μm in (C)。(C) 中的柱线也适用于 (B)。 请点击此处查看此图的大图。
补充图1:用ScaleSF,CUBIC和PACT清除的大脑切片中的超微结构。(A-C)用ScaleSF(A),CUBIC(B)和PACT(C)清除的小鼠大脑皮层的传输EM图像。小鼠大脑用含有1%戊二醛的4%PFA固定。超薄切片是从清除的大脑切片中制备的。膜结构在用CUBIC(B)和PACT(C)清除的脑切片中严重受损。箭头表示突触后膜。比例尺:500 nm。此数字已从Furata等人修改而来 20226.请点击此处下载此文件。
| ScaleS 解决方案的注意事项 | |
| ScaleS0 解决方案 | |
| 试剂 | 最终浓度 |
| D-山梨糖醇 | 20% (无/ v) |
| 甘油 | 5% (无/ v) |
| 甲基-β-环糊精 | 1 毫米 |
| γ-环糊精 | 1 毫米 |
| 二甲基亚砜 | 3% (v/v) |
| 10x PBS(–) | 1 倍 |
| ScaleS4 解决方案 | |
| 试剂 | 最终浓度 |
| 尿素 | 4 米 |
| D-山梨糖醇 | 40% (无/ v) |
| 甘油 | 10% (无重) |
| 曲拉通X-100 | 0.2% (无/v) |
| 二甲基亚砜 | 25% (v/v) |
| ScaleS4D25(0) 解决方案 | |
| 试剂 | 最终浓度 |
| 尿素 | 4 米 |
| D-山梨糖醇 | 40% (无/ v) |
| 甘油 | 10% (无重) |
| 二甲基亚砜 | 25% (v/v) |
表1:三种ScaleS溶液的组成。 列出了ScaleS0,ScaleS4和ScaleS4D25(0)溶液的组成。有关制备这些溶液的详细程序,请参阅Miyawaki et al. 20167。
讨论
协议中的关键步骤
协议中有一些关键步骤应该非常谨慎地进行,以获得有意义的结果。样品的均匀固定对于大规模组织内的3D成像至关重要。物镜、样品和浸入液应具有匹配的 RI。它们之间的RI不匹配将导致清除的脑切片内表达EGFP的细胞的高度干扰成像(图3)。物镜对浸入液的校正环调整可最大限度地减少深度引起的球面像差,从而最大限度地提高3D成像中的信号、对比度和空间分辨率。可以使用折光率仪测量所制备溶液的RI。
技术故障排除
溶液的更长时间存储会影响清除能力,以及其保存荧光信号和结构完整性的能力。应使用新鲜制备的溶液。这些溶液可以在4°C下储存长达1个月。 等距性对于有效和高效的神经元成像以及准确的信号重建至关重要。尽管在孵育12小时后观察到样品量的轻微增加(图1B),但可以通过减少8-12小时之间的孵育期来控制扩增。为了获得更精确的3D深度成像,由于深度引起的球面像差,可能需要在给定平面上调整校正环。
技术的修改
在本研究中,我们利用小鼠脑组织来证明该方案的可行性。然而,这里描述的协议也可用于大型脑动物,如灵长类动物。事实上,该协议已被用于普通狨猴(Callithrix jacchus)脑组织中,并成功地同时可视化其皮质纹状体回路的神经回路和亚细胞结构6。显微镜载物台适配器设计用于将成像室直接安装在显微镜载物台6 上(图2A,B)。使用倒置显微镜通过成像室的底部盖玻片观察清除的组织切片。在用PBS(-)(deScaling)5,11恢复已清除的脑组织后,我们可以从用ScaleSF(重新切片)清除的脑组织中制备20μm至50μm厚度的组织切片6。在清除的组织中捕获的亚细胞结构可以在短WD的高NA物镜的重切面上再次成像.使用该方案已经实现了用含有戊二醛的固定剂填充的脑切片的清除,从而提供了卓越的超微结构保存6。ScaleSF实现了高水平的超微结构保存,允许在光学清除的组织6 中进行EM分析(补充图1)。该方法的EM兼容性对于具有从宏观到纳米级尺度的成像结构特别有用。
该技术的局限性
这里描述的方案使我们能够可视化1毫米厚的脑切片中从电路到亚细胞鳞片的神经元结构。但是,该协议中仍然存在三个限制。首先是清算协议的清算能力。ScaleSF是大脑切片的清除协议,而不是整个大脑。虽然1毫米厚的脑切片可以提供树突状和局部轴突12的良好知识,但关于跨越整个大脑的轴突投射的信息在切片13,14,15,16中是碎片和不完整的。其次是成像分辨率。使用此处描述的方案,我们成功地在光学清除的脑切片中可视化亚细胞神经元结构,例如树突状棘和轴突(图4)。然而,本研究中使用的物镜的分辨率为400-750nm的xy分辨率不足以解析神经元细胞的更精细结构。鉴于高数值孔径物镜通常设计用于油浸(RI 1.52),RI与溶液的不匹配(RI 1.47)可能会阻止使用这些物镜进行高分辨率成像。第三是神经元细胞的荧光蛋白标记。标记方法限制了我们成像技术的广泛应用。在保持组织完整性的同时标记大规模组织的组织化学和/或免疫组织化学技术将显着推进此处提供的方案。
关于现有方法和技术未来应用的意义
在本研究中,我们描述了使用ScaleSF组织清除从介观结构到微观结构的神经元成像的详细方案。这里描述的协议使得在没有专用设备的情况下可以在合理的时间内可视化从电路到亚细胞水平的神经元结构,从而有助于理解从电路到组件尺度的神经元结构。神经元精心设计了巨大的繁荣过程,并安排了专门的精细结构来传输和接收信息。因此,神经元成像需要一种组织清除方法,该方法具有强大的清除能力以及高水平的组织保存,以便同时可视化大尺度和小尺度结构。然而,具有高清除能力的组织清除方法可积极去除脂质和色素,以实现广泛的组织澄清3,4,损害组织完整性5,6,17 (补充图1)。这与此处使用的清除协议形成鲜明对比,该协议实现了高水平的结构保存6 (补充图1)。因此,ScaleSF组织清除允许有效和高效的神经元成像,这需要多尺度高分辨率3D成像和准确的信号重建。
披露声明
作者没有什么可透露的。
致谢
作者感谢横子(顺天堂大学)的AAV载体生产以及Kisara Hoshino(顺天堂大学)的技术援助。本研究得到了JSPS KAKENHI(JP20K07231至K.Y.;JP21H03529 转 T.F.;JP20K07743 转 M.K.;JP21H02592 转 H.H.)和创新领域"共振生物"的科学研究(JP18H04743至H.H.)。本研究还得到了日本医学研究开发厅(AMED)(JP21dm0207112至T.F.和H.H.)、日本科学技术振兴机构(JST)的登月研发(JPMJMS2024至H.H.)、JST的颠覆性科学与技术聚变导向研究(FOREST)(JPMJFR204D至H.H.)、顺天堂大学医学院老年疾病研究所的助学金(X2016至K.Y.;X2001至H.H.),以及私立学校品牌项目。
材料
| Name | Company | Catalog Number | Comments |
| 16x multi-immersion objective lens | Leica Microsystems | HC FLUOTAR 16x/0.60 IMM CORR VISIR | |
| Agar | Nacalai Tesque | 01028-85 | |
| Agarose | TaKaRa Bio | L03 | |
| Dimethyl sulfoxide | Nacalai Tesque | 13407-45 | |
| D-Sorbitol | Nacalai Tesque | 06286-55 | |
| γ-cyclodextrin | Wako Pure Chemical Industries | 037-10643 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Huygens Essential | Scientific Volume Imaging | ver. 18.10.0p8/21.10.1p0 64b | |
| Imaris | Bitplane | ver. 9.0.0 | |
| Leica Application Suite X | Leica Microsystems | LAS X, ver. 3.5.5.19976 | |
| Methyl-β-cyclodextrin | Tokyo Chemical Industry | M1356 | |
| Paraformaldehyde | Merck Millipore | 1.04005.1000 | |
| Phosphate Buffered Saline (10x; pH 7.4) | Nacalai Tesque | 27575-31 | 10x PBS(–) |
| Sodium azide | Nacalai Tesque | 31233-55 | |
| Sodium pentobarbital | Kyoritsu Seiyaku | N/A | |
| TCS SP8 | Leica Microsystems | N/A | |
| Triton X-100 | Nacalai Tesque | 35501-15 | |
| Urea | Nacalai Tesque | 35940-65 | |
| Vibrating tissue slicer | Dosaka EM | PRO7N |
参考文献
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chemical Biology. 23 (1), 137-157 (2016).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annual Reviews of Cell and Developmental Biology. 32, 713-741 (2016).
- Ueda, H. R., et al. Whole-brain profiling of cells and circuits in mammals by tissue clearing and light-sheet microscopy. Neuron. 106 (3), 369-387 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews. Neuroscience. 21 (2), 61-79 (2020).
- Hama, H., et al. ScaleS: an optical clearing palette for biological imaging. Nature Neuroscience. 18 (10), 1518-1529 (2015).
- Furuta, T., et al. Multi-scale light microscopy/electron microscopy neuronal imaging from brain to synapse with a tissue clearing method, ScaleSF. iScience. 25 (1), 103601(2022).
- Miyawaki, A., et al. Deep imaging of cleared brain by confocal laser-scanning microscopy. Protocol Exchange. , (2016).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protocols. 2 (1), 100230(2021).
- Kameda, H., et al. Parvalbumin-producing cortical interneurons receive inhibitory inputs on proximal portions and cortical excitatory inputs on distal dendrites. The European Journal of Neuroscience. 35 (6), 838-854 (2012).
- Sohn, J., et al. A single vector platform for high-level gene transduction of central neurons: Adeno-associated virus vector equipped with the Tet-off system. PLoS One. 12 (1), 0169611(2017).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14 (11), 1481-1488 (2011).
- Stepanyants, A., Martinez, L. M., Ferecsko, A. S., Kisvarday, Z. F. The fractions of short- and long-range connections in the visual cortex. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3555-3560 (2009).
- Kuramoto, E., et al. Two types of thalamocortical projections from the motor thalamic nuclei of the rat: a single neuron-tracing study using viral vectors. Cerebral Cortex. 19 (9), New York, N.Y. 2065-2077 (2009).
- Matsuda, W., et al. Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nature Methods. 15 (12), 1033-1036 (2018).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6, 34331(2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。