Method Article
중시경에서 현미경 비늘에 이르기까지 신경 세포 이미징을위한 조직 제거 방법
요약
이 프로토콜은 조직 제거 방법인 ScaleSF를 사용하여 뇌 절편에서 신경 세포 영상의 상세한 방법을 제공한다. 이 프로토콜에는 뇌 조직 준비, 조직 정화, 클리어 슬라이스 처리 및 공초점 레이저 스캐닝 현미경 이미징이 포함됩니다.
초록
중강경에서 뇌 조직의 현미경 수준에 이르기까지 신경 구조를 시각화하기 위해 상세한 프로토콜이 여기에 제공됩니다. 신경 회로에서 세포 하부 신경 구조에 이르기까지 뉴런 구조는 ScaleSF로 광학적으로 클리어 된 마우스 뇌 조각에서 시각화됩니다. 이 클리어링 방법은 ScaleS의 변형 된 버전이며 강력한 클리어링 기능뿐만 아니라 형광 신호의 높은 수준의 보존 및 구조적 무결성을 달성하는 조직 슬라이스에 대한 친수성 조직 제거 방법입니다. 사용자 정의 가능한 3차원(3D) 인쇄 이미징 챔버는 클리어된 뇌 조직의 안정적인 장착을 위해 설계되었습니다. 강화된 녹색 형광 단백질 유전자를 운반하는 아데노 관련 바이러스 벡터를 주입한 마우스 뇌를 4% 파라포름알데히드로 고정시키고, 진동 조직 슬라이서로 1-mm 두께의 조각으로 절단하였다. 뇌 조각은 세 가지 용액, 즉 Sca l eS0 용액, 인산염 완충 식염수 (-) 및 ScaleS4 용액에서 순차적 인 배양을 포함하는 클리어링 프로토콜에 따라 총10.5-14.5 h의 클리어링 프로토콜에 따라 제거되었습니다. 클리어된 뇌 조각을 이미징 챔버에 장착하고 ScaleS4D25(0) 용액에 용해된 1.5% 아가로스 겔에 매립하였다. 슬라이스의 3D 이미지 획득은 긴 작동 거리의 다중 침지 대물 렌즈가 장착 된 공초점 레이저 스캐닝 현미경을 사용하여 수행되었습니다. 중강경 신경 영상으로 시작하여, 우리는 수지상 척추 및 축삭돌과 같은 미세한 세포 하부 신경 구조를 광학적으로 지워진 뇌 조각에서 시각화하는 데 성공했습니다. 이 프로토콜은 회로에서 아세포 구성 요소 척도에 이르기까지 신경 구조의 이해를 용이하게합니다.
서문
조직 제거 방법은 광 현미경으로 생물학적 및 임상 샘플의 깊이 독립적 인 이미징을 개선하여 손상되지 않은 조직 1,2에 대한 구조 정보를 추출 할 수 있습니다. 광학 클리어링 기술은 잠재적으로 속도를 높이고 조직학적 분석 비용을 절감할 수 있습니다. 현재 세 가지 주요 클리어링 접근법이 있습니다 : 친수성, 소수성 및 하이드로 겔 기반 방법 1,2. 친수성 접근법은 형광 신호 및 조직 완전성을 보존하는 데 있어 능가하며, 다른 두 접근법(3,4)에 비해 독성이 적다.
친수성 클리어링 방법인 ScaleS는 구조적 및 분자 무결성의 보존과 강력한 클리어링 능력(클리어링-보존 스펙트럼)5으로 독특한 위치를 차지하고 있습니다. 이전 연구에서, 우리는 Sca l eS6의 클리어링 절차를 수정하여 조직 슬라이스 (~ 1-mm 두께)에 대한 신속하고 등각 클리어링 프로토콜 인 ScaleSF를 개발했습니다. 이 클리어링 프로토콜은 10.5-14.5 시간 동안 세 가지 솔루션으로 뇌 조각을 순차적으로 배양해야합니다. 이 방법은 전자 현미경 (EM) 분석 (보충 그림 1)과도 호환되는 높은 클리어링 보존 스펙트럼을 특징으로하므로 정확한 신호 재구성6을 갖춘 멀티 스케일 고해상도 3D (3D) 이미징이 가능합니다. 따라서 ScaleSF는 특히 신경 세포가 엄청난 길이의 풍부한 과정을 정교하게하고 정보를 전달하고 수신하기위한 전문화 된 미세한 세포 하부 구조를 배열하는 뇌에서 효과적이어야합니다. 신경 세포의 회로에서 세포 하위 수준까지 비늘로 구조 정보를 추출하는 것은 뇌 기능을 더 잘 이해하는 데 매우 유용합니다.
여기에서는 ScaleSF를 사용하여 중시경 / 회로에서 현미경 / 세포 수준까지의 스케일로 신경 구조를 시각화하기위한 자세한 프로토콜을 제공합니다. 이 프로토콜에는 조직 준비, 조직 정화, 클리어 된 조직의 취급 및 클리어 된 조직의 공초점 레이저 스캐닝 현미경 (CLSM) 이미징이 포함됩니다. 우리의 프로토콜은 회로에서 아세포 구성 요소 척도에 이르기까지 신경 구조를 심문하는 데 중점을 둡니다. 용액의 제조를 위한 상세한 절차와 마우스 뇌에 아데노-연관 바이러스(AAV) 벡터의 입체택시 주사를 위한 상세한 절차는 각각 Miyawaki et al. 20167 및 Okamoto et al. 20218을 참조한다.
프로토콜
모든 실험은 준텐도 대학의 기관 동물 관리 및 사용위원회 (승인 번호 2021245, 2021246)의 승인을 받았으며 일본 과학위원회 (2006)의 동물 실험의 적절한 수행을위한 기본 지침에 따라 수행되었습니다. 여기서, 강화된 녹색 형광 단백질(EGFP) 유전자와 파브알부민(PV)/미리스토일화-EGFP-저밀도 지단백 수용체 C-말단 박테리아 인공염색체(BAC) 형질전환 마우스(PV-FGL 마우스)9 를 담은 AAV 벡터를 주입한 수컷 C57BL/6J 마우스를 사용하였다. PV-FGL 마우스는 C57BL/6J 배경에서 유지되었다. 이 연구와 관련하여 성별에 근거한 차이는 발견되지 않았습니다.
1. 조직 준비
- 관류 고정
참고: 흄 후드에서 1.1.1~1.1.3단계를 수행하여 파라포름알데히드(PFA)에 대한 노출을 제한하십시오.- 성인 남성 마우스 (8-16 주령)를 펜토바르비탈 나트륨 (200 mg / kg)의 과다 복용으로 복강 내 주사하여 마취하십시오. 발가락 꼬집음 금단과 눈 깜빡임 반사의 부재로 마취의 적절성을 확인하십시오.
- 흉강을 열고 수술 가위로 오른쪽 심방 부속기를 자릅니다. 20 mL 주사기에 부착된 23 G 바늘을 사용하여 마우스를 빙냉 인산완충염수 (PBS) 20 mL로 관류시키고, 이어서 또 다른 20 mL 주사기를 사용하여 0.1 M 인산염 완충액 (PB) 중의 빙냉 4% PFA 20 mL를 관류시켰다.
주의: PFA는 독성이 있으며 기형발생성입니다. 흡입이나 피부, 눈 및 점막과의 접촉을 피하십시오. - 핀셋으로 두개골에서 뇌 조직을 제거하십시오. 뇌 조직을 0.1 M PB의 4% PFA가 들어있는 15 mL 튜브로 옮기고, 샘플을 빛으로부터 보호하고, 50-100 rpm의 진탕기에서 4°C에서 밤새 부드럽게 흔들어줍니다.
- 참고: 수확된 뇌 조직은 4°C에서 PBS 중의 0.02% 아지드 나트륨(NaN3)에 수 주 동안 저장될 수 있다.
주의:NaN3는 독성이 있습니다. 흡입이나 피부, 눈 및 점막과의 접촉을 피하십시오. 흄 후드 안에서 다루십시오.
- 두뇌 조각 준비
- PBS 50 mL에 한천 2 g을 첨가하여 PBS 중의 4% 한천을 제조하였다. 한천이 완전히 용해 될 때까지 혼합물을 전자 레인지. 용액을 40-45°C로 냉각시킨다.
참고 : 한천의 주요 구성 요소 인 agaropectin이 제공하는 점성 특성은 조직 조각의 절단 용이성을 향상시킵니다. - 한천 용액 10 mL를 6-웰 배양 플레이트에 첨가한다. 포셉을 사용하여 한천 용액에 뇌 조직을 잠급니다. 한천이 얼음 위에서 굳어지게하십시오.
- 우물에서 내장 된 뇌 조직을 제거하고 면도날로 한천을 다듬습니다. 아가 블록을 수퍼 접착제로 비브라톰 욕조 바닥에 고정하고 버퍼 트레이에 0.1M PB를 붓습니다.
- 에탄올에 담근 보풀이 없는 티슈 페이퍼를 사용하여 다른 면도날을 청소하고 진동 조직 슬라이서의 블레이드 홀더에 블레이드를 부착합니다.
- 단면화 속도를 진폭이 1.4mm인 0.14mm/s로, 주파수를 75-77Hz로 설정합니다. 뇌 조직을 1mm 두께의 조각으로 자르고 PBS가 포함된 6웰 세포 배양 플레이트에 조각을 수집합니다.
참고: 뇌 절편은 4°C에서 PBS 중의 0.02%NaN3 에 몇 주 동안 저장될 수 있다.
- PBS 50 mL에 한천 2 g을 첨가하여 PBS 중의 4% 한천을 제조하였다. 한천이 완전히 용해 될 때까지 혼합물을 전자 레인지. 용액을 40-45°C로 냉각시킨다.
2. 조직 정화
참고: 사용된 ScaleS 용액의 조성은 표 1에 열거되어 있다. 샘플은 호일로 덮어서 빛으로부터 보호해야합니다. 지우기 단계는 그림 1A에 나와 있습니다.
- 8 mL의 Sca l eS0 용액을 6-웰 세포 배양 플레이트의 한 웰에 첨가하고, 8 mL의 ScaleS4 용액을 플레이트의다른 웰에 첨가하고, 인큐베이터에서 37°C로 예열한다.
- 뇌 절편을 주걱으로 미리 가온된 ScaleS0 용액으로 옮기고 90 rpm의 진탕 인큐베이터에서 37°C에서 2시간 동안 인큐베이션한다.
- 투과화된 뇌 조각을 주걱이 있는 6-웰 세포 배양 플레이트에 PBS(–) 8 mL로 옮기고 40-60 rpm의 오비탈 진탕기에 보관하여 15분 동안 세척한다. 이 작업을 두 번 반복하십시오.
- 뇌 조각을 미리 가온된 8 mL의 ScaleS4 용액에 주걱으로 옮기고 37°C에서 8-12시간 동안 90rpm의 진탕 인큐베이터에서 배양하여 이를 지웁니다. 지워진 뇌 조각은 그림 1에서 볼 수 있습니다.
3. 브레인 슬라이스 장착
참고: 사용자 지정 가능한 이미징 챔버는 클리어된 뇌 조각의 안정적인 장착에 사용됩니다(그림 2)6. 챔버는 챔버 프레임과 하단 커버 슬립으로 구성됩니다. 현미경 스테이지 어댑터는 이미징 챔버를 현미경 스테이지에 직접 장착하도록 설계되었습니다(그림 2A,B). 챔버 프레임 및 현미경 스테이지 어댑터는 사내 또는 아웃소싱 3D 인쇄 서비스를 사용하여 3D 인쇄할 수 있습니다. 이미징 챔버의 3D 컴퓨터 지원 설계(CAD) 데이터는 Furuta et al. 20226에 제공된다.
- 챔버 준비를 위해, 감압 접착제를 사용하여 챔버 프레임을 커버슬립에 부착하십시오.
- 병에 든 용액 100 mL에 아가로오스 1.5 g을 첨가하여 Sca l eS4D25 (0) 용액 (ScaleS4 겔)에 1.5 % 아가로스를 준비하십시오. 아가로스가 완전히 용해 될 때까지 용액을 교반하고 전자 레인지로 용액을 잘 섞는다. 완료되면 용액을 37 °C로 냉각하십시오.
- 클리어 된 뇌 조각을 주걱으로 이미징 챔버의 하단 커버 슬립에 장착하십시오. 보풀이 없는 깨끗한 티슈 페이퍼를 사용하여 클리어된 슬라이스에서 과량의 용액을 닦아냅니다.
- ScaleS4 겔을 마이크로피펫을 사용하여 뇌 슬라이스에 첨가하여 이미징 챔버를 채운다. 포셉으로 위에 다른 커버슬립을 놓고 보풀이 없는 티슈 페이퍼와 유리 슬라이드를 커버슬립에 순서대로 놓습니다.
- 이미징 챔버를 4°C의 냉장고로 옮긴다. 유리 슬라이드에 금속 무게를 놓고 30 분 동안 그대로 두십시오.
- 이미징 챔버에서 금속 중량, 유리 슬라이드, 보풀이 없는 티슈 페이퍼 및 커버슬립을 제거하고 과도한 젤을 닦아냅니다(그림 2A,B).
- 이미징 챔버를 60mm 유리 페트리 접시에 넣고 퍼티와 같은 감압 접착제로 이미징 챔버의 테두리를 접시에 부착하십시오. 여러 지점의 챔버를 페트리 접시에 부착하십시오.
- ScaleS4 용액을 접시에 붓고 40-60 rpm의 오비탈 쉐이커 상에서 20-25°C에서 1시간 동안 부드럽게 흔들어 준다. 신선한 용액으로 대체하고 200 μL 피펫 팁을 사용하여 표면을 부드럽게 긁어 젤 표면의 기포를 제거하십시오. 침지된 이미징 챔버를 현미경 스테이지에 장착합니다(그림 2C).
4. CLSM 이미징
- 장거리 작동 거리(WD)의 다중 침지 대물 렌즈가 장착된 CLSM을 사용하여 이미지를 획득합니다(16x/0.60 수치 조리개[NA], WD = 2.5mm).
참고: 높은 NA 대물 렌즈는 높은 회절 제한 해상도를 제공할 수 있습니다. - 모든 관련 이미징 장비(워크스테이션, 현미경, 스캐너, 레이저 및 수은 램프)를 켜고 CLSM 이미징 소프트웨어를 시작합니다.
- 다중 침지 대물 렌즈의 보정 칼라를 1.47로 설정합니다. ScaleS4 용액은 약 1.47,5,7의 굴절률 (RI)을 갖는다. RI 불일치로 인한 수차는 이미지 형성을 방해할 수 있습니다(그림 3).
- 대물 렌즈를 용액에 담그고 슬라이스에 천천히 접근하게하십시오. 대물 렌즈 끝에 갇힌 기포를 제거합니다. epifluorescence를 사용하여 클리어링된 조직에서 관심 영역(ROI)을 찾습니다.
- 적절한 설정을 테스트하여 이미지 수집 매개 변수를 설정합니다.
- 이미지 수집을 위한 비트 심도를 결정합니다. 이미지의 데이터 크기는 비트 깊이에 따라 증가합니다.
- 감지 파장을 설정합니다. 방출 스펙트럼에 따라 검출기에 적합한 게이트를 조정하십시오. 검출 파장이 레이저 라인을 커버하지 않는지 확인하십시오.
- xy 해상도를 설정합니다. 형식이 클수록 더 나은 xy 해상도를 제공하지만 이미지를 수집하는 데 시간이 더 오래 걸립니다.
- 스캔 속도를 설정합니다. 느린 스캔 속도는 높은 신호 대 잡음비를 제공합니다. 그러나 픽셀 체류 시간과 광표백의 위험도 증가합니다. 그에 따라 선택하십시오.
- 핀홀 크기를 조정합니다. 핀홀 크기는 광학 섹션 두께를 제어합니다. 핀홀 크기가 작을수록 광학 섹션이 더 얇아져 z 분해능이 향상되지만 형광 신호는 감소합니다. 핀홀 크기를 크게 만들면 형광 신호가 더 강한 더 두꺼운 광학 섹션이 제공됩니다.
- 레이저 전력, 검출기/증폭기 게인 및 오프셋을 설정합니다. 적절한 이미지가 얻어질 때까지 레이저 전력 및 검출기/증폭기 이득을 점진적으로 증가시킨다. 높은 레이저 파워는 광표백의 위험을 수반합니다. 오프셋(콘트라스트)을 적절하게 조정하여 높은 신호 대 잡음비를 얻습니다.
- ROI 크기에 따라 필요한 경작 영역을 결정합니다. ROI의 전체 길이와 너비가 캡처되었는지 확인하십시오.
- 모든 평면에서 지워진 조직을 탐색하고 스택의 시작점과 끝점을 설정합니다. 원하는 z 분해능에 따라 z-스텝 크기를 설정합니다.
- 이미지 획득 설정에 만족할 때 이미지를 수집하고 캡처된 이미지를 기록합니다. 이미지 분석 소프트웨어를 사용하여 이미지를 처리합니다.
결과
1-mm 두께의 마우스 뇌 슬라이스의 광학 클리어링은 이 프로토콜을 사용하여 달성되었다. 도 1B 는 클리어링 처리 전후의 마우스 뇌 슬라이스의 전송 이미지를 나타낸다. 조직 제거 방법은 1mm 두께의 마우스 뇌 조각을 투명하게 렌더링했습니다. 뇌 조각의 최종 크기에서 약간의 확장은 12 h 동안 클리어링 용액에서 인큐베이션 한 후에 발견되었다 (선형 팽창 : 102.5 % ± 1.3 %). 조직의 형광 및 구조적 완전성의 보존을 PV-FGL 마우스에서 원형질막에서의 표적화된 EGFP 발현으로 평가하였다(도 1C). 이들 마우스에서, 소마토덴드린성 막-표적화된 EGFP는 PV 양성 뉴런9에서 발현된다. 소마토덴드리아 영역에서 원형질막을 표적으로 하는 EGFP 발현은 처리 후에 유지되었다(도 1C). 또한, 이전의 EM 연구는 ScaleSF로 클리어된 뇌 조직에서 잘 보존된 구조적 완전성을 보여준다(보충 그림 1)6.
RI 불일치로 인한 수차로 인해 이미지 밝기와 해상도가 눈에 띄게 손실되었습니다(그림 3). PV-FGL 마우스의 1mm 두께의 뇌 조각을 긴 WD의 다중 침지 대물렌즈가 장착된 CLSM 하에서 클리어하고 영상화하였다. 대물렌즈의 보정 칼라를 물 위치(RI 1.33)로 조정하면 낮은 밝기와 낮은 콘트라스트로 인해 400μm 및 800μm의 깊이에 위치한 EGFP 양성 뉴런의 명확한 시각화가 방해받았다. (그림 3A,C). 이들 뉴런은 동일한 CLSM으로 명확하게 가시화되었고, 보정 칼라가 ScaleS4 용액과 일치하도록 조정되었을 때 (RI 1.47; 그림 3B, D). 침지 유체와 대물 렌즈 사이의 RI 정합은 광학적으로 클리어링된 조직에서 정확한 3D 이미징을 위해 매우 중요합니다.
마지막으로, 마우스 신피질 뉴런을 프로토콜의 실현 가능성을 입증하기 위해 활용하였다. 1차 체감각 피질(S1)에 AAV2/1-SynTetOff-EGFP 벡터10 을 주입한 마우스 뇌를 0.1 M PB 중의 4% PFA로 고정시켰다. 1-mm 두께의 코로나 슬라이스를 진동 조직 슬라이서로 뇌로부터 제조하였다. 영상화 챔버를 클리어링하고 장착한 후, 신피질 뉴런을 표적으로 하는 뉴런 이미징이 수행되었다(도 4). 1-mm 두께의 뇌 절편에서 EGFP 표지된 뉴런의 3D 재구성이 도 4A에 표현되어 있다. 더 높은 배율 이미지는 수지상 척추로 장식 된 개별 수지상 arbors를 보여줍니다 (그림 4B). 우리는 또한 대측 피질에서 축삭 말단 교목화와 축삭 부톤을 보여주었습니다 (그림 4C).
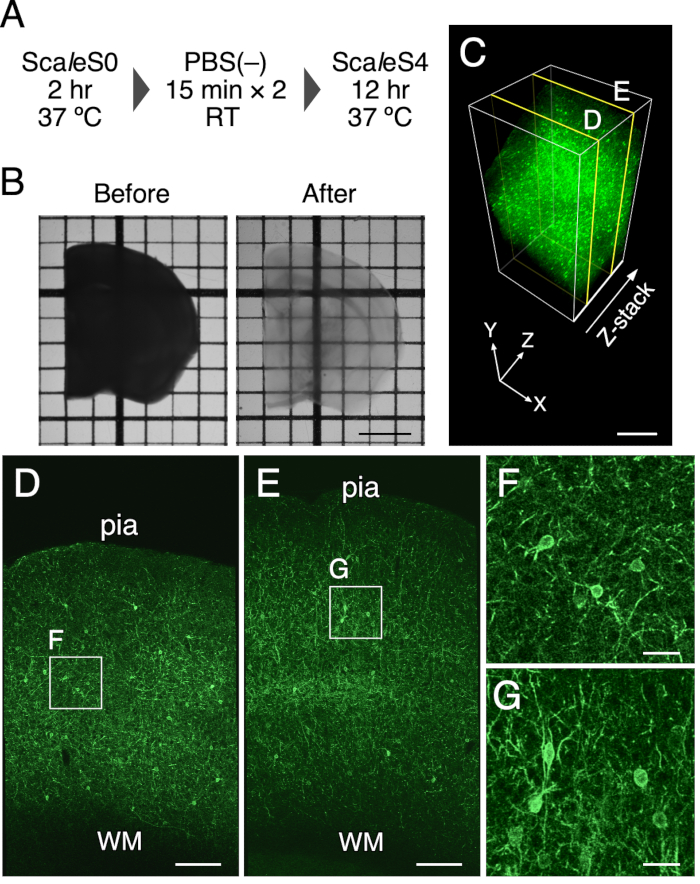
그림 1: 1mm 두께의 마우스 뇌 조각의 광학 클리어 링. (A) ScaleSF 조직 지우기 일정. (B) 치료 전(왼쪽)과 후(오른쪽) 1mm 두께의 뇌 조각의 이미지를 전송한다. (c) 조직 클리어링 방법을 사용하여 클리어링된 PV-FGL 마우스의 대뇌 피질의 3D 볼륨 렌더링. (D,E) 250 μm (D) 및 750 μm (E)의 깊이에서 (C)의 xy 이미지. (F, G) (D) 및 (E)에 윤곽선이 그려진 사각형의 확대 보기. (C-G)에 나타나는 이미지는 렌더링 프로세스 전에 디컨볼루션됩니다. 약어 : 피아 = 피아 매트, WM = 백질. 스케일 바: 2mm in (B), 500 μm in (C), 200 μm in (D,E) 및 40 μm in (F,G). 이 수치는 Furata et al. 20226에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
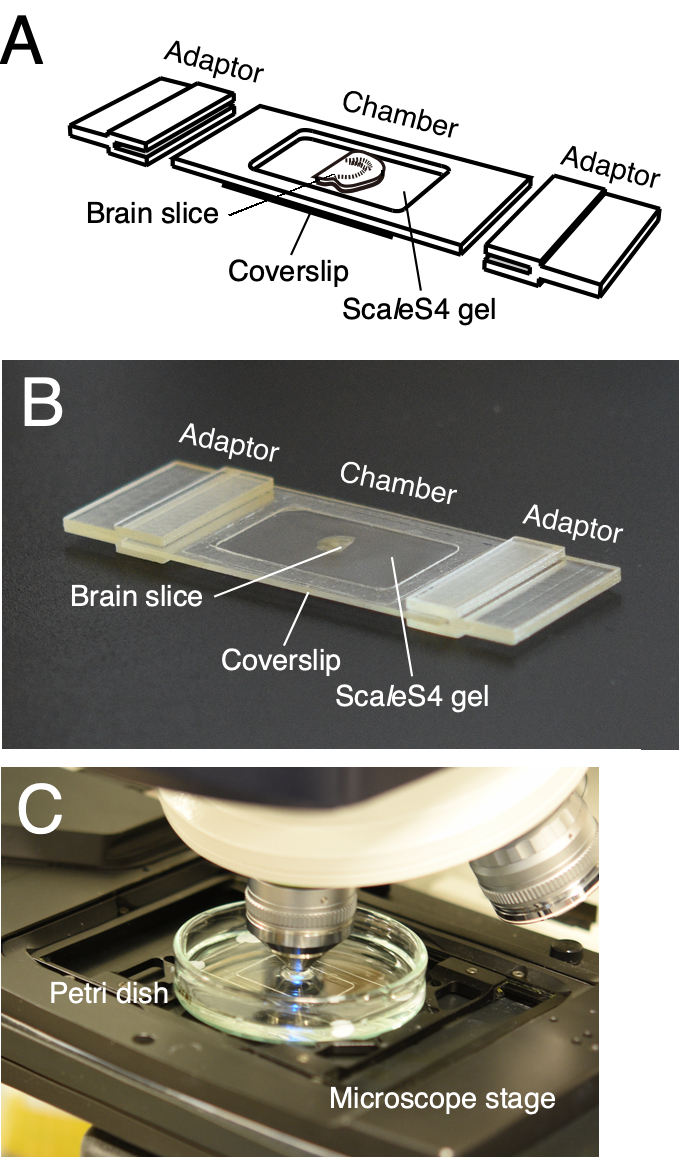
그림 2: 조직 조각 시각화를 위한 사용자 지정 가능한 3D 인쇄 이미징 챔버. (A,B) 사용자 지정 가능한 3D 인쇄 이미징 챔버의 스키마 드로잉(A) 및 그림(B). 이미징 챔버는 챔버 프레임, 하단 커버슬립 및 현미경 스테이지 어댑터로 구성됩니다. 클리어된 조직 조각은 하단 커버슬립 위에 놓여지고 ScaleS4 겔에 묻혀 있습니다. 챔버 프레임, 하단 커버 슬립 및 현미경 스테이지 어댑터는 조직 조각의 크기와 두께에 따라 사용자 정의 할 수 있습니다. (c) 이미징 챔버를 사용한 이미징 설정. 이미징 챔버는 페트리 접시의 ScaleS4 용액에 담그고 직립 CLSM의 스테이지에 장착됩니다. 이 수치는 Furata et al. 20226에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 대물렌즈와 ScaleS4 용액 사이의 RI 불일치로 인한 손상된 딥 이미징. (A-D) 400μm(A,B) 및 800μm(C,D)의 깊이에서 PV-FGL 마우스의 대뇌 피질의 xy 이미지. 다중 침수 대물 렌즈의 칼라 보정은 1.33in(A,C) 및 1.47in(B,D)으로 조정됩니다. 이미지는 대물 렌즈의 RI를 제외하고 동일한 매개 변수로 획득됩니다. 스케일 바: 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: ScaleSF로 클리어된 1mm 두께의 마우스 뇌 슬라이스에서의 뉴런 이미징. (a) S1에서 EGFP 표지된 마우스 신피질 뉴런의 3D 부피 렌더링. 신피질 뉴런은 AAV2/1 SynTetOff-EGFP 벡터로 표지된다. (B) EGFP 표지된 신피질 뉴런의 덴드리틱 아버. 39 μm 내지 48 μm의 깊이로부터의 최대 강도 프로젝션(MIP) 이미지가 표현된다. 화살촉은 수지상 척추를 나타냅니다. (c) 대측성 피질에서 EGFP 표지된 축삭 말단. 481.5 μm 내지 513 μm의 깊이로부터의 MIP 이미지가 표현된다. 화살촉은 축삭 부톤을 나타냅니다. (B)와 (C)에 나타나는 이미지는 디컨볼루션됩니다. 스케일 바: 300 μm in (A) 및 10 μm in (C). (C)의 막대는 (B)에도 적용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1 : ScaleSF, CUBIC 및 PACT로 지워진 뇌 조각의 울트라 구조. (A-C) ScaleSF (A), CUBIC (B) 및 PACT (C)로 클리어링된 마우스 대뇌 피질의 EM 이미지를 전송한다. 마우스 뇌는 1% 글루타르알데히드를 함유하는 4% PFA로 고정된다. 초박형 절편은 맑은 뇌 조각으로 준비됩니다. 막 구조는 CUBIC (B) 및 PACT (C)로 클리어 된 뇌 조각에서 심각하게 손상됩니다. 화살촉은 시냅스 후 막을 나타냅니다. 스케일 바: 500 nm. 이 수치는 Furata et al. 20226에서 수정되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
| ScaleS 솔루션을 위한 리시피 | |
| ScaleS0 솔루션 | |
| 시약 | 최종 농도 |
| D-소르비톨 | 20% (승 / v) |
| 글리세롤 | 5% (승 / v) |
| 메틸-β-사이클로덱스트린 | 1 밀리지미터 |
| γ-사이클로덱스트린 | 1 밀리지미터 |
| 디메틸 설폭사이드 | 3% (v/v) |
| 10x PBS (–) | 1배 |
| 스카leS4 솔루션 | |
| 시약 | 최종 농도 |
| 요소 | 4 엠 |
| D-소르비톨 | 40%(승 v) |
| 글리세롤 | 10% (승 / v) |
| 트리톤 X-100 | 0.2%(v/v) |
| 디메틸 설폭사이드 | 25% (v/v) |
| ScaleS4D25(0) 솔루션 | |
| 시약 | 최종 농도 |
| 요소 | 4 엠 |
| D-소르비톨 | 40%(승 v) |
| 글리세롤 | 10% (승 / v) |
| 디메틸 설폭사이드 | 25% (v/v) |
표 1: 세 개의 ScaleS 용액의 조성. Sca l eS0, Sca l eS4 및 ScaleS4D25(0) 용액의 조성물이 열거되어 있다. 이러한 솔루션을 준비하기위한 자세한 절차는 Miyawaki et al. 20167을 참조하십시오.
토론
프로토콜 내의 중요한 단계
프로토콜에는 의미 있는 결과를 얻기 위해 최대한의 주의를 기울여 수행해야 하는 몇 가지 중요한 단계가 있습니다. 샘플의 균일 한 고정은 대규모 조직 내에서 3D 이미징을 위해 필수적입니다. 대물 렌즈, 샘플 및 침지 유체는 일치하는 RI를 가져야합니다. 이들 사이의 RI-불일치는 제거된 뇌 절편 내에서 EGFP 발현 세포의 고도로 교란된 영상화로 이어질 것이다(도 3). 대물 렌즈를 침지 유체에 대한 보정 칼라 조정은 깊이 유도 구형 수차를 최소화하여 3D 이미징에서 신호, 콘트라스트 및 공간 분해능을 극대화합니다. 준비된 용액의 RI는 굴절계를 사용하여 측정 할 수 있습니다.
기술 문제 해결
용액의 더 긴 저장은 클리어링 능력과 형광 신호 보존 능력 및 구조적 무결성에 영향을 줄 수 있습니다. 갓 준비된 용액을 사용해야합니다. 이들 용액은 4°C에서 최대 1개월까지 저장할 수 있다. 아이소메트릭성은 정확한 신호 재구성을 통해 효과적이고 효율적인 뉴런 이미징에 매우 중요합니다. 12시간 동안 인큐베이션 후에 샘플 크기의 약간의 팽창이 관찰되었지만(도 1B), 확장은 8-12h 사이의 인큐베이션 기간을 감소시킴으로써 조절될 수 있다. 보다 정확한 3D 깊이 이미징을 위해 깊이 유도 구형 수차로 인해 지정된 평면에서 보정 칼라를 조정해야 할 수 있습니다.
기술의 수정
본 연구에서, 우리는 프로토콜의 타당성을 입증하기 위해 마우스 뇌 조직을 이용했다. 그러나 여기에 설명 된 프로토콜은 영장류와 같은 큰 두뇌 동물에도 사용될 수 있습니다. 실제로, 이 프로토콜은 일반적인 마모셋(Callithrix jacchus) 뇌 조직에서 사용되어 왔으며, 그의 피질성 회로의 신경 회로 및 아세포 구조의 동시 시각화에 성공하였다6. 현미경 스테이지 어댑터는 이미징 챔버를 현미경 스테이지6에 직접 장착하도록 설계되었습니다(그림 2A, B). 클리어된 조직 조각은 이미징 챔버의 바닥 커버슬립을 통해 거꾸로 된 현미경을 사용하여 관찰할 수 있습니다. PBS(-) (deScaling)5,11로 맑은 뇌 조직을 회복한 후, ScaleSF (re-sectioning)6로 클리어링된 뇌 조직으로부터 20-μm 내지 50-μm 두께의 조직 절편을 준비할 수 있다. 클리어 조직 내에서 포획된 하부 세포 구조는 짧은 WD의 높은 NA 대물 렌즈를 사용하여 재절편으로 다시 이미징할 수 있습니다. 글루타르알데히드를 함유하는 고정제로 관류된 뇌 조각의 제거는 이 프로토콜을 사용하여 달성되었으며, 우수한 초구조 보존을 제공합니다6. ScaleSF는 광학적으로 제거된 조직6에서 EM 분석을 가능하게 하는 높은 수준의 초구조 보존을 달성한다(보충 그림 1). 이 방법의 EM 상용성은 거시적 수준에서 내시적 수준까지 스케일을 갖는 구조물을 이미징하는 데 특히 유용하다.
기술의 한계
여기에 설명 된 프로토콜을 통해 우리는 1mm 두께의 뇌 조각에서 회로에서 아세포 비늘까지 신경 구조를 시각화 할 수 있습니다. 그러나 프로토콜에는 세 가지 제한 사항이 남아 있습니다. 첫 번째는 지우기 프로토콜의 지우기 기능입니다. ScaleSF는 전체 뇌가 아닌 뇌 조각을위한 클리어링 프로토콜입니다. 1-mm 두께의 뇌 조각은 수지상 및 국소 축삭 arbors (12)에 대한 좋은 지식을 제공 할 수 있지만, 전체 뇌에 걸친 축삭 돌기에 대한 정보는 조각13,14,15,16에서 단편적이고 불완전합니다. 두 번째는 이미징 해상도입니다. 여기에 설명된 프로토콜을 사용하여 수지상 척추 및 축삭돌기와 같은 세포하 신경 구조를 광학적으로 제거된 뇌 조각에서 시각화하는 데 성공했습니다(그림 4). 그러나, 본 연구에 사용된 대물렌즈의 해상도, 400-750 nm의 xy 분해능은 신경세포의 보다 미세한 구조를 해결하기에 충분하지 않다. 높은 NA 대물 렌즈가 일반적으로 오일 침지형(RI 1.52)용으로 설계되었기 때문에 RI 솔루션(RI 1.47)과의 불일치는 이러한 대물 렌즈를 사용한 고해상도 이미징을 방지할 수 있습니다. 세 번째는 신경 세포의 형광 단백질 표지입니다. 라벨링 방법은 이미징 기술의 광범위한 적용을 제한합니다. 조직 무결성을 유지하면서 대규모 조직을 분류하는 조직화학 및/또는 면역조직화학 기술은 여기에 제공된 프로토콜을 상당히 발전시킬 것입니다.
기존 방법 및 기술의 향후 적용에 대한 중요성
본 연구에서, 우리는 ScaleSF 조직 클리어링을 사용하여 중강경에서 현미경 구조에 이르기까지 신경 이미징을위한 세부 프로토콜을 설명합니다. 여기에 설명 된 프로토콜은 특수 장비 없이도 합리적인 시간 내에 회로에서 세포 하부 수준까지 신경 구조를 시각화 할 수있게하여 회로에서 구성 요소 척도에 이르기까지 신경 구조에 대한 이해를 용이하게합니다. 뉴런은 엄청난 길이의 풍부한 과정을 정교하게 만들고 정보를 전달하고 수신하기위한 전문화 된 미세 구조를 마련합니다. 따라서, 뉴런 이미징은 크고 작은 규모의 구조물을 동시에 시각화하기 위해 강력한 클리어링 능력뿐만 아니라 높은 수준의 조직 보존을 발휘하는 조직 제거 방법을 필요로 한다. 그러나, 높은 클리어링 능력을 특징으로 하는 조직 제거 방법은 광범위한 조직 정화를 위해 지질과 색소를 공격적으로 제거한다 3,4, 조직 완전성을 손상시킨다 5,6,17 (보충 그림 1). 이는 높은 수준의 구조 보존6을 달성하는 여기에 사용된 클리어링 프로토콜과는 뚜렷한 대조를 이룬다(보충 그림 1). 따라서 ScaleSF 조직 제거는 정확한 신호 재구성과 함께 멀티 스케일 고해상도 3D 이미징이 필요한 효과적이고 효율적인 신경 이미징을 허용합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자들은 AAV 벡터 제작을 위한 이시다 요코(준텐도 대학)와 기술 지원을 위해 호시노 키사라(준텐도 대학)에게 감사를 표한다. 본 연구는 JSPS KAKENHI (JP20K07231 내지 K.Y.; JP21H03529 내지 T.F.; JP20K07743 내지 M.K.; JP21H02592 내지 H.H.) 혁신 영역 "공명 바이오"에 대한 과학 연구 (JP18H04743 ~ H.H.). 이 연구는 또한 일본 의학 연구 개발청 (AMED) (JP21dm0207112 ~ T.F. 및 H.H.), 일본 과학 기술국 (JST)의 Moonshot R & D (JPMJMS2024 ~ H.H.), JST (JPMJFR204D에서 H.H.까지)의 파괴적인 과학 기술을위한 융합 지향 연구 (FOREST), 중텐도 대학 의과 대학 의과 대학 노년기 질환 연구소 (X2016 ~ K.Y.; X2001 to H.H.), 그리고 사립 학교 브랜딩 프로젝트.
자료
| Name | Company | Catalog Number | Comments |
| 16x multi-immersion objective lens | Leica Microsystems | HC FLUOTAR 16x/0.60 IMM CORR VISIR | |
| Agar | Nacalai Tesque | 01028-85 | |
| Agarose | TaKaRa Bio | L03 | |
| Dimethyl sulfoxide | Nacalai Tesque | 13407-45 | |
| D-Sorbitol | Nacalai Tesque | 06286-55 | |
| γ-cyclodextrin | Wako Pure Chemical Industries | 037-10643 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Huygens Essential | Scientific Volume Imaging | ver. 18.10.0p8/21.10.1p0 64b | |
| Imaris | Bitplane | ver. 9.0.0 | |
| Leica Application Suite X | Leica Microsystems | LAS X, ver. 3.5.5.19976 | |
| Methyl-β-cyclodextrin | Tokyo Chemical Industry | M1356 | |
| Paraformaldehyde | Merck Millipore | 1.04005.1000 | |
| Phosphate Buffered Saline (10x; pH 7.4) | Nacalai Tesque | 27575-31 | 10x PBS(–) |
| Sodium azide | Nacalai Tesque | 31233-55 | |
| Sodium pentobarbital | Kyoritsu Seiyaku | N/A | |
| TCS SP8 | Leica Microsystems | N/A | |
| Triton X-100 | Nacalai Tesque | 35501-15 | |
| Urea | Nacalai Tesque | 35940-65 | |
| Vibrating tissue slicer | Dosaka EM | PRO7N |
참고문헌
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chemical Biology. 23 (1), 137-157 (2016).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annual Reviews of Cell and Developmental Biology. 32, 713-741 (2016).
- Ueda, H. R., et al. Whole-brain profiling of cells and circuits in mammals by tissue clearing and light-sheet microscopy. Neuron. 106 (3), 369-387 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews. Neuroscience. 21 (2), 61-79 (2020).
- Hama, H., et al. ScaleS: an optical clearing palette for biological imaging. Nature Neuroscience. 18 (10), 1518-1529 (2015).
- Furuta, T., et al. Multi-scale light microscopy/electron microscopy neuronal imaging from brain to synapse with a tissue clearing method, ScaleSF. iScience. 25 (1), 103601(2022).
- Miyawaki, A., et al. Deep imaging of cleared brain by confocal laser-scanning microscopy. Protocol Exchange. , (2016).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protocols. 2 (1), 100230(2021).
- Kameda, H., et al. Parvalbumin-producing cortical interneurons receive inhibitory inputs on proximal portions and cortical excitatory inputs on distal dendrites. The European Journal of Neuroscience. 35 (6), 838-854 (2012).
- Sohn, J., et al. A single vector platform for high-level gene transduction of central neurons: Adeno-associated virus vector equipped with the Tet-off system. PLoS One. 12 (1), 0169611(2017).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14 (11), 1481-1488 (2011).
- Stepanyants, A., Martinez, L. M., Ferecsko, A. S., Kisvarday, Z. F. The fractions of short- and long-range connections in the visual cortex. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3555-3560 (2009).
- Kuramoto, E., et al. Two types of thalamocortical projections from the motor thalamic nuclei of the rat: a single neuron-tracing study using viral vectors. Cerebral Cortex. 19 (9), New York, N.Y. 2065-2077 (2009).
- Matsuda, W., et al. Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nature Methods. 15 (12), 1033-1036 (2018).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6, 34331(2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유