Method Article
メゾスコピックから顕微鏡スケールまでのニューロンイメージングのための組織クリアリング法
要約
プロトコールは、組織クリアリング法ScaleSFを用いた脳スライスにおけるニューロンイメージングの詳細な方法を提供する。このプロトコルには、脳組織調製、組織清澄化、クリアスライスの取り扱い、およびメゾスコピックレベルから顕微鏡レベルまでのニューロン構造の共焦点レーザー走査顕微鏡イメージングが含まれます。
要約
ここでは、脳組織のメゾスコピックレベルからミクロレベルまでのニューロン構造を視覚化するための詳細なプロトコルが提供されています。神経回路から細胞内ニューロン構造に至るまでのニューロン構造は、ScaleSFで光学的にクリアされたマウス脳スライスにおいて視覚化される。この透明化方法は、ScaleSの修正版であり、強力な透明化能力ならびに蛍光シグナルの高レベルの保存および構造的完全性を達成する組織スライスのための親水性組織透明化方法である。カスタマイズ可能な3次元(3D)プリントイメージングチャンバは、クリアされた脳組織を確実に取り付けるように設計されています。増強された緑色蛍光タンパク質遺伝子を有するアデノ随伴ウイルスベクターを注入したマウス脳を4%パラホルムアルデヒドで固定し、振動組織スライサーで1mm厚のスライスに切断した。脳スライスは、3つの溶液、すなわちScaleS0溶液、リン酸緩衝液生理食塩水(-)、およびScaleS4溶液中で合計10.5〜14.5時間逐次インキュベーションを含むクリアリングプロトコルに従ってクリアされた。クリアした脳スライスをイメージングチャンバーにマウントし、ScaleS4D25(0)溶液に溶解した1.5%アガロースゲルに埋め込んだ。スライスの3D画像取得を、長い作動距離の多液浸対物レンズを搭載した共焦点レーザー走査顕微鏡を用いて行った。メゾスコピックニューロンイメージングから始まり、樹状突起スパインや軸索ブートンなどの微細な細胞内ニューロン構造を光学的にクリアした脳スライスに可視化することに成功しました。このプロトコルは、回路から細胞内成分スケールまでのニューロン構造の理解を容易にするであろう。
概要
組織透明化法は、光学顕微鏡による生物学的および臨床的サンプルの深さに依存しないイメージングを改善し、無傷の組織上の構造情報の抽出を可能にした1,2。光学的クリアリング技術は、潜在的にスピードアップし、組織学的分析のコストを削減する可能性があります。現在、3つの主要なクリアリングアプローチが利用可能である:親水性、疎水性、およびヒドロゲルベースの方法1,2。親水性アプローチは、蛍光シグナルおよび組織の完全性を維持する上で凌駕し、他の2つのアプローチと比較して毒性が低い3、4。
親水性透明化法であるScaleSは、構造的および分子的完全性の保持と強力な透明化能力(透明化保存スペクトル)により、独特の地位を占めています5。以前の研究では、Sca l eS6の透明化手順を変更することによって、組織スライス(〜1mm厚)に対する迅速で等尺性透明化プロトコルScaleSFを開発しました。このクリアリングプロトコルは、10.5〜14.5時間の間、3つの溶液中で脳スライスのシーケンシャルインキュベーションを必要とする。電子顕微鏡(EM)分析(補足図1)にも対応可能な高透明保存スペクトルを特長とし、正確な信号再構成によるマルチスケールの高分解能3次元(3D)イメージングが可能6.したがって、ScaleSFは、特に神経細胞が途方もない長さの熱狂的なプロセスを精巧にし、情報を送受信するための特殊な微細な細胞下構造を配置する脳において有効であるはずである。神経細胞の回路レベルから細胞内レベルまでのスケールで構造情報を抽出することは、脳機能の理解を深めるために非常に有用です。
ここでは、ScaleSFを用いて、中視/回路から微視/細胞内レベルまでのスケールでニューロン構造を視覚化するための詳細なプロトコルを提供します。プロトコールには、組織調製、組織清澄化、透明化組織の取り扱い、および清澄組織における共焦点レーザー走査顕微鏡(CLSM)イメージングが含まれる。私たちのプロトコルは、回路から細胞内成分スケールまでのニューロン構造を調べることに焦点を当てています。マウス脳へのアデノ随伴ウイルス(AAV)ベクターの溶液の調製および定位注射のための詳細な手順については、それぞれMiyawaki et al. 20167 およびOkamoto et al. 20218を参照されたい。
プロトコル
すべての実験は順天堂大学施設動物管理利用委員会(承認第2021245号2021246)により承認され、日本学術会議「動物実験の適正な実施のための基本指針」(2006年)に従って実施された。ここでは、増強緑色蛍光タンパク質(EGFP)遺伝子を搭載したAAVベクターを注射した雄C57BL/6Jマウスと、パルブアルブミン(PV)/ミリストイル化-EGFP-低密度リポタンパク質受容体C末端細菌人工染色体(BAC)トランスジェニックマウス(PV-FGLマウス)9 を用いた。PV-FGLマウスは、C57BL/6Jバックグラウンドで維持した。この研究に関して性別に基づく差は見つからなかった。
1. 組織調製
- 灌流固定
メモ: ヒュームフードで手順 1.1.1 ~ 1.1.3 を実行して、パラホルムアルデヒド(PFA)への曝露を制限します。- 成体雄マウス(8〜16週齢)をペントバルビタールナトリウム(200mg / kg)の過剰摂取の腹腔内注射によって麻酔する。つま先ピンチ離脱およびまばたき反射の欠如によって麻酔の妥当性を確認する。
- 胸腔を開き、外科用はさみで右心房付属器を切断する。20 mL シリンジに取り付けられた 23 G 針を使用して、マウスに 20 mL の氷冷リン酸緩衝液生理食塩水 (PBS) を灌流し、続いて、別の 20 mL シリンジを使用して 0.1 M リン酸緩衝液 (PB) 中の 20 mL の氷冷 4% PFA を灌流します。
注意:PFAは毒性があり、催奇形性です。吸入や皮膚、目、粘膜との接触を避けてください。 - ピンセットで頭蓋骨から脳組織を取り除きます。脳組織を0.1 M PB中の4% PFAを含む15 mLチューブに移し、サンプルを光から保護し、50~100 rpmのシェーカー上で4°Cで一晩静かに揺らします。
- 注:採取した脳組織は、4°CのPBS中の0.02%アジ化ナトリウム(NaN3)に数週間保存することができます。
警告: NaN3 は有毒です。吸入や皮膚、目、粘膜との接触を避けてください。ヒュームフードの中でそれを扱います。
- 脳スライス調製
- 50 mLのPBSに2 gの寒天を加えてPBS中の4%寒天を調製する。寒天が完全に溶解するまで混合物をマイクロ波で送る。溶液を40〜45°Cに冷却する。
注:寒天の主要成分であるアガロペクチンによって提供される粘性特性は、組織スライスの切断の容易さを改善する。 - 10 mLの寒天溶液を6穴培養プレートに加える。鉗子を用いて脳組織を寒天溶液に沈める。寒天を氷上で固めましょう。
- 埋め込まれた脳組織を井戸から取り除き、カミソリの刃で寒天をトリミングします。寒天ブロックをスーパーグルーでビブラトーム浴の底に固定し、バッファートレイに0.1 M PBを注ぎます。
- エタノールに浸した糸くずの出ないティッシュペーパーを使用して別のカミソリの刃を清掃し、振動するティッシュスライサーのブレードホルダーにブレードを取り付けます。
- 切片速度を振幅1.4mmで0.14mm/s、周波数を75~77Hzに設定し、脳組織を厚さ1mmのスライスに切断し、PBSを含む6ウェル細胞培養プレートにスライスを採取します。
注:脳スライスは、4°CでPBS中の0.02%NaN3 で数週間保存することができます。
- 50 mLのPBSに2 gの寒天を加えてPBS中の4%寒天を調製する。寒天が完全に溶解するまで混合物をマイクロ波で送る。溶液を40〜45°Cに冷却する。
2. 組織清澄化
注:使用したScaleSソリューションの組成を 表1に記載する。サンプルはホイルで覆うことで光から保護する必要があります。クリアー・ステップを 図 1A に示します。
- 6ウェル細胞培養プレートの1つのウェルに8mLのSca l eS0溶液を加え、プレートの別のウェルに8mLのScaleS4溶液を加え、インキュベーター内で37°Cに予備加温した。
- 脳スライスをヘラで予め加温したScaleS0溶液に移し、90rpmの振とうインキュベーター内で37°Cで2時間インキュベートする。
- 透過処理した脳スライスを8 mLのPBS(–)でヘラ付きの6ウェル細胞培養プレートに移し、オービタルシェーカーで40~60 rpmに保ちながら15分間洗浄します。これを 2 回繰り返します。
- 脳スライスを、予め加温した8mLのScaleS4溶液にヘラで移し、振とうインキュベーター内で90rpmで37°Cで8〜12時間インキュベートすることによってそれらをクリアする。 クリアされた脳のスライスを 図1に示します。
3. ブレインスライスマウント
メモ:カスタマイズ可能なイメージングチャンバは、クリアされた脳スライスを確実に取り付けるために使用されます(図2)6。チャンバは、チャンバフレームとボトムカバースリップで構成されています。顕微鏡ステージアダプターは、イメージングチャンバーを顕微鏡ステージに直接取り付けるように設計されています(図2A、B)。チャンバーフレームと顕微鏡ステージアダプターは、社内または外部委託の3D印刷サービスを使用して3D印刷できます。撮像チャンバの3Dコンピュータ支援設計(CAD)データは、Furuta et al. 20226に提供されている。
- チャンバーの準備のために、粘着剤を使用してチャンバーフレームをカバースリップに取り付けます。
- 1.5%アガロースをScal eS4D25(0)溶液(ScaleS4ゲル)に調製するには、ボトル内の溶液100mLに1.5gのアガロースを加えます。アガロースが完全に溶解するまで溶液を攪拌し、電子レンジで送ることによって溶液をよく混合する。完了したら、溶液を37°Cまで冷却します。
- クリアした脳スライスをヘラでイメージングチャンバの底部カバースリップに取り付けます。透明なスライスから余分な溶液を、糸くずの出ないきれいなティッシュペーパーで拭き取ります。
- マイクロピペットを用いて脳スライス上にScaleS4ゲルを加え、画像化チャンバを充填する。鉗子で別のカバースリップを上に置き、糸くずの出ないティッシュペーパーとスライドガラスをこの順序でカバースリップの上に置きます。
- 撮像チャンバーを4°Cの冷蔵庫に移す。 スライドガラスに金属製の重りを置き、30分間放置します。
- 金属製のウェイト、スライドガラス、糸くずの出ないティッシュペーパー、カバースリップをイメージングチャンバーから取り出し、余分なゲルを拭き取ります(図2A、B)。
- イメージングチャンバを60mmガラスのシャーレに入れ、パテ状の感圧接着剤でイメージングチャンバの縁をディッシュに取り付けます。チャンバーをペトリ皿に複数のポイントで取り付けます。
- ScaleS4溶液を皿に注ぎ、40〜60rpmのオービタルシェーカー上で20〜25°Cで1時間穏やかに振る。新鮮な溶液で代用し、200 μLのピペットチップを使用して表面を静かにこすり取ることによってゲル表面の気泡を除去します。浸漬されたイメージングチャンバを顕微鏡ステージ上に取り付ける(図2C)。
4. CLSMイメージング
- 長作動距離(WD)の多液浸対物レンズを搭載したCLSMを用いて画像を取得します(16x/0.60開口数[NA]、WD=2.5mm)。
注: 高 NA 対物レンズは、回折制限の高い解像度を提供できます。 - 関連するすべてのイメージング機器(ワークステーション、顕微鏡、スキャナー、レーザー、水銀灯)の電源を入れ、CLSMイメージングソフトウェアを起動します。
- マルチ液浸対物レンズの補正カラーを1.47に設定します。ScaleS4溶液は、約1.47 5,7の屈折率(RI)を有する。RIミスマッチによる収差は、画像形成を妨げる可能性があります(図3)。
- 対物レンズを溶液に浸し、ゆっくりとスライスに近づけます。対物レンズの先端に付着した気泡を取り除きます。エピ蛍光を使用して、クリアされた組織内の関心領域(ROI)を見つけます。
- 適切な設定をテストして、画像取得パラメータを設定します。
- 画像集録のビット深度を決定します。画像のデータサイズは、ビット深度とともに増加します。
- 検出波長を設定します。発光スペクトルに応じて検出器の適切なゲートを調整します。検出波長がレーザーラインをカバーしていないことを確認します。
- xy 解像度を設定します。形式が大きいほど xy 解像度は高くなりますが、画像の収集に時間がかかります。
- スキャン速度を設定します。スキャン速度が遅いほど、信号対雑音比が高くなります。しかし、それはまた、ピクセル滞留時間とフォトブリーチングのリスクを増加させます。それに応じて選択してください。
- ピンホールのサイズを調整します。ピンホールサイズは、光学断面の厚さを制御します。ピンホールサイズが小さいほど光学セクションが薄くなり、 z 分解能が向上しますが、蛍光シグナルは減少します。ピンホールサイズを大きくすると、より強い蛍光シグナルを持つより厚い光学セクションが得られます。
- レーザー出力、検出器/アンプゲイン、オフセットを設定します。適切な画像が得られるまで、レーザー出力と検出器/アンプのゲインを徐々に上げます。高いレーザー出力は、フォトブリーチングのリスクを伴います。オフセット(コントラスト)を適切に調整して、高い信号対雑音比を得ます。
- ROI のサイズに基づいて必要な耕作領域を決定します。ROIの全長と幅がキャプチャされていることを確認します。
- クリアした組織をすべての平面でナビゲートし、スタックの始点と終点を設定します。Z ステップ サイズを目的の Z 解像度に応じて設定します。
- 画像取得設定に満足したら画像を収集し、キャプチャした画像を記録します。画像解析ソフトウェアを使用して画像を処理します。
結果
1−mm厚さのマウス脳スライスの光学的透明化は、このプロトコールを用いて達成された。 図1B は、クリアリング処理前後のマウス脳スライスの透過像を表す。組織透明化法は、厚さ1mmのマウス脳スライスを透明にした。脳スライスの最終サイズのわずかな拡大は、透明化溶液中で12時間インキュベーションした後に見出された(線膨張:102.5%±1.3%)。組織の蛍光および構造的完全性の保存を、PV−FGLマウスにおける原形質膜における標的EGFP発現を用いて評価した(図1C)。これらのマウスにおいて、ソマトデンドライト膜標的EGFPはPV陽性ニューロン9において発現される。ソマトデンドライト領域における原形質膜を標的としたEGFP発現は、処理後も維持された(図1C)。さらに、以前のEM研究は、ScaleSFでクリアされた脳組織において、よく保存された構造的完全性を示している(補足図1)6。
RIの不一致による収差は、画像の明るさと解像度の顕著な損失を引き起こしました(図3)。厚さ1mmのPV-FGLマウスの脳スライスをクリアし、長いWDのマルチ浸漬対物レンズを備えたCLSM下で撮像した。対物レンズの補正襟を水の位置(RI 1.33)に調整すると、低輝度と低コントラストのために400μmと800μmの深さに位置するEGFP陽性ニューロンの明確な視覚化が妨げられた。(図3A、C)。これらのニューロンは、ScaleS4溶液と一致するように補正首輪を調整したときに、同じCLSMで明確に視覚化された(RI 1. 図3B、D)。液浸液と対物レンズの間のRIマッチングは、光学的に除去された組織における正確な3Dイメージングに不可欠です。
最後に、マウス新皮質ニューロンを、プロトコールの実現可能性を実証するために利用した。初代体性感覚皮質(S1)にAAV2/1-SynTetOff-EGFPベクター10 を注射したマウス脳を、0.1M PB中の4%PFAで固定した。1mm厚の冠状スライスを、振動組織スライサーを用いて脳から調製した。透明化および画像化チャンバーへの装着後、新皮質ニューロンを標的としたニューロンイメージングが実施された(図4)。厚さ1mmの脳スライスにおけるEGFP標識ニューロンの3D再構成を 図4Aに示す。より高い倍率の画像は、樹枝状棘で装飾された個々の樹状樹木を示す(図4B)。我々はさらに、対側皮質における軸索終末樹木化および軸索ブートンを示した(図4C)。
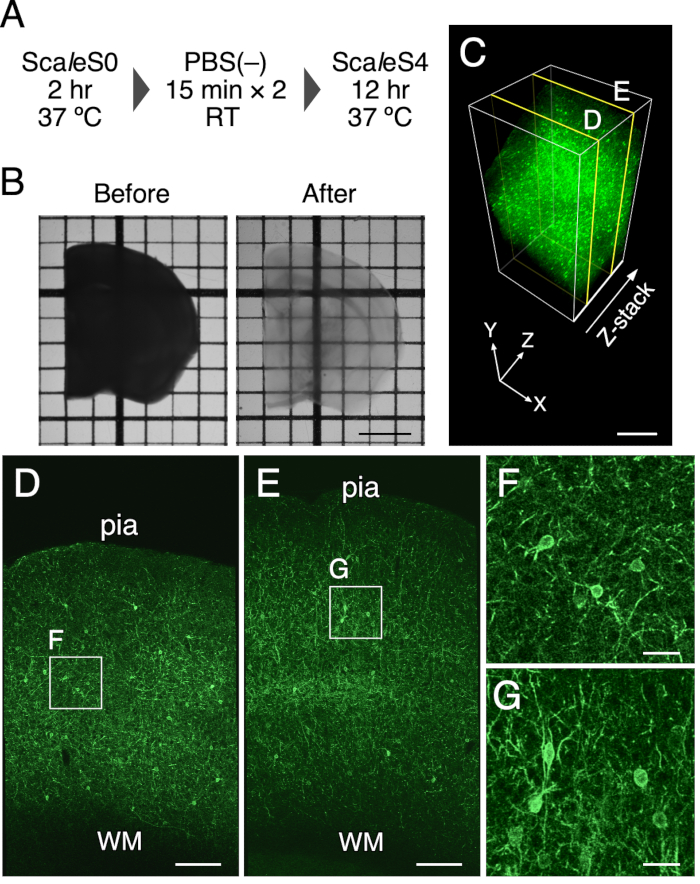
図1:厚さ1mmのマウス脳スライスの光学的クリアリング。 (A)ScaleSF組織クリアリングのスケジュール。(B)治療前(左)と治療後(右)の厚さ1mmの脳スライスの透過像。(C)組織クリアリング法を用いてクリアしたPV-FGLマウスの大脳皮質の3Dボリュームレンダリング。(D,E)250 μm (D) および 750 μm (E) の深さでの (C) の xy 画像。(F,G)(D)および(E)で概説された長方形の拡大図。(C-G)に表示される画像は、レンダリング処理の前にデコンボリューションされます。略語: pia = pia mater, WM = 白質。スケールバー:(B)で2 μm、(C)で500 μm、(D,E)で200 μm、および(F,G)で40 μm。この図は、Furata et al. 2022 6から修正されたものである。 この図の拡大版を表示するには、ここをクリックしてください。
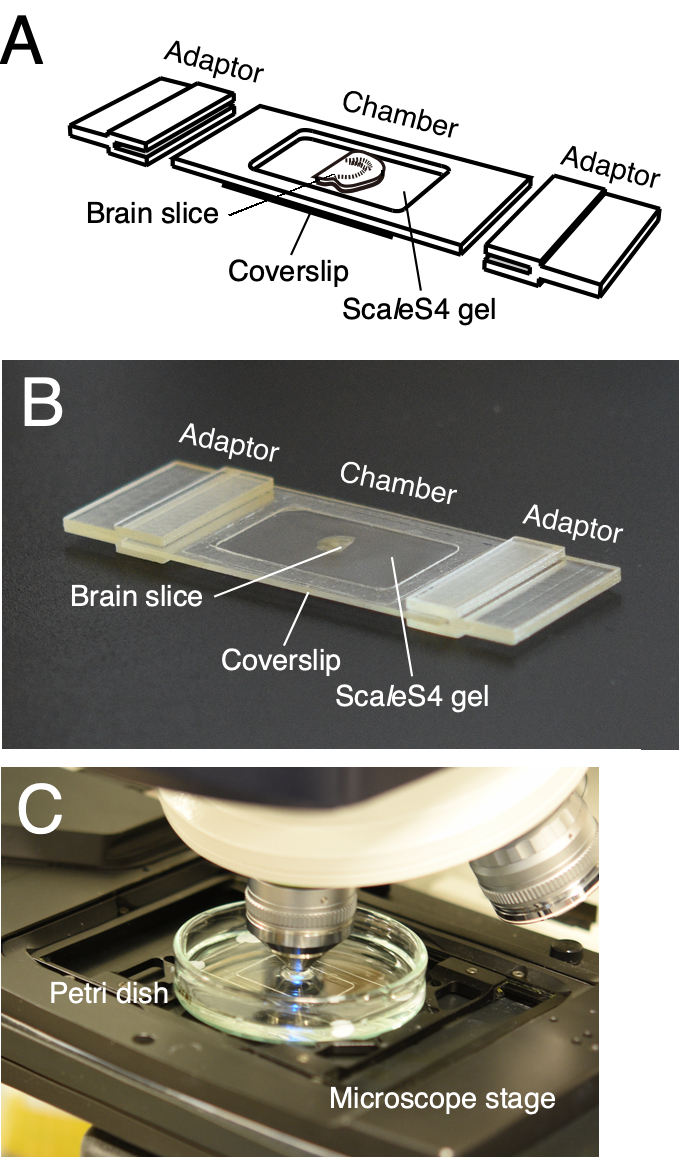
図 2: 組織スライスの視覚化用にカスタマイズ可能な 3D プリント イメージング チャンバー。(A,B) カスタマイズ可能な 3D プリント イメージング チャンバのスキーマ図 (A) と画像 (B)。撮像チャンバは、チャンバフレーム、ボトムカバースリップおよび顕微鏡ステージアダプタから構成される。透明化された組織スライスを底部カバースリップ上に置き、ScaleS4ゲルに包埋する。チャンバーフレーム、ボトムカバースリップ、顕微鏡ステージアダプターは、組織スライスのサイズと厚さに応じてカスタマイズ可能です。(C)イメージングチャンバを備えたイメージングセットアップ。画像化チャンバを、ペトリ皿中のScaleS4溶液に浸漬し、直立したCLSMのステージに取り付けた。この図は、Furata et al. 2022 6から修正されたものである。この図の拡大版を表示するには、ここをクリックしてください。

図3:対物レンズとScエールS4溶液との間のRIの不一致によって引き起こされる深部イメージングの妥協。 (A-D)400μm(A,B)および800μm(C,D)の深さにおけるPV-FGLマウスの大脳皮質のxy画像。マルチ液浸対物レンズの襟の補正は、1.33インチ(A,C)と1.47インチ(B,D)に調整されます。画像は、対物レンズのRIを除いて同じパラメータで取得される。スケール バー: 50 μm。この図の拡大版を表示するには、ここをクリックしてください。

図4:ScaleSFでクリアした厚さ1mmのマウス脳スライスにおけるニューロンイメージング。 (a)S1におけるEGFP標識マウス新皮質ニューロンの3Dボリュームレンダリング。新皮質ニューロンは、AAV2/1 SynTetOff-EGFPベクターで標識されている。(b)EGFP標識新皮質ニューロンの樹状樹状樹木。39μmから48μmの深さからの最大強度投影(MIP)画像が表現される。矢印は樹状突起棘を示す。(c)対側皮質におけるEGFP標識軸索末端。481.5μmから513μmの深さのMIP画像が表現される。矢印は軸索ブートンを示す。(B)と(C)に現れる画像はデコンボリューションされています。スケールバー:(A)で300μm、(C)で10μm。(C)のバーは(B)にも適用されます。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:ScaleSF、CUBIC、およびPACTでクリアされた脳スライスの超構造。 (A−C)ScaleSF(A)、キュービック(B)、およびPACTでクリアされたマウス大脳皮質の透過EM画像(C)。マウスの脳は、1%グルタルアルデヒドを含む4%PFAで固定される。超薄切片は、クリアされた脳スライスから調製される。膜構造は、CUBICおよびPACTでクリアされた脳スライス(B)およびPACTで重度の損傷を受ける。矢印はシナプス後膜を示す。スケールバー:500 nm。この図は、Furata et al. 2022 6から修正されたものである。 このファイルをダウンロードするには、ここをクリックしてください。
| ScaleSソリューションのレシピ | |
| ScaleS0 ソリューション | |
| 試薬 | 最終濃度 |
| D-ソルビトール | 20% (ワット/V) |
| グリセロール | 5% (ワット/V) |
| メチル-β-シクロデキストリン | 1 ミリオン |
| γ-シクロデキストリン | 1 ミリオン |
| ジメチルスルホキシド | 3% (v/v) |
| 10倍PBS(–) | 1倍速 |
| ScaleS4 ソリューション | |
| 試薬 | 最終濃度 |
| 尿素 | 4メートル |
| D-ソルビトール | 40% (税抜率) |
| グリセロール | 10% (ワット/バイ) |
| トリトンX-100 | 0.2% (ワット/V) |
| ジメチルスルホキシド | 25% (v/v) |
| ScaleS4D25(0) ソリューション | |
| 試薬 | 最終濃度 |
| 尿素 | 4メートル |
| D-ソルビトール | 40% (税抜率) |
| グリセロール | 10% (ワット/バイ) |
| ジメチルスルホキシド | 25% (v/v) |
表 1: 3 つの ScaleS ソリューションの構成。Sca l eS0、Sca l eS4、および ScaleS4D25(0) ソリューションの組成がリストされています。これらの溶液の調製のための詳細な手順については、Miyawaki et al. 20167を参照されたい。
ディスカッション
プロトコル内の重要なステップ
プロトコルには、意味のある結果を得るために細心の注意を払って実行する必要があるいくつかの重要なステップがあります。サンプルの均一な固定は、大規模組織内の3Dイメージングに不可欠です。対物レンズ、サンプル、および液浸液は、RI と一致する必要があります。それらの間のRIミスマッチは、クリアされた脳スライス内のEGFP発現細胞の画像化を高度に乱すことにつながる(図3)。対物レンズを液浸液に補正するカラー調整により、深さ誘起球面収差が最小限に抑えられ、3Dイメージングにおける信号、コントラスト、空間分解能が最大化されます。調製した溶液のRIsは、屈折計を用いて測定することができる。
手法のトラブルシューティング
溶液の長期保存は、透明化能力、および蛍光シグナルおよび構造的完全性の保存能力に影響を及ぼす可能性がある。新しく調製した溶液を使用する必要があります。これらの溶液は、4°Cで1ヶ月まで保存することができる。 アイソメーションは、正確な信号再構成を伴う効果的かつ効率的なニューロンイメージングに不可欠です。12時間のインキュベーション後にサンプルサイズのわずかな拡大が観察されたが(図1B)、8〜12時間のインキュベーション期間を短くすることによって膨張を制御することができる。より正確な 3D 深度イメージングを行うには、深さによる球面収差のために、補正カラーを特定の平面で調整する必要がある場合があります。
技術の変更
本研究では、マウスの脳組織を利用して、プロトコールの実現可能性を実証した。しかし、ここで説明するプロトコルは、霊長類などの大脳動物にも使用できます。実際、このプロトコルは一般的なマーモセット(Callithrix jacchus)脳組織で使用されており、神経回路とその皮質膜回路の細胞内構造を同時に可視化することに成功しました6。顕微鏡ステージアダプタは、イメージングチャンバを顕微鏡ステージ6に直接取り付けるように設計されています(図2A、B)。透明化された組織スライスは、画像化チャンバの底部カバースリップを通して倒立顕微鏡を用いて観察可能である。PBS(-)(deSca l ing)5,11でクリアした脳組織を復元した後、ScaleSF(再切除)6でクリアした脳組織から20μm~50μmの厚さの組織切片を作製することができます。クリアされた組織内でキャプチャされた細胞内構造は、短いWDの高いNA対物レンズで再切片上で再び画像化することができる。ScaleSFは、光学的に除去された組織6におけるEM分析を可能にする高レベルの超微細構造保存を達成する(補足図1)。この方法のEM適合性は、巨視的レベルからナノスコピックレベルまでのスケールを有する構造をイメージングするために特に有用である。
技術の限界
ここで説明するプロトコルにより、回路から細胞内スケールまでのニューロン構造を、厚さ1mmの脳スライスで視覚化することができます。ただし、プロトコルには 3 つの制限が残っています。1 つ目は、クリアリング プロトコルのクリア機能です。ScaleSFは、脳全体ではなく、脳スライスのクリアリングプロトコルです。厚さ1mmの脳スライスは樹状突起および局所軸索樹木12についての十分な知識を提供することができるが、脳全体にまたがる軸索突起に関する情報は断片的であり、スライス13、14、15、16において不完全である。2つ目は、イメージング解像度です。ここで説明したプロトコルを用いて、樹状突起スパインや軸索ブートンなどの細胞内ニューロン構造を光学的にクリアした脳スライスで可視化することに成功しました(図4)。しかしながら、本研究で用いた対物レンズの解像度は、xy解像度が400〜750nmであり、神経細胞のより微細な構造を解像するには十分ではない。高NA対物レンズが通常油浸(RI 1.52)用に設計されていることを考えると、RIと溶液の不一致(RI 1.47)により、これらの対物レンズでの高解像度イメージングが妨げられる可能性があります。3つ目は、神経細胞の蛍光タンパク質標識です。ラベリング方法は、当社のイメージング技術の幅広い用途を制限します。組織の完全性を維持しながら大規模な組織を標識する組織化学的および/または免疫組織化学的技術は、ここで提供されるプロトコルを著しく進歩させるであろう。
既存の方法と技術の将来の応用に関する意義
本研究では、Sca l eSF組織クリアリングを用いたメゾスコピックから顕微鏡的構造へのニューロンイメージングのための詳細なプロトコールを記載する。ここで説明するプロトコルは、特殊な機器なしで、回路レベルから細胞下レベルまでのニューロン構造を妥当な時間で視覚化することを可能にし、回路からコンポーネントスケールまでのニューロン構造の理解を容易にする。ニューロンは、途方もない長さの熱狂的なプロセスを精巧にし、情報を送受信するための特殊な微細構造を配置します。したがって、ニューロンイメージングには、強力なクリアリング能力を発揮する組織クリアリング方法と、大規模および小規模の両方の構造を同時に可視化するための高レベルの組織保存が必要です。しかしながら、高い透明化能力を有する組織透明化方法は、広範な組織清澄化のために脂質および色素を積極的に除去し3、4、組織完全性を損ないます5、6、17(補足図1)。これは、高レベルの構造保存6(補足図1)を達成するここで使用されるクリアリングプロトコルとはまったく対照的である。したがって、ScaleSF組織クリアリングは、正確な信号再構成を伴うマルチスケール高解像度3Dイメージングを必要とする効果的かつ効率的なニューロンイメージングを可能にします。
開示事項
著者らは開示するものは何もありません。
謝辞
著者らは、AAVベクター作製に石田洋子(順天堂大学)と技術支援を寄せた星野喜晃氏(順天堂大学)に感謝の意を表した。本研究は、日本学術振興会科学研究費補助金(JP20K07231 to K.Y.;JP21H03529 から T.F. まで;JP20K07743 から M.K.;JP21H02592 から H.H.)革新的領域「共鳴バイオ」に関する科学的研究(JP18H04743からH.H.へ)。本研究は、国立研究開発法人日本医療研究開発機構(AMED)(JP21dm0207112 to T.F.およびH.H.)、科学技術振興機構(JST)のMoonshot R&D(JPMJMS2024 to H.H.)、JSTのFusion Oriented Research for Disruptive Science and Technology(FOREST)(JPMJFR204D to H.H.)、順天堂大学医学部老年期疾病研究所の助成金(X2016 to K.Y.;X2001 to H.H.)、および私立学校ブランディングプロジェクト。
資料
| Name | Company | Catalog Number | Comments |
| 16x multi-immersion objective lens | Leica Microsystems | HC FLUOTAR 16x/0.60 IMM CORR VISIR | |
| Agar | Nacalai Tesque | 01028-85 | |
| Agarose | TaKaRa Bio | L03 | |
| Dimethyl sulfoxide | Nacalai Tesque | 13407-45 | |
| D-Sorbitol | Nacalai Tesque | 06286-55 | |
| γ-cyclodextrin | Wako Pure Chemical Industries | 037-10643 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Huygens Essential | Scientific Volume Imaging | ver. 18.10.0p8/21.10.1p0 64b | |
| Imaris | Bitplane | ver. 9.0.0 | |
| Leica Application Suite X | Leica Microsystems | LAS X, ver. 3.5.5.19976 | |
| Methyl-β-cyclodextrin | Tokyo Chemical Industry | M1356 | |
| Paraformaldehyde | Merck Millipore | 1.04005.1000 | |
| Phosphate Buffered Saline (10x; pH 7.4) | Nacalai Tesque | 27575-31 | 10x PBS(–) |
| Sodium azide | Nacalai Tesque | 31233-55 | |
| Sodium pentobarbital | Kyoritsu Seiyaku | N/A | |
| TCS SP8 | Leica Microsystems | N/A | |
| Triton X-100 | Nacalai Tesque | 35501-15 | |
| Urea | Nacalai Tesque | 35940-65 | |
| Vibrating tissue slicer | Dosaka EM | PRO7N |
参考文献
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chemical Biology. 23 (1), 137-157 (2016).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annual Reviews of Cell and Developmental Biology. 32, 713-741 (2016).
- Ueda, H. R., et al. Whole-brain profiling of cells and circuits in mammals by tissue clearing and light-sheet microscopy. Neuron. 106 (3), 369-387 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews. Neuroscience. 21 (2), 61-79 (2020).
- Hama, H., et al. ScaleS: an optical clearing palette for biological imaging. Nature Neuroscience. 18 (10), 1518-1529 (2015).
- Furuta, T., et al. Multi-scale light microscopy/electron microscopy neuronal imaging from brain to synapse with a tissue clearing method, ScaleSF. iScience. 25 (1), 103601 (2022).
- Miyawaki, A., et al. Deep imaging of cleared brain by confocal laser-scanning microscopy. Protocol Exchange. , (2016).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protocols. 2 (1), 100230 (2021).
- Kameda, H., et al. Parvalbumin-producing cortical interneurons receive inhibitory inputs on proximal portions and cortical excitatory inputs on distal dendrites. The European Journal of Neuroscience. 35 (6), 838-854 (2012).
- Sohn, J., et al. A single vector platform for high-level gene transduction of central neurons: Adeno-associated virus vector equipped with the Tet-off system. PLoS One. 12 (1), 0169611 (2017).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14 (11), 1481-1488 (2011).
- Stepanyants, A., Martinez, L. M., Ferecsko, A. S., Kisvarday, Z. F. The fractions of short- and long-range connections in the visual cortex. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3555-3560 (2009).
- Kuramoto, E., et al. Two types of thalamocortical projections from the motor thalamic nuclei of the rat: a single neuron-tracing study using viral vectors. Cerebral Cortex. 19 (9), 2065-2077 (2009).
- Matsuda, W., et al. Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nature Methods. 15 (12), 1033-1036 (2018).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6, 34331 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved