Method Article
Une méthode de nettoyage des tissus pour l’imagerie neuronale des échelles mésoscopiques aux échelles microscopiques
Dans cet article
Résumé
Le protocole fournit une méthode détaillée d’imagerie neuronale dans une tranche de cerveau à l’aide d’une méthode de nettoyage destissus, Sca l eSF. Le protocole comprend la préparation des tissus cérébraux, la clarification des tissus, la manipulation des tranches nettoyées et l’imagerie par microscopie confocale à balayage laser des structures neuronales, des niveaux mésoscopiques aux niveaux microscopiques.
Résumé
Un protocole détaillé est fourni ici pour visualiser les structures neuronales des niveaux mésoscopiques aux niveaux microscopiques dans les tissus cérébraux. Les structures neuronales allant des circuits neuronaux aux structures neuronales subcellulaires sont visualisées dans des tranches de cerveau de souris optiquement nettoyées avec ScaleSF. Cette méthode de nettoyage est une version modifiée de ScaleS et est une méthode de nettoyage des tissus hydrophiles pour les tranches de tissu qui permet d’obtenir une capacité de nettoyage puissante ainsi qu’un haut niveau de préservation des signaux de fluorescence et de l’intégrité structurelle. Une chambre d’imagerie tridimensionnelle (3D) personnalisable est conçue pour un montage fiable des tissus cérébraux nettoyés. Les cerveaux de souris injectés avec un vecteur viral adéno-associé porteur d’un gène de protéine fluorescente verte amélioré ont été fixés avec 4% de paraformaldéhyde et coupés en tranches de 1 mm d’épaisseur avec une trancheuse de tissu vibrante. Les tranches de cerveau ont été éliminées en suivant le protocole de nettoyage, qui comprend des incubations séquentielles dans trois solutions, à savoir la solution ScaleS0, la solution saline tampon phosphate (–) et la solution ScaleS4, pour un total de 10,5 à 14,5 h. Les tranches de cerveau nettoyées ont été montées sur la chambre d’imagerie et incorporées dans du gel d’agarose à 1,5% dissous dans la solution ScaleS4D25(0). L’acquisition d’images 3D des tranches a été réalisée à l’aide d’un microscope à balayage laser confocal équipé d’une lentille d’objectif multi-immersion d’une longue distance de travail. En commençant par l’imagerie neuronale mésoscopique, nous avons réussi à visualiser de fines structures neuronales subcellulaires, telles que les épines dendritiques et les boutons axonaux, dans les tranches de cerveau optiquement dégagées. Ce protocole faciliterait la compréhension des structures neuronales des circuits aux échelles des composants subcellulaires.
Introduction
Les méthodes de nettoyage des tissus ont amélioré l’imagerie indépendante de la profondeur des échantillons biologiques et cliniques avec la microscopie optique, permettant l’extraction d’informations structurelles sur des tissus intacts 1,2. Les techniques de nettoyage optique pourraient également accélérer et réduire le coût de l’analyse histologique. À l’heure actuelle, trois grandes approches de défrichage sont disponibles : les méthodeshydrophiles, hydrophobes et à base d’hydrogel 1,2. Les approches hydrophiles surpassent en préservant les signaux de fluorescence et l’intégrité des tissus et sont moins toxiques que les deux autres approches 3,4.
Une méthode de nettoyage hydrophile, ScaleS, occupe une position distinctive avec sa préservation de l’intégrité structurelle et moléculaire ainsi que sa puissante capacité de nettoyage (spectre de clairance-préservation)5. Dans une étude précédente, nous avons développé un protocole de nettoyage rapide et isométrique, ScaleSF, pour les tranches de tissu (~1 mm d’épaisseur) en modifiant la procédure de nettoyage de ScaleS6. Ce protocole de nettoyage nécessite des incubations séquentielles de tranches de cerveau dans trois solutions pendant 10,5 à 14,5 h. La méthode est dotée d’un spectre de conservation de clairance élevé, compatible même avec l’analyse par microscopie électronique (EM) (figure supplémentaire 1), permettant une imagerie tridimensionnelle (3D) haute résolution à plusieurs échelles avec une reconstruction précise du signal6. Ainsi, ScaleSF devrait être efficace en particulier dans le cerveau, où les cellules neuronales élaborent des processus exubérants d’une longueur énorme et organisent des structures subcellulaires fines spécialisées pour transmettre et recevoir des informations. L’extraction d’informations structurelles avec des échelles allant du circuit aux niveaux subcellulaires sur les cellules neuronales est très utile pour mieux comprendre les fonctions cérébrales.
Ici, nous fournissons un protocole détaillé pour visualiser les structures neuronales avec des échelles allant du niveau mésoscopique / circuit au niveau microscopique / subcellulaire en utilisant ScaleSF. Le protocole comprend la préparation des tissus, la clarification des tissus, la manipulation des tissus nettoyés et l’imagerie par microscopie confocale à balayage laser (CLSM) des tissus nettoyés. Notre protocole se concentre sur l’interrogation des structures neuronales des circuits aux échelles des composants subcellulaires. Pour une procédure détaillée de préparation des solutions et d’injection stéréotaxique de vecteurs du virus adéno-associé (AAV) dans le cerveau des souris, se référer à Miyawaki et al. 20167 et Okamoto et al. 20218, respectivement.
Protocole
Toutes les expériences ont été approuvées par les comités institutionnels de soins et d’utilisation des animaux de l’Université Juntendo (approbation n° 2021245, 2021246) et réalisées conformément aux Directives fondamentales pour la bonne conduite des expériences sur les animaux par le Conseil scientifique du Japon (2006). Ici, des souris mâles C57BL/6J injectées avec un vecteur AAV porteur du gène de la protéine fluorescente verte améliorée (EGFP) et de la parvalbumine (PV)/myristoylation-EGFP-récepteur des lipoprotéines de basse densité C-terminal chromosome artificiel bactérien (BAC) souris transgéniques (souris PV-FGL)9 ont été utilisées. Les souris PV-FGL ont été maintenues en fond C57BL/6J. Aucune différence fondée sur le sexe n’a été observée en ce qui concerne cette étude.
1. Préparation des tissus
- Fixation par perfusion
REMARQUE : Effectuer les étapes 1.1.1 à 1.1.3 dans une hotte pour limiter l’exposition au paraformaldéhyde (PFA).- Anesthésier des souris mâles adultes (âgées de 8 à 16 semaines) par injection intrapéritonéale de surdosage de pentobarbital de sodium (200 mg/kg). Confirmer l’adéquation de l’anesthésie par l’absence de sevrage par pincement des orteils et de réflexes de clignement des yeux.
- Ouvrez la cavité thoracique et coupez l’appendice auriculaire droit avec des ciseaux chirurgicaux. Perfuser les souris avec 20 mL de solution saline tampon phosphate glacée (PBS) à l’aide d’une aiguille de 23 G attachée à une seringue de 20 mL, suivie d’une perfusion de 20 mL de PFA glacé à 4 % dans un tampon phosphate (PB) glacé à l’aide d’une autre seringue de 20 mL.
ATTENTION : Le PFA est toxique et tératogène. Évitez l’inhalation ou le contact avec la peau, les yeux et les muqueuses. - Retirez les tissus cérébraux du crâne avec une pince à épiler. Transférer les tissus cérébraux dans un tube de 15 mL contenant 4 % de PFA dans 0,1 M PB, protéger les échantillons de la lumière et basculer doucement pendant la nuit à 4 °C sur un agitateur à 50-100 tr/min.
- REMARQUE: Les tissus cérébraux récoltés peuvent être conservés pendant plusieurs semaines dans de l’azoture de sodium à 0,02% (NaN3) dans du PBS à 4 ° C.
ATTENTION : NaN3 est toxique. Évitez l’inhalation ou le contact avec la peau, les yeux et les muqueuses. Manipulez-le à l’intérieur d’une hotte aspirante.
- Préparation de tranches de cerveau
- Préparer une gélose à 4 % dans du PBS en ajoutant 2 g de gélose à 50 mL de PBS. Cuire le mélange au micro-ondes jusqu’à ce que la gélose soit complètement dissoute. Laisser refroidir la solution à 40-45 °C.
REMARQUE: La propriété visqueuse fournie par l’agaropectine, un composant majeur de la gélose, améliore la facilité de coupe des tranches de tissu. - Ajouter 10 mL de la solution de gélose à une plaque de culture à 6 puits. Immergez le tissu cérébral dans la solution d’agar à l’aide de pinces. Laissez la gélose se solidifier sur la glace.
- Retirez le tissu cérébral incrusté du puits et coupez la gélose avec une lame de rasoir. Fixez le bloc de gélose sur le fond du bain vibratome avec de la superglue et versez 0,1 M PB dans le bac tampon.
- Nettoyez une autre lame de rasoir à l’aide d’un papier de soie non pelucheux imbibé d’éthanol et fixez la lame au support de lame de la trancheuse de tissu vibrante.
- Réglez la vitesse de sectionnement à 0,14 mm/s avec une amplitude de 1,4 mm et la fréquence à 75–77 Hz. Coupez le tissu cérébral en tranches de 1 mm d’épaisseur et collectez les tranches dans une plaque de culture cellulaire de 6 puits contenant du PBS.
REMARQUE: Les tranches de cerveau peuvent être stockées pendant plusieurs semaines dans 0,02% NaN3 dans PBS à 4 ° C.
- Préparer une gélose à 4 % dans du PBS en ajoutant 2 g de gélose à 50 mL de PBS. Cuire le mélange au micro-ondes jusqu’à ce que la gélose soit complètement dissoute. Laisser refroidir la solution à 40-45 °C.
2. Clarification des tissus
NOTE: Les compositions des solutions ScaleS utilisées sont énumérées dans le tableau 1. Les échantillons doivent être protégés de la lumière en les recouvrant d’une feuille d’aluminium. Les étapes de compensation sont illustrées à la figure 1A.
- Ajouter 8 mL de solution ScaleS0 à un puits d’une plaque de culture cellulaire à 6 puits et ajouter 8 mL de solution ScaleS4 à un autre puits de la plaque et préchauffer à 37 °C dans un incubateur.
- Transférer les tranches de cerveau dans la solution préchauffée ScaleS0 à l’aide d’une spatule et incuber pendant 2 h à 37 °C dans un incubateur à agitation à 90 tr/min.
- Transférer les tranches de cerveau perméabilisées dans 8 mL de PBS(–) dans une plaque de culture cellulaire à 6 puits avec une spatule et laver pendant 15 min en les maintenant dans un shaker orbital à 40-60 tr / min. Répétez cette opération deux fois.
- Transférer les tranches de cerveau dans les 8 mL préchauffés de la solution ScaleS4 avec une spatule et les éliminer en les couplant dans un incubateur à agitation à 90 tr/min pendant 8–12 h à 37 °C. Une tranche de cerveau dégagée peut être vue à la figure 1.
3. Montage de tranches de cerveau
REMARQUE : Une chambre d’imagerie personnalisable est utilisée pour un montage fiable des tranches de cerveau nettoyées (Figure 2)6. La chambre se compose du cadre de la chambre et du couvercle inférieur. Les adaptateurs d’étage de microscope sont également conçus pour monter directement la chambre d’imagerie sur les étages de microscope (Figure 2A,B). Les adaptateurs de monture de chambre et d’étage de microscope peuvent être imprimés en 3D à l’aide de services d’impression 3D internes ou externalisés. Les données de conception assistée par ordinateur (CAO) 3D de la chambre d’imagerie sont fournies dans Furuta et al. 20226.
- Pour la préparation de la chambre, fixez le cadre de la chambre à un couvercle à l’aide d’un adhésif sensible à la pression.
- Préparer l’agarose à 1,5 % dans une solution ScaleS4D25(0) (gel ScaleS4) en ajoutant 1,5 g d’agarose à 100 mL de la solution dans un flacon. Bien mélanger la solution en remuant et la cuire au micro-ondes jusqu’à ce que l’agarose soit complètement dissoute. Une fois cela fait, laissez la solution refroidir à 37 °C.
- Montez la tranche de cerveau dégagée sur le couvercle inférieur de la chambre d’imagerie à l’aide d’une spatule. Essuyez l’excès de solution de la tranche nettoyée à l’aide d’un papier de soie propre et non pelucheux.
- Ajouter le gel ScaleS4 sur la tranche de cerveau à l’aide d’une micropipette pour remplir la chambre d’imagerie. Placez un autre couvercle sur le dessus avec une pince et placez un morceau de papier de soie non pelucheux et une glissière en verre sur le couvercle dans cet ordre.
- Transférer la chambre d’imagerie au réfrigérateur à 4 °C. Placez des poids métalliques sur la glissière en verre et laissez-les pendant 30 min.
- Retirez les poids métalliques, la lame de verre, le papier de soie non pelucheux et le couvercle de la chambre d’imagerie et essuyez l’excès de gel (Figure 2A, B).
- Placez la chambre d’imagerie dans une boîte de Petri en verre de 60 mm et fixez le bord de la chambre d’imagerie à la boîte avec un adhésif sensible à la pression semblable à du mastic. Fixez la chambre en plusieurs points à la boîte de Pétri.
- Verserlasolution Sca l eS4 dans le plat et agiter doucement pendant 1 h à 20-25 °C sur un agitateur orbital à 40-60 tr/min. Remplacer par une solution fraîche et éliminer les bulles d’air sur la surface du gel en grattant doucement la surface à l’aide d’une pointe de pipette de 200 μL. Montez la chambre d’imagerie immergée sur une scène de microscope (Figure 2C).
4. Imagerie CLSM
- Acquérir des images à l’aide d’un CLSM équipé d’un objectif multi-immersion d’une longue distance de travail (WD) (ouverture numérique 16x/0,60 [NA], WD = 2,5 mm).
REMARQUE: Les objectifs à NA élevé peuvent fournir une résolution élevée limitée par diffraction. - Allumez tous les équipements d’imagerie pertinents (station de travail, microscope, scanner, lasers et lampe au mercure) et lancez un logiciel d’imagerie CLSM.
- Réglez le collier de correction de l’objectif multi-immersion sur 1,47. La solution ScaleS4 a un indice de réfraction (RI) d’environ 1,47 5,7. Les aberrations induites par l’incompatibilité de RI peuvent perturber la formation de l’image (Figure 3).
- Immergez l’objectif dans la solution et laissez-le s’approcher lentement de la tranche. Retirez toutes les bulles d’air piégées sur la pointe de l’objectif. Trouvez des régions d’intérêt (ROI) dans les tissus nettoyés en utilisant l’épifluorescence.
- Définissez les paramètres d’acquisition d’image en testant les paramètres appropriés.
- Déterminez la profondeur de bits pour l’acquisition d’images. La taille des données de l’image augmente avec la profondeur de bits.
- Définissez la longueur d’onde de détection. Ajustez la grille appropriée pour le détecteur en fonction du spectre d’émission. Assurez-vous que la longueur d’onde de détection ne couvre aucune ligne laser.
- Définissez la résolution xy . Les formats plus grands offrent de meilleures résolutions xy , mais il faut plus de temps pour collecter les images.
- Définissez la vitesse d’analyse. Une vitesse de balayage plus lente fournit un rapport signal/bruit élevé. Cependant, il augmente également le temps de séjour des pixels et le risque de photoblanchiment. Choisissez en conséquence.
- Ajustez la taille du sténopé. La taille du sténopé contrôle l’épaisseur de la section optique. Une taille de sténopé plus petite crée une section optique plus mince, et donc une meilleure résolution z , mais réduit le signal de fluorescence. L’agrandissement de la taille du sténopé fournit une section optique plus épaisse avec un signal de fluorescence plus fort.
- Réglez la puissance du laser, le gain du détecteur / amplificateur et le décalage. Augmentez progressivement la puissance du laser et le gain du détecteur/amplificateur jusqu’à ce qu’une image appropriée soit obtenue. Une puissance laser élevée comporte le risque de photoblanchiment. Ajustez le décalage (contraste) de manière appropriée pour obtenir un rapport signal/bruit élevé.
- Déterminez la surface de labour nécessaire en fonction de la taille du retour sur investissement. Assurez-vous que toute la longueur et la largeur du retour sur investissement sont capturées.
- Naviguez dans les tissus dégagés dans tous les plans et définissez les points de départ et d’arrivée de la pile. Définissez la taille z-step en fonction de la résolution z souhaitée.
- Collectez des images lorsque vous êtes satisfait des paramètres d’acquisition d’images et enregistrez les images capturées. Traitez les images à l’aide d’un logiciel d’analyse d’images.
Résultats
Le nettoyage optique d’une tranche de cerveau de souris de 1 mm d’épaisseur a été réalisé à l’aide de ce protocole. La figure 1B représente les images de transmission d’une tranche de cerveau de souris avant et après le traitement de nettoyage. La méthode de nettoyage des tissus a rendu transparente une tranche de cerveau de souris de 1 mm d’épaisseur. Une légère expansion de la taille finale des tranches de cerveau a été constatée après l’incubation dans la solution de clairance pendant 12 h (expansion linéaire: 102,5% ± 1,3%). La préservation de la fluorescence et de l’intégrité structurelle des tissus a été évaluée avec une expression ciblée de l’EGFP dans la membrane plasmique chez les souris PV-FGL (Figure 1C). Chez ces souris, l’EGFP ciblant la membrane somatodendritique est exprimée dans les neurones PV positifs9. L’expression de l’EGFP ciblant la membrane plasmique dans la région somatodendritique a été maintenue après le traitement (Figure 1C). De plus, l’étude EM précédente montre une intégrité structurelle bien préservée dans les tissus cérébraux nettoyés avec ScaleSF (Figure supplémentaire 1)6.
Les aberrations induites par l’incompatibilité de l’IR ont entraîné une perte notable de luminosité et de résolution de l’image (Figure 3). Une tranche cérébrale de 1 mm d’épaisseur de souris PV-FGL a été nettoyée et imagée sous un CLSM équipé d’un objectif multi-immersion d’un long WD. L’ajustement du collier de correction de l’objectif à la position de l’objectif à la position de l’eau (RI 1.33) a entravé la visualisation claire des neurones EGFP positifs situés à des profondeurs de 400 μm et 800 μm en raison de la faible luminosité et du faible contraste. (Figure 3A,C). Ces neurones ont été clairement visualisés avec le même CLSM, lorsque le collier de correction a été ajusté pour correspondre à la solution ScaleS4 (RI 1.47; Figure 3B,D). L’appariement de l’IR entre un fluide d’immersion et une lentille d’objectif est essentiel pour une imagerie 3D précise dans les tissus optiquement nettoyés.
Enfin, des neurones néocorticaux de souris ont été utilisés pour démontrer la faisabilité du protocole. Un cerveau de souris injecté avec le vecteur AAV2/1-SynTetOff-EGFP10 dans le cortex somatosensoriel primaire (S1) a été fixé avec 4% de PFA dans 0,1 M PB. Des tranches coronales de 1 mm d’épaisseur ont été préparées à partir du cerveau avec une trancheuse de tissu vibrante. Après le nettoyage et le montage sur la chambre d’imagerie, une imagerie neuronale ciblant les neurones néocorticaux a été réalisée (Figure 4). Une reconstruction 3D de neurones marqués EGFP dans la tranche cérébrale de 1 mm d’épaisseur est représentée à la figure 4A. Une image à grossissement plus élevé montre des tonnelles dendritiques individuelles décorées d’épines dendritiques (Figure 4B). Nous avons également montré des arborisations terminales axonales et des boutons axonaux dans le cortex controlatéral (Figure 4C).
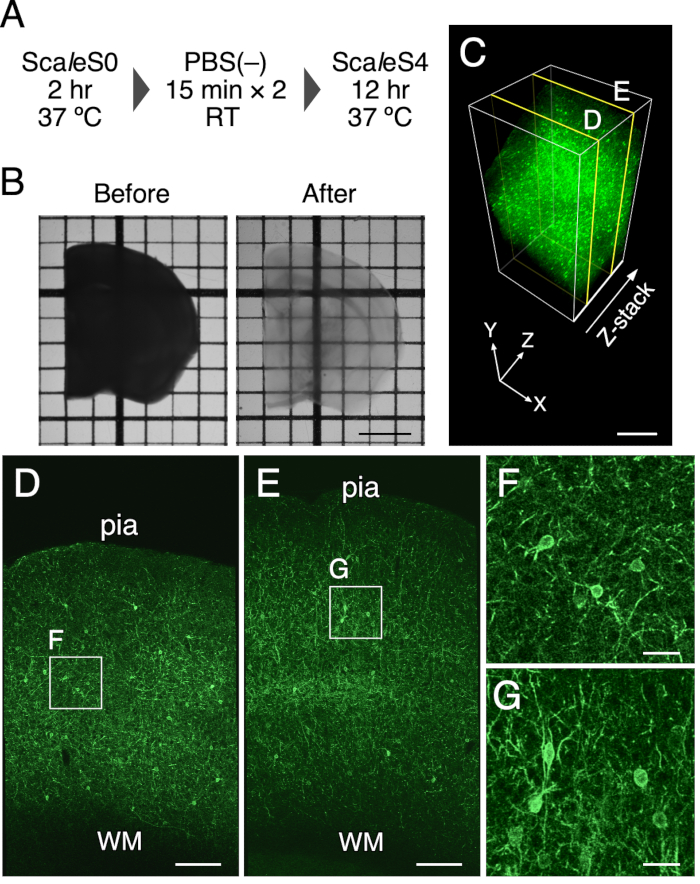
Figure 1: Nettoyage optique de tranches de cerveau de souris de 1 mm d’épaisseur. (A) Le calendrier de nettoyage des tissus ScaleSF. (B) Images de transmission d’une tranche de cerveau de 1 mm d’épaisseur avant (à gauche) et après (à droite) le traitement. (C) Un rendu volumique 3D du cortex cérébral d’une souris PV-FGL nettoyé à l’aide de la méthode de nettoyage des tissus. (D,E) xy images en (C) à des profondeurs de 250 μm (D) et 750 μm (E). (F,G) Vue agrandie des rectangles décrits en (D) et (E). Les images apparaissant en (C-G) sont déconvolutées avant le processus de rendu. Abréviations : pia = pia mater, WM = substance blanche. Barre d’échelle : 2 mm in (B), 500 μm in (C), 200 μm in (D,E) et 40 μm in (F,G). Ce chiffre a été modifié à partir de Furata et al. 20226. Veuillez cliquer ici pour voir une version agrandie de cette figure.
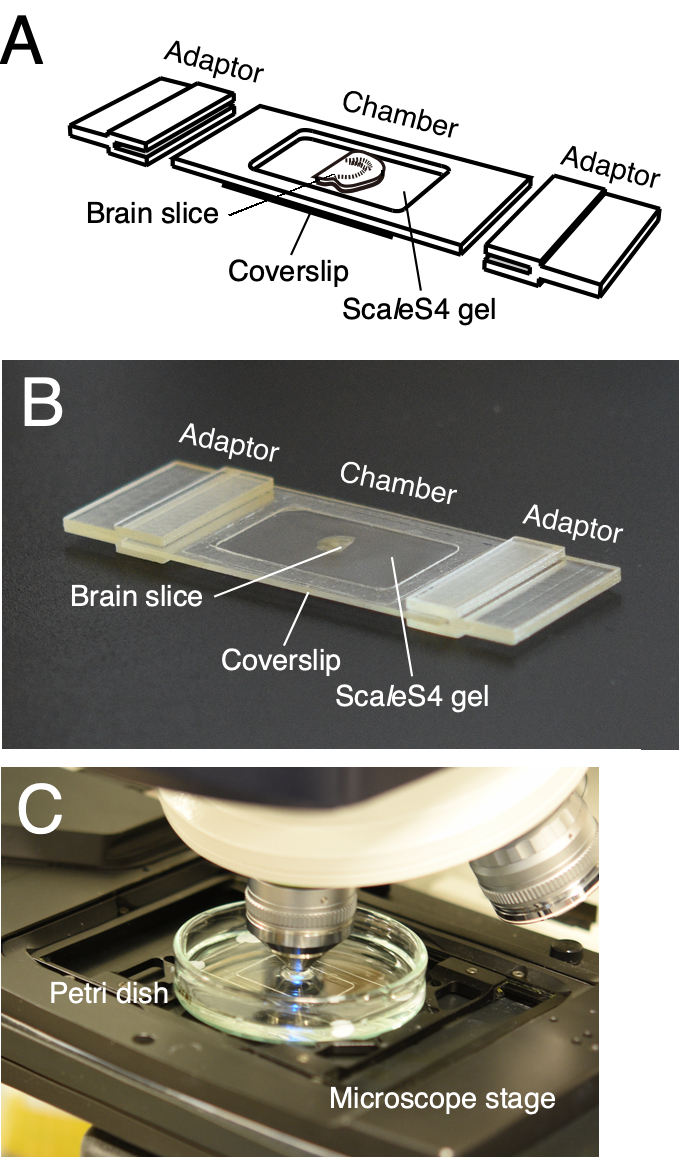
Figure 2 : Une chambre d’imagerie personnalisable imprimée en 3D pour la visualisation de tranches de tissu. (A,B) Dessin de schéma (A) et image (B) d’une chambre d’imagerie personnalisable imprimée en 3D. La chambre d’imagerie est composée d’un cadre de chambre, d’un couvercle inférieur et d’adaptateurs de scène de microscope. Les tranches de tissu nettoyées sont placées sur le couvercle inférieur et incorporées dans le gel ScaleS4. Le cadre de la chambre, le couvercle inférieur et les adaptateurs de scène de microscope sont personnalisables en fonction de la taille et de l’épaisseur des tranches de tissu. (C) Une installation d’imagerie avec la chambre d’imagerie. La chambre d’imagerie est immergée dans la solution ScaleS4 dans une boîte de Pétri et montée sur une scène d’un CLSM vertical. Ce chiffre a été modifié à partir de Furata et al. 20226. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Imagerie profonde compromise causée par une inadéquation de l’IR entre une lentille d’objectif et une solution ScaleS4. (A-D) images xy du cortex cérébral d’une souris PV-FGL à des profondeurs de 400 μm (A, B) et 800 μm (C, D). La correction du collier d’un objectif multi-immersion est ajustée à 1,33 po (A, C) et 1,47 po (B, D). Les images sont acquises avec les mêmes paramètres, à l’exception des RI de l’objectif. Barre d’échelle : 50 μm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.

Figure 4 : Imagerie neuronale dans une tranche de cerveau de souris de 1 mm d’épaisseur nettoyée avec ScaleSF. (A) Rendu de volume 3D de neurones néocorticaux de souris marqués EGFP dans le S1. Les neurones néocorticaux sont marqués avec le vecteur AAV2/1 SynTetOff-EGFP. (B) Tonnelles dendritiques de neurones néocorticaux marqués EGFP. Une image de projection d’intensité maximale (MIP) d’une profondeur de 39 μm à 48 μm est représentée. Les pointes de flèches indiquent des épines dendritiques. (C) Terminaux axonaux marqués EGFP dans le cortex controlatéral. Une image MIP d’une profondeur de 481,5 μm à 513 μm est représentée. Les pointes de flèche indiquent des boutons axonaux. Les images apparaissant en (B) et (C) sont déconvolutées. Barres d’échelle : 300 μm en (A) et 10 μm en (C). La barre en (C) s’applique également à (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1 : Ultrastructure dans les tranches de cerveau nettoyées avec ScaleSF, CUBIC et PACT. (A-C) Transmission d’images EM du cortex cérébral de la souris effacées avec ScaleSF (A), CUBIC (B) et PACT (C). Les cerveaux de souris sont fixés avec 4% de PFA contenant 1% de glutaraldéhyde. Les sections ultraminces sont préparées à partir de tranches de cerveau nettoyées. Les structures membranaires sont gravement endommagées dans les tranches de cerveau nettoyées avec CUBIC (B) et PACT (C). Les pointes de flèche indiquent des membranes postsynaptiques. Barre d’échelle: 500 nm. Ce chiffre a été modifié à partir de Furata et al. 20226. Veuillez cliquer ici pour télécharger ce fichier.
| Recettes pour les solutions ScaleS | |
| Solution ScaleS0 | |
| Réactif | Concentration finale |
| D-sorbitol | 20 % (p/v) |
| Glycérol | 5 % (p/v) |
| Méthyl-β-cyclodextrine | 1 mM |
| γ-cyclodextrine | 1 mM |
| Sulfoxyde de diméthyle | 3 % (v/v) |
| 10x PBS(–) | 1x |
| Solution ScaleS4 | |
| Réactif | Concentration finale |
| Urée | 4 M |
| D-sorbitol | 40 % (p/v) |
| Glycérol | 10 % (p/v) |
| Triton X-100 | 0,2 % (p/v) |
| Sulfoxyde de diméthyle | 25 % (v/v) |
| Solution ScaleS4D25(0) | |
| Réactif | Concentration finale |
| Urée | 4 M |
| D-sorbitol | 40 % (p/v) |
| Glycérol | 10 % (p/v) |
| Sulfoxyde de diméthyle | 25 % (v/v) |
Tableau 1: Composition des trois solutions ScaleS. Les compositions des solutions ScaleS0, ScaleS4 et ScaleS4D25(0) sont répertoriées. Pour une procédure détaillée de préparation de ces solutions, reportez-vous à Miyawaki et al. 20167.
Discussion
Étapes critiques du protocole
Il y a quelques étapes critiques dans le protocole qui doivent être menées avec la plus grande prudence pour obtenir des résultats significatifs. La fixation uniforme des échantillons est impérative pour l’imagerie 3D dans les tissus à grande échelle. La lentille de l’objectif, l’échantillon et le fluide d’immersion doivent avoir une IR correspondante. L’inadéquation de l’IR entre eux conduira à une imagerie très perturbée des cellules exprimant l’EGFP dans les tranches de cerveau nettoyées (Figure 3). Le réglage du collier de correction de la lentille de l’objectif au fluide d’immersion minimise les aberrations sphériques induites par la profondeur pour maximiser le signal, le contraste et la résolution spatiale en imagerie 3D. Les IR des solutions préparées peuvent être mesurés à l’aide d’un réfractomètre.
Dépannage de la technique
Un stockage plus long des solutions peut affecter la capacité de nettoyage et sa capacité à préserver les signaux de fluorescence et l’intégrité structurelle. Des solutions fraîchement préparées doivent être utilisées. Ces solutions peuvent être conservées jusqu’à 1 mois à 4 °C. L’isométrie est essentielle pour une imagerie neuronale efficace et efficiente avec une reconstruction précise du signal. Bien qu’une légère expansion de la taille des échantillons ait été observée après l’incubation pendant 12 h (figure 1B), l’expansion peut être contrôlée en diminuant la période d’incubation entre 8 et 12 h. Pour une imagerie de profondeur 3D plus précise, le collier de correction peut avoir besoin d’être ajusté à un plan donné en raison d’une aberration sphérique induite par la profondeur.
Modifications de la technique
Dans la présente étude, nous avons utilisé des tissus cérébraux de souris pour démontrer la faisabilité du protocole. Pourtant, le protocole décrit ici peut également être utilisé pour les animaux à gros cerveau, tels que les primates. En effet, ce protocole a été utilisé dans les tissus cérébraux des ouistitis communs (Callithrix jacchus), et a réussi à visualiser simultanément les circuits neuronaux et les structures subcellulaires de ses circuits corticostriataux6. Les adaptateurs d’étage de microscope sont conçus pour monter la chambre d’imagerie sur les étages de microscope directement6 (Figure 2A, B). Les tranches de tissus nettoyées sont observables à l’aide d’un microscope inversé à travers le couvercle inférieur de la chambre d’imagerie. Après la restauration de tissus cérébraux nettoyés avec PBS(-) (deScaling)5,11, nous pouvons préparer des coupes de tissus de 20 μm à 50 μm d’épaisseur à partir de tissus cérébraux qui ont été nettoyés avec ScaleSF (re-sectioning)6. Les structures subcellulaires capturées dans les tissus nettoyés peuvent être imagées à nouveau sur des recousses avec une lentille d’objectif NA élevée d’un WD court. L’élimination des tranches de cerveau perfusées de fixateurs contenant du glutaraldéhyde a été réalisée à l’aide de ce protocole, offrant une préservation supérieure de l’ultrastructure6. ScaleSF atteint un niveau élevé de préservation de l’ultrastructure qui permet l’analyse EM dans les tissus optiquement nettoyés6 (Figure supplémentaire 1). La compatibilité EM de cette méthode est particulièrement utile pour l’imagerie des structures avec les échelles du niveau macroscopique au niveau nanoscopique.
Limites de la technique
Le protocole décrit ici nous permet de visualiser les structures neuronales du circuit aux échelles subcellulaires dans des tranches de cerveau de 1 mm d’épaisseur. Cependant, trois limites demeurent dans le protocole. Le premier est la capacité de compensation du protocole de compensation. ScaleSF est un protocole de nettoyage pour les tranches de cerveau, pas pour l’ensemble du cerveau. Bien que des tranches cérébrales de 1 mm d’épaisseur puissent fournir une bonne connaissance des tonnelles axonales dendritiques et locales12, les informations sur les projections axonales couvrant l’ensemble du cerveau sont fragmentaires et incomplètes dans les tranches 13,14,15,16. La seconde est la résolution d’imagerie. En utilisant le protocole décrit ici, nous avons réussi à visualiser des structures neuronales subcellulaires, telles que des épines dendritiques et des boutons axonaux, dans une tranche de cerveau optiquement dégagée (Figure 4). Cependant, la résolution de la lentille objective utilisée dans cette étude, une résolution xy de 400-750 nm, n’est pas suffisante pour résoudre des structures plus fines des cellules neuronales. Étant donné que les objectifs NA élevés sont généralement conçus pour l’immersion dans l’huile (RI 1.52), l’inadéquation RI avec les solutions (RI 1.47) pourrait empêcher l’imagerie haute résolution avec ces objectifs. Le troisième est le marquage des protéines fluorescentes des cellules neuronales. La méthode d’étiquetage limite les larges applications de notre technique d’imagerie. Les techniques histochimiques et/ou immunohistochimiques qui marquent les tissus à grande échelle tout en maintenant l’intégrité des tissus feraient progresser considérablement le protocole fourni ici.
Importance par rapport aux méthodes existantes et aux applications futures de la technique
Dans la présente étude, nous décrivons un protocole détaillé pour l’imagerie neuronale des structures mésoscopiques aux structures microscopiques en utilisant la clairance tissulaire ScaleSF. Le protocole décrit ici permet de visualiser les structures neuronales du circuit aux niveaux subcellulaires dans un laps de temps raisonnable sans équipement spécialisé, facilitant ainsi la compréhension des structures neuronales des échelles de circuit aux composants. Les neurones élaborent des processus exubérants d’une longueur énorme et organisent des structures fines spécialisées pour transmettre et recevoir des informations. Ainsi, l’imagerie neuronale nécessite une méthode de nettoyage des tissus qui exerce une puissante capacité de nettoyage ainsi qu’un haut niveau de préservation des tissus pour la visualisation simultanée de structures à grande et à petite échelle. Cependant, les méthodes de nettoyage des tissus présentées avec des capacités de nettoyage élevées éliminent agressivement les lipides et les pigments pour une clarification approfondie des tissus 3,4, compromettant l’intégrité des tissus 5,6,17 (figure supplémentaire 1). Cela contraste fortement avec le protocole de défrichement utilisé ici qui permet d’atteindre un niveau élevé de préservation de la structure6 (figure supplémentaire 1). Par conséquent,l’éliminationdes tissus Sca l eSF permet une imagerie neuronale efficace et efficiente qui nécessite une imagerie 3D haute résolution multi-échelle avec une reconstruction précise du signal.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient Yoko Ishida (Université Juntendo) pour la production de vecteurs AAV et Kisara Hoshino (Université Juntendo) pour l’assistance technique. Cette étude a été soutenue par JSPS KAKENHI (JP20K07231 à K.Y.; JP21H03529 à T.F.; JP20K07743 à M.K.; JP21H02592 à H.H.) et la recherche scientifique sur le domaine innovant « Resonance Bio » (JP18H04743 à H.H.). Cette étude a également été soutenue par l’Agence japonaise pour la recherche et le développement médicaux (AMED) (JP21dm0207112 à T.F. et H.H.), Moonshot R&D de l’Agence japonaise de la science et de la technologie (JST) (JPMJMS2024 à H.H.), Fusion Oriented Research for disruptive Science and Technology (FOREST) de JST (JPMJFR204D à H.H.), Subventions d’aide de l’Institut de recherche sur les maladies de la vieillesse de la Faculté de médecine de l’Université Juntendo (X2016 à K.Y.; X2001 à H.H.), et le projet de marque des écoles privées.
matériels
| Name | Company | Catalog Number | Comments |
| 16x multi-immersion objective lens | Leica Microsystems | HC FLUOTAR 16x/0.60 IMM CORR VISIR | |
| Agar | Nacalai Tesque | 01028-85 | |
| Agarose | TaKaRa Bio | L03 | |
| Dimethyl sulfoxide | Nacalai Tesque | 13407-45 | |
| D-Sorbitol | Nacalai Tesque | 06286-55 | |
| γ-cyclodextrin | Wako Pure Chemical Industries | 037-10643 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Huygens Essential | Scientific Volume Imaging | ver. 18.10.0p8/21.10.1p0 64b | |
| Imaris | Bitplane | ver. 9.0.0 | |
| Leica Application Suite X | Leica Microsystems | LAS X, ver. 3.5.5.19976 | |
| Methyl-β-cyclodextrin | Tokyo Chemical Industry | M1356 | |
| Paraformaldehyde | Merck Millipore | 1.04005.1000 | |
| Phosphate Buffered Saline (10x; pH 7.4) | Nacalai Tesque | 27575-31 | 10x PBS(–) |
| Sodium azide | Nacalai Tesque | 31233-55 | |
| Sodium pentobarbital | Kyoritsu Seiyaku | N/A | |
| TCS SP8 | Leica Microsystems | N/A | |
| Triton X-100 | Nacalai Tesque | 35501-15 | |
| Urea | Nacalai Tesque | 35940-65 | |
| Vibrating tissue slicer | Dosaka EM | PRO7N |
Références
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chemical Biology. 23 (1), 137-157 (2016).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annual Reviews of Cell and Developmental Biology. 32, 713-741 (2016).
- Ueda, H. R., et al. Whole-brain profiling of cells and circuits in mammals by tissue clearing and light-sheet microscopy. Neuron. 106 (3), 369-387 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews. Neuroscience. 21 (2), 61-79 (2020).
- Hama, H., et al. ScaleS: an optical clearing palette for biological imaging. Nature Neuroscience. 18 (10), 1518-1529 (2015).
- Furuta, T., et al. Multi-scale light microscopy/electron microscopy neuronal imaging from brain to synapse with a tissue clearing method, ScaleSF. iScience. 25 (1), 103601(2022).
- Miyawaki, A., et al. Deep imaging of cleared brain by confocal laser-scanning microscopy. Protocol Exchange. , (2016).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protocols. 2 (1), 100230(2021).
- Kameda, H., et al. Parvalbumin-producing cortical interneurons receive inhibitory inputs on proximal portions and cortical excitatory inputs on distal dendrites. The European Journal of Neuroscience. 35 (6), 838-854 (2012).
- Sohn, J., et al. A single vector platform for high-level gene transduction of central neurons: Adeno-associated virus vector equipped with the Tet-off system. PLoS One. 12 (1), 0169611(2017).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14 (11), 1481-1488 (2011).
- Stepanyants, A., Martinez, L. M., Ferecsko, A. S., Kisvarday, Z. F. The fractions of short- and long-range connections in the visual cortex. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3555-3560 (2009).
- Kuramoto, E., et al. Two types of thalamocortical projections from the motor thalamic nuclei of the rat: a single neuron-tracing study using viral vectors. Cerebral Cortex. 19 (9), New York, N.Y. 2065-2077 (2009).
- Matsuda, W., et al. Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nature Methods. 15 (12), 1033-1036 (2018).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6, 34331(2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.