Method Article
طريقة تطهير الأنسجة للتصوير العصبي من المقاييس المتوسطة إلى المجهرية
In This Article
Summary
يوفر البروتوكول طريقة مفصلة للتصوير العصبي في شريحة الدماغ باستخدام طريقة مسح الأنسجة ، ScaleSF. ويشمل البروتوكول إعداد أنسجة المخ، وتوضيح الأنسجة، والتعامل مع الشرائح التي تم تطهيرها، والتصوير المجهري بالليزر البؤري للهياكل العصبية من المستويات المجهرية إلى المجهرية.
Abstract
يتم توفير بروتوكول مفصل هنا لتصور الهياكل العصبية من المستويات المسكوبية إلى المجهرية في أنسجة المخ. يتم تصور الهياكل العصبية التي تتراوح من الدوائر العصبية إلى الهياكل العصبية دون الخلوية في شرائح دماغ الفئران التي تم تطهيرها بصريا باستخدام ScaleSF. طريقة التطهير هذه هي نسخة معدلة من ScaleS وهي طريقة إزالة الأنسجة المحبة للماء لشرائح الأنسجة التي تحقق قدرة تطهير قوية بالإضافة إلى مستوى عال من الحفاظ على إشارات التألق والسلامة الهيكلية. تم تصميم غرفة تصوير ثلاثية الأبعاد (3D) مطبوعة قابلة للتخصيص للتركيب الموثوق به لأنسجة المخ التي تم تطهيرها. تم إصلاح أدمغة الفئران التي تم حقنها بناقل فيروس مرتبط بالغدي يحمل جين بروتين فلورسنت أخضر محسن بنسبة 4٪ بارافورمالديهايد ومقطعة إلى شرائح بسماكة 1 مم باستخدام قطاعة أنسجة مهتزة. تم تطهير شرائح الدماغ باتباع بروتوكول المقاصة، والذي يتضمن حضانات متسلسلة في ثلاثة حلول، وهي محلول Sca l eS0، ومحلول ملحي عازل للفوسفات (–)، ومحلول ScaleS4، بإجمالي 10.5-14.5 ساعة. تم تركيب شرائح الدماغ التي تم تطهيرها على غرفة التصوير وتضمينها في هلام الأغاروز بنسبة 1.5٪ المذاب في محلول ScaleS4D25 (0). تم الحصول على صورة 3D للشرائح باستخدام مجهر مسح ليزر متحد البؤرة مجهز بعدسة موضوعية متعددة الغمر لمسافة عمل طويلة. بدءا من التصوير العصبي المنظاري ، نجحنا في تصور الهياكل العصبية الدقيقة تحت الخلوية ، مثل العمود الفقري التغصني والبوتونات المحورية ، في شرائح الدماغ التي تم تطهيرها بصريا. هذا البروتوكول من شأنه أن يسهل فهم الهياكل العصبية من الدائرة إلى مقاييس المكونات دون الخلوية.
Introduction
وقد حسنت طرق إزالة الأنسجة التصوير المستقل عن العمق للعينات البيولوجية والسريرية باستخدام المجهر الضوئي، مما يسمح باستخراج المعلومات الهيكلية عن الأنسجة السليمة 1,2. يمكن لتقنيات المقاصة البصرية أيضا تسريع وتقليل تكلفة التحليل النسيجي. حاليا ، تتوفر ثلاثة طرق رئيسية للتطهير: الطرق المحبة للماء ، الكارهة للماء ، والهيدروجيل القائم على 1,2. النهج المحبة للماء تفوق في الحفاظ على إشارات التألق وسلامة الأنسجة وهي أقل سمية مقارنة بالنهجين الآخرين 3,4.
وتحتل طريقة المقاصة المحبة للماء، ScaleS، موقعا مميزا من خلال الحفاظ على السلامة الهيكلية والجزيئية فضلا عن قدرتها القوية على التطهير (طيف التطهير والحفظ)5. في دراسة سابقة ، طورنا بروتوكول تطهير سريع ومتساوي القياس ، Scal eSF ، لشرائح الأنسجة (سمك ~ 1 مم) عن طريق تعديل إجراء المقاصة في ScaleS6. يتطلب بروتوكول التطهير هذا حضانة متسلسلة لشرائح الدماغ في ثلاثة حلول لمدة 10.5-14.5 ساعة. تتميز هذه الطريقة بطيف عالي التطهير والحفظ ، وهو متوافق حتى مع تحليل المجهر الإلكتروني (EM) (الشكل التكميلي 1) ، مما يسمح بالتصوير ثلاثي الأبعاد (3D) عالي الدقة متعدد النطاقات مع إعادة بناء إشارة دقيقة6. وبالتالي ، يجب أن يكون ScaleSF فعالا خاصة في الدماغ ، حيث تقوم الخلايا العصبية بوضع عمليات وفيرة ذات طول هائل ، وترتيب هياكل تحت الخلايا الدقيقة المتخصصة لنقل المعلومات واستقبالها. استخراج المعلومات الهيكلية مع المقاييس من الدائرة إلى المستويات دون الخلوية على الخلايا العصبية مفيد جدا نحو فهم أفضل لوظائف الدماغ.
هنا ، نقدم بروتوكولا مفصلا لتصور الهياكل العصبية بمقاييس من الميزوسكوبيك / الدائرة إلى المستوى المجهري / دون الخلوي باستخدام ScaleSF. ويشمل البروتوكول إعداد الأنسجة، وتوضيح الأنسجة، والتعامل مع الأنسجة التي تم تطهيرها، والتصوير المجهري بالليزر البؤري (CLSM) للأنسجة التي تم تطهيرها. يركز بروتوكولنا على استجواب الهياكل العصبية من الدائرة إلى مقاييس المكونات دون الخلوية. للحصول على إجراء مفصل لإعداد المحاليل والحقن المجسمة لناقلات الفيروسات المرتبطة بالغدية (AAV) في أدمغة الفئران ، راجع Miyawaki et al. 20167 و Okamoto et al. 20218 ، على التوالي.
Protocol
تمت الموافقة على جميع التجارب من قبل اللجان المؤسسية لرعاية واستخدام الحيوانات في جامعة جونتيندو (الموافقة رقم 2021245 ، 2021246) وتم إجراؤها وفقا للمبادئ التوجيهية الأساسية للسير السليم للتجارب على الحيوانات من قبل مجلس العلوم الياباني (2006). هنا ، تم استخدام الفئران الذكور C57BL / 6J التي تم حقنها بناقل AAV الذي يحمل جين بروتين الفلورسنت الأخضر المحسن (EGFP) والبارفالبومين (PV) / myristoylation-EGFP-منخفض الكثافة مستقبلات البروتين الدهني C-terminal الكروموسوم الاصطناعي البكتيري الاصطناعي (BAC) الفئران المعدلة وراثيا (الفئران PV-FGL)9 . تم الحفاظ على الفئران PV-FGL في خلفية C57BL/6J. لم يتم العثور على اختلافات قائمة على الجنس فيما يتعلق بهذه الدراسة.
1. إعداد الأنسجة
- تثبيت التروية
ملاحظة: قم بتنفيذ الخطوات من 1.1.1 إلى 1.1.3 في غطاء الدخان للحد من التعرض لبارافورمالدهيد (PFA).- تخدير الفئران الذكور البالغة (8-16 أسبوعا) عن طريق الحقن داخل الصفاق من جرعة زائدة من بنتوباربيتال الصوديوم (200 ملغ / كغ). تأكد من كفاية التخدير من خلال عدم وجود انسحاب قرصة إصبع القدم وردود الفعل طرفة العين.
- افتح التجويف الصدري واقطع الزائدة الأذينية اليمنى بالمقص الجراحي. قم بدمج الفئران مع 20 مل من محلول ملحي عازل للفوسفات البارد (PBS) باستخدام إبرة 23 جم متصلة بحقنة سعة 20 مل ، تليها تروية 20 مل من PFA البارد المثلج بنسبة 4٪ في مخزن فوسفات مؤقت 0.1 م (PB) باستخدام حقنة أخرى سعة 20 مل.
تحذير: PFA سامة ومسخية. تجنب الاستنشاق أو ملامسة الجلد والعينين والأغشية المخاطية. - إزالة أنسجة المخ من الجمجمة باستخدام ملاقط. انقل أنسجة المخ إلى أنبوب 15 مل يحتوي على 4٪ PFA في 0.1 M PB ، وقم بحماية العينات من الضوء ، واهتز بلطف بين عشية وضحاها عند 4 درجات مئوية على شاكر عند 50-100 دورة في الدقيقة.
- ملاحظة: يمكن تخزين أنسجة المخ التي تم حصادها لعدة أسابيع في 0.02٪ من أزيد الصوديوم (NaN3) في PBS عند 4 درجات مئوية.
تحذير: NaN3 سام. تجنب الاستنشاق أو ملامسة الجلد والعينين والأغشية المخاطية. تعامل معها داخل غطاء الدخان.
- تحضير شرائح الدماغ
- تحضير 4٪ أجار في PBS عن طريق إضافة 2 غرام من أجار إلى 50 مل من PBS. ضعي الخليط في الميكروويف حتى يذوب الآجار بالكامل. دع المحلول يبرد إلى 40-45 درجة مئوية.
ملاحظة: الخاصية اللزجة التي يوفرها agaropectin ، وهو مكون رئيسي من agar ، يحسن سهولة قطع شرائح الأنسجة. - أضف 10 مل من محلول الأجار إلى لوحة استزراع من 6 آبار. غمر أنسجة المخ في محلول أجار باستخدام الملقط. دع الأجار يتصلب على الجليد.
- قم بإزالة أنسجة المخ المدمجة من البئر وقم بتقليم الأجار بشفرة حلاقة. قم بتثبيت كتلة الأجار في الجزء السفلي من حمام الاهتزاز باستخدام الغراء الفائق واسكب 0.1 M PB في صينية التخزين المؤقت.
- نظف شفرة حلاقة أخرى باستخدام ورق مناديل خالية من الوبر غارق في الإيثانول وقم بتوصيل الشفرة بحامل شفرة قطاعة الأنسجة المهتزة.
- اضبط سرعة التقسيم على 0.14 مم / ثانية بسعة 1.4 مم والتردد إلى 75-77 هرتز.
ملاحظة: يمكن تخزين شرائح الدماغ لعدة أسابيع في 0.02٪ NaN3 في PBS عند 4 درجات مئوية.
- تحضير 4٪ أجار في PBS عن طريق إضافة 2 غرام من أجار إلى 50 مل من PBS. ضعي الخليط في الميكروويف حتى يذوب الآجار بالكامل. دع المحلول يبرد إلى 40-45 درجة مئوية.
2. توضيح الأنسجة
ملاحظة: يتم سرد تركيبات حلول ScaleS المستخدمة في الجدول 1. يجب حماية العينات من الضوء عن طريق تغطيتها بورق معدني. وترد خطوات المقاصة في الشكل 1 ألف.
- أضف 8 مل من محلول Sca leS0 إلى بئر واحد من صفيحة زراعة الخلايا المكونة من 6 آبار وأضف 8 مل من محلول ScaleS4 إلى بئر آخر من اللوحة وقم بتسخينه مسبقا إلى 37 درجة مئوية في حاضنة.
- انقل شرائح الدماغ إلى محلول ScaleS0 الذي تم تسخينه مسبقا باستخدام ملعقة واحتضنها لمدة 2 ساعة عند 37 درجة مئوية في حاضنة تهتز عند 90 دورة في الدقيقة.
- انقل شرائح الدماغ المتخلل في 8 مل من PBS (-) في صفيحة زراعة خلايا من 6 آبار مع ملعقة واغسلها لمدة 15 دقيقة عن طريق الاحتفاظ بها في شاكر مداري عند 40-60 دورة في الدقيقة. كرر هذا مرتين.
- انقل شرائح الدماغ في محلول ScaleS4 الذي تم تسخينه مسبقا بمقدار 8 مل باستخدام ملعقة وقم بمسحها عن طريق احتضانها في حاضنة اهتزاز عند 90 دورة في الدقيقة لمدة 8-12 ساعة عند 37 درجة مئوية. يمكن رؤية شرائح دماغية واضحة في الشكل 1.
3. تركيب شريحة الدماغ
ملاحظة: يتم استخدام غرفة تصوير قابلة للتخصيص للتركيب الموثوق به لشرائح الدماغ التي تم تطهيرها (الشكل 2)6. تتكون الغرفة من إطار الغرفة والغطاء السفلي. تم تصميم محولات مرحلة المجهر أيضا لتركيب غرفة التصوير على مراحل المجهر مباشرة (الشكل 2A ، B). يمكن طباعة إطار الغرفة ومحولات مرحلة المجهر 3D باستخدام خدمات الطباعة ثلاثية الأبعاد الداخلية أو الخارجية. يتم توفير بيانات التصميم 3D بمساعدة الكمبيوتر (CAD) لغرفة التصوير في Furuta et al. 20226.
- لإعداد الغرفة ، قم بتوصيل إطار الغرفة بغطاء باستخدام مادة لاصقة حساسة للضغط.
- تحضير 1.5٪ من الأغاروز في محلولSca l eS4D25 (0) (ScaleS4 gel) عن طريق إضافة 1.5 غرام من الأغاروز إلى 100 مل من المحلول في زجاجة. اخلطي المحلول جيدا عن طريق تحريك المحلول ووضعه في الميكروويف حتى يذوب الأغاروز بالكامل. بمجرد الانتهاء من ذلك ، اترك المحلول يبرد إلى 37 درجة مئوية.
- قم بتركيب شريحة الدماغ التي تم تطهيرها على الغطاء السفلي لغرفة التصوير باستخدام ملعقة. امسح المحلول الزائد من الشريحة التي تم مسحها باستخدام ورق مناديل نظيف خال من الوبر.
- أضف جل ScaleS4 على شريحة الدماغ باستخدام ماصة دقيقة لملء غرفة التصوير. ضع غطاء آخر في الأعلى باستخدام ملقط وضع قطعة من المناديل الورقية الخالية من الوبر وشريحة زجاجية على الغطاء بهذا الترتيب.
- انقل غرفة التصوير إلى الثلاجة عند 4 درجات مئوية. ضع أوزانا معدنية على الشريحة الزجاجية واتركها لمدة 30 دقيقة.
- قم بإزالة الأوزان المعدنية والانزلاق الزجاجي وورق المناديل الخالية من الوبر والغطاء من غرفة التصوير ، وامسح الجل الزائد بعيدا (الشكل 2A ، B).
- ضع غرفة التصوير في طبق بتري زجاجي مقاس 60 مم وقم بتوصيل حافة غرفة التصوير بالطبق باستخدام مادة لاصقة حساسة للضغط تشبه المعجون. نعلق الغرفة في نقاط متعددة على طبق بيتري.
- صب محلول ScaleS4 في الطبق ورجه بلطف لمدة 1 ساعة عند 20-25 درجة مئوية على شاكر مداري عند 40-60 دورة في الدقيقة. استبدله بمحلول منعش وأزل فقاعات الهواء على سطح الجل عن طريق كشط السطح بلطف باستخدام طرف ماصة 200 ميكرولتر. قم بتركيب غرفة التصوير المغمورة على مرحلة المجهر (الشكل 2C).
4. تصوير CLSM
- احصل على صور باستخدام CLSM مزود بعدسة موضوعية متعددة الغمر لمسافة عمل طويلة (WD) (فتحة عدسة رقمية 16x/0.60 [NA]، WD = 2.5 مم).
ملاحظة: يمكن أن توفر العدسات عالية الدقة عالية الدقة المحدودة للحيود (NA) عالية القدر. - قم بتشغيل جميع معدات التصوير ذات الصلة (محطة العمل والمجهر والماسح الضوئي والليزر ومصباح الزئبق) وقم بتشغيل برنامج تصوير CLSM.
- اضبط طوق التصحيح للعدسة الموضوعية متعددة الغمر على 1.47. يحتوي حل ScaleS4 على معامل انكسار (RI) يبلغ حوالي 1.47 5,7. يمكن أن تزعج الانحرافات الناجمة عن عدم تطابق RI تكوين الصورة (الشكل 3).
- اغمر العدسة الموضوعية في المحلول ، واتركها تقترب من الشريحة ببطء. قم بإزالة أي فقاعات هواء عالقة على طرف العدسة الموضوعية. ابحث عن مناطق الاهتمام (ROIs) في الأنسجة التي تم تطهيرها باستخدام التألق اللاإرادي.
- قم بتعيين معلمات الحصول على الصور عن طريق اختبار الإعدادات المناسبة.
- تحديد عمق البت للحصول على الصورة. يزداد حجم بيانات الصورة مع عمق البت.
- اضبط الطول الموجي للكشف. اضبط البوابة المناسبة للكاشف وفقا لطيف الانبعاثات. تأكد من أن الطول الموجي للكشف لا يغطي أي خطوط ليزر.
- اضبط دقة xy . توفر التنسيقات الأكبر حجما دقة xy أفضل ، ولكن الأمر يستغرق وقتا أطول لجمع الصور.
- اضبط سرعة المسح الضوئي. توفر سرعة المسح الضوئي الأبطأ نسبة إشارة إلى ضوضاء عالية. ومع ذلك ، فإنه يزيد أيضا من وقت سكن البكسل وخطر التبييض الضوئي. اختر وفقا لذلك.
- اضبط حجم الثقب. يتحكم حجم الثقب في سمك المقطع البصري. يخلق حجم الثقب الأصغر قسما بصريا أرق ، وبالتالي دقة z أفضل ، ولكنه يقلل من إشارة التألق. إن تكبير حجم الثقب يوفر قسما بصريا أكثر سمكا مع إشارة تألق أقوى.
- اضبط طاقة الليزر ، وكسب الكاشف / مكبر الصوت ، والإزاحة. قم بزيادة طاقة الليزر تدريجيا واكتساب الكاشف / مكبر الصوت حتى يتم الحصول على صورة مناسبة. تحمل قوة الليزر العالية خطر التبييض الضوئي. اضبط الإزاحة (التباين) بشكل مناسب للحصول على نسبة إشارة إلى ضوضاء عالية.
- حدد منطقة الحراثة اللازمة بناء على حجم عائد الاستثمار. تأكد من التقاط كامل طول وعرض عائد الاستثمار.
- تنقل بين الأنسجة التي تم مسحها في جميع الطائرات، واضبط نقطتي البداية والنهاية للمكدس. اضبط حجم الخطوة z وفقا لدقة z المطلوبة.
- اجمع الصور عندما تكون راضيا عن إعدادات الحصول على الصور، وسجل الصور الملتقطة معالجة الصور باستخدام برنامج تحليل الصور.
النتائج
تم تحقيق التطهير البصري لشريحة دماغ الماوس بسماكة 1 مم باستخدام هذا البروتوكول. يمثل الشكل 1B صور انتقال شريحة دماغ الفأر قبل وبعد العلاج المقاصة. جعلت طريقة تطهير الأنسجة شريحة دماغ فأر بسماكة 1 مم شفافة. تم العثور على توسع طفيف في الأحجام النهائية لشرائح الدماغ بعد الحضانة في محلول المقاصة لمدة 12 ساعة (التوسع الخطي: 102.5٪ ± 1.3٪). تم تقييم الحفاظ على التألق والسلامة الهيكلية للأنسجة باستخدام تعبير EGFP المستهدف في غشاء البلازما في الفئران PV-FGL (الشكل 1C). في هذه الفئران ، يتم التعبير عن EGFP المستهدف بالغشاء السوماتي في الخلايا العصبية الكهروضوئية الإيجابية9. تم الحفاظ على تعبير EGFP الذي يستهدف غشاء البلازما في المنطقة الجسدية بعد العلاج (الشكل 1C). بالإضافة إلى ذلك ، تظهر دراسة EM السابقة السلامة الهيكلية المحفوظة جيدا في أنسجة المخ التي تم تطهيرها باستخدام ScaleSF (الشكل التكميلي 1)6.
تسببت الانحرافات الناجمة عن عدم تطابق RI في فقدان ملحوظ لسطوع الصورة ودقتها (الشكل 3). تم مسح شريحة دماغية بسماكة 1 مم من الماوس PV-FGL وتصويرها تحت CLSM مجهزة بعدسة موضوعية متعددة الغمر ل WD طويل. (الشكل 3 ألف، جيم). تم تصور هذه الخلايا العصبية بوضوح بنفس CLSM ، عندما تم ضبط طوق التصحيح لمطابقة حل ScaleS4 (RI 1.47; الشكل 3 ب ، دال). تعد مطابقة RI بين سائل الغمر والعدسة الموضوعية أمرا بالغ الأهمية للتصوير الدقيق 3D في الأنسجة التي تم تطهيرها بصريا.
وأخيرا ، تم استخدام الخلايا العصبية القشرية الجديدة للفئران لإثبات جدوى البروتوكول. تم إصلاح دماغ الفأر الذي تم حقنه بمتجه AAV2/1-SynTetOff-EGFP10 في القشرة الحسية الجسدية الأولية (S1) بنسبة 4٪ PFA في 0.1 M PB. تم تحضير شرائح إكليلية بسماكة 1 مم من الدماغ باستخدام قطاعة أنسجة تهتز. بعد التطهير والتركيب على غرفة التصوير ، تم إجراء التصوير العصبي الذي يستهدف الخلايا العصبية القشرية الحديثة (الشكل 4). يتم تمثيل إعادة بناء ثلاثية الأبعاد للخلايا العصبية التي تحمل علامة EGFP في شريحة الدماغ التي يبلغ سمكها 1 مم في الشكل 4A. تظهر صورة التكبير الأعلى العرش الشجيري الفردي المزين بأشواك تغصنية (الشكل 4B). كما أظهرنا تشجيرات طرفية محورية وبوتونات محورية في القشرة المتعارضة (الشكل 4C).
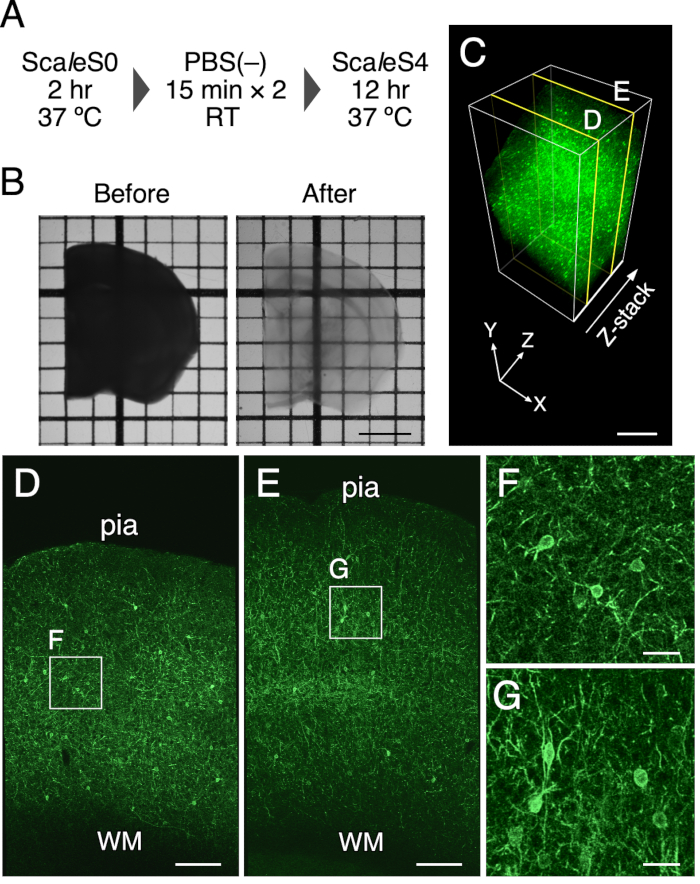
الشكل 1: التطهير البصري لشرائح دماغ الفأر بسماكة 1 مم. (أ) الجدول الزمني لإزالة أنسجة ScaleSF. (ب) نقل صور لشرائح دماغية بسمك 1 مم قبل (يسار) وبعد العلاج (يمين). (ج) عرض حجم 3D للقشرة الدماغية لفأر PV-FGL تم تطهيره باستخدام طريقة إزالة الأنسجة. (دال، هاء) صور xy في (C) على أعماق 250 ميكرومتر (D) و 750 ميكرومتر (E). (F,G) عرض موسع للمستطيلات الموضحة في (D) و (E). يتم إزالة التعقيد من الصور التي تظهر في (C-G) قبل عملية العرض. الاختصارات: pia = pia mater ، WM = المادة البيضاء. شريط المقياس: 2 مم في (B)، 500 ميكرومتر في (C)، 200 ميكرومتر في (D، E)، و 40 ميكرومتر في (F، G). تم تعديل هذا الرقم من Furata et al. 20226. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
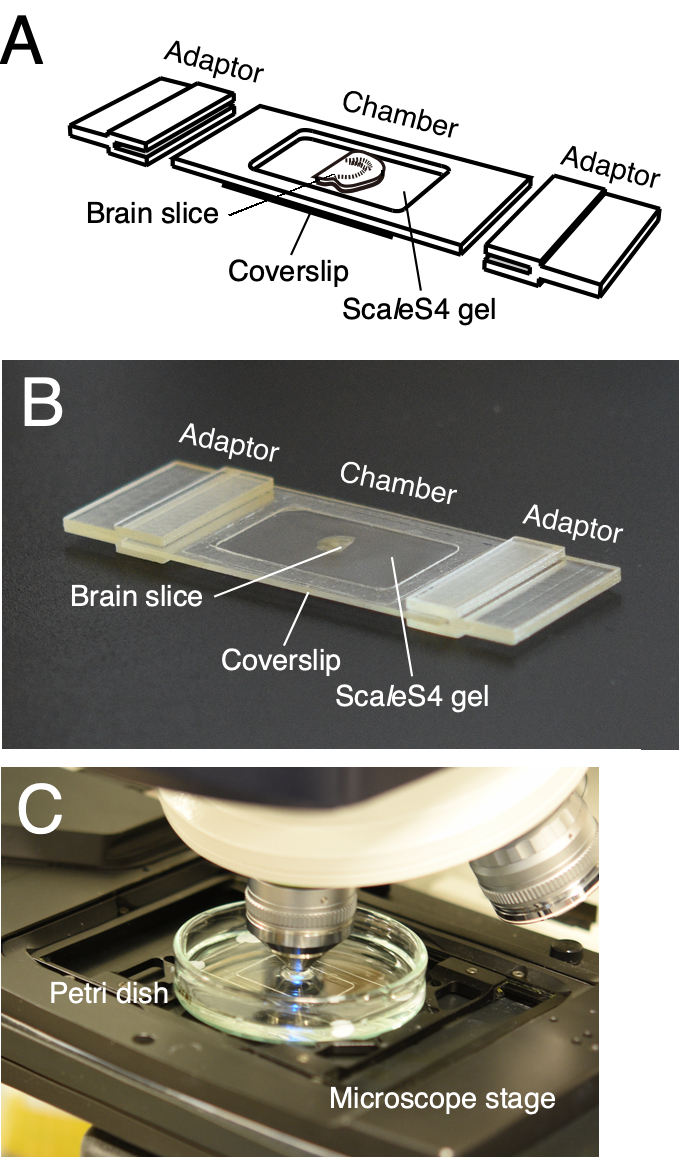
الشكل 2: غرفة تصوير مطبوعة ثلاثية الأبعاد قابلة للتخصيص لتصور شريحة الأنسجة. (A ، B) رسم مخطط (A) وصورة (B) لغرفة تصوير مطبوعة 3D قابلة للتخصيص. تتكون غرفة التصوير من إطار غرفة ، وغطاء سفلي ومحولات مرحلة المجهر. يتم وضع شرائح الأنسجة التي تم تطهيرها على الغطاء السفلي وتضمينها في جل ScaleS4. يمكن تخصيص إطار الغرفة والغطاء السفلي ومحولات مرحلة المجهر وفقا لحجم وسمك شرائح الأنسجة. (ج) إعداد التصوير مع غرفة التصوير. يتم غمر غرفة التصوير في محلول ScaleS4 في طبق بتري وتركيبها على مرحلة CLSM مستقيمة. تم تعديل هذا الرقم من Furata et al. 20226. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التصوير العميق المخترق الناجم عن عدم تطابق RI بين عدسة موضوعية ومحلول ScaleS4. (A-D) xy صور للقشرة الدماغية لفأر PV-FGL على أعماق 400 ميكرومتر (A ، B) و 800 ميكرومتر (C ، D). يتم ضبط تصحيح طوق عدسة الهدف متعددة الغمر إلى 1.33 بوصة (A ، C) و 1.47 بوصة (B ، D). يتم الحصول على الصور بنفس المعلمات باستثناء المثيلات المحجوزة للعدسة الموضوعية. شريط المقياس: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التصوير العصبي في شريحة دماغ فأر بسماكة 1 مم تم مسحها باستخدام ScaleSF. (أ) تقديم حجم 3D من الخلايا العصبية القشرية الجديدة للفأر المسمى EGFP في S1. يتم تصنيف الخلايا العصبية القشرية الجديدة بمتجه AAV2/1 SynTetOff-EGFP. (ب) العرش الشجيري للخلايا العصبية القشرية الجديدة المسماة EGFP. يتم تمثيل صورة إسقاط الكثافة القصوى (MIP) من عمق 39 ميكرومتر إلى 48 ميكرومتر. تشير رؤوس الأسهم إلى أشواك تغصنية. (ج) محطات المحور العصبي الموسومة EGFP في القشرة المتعارضة الجانبية. يتم تمثيل صورة MIP من عمق 481.5 ميكرومتر إلى 513 ميكرومتر. تشير رؤوس الأسهم إلى البوتونات المحورية. الصور التي تظهر في (B) و (C) غير معقدة. أشرطة المقياس: 300 ميكرومتر في (A) و 10 ميكرومتر في (C). ينطبق الشريط الموجود في (C) على (B) أيضا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: البنية الفائقة في شرائح الدماغ التي تم مسحها باستخدام ScaleSF و CUBIC و PACT. (A-C) نقل صور EM للقشرة الدماغية للفأر تم مسحها باستخدام ScaleSF (A) والمكعب (B) و PACT (C). يتم إصلاح أدمغة الفئران بنسبة 4٪ PFA التي تحتوي على 1٪ glutaraldehyde. يتم تحضير أقسام رقيقة جدا من شرائح الدماغ التي تم تطهيرها. تتضرر هياكل الغشاء بشدة في شرائح الدماغ التي تم تطهيرها باستخدام CUBIC (B) و PACT (C). تشير رؤوس الأسهم إلى أغشية ما بعد المشبكي. شريط الميزان: 500 نانومتر. تم تعديل هذا الرقم من Furata et al. 20226. يرجى النقر هنا لتنزيل هذا الملف.
| وصفات حلول ScaleS | |
| حل ScaleS0 | |
| الكاشف | التركيز النهائي |
| د-سوربيتول | 20٪ (ث/ت) |
| الجلسرين | 5٪ (ث / v) |
| ميثيل β سيكلوديكسترين | 1 مللي متر |
| γ-سيكلوديكسترين | 1 مللي متر |
| ثنائي ميثيل سلفوكسيد | 3٪ (v / v) |
| 10x PBS (–) | 1x |
| حل ScaleS4 | |
| الكاشف | التركيز النهائي |
| يوريا | 4 م |
| د-سوربيتول | 40٪ (ث/ت) |
| الجلسرين | 10٪ (ث/ت) |
| تريتون X-100 | 0.2٪ (ث / v) |
| ثنائي ميثيل سلفوكسيد | 25٪ (v / v) |
| حل ScaleS4D25(0) | |
| الكاشف | التركيز النهائي |
| يوريا | 4 م |
| د-سوربيتول | 40٪ (ث/ت) |
| الجلسرين | 10٪ (ث/ت) |
| ثنائي ميثيل سلفوكسيد | 25٪ (v / v) |
الجدول 1: تكوين حلول ScaleS الثلاثة. يتم سرد تركيبات حلول Scal eS0 و Sca l eS4 و ScaleS4D25 (0). للحصول على إجراء مفصل لإعداد هذه الحلول ، راجع Miyawaki et al. 20167.
Discussion
الخطوات الحاسمة في إطار البروتوكول
هناك بعض الخطوات الحاسمة في البروتوكول التي ينبغي إجراؤها بأقصى درجات الحذر للحصول على نتائج ذات مغزى. التثبيت الموحد للعينات أمر حتمي للتصوير 3D داخل الأنسجة واسعة النطاق. يجب أن تحتوي العدسة الموضوعية والعينة وسيولة الغمر على مثيل محجوز مطابق. سيؤدي عدم تطابق RI فيما بينها إلى تصوير مضطرب للغاية للخلايا المعبرة عن EGFP داخل شرائح الدماغ التي تم تطهيرها (الشكل 3). إن ضبط طوق التصحيح للعدسة الموضوعية على سائل الغمر يقلل من الانحرافات الكروية الناجمة عن العمق لتحقيق أقصى قدر من الإشارة والتباين والدقة المكانية في التصوير ثلاثي الأبعاد. يمكن قياس المثيلات المحجوزة للحلول المعدة باستخدام مقياس الانكسار.
استكشاف الأخطاء وإصلاحها في هذه التقنية
يمكن أن يؤثر التخزين الأطول للحلول على قدرة التطهير ، وقدرتها على الحفاظ على إشارات التألق والسلامة الهيكلية. يجب استخدام المحاليل الطازجة. يمكن تخزين هذه الحلول حتى 1 شهر عند 4 درجات مئوية. تعد القياسات المتساوية أمرا بالغ الأهمية للتصوير العصبي الفعال والكفء مع إعادة بناء إشارة دقيقة. على الرغم من ملاحظة توسع طفيف في أحجام العينات بعد الحضانة لمدة 12 ساعة (الشكل 1 ب) ، يمكن التحكم في التمدد عن طريق تقليل فترة الحضانة بين 8-12 ساعة. للحصول على تصوير عمق 3D أكثر دقة ، قد تحتاج إلى ضبط طوق التصحيح في مستوى معين بسبب الانحراف الكروي الناجم عن العمق.
تعديلات على التقنية
في هذه الدراسة ، استخدمنا أنسجة دماغ الفئران لإثبات جدوى البروتوكول. ومع ذلك ، يمكن أيضا استخدام البروتوكول الموصوف هنا للحيوانات ذات الدماغ الكبير ، مثل الرئيسيات. في الواقع ، تم استخدام هذا البروتوكول في أنسجة المخ المشتركة marmoset (Callithrix jacchus) ، ونجح في التصور المتزامن للدائرة العصبية والهياكل دون الخلوية لدوائر الكورتيكوستريا6. تم تصميم محولات مرحلة المجهر لتركيب غرفة التصوير على مراحل المجهر مباشرة6 (الشكل 2A ، B). يمكن ملاحظة شرائح الأنسجة التي تم تطهيرها باستخدام مجهر مقلوب من خلال الغطاء السفلي لغرفة التصوير. بعد استعادة أنسجة المخ التي تم تطهيرها باستخدام PBS(-) (deSca l ing)5,11 ، يمكننا إعداد أقسام الأنسجة بسماكة 20-μm إلى 50-μm من أنسجة المخ التي تم تطهيرها باستخدام ScaleSF (إعادة التقسيم)6. يمكن تصوير الهياكل دون الخلوية التي تم التقاطها داخل الأنسجة التي تم تطهيرها مرة أخرى على إعادة المقاطع باستخدام عدسة موضوعية عالية NA ل WD قصير. تم تحقيق إزالة شرائح الدماغ المدمجة مع المثبتات التي تحتوي على glutaraldehyde باستخدام هذا البروتوكول ، مما يوفر الحفاظ على البنية الفائقةالفائقة 6. يحقق ScaleSF مستوى عاليا من الحفاظ على البنية الفائقة التي تسمح بتحليل EM في الأنسجة التي تم تطهيرها بصريا6 (الشكل التكميلي 1). يعد توافق EM لهذه الطريقة مفيدا بشكل خاص لتصوير الهياكل ذات المقاييس من المستوى العياني إلى المستوى النانوي.
قيود التقنية
يسمح لنا البروتوكول الموصوف هنا بتصور الهياكل العصبية من الدائرة إلى المقاييس تحت الخلوية في شرائح الدماغ بسماكة 1 مم. ومع ذلك، لا تزال هناك ثلاثة قيود في البروتوكول. الأول هو قدرة المقاصة لبروتوكول المقاصة. ScaleSF هو بروتوكول مسح لشرائح الدماغ ، وليس للدماغ بأكمله. على الرغم من أن شرائح الدماغ التي يبلغ سمكها 1 مم يمكن أن توفر معرفة جيدة بالعرش المحوري المتغصن والمحلي 12 ، إلا أن المعلومات حول الإسقاطات المحورية التي تغطي الدماغ بأكمله مجزأة وغير مكتملة في الشرائح13،14،15،16. والثاني هو دقة التصوير. باستخدام البروتوكول الموصوف هنا ، نجحنا في تصور الهياكل العصبية تحت الخلوية ، مثل العمود الفقري الشجيري والبوتونات المحورية ، في شريحة دماغية واضحة بصريا (الشكل 4). ومع ذلك ، فإن دقة العدسة الموضوعية المستخدمة في هذه الدراسة ، وهي دقة xy من 400-750 نانومتر ، ليست كافية لحل المزيد من الهياكل الدقيقة للخلايا العصبية. نظرا لأن العدسات عالية الهدف NA مصممة عادة للغمر بالزيت (RI 1.52) ، فإن عدم تطابق RI مع المحاليل (RI 1.47) قد يمنع التصوير عالي الدقة باستخدام هذه العدسات الموضوعية. والثالث هو وضع العلامات على البروتين الفلورسنت للخلايا العصبية. تحد طريقة وضع العلامات من التطبيقات الواسعة لتقنية التصوير الخاصة بنا. التقنيات الكيميائية النسيجية و / أو الكيميائية النسيجية المناعية التي تضع علامات على الأنسجة واسعة النطاق مع الحفاظ على سلامة الأنسجة من شأنها أن تقدم بشكل كبير البروتوكول المقدم هنا.
الأهمية فيما يتعلق بالأساليب الحالية والتطبيقات المستقبلية لهذه التقنية
في هذه الدراسة ، نصف بروتوكولا مفصلا للتصوير العصبي من الهياكل الميزوسكوبية إلى المجهرية باستخدام مسح الأنسجة ScaleSF. يتيح البروتوكول الموصوف هنا تصور الهياكل العصبية من الدائرة إلى المستويات دون الخلوية في فترة زمنية معقولة دون معدات متخصصة ، مما يسهل فهم الهياكل العصبية من الدائرة إلى مقاييس المكونات. تقوم الخلايا العصبية بتطوير عمليات حماسية ذات طول هائل وترتيب هياكل دقيقة متخصصة لنقل المعلومات واستقبالها. وبالتالي ، يتطلب التصوير العصبي طريقة لتطهير الأنسجة تمارس قدرة تطهير قوية بالإضافة إلى مستوى عال من الحفاظ على الأنسجة من أجل التصور المتزامن لكل من الهياكل الكبيرة والصغيرة. ومع ذلك ، فإن طرق تطهير الأنسجة المميزة بقدرات إزالة عالية تزيل بقوة الدهون والأصباغ لتوضيح الأنسجة على نطاق واسع 3,4 ، مما يعرض سلامة الأنسجة للخطر5,6,17 (الشكل التكميلي 1). وهذا يتناقض تناقضا صارخا مع بروتوكول التطهير المستخدم هنا الذي يحقق مستوى عاليا من الحفاظ على الهيكل6 (الشكل التكميلي 1). وبالتالي ، فإن إزالة الأنسجة ScaleSF تسمح بالتصوير العصبي الفعال والكفء الذي يتطلب تصويرا 3D عالي الدقة متعدد المقاييس مع إعادة بناء إشارة دقيقة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
ويشكر المؤلفان يوكو إيشيدا (جامعة جونتيندو) على إنتاج نواقل فيروس AAV وكيسارا هوشينو (جامعة جونتيندو) على المساعدة التقنية. تم دعم هذه الدراسة من قبل JSPS KAKENHI (JP20K07231 to K.Y.; JP21H03529 إلى T.F. ؛ JP20K07743 إلى M.K. ؛ JP21H02592 إلى H.H.) والبحث العلمي في مجال الابتكار "الرنين الحيوي" (JP18H04743 إلى H.H.). تم دعم هذه الدراسة أيضا من قبل الوكالة اليابانية للبحث والتطوير الطبي (AMED) (JP21dm0207112 إلى T.F. و H.H.) ، و Moonshot R & D من الوكالة اليابانية للعلوم والتكنولوجيا (JST) (JPMJMS2024 إلى H.H.) ، والبحوث الموجهة نحو الانصهار للعلوم والتكنولوجيا المدمرة (FOREST) من JST (JPMJFR204D إلى H.H.) ، والمنح المقدمة من معهد أبحاث أمراض الشيخوخة في كلية الطب بجامعة جونتيندو (X2016 إلى K.Y. ؛ X2001 إلى H.H.)، ومشروع العلامة التجارية للمدارس الخاصة.
Materials
| Name | Company | Catalog Number | Comments |
| 16x multi-immersion objective lens | Leica Microsystems | HC FLUOTAR 16x/0.60 IMM CORR VISIR | |
| Agar | Nacalai Tesque | 01028-85 | |
| Agarose | TaKaRa Bio | L03 | |
| Dimethyl sulfoxide | Nacalai Tesque | 13407-45 | |
| D-Sorbitol | Nacalai Tesque | 06286-55 | |
| γ-cyclodextrin | Wako Pure Chemical Industries | 037-10643 | |
| Glycerol | Sigma-Aldrich | G9012 | |
| Huygens Essential | Scientific Volume Imaging | ver. 18.10.0p8/21.10.1p0 64b | |
| Imaris | Bitplane | ver. 9.0.0 | |
| Leica Application Suite X | Leica Microsystems | LAS X, ver. 3.5.5.19976 | |
| Methyl-β-cyclodextrin | Tokyo Chemical Industry | M1356 | |
| Paraformaldehyde | Merck Millipore | 1.04005.1000 | |
| Phosphate Buffered Saline (10x; pH 7.4) | Nacalai Tesque | 27575-31 | 10x PBS(–) |
| Sodium azide | Nacalai Tesque | 31233-55 | |
| Sodium pentobarbital | Kyoritsu Seiyaku | N/A | |
| TCS SP8 | Leica Microsystems | N/A | |
| Triton X-100 | Nacalai Tesque | 35501-15 | |
| Urea | Nacalai Tesque | 35940-65 | |
| Vibrating tissue slicer | Dosaka EM | PRO7N |
References
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chemical Biology. 23 (1), 137-157 (2016).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annual Reviews of Cell and Developmental Biology. 32, 713-741 (2016).
- Ueda, H. R., et al. Whole-brain profiling of cells and circuits in mammals by tissue clearing and light-sheet microscopy. Neuron. 106 (3), 369-387 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews. Neuroscience. 21 (2), 61-79 (2020).
- Hama, H., et al. ScaleS: an optical clearing palette for biological imaging. Nature Neuroscience. 18 (10), 1518-1529 (2015).
- Furuta, T., et al. Multi-scale light microscopy/electron microscopy neuronal imaging from brain to synapse with a tissue clearing method, ScaleSF. iScience. 25 (1), 103601(2022).
- Miyawaki, A., et al. Deep imaging of cleared brain by confocal laser-scanning microscopy. Protocol Exchange. , (2016).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protocols. 2 (1), 100230(2021).
- Kameda, H., et al. Parvalbumin-producing cortical interneurons receive inhibitory inputs on proximal portions and cortical excitatory inputs on distal dendrites. The European Journal of Neuroscience. 35 (6), 838-854 (2012).
- Sohn, J., et al. A single vector platform for high-level gene transduction of central neurons: Adeno-associated virus vector equipped with the Tet-off system. PLoS One. 12 (1), 0169611(2017).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14 (11), 1481-1488 (2011).
- Stepanyants, A., Martinez, L. M., Ferecsko, A. S., Kisvarday, Z. F. The fractions of short- and long-range connections in the visual cortex. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3555-3560 (2009).
- Kuramoto, E., et al. Two types of thalamocortical projections from the motor thalamic nuclei of the rat: a single neuron-tracing study using viral vectors. Cerebral Cortex. 19 (9), New York, N.Y. 2065-2077 (2009).
- Matsuda, W., et al. Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 29 (2), 444-453 (2009).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nature Methods. 15 (12), 1033-1036 (2018).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281 (2019).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6, 34331(2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved