Method Article
Использование аналога пиримидина, 5-йод-2'-дезоксиуридина (IdU) с маркерами клеточного цикла для установления фаз клеточного цикла на платформе массовой цитометрии
В этой статье
Резюме
Этот протокол адаптирует измерения клеточного цикла для использования в платформе массовой цитометрии. Благодаря многопараметрическим возможностям массовой цитометрии прямое измерение включения йода позволяет идентифицировать клетки в S-фазе, в то время как маркеры внутриклеточного цикла позволяют характеризовать состояние каждого клеточного цикла в различных экспериментальных условиях.
Аннотация
Регуляция фазы клеточного цикла является важным аспектом клеточной пролиферации и гомеостаза. Нарушение регуляторных механизмов, регулирующих клеточный цикл, является особенностью целого ряда заболеваний, в том числе онкологических. Изучение клеточного цикла требует способности определять количество клеток в каждой части прогрессии клеточного цикла, а также четко разграничивать каждую фазу клеточного цикла. Появление массовой цитометрии (MCM) обеспечивает огромный потенциал для высокопроизводительного анализа отдельных клеток посредством прямых измерений элементарных изотопов, а разработка метода измерения состояния клеточного цикла с помощью MCM еще больше расширяет полезность MCM. Здесь мы описываем метод, который непосредственно измеряет 5-йодо-2'-дезоксиуридин (IdU), аналогичный 5-бром-2'-дезоксиуридину (BrdU), в системе MCM. Использование этого MCM на основе IdU дает несколько преимуществ. Во-первых, IdU быстро включается в ДНК во время ее синтеза, что позволяет надежно измерять клетки в S-фазе с инкубацией всего за 10-15 минут. Во-вторых, IdU измеряется без необходимости вторичных антител или необходимости деградации ДНК. В-третьих, окрашивание IdU можно легко комбинировать с измерением циклина B1, фосфорилированного белка ретинобластомы (pRb) и фосфорилированного гистона H3 (pHH3), что в совокупности обеспечивает четкое разграничение пяти фаз клеточного цикла. Комбинация этих маркеров клеточного цикла с большим количеством параметров, возможных с MCM, позволяет комбинировать их со многими другими показателями.
Введение
Масс-цитометрия позволяет обнаруживать около 40 параметров, используя преимущества высокого разрешения и количественного характера масс-спектроскопии. Антитела, меченные металлами, используются вместо флуорофорных конъюгированных антител, которые допускают большее количество каналов и производят минимальный побочный эффект 1,2. MCM имеет преимущества и недостатки в отношении анализа клеточного цикла по сравнению с проточной цитометрией. Одним из основных преимуществ MCM является то, что большое количество параметров позволяет одновременно измерять состояние клеточного цикла в большом количестве иммунофенотипически различных типов Т-клеток в очень гетерогенных образцах. MCM успешно используется для измерения состояния клеточного цикла при нормальном кроветворении в костном мозгечеловека 3 и трансгенных мышиных моделях дефицита теломеразы4. Анализ состояния клеточного цикла при остром миелоидном лейкозе (ОМЛ) показал, что клеточный цикл коррелирует с известными реакциями на клиническую терапию, обеспечивая понимание in vivo функциональных характеристик, которые могут информировать о выборе терапии5. Вторым преимуществом массового цитометрического анализа клеточного цикла является возможность измерения большого количества других функциональных маркеров, которые могут быть коррелированы с состоянием клеточного цикла. Недавняя работа смогла коррелировать синтез белка и РНК с состоянием клеточного цикла с помощью IdU и меченных металлами антител к BRU и рРНК6. Такой высокопараметрический анализ, измеряющий состояние клеточного цикла в многочисленных популяциях в континууме дифференцировки, был бы практически невозможен с современной технологией проточной цитометрии. Основным недостатком MCM является отсутствие сопоставимых красителей ДНК или РНК, используемых во флуоресцентной проточной цитометрии (например, DAPI, Hoechst, Pyronin Y и т. Д.). Флуоресцентные красители могут давать относительно точные измерения содержания ДНК и РНК, но эта точность возможна только благодаря изменениям флуоресцентных свойств этих красителей, которые происходят при интеркаляции между нуклеотидными основаниями. Таким образом, анализ MCM не может измерить содержание ДНК или РНК с аналогичной точностью. Вместо этого массовый цитометрический анализ клеточного цикла основан на измерениях белков, связанных с состоянием клеточного цикла, таких как циклин B1, фосфорилированный белок ретинобластомы (pRb) и фосфорилированный гистон H3 (pHH3) в сочетании с прямым измерением атома йода от включения IdU в клетки S-фазы. Эти два подхода к измерению дают очень похожие результаты во время нормальной клеточной пролиферации, но потенциально могут быть диссонирующими, когда прогрессирование клеточного цикла нарушается.
Измерение количества клеток в каждой фазе клеточного цикла важно для понимания нормального развития клеточного цикла, а также нарушения клеточного цикла, которое обычно наблюдается при раке и иммунологических заболеваниях. MCM обеспечивает надежное измерение внеклеточных и внутриклеточных факторов с использованием метенных металлом антител; однако измерение S-фазы было ограничено, поскольку интеркалятор ДНК на основе иридия не мог различать 2N и 4N ДНК. Чтобы определить фазы клеточного цикла, Бехбехани разработал метод, в котором используется IdU с массой 127, который попадает в диапазон массового цитометра и позволяет напрямую измерять клетки в S-фазе3. Это прямое измерение обходит необходимость во вторичных антителах или использовании денатурирующих ДНК агентов, таких как кислота или ДНКаза. В сочетании с маркерами внутриклеточного цикла он обеспечивает высокое разрешение распределения клеточного цикла в экспериментальных моделях.
Этот протокол адаптирует измерения клеточного цикла из общих протоколов проточной цитометрии для MCM. Наши методы обеспечивают удобный и простой способ включения параметров клеточного цикла. Для включения образцов IdU in vitro требуется всего от 10 до 15 минут инкубации при 37 ° C, что короче, чем у большинства протоколов окрашивания BrdU, которые рекомендуют время инкубации в несколько часов 3,7. Образцы, включенные в IdU и BrdU, могут быть зафиксированы с помощью протеомного стабилизатора, а затем храниться в течение некоторого времени в морозильной камере с температурой -80 °C. Это позволяет архивировать большое количество образцов, окрашенных IdU, для пакетного анализа без снижения качества образцов.
протокол
1. Подготовка запасов IdU
- Растворить 5-йодо-2'-дезоксиуридин (IdU) в ДМСО до концентрации 50 мМ. Стерильный фильтр аликвотировать в пробирки по 10-50 мкл и хранить при температуре -80 °C
- Достаньте IdU из морозильной камеры и разморозьте при комнатной температуре. Разбавьте IdU в RPMI-1640, чтобы получить рабочий раствор при конечной концентрации 1 мМ. Пипеткой вверх и вниз или вихревым для перемешивания.
- Как правило, разводят концентрированный IdU в среде, в которой культивируются клетки (например, DMEM, IMDM и т. д.), или разбавляют его в PBS для добавления непосредственно к образцам аспирата периферической крови или костного мозга. Эта стадия предварительного разбавления облегчает смешивание ДМСО с водными средами интересующих клеток.
ПРИМЕЧАНИЕ: Конечная концентрация IdU во время инкубации должна составлять 10 мкМ; раствор 1 мМ можно добавить в соотношении 10 мкл на каждый 1 мл среды.
- Как правило, разводят концентрированный IdU в среде, в которой культивируются клетки (например, DMEM, IMDM и т. д.), или разбавляют его в PBS для добавления непосредственно к образцам аспирата периферической крови или костного мозга. Эта стадия предварительного разбавления облегчает смешивание ДМСО с водными средами интересующих клеток.
2. Инкубация IdU и сохранение образцов
- Храните образцы в увлажненном инкубаторе с температурой 37 °C. Извлеките образец из инкубатора и переместите образец в колпак биобезопасности.
- Добавьте 10 мкл 1 мМ IdU на каждый 1 мл образца.
- Для 6-луночного планшета добавьте 30 мкл 1 мМ IdU к 3 мл питательных сред в каждой лунке. IdU также можно использовать непосредственно в аспиратах костного мозга, а также в исследованиях на мышах4.
- Поместите образец обратно в инкубатор при температуре 37 °C на 10-15 минут. Поддерживайте клетки в оптимальных условиях роста, представляющих интерес во время воздействия IdU, чтобы получить наиболее точное измерение S-фазы.
- После инкубации IdU извлеките образец и переложите в коническую пробирку.
- Отжимайте образец при 400 x g в течение 10 мин при комнатной температуре.
- Аспирируют надосадочную жидкость и ресуспендируют в 200 мкл PBS.
- При необходимости выполните живое/мертвое окрашивание (с использованием цисплатина) на этом этапе, чтобы пометить мертвые клетки перед фиксацией и замораживанием.
ПРИМЕЧАНИЕ: Окрашивание живого/мертвого родия плохо работает после пермеабилизации метанолом, поэтому его не рекомендуется использовать в анализе клеточного цикла.
- При необходимости выполните живое/мертвое окрашивание (с использованием цисплатина) на этом этапе, чтобы пометить мертвые клетки перед фиксацией и замораживанием.
- Добавьте 18,75 мкл 16% параформальдегида (ПФА) в PBS для получения конечной концентрации 1,5% PFA. Инкубировать при комнатной температуре 10 мин. Отжимайте образец при 400 x g в течение 10 мин при комнатной температуре.
- Аспирируйте раствор PBS/PFA и повторно суспендируйте образец в 500 мкл среды для окрашивания клеток (CSM; 1x PBS с 0,5% BSA и 0,02% азида натрия) + 10% ДМСО перед замораживанием.
- При использовании коммерческого протеомного стабилизатора добавьте 280 мкл протеомного стабилизатора в образец, повторно взвешенный в 200 мкл PBS (1:1,4). Инкубируйте образцы при комнатной температуре в течение 10 минут, а затем поместите непосредственно в -80 °C.
ПРИМЕЧАНИЕ: Было показано, что IdU эффективно включается в течение 10-15 минут инкубации при 37 ° C. Инкубация IdU продолжительностью более 10-15 минут будет постепенно снижать разрешение популяций S и G2-фазы, поскольку меченные IdU клетки покидают S-фазу и переходят в фазу G2 или M. Мы также заметили, что длительная инкубация с IdU может вызвать гибель клеток и артефакты клеточного цикла. Последующая клеточная обработка и окрашивание антител после включения IdU достаточны для вымывания остаточного IdU, который не был включен в клетки S-фазы. Мы не наблюдали значительного йодного фона при использовании протокола in vitro, описанного здесь; Однако мы очень редко наблюдали загрязнение йодом в клинических образцах. Это может произойти из-за медицинских процедур, таких как контрастирование йода при компьютерной томографии, или из-за йодсодержащих фармацевтических препаратов. Если наблюдается большое количество фона IdU, образец не следует запускать, чтобы избежать повреждения детектора масс-цитометра.
- При использовании коммерческого протеомного стабилизатора добавьте 280 мкл протеомного стабилизатора в образец, повторно взвешенный в 200 мкл PBS (1:1,4). Инкубируйте образцы при комнатной температуре в течение 10 минут, а затем поместите непосредственно в -80 °C.
3. Окрашивание образцов для массовой цитометрии
- Снимите образцы с -80 °C и дайте им оттаять перед окрашиванием поверхности.
- При использовании метода фиксации SmartTube размораживайте образцы при 0-4 °C, чтобы избежать дополнительной фиксации по мере нагревания образцов.
- После того, как образцы будут разморожены, перенесите примерно 1-2 миллиона клеток в пробирку FACS объемом 5 мл.
- Центрифугируйте пробирку FACS при 600 x g в течение 5 мин и заполните пробирку FACS средой для окрашивания клеток (CSM) для промывки клеток. Повторите еще один раз.
- Если известно, что клетки слипаются, добавьте 400 ЕД / мл гепарина в промывки CSM, чтобы предотвратить контакт клеток с клетками, но это не является строго необходимым.
- Инкубируют клетки с FC-блокатором, 5 мкл агента на 100 мкл клеток, в течение 10 мин при комнатной температуре.
- Приготовьте смесь антител, которые окрасят поверхность или внеклеточную часть клеток. Общая окрашивающая смесь составит 100 мкл на 1-2 миллиона клеток в каждом тесте. Красящая смесь будет уравновешена соответственно CSM и гепарином в коктейле и пробирке FACS.
ПРИМЕЧАНИЕ: Добавление CSM на этом этапе также уменьшит количество неспецифических артефактов окрашивания8. Эта окрашивающая смесь полностью зависит от интересующих мишеней и поверхностного фенотипа (например, в исследовании с участием Т-клеток будет использоваться поверхностная смесь CD45, CD3, CD4, CD8 и т. д.). Подробный протокол обработки и окрашивания образцов можно найти в Behbehani and McCarthy et al.9,10. - Добавьте в клетки смесь для окрашивания поверхности и выдержите при комнатной температуре при непрерывном встряхивании в течение 30-60 мин.
- После окрашивания заполните пробирку FACS CSM и открутите при 600 x g в течение 5 мин.
- Промойте еще два раза с помощью CSM, вращая образец при 600 x g в течение 5 минут и аспирируя каждую стирку CSM.
- Зафиксируйте внеклеточные антитела, добавив 1 мл PBS с 10% CSM и 1,5% PFA.
- Заполните пробирку FACS, содержащую смесь PBS/CSM/PFA, CSM. Отжимайте при 600 x g в течение 5 минут и аспирируйте надосадочную жидкость.
- Добавьте метанол при -20 °C.
- Встряхните образец в течение 1-2 минут, чтобы получить суспензию одной клетки, и убедитесь, что все клеточные скопления были повторно суспендированы.
- Пока образец медленно вращается, быстро добавьте 1 мл ледяного метанола с помощью пипетки объемом 1000 мкл с наконечником фильтра.
- Поднесите трубку FAC к свету и убедитесь, что на ней нет видимых комков; Следует ожидать облачности. Любые скопления сделают образец непригодным для последующего анализа MCM.
- Храните образец при температуре -20 °C в течение 10-20 минут.
- За это время приготовьте внутриклеточную окрашивающую смесь. Внутриклеточная окрашивающая смесь будет зависеть от интересующих целей. Для анализа клеточного цикла включите в эту окрашивающую смесь CyclinB1, pRb, Ki67 и pHH3, но при необходимости можно добавить и другие внутриклеточные маркеры.
- Через 10-20 мин при -20 °C извлеките образец, добавьте 1,5 мл PBS и заполните остаток CSM.
- Центрифугируйте образец 600 x g в течение 5 мин и аспирируйте надосадочную жидкость.
- Промойте еще два раза CSM, отжимая образец при 600 x g в течение 5 минут и каждый раз аспирируя надосадочную жидкость.
- После последней промывки CSM центрифугируйте образец и оставьте остаточный объем примерно 50 мкл.
- Добавляют приготовленную смесь антител (обычно добавляют 50 мкл коктейля для окрашивания антител для достижения конечного объема окрашивания 100 мкл) к образцу и инкубируют на встряхивающей платформе в течение 30-60 минут при комнатной температуре.
- После окрашивания добавляют CSM и центрифугу при 600 x g в течение 5 мин.
- Аспирируйте CSM, снова промойте CSM, вращая при 600 x g в течение 5 минут, аспирируя CSM, затем добавьте PBS.
- После завершения внутриклеточного окрашивания поместите клетки в интеркаляторный раствор, который фиксирует антитела к клеткам и окрашивает ДНК каждой клетки, чтобы обеспечить идентификацию. Интеркаляторный раствор содержит неизотопно чистый иридиевый интеркалятор (пентаметилциклопентадиенил-Ir(III)-дипиридофеназин), добавленный из исходного раствора производителя в концентрации 500 мкМ. Разбавьте иридиевый запас 1:4000 в растворе PBS и 1,5% PFA. Добавьте раствор иридиевого интеркалатора в концентрации 100-200 мкл на миллион клеток, чтобы равномерно окрасить и предотвратить переокрашивание.
ПРИМЕЧАНИЕ: Иридий в этом растворе интеркалатора предназначен для идентификации клеток для синглетного стробирования, его не следует использовать для живых/мертвых пятен. Если желательны живые/мертвые пятна, их необходимо выполнить перед фиксацией, как отмечено выше и в McCarthy et al.9. - Храните образцы в растворе интеркалятора в холодильнике при температуре 4 °C до двух недель до получения образца на CyTOF.
4. Работа масс-цитометра
ПРИМЕЧАНИЕ: Операция массовой цитометрии может быть специфической для машины. Перед началом работы всегда рекомендуется ознакомиться с руководством пользователя CyTOF. Кроме того, в настоящее время есть две статьи JoVE, посвященные запуску и техническому обслуживанию машин 9,11.
- Перед работой масс-цитометра проверьте небулайзер на наличие засоров, трещин и других неровностей.
- Подключите небулайзер к цитометру и начните процедуру прогревания. Не запускайте массовый цитометр без установленного небулайзера.
- Пропустите воду через линии отбора проб, как только масс-цитометр закончит прогрев. Перед настройкой или анализом образца температура в распылительной камере должна нагреться примерно до 200 °C.
- Пропустите воду на 5-10 мин. Через 5-10 минут загрузите решение для настройки и выберите менеджер настройки. Настроечное решение представляет собой раствор, содержащий фиксированные концентрации металлов и используемый для оптимизации массы цитометра перед взятием образца
- В диспетчере настройки выберите Предварительный просмотр после того, как решение настройки достигнет записи попадания в устойчивое состояние, чтобы начать процесс автоматической настройки.
- После завершения настройки загрузите пробоотборник водой и дайте воде пройти через пробоотборные линии во время обработки пробы. Подробный протокол ежедневной работы и настройки цитометра можно найти по адресу Leipold11.
- Иногда автоматическая настройка не настраивается на оптимальную производительность машины. Повторите процедуру настройки, чтобы исправить это.
- Перед взятием образца промойте образец CSM один раз и чистой деионизированной водой дважды. Промывание водой важно для удаления остатков соли из PBS/CSM.
- Проверьте чувствительность и расход образца с помощью поставляемых производителем уравновешивающих шариков, полистирольных шариков, загруженных известными концентрациями металлов.
- Измените режим сбора данных с настройки на режим захвата событий. Установите ограничение по времени остановки сбора данных на уровне 120 с. Подождите 45 секунд, прежде чем выбрать «Запись».
- Масс-цитометр автоматически остановит сбор образца через 120 секунд. Используйте средство просмотра графика дождя, чтобы проверить интенсивность Eu151 и Eu153.
- Разбавьте шарики равновесия в чистой деионизированной воде в соотношении 1:20.
- Перед взятием образца проверьте диспетчера эксперимента. Используйте диспетчер экспериментов, чтобы назначать имена каналам и добавлять каналы для записи.
- Убедитесь, что 127-й канал добавлен при использовании IdU.
- Обратите внимание, что перед взятием образца важно настроить масс-цитометр для измерения необходимых параметров (например, IdU). Если каналы не выбраны заранее, данные не будут собираться ни с одного невыбранного канала и не могут быть восстановлены.
- Разбавьте клетки до концентрации примерно 1-2 x 106 / мл, используя чистую деионизированную воду 1:20 и смесь уравновешивающих шариков. Пропустите ячейки через трубку FACS с фильтром, чтобы удалить остатки комков.
- Загрузите образец и измените время сбора.
- Нажмите кнопку «Просмотр» и дождитесь стабилизации количества событий в секунду.
- Не запускайте события, превышающие 400 событий в секунду, это приведет к значительному количеству дублетов и мусора. Обычно мы собираем от 20 000 до 50 000 клеточных событий, но оптимальное количество будет зависеть от дизайна эксперимента. Окрашивание до 2 миллионов клеток обычно дает от 300 000 до 400 000 клеточных событий. Обратите внимание, что не все события будут ячейками (в подсчет событий будут включены события мусора и бусин).
- После того, как отбор проб завершен, загрузите моющий раствор, начните индукцию образца и работайте в течение 5-10 минут. Через 5-10 минут прекратите индукцию образца и запустите воду на 10-20 минут. Промывочный раствор представляет собой слабый раствор плавиковой кислоты, предназначенный для удаления остатков металла из линий отбора проб.
- Выключите масс-цитометр и извлеките небулайзер. Небулайзер будет горячим, будьте осторожны во время обращения.
5. Анализ данных
- Чтобы удалить шарики, а также исправить дрейф сигнала во время сбора образцов, нормализуйте файлы FCS с помощью программного обеспечения Fluidigm или приложения, разработанного Finck12.
- Загрузите FCS в Cytobank или другое программное обеспечение для анализа проточной цитометрии. Файлы FCS могут использоваться в любом совместимом программном обеспечении, для целей этого протокола все стробирование и дальнейший анализ были выполнены в Cytobank13.
- Прежде чем можно будет нарисовать ворота клеточного цикла, исключите любые дублеты или клеточный мусор из последующего анализа, это можно сделать с помощью двухосного графика зависимости длины события от 191-Ir (рис. 1a). Клетки будут формировать отчетливую, яркую популяциюIr high , которая может быть использована для исключения дублетов и мусора. Это синглетные ворота. Этот метод стробирования обычно удаляет около 50-60% событий дублетных клеток, поэтому могут потребоваться дополнительные стратегии для удаления оставшихся событий дуплетных клеток.
- Измените шкалу длины события (минимальную и максимальную), чтобы клетки выглядели более заметными, чтобы помочь в синглетном стробировании.
- Далее удалите дублеты и мусор с помощью параметров Гаусса, остатка и смещения. Более высокий остаток с меньшим смещением также является мусором и дублетами, и стробирование вокруг этой популяции может дополнительно удалить дублеты и мусор (рис. 1b, c).
- Стробирование S-фазы - S-фаза - самый простой затвор для рисования, но также и самый важный. Нарисуйте этот затвор, используя двухосный график IdU против pRb, Ki67 или cyclinB1. Клетки S-фазы IdU+ образуют отдельную популяцию при взгляде на эти двухосные графики (рис. 2b).
- G0/G1-фаза, G2/M-фазовое стробирование – Установите фазовые затворы G0/G1 и G2/M на графике IdU vs CyclinB1, и использование включения IdU имеет решающее значение для установления границы между фазовыми затворами G0/G1 и G2/M. G0 / G1-фаза будет CyclinB1низкой / IdU-, а G2 / M-фаза будетCyclinB1 высокой / IdU-. Хорошее окрашивание CyclinB1 покажет естественную популяцию между популяциями G0-G1 и G2-M; Однако это будет варьироваться в зависимости от образца и типа клеток в экспериментальных условиях. В экспериментальных условиях, когда может быть нарушено распределение клеточного цикла и существует меньшее разделение между G0/G1-фазой CyclinB1 и G2/M-фазой, использование S-фазы позволит обеспечить последовательное стробирование для определенных типов клеток в каждом конкретном эксперименте. Этот метод подробно описан ниже.
- Нанесите на график только ячейки S-фазы на CyclinB1 и IdU, чтобы помочь установить разделение между G0 / G1-фазой и G2 / M-фазой. Нарисуйте ворота навысокой популяции CyclinB1 и отрегулируйте их до тех пор, пока примерно 5% верхних 5% популяции S-фазы не окажутся внутри ворот (рис. 2c). При этом устанавливается точка разрыва между фазовыми затворами G0/G1 и G2/M (рис. 2, e,f). Активная популяция будет изменена на интересующую популяцию, и часть, находящаяся внутри предыдущих ворот, будет популяцией G2/M-фазы, а остальная часть будет популяцией G0/G1-фазы.
- G0-фазное стробирование - Установите G0-фазу на графике pRb против IdU. Фаза G0 будет представленапопуляцией pRb low/IdU-. Активная циклическая популяция будет иметь высокую экспрессию включения pRb и IdU, на этой границе можно нарисовать G0-фазовый гейт, поскольку он обычно экспрессируется в двух различных популяциях (рис. 2g,i).
- Определите G0-фазу, сделав популяцию S-фазы, нарисованную ранее (рис. 2b), активной популяцией и нарисовав ворота, включающие верхние 90-100% населенияс высоким pRb. Это популяция велосипедистов pRb+ (рис. 2i),низкая популяция pRb за пределами этих ворот — популяция G0 (рис. 2j).
- Если pRb недоступен или не может быть записан, используйте Ki67 против IdU для определения популяции G0-фазы. Нарисовав ворота, представляющие большую часть популяции S-фазы, и используя эти ворота в качестве границы для Ki67 и IdU, остальная часть популяции будет G0-фазой (рис. 3a).
- Стробирование M-фазы - Установите M-фазу на двухосном графике IdU и pH3. М-фаза представляет собой очень маленькую часть клеток и ограничена популяциейс высоким рН3 (рис. 2d).
- Включение IdU не удалось или было невозможно - Если IdU недоступен, определите циклические и не циклические фракции клеток, используя Ki67 и pRb. Ki67 и pRb в нормальных условиях образуют две различные популяции: Ki67 свысоким /высоким pRb и Ki67с низким / низким уровнемpRb. Двойная положительная популяция представляет собой активную велосипедную популяцию, коррелирующую с G1-фазой, S-фазой, G2-фазой и М-фазой. Двойная низкая популяция представляет собой нециклическую популяцию, коррелирующую с G0-фазой (рис. 3b).
ПРИМЕЧАНИЕ: Невозможно разграничить каждую отдельную фазу с использованием Ki67 против pRb, но экспериментальное воздействие на относительные циклические/нециклические популяции могут быть определены. - Анализ клеточного цикла - После того, как ворота установлены, экспортируйте числовые значения из ворот для дальнейшего анализа. Проценты в каждом цикле могут быть достигнуты путем вычитания отдельных популяций из объединенных популяций. G0-фаза, нарисованная нанизком уровне IdU pRb, процент затвора может быть вычтен из G0/G1-фазы, нарисованной наCyclinB1 с низкимотрицательным IdU, чтобы найти процент G1-фазы. Точно так же процент фазы G2 получается из вычитания затвора М-фазы из затвора G2/M-фазы. Это приведет к получению числовых значений для каждой отдельной фазы клеточного цикла; G0, G1, S, G2 и M. Числовые значения, сгенерированные для каждой отдельной фазы клеточного цикла, могут быть использованы для дальнейшего анализа, такого как построение графиков и статистический анализ.
Результаты
Используя клетки HL-60 и аспират костного мозга человека, можно показать, как экспериментальные условия могут влиять на распределение и анализ клеточного цикла. Во-первых, необходимо разработать стратегию стробирования, чтобы продемонстрировать, как формируются фазы клеточного цикла. На рисунке 1 мы показываем создание синглетных ворот, которые важны для разделения клеточного мусора и дублетов, создания единой клеточной популяции. Для клеточных линий синглетные ворота - это все, что нужно для перехода к анализу клеточного цикла (рис. 2a). Для образцов человека иммунофенотипические популяции, как правило, должны быть установлены до анализа клеточного цикла, поскольку точные границы каждого ворот клеточного цикла могут варьироваться для разных типов клеток. После того, как популяции будут установлены (обычно путем стробирования поверхностных маркеров, определяющих эту популяцию), необходимо будет установить ворота клеточного цикла. На рисунке 2b показано установление S-фазы на двухосном графике IdU и CyclinB1. Этот график также используется для установления границы затвора G2/M-фазы (рис. 2f). После того, как G2/M-фаза установлена, остаток представляет собой G0/G1-фазный затвор (рис. 2f). IdU vs pRb используется для создания популяции циклов pRb + путем создания ворот на IdU, включающих клетки (рис. 2g, i). Популяция pRb+/IdUneg за пределами этих ворот представляет собой G0-фазу (рис. 2j). М-фаза устанавливается на IdU по сравнению с pHH3, где клетки М-фазы экспрессируют высокие уровни pHH3 и не проявляют включения IdU (рис. 2k). В случае, если pRb не включен, G0-фаза может быть реплицирована с использованием Ki67 аналогично способу, описанному выше (рис. 3a). Если включение IdU не удалось или не было выполнено, все еще можно определить относительные доли циклов с помощью Ki67 и pRb. При использовании Ki67 и pRb образуются две различные популяции: двойная положительная популяция pRb+/Ki67+ инизкая популяция pRblow/Ki67. Двойная положительная популяция представляет клетки в цикле, в то время как низкая представляет клетки, не находящиеся в цикле (рис. 3b). Используя IdU, включающие клетки и клетки с низким содержанием pRb без включения IdU, мы показываем, что S-фаза в основном находится в популяции pRb+/Ki67+, в то время как G0-фаза в основном находится впопуляции с низким уровнем pRb/Ki67.
Анализ клеточного цикла опирается на хорошую экспериментальную технику, особенно на этапе инкубации IdU. В то время как инкорпорация IdU является гибкой (применимой в клеточных культурах, аспиратах костного мозга и даже в исследованиях на мышах), необходимо выполнять включение и фиксацию IdU, не нарушая состояние клеточного цикла, представляющее интерес для эксперимента. Маркировка IdU и, следовательно, последующий анализ клеточного цикла могут значительно зависеть от времени и температуры, как показано на рисунке 4. Клетки, которые слишком долго остаются в закрытых сосудах или могут быть встречены при транспортировке проб или транспортировке образцов между местами, будут иметь пониженную долю S-фазы и не будут точными для анализа клеточного цикла (рис. 4a). Однако короткие периоды времени, в общей сложности менее часа, будут иметь нормальное распределение клеточного цикла, что указывает на то, что быстрый транспорт не может отрицательно повлиять на анализ клеточного цикла (рис. 4b). Другим важным модификатором является криоконсервация, которая обычно используется в большинстве лабораторий. При исследовании состояния клеточного цикла в криоконсервированных клетках может потребоваться длительный период равновесия, прежде чем клетки вернутся к активному клеточному циклу, который все еще может не отражать состояние клеточного цикла до циросконсервации (рис. 4c).
Первичные человеческие образцы часто представляют собой композиты из нескольких разных типов клеток, эти разные типы клеток могут иметь разную чувствительность к обработке, что приводит к различному стробированию клеточного цикла. В двух аспиратах костного мозга, которые были немедленно мечены IdU, хранились в течение 30 минут до маркировки IdU или криогенно хранились после разделения по Фиколлу, существуют различия между каждым образцом и популяцией (рис. 5a, b). Две иммунофенотипические популяции были исследованы на предмет различий в инкорпорации IdU; Т-клетки (CD45высокий/CD3высокий) и монобласты (CD33+, HLADR+, CD11bнизкий, CD14отрицательный). При правильном сочетании поверхностных меток можно исследовать дальнейшие иммунофенотипические популяции. В костном мозге #2 наблюдался заметный эффект активации Т-клеток после 30 минут хранения, который не наблюдался в монобластах у того же пациента (рис. 5b). Как и в культивируемых клетках, после криогенного хранения наблюдались заметные изменения в маркировке IdU, которые также зависели от популяции. Костный мозг #1 имел снижение популяции Т-клеток, но увеличение фракций, меченных IdU монобластов, по сравнению с исходным уровнем (рис. 5 a, b), костный мозг #2 показал снижение как Т-клеток, так и монобластов по сравнению с исходным уровнем (рис. 5a, b). Замороженные клетки затем требуют заметного инкубационного периода, прежде чем вернуться к нормальному состоянию клеточного цикла, и это может повлиять на исследования, которые полагаются на изменение состояния клеточного цикла или состояния клеточного цикла в качестве показателя лекарственного или экспериментального эффекта.
Еще одним преимуществом MCM является способность различать клетки при остановке клеточного цикла или с аномальным распределением клеточного цикла. В то время как ДНК-красители, обычно используемые в проточной цитометрии, способны различать содержание 2N и 4N ДНК, они очень яркие, что может значительно усложнить измерение других параметров этого лазера. IdU, однако, занимает только один массовый канал и имеет минимальный перелив, что позволяет использовать другие маркеры для определения клеточного цикла. Клетки MOLM13, которые были облучены, показывают снижение включения IdU и уменьшение М-фазы по сравнению с контрольными клетками (рис. 6). Нарушение нормальных контрольных точек клеточного цикла может изменить видимое состояние клеточного цикла MCM. Глядя на популяции pH2AX и cPARP в необлученных клетках, низкая популяция pH2AX инизкая популяция cPARP показывают нормальное распределение клеточного цикла, в то время как клетки, экспрессирующие более высокие уровни pH2AX или cPARP, локализуются в основном в фазе G0 / G1, что ожидается (рис. 6a). В облученных клетках pH2AXнизкий иcPARP низкий, однако клетки почти полностью локализованы в G0-фазе, в то время какклетки pH2AX с высоким инизким cPARP демонстрируют фенотип остановки клеточного цикла с включением IdU и локализацией в G0/G1-фазу и G2-фазу с отсутствием М-фазы. Клеткис высоким pH2AX ивысоким уровнем cPARP также показывают клетки, включающие некоторое количество IdU и локализованные в фазе G0 / G1, что указывает на радиационное повреждение (рис. 6b).
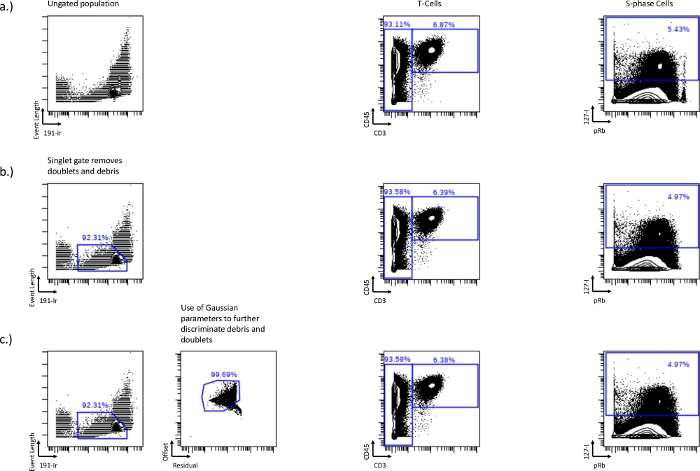
Рисунок 1: Установление синглетных ворот с использованием 191-Ir по длине события, а также гауссовским параметрам, остатку и смещению.
Различия в Т-клетках (CD45+/CD3+) и S-фазе (IdU+) между неочищенным образцом (a), продолжительностью события и 191-Ir синглетным затвором (b) или синглетным затвором в сочетании с гауссовскими параметрами, остаточностью и смещением (c). Синглетное стробирование удаляет обломки, дублеты и шарики, показанные в потеревысокой популяции pRb в правом углу двухосного крыла. Этот синглетный затвор может быть дополнительно оптимизирован путем включения гауссовских параметров, таких как остаток и смещение, удаляя больше мусора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
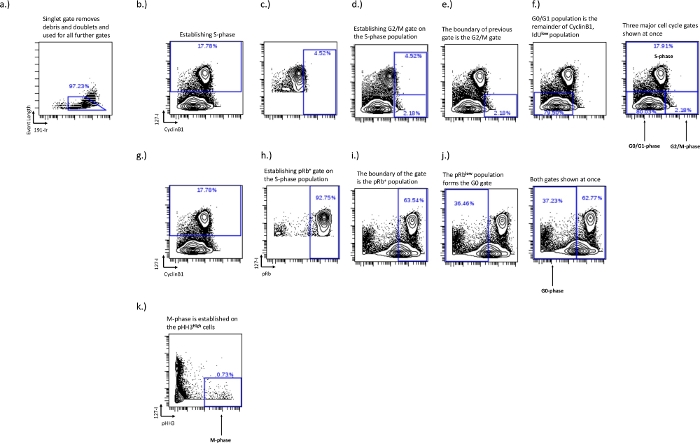
Рисунок 2: Стробировочная схема для установления затворов клеточного цикла для фаз G0, G1, S, G2 и M с использованием IdU, CyclinB1, pRb и pHH3.
Синглетный затвор устанавливается для удаления дублетов и мусора (а). S-фаза должна быть установлена (b), как только S-фаза установлена, популяция IdU+ может быть использована для установления границы G2/M-фазы (c, d). Установление границы G2/M-фазы устанавливает границы популяции G0/G1-фазы (f). Популяция pRb+ и G0-фазы устанавливается на двухосном IdU и pRb. Клетки IdU+ (h) используются для установления границы популяции pRb+ (i). Граница популяции pRb+ устанавливает границу популяции G0-фазы (j). М-фаза устанавливается на клетках pHH3+, которые являются IdU- (k). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
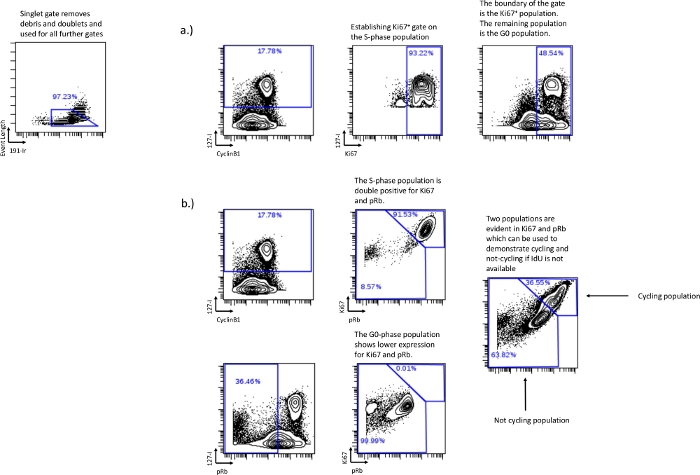
Рисунок 3: Установка ворот клеточного цикла без использования pRb или без использования включения IdU.
Рисование G0-фазы также может быть выполнено с использованием Ki-67 в соответствии с той же стратегией стробирования, которая использовалась с pRb, если pRb не включен в эксперимент (а). Если включение IdU не удалось или не было выполнено, можно все же восстановить относительные фракции клеточного циклирования с помощью Ki67 и pRb. Двойная положительная экспрессия Ki67 и pRb коррелирует с клетками в цикле, о чем свидетельствует демонстрация того, что клетки IdU + обнаруживаются в основном в двойной положительной популяции (b). Низкая популяция Ki67 и pRb коррелирует с популяцией G0-фазы или нецикличной популяцией, демонстрируемой клетками pRb с низким / IdUneg, обнаруженными в популяциис низким содержанием Ki67 и pRb. Этот метод не может различать отдельные фазы клеточного цикла, но все же может быть использован для определения относительных фракций цикла в экспериментальных условиях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Репрезентативные цифры влияния различных условий хранения на распределение клеток HL-60 в клеточном цикле.
Клетки инкубировали в течение часа с последующим часовым отдыхом при указанных температурных условиях в герметичных пробирках (а). Наблюдается заметное влияние на распределение клеточного цикла по сравнению с контролем. Клетки HL60 хранили в герметичных пробирках при комнатной температуре в течение 30 минут, что может произойти в клинических условиях до включения IdU (b). Герметичные пробирки, хранящиеся при комнатной температуре в течение 30 минут, не показали заметных различий в клеточном цикле. Было исследовано влияние криогенного хранения на клеточный цикл в клетках HL60, где образец был взят перед криогенным хранением, а образец - после часового отдыха после недели в криогенном хранилище (c). Через час после оттаивания распределение клеточного цикла нарушается, и распределение клеточного цикла не возвращается к норме примерно через неделю после оттаивания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Обработка может оказывать влияние на образцы пациентов, и репрезентативные изображения показаны между двумя разными пациентами, показывающими (а) Т-клетки (CD45 высокий / CD3высокий) и (б) монобласты (CD33+, HLADR+, CD11bнизкий,CD14 отрицательный).
Между первым и вторым костным мозгом ясно, что в костном мозге 2 наблюдался эффект активации Т-клеток во время 30-минутного отдыха, тогда как в первом костном мозге такого эффекта не было. Первый костный мозг показал возможный эффект активации в популяции монобластов через 30 минут, в то время как второй костный мозг этого не сделал. Однако в обоих костных мозгах было ясно, что криогенное хранение влияет на распределение клеточного цикла независимо от типа клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Клетки MOLM13 либо оставляли в качестве контроля, либо облучали с помощью рентгеновского облучателя при 10 Гр.
Клетки MOLM13 показывают распределение клеточного цикла в четырех различных популяциях экспрессии pH2AX и cPARP. Контрольные клетки демонстрируют минимальное окрашивание pH2AX и cPARP, при этом нормальные характеристики клеточного цикла проявляются в популяции с низким pH2AX инизким уровнем cPARP (a). В то время как облученные клетки демонстрируют аномальное распределение клеточного цикла, при этом большинство циклических клеток расположены на высоком уровне pH2AX ивысоком уровне cPARP, что указывает на нарушение клеточного цикла (b). Неповрежденные клетки с низким pH2AX инизким уровнем cPARP, демонстрирующие отсутствие циклических характеристик, в основном обнаруживаются в G0-фазе. Без этих маркеров эти клетки выглядели бы как клетки 4N и 2N при нормальной проточной цитометрии, что может привести к путанице в последующем анализе клеточного цикла. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Представленные здесь примеры демонстрируют, как использовать платформу MCM для анализа распределения клеточного цикла. Также было продемонстрировано, что анализ клеточного цикла чувствителен к экспериментальным условиям, таким как время и температура, что является важным соображением, которое исследователи должны учитывать при рассмотрении MCM для анализа клеточного цикла14. Образцы, оставленные на хранение в течение короткого периода времени, не более часа, будут иметь инкорпорацию IDU, сравнимую с их нормальным состоянием. Образцы в закрытой системе в течение длительных периодов времени, примерно 2 часа, будут иметь уменьшенное включение IdU, однако относительные циклические и нециклические фракции не изменятся, что позволит провести анализ грубого клеточного цикла. Криогенное хранение и последующее размораживание нарушают нормальное распределение клеточного цикла в течение значительного периода времени. Ранее было отмечено, что криогенное хранение нарушает распределение белка и РНК, но только недавно было показано, что оно нарушает клеточный цикл14,15,16,17. Взятые вместе, они указывают на то, что если ожидается длительное время хранения или криогенная консервация образцов, было бы лучше окрасить клетки IdU перед хранением или криогенным хранением, зафиксировать клетки и хранить их до тех пор, пока не будет проведен анализ. Поскольку для анализа клеточного цикла с помощью MCM не требуются живые клетки, это позволит исследователям хранить драгоценные образцы и выполнять точный анализ клеточного цикла.
Анализ клеточного цикла с помощью MCM представляет собой надежную систему, способную глубоко опрашивать экспериментальные модели. Из-за большого количества параметров MCM, примерно 40-50 массовых каналов, анализ клеточного цикла может быть объединен с другими внутриклеточными или внеклеточными маркерами, минуя необходимость сортировки клеток на основе иммунофенотипа, что может привести к потере значительных эффектов клеточного цикла. Высокопараметрическая природа MCM позволяет исследовать эффекты в многомерных картографических приложениях, таких как SPADE и viSNE. В то время как SPADE и viSNE обычно используются для определения иммунофенотипических популяций, которые затем могут быть исследованы на предмет изменений клеточного цикла, также можно будет сопоставлять маркеры клеточного цикла. В зависимости от условий эксперимента картирование маркеров клеточного цикла в многомерном пространстве может показать корреляцию клеточного цикла с эффектом лекарственного средства или то, какие иммунофенотипические популяции могут локализоваться в каждом состоянии цикла 3,5. В то время как MCM может быть ограничен отсутствием ДНК-связывающих флуоресцентных красителей, это компенсируется прямым включением IdU во время клеток S-фазы, а белки внутриклеточного клеточного цикла могут использоваться для определения состояния клеточного цикла. Эти белки клеточного цикла также могут помочь различать стадии остановки клеточного цикла, которые в противном случае выглядели бы как 3N или 4N в традиционном потоке с использованием ДНК-связывающих красителей. Однако такие высокопараметрические системы не лишены недостатков и чувствительны к нарушениям клеточного цикла. Мы показали, что длительное время хранения и криогенное хранение могут существенно повлиять на распределение клеточного цикла. Это особенно важно при попытке рационализировать экспериментальные эффекты для лекарств, которые могут влиять на распределение клеточного цикла. Обработка препаратами, предназначенными для воздействия на клеточный цикл на замороженных первичных образцах, может дать ложные данные об эффекте клеточного цикла при использовании сразу после размораживания из криогенного хранилища. MCM — это универсальная технология анализа клеточного цикла, которая может быть применена к ряду экспериментальных моделей и особенно подходит для глубокого профилирования гетерогенных систем. Как и в случае с другими высокопараметрическими методами, необходимо провести тщательно спланированный эксперимент с соответствующими соображениями о том, как обработка и экспериментальные эффекты повлияют на анализ клеточного цикла.
Раскрытие информации
Доктор Бехбехани получает поддержку в поездках от Fluidigm. Fluidigm также закупила реагенты и материалы для лабораторного использования.
Благодарности
Авторы хотели бы поблагодарить Палака Сехри, Хусама Алхалайле, Сяочи Чанга и Джастина Либергера за их экспериментальную поддержку. Эта работа была поддержана Программой стипендий Pelotonia. Любые мнения, выводы и заключения, выраженные в этом материале, принадлежат автору (авторам) и не обязательно отражают мнения Программы стипендий Pelotonia».
Материалы
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma | A3059 | Component of CSM |
| Centrifuge | Thermo Scientific | 75-217-420 | Sample centrifugation |
| Cleaved-PARP (D214) | BD Biosciences | F21-852 | Identification of apoptotic cells |
| Cyclin B1 | BD Biosciences | GNS-1 | G2 Resolution |
| Dimethylsulfoxide (DMSO) | Sigma | D2650 | Cryopreservative |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | Internal metal standard for CyTOF performance |
| FACS Tube w/ mesh strainer | Corning | 08-771-23 | Cell strainer to remove clumps/debris before CyTOF run |
| Fetal Bovine Serum (FBS) | VWR | 97068-085 | Cell culture growth supplement |
| Helios | Fluidigm | CyTOF System/Platform | |
| Heparin | Sigma | H3393 | Staining additive to prevent non-specific staining |
| IdU (5-Iodo-2′-deoxyuridine) | Sigma | I7125 | Incorporates in S-phase |
| Ki-67 | eBiosciences | SolA15 | Confirmation of G0/G1 |
| MaxPar Multi Label Kit | Fluidigm | 201300 | Metal labeling kit, attaches metals to antibodies |
| Microplate Shaker | Thermo Scientific | 88880023 | Mixing samples during staining |
| Paraformaldehyde (PFA) | Electron Microscopy Services | 15710 | Fixative |
| pentamethylcyclopentadienyl-Ir(III)-dipyridophenazine | Fluidigm | 201192 | Cell identification during CyTOF acquisition |
| p-H2AX (S139) | Millipore | JBW301 | Detection of DNA damage |
| p-HH3 (S28) | Biolegend | HTA28 | M-phase Resolution |
| Phosphate Buffered Saline (PBS) | Gibco | 14190-144 | Wash solution for cell culture and component of fixative solution |
| p-Rb (S807/811) | BD Biosciences | J112906 | G0/G1 Resolution |
| Proteomic Stabilizer | SmartTube Inc | PROT1 | Sample fixative |
| RPMI 1640 | Gibco | 21870-076 | Cell culture growth medium |
| Sodium Azide | Acros Organics | AC447810250 | Component of CSM/Antibody buffer, biocide |
Ссылки
- Ornatsky, O., Baranov, V. I., Bandura, D. R., Tanner, S. D., Dick, J. Multiple cellular antigen detection by ICP-MS. Journal of Immunological Methods. 308 (1-2), 68-76 (2006).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Analytical Chemistry. 80 (7), 2539-2547 (2008).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry A. 81 (7), 552-566 (2012).
- Raval, A., et al. Reversibility of Defective Hematopoiesis Caused by Telomere Shortening in Telomerase Knockout Mice. PLoS One. 10 (7), 0131722 (2015).
- Behbehani, G. K., et al. Mass Cytometric Functional Profiling of Acute Myeloid Leukemia Defines Cell-Cycle and Immunophenotypic Properties That Correlate with Known Responses to Therapy. Cancer Discovery. 5 (9), 988-1003 (2015).
- Kimmey, S. C., Borges, L., Baskar, R., Bendall, S. C. Parallel analysis of tri-molecular biosynthesis with cell identity and function in single cells. Nature Communications. 10 (1), 1185 (2019).
- Rabinovitch, P. S., Kubbies, M., Chen, Y. C., Schindler, D., Hoehn, H. BrdU-Hoechst flow cytometry: a unique tool for quantitative cell cycle analysis. Experimental Cell Research. 174 (2), 309-318 (1988).
- Rahman, A. H., Tordesillas, L., Berin, M. C. Heparin reduces nonspecific eosinophil staining artifacts in mass cytometry experiments. Cytometry A. 89 (6), 601-607 (2016).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample Preparation for Mass Cytometry Analysis. Journal of Visualized Experiments. (122), e54394 (2017).
- Behbehani, G. K. Immunophenotyping by Mass Cytometry. Methods in Molecular Biology. 2032, 31-51 (2019).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. Journal of Visualized Experiments. (69), e4398 (2012).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry A. 83 (5), 483-494 (2013).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Current Protocols in Cytometry. , 17 (2010).
- Devine, R. D., Sekhri, P., Behbehani, G. K. Effect of storage time and temperature on cell cycle analysis by mass cytometry. Cytometry A. 93 (11), 1141-1149 (2018).
- Campos, L., et al. Expression of immunological markers on leukemic cells before and after cryopreservation and thawing. Cryobiology. 25 (1), 18-22 (1988).
- Kadic, E., Moniz, R. J., Huo, Y., Chi, A., Kariv, I. Effect of cryopreservation on delineation of immune cell subpopulations in tumor specimens as determinated by multiparametric single cell mass cytometry analysis. BMC Immunology. 18 (1), 6 (2017).
- Shabihkhani, M., et al. The procurement, storage, and quality assurance of frozen blood and tissue biospecimens in pathology, biorepository, and biobank settings. Clinical Biochemistry. 47 (4-5), 258-266 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены