Method Article
Verwendung des Pyrimidin-Analogons 5-Iod-2′-Desoxyuridin (IdU) mit Zellzyklusmarkern zur Etablierung von Zellzyklusphasen in einer Massenzytometrie-Plattform
In diesem Artikel
Zusammenfassung
Dieses Protokoll passt Zellzyklusmessungen für den Einsatz in einer Massenzytometrie-Plattform an. Mit den Multiparameter-Fähigkeiten der Massenzytometrie ermöglicht die direkte Messung des Jodeinbaus die Identifizierung von Zellen in der S-Phase, während intrazelluläre Zyklusmarker die Charakterisierung jedes Zellzykluszustands unter einer Reihe von experimentellen Bedingungen ermöglichen.
Zusammenfassung
Die Regulation der Zellzyklusphase ist ein wichtiger Aspekt der Zellproliferation und Homöostase. Die Störung der Regulationsmechanismen, die den Zellzyklus steuern, ist ein Merkmal einer Reihe von Krankheiten, darunter auch Krebs. Die Untersuchung des Zellzyklus erfordert die Fähigkeit, die Anzahl der Zellen in jedem Teil des Zellzyklusverlaufs zu definieren und die einzelnen Zellzyklusphasen klar abzugrenzen. Das Aufkommen der Massenzytometrie (MCM) bietet ein enormes Potenzial für die Einzelzellanalyse mit hohem Durchsatz durch direkte Messungen von Elementisotopen, und die Entwicklung einer Methode zur Messung des Zellzykluszustands mittels MCM erweitert den Nutzen von MCM weiter. Hier beschreiben wir eine Methode, die 5-Iod-2′-Desoxyuridin (IdU), ähnlich wie 5-Brom-2'-Desoxyuridin (BrdU), in einem MCM-System direkt misst. Der Einsatz dieses IdU-basierten MCM bietet mehrere Vorteile. Erstens wird IdU während seiner Synthese schnell in die DNA eingebaut, was eine zuverlässige Messung von Zellen in der S-Phase mit Inkubationszeiten von nur 10-15 Minuten ermöglicht. Zweitens wird IdU gemessen, ohne dass sekundäre Antikörper oder DNA-Abbau erforderlich sind. Drittens kann die IdU-Färbung leicht mit der Messung von Cyclin B1, phosphoryliertem Retinoblastomprotein (pRb) und phosphoryliertem Histon H3 (pHH3) kombiniert werden, was zusammen eine klare Abgrenzung der fünf Zellzyklusphasen ermöglicht. Die Kombination dieser Zellzyklusmarker mit der hohen Anzahl von Parametern, die mit MCM möglich sind, ermöglicht die Kombination mit zahlreichen anderen Metriken.
Einleitung
Die Massenzytometrie ermöglicht die Detektion von ca. 40 Parametern, indem sie die hohe Auflösung und quantitative Natur der Massenspektroskopie nutzt. Anstelle von Fluorophor-konjugierten Antikörpern werden metallmarkierte Antikörper verwendet, die eine höhere Anzahl von Kanälen ermöglichen und einen minimalen Spillovererzeugen 1,2. MCM hat Vor- und Nachteile in Bezug auf die Zellzyklusanalyse im Vergleich zur Durchflusszytometrie. Ein großer Vorteil von MCM besteht darin, dass die große Anzahl von Parametern die gleichzeitige Messung des Zellzykluszustands über eine große Anzahl immunphänotypisch unterschiedlicher T-Zelltypen in sehr heterogenen Proben ermöglicht. MCM wurde erfolgreich eingesetzt, um den Zellzykluszustand während der normalen Hämatopoese im menschlichen Knochenmark3 und transgenen Mausmodellen des Telomerasemangels4 zu messen. Die Analyse des Zellzykluszustands bei akuter myeloischer Leukämie (AML) zeigte, dass der Zellzyklus mit bekannten Reaktionen auf klinische Therapien korrelierte, was einen In-vivo-Einblick in funktionelle Merkmale lieferte, die die Therapieauswahl beeinflussen können5. Ein zweiter Vorteil der zytometrischen Massenanalyse des Zellzyklus ist die Möglichkeit, eine große Anzahl anderer funktioneller Marker zu messen, die mit dem Zellzykluszustand korreliert werden können. Neuere Arbeiten konnten die Protein- und RNA-Synthese mit dem Zellzykluszustand korrelieren, indem IdU und metallmarkierte Antikörper gegen BRU und rRNA6 verwendet wurden. Diese Art von hochparametrischer Analyse, die den Zellzykluszustand über zahlreiche Populationen hinweg in einem Kontinuum der Differenzierung misst, wäre mit der derzeitigen Durchflusszytometrie-Technologie nahezu unmöglich. Der größte Nachteil von MCM ist das Fehlen vergleichbarer DNA- oder RNA-Färbungen, wie sie in der Fluoreszenz-Durchflusszytometrie verwendet werden (z. B. DAPI, Hoechst, Pyronin Y usw.). Fluoreszenzfarbstoffe können relativ genaue Messungen des DNA- und RNA-Gehalts liefern, aber diese Präzision ist nur aufgrund der Änderungen der Fluoreszenzeigenschaften dieser Farbstoffe möglich, die bei der Interkalation zwischen Nukleotidbasen auftreten. Die MCM-Analyse ist daher nicht in der Lage, den DNA- oder RNA-Gehalt mit ähnlicher Präzision zu messen. Stattdessen stützt sich die zytometrische Massenzellzyklusanalyse auf Messungen von Proteinen, die mit dem Zellzykluszustand in Verbindung stehen, wie z. B. Cyclin B1, phosphoryliertes Retinoblastomprotein (pRb) und phosphoryliertes Histon H3 (pHH3) in Kombination mit der direkten Messung des Jodatoms aus dem Einbau von IdU in S-Phase-Zellen. Diese beiden Messansätze liefern während der normalen Zellproliferation sehr ähnliche Ergebnisse, können aber möglicherweise diskordant sein, wenn der Zellzyklus gestört ist.
Die Messung der Anzahl der Zellen in jeder Zellzyklusphase ist wichtig, um die normale Entwicklung des Zellzyklus sowie die Unterbrechung des Zellzyklus, die häufig bei Krebs und immunologischen Erkrankungen beobachtet wird, zu verstehen. MCM ermöglicht eine zuverlässige Messung von extrazellulären und intrazellulären Faktoren mit metallmarkierten Antikörpern. Die Messung der S-Phase war jedoch eingeschränkt, da der Iridium-basierte DNA-Interkalator nicht in der Lage war, zwischen 2N- und 4N-DNA zu unterscheiden. Um Zellzyklusphasen zu definieren, entwickelte Behbehani eine Methode, die IdU mit einer Masse von 127 verwendet, die in den Bereich des Massenzytometers fällt und eine direkte Messung von Zellen in S-Phase3 ermöglicht. Durch diese direkte Messung entfällt die Notwendigkeit von Sekundärantikörpern oder der Einsatz von DNA-Vergällungsmitteln wie Säure oder DNase. In Verbindung mit intrazellulären Zyklusmarkern ermöglicht es eine hohe Auflösung der Zellzyklusverteilung in experimentellen Modellen.
Dieses Protokoll adaptiert Zellzyklusmessungen von gängigen Durchflusszytometrieprotokollen für MCM. Unsere Methoden bieten eine bequeme und einfache Möglichkeit, Zellzyklusparameter einzubeziehen. Die Inkorporation von In-vitro-Proben erfordert nur 10 bis 15 Minuten Inkubationszeit bei 37 °C, was kürzer ist als bei den meisten BrdU-Färbeprotokollen, die Inkubationszeiten von mehreren Stunden empfehlen 3,7. IdU- und BrdU-inkorporierte Proben können mit einem proteomischen Stabilisator fixiert und dann für einige Zeit in einem -80 °C Gefrierschrank gelagert werden. Auf diese Weise kann eine große Anzahl von IdU-gefärbten Proben für die Chargenanalyse archiviert werden, ohne dass die Probenqualität beeinträchtigt wird.
Protokoll
1. Aufbereitung von IdU-Beständen
- 5-Iod-2'-Desoxyuridin (IdU) in DMSO bis zu einer Konzentration von 50 mM lösen. Sterilfilter, aliquot in 10-50 μL Röhrchen und bei -80 °C lagern
- IdU aus dem Gefrierschrank nehmen und bei Raumtemperatur auftauen. IdU in RPMI-1640 verdünnen, um eine funktionierende Lösung mit einer Endkonzentration von 1 mM herzustellen. Pipettieren Sie auf und ab oder wirbeln Sie zum Mischen.
- In der Regel wird das konzentrierte IdU in das Medium verdünnt, in dem die Zellen kultiviert werden (z. B. DMEM, IMDM usw.), oder es wird zu PBS verdünnt, um es direkt zu peripheren Blut- oder Knochenmarkaspiratproben hinzuzufügen. Dieser Vorverdünnungsschritt erleichtert das Mischen des DMSO mit den wässrigen Medien der interessierenden Zellen.
HINWEIS: Die Endkonzentration von IdU während der Inkubation sollte 10 μM betragen; Eine Lösung von 1 mM kann in einem Verhältnis von 10 μL zu je 1 mL Medium hinzugefügt werden.
- In der Regel wird das konzentrierte IdU in das Medium verdünnt, in dem die Zellen kultiviert werden (z. B. DMEM, IMDM usw.), oder es wird zu PBS verdünnt, um es direkt zu peripheren Blut- oder Knochenmarkaspiratproben hinzuzufügen. Dieser Vorverdünnungsschritt erleichtert das Mischen des DMSO mit den wässrigen Medien der interessierenden Zellen.
2. IdU-Inkubation und Probenkonservierung
- Bewahren Sie die Proben in einem befeuchteten Inkubator bei 37 °C auf. Nehmen Sie die Probe aus dem Inkubator und bringen Sie die Probe in eine Biosicherheitshaube.
- Fügen Sie 10 μl 1 mM IdU pro 1 ml Probe hinzu.
- Für eine 6-Well-Platte geben Sie 30 μl 1 mM IdU zu den 3 mL Nährmedien in jeder Well. IdU kann auch direkt in Knochenmarkaspiraten sowie in murinen Studien eingesetzt werden4.
- Legen Sie die Probe für 10-15 Minuten bei 37 °C zurück in den Inkubator. Halten Sie die Zellen während der IdU-Exposition unter den optimalen Wachstumsbedingungen, um die genaueste Messung der S-Phase zu erhalten.
- Nach der IdU-Inkubation wird die Probe entnommen und in ein konisches Röhrchen überführt.
- Schleudern Sie die Probe bei 400 x g für 10 min bei Raumtemperatur.
- Saugen Sie den Überstand ab und resuspendieren Sie ihn in 200 μl PBS.
- Führen Sie bei Bedarf in diesem Schritt eine lebende/tote Färbung (mit Cisplatin) durch, um abgestorbene Zellen vor der Fixierung und dem Einfrieren zu markieren.
HINWEIS: Die Lebend-/Totfärbung von Rhodium funktioniert nach der Methanolpermeabilisierung nicht gut und wird daher nicht für die Verwendung in Zellzyklusanalysen empfohlen.
- Führen Sie bei Bedarf in diesem Schritt eine lebende/tote Färbung (mit Cisplatin) durch, um abgestorbene Zellen vor der Fixierung und dem Einfrieren zu markieren.
- Fügen Sie dem PBS 18,75 μl 16 % Paraformaldehyd (PFA) hinzu, um eine Endkonzentration von 1,5 % PFA zu erhalten. Bei Raumtemperatur 10 min inkubieren. Schleudern Sie die Probe bei 400 x g für 10 Minuten bei Raumtemperatur herunter.
- Saugen Sie die PBS/PFA-Lösung ab und suspendieren Sie die Probe vor dem Einfrieren erneut in 500 μl Zellfärbemedien (CSM; 1x PBS mit 0,5 % BSA und 0,02 % Natriumazid) + 10 % DMSO.
- Wenn Sie einen handelsüblichen Proteom-Stabilisator verwenden, fügen Sie 280 μl Proteom-Stabilisator zur Probe hinzu, die in 200 μl PBS (1:1,4) resuspendiert wurde. Inkubieren Sie die Proben bei Raumtemperatur für 10 min und legen Sie sie dann direkt in die -80 °C.
HINWEIS: Es hat sich gezeigt, dass IdU innerhalb von 10-15 Minuten Inkubationszeit bei 37 °C effektiv inkorporiert wird. IdU-Inkubationen, die länger als 10-15 Minuten dauern, verringern zunehmend die Auflösung der Populationen der S- und G2-Phase, da IdU-markierte Zellen die S-Phase verlassen und in die G2- oder M-Phase übergehen. Wir haben auch beobachtet, dass eine langfristige Inkubation mit IdU Zelltod und Zellzyklusartefakte verursachen kann. Die anschließende Zellprozessierung und Antikörperfärbung nach dem Einbau von IdU ist ausreichend, um Rest-IdU, das nicht in S-Phase-Zellen eingebaut wurde, wegzuspülen. Wir haben bei der Verwendung des hier beschriebenen In-vitro-Protokolls keinen signifikanten Jodhintergrund beobachtet. Wir haben jedoch sehr selten eine Jodkontamination in klinischen Proben beobachtet. Dies kann durch medizinische Verfahren, wie z. B. Jodkontrast in einer CT-Untersuchung, oder durch jodhaltige Arzneimittel geschehen. Sollten große Mengen an IdU-Hintergrund beobachtet werden, sollte die Probe nicht entnommen werden, um eine Beschädigung des Detektors des Massenzytometers zu vermeiden.
- Wenn Sie einen handelsüblichen Proteom-Stabilisator verwenden, fügen Sie 280 μl Proteom-Stabilisator zur Probe hinzu, die in 200 μl PBS (1:1,4) resuspendiert wurde. Inkubieren Sie die Proben bei Raumtemperatur für 10 min und legen Sie sie dann direkt in die -80 °C.
3. Färben von Proben für die Massenzytometrie
- Nehmen Sie die Proben aus dem -80 °C und lassen Sie sie auftauen, bevor Sie die Oberfläche färben.
- Wenn Sie die SmartTube-Fixierungsmethode verwenden, tauen Sie die Proben bei 0-4 °C auf, um eine zusätzliche Fixierung zu vermeiden, wenn sich die Proben erwärmen.
- Nachdem die Proben aufgetaut sind, übertragen Sie ca. 1-2 Millionen Zellen in ein 5-ml-FACS-Röhrchen.
- Zentrifugieren Sie das FACS-Röhrchen bei 600 x g für 5 Minuten und füllen Sie das FACS-Röhrchen mit Zellfärbemedien (CSM), um die Zellen zu waschen. Wiederholen Sie den Vorgang noch einmal.
- Wenn bekannt ist, dass Zellen zusammenkleben, fügen Sie 400 U/ml Heparin zu CSM-Waschungen hinzu, um den Kontakt von Zelle zu Zelle zu verhindern, dies ist jedoch nicht unbedingt erforderlich.
- Inkubieren Sie die Zellen mit FC-Blocker, 5 μl des Mittels pro 100 μl Zellen, für 10 min bei Raumtemperatur.
- Bereiten Sie eine Mischung von Antikörpern vor, die die Oberfläche oder den extrazellulären Teil der Zellen färben. Die gesamte Färbemischung beträgt 100 μl pro 1-2 Millionen Zellen in jedem Test. Die Färbemischung wird entsprechend mit CSM und Heparin im Cocktail- und FACS-Röhrchen ausbalanciert.
HINWEIS: Durch die Zugabe von CSM in diesem Schritt werden auch unspezifische Färbeartefakte8 reduziert. Diese Färbemischung hängt vollständig von den Zielmolekülen und dem Oberflächenphänotyp ab (z. B. wird in einer Studie mit T-Zellen eine Oberflächenmischung aus CD45, CD3, CD4, CD8 usw. verwendet). Ein detailliertes Protokoll der Probenverarbeitung und -färbung findet sich in Behbehani und McCarthy et al.9,10. - Die Oberflächenfärbemischung zu den Zellen geben und bei Raumtemperatur unter ständigem Schütteln 30-60 min inkubieren.
- Füllen Sie nach dem Färben das FACS-Röhrchen mit CSM und schleudern Sie es 5 Minuten lang bei 600 x g herunter.
- Waschen Sie die Probe noch zwei weitere Male mit CSM, schleudern Sie die Probe 5 Minuten lang bei 600 x g und saugen Sie jede CSM-Wäsche ab.
- Fixieren Sie die extrazellulären Antikörper durch Zugabe von 1 ml PBS mit 10 % CSM und 1,5 % PFA.
- Füllen Sie das FACS-Röhrchen mit dem PBS/CSM/PFA-Gemisch mit CSM. Bei 600 x g 5 min herunterdrehen und den Überstand absaugen.
- Methanol bei -20 °C zugeben.
- Wirbeln Sie die Probe 1-2 Minuten lang, um eine einzelne Zellsuspension zu erhalten, und stellen Sie sicher, dass alle Zellklumpen wieder suspendiert wurden.
- Während die Probe langsam wirbelt, fügen Sie schnell 1 ml eiskaltes Methanol mit einer 1.000-μl-Pipette mit einer Filterspitze hinzu.
- Halten Sie die FACs-Röhre gegen das Licht und stellen Sie sicher, dass keine sichtbaren Klumpen vorhanden sind. Es ist mit Bewölkung zu rechnen. Verklumpungen machen die Probe für die nachfolgende MCM-Analyse unbrauchbar.
- Lagern Sie die Probe bei -20 °C für 10-20 min.
- Bereiten Sie während dieser Zeit die intrazelluläre Färbemischung vor. Die intrazelluläre Färbemischung hängt von den Zielmolekülen ab, die sie interessieren. Für die Zellzyklusanalyse werden CyclinB1, pRb, Ki67 und pHH3 in diese Färbemischung aufgenommen, aber bei Bedarf können auch andere intrazelluläre Marker hinzugefügt werden.
- Nach 10-20 min bei -20 °C wird die Probe entnommen, 1,5 ml PBS hinzugefügt und der Rest mit CSM gefüllt.
- Zentrifugieren Sie die Probe 600 x g für 5 min und saugen Sie den Überstand ab.
- Waschen Sie die Probe noch zwei weitere Male mit CSM, schleudern Sie die Probe 5 Minuten lang bei 600 x g herunter und saugen Sie den Überstand jedes Mal ab.
- Nach der letzten CSM-Wäsche zentrifugieren Sie die Probe und lassen Sie ein Restvolumen von ca. 50 μl übrig.
- Geben Sie die vorbereitete Antikörpermischung (in der Regel fügen Sie 50 μl Antikörper-Färbecocktail hinzu, um ein endgültiges Färbevolumen von 100 μl zu erreichen) in die Probe und inkubieren Sie sie 30 bis 60 Minuten lang bei Raumtemperatur auf einer Schüttelplattform.
- Nach der Färbung CSM zugeben und bei 600 x g 5 min zentrifugieren.
- Saugen Sie das CSM ab, waschen Sie es erneut mit CSM, schleudern Sie es 5 Minuten lang bei 600 x g , saugen Sie das CSM ab und fügen Sie dann PBS hinzu.
- Nach Abschluss der intrazellulären Färbung legen Sie die Zellen in eine Interkalatorlösung, die die Antikörper an den Zellen fixiert und die DNA jeder Zelle färbt, um eine Identifizierung zu ermöglichen. Die Interkalatorlösung enthält einen nichtisotopenreinen Iridium-Interkalator (Pentamethylcyclopentadienyl-Ir(III)-dipyridophenazin), der aus der Stammlösung des Herstellers in einer Konzentration von 500 μM zugesetzt wird. Der Iridiumstamm wird 1:4000 in einer Lösung aus PBS und 1,5 % PFA verdünnt. Fügen Sie die Iridium-Interkalatorlösung mit 100-200 μl pro Million Zellen hinzu, um eine gleichmäßige Färbung zu erzielen und eine Überfärbung zu verhindern.
HINWEIS: Das Iridium in dieser Interkalatorlösung dient zur Identifizierung von Zellen für Singulett-Gating, es sollte nicht für lebende/tote Färbungen verwendet werden. Wenn lebende/tote Färbungen erwünscht sind, müssen sie vor der Fixierung durchgeführt werden, wie oben und in McCarthy et al.9 erwähnt. - Lagern Sie die Proben in Interkalatorlösung bis zu zwei Wochen in einem 4 °C-Kühlschrank, bevor Sie die Probe auf dem CyTOF aufnehmen.
4. Betrieb des Massenzytometers
Anmerkungen: Der Massenzytometriebetrieb kann maschinenspezifisch sein. Es ist immer ratsam, vor der Inbetriebnahme die CyTOF-Bedienungsanleitung zu lesen. Darüber hinaus gibt es derzeit zwei JoVE-Artikel, die sich mit der Inbetriebnahme und Wartung von Maschinen befassen 9,11.
- Überprüfen Sie den Vernebler auf Verstopfungen, Risse und andere Unregelmäßigkeiten, bevor Sie das Massenzytometer in Betrieb nehmen.
- Schließen Sie den Vernebler an das Zytometer an und beginnen Sie mit dem Aufwärmvorgang. Starten Sie das Massenzytometer nicht, ohne dass der Vernebler eingesetzt ist.
- Lassen Sie Wasser durch die Probenleitungen laufen, sobald das Massenzytometer mit dem Aufwärmen fertig ist. Die Sprühkammer muss ca. 200 °C erreichen, bevor eine Abstimmung oder Probenanalyse durchgeführt werden kann.
- Lassen Sie das Wasser 5-10 Minuten lang laufen. Laden Sie nach 5-10 Minuten die Tuning-Lösung und wählen Sie den Tuning-Manager aus. Die Tuning-Lösung ist eine Lösung, die feste Konzentrationen von Metallen enthält und zur Optimierung des Massenzytometers vor der Probenentnahme verwendet wird
- Wählen Sie im Tuning-Manager die Option Vorschau aus, sobald die Optimierungslösung einen Steady-State-Trefferdatensatz erreicht hat, um den automatisierten Optimierungsprozess zu starten.
- Sobald die Abstimmung abgeschlossen ist, füllen Sie den Probenehmer mit Wasser und lassen Sie das Wasser während der Probenverarbeitung durch die Abtastleitungen laufen. Ein detailliertes Protokoll für den täglichen Betrieb und die Einstellung des Zytometers finden Sie bei Leipold11.
- Gelegentlich kann es vorkommen, dass die automatische Abstimmung nicht auf die optimale Maschinenleistung abgestimmt ist. Wiederholen Sie den Tuning-Vorgang, um dies zu korrigieren.
- Waschen Sie die Probe einmal mit CSM und zweimal mit reinem deionisiertem Wasser, bevor Sie die Probe aufnehmen. Das Waschen mit Wasser ist wichtig, um Salzreste aus dem PBS/CSM zu entfernen.
- Überprüfen Sie die Empfindlichkeit und den Probenfluss mit vom Hersteller gelieferten Äquilibrierungsperlen, Polystyrolperlen, die mit bekannten Metallkonzentrationen beladen sind.
- Ändern Sie den Erfassungsmodus von Tuning in den Ereigniserfassungsmodus. Legen Sie das Zeitlimit zum Beenden der Erfassung auf 120 s fest. Warten Sie 45 Sekunden, bevor Sie Aufnahme auswählen.
- Das Massenzytometer stoppt die Probenentnahme automatisch nach 120 Sekunden. Verwenden Sie den Regendiagramm-Viewer, um die Intensität von Eu151 und Eu153 zu überprüfen.
- Verdünnen Sie die Äquilibrierungsperlen in reinem deionisiertem Wasser im Verhältnis 1:20.
- Überprüfen Sie vor der Probenerfassung den Experimentmanager. Verwenden Sie den Experiment-Manager, um Kanälen Namen zuzuweisen und Kanäle hinzuzufügen, die aufgezeichnet werden sollen.
- Stellen Sie sicher, dass der 127-I-Kanal hinzugefügt wird, wenn Sie IdU verwenden.
- Beachten Sie, dass es wichtig ist, das Massenzytometer so einzustellen, dass es die erforderlichen Parameter (z. B. IdU) vor der Probenentnahme misst. Wenn Kanäle nicht im Voraus ausgewählt werden, werden keine Daten von einem nicht ausgewählten Kanal erfasst und können nicht wiederhergestellt werden.
- Verdünnen Sie die Zellen auf eine Konzentration von ca. 1-2 x 106/ml mit dem 1:20 reinen deionisierten Wasser und der Mischung aus Äquilibrierungsperlen. Führen Sie die Zellen durch das FACS-Röhrchen mit Filteraufsatz, um alle verbleibenden Klumpen zu entfernen.
- Legen Sie die Probe ein und ändern Sie die Erfassungszeit.
- Drücken Sie auf Vorschau und warten Sie, bis sich die Anzahl der Ereignisse pro Sekunde stabilisiert hat.
- Führen Sie keine Ereignisse mit mehr als 400 Ereignissen pro Sekunde durch, da dies zu erheblichen Mengen an Dubletten und Schmutz führt. Wir sammeln in der Regel mindestens 20.000 bis 50.000 Zellereignisse, aber die optimale Anzahl hängt vom Versuchsdesign ab. Die Färbung von bis zu 2 Millionen Zellen ergibt in der Regel 300.000 bis 400.000 Zellereignisse. Beachten Sie, dass nicht alle Ereignisse Zellen sind (es gibt Trümmer- und Perlenereignisse, die in der Ereignisanzahl enthalten sind).
- Sobald die Probenentnahme abgeschlossen ist, laden Sie eine Waschlösung, starten Sie die Probeninduktion und lassen Sie sie 5-10 Minuten lang laufen. Stoppen Sie nach 5-10 Minuten die Probeninduktion und lassen Sie das Wasser 10-20 Minuten lang laufen. Die Waschlösung ist eine schwache Lösung aus Flusssäure, die entwickelt wurde, um Metallreste aus den Probenleitungen zu entfernen.
- Schalten Sie das Massenzytometer aus und entfernen Sie den Vernebler. Der Vernebler wird heiß sein, seien Sie vorsichtig bei der Handhabung.
5. Datenanalyse
- Um Perlen zu entfernen und auch die Signaldrift während der Probenaufnahme zu korrigieren, normalisieren Sie die FCS-Dateien mit der Software Fluidigm oder der von Finck12 entwickelten Anwendung.
- Laden Sie das FCS in die Cytobank oder eine andere Durchflusszytometrie-Analysesoftware hoch. FCS-Dateien können in jeder kompatiblen Software verwendet werden, für die Zwecke dieses Protokolls wurden alle Gates und weiteren Analysen in Cytobank13 durchgeführt.
- Bevor Zellzyklus-Gates gezeichnet werden können, schließen Sie alle Dubletten oder Zelltrümmer aus der nachgeschalteten Analyse aus, indem Sie das biaxiale Diagramm der Ereignislänge vs. 191-Ir verwenden (Abbildung 1a). Die Zellen bilden eine ausgeprägte, helle Population, die zum Ausschluss von Dubletten und Trümmern verwendet werden kann. Dies ist das Singlet-Gate. Diese Gating-Methode entfernt in der Regel etwa 50-60 % der Dublettzellenereignisse, so dass zusätzliche Strategien erforderlich sein können, um die verbleibenden Dublettzellenereignisse zu entfernen.
- Ändern Sie die Ereignislängenskala (Minimum und Maximum), um die Zellen prominenter erscheinen zu lassen, um das Singulett-Gating zu erleichtern.
- Entfernen Sie Dubletten und Schmutz mithilfe der Gaußschen Parameter, Residuum und Offset. Ein höheres Residuum mit geringerem Offset besteht ebenfalls aus Schutt und Dubletten, und das Gating um diese Population herum kann Dubletten und Trümmer weiter entfernen (Abbildung 1b,c).
- S-Phasen-Gating – Die S-Phase ist das am einfachsten zu zeichnende, aber auch das wichtigste. Zeichnen Sie dieses Gatter mit einem biaxialen Diagramm von IdU vs. pRb, Ki67 oder cyclinB1. S-Phasen-IdU+ -Zellen bilden bei der Betrachtung dieser biaxialen Diagramme eine eigene Population (Abbildung 2b).
- G0/G1-Phase, G2/M-Phasen-Gating – Legen Sie die G0/G1- und G2/M-Phasengatter auf dem IdU- vs. CyclinB1-Diagramm fest, und die Verwendung des IdU-Einbaus ist entscheidend, um die Grenze zwischen den G0/G1- und G2/M-Phasengattern festzulegen. Die G0/G1-Phase ist CyclinB1niedrig/IdU- und die G2/M-Phase ist CyclinB1hoch/IdU-. Eine gute CyclinB1-Färbung zeigt eine natürliche Population zwischen den Populationen G0-G1 und G2-M. Dies variiert jedoch je nach Proben- und Zelltyp unter experimentellen Bedingungen. Unter experimentellen Bedingungen, unter denen die Zellzyklusverteilung beeinträchtigt werden kann und es weniger Abstand zwischen der CyclinB1-G0/G1-Phase und der G2/M-Phase gibt, ermöglicht die Verwendung der S-Phase ein konsistentes Gating für bestimmte Zelltypen in jedem spezifischen Experiment. Diese Methode wird im Folgenden beschrieben.
- Zeichnen Sie nur die S-Phasen-Zellen auf dem CyclinB1 vs. IdU auf, um die Trennung zwischen G0/G1-Phase und G2/M-Phase zu ermitteln. Zeichnen Sie ein Gate aufdie CyclinB1-Hochpopulation und passen Sie es an, bis sich etwa die oberen 5 % der S-Phasen-Population innerhalb des Gates befinden (Abbildung 2c). Damit wird der Bruchpunkt zwischen den Phasengattern G0/G1 und G2/M festgelegt (Abbildung 2e,f). Die aktive Population wird in die Population von Interesse geändert, und der Teil, der innerhalb des vorherigen Tors lebt, ist die G2/M-Phasenpopulation, während der Rest die G0/G1-Phasenpopulation ist.
- G0-Phasen-Gating – Legen Sie die G0-Phase auf dem pRb- vs. IdU-Diagramm fest. Die G0-Phase wird durch eine pRblow/IdU- Population repräsentiert. Die aktive zyklische Population weist eine hohe Expression der pRb- und IdU-Inkorporation auf, das G0-Phasengatter kann an dieser Grenze gezeichnet werden, da es typischerweise in zwei verschiedenen Populationen exprimiert wird (Abbildung 2g,i).
- Definieren Sie die G0-Phase, indem Sie die zuvor gezeichnete S-Phasen-Population (Abbildung 2b) zur aktiven Population machen und ein Gate zeichnen, das die obersten 90-100%der pRb-Population enthält. Dies ist die pRb+-Radpopulation (Abbildung 2i), die pRb-niedrige Population außerhalb dieses Tors ist die G0-Population (Abbildung 2j).
- Wenn pRb nicht verfügbar ist oder nicht aufgezeichnet werden kann, verwenden Sie Ki67 vs. IdU, um die G0-Phasenpopulation zu ermitteln. Wenn man ein Gate zeichnet, das die Mehrheit der S-Phasen-Population repräsentiert, und dieses Gate als Grenze für Ki67 vs. IdU verwendet, wird der Rest der Population die G0-Phase sein (Abbildung 3a).
- M-Phasen-Gating – Bestimmen Sie die M-Phase im biaxialen IdU- vs. pH3-Diagramm. Die M-Phase repräsentiert einen sehr kleinen Teil der Zellen und ist an die Population mithohem pH3-Wert gekoppelt (Abbildung 2d).
- Die IdU-Inkorporation ist fehlgeschlagen oder war nicht möglich – Wenn IdU nicht verfügbar ist, definieren Sie Zellzyklus- und Nicht-Zyklusfraktionen mit Ki67 und pRb. Ki67 und pRb bilden unter normalen Bedingungen zwei unterschiedliche Populationen, eine Ki67 high/pRbhigh und eine Ki67 low/pRblow. Die doppelt positive Population repräsentiert die aktive zyklische Population und korreliert mit der G1-Phase, der S-Phase, der G2-Phase und der M-Phase. Die doppelt niedrige Population repräsentiert die nicht radelnde Population und korreliert mit der G0-Phase (Abbildung 3b).
ANMERKUNG: Es ist nicht möglich, jede einzelne Phase mit dem Ki67 vs. pRb abzugrenzen, aber experimentelle Effekte auf die relativen zyklischen/nicht zyklischen Populationen können bestimmt werden. - Zellzyklusanalyse – Sobald die Gates festgelegt wurden, exportieren Sie die numerischen Werte aus den Gates zur weiteren Analyse. Die Prozentsätze in jedem Zyklus können erreicht werden, indem die einzelnen Populationen von den kombinierten Populationen subtrahiert werden. Der G0-Phasenanteil, gezeichnet auf dem pRb-Low-IdU-Low, kann von der G0/G1-Phase, gezeichnet auf CyclinB1Low IdUneg, subtrahiert werden, um den G1-Phasen-Prozentsatz zu ermitteln. In ähnlicher Weise wird der G2-Phasenprozentsatz aus der Subtraktion des M-Phasengatters vom G2/M-Phasengatter abgeleitet. Dadurch werden numerische Werte für jede einzelne Zellzyklusphase generiert; G0, G1, S, G2 und M. Die für jede einzelne Zellzyklusphase generierten Zahlenwerte können für weitere Analysen, wie z. B. grafische und statistische Analysen, verwendet werden.
Ergebnisse
Mit Hilfe von HL-60-Zellen und einem humanen Knochenmarkaspirat kann gezeigt werden, wie experimentelle Bedingungen die Zellzyklusverteilung und -analyse beeinflussen können. Zunächst muss die Gating-Strategie festgelegt werden, um zu zeigen, wie die Zellzyklusphasen abgeleitet werden. In Abbildung 1 zeigen wir die Etablierung des Singulett-Gates, das für die Trennung von Zelltrümmern und Dubletten wichtig ist, wodurch eine Einzelzellpopulation entsteht. Für Zelllinien genügt das Singulett-Gate, um mit der Zellzyklusanalyse fortzufahren (Abbildung 2a). Für menschliche Proben müssen immunphänotypische Populationen in der Regel vor der Zellzyklusanalyse festgelegt werden, da die genauen Grenzen jedes Zellzyklustors zwischen verschiedenen Zelltypen variieren können. Sobald die Populationen etabliert sind (in der Regel durch Gating auf Oberflächenmarkern, die diese Population definieren), müssen die Zellzyklustore etabliert werden. Abbildung 2b zeigt die Etablierung der S-Phase auf dem biaxialen IdU- vs. CyclinB1-Diagramm. Dieses Diagramm wird auch verwendet, um den Rand des G2/M-Phasengatters festzulegen (Abbildung 2f). Sobald die G2/M-Phase etabliert ist, ist der Rest das G0/G1-Phasengatter (Abbildung 2f). Der IdU vs. pRb wird verwendet, um zunächst die pRb+-zyklische Population zu bestimmen, indem ein Gate auf IdU-Zellen etabliert wird (Abbildung 2g,i). Die pRb+/IdUneg Population außerhalb dieses Tores ist die G0-Phase (Abbildung 2j). Die M-Phase wird auf dem IdU vs. pHH3 etabliert, wobei M-Phasenzellen hohe Mengen an pHH3 exprimieren und keinen IdU-Einbau aufweisen (Abbildung 2k). Für den Fall, dass pRb nicht enthalten ist, kann die G0-Phase mit Ki67 in ähnlicher Weise wie oben beschrieben repliziert werden (Abbildung 3a). Wenn die IdU-Inkorporation fehlgeschlagen ist oder nicht durchgeführt wurde, ist es immer noch möglich, relative zyklische Anteile mit Ki67 und pRb zu bestimmen. Durch die Verwendung von Ki67 und pRb biaxial bilden sich zwei unterschiedliche Populationen, eine pRb+/Ki67+ doppelt positive und eine pRb low/Ki67low Population. Die doppelt positive Population repräsentiert Zellen im Zyklus, während die niedrige Population Zellen darstellt, die sich nicht im Zyklus befinden (Abbildung 3b). Unter Verwendung von IdU-Zellen und pRb-Low-Zellen ohne IdU-Inkorporation zeigen wir, dass die S-Phase hauptsächlich in der pRb+/Ki67+-Population liegt, während die G0-Phase hauptsächlich inder pRb-niedrigen/Ki67-Low-Population liegt.
Die Zellzyklusanalyse beruht auf einer guten experimentellen Technik, insbesondere während des IdU-Inkubationsschritts. Während die IdU-Inkorporation flexibel ist (sie ist in Zellkulturen, Knochenmarkaspiraten und sogar in murinen Studien anwendbar), ist es notwendig, die IdU-Inkorporation und -Fixierung durchzuführen, ohne den Zellzykluszustand von experimentellem Interesse zu unterbrechen. Die IdU-Markierung und damit die nachgelagerte Zellzyklusanalyse können erheblich von Zeit und Temperatur beeinflusst werden, wie in Abbildung 4 dargestellt. Zellen, die zu lange in geschlossenen Gefäßen verbleiben oder bei Probentransporten oder Probentransporten zwischen Standorten angetroffen werden können, weisen einen reduzierten S-Phasen-Anteil auf und sind für die Zellzyklusanalyse nicht genau (Abbildung 4a). Kurze Zeiträume, die insgesamt weniger als eine Stunde betragen, weisen jedoch eine normale Zellzyklusverteilung auf, was darauf hindeutet, dass ein schneller Transport die Zellzyklusanalyse möglicherweise nicht negativ beeinflusst (Abbildung 4b). Ein weiterer wichtiger Modifikator ist die Kryokonservierung, die in den meisten Labors routinemäßig eingesetzt wird. Bei der Untersuchung des Zellzykluszustands in kryokonservierten Zellen kann eine lange Äquilibrierungszeit erforderlich sein, bevor die Zellen in den aktiven Zellzyklus zurückkehren, der möglicherweise immer noch nicht den Zellzykluszustand vor der Kryokonservierung widerspiegelt (Abbildung 4c).
Primäre menschliche Proben sind oft Komposite aus mehreren verschiedenen Zelltypen, diese verschiedenen Zelltypen können unterschiedliche Empfindlichkeiten gegenüber der Verarbeitung haben, was zu unterschiedlichem Zellzyklus-Gating führt. In zwei Knochenmarkaspiraten, die sofort IdU markiert, 30 Minuten vor der IdU-Markierung gelagert oder nach der Ficoll-Trennung kryogenisch gelagert wurden, gab es Unterschiede zwischen den einzelnen Proben und Populationen (Abbildung 5a,b). Zwei immunphänotypische Populationen wurden auf Unterschiede in der IdU-Inkorporation untersucht; T-Zellen (CD45 hoch/CD3hoch) und Monoblasten (CD33+, HLADR+, CD11bniedrig, CD14neg). Mit der richtigen Kombination von Oberflächenmarkierungen ist es möglich, weitere immunphänotypische Populationen zu untersuchen. Im Knochenmark #2 zeigte sich nach 30-minütiger Lagerung ein auffälliger T-Zell-Aktivierungseffekt, der in den Monoblasten desselben Patienten nicht beobachtet wurde (Abbildung 5b). Wie bei kultivierten Zellen gab es nach der kryogenen Lagerung, die ebenfalls von der Population abhängig war, deutliche Veränderungen in der IdU-Markierung. Knochenmark #1 hatte eine Verringerung der T-Zell-Population, aber eine Zunahme der Monoblasten-IdU-markierten Fraktionen im Vergleich zum Ausgangswert (Abbildung 5 a,b), Knochenmark #2 zeigte eine Verringerung sowohl der T-Zellen als auch der Monoblasten im Vergleich zum Ausgangswert (Abbildung 5a,b). Gefrorene Zellen benötigen dann eine beträchtliche Inkubationszeit, bevor sie in den normalen Zellzykluszustand zurückkehren, und dies kann Studien beeinflussen, die sich auf die Änderung des Zellzykluszustands oder des Zellzykluszustands als Metrik für die Wirkung des Medikaments oder des experimentellen Medikaments stützen.
Ein weiterer Vorteil von MCM ist die Fähigkeit, Zellen zu unterscheiden, die sich im Zellzyklusarrest befinden oder eine abnormale Zellzyklusverteilung aufweisen. Während DNA-Farbstoffe, die üblicherweise in der Durchflusszytometrie verwendet werden, in der Lage sind, zwischen 2N- und 4N-DNA-Gehalt zu unterscheiden, sind sie sehr hell, was die Messung anderer Parameter dieses Lasers erheblich erschweren kann. IdU benötigt jedoch nur einen Massenkanal und hat nur einen minimalen Spillover, so dass andere Marker bei der Bestimmung des Zellzyklus verwendet werden können. MOLM13-Zellen, die bestrahlt wurden, zeigten im Vergleich zu Kontrollzellen eine verringerte IdU-Inkorporation und eine Abnahme der M-Phase (Abbildung 6). Eine Störung der normalen Zellzyklus-Checkpoints könnte den scheinbaren Zellzykluszustand durch MCM verändern. Betrachtet man die pH2AX- und cPARP-Populationen in den unbestrahlten Zellen, so zeigt die pH2AX-niedrigeund cPARP-niedrige Population eine normale Zellzyklusverteilung, während Zellen, die höhere pH2AX- oder cPARP-Konzentrationen exprimieren, hauptsächlich in der erwarteten G0/G1-Phase lokalisieren (Abbildung 6a). In den bestrahlten Zellen sind der pH2AX niedrig und cPARPniedrig, die Zellen jedoch fast vollständig in der G0-Phase lokalisiert, während die pH2AXhigh und cPARPlow Zellen einen Zellzyklusarrest-Phänotyp mit IdU-Inkorporation und Lokalisation in die G0/G1-Phase und G2-Phase ohne M-Phase zeigen. Die pH2AX-High- und cPARP-High-Zellen zeigen ebenfalls Zellen, die etwas IdUenthalten und in der G0/G1-Phase lokalisiert sind, was auf eine Strahlenschädigung hinweist (Abbildung 6b).
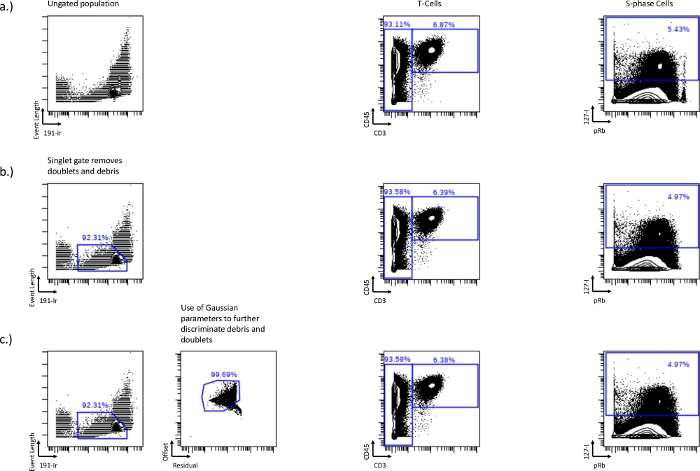
Abbildung 1: Festlegen der Singulett-Gatter unter Verwendung von 191-Ir nach Ereignislänge sowie Gauß-Parametern, Residuum und Offset.
Die Unterschiede in der T-Zelle (CD45+/CD3+) und der S-Phase (IdU+) zwischen einer Probe ohne Anschnitt (a), einer Ereignislänge und einem 191-Ir-Singulett-Gatter (b) oder einem Singulett-Gatter in Kombination mit Gauß-Parametern, Residuum und Offset (c). Das Singulett-Gating entfernt Schutt, Dubletten und Perlen, die sich im Verlust derhohen pRb-Population in der rechten Ecke des Biaxialen zeigen. Dieses Singulett-Gatter kann weiter optimiert werden, indem Gaußsche Parameter wie Residuum und Offset einbezogen werden, wodurch mehr Schmutz entfernt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
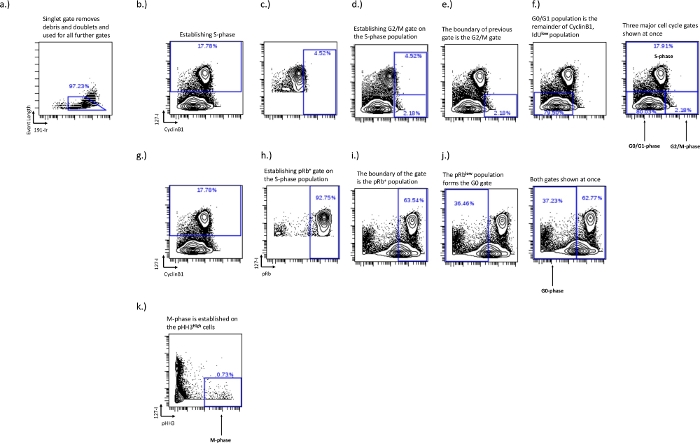
Abbildung 2: Das Gating-Schema zur Etablierung von Zellzyklusgates für G0-, G1-, S-, G2- und M-Phasen unter Verwendung von IdU, CyclinB1, pRb und pHH3.
Das Singulett-Tor dient zum Entfernen von Dubletten und Schmutz (a). Die S-Phase muss etabliert werden (b), sobald die S-Phase etabliert ist, kann die IdU+-Population verwendet werden, um die G2/M-Phasengrenze zu bestimmen (c,d). Die Festlegung der G2/M-Phasengrenze legt die Grenzen der G0/G1-Phasenpopulation fest (f). Die pRb+- und G0-Phasenpopulation wird auf dem IdU vs. pRb biaxial bestimmt. Die IdU+-Zellen (h) werden verwendet, um die Grenze für die pRb+-Population (i) festzulegen. Der Rand der pRb+-Population bildet den Rand der G0-Phasen-Population (j). Die M-Phase wird auf pHH3+-Zellen etabliert, die IdU- (k) sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
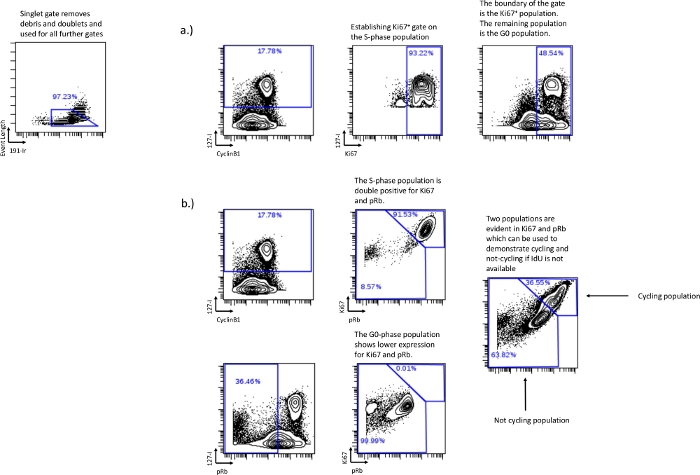
Abbildung 3: Etablierung von Zellzyklus-Gates ohne die Verwendung von pRb oder ohne die Verwendung von IdU-Inkorporation.
Das Zeichnen der G0-Phase kann auch mit Ki-67 nach der gleichen Gating-Strategie erfolgen, die mit pRb verwendet wurde, wenn pRb nicht in das Experiment einbezogen wird (a). Wenn die IdU-Inkorporation fehlschlug oder nicht durchgeführt wurde, konnten die relativen Zellzyklusfraktionen durch die Verwendung von Ki67 und pRb dennoch gewonnen werden. Die doppelt positive Expression von Ki67 und pRb korreliert mit Zellen im Zyklus, was durch den Nachweis der IdU+-Zellen gezeigt wird, die hauptsächlich in der doppelt positiven Population zu finden sind (b). Die niedrige Ki67- und pRb-Population korreliert mit der G0-Phase oder der nicht zyklischen Population, die durch pRb-low/IdUneg-Zellen in der Ki67- und pRb-Low-Population nachgewiesen wird. Diese Methode kann einzelne Zellzyklusphasen nicht unterscheiden, kann aber dennoch verwendet werden, um relative Zyklusfraktionen unter experimentellen Bedingungen zu bestimmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Repräsentative Abbildungen des Einflusses unterschiedlicher Lagerbedingungen auf die Zellzyklusverteilung von HL-60-Zellen.
Die Zellen wurden eine Stunde lang inkubiert, gefolgt von einer Stunde Ruhezeit unter den angegebenen Temperaturbedingungen in verschlossenen Röhrchen (a). Es gibt spürbare Auswirkungen auf die Zellzyklusverteilung im Vergleich zur Kontrolle. HL60-Zellen wurden 30 Minuten lang in verschlossenen Röhrchen bei Raumtemperatur aufbewahrt, eine Situation, die in einer klinischen Umgebung auftreten kann, bevor IdU eingebaut wurde (b). Versiegelte Röhrchen, die 30 Minuten lang bei Raumtemperatur aufbewahrt wurden, zeigten keine nennenswerten Unterschiede im Zellzyklus. Die Wirkung der kryogenen Lagerung auf den Zellzyklus in HL60-Zellen wurde untersucht, wobei eine Probe vor der kryogenen Lagerung und eine Probe nach einer Stunde Pause nach einer Woche in der kryogenen Lagerung entnommen wurde (c). Eine Stunde nach dem Auftauen ist die Zellzyklusverteilung beeinträchtigt und die Zellzyklusverteilung normalisiert sich erst etwa eine Woche nach dem Auftauen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Die Aufbereitung kann sich auf die Patientenproben auswirken und es werden repräsentative Bilder zwischen zwei verschiedenen Patienten gezeigt, die die (a) T-Zellen (CD45 hoch/CD3hoch) und (b) Monoblasten (CD33+, HLADR+, CD11bniedrig, CD14neg) zeigen.
Zwischen Knochenmark eins und Knochenmark zwei ist deutlich, dass es in Knochenmark 2 einen T-Zell-Aktivierungseffekt während der 30-minütigen Ruhezeit gab, während Knochenmark eins keinen solchen Effekt aufwies. Mark eins zeigte nach 30 Minuten einen möglichen Aktivierungseffekt in der Monoblastenpopulation, während Mark zwei dies nicht tat. In beiden Knochenmark zeigte sich jedoch, dass die kryogene Lagerung die Zellzyklusverteilung unabhängig vom Zelltyp beeinflusste. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: MOLM13-Zellen wurden entweder als Kontrollen belassen oder mit einem Röntgenstrahler bei 10 Gy bestrahlt.
MOLM13-Zellen zeigen die Zellzyklusverteilung in vier verschiedenen Populationen der pH2AX- und cPARP-Expression. Kontrollzellen zeigen eine minimale pH2AX- und cPARP-Färbung, wobei normale Zellzykluseigenschaften in der Population mit niedrigem pH2AX- und cPARP-niedrigempH-Wert gezeigt werden (a). Während die bestrahlten Zellen eine abnorme Zellzyklusverteilung aufweisen, wobei sich die Mehrheit der zyklischen Zellen im pH2AX-Hoch und cPARP-Hoch befindet, was auf eine Zellzyklusstörung hinweist (b). Die nicht geschädigten, pH2AX-armen und cPARP-armen Zellen zeigen einen Mangel an Zykluseigenschaften, die vor allem in der G0-Phase zu finden sind. Ohne diese Marker würden diese Zellen in der normalen Durchflusszytometrie als 4N- und 2N-Zellen erscheinen, was möglicherweise die nachgeschaltete Zellzyklusanalyse verwirren würde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Die hier vorgestellten Beispiele zeigen, wie eine MCM-Plattform zur Analyse der Zellzyklusverteilung eingesetzt werden kann. Es hat sich auch gezeigt, dass die Zellzyklusanalyse empfindlich auf experimentelle Bedingungen wie Zeit und Temperatur reagiert, was eine wichtige Überlegung ist, die Forscher berücksichtigen müssen, wenn sie MCM für ihre Zellzyklusanalyse in Betracht ziehen14. Proben, die für einen kurzen Zeitraum, nicht länger als eine Stunde, gelagert werden, weisen eine IdU-Einarbeitung auf, die mit ihrem normalen Zustand vergleichbar ist. Proben in einem geschlossenen System über einen längeren Zeitraum, etwa 2 Stunden, weisen eine reduzierte IdU-Inkorporation auf, jedoch ändern sich die relativen zyklischen und nicht-zyklischen Fraktionen nicht, was eine Analyse des groben Zellzyklus ermöglicht. Die kryogene Lagerung und das anschließende Auftauen stören die normale Verteilung des Zellzyklus über einen längeren Zeitraum. Es wurde bereits früher festgestellt, dass die kryogene Lagerung die Protein- und RNA-Verteilung stört, aber erst kürzlich wurde gezeigt, dass sie den Zellzyklusstört 14,15,16,17. Zusammenfassend deuten diese darauf hin, dass es besser wäre, die Zellen vor der Lagerung oder der kryogenen Lagerung mit IdU zu färben, die Zellen zu fixieren und zu lagern, bis die Analyse durchgeführt werden kann, wenn lange Lagerzeiten oder eine kryogene Konservierung von Proben zu erwarten sind. Da für die Zellzyklusanalyse mit MCM keine lebenden Zellen erforderlich sind, können die Forscher wertvolle Proben einlagern und eine genaue nachgeschaltete Zellzyklusanalyse durchführen.
Die Zellzyklusanalyse von MCM ist ein robustes System, das in der Lage ist, experimentelle Modelle eingehend zu untersuchen. Aufgrund der hohen MCM-Parameterzahl, etwa 40-50 Massenkanäle, kann die Zellzyklusanalyse mit anderen intrazellulären oder extrazellulären Markern kombiniert werden, wodurch die Notwendigkeit einer Sortierung der Zellen auf der Grundlage des Immunphänotyps umgangen wird, was dazu führen kann, dass signifikante Zellzykluseffekte verloren gehen. Die hohe Parameternatur von MCM eignet sich für die Untersuchung von Effekten in hochdimensionalen Mapping-Anwendungen wie SPADE und viSNE. Während SPADE und viSNE typischerweise zur Definition immunphänotypischer Populationen verwendet werden, die dann auf Zellzyklusveränderungen untersucht werden können, wäre es auch möglich, auf Zellzyklusmarkern zu kartieren. Abhängig von den experimentellen Bedingungen kann die Kartierung von Zellzyklusmarkern in einem hochdimensionalen Raum eine Korrelation des Zellzyklus mit der Wirkung des Arzneimittels zeigen oder zeigen, welche immunphänotypischen Populationen für jeden Zykluszustand lokalisiert sein könnten 3,5. Während MCM durch das Fehlen von DNA-bindenden Fluoreszenzfarbstoffen eingeschränkt sein kann, wird dies durch den direkten Einbau von IdU in S-Phase-Zellen kompensiert, und intrazelluläre Zellzyklusproteine können verwendet werden, um den Zellzykluszustand zu bestimmen. Diese Zellzyklusproteine können auch dazu beitragen, zwischen Stadien des Zellzyklusarrests zu unterscheiden, die sonst im traditionellen Fluss mit DNA-Bindungsfarbstoffen als 3N oder 4N erscheinen würden. Solche hochparametrischen Systeme sind jedoch nicht ohne Nachteile und reagieren empfindlich auf Störungen im Zellzyklus. Wir haben gezeigt, dass lange Lagerzeiten und kryogene Lagerung die Zellzyklusverteilung signifikant beeinflussen können. Dies ist besonders wichtig, wenn versucht wird, experimentelle Effekte für Medikamente zu rationalisieren, die die Verteilung des Zellzyklus beeinflussen können. Die Behandlung von Medikamenten, die den Zellzyklus beeinflussen sollen, an gefrorenen Primärproben kann falsche Daten über den Zellzykluseffekt liefern, wenn sie unmittelbar nach dem Auftauen aus der kryogenen Lagerung verwendet werden. MCM ist eine vielseitige Technologie für die Zellzyklusanalyse, die auf eine Reihe von experimentellen Modellen angewendet werden kann und sich besonders für die Tiefenprofilierung heterogener Systeme eignet. Wie bei anderen hochparametrischen Methoden ist es notwendig, ein sorgfältig geplantes Experiment mit geeigneten Überlegungen darüber durchzuführen, wie sich die Verarbeitung und die experimentellen Effekte auf die Zellzyklusanalyse auswirken.
Offenlegungen
Dr. Behbehani erhält Reiseunterstützung von Fluidigm. Fluidigm hat auch Reagenzien und Materialien für den Laborgebrauch gekauft.
Danksagungen
Die Autoren danken den Bemühungen von Palak Sekhri, Hussam Alkhalaileh, Hsiaochi Chang und Justin Lyeberger für ihre experimentelle Unterstützung. Diese Arbeit wurde durch das Pelotonia Fellowship Program unterstützt. Alle Meinungen, Erkenntnisse und Schlussfolgerungen, die in diesem Material zum Ausdruck gebracht werden, sind die des Autors/der Autoren und spiegeln nicht unbedingt die des Pelotonia-Stipendienprogramms wider."
Materialien
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma | A3059 | Component of CSM |
| Centrifuge | Thermo Scientific | 75-217-420 | Sample centrifugation |
| Cleaved-PARP (D214) | BD Biosciences | F21-852 | Identification of apoptotic cells |
| Cyclin B1 | BD Biosciences | GNS-1 | G2 Resolution |
| Dimethylsulfoxide (DMSO) | Sigma | D2650 | Cryopreservative |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | Internal metal standard for CyTOF performance |
| FACS Tube w/ mesh strainer | Corning | 08-771-23 | Cell strainer to remove clumps/debris before CyTOF run |
| Fetal Bovine Serum (FBS) | VWR | 97068-085 | Cell culture growth supplement |
| Helios | Fluidigm | CyTOF System/Platform | |
| Heparin | Sigma | H3393 | Staining additive to prevent non-specific staining |
| IdU (5-Iodo-2′-deoxyuridine) | Sigma | I7125 | Incorporates in S-phase |
| Ki-67 | eBiosciences | SolA15 | Confirmation of G0/G1 |
| MaxPar Multi Label Kit | Fluidigm | 201300 | Metal labeling kit, attaches metals to antibodies |
| Microplate Shaker | Thermo Scientific | 88880023 | Mixing samples during staining |
| Paraformaldehyde (PFA) | Electron Microscopy Services | 15710 | Fixative |
| pentamethylcyclopentadienyl-Ir(III)-dipyridophenazine | Fluidigm | 201192 | Cell identification during CyTOF acquisition |
| p-H2AX (S139) | Millipore | JBW301 | Detection of DNA damage |
| p-HH3 (S28) | Biolegend | HTA28 | M-phase Resolution |
| Phosphate Buffered Saline (PBS) | Gibco | 14190-144 | Wash solution for cell culture and component of fixative solution |
| p-Rb (S807/811) | BD Biosciences | J112906 | G0/G1 Resolution |
| Proteomic Stabilizer | SmartTube Inc | PROT1 | Sample fixative |
| RPMI 1640 | Gibco | 21870-076 | Cell culture growth medium |
| Sodium Azide | Acros Organics | AC447810250 | Component of CSM/Antibody buffer, biocide |
Referenzen
- Ornatsky, O., Baranov, V. I., Bandura, D. R., Tanner, S. D., Dick, J. Multiple cellular antigen detection by ICP-MS. Journal of Immunological Methods. 308 (1-2), 68-76 (2006).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Analytical Chemistry. 80 (7), 2539-2547 (2008).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry A. 81 (7), 552-566 (2012).
- Raval, A., et al. Reversibility of Defective Hematopoiesis Caused by Telomere Shortening in Telomerase Knockout Mice. PLoS One. 10 (7), 0131722 (2015).
- Behbehani, G. K., et al. Mass Cytometric Functional Profiling of Acute Myeloid Leukemia Defines Cell-Cycle and Immunophenotypic Properties That Correlate with Known Responses to Therapy. Cancer Discovery. 5 (9), 988-1003 (2015).
- Kimmey, S. C., Borges, L., Baskar, R., Bendall, S. C. Parallel analysis of tri-molecular biosynthesis with cell identity and function in single cells. Nature Communications. 10 (1), 1185 (2019).
- Rabinovitch, P. S., Kubbies, M., Chen, Y. C., Schindler, D., Hoehn, H. BrdU-Hoechst flow cytometry: a unique tool for quantitative cell cycle analysis. Experimental Cell Research. 174 (2), 309-318 (1988).
- Rahman, A. H., Tordesillas, L., Berin, M. C. Heparin reduces nonspecific eosinophil staining artifacts in mass cytometry experiments. Cytometry A. 89 (6), 601-607 (2016).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample Preparation for Mass Cytometry Analysis. Journal of Visualized Experiments. (122), e54394 (2017).
- Behbehani, G. K. Immunophenotyping by Mass Cytometry. Methods in Molecular Biology. 2032, 31-51 (2019).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. Journal of Visualized Experiments. (69), e4398 (2012).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry A. 83 (5), 483-494 (2013).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Current Protocols in Cytometry. , 17 (2010).
- Devine, R. D., Sekhri, P., Behbehani, G. K. Effect of storage time and temperature on cell cycle analysis by mass cytometry. Cytometry A. 93 (11), 1141-1149 (2018).
- Campos, L., et al. Expression of immunological markers on leukemic cells before and after cryopreservation and thawing. Cryobiology. 25 (1), 18-22 (1988).
- Kadic, E., Moniz, R. J., Huo, Y., Chi, A., Kariv, I. Effect of cryopreservation on delineation of immune cell subpopulations in tumor specimens as determinated by multiparametric single cell mass cytometry analysis. BMC Immunology. 18 (1), 6 (2017).
- Shabihkhani, M., et al. The procurement, storage, and quality assurance of frozen blood and tissue biospecimens in pathology, biorepository, and biobank settings. Clinical Biochemistry. 47 (4-5), 258-266 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten