Method Article
استخدام بيريميدين التناظري ، 5-iodo-2′-deoxyuridine (IdU) مع علامات دورة الخلية لإنشاء مراحل دورة الخلية في منصة قياس الخلايا الجماعية
In This Article
Summary
يقوم هذا البروتوكول بتكييف قياسات دورة الخلية لاستخدامها في منصة قياس الخلايا الجماعية. مع قدرات متعددة المعلمات لقياس الكتلة الخلوية ، يسمح القياس المباشر لدمج اليود بتحديد الخلايا في المرحلة S بينما تتيح علامات الدورة داخل الخلايا توصيف كل حالة دورة خلية في مجموعة من الظروف التجريبية.
Abstract
يعد تنظيم مرحلة دورة الخلية جانبا مهما من جوانب الانتشار الخلوي والاتزان الداخلي. يعد تعطيل الآليات التنظيمية التي تحكم دورة الخلية سمة من سمات عدد من الأمراض ، بما في ذلك السرطان. تتطلب دراسة دورة الخلية القدرة على تحديد عدد الخلايا في كل جزء من تقدم دورة الخلية وكذلك التحديد الواضح بين كل مرحلة من مراحل دورة الخلية. يوفر ظهور القياس الخلوي الشامل (MCM) إمكانات هائلة لتحليل الخلية المفردة عالية الإنتاجية من خلال القياسات المباشرة للنظائر الأولية ، كما أن تطوير طريقة لقياس حالة دورة الخلية بواسطة MCM يزيد من فائدة MCM. هنا نصف طريقة تقيس مباشرة 5-iodo-2′-deoxyuridine (IdU) ، على غرار 5-bromo-2'-deoxyuridine (BrdU) ، في نظام MCM. يوفر استخدام MCM المستند إلى IdU العديد من المزايا. أولا ، يتم دمج IdU بسرعة في الحمض النووي أثناء تخليقه ، مما يسمح بقياس موثوق للخلايا في المرحلة S مع حضانات قصيرة تصل إلى 10-15 دقيقة. ثانيا ، يتم قياس IdU دون الحاجة إلى أجسام مضادة ثانوية أو الحاجة إلى تدهور الحمض النووي. ثالثا ، يمكن دمج تلطيخ IdU بسهولة مع قياس سيكلين B1 ، وبروتين الورم الأرومي الشبكي المفسفر (pRb) ، والهستون المفسفر H3 (pHH3) ، والذي يوفر مجتمعة تحديدا واضحا لمراحل دورة الخلية الخمس. يسمح الجمع بين علامات دورة الخلية هذه مع العدد الكبير من المعلمات الممكنة مع MCM بالاندماج مع العديد من المقاييس الأخرى.
Introduction
يتيح قياس الكتلة الخلوي الكشف عن ما يقرب من 40 معلمة من خلال الاستفادة من الدقة العالية والطبيعة الكمية لتحليل الطيف الكتلي. تستخدم الأجسام المضادة ذات العلامات المعدنية بدلا من الأجسام المضادة المترافقة بالفلوروفور التي تسمح بعدد أكبر من القنوات وتنتج الحد الأدنى من التداعيات 1,2. MCM له مزايا وعيوب فيما يتعلق بتحليل دورة الخلية مقارنة بقياس التدفق الخلوي. تتمثل إحدى المزايا الرئيسية ل MCM في أن العدد الكبير من المعلمات يتيح القياس المتزامن لحالة دورة الخلية عبر عدد كبير من أنواع الخلايا التائية المتميزة المناعية في عينات غير متجانسة للغاية. تم استخدام MCM بنجاح لقياس حالة دورة الخلية أثناء تكون الدم الطبيعي في نخاع العظمالبشري 3 ونماذج الفئران المعدلة وراثيا لنقص التيلوميراز4. أظهر تحليل حالة دورة الخلية في ابيضاض الدم النخاعي الحاد (AML) أن دورة الخلية مرتبطة بالاستجابات المعروفة للعلاجات السريرية ، مما يوفر نظرة ثاقبة في الجسم الحي للخصائص الوظيفية التي يمكن أن تفيد اختيارات العلاج5. الميزة الثانية لتحليل دورة الخلية الخلوية الجماعية هي القدرة على قياس عدد كبير من العلامات الوظيفية الأخرى التي قد تكون مرتبطة بحالة دورة الخلية. تمكنت الأعمال الحديثة من ربط تخليق البروتين والحمض النووي الريبي بحالة دورة الخلية من خلال استخدام IdU والأجسام المضادة الموسومة بالمعدن إلى BRU و rRNA6. هذا النوع من التحليل البارامتري للغاية الذي يقيس حالة دورة الخلية عبر العديد من المجموعات السكانية في سلسلة متصلة من التمايز سيكون شبه مستحيل مع تقنية قياس التدفق الخلوي الحالية. العيب الرئيسي ل MCM هو عدم وجود بقع الحمض النووي أو الحمض النووي الريبي مماثلة لتلك المستخدمة في قياس التدفق الخلوي الفلوري (على سبيل المثال ، DAPI ، Hoechst ، Pyronin Y ، إلخ). يمكن أن تعطي الأصباغ الفلورية قياسات دقيقة نسبيا لمحتوى الحمض النووي والحمض النووي الريبي ، ولكن هذه الدقة ممكنة فقط بسبب التغيرات في خصائص الفلورسنت لهذه الأصباغ التي تحدث عند الإقحام بين قواعد النيوكليوتيدات. وبالتالي فإن تحليل MCM غير قادر على قياس محتوى الحمض النووي أو الحمض النووي الريبي بدقة مماثلة. بدلا من ذلك ، يعتمد تحليل دورة الخلية الخلوية الجماعية على قياسات البروتينات المتعلقة بحالة دورة الخلية مثل سيكلين B1 ، وبروتين الورم الأرومي الشبكي المفسفر (pRb) ، وهيستون H3 المفسفر (pHH3) جنبا إلى جنب مع القياس المباشر لذرة اليود من دمج IdU في خلايا المرحلة S. ينتج عن هذين النهجين للقياس نتائج متشابهة للغاية أثناء الانتشار الخلوي الطبيعي ، ولكن يمكن أن يكونا متنافرين عندما يتعطل تقدم دورة الخلية.
يعد قياس عدد الخلايا في كل مرحلة من مراحل دورة الخلية أمرا مهما في فهم تطور دورة الخلية الطبيعية وكذلك اضطراب دورة الخلية ، والذي يلاحظ بشكل شائع في السرطانات والأمراض المناعية. يوفر MCM قياسا موثوقا للعوامل خارج الخلية وداخل الخلايا باستخدام الأجسام المضادة الموسومة بالمعادن. ومع ذلك ، كان قياس المرحلة S محدودا لأن مقحم الحمض النووي القائم على الإيريديوم لم يكن قادرا على التمييز بين الحمض النووي 2N و 4N. من أجل تحديد مراحل دورة الخلية ، طور بهبهاني طريقة تستخدم IdU بكتلة 127 ، والتي تقع ضمن نطاق مقياس الكتلة الخلوية وتسمح بالقياس المباشر للخلايا في المرحلةS 3. يتحايل هذا القياس المباشر على الحاجة إلى الأجسام المضادة الثانوية أو استخدام عوامل تغيير طبيعة الحمض النووي مثل الحمض أو DNase. بالاقتران مع علامات ركوب الدراجات داخل الخلايا ، فإنه يسمح بدقة عالية لتوزيع دورة الخلية في النماذج التجريبية.
يتكيف هذا البروتوكول مع قياسات دورة الخلية من بروتوكولات قياس التدفق الخلوي الشائعة ل MCM. توفر أساليبنا طريقة مريحة وبسيطة لتضمين معلمات دورة الخلية. يتطلب دمج IdU للعينات في المختبر من 10 إلى 15 دقيقة فقط من الحضانة عند 37 درجة مئوية ، وهو أقصر من معظم بروتوكولات تلطيخ BrdU التي توصي بأوقات حضانة لعدة ساعات 3,7. يمكن تثبيت العينات المدمجة IdU و BrdU باستخدام مثبت بروتيني ثم تخزينها لبعض الوقت في مجمد -80 درجة مئوية. وهذا يسمح بأرشفة أعداد كبيرة من العينات الملطخة ب IdU لتحليل الدفعات دون تقليل جودة العينة.
Protocol
1. إعداد مخزونات IdU
- قم بإذابة 5-iodo-2'-deoxyuridine (IdU) في DMSO بتركيز 50 mM. مرشح معقم ، قسمة في أنابيب 10-50 ميكرولتر ، وتخزينها في -80 درجة مئوية
- أخرج IdU من الفريزر ، وقم بإذابة الثلج في درجة حرارة الغرفة. قم بتخفيف IdU في RPMI-1640 لعمل حل عملي بتركيز نهائي قدره 1 mM. ماصة صعودا وهبوطا أو دوامة لخلط.
- عادة ، قم بتخفيف IdU المركز في الوسائط التي يتم فيها زراعة الخلايا (مثل DMEM ، IMDM ، إلخ) أو قم بتخفيفه إلى PBS لإضافته مباشرة إلى الدم المحيطي أو عينات نضح نخاع العظم. تسهل خطوة ما قبل التخفيف هذه خلط DMSO مع الوسائط المائية للخلايا المعنية.
ملاحظة: يجب أن يكون التركيز النهائي ل IdU أثناء الحضانة 10 ميكرومتر ؛ يمكن إضافة محلول مقداره 1 mM بنسبة 10 μL لكل 1 مل من الوسائط.
- عادة ، قم بتخفيف IdU المركز في الوسائط التي يتم فيها زراعة الخلايا (مثل DMEM ، IMDM ، إلخ) أو قم بتخفيفه إلى PBS لإضافته مباشرة إلى الدم المحيطي أو عينات نضح نخاع العظم. تسهل خطوة ما قبل التخفيف هذه خلط DMSO مع الوسائط المائية للخلايا المعنية.
2. حضانة IdU وحفظ العينات
- احتفظ بالعينات في حاضنة مرطبة بدرجة حرارة 37 درجة مئوية. أخرج العينة من الحاضنة وانقل العينة إلى غطاء للسلامة البيولوجية.
- أضف 10 ميكرولتر من 1 mM IdU إلى كل 1 مل من العينة.
- بالنسبة للوحة 6 آبار ، أضف 30 ميكرولتر من 1 mM IdU إلى 3 مل من وسائط الاستزراع في كل بئر. يمكن أيضا استخدام IdU مباشرة في شفاطات نخاع العظم وكذلك دراسات الفئران4.
- ضع العينة مرة أخرى في الحاضنة على حرارة 37 درجة مئوية لمدة 10-15 دقيقة. الحفاظ على الخلايا في ظل ظروف النمو المثلى ذات الأهمية أثناء التعرض ل IdU من أجل الحصول على القياس الأكثر دقة للمرحلة S.
- بعد حضانة IdU ، قم بإزالة العينة ونقلها إلى أنبوب مخروطي.
- أدر العينة على حرارة 400 × جم لمدة 10 دقائق في درجة حرارة الغرفة.
- نضح الطاف وإعادة تعليقه في 200 ميكرولتر من برنامج تلفزيوني.
- إذا لزم الأمر ، قم بإجراء بقعة حية / ميتة (باستخدام سيسبلاتين) في هذه الخطوة لتمييز الخلايا الميتة قبل التثبيت والتجميد.
ملاحظة: لا يعمل تلطيخ الروديوم الحي / الميت بشكل جيد بعد نفاذية الميثانول ، لذلك لا يوصى باستخدامه في تحليلات دورة الخلية.
- إذا لزم الأمر ، قم بإجراء بقعة حية / ميتة (باستخدام سيسبلاتين) في هذه الخطوة لتمييز الخلايا الميتة قبل التثبيت والتجميد.
- أضف 18.75 ميكرولتر من 16٪ بارافورمالدهايد (PFA) إلى PBS للحصول على تركيز نهائي قدره 1.5٪ PFA. احتضان في درجة حرارة الغرفة لمدة 10 دقائق. أدر العينة لأسفل عند 400 × جم لمدة 10 دقائق في درجة حرارة الغرفة.
- قم بنضح محلول PBS / PFA وأعد تعليق العينة في 500 ميكرولتر من وسائط تلطيخ الخلايا (CSM ؛ 1x PBS مع 0.5٪ BSA و 0.02٪ أزيد الصوديوم) + 10٪ DMSO قبل التجميد.
- في حالة استخدام مثبت بروتيني تجاري ، أضف 280 ميكرولتر من المثبت البروتيني إلى العينة المعاد تعليقها في 200 ميكرولتر من PBS (1: 1.4). احتضان العينات في درجة حرارة الغرفة لمدة 10 دقائق ثم ضعها مباشرة في -80 درجة مئوية.
ملاحظة: ثبت أن IdU يندمج بشكل فعال في غضون 10-15 دقيقة حضانة عند 37 درجة مئوية. ستقلل حضانات IdU التي تزيد مدتها عن 10-15 دقيقة تدريجيا من دقة مجموعات المرحلة S و G2 ، حيث تغادر الخلايا التي تحمل علامة IdU المرحلة S وتتقدم إلى المرحلة G2 أو M. لقد لاحظنا أيضا أن الحضانة طويلة الأمد مع IdU يمكن أن تسبب موت الخلايا والتحف دورة الخلية. المعالجة اللاحقة للخلايا وتلطيخ الأجسام المضادة بعد دمج IdU كافية لغسل IdU المتبقي الذي لم يتم دمجه في خلايا الطور S. لم نلاحظ خلفية كبيرة من اليود عند استخدام البروتوكول في المختبر الموصوف هنا; ومع ذلك ، نادرا ما لاحظنا تلوث اليود في العينات السريرية. قد يحدث هذا من الإجراءات الطبية ، مثل تباين اليود في التصوير المقطعي المحوسب ، أو من الأدوية المحتوية على اليود. في حالة ملاحظة كميات كبيرة من خلفية IdU ، يجب عدم تشغيل العينة لتجنب تلف كاشف مقياس الكتلة الخلوية.
- في حالة استخدام مثبت بروتيني تجاري ، أضف 280 ميكرولتر من المثبت البروتيني إلى العينة المعاد تعليقها في 200 ميكرولتر من PBS (1: 1.4). احتضان العينات في درجة حرارة الغرفة لمدة 10 دقائق ثم ضعها مباشرة في -80 درجة مئوية.
3. عينات تلطيخ لقياس الخلايا الجماعية
- قم بإزالة العينات من -80 درجة مئوية واتركها تذوب قبل تلطيخ السطح.
- في حالة استخدام طريقة التثبيت SmartTube ، قم بإذابة العينات عند 0-4 درجة مئوية لتجنب التثبيت الإضافي أثناء تسخين العينات.
- بعد إذابة العينات ، انقل ما يقرب من 1-2 مليون خلية إلى أنبوب FACS سعة 5 مل.
- قم بطرد أنبوب FACS عند 600 × جم لمدة 5 دقائق ، واملأ أنبوب FACS بوسائط تلطيخ الخلايا (CSM) لغسل الخلايا. كرر مرة واحدة إضافية.
- إذا كان من المعروف أن الخلايا تلتصق ببعضها البعض ، أضف 400 وحدة / مل من الهيبارين إلى غسول CSM لمنع ملامسة الخلية للخلايا ولكن هذا ليس ضروريا تماما.
- احتضان الخلايا بعامل مانع FC ، 5 ميكرولتر من العامل لكل 100 ميكرولتر من الخلايا ، لمدة 10 دقائق في درجة حرارة الغرفة.
- تحضير خليط من الأجسام المضادة التي من شأنها تلطيخ سطح ، أو جزء خارج الخلية ، من الخلايا. سيصل إجمالي خليط التلوين إلى 100 ميكرولتر لكل 1-2 مليون خلية في كل اختبار. سيتم موازنة خليط التلوين وفقا لذلك مع CSM والهيبارين في أنبوب الكوكتيل و FACS.
ملاحظة: ستؤدي إضافة CSM في هذه الخطوة أيضا إلى تقليل القطع الأثرية غير المحددة8. يعتمد خليط التلوين هذا كليا على الأهداف ذات الأهمية والنمط الظاهري السطحي (على سبيل المثال ، ستستخدم دراسة تتضمن الخلايا التائية خليطا سطحيا من CD45 و CD3 و CD4 و CD8 وما إلى ذلك). يمكن العثور على بروتوكول مفصل لمعالجة العينات وتلطيخها في Behbehani and McCarthy et al.9,10. - أضف خليط تلطيخ السطح إلى الخلايا واحتضانه في درجة حرارة الغرفة مع الاهتزاز المستمر لمدة 30-60 دقيقة.
- بعد التلوين ، املأ أنبوب FACS ب CSM ، وقم بتدويره لأسفل عند 600 × جم لمدة 5 دقائق.
- اغسل مرتين أخريين باستخدام CSM ، وقم بتدوير العينة عند 600 × جم لمدة 5 دقائق وشفط كل غسلة CSM.
- إصلاح الأجسام المضادة خارج الخلية عن طريق إضافة 1 مل من PBS مع 10٪ CSM و 1.5٪ PFA.
- املأ أنبوب FACS الذي يحتوي على خليط PBS / CSM / PFA ب CSM. قم بالدوران لأسفل عند 600 × جم لمدة 5 دقائق ونضح المادة الطافية.
- أضف الميثانول عند -20 درجة مئوية.
- دوامة العينة لمدة 1-2 دقيقة لتحقيق تعليق خلية واحدة والتحقق من إعادة تعليق جميع كتل الخلايا.
- بينما تدور العينة ببطء ، أضف بسرعة 1 مل من الميثانول المثلج باستخدام ماصة 1000 ميكرولتر مع طرف مرشح.
- امسك أنبوب FACs حتى الضوء وتأكد من عدم وجود كتل مرئية ؛ الغيوم أمر متوقع. أي كتل ستجعل العينة غير قابلة للاستخدام لتحليل MCM اللاحق.
- قم بتخزين العينة في درجة حرارة -20 درجة مئوية لمدة 10-20 دقيقة.
- تحضير خليط تلطيخ داخل الخلايا خلال هذا الوقت. يعتمد خليط التلوين داخل الخلايا على الأهداف ذات الاهتمام. لتحليل دورة الخلية ، قم بتضمين CyclinB1 و pRb و Ki67 و pHH3 في خليط التلوين هذا ، ولكن يمكن إضافة علامات أخرى داخل الخلايا حسب الحاجة.
- بعد 10-20 دقيقة عند -20 درجة مئوية ، قم بإزالة العينة وإضافة 1.5 مل من PBS واملأ الباقي ب CSM.
- أجهزة الطرد المركزي العينة 600 × ز لمدة 5 دقائق ، ونضح طاف الطاف.
- اغسل مرتين أخريين باستخدام CSM ، وقم بتدوير العينة لأسفل عند 600 × جم لمدة 5 دقائق وشفط المادة الطافية في كل مرة.
- بعد غسل CSM الأخير ، قم بطرد العينة واترك حجما متبقيا يبلغ حوالي 50 ميكرولتر.
- أضف خليط الأجسام المضادة المحضر (عادة ما تضيف 50 ميكرولتر من كوكتيل تلطيخ الأجسام المضادة لتحقيق حجم تلطيخ نهائي يبلغ 100 ميكرولتر) إلى العينة واحتضانها على منصة اهتزاز لمدة 30 إلى 60 دقيقة في درجة حرارة الغرفة.
- بعد تلطيخ إضافة CSM وأجهزة الطرد المركزي في 600 × غرام لمدة 5 دقائق.
- نضح CSM ، واغسله مرة أخرى باستخدام CSM ، ويدور عند 600 × جم لمدة 5 دقائق ، واستنشق CSM ، ثم أضف برنامج تلفزيوني.
- بعد الانتهاء من التلوين داخل الخلايا ، ضع الخلايا في محلول مقحم يثبت الأجسام المضادة للخلايا ويلطخ الحمض النووي لكل خلية لتمكين التعرف عليها. يحتوي محلول الإقحام على مقحم إيريديوم نقي غير نظائري (خماسي ميثيل سيكلوبنتادينيل-Ir(III)-ديبيريدوفينازين) مضاف من محلول مخزون الشركة المصنعة بتركيز 500 ميكرومتر. تمييع مخزون إيريديوم 1: 4000 في محلول PBS و 1.5٪ PFA. أضف محلول إقحام الإيريديوم بمعدل 100-200 ميكرولتر لكل مليون خلية من أجل تلطيخها بالتساوي ومنع الإفراط في تلطيخها.
ملاحظة: يهدف الإيريديوم في محلول الإقحام هذا إلى تحديد الخلايا للبوابات المفردة ، ولا ينبغي استخدامه للبقع الحية / الميتة. إذا كانت البقع الحية / الميتة مرغوبة ، فيجب إجراؤها قبل التثبيت كما هو مذكور أعلاه وفي McCarthy et al.9. - قم بتخزين العينات في محلول الإقفال في ثلاجة 4 درجات مئوية لمدة تصل إلى أسبوعين قبل الحصول على العينة على CyTOF.
4. عملية مقياس الخلايا الشامل
ملاحظة: يمكن أن تكون عملية قياس الخلايا الجماعية خاصة بالماكينة. ينصح دائما بالتحقق من دليل مستخدم CyTOF قبل التشغيل. بالإضافة إلى ذلك ، يوجد حاليا مقالتان من JoVE تتناولان بدء تشغيل الماكينة وصيانتها 9,11.
- افحص البخاخات بحثا عن أي قباقيب أو تشققات أو مخالفات أخرى قبل تشغيل مقياس الكتلة الخلوية.
- قم بتوصيل البخاخات بمقياس الخلايا وابدأ إجراء الإحماء. لا تقم بتشغيل مقياس الكتلة الخلوي بدون وجود البخاخات في مكانها.
- مرر الماء عبر خطوط العينة بمجرد انتهاء مقياس الكتلة الخلوي من الاحماء. يجب أن تصل غرفة الرش إلى حوالي 200 درجة مئوية قبل إجراء الضبط أو تحليل العينة.
- تشغيل المياه لمدة 5-10 دقائق. بعد 5-10 دقائق ، قم بتحميل حل الضبط وحدد مدير الضبط. محلول الضبط هو محلول يحتوي على تركيزات ثابتة من المعادن ويستخدم لتحسين مقياس الكتلة الخلوي قبل الحصول على العينة
- في مدير الضبط ، حدد معاينة بمجرد وصول حل الضبط إلى سجل ضرب في حالة ثابتة لبدء عملية الضبط التلقائي.
- بمجرد الانتهاء من الضبط ، قم بتحميل جهاز أخذ العينات بالماء والسماح للماء بالمرور عبر خطوط العينة أثناء معالجة العينة. يمكن العثور على بروتوكول مفصل لتشغيل مقياس الخلايا اليومي وضبطه في Leipold11.
- في بعض الأحيان ، لن يتم ضبط الضبط الآلي على الأداء الأمثل للماكينة. كرر إجراء الضبط لتصحيح هذا.
- اغسل العينة باستخدام CSM مرة واحدة وبالماء النقي منزوع الأيونات مرتين قبل الحصول على العينة. الغسيل بالماء مهم لإزالة الملح المتبقي من PBS / CSM.
- تحقق من الحساسية وتدفق العينات باستخدام حبات التوازن التي توفرها الشركة المصنعة ، حبات البوليسترين المحملة بتركيزات معدنية معروفة.
- قم بتغيير وضع الاستحواذ من الضبط إلى وضع التقاط الأحداث. اضبط الحد الزمني لإيقاف الاستحواذ على 120 ثانية. انتظر 45 ثانية قبل تحديد تسجيل.
- سيوقف مقياس الكتلة الخلوي الحصول على العينات تلقائيا بعد 120 ثانية. استخدم عارض مخطط المطر للتحقق من شدة Eu151 و Eu153.
- خرز التوازن المخفف في الماء النقي منزوع الأيونات بنسبة 1:20.
- قبل الحصول على عينة تحقق من مدير التجربة. استخدم مدير التجربة لتعيين أسماء للقنوات وإضافة قنوات لتسجيلها.
- تأكد من إضافة قناة 127-I في حالة استخدام IdU.
- لاحظ أنه من الضروري ضبط مقياس الكتلة الخلوية لقياس المعلمات المطلوبة (على سبيل المثال ، IdU) قبل الحصول على العينة. إذا لم يتم تحديد القنوات مسبقا ، فلن يتم جمع البيانات من أي قناة غير محددة ولا يمكن استردادها.
- قم بتخفيف الخلايا إلى تركيز حوالي 1-2 × 106 / مل باستخدام الماء النقي منزوع الأيونات 1:20 وخليط حبة التوازن. مرر الخلايا عبر أنبوب FACS المغطى بالمرشح لإزالة أي كتل متبقية.
- قم بتحميل العينة وتغيير وقت الاستحواذ.
- اضغط على معاينة وانتظر حتى يستقر عدد الأحداث في الثانية.
- لا تقم بتشغيل الأحداث التي تزيد عن 400 حدث في الثانية ، فسيؤدي ذلك إلى كميات كبيرة من المضاعفة والحطام. عادة ما نجمع ما لا يقل عن 20000 إلى 50000 حدث خلية ، لكن العدد الأمثل سيعتمد على التصميم التجريبي. عادة ما ينتج عن تلطيخ ما يصل إلى 2 مليون خلية 300000 إلى 400000 حدث خلوي. لاحظ أنه لن تكون جميع الأحداث عبارة عن خلايا (ستكون هناك أحداث حطام وخرز مدرجة في عدد الأحداث).
- بمجرد الانتهاء من الحصول على العينة ، قم بتحميل محلول الغسيل ، وابدأ تحريض العينة وقم بتشغيله لمدة 5-10 دقائق. بعد 5-10 دقائق توقف عن تحريض العينة وقم بتشغيل المياه لمدة 10-20 دقيقة. محلول الغسيل هو محلول ضعيف من حمض الهيدروفلوريك مصمم لتجريد المعدن المتبقي من خطوط العينة.
- أغلق مقياس الكتلة الخلوي وأزل البخاخات. سيكون البخاخات ساخنا ، توخ الحذر أثناء المناولة.
5. تحليل البيانات
- من أجل إزالة الخرز وأيضا لتصحيح انحراف الإشارة أثناء الحصول على العينة ، قم بتطبيع ملفات FCS باستخدام برنامج Fluidigm أو التطبيق الذي طورته Finck12.
- قم بتحميل FCS إلى Cytobank أو أي برنامج آخر لتحليل التدفق الخلوي. يمكن استخدام ملفات FCS في أي برنامج متوافق ، لأغراض هذا البروتوكول ، تم إجراء جميع البوابات والمزيد من التحليل في Cytobank13.
- قبل أن يتم رسم بوابات دورة الخلية ، استبعد أي ثنائيات أو حطام خلية من تحليل المصب ، يمكن القيام بذلك باستخدام المخطط ثنائي المحور لطول الحدث مقابل 191-Ir (الشكل 1 أ). ستشكل الخلايا مجموعة متميزة ومشرقة من الأشعة تحتالحمراء يمكن استخدامها لاستبعاد الثنائيات والحطام. هذه هي البوابة المفردة. عادة ما تزيل طريقة البوابات هذه حوالي 50-60٪ من أحداث الخلايا المزدوجة ، لذلك قد تكون هناك حاجة إلى استراتيجيات إضافية لإزالة أحداث الخلايا المزدوجة المتبقية.
- قم بتغيير مقياس طول الحدث (الحد الأدنى والحد الأقصى) لجعل الخلايا تبدو أكثر بروزا للمساعدة في بوابات المفردة.
- قم بإزالة الثنائيات والحطام باستخدام معلمات Gaussian والمتبقية والإزاحة. المتبقي الأعلى مع الإزاحة المنخفضة هو أيضا الحطام والزوجي ، ويمكن للبوابات حول هذه المجموعة أن تزيل الثنائيات والحطام (الشكل 1ب ، ج).
- بوابة المرحلة S - المرحلة S هي أسهل بوابة للرسم ولكنها أيضا الأكثر أهمية. ارسم هذه البوابة باستخدام مخطط ثنائي المحور من IdU مقابل pRb أو Ki67 أو cyclinB1. ستشكل خلايا IdU + في المرحلة S مجموعة مميزة عند النظر إلى هذه المخططات ثنائية المحور (الشكل 2 ب).
- بوابة المرحلة G0 / G1 ، بوابة المرحلة G2 / M - إنشاء بوابات المرحلة G0 / G1 و G2 / M على قطعة أرض IdU مقابل CyclinB1 واستخدام دمج IdU أمر بالغ الأهمية لإنشاء الحدود بين بوابات المرحلة G0 / G1 و G2 / M. ستكون المرحلة G0 / G1 منخفضة CyclinB1/ IdU- وستكون المرحلة G2 / Mعالية CyclinB1 / IdU-. سيظهر تلطيخ CyclinB1 الجيد تجمعا طبيعيا بين مجموعات G0-G1 و G2-M ؛ ومع ذلك ، سيختلف هذا عبر أنواع العينات والخلايا في ظل الظروف التجريبية. في الظروف التجريبية حيث قد يتأثر توزيع دورة الخلية وهناك فصل أقل بين مرحلة CyclinB1 G0 / G1 ومرحلة G2 / M ، سيسمح استخدام المرحلة S ببوابات متسقة لأنواع معينة من الخلايا في كل تجربة محددة. هذه الطريقة مفصلة أدناه.
- ارسم فقط خلايا الطور S على CyclinB1 مقابل IdU للمساعدة في إنشاء الفصل بين المرحلة G0 / G1 والمرحلة G2 / M. ارسم بوابة على عددالسكان المرتفع CyclinB1 واضبطه حتى يصبح أعلى 5٪ تقريبا من سكان المرحلة S داخل البوابة (الشكل 2 ج). يحدد هذا نقطة التوقف بين بوابات الطور G0 / G1 و G2 / M (الشكل 2ه ، و). سيتم تغيير السكان النشطين إلى السكان محل الاهتمام وسيكون الجزء المقيم داخل البوابة السابقة هو سكان المرحلة G2 / M بينما سيكون الباقي هو سكان المرحلة G0 / G1.
- بوابة المرحلة G0 - قم بإنشاء المرحلة G0 على مخطط pRb مقابل IdU. سيتم تمثيل المرحلة G0 بعدد منخفض من السكان pRb / IdU. سيكون لسكان ركوب الدراجات النشطين تعبير عال عن دمج pRb و IdU ، ويمكن رسم بوابة المرحلة G0 على هذه الحدود لأنها تعبر عادة عن مجموعتين متميزتين (الشكل 2g ، i).
- حدد المرحلة G0 عن طريق جعل سكان المرحلة S الذين تم رسمهم سابقا (الشكل 2 ب) هم السكان النشطون ورسم بوابة تضم أعلى 90-100٪ من السكانالمرتفعين في pRb. هذا هو عدد سكان ركوب الدراجات pRb + (الشكل 2i) ، وعددالسكان المنخفض pRb خارج هذه البوابة هو عدد السكان G0 (الشكل 2j).
- إذا كان pRb غير متوفر أو لا يمكن تسجيله ، فاستخدم Ki67 vs IdU لإنشاء مجتمع المرحلة G0. رسم بوابة تمثل غالبية سكان المرحلة S واستخدام تلك البوابة كحدود ل Ki67 مقابل IdU ، سيكون باقي السكان هو المرحلة G0 (الشكل 3 أ).
- بوابة المرحلة M - إنشاء المرحلة M في مخطط ثنائي المحور IdU مقابل pH3. تمثل المرحلة M جزءا صغيرا جدا من الخلايا وهي مسورة على عددالسكان المرتفع pH3 (الشكل 2 د).
- فشل دمج IdU أو لم يكن ممكنا - إذا كان IdU غير متوفر ، فحدد دورة الخلية وليس كسور التدوير باستخدام Ki67 و pRb. Ki67 و pRb ، في الظروف العادية ، يشكلان مجموعتين متميزتين Ki67 عالية / pRbعالية و Ki67 منخفضة / pRb منخفضة. يمثل السكان الإيجابيون المزدوجون السكان النشطين لركوب الدراجات ، ويرتبطون بالمرحلة G1 والمرحلة S والمرحلة G2 والمرحلة M. يمثل السكان المنخفضون المزدوجون السكان غير الدراجين ، ويرتبط بالمرحلة G0 (الشكل 3 ب).
ملاحظة: لا يمكن تحديد كل مرحلة على حدة باستخدام Ki67 مقابل pRb ولكن يمكن تحديد التأثيرات التجريبية على مجموعات الدراجات / عدم ركوب الدراجات النسبية. - تحليل دورة الخلية - بمجرد إنشاء البوابات ، قم بتصدير القيم العددية من البوابات لمزيد من التحليل. يمكن تحقيق النسب المئوية في كل دورة عن طريق طرح المجموعات السكانية الفردية من المجموعات السكانية المجمعة. يمكن طرح المرحلة G0 ، المرسومة علىانخفاض IdU المنخفضpRb ،من المرحلة G0 / G1 ، المرسومة على CyclinB1IdU negالمنخفضة ، لإيجاد النسبة المئوية للمرحلة G1. وبالمثل ، فإن النسبة المئوية للمرحلة G2 مشتقة من طرح بوابة الطور M من بوابة الطور G2 / M. سيؤدي ذلك إلى إنشاء قيم عددية لكل مرحلة من مراحل دورة الخلية الفردية ؛ G0 و G1 و S و G2 و M. يمكن استخدام القيم العددية التي تم إنشاؤها لكل مرحلة من مراحل دورة الخلية الفردية لمزيد من التحليل مثل الرسوم البيانية والتحليل الإحصائي.
النتائج
باستخدام خلايا HL-60 ونضح نخاع العظم البشري ، من الممكن إظهار كيف يمكن أن تؤثر الظروف التجريبية على توزيع دورة الخلية وتحليلها. أولا ، يجب إنشاء استراتيجية البوابة لتوضيح كيفية اشتقاق مراحل دورة الخلية. في الشكل 1 ، نعرض إنشاء البوابة المفردة ، وهو أمر مهم في فصل الحطام الخلوي والثنائيات ، وإنشاء مجموعة خلية واحدة. بالنسبة لخطوط الخلايا ، فإن البوابة المفردة هي كل ما هو مطلوب للانتقال إلى تحليل دورة الخلية (الشكل 2 أ). بالنسبة للعينات البشرية ، يجب عادة تحديد مجموعات النمط المناعي قبل تحليل دورة الخلية ، حيث يمكن أن تختلف الحدود الدقيقة لكل بوابة دورة خلية عبر أنواع الخلايا المختلفة. بمجرد إنشاء المجموعات (عادة عن طريق بوابات على علامات السطح التي تحدد تلك المجموعة) ، ستحتاج بوابات دورة الخلية إلى الإنشاء. يوضح الشكل 2 ب إنشاء المرحلة S على مخطط ثنائي المحور IdU مقابل CyclinB1. تستخدم هذه المؤامرة أيضا لتحديد حدود بوابة المرحلة G2 / M (الشكل 2f). بمجرد إنشاء المرحلة G2 / M ، يكون الباقي هو بوابة المرحلة G0 / G1 (الشكل 2f). يتم استخدام IdU مقابل pRb لتحديد مجموعة ركوب الدراجات pRb + أولا عن طريق إنشاء بوابة على IdU تتضمن خلايا (الشكل 2g ، i). مجموعة pRb + / IdUneg خارج هذه البوابة هي المرحلة G0 (الشكل 2j). يتم إنشاء المرحلة M على IdU مقابل pHH3 حيث تعبر خلايا الطور M عن مستويات عالية من pHH3 ولا تظهر أي دمج IdU (الشكل 2k). في حالة عدم تضمين pRb ، يمكن تكرار المرحلة G0 باستخدام Ki67 بطريقة مماثلة للطريقة الموضحة أعلاه (الشكل 3 أ). إذا فشل دمج IdU أو لم يتم تنفيذه ، فلا يزال من الممكن تحديد كسور الدورة النسبية باستخدام Ki67 و pRb. باستخدام Ki67 و pRb ثنائي المحور يشكلان مجموعتين متميزتين ، pRb + / Ki67 + موجب مزدوج و pRb منخفض / Ki67منخفض السكان. يمثل السكان الموجب المزدوج خلايا في الدورة ، بينما يمثل المنخفض خلايا ليست في دورة (الشكل 3 ب). باستخدام IdU دمج الخلايا والخلاياالمنخفضة pRb مع عدم دمج IdU ، نظهر أن المرحلة S هي في المقام الأول في السكان pRb + / Ki67 + بينما تكون المرحلة G0 في المقام الأول في السكانالمنخفض pRb / Ki67المنخفض.
يعتمد تحليل دورة الخلية على تقنية تجريبية جيدة خاصة أثناء خطوة حضانة IdU. في حين أن دمج IdU مرن (قابل للتطبيق في زراعة الخلايا ، وشفط نخاع العظم ، وحتى دراسات الفئران) ، فمن الضروري إجراء دمج IdU وتثبيته دون تعطيل حالة دورة الخلية ذات الأهمية التجريبية. يمكن أن يتأثر وضع العلامات على IdU وبالتالي تحليل دورة الخلية النهائية بشكل كبير بالوقت ودرجة الحرارة كما هو موضح في الشكل 4. الخلايا التي تبقى لفترة طويلة جدا في الأوعية المغلقة أو التي قد تصادفها في شحن العينات أو نقل العينات بين المواقع ، ستقلل من جزء الطور S ولن تكون دقيقة لتحليل دورة الخلية (الشكل 4 أ). على الرغم من أن الفترات الزمنية القصيرة ، تلك التي تقل عن ساعة في المجموع ، سيكون لها توزيع طبيعي لدورة الخلية مما يشير إلى أن النقل السريع قد لا يؤثر سلبا على تحليل دورة الخلية (الشكل 4 ب). معدل مهم آخر هو الحفظ بالتبريد الذي يستخدم بشكل روتيني في معظم المختبرات. عند فحص حالة دورة الخلية في الخلايا المحفوظة بالتبريد ، قد تكون هناك حاجة إلى فترة توازن طويلة قبل عودة الخلايا إلى دورة الخلية النشطة ، والتي قد لا تعكس حالة دورة الخلية قبل الحفظ الحراري (الشكل 4 ج).
غالبا ما تكون العينات البشرية الأولية مركبات من أنواع مختلفة من الخلايا المتعددة ، ويمكن أن يكون لهذه الأنواع المختلفة من الخلايا حساسيات مختلفة للمعالجة مما يؤدي إلى بوابات دورة خلية مختلفة. في اثنين من شفط نخاع العظم الذي تم وضع علامة IdU عليه على الفور ، أو تخزينه لمدة 30 دقيقة قبل وضع العلامات على IdU ، أو تخزينه بالتبريد بعد فصل Ficoll ، هناك اختلافات بين كل عينة ومجموعة سكانية (الشكل 5أ ، ب). تم فحص مجموعتين من النمط المناعي للاختلافات في دمج IdU. الخلايا التائية (CD45 عالية /CD3 عالية) والخلايا الأحادية (CD33 + ، HLADR + ، CD11bمنخفضة ، CD14neg). مع المزيج الصحيح من العلامات السطحية ، من الممكن فحص المزيد من المجموعات المناعية. في النخاع # 2 كان هناك تأثير تنشيط ملحوظ للخلايا التائية بعد تخزين 30 دقيقة لم يتم رؤيته في الأرومات الأحادية من نفس المريض (الشكل 5 ب). مثل الخلايا المستزرعة ، كانت هناك تغييرات ملحوظة في وضع العلامات على IdU بعد التخزين المبرد الذي كان يعتمد أيضا على السكان. كان للنخاع #1 انخفاض في عدد الخلايا التائية ولكن زيادة في الكسور الموسومة ب IdU عند مقارنتها بخط الأساس (الشكل 5 أ ، ب) ، أظهر النخاع # 2 انخفاضا في كل من الخلايا التائية والأرومات الأحادية عند مقارنتها بخط الأساس (الشكل 5أ ، ب). تتطلب الخلايا المجمدة بعد ذلك فترة حضانة ملحوظة قبل العودة إلى حالة دورة الخلية الطبيعية وهذا يمكن أن يؤثر على الدراسات التي تعتمد على تعديل حالة دورة الخلية أو حالة دورة الخلية كمقياس للتأثير الدوائي أو التجريبي.
فائدة أخرى ل MCM هي القدرة على تمييز الخلايا في توقف دورة الخلية أو التي لديها توزيع غير طبيعي لدورة الخلية. في حين أن أصباغ الحمض النووي المستخدمة بشكل شائع في قياس التدفق الخلوي قادرة على التمييز بين محتوى الحمض النووي 2N و 4N ، إلا أنها ساطعة للغاية ، مما قد يعقد بشكل كبير قياس المعلمات الأخرى من هذا الليزر. ومع ذلك ، فإن IdU لا يأخذ سوى قناة كتلة واحدة ولديه الحد الأدنى من الانسكاب مما يسمح باستخدام علامات أخرى في تحديد دورة الخلية. تظهر خلايا MOLM13 التي تم تشعيعها انخفاضا في دمج IdU وانخفاضا في المرحلة M مقارنة بالخلايا الضابطة (الشكل 6). قد يؤدي تعطيل نقاط تفتيش دورة الخلية العادية إلى تغيير حالة دورة الخلية الظاهرة بواسطة MCM. بالنظر إلى مجموعات pH2AX و cPARP في الخلايا غير المشععة ،يظهر عدد السكان المنخفض و cPARPالمنخفض توزيع دورة الخلية الطبيعي بينما الخلايا التي تعبر عن مستويات أعلى من pH2AX أو cPARP تتمركز بشكل رئيسي في المرحلة G0 / G1 المتوقعة (الشكل 6 أ). في الخلايا المشععة ،يكون pH2AX منخفضا و cPARPمنخفضا ، ومع ذلك ، تكون الخلايا موضعية بالكامل تقريبا في المرحلة G0 ، بينما تظهر الخلاياالعالية pH2AXوخلايا cPARP المنخفضة نمطا ظاهريا لإيقاف دورة الخلية مع دمج IdU وتوطينه إلى المرحلة G0 / G1 والمرحلة G2 مع عدم وجود المرحلة M. تظهر الخلاياالعالية pH2AX و cPARP العالية أيضا خلايا تتضمن بعض IdU وتوطينها في المرحلة G0 / G1 التي تشير إلى الضرر الإشعاعي (الشكل 6 ب).
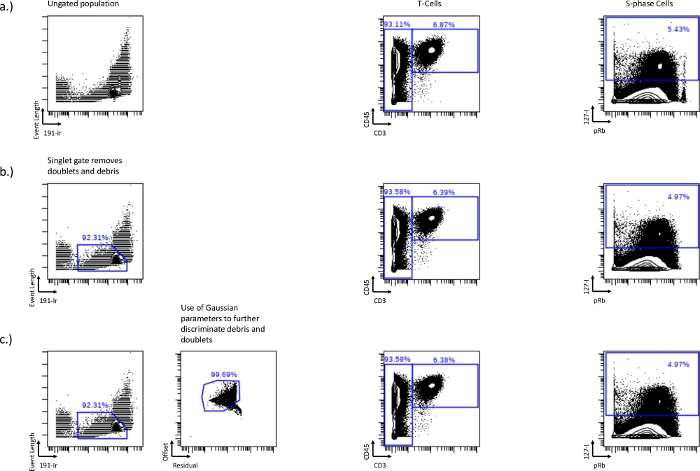
الشكل 1: إنشاء البوابات المفردة باستخدام 191-Ir حسب طول الحدث وكذلك المعلمات الغاوسية والمتبقية والإزاحة.
الاختلافات في الخلية التائية (CD45 + / CD3 +) والمرحلة S (IdU +) بين عينة غير محددة (a) ، أو طول الحدث مقابل البوابة المفردة 191-Ir (b) ، أو بوابة مفردة مدمجة مع معلمات Gaussian ، المتبقية والإزاحة (c). تزيل البوابة المفردة الحطام والزوجي والخرز الموضح في فقدانعدد السكان المرتفع pRb في الزاوية اليمنى من المحور الثنائي. يمكن تحسين هذه البوابة الفردية بشكل أكبر من خلال تضمين معلمات Gaussian مثل المتبقية والإزاحة ، وإزالة المزيد من الحطام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
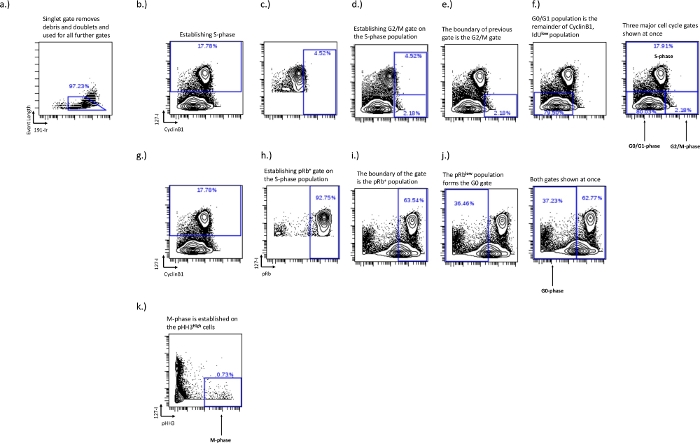
الشكل 2: مخطط البوابات لإنشاء بوابات دورة الخلية لمراحل G0 و G1 و S و G2 و M باستخدام IdU و CyclinB1 و pRb و pHH3.
تم إنشاء البوابة المفردة لإزالة الثنائيات والحطام (أ). يجب إنشاء المرحلة S (ب) ، بمجرد إنشاء المرحلة S ، يمكن استخدام مجموعة IdU + لإنشاء حدود المرحلة G2 / M (c ، d). يحدد إنشاء حدود المرحلة G2 / M حدود مجموعة الطور G0 / G1 (f). يتم إنشاء مجتمع المرحلة pRb + و G0 على ثنائي المحور IdU مقابل pRb. تستخدم خلايا IdU + (h) لإنشاء حدود مجتمع pRb + (i). تحدد حدود مجتمع pRb + حدود مجتمع المرحلة G0 (j). يتم إنشاء المرحلة M على خلايا pHH3 + التي هي IdU- (k). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
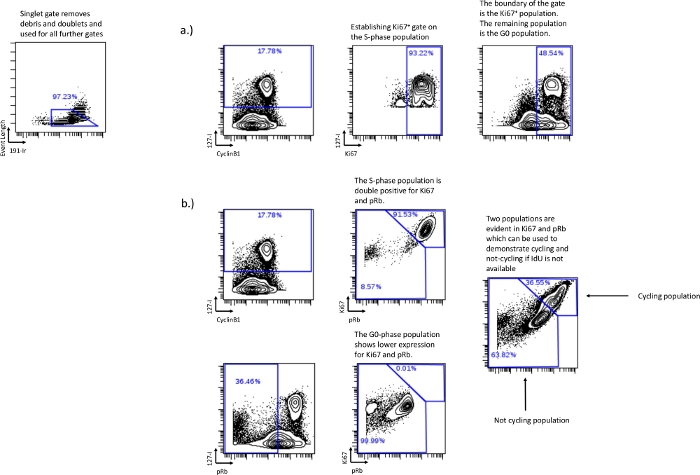
الشكل 3: إنشاء بوابات دورة الخلية دون استخدام pRb أو بدون استخدام دمج IdU.
يمكن أيضا رسم المرحلة G0 باستخدام Ki-67 باتباع نفس استراتيجية البوابات التي تم استخدامها مع pRb ، إذا لم يتم تضمين pRb في التجربة (أ). إذا فشل دمج IdU أو لم يتم تنفيذه ، فلا يزال من الممكن استعادة كسور دورة الخلية النسبية من خلال استخدام Ki67 و pRb. يرتبط التعبير الإيجابي المزدوج Ki67 و pRb بالخلايا في الدورة كما يتضح من إظهار أن خلايا IdU + موجودة بشكل أساسي في السكان الموجب المزدوج (b). يرتبط عدد السكان المنخفض Ki67 و pRb بالسكان G0 في المرحلة أو عدم ركوب الدراجات الذي أظهرتهخلايا pRb المنخفضة / IdU neg الموجودة في Ki67 و pRb منخفضة السكان. لا يمكن لهذه الطريقة تمييز مراحل دورة الخلية الفردية ولكن لا يزال من الممكن استخدامها لتحديد كسور الدورة النسبية في الظروف التجريبية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: أرقام تمثيلية لتأثير ظروف التخزين المختلفة على توزيع دورة الخلية لخلايا HL-60.
تم تحضين الخلايا لمدة ساعة تليها ساعة راحة في ظروف درجة الحرارة المذكورة في أنابيب محكمة الغلق (أ). هناك تأثيرات ملحوظة على توزيع دورة الخلية عند مقارنتها بالتحكم. تم الاحتفاظ بخلايا HL60 في أنابيب محكمة الغلق في درجة حرارة الغرفة لمدة 30 دقيقة ، وهي حالة قد تحدث في بيئة سريرية ، قبل دمج IdU (ب). الأنابيب المختومة المحفوظة في درجة حرارة الغرفة لمدة 30 دقيقة لم تظهر اختلافات ملحوظة في دورة الخلية. تم التحقيق في تأثير التخزين المبرد على دورة الخلية في خلايا HL60 ، حيث تم أخذ عينة قبل التخزين المبرد وعينة مأخوذة بعد ساعة راحة بعد أسبوع في التخزين المبرد (c). بعد ساعة واحدة من ذوبان الجليد ، يتأثر توزيع دورة الخلية ولا يعود توزيع دورة الخلية إلى طبيعته إلا بعد أسبوع تقريبا من ذوبان الجليد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: يمكن أن يكون للمعالجة تأثير على عينات المرضى ويتم عرض صور تمثيلية بين مريضين مختلفين تظهر (أ) الخلايا التائية (CD45 عالية /CD3 عالية) و (ب) الأرومة الأحادية (CD33 + ، HLADR + ، CD11bمنخفضة ، CD14neg).
بين النخاع الأول والنخاع الثاني ، من الواضح أنه في النخاع 2 كان هناك تأثير تنشيط الخلايا التائية خلال 30 دقيقة من الراحة بينما لم يكن للنخاع الأول مثل هذا التأثير. أظهر النخاع الأول تأثير تنشيط محتمل في مجموعة الأرومات الأحادية بعد 30 دقيقة بينما لم يظهر النخاع الثاني. ومع ذلك ، في كلا النخاع ، كان من الواضح أن التخزين المبرد أثر على توزيع دورة الخلية بغض النظر عن نوع الخلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تركت خلايا MOLM13 إما كعناصر تحكم أو تعرضت للإشعاع باستخدام مشع الأشعة السينية عند 10Gy.
تظهر خلايا MOLM13 توزيع دورة الخلية في أربع مجموعات مختلفة من تعبير pH2AX و cPARP. تظهر الخلايا الضابطة الحد الأدنى من تلطيخ pH2AX و cPARP ، مع إظهار خصائص دورة الخلية الطبيعية في عددالسكان المنخفض pH2AX و cPARPالمنخفض (a). بينما تظهر الخلايا المشععة توزيعا غير طبيعي لدورة الخلية مع وجود غالبية الخلايا الدائرية في ارتفاع pH2AXوارتفاع cPARP ، مما يشير إلى اضطراب دورة الخلية (b). تظهر الخلايا غير التالفة ، pH2AX المنخفضة و cPARPالمنخفضة ، نقصا في خصائص ركوب الدراجات بشكل أساسي في المرحلة G0. بدون هذه العلامات ، ستظهر هذه الخلايا كخلايا 4N و 2N في قياس التدفق الخلوي الطبيعي مما قد يربك تحليل دورة الخلية النهائية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
توضح الأمثلة المقدمة هنا كيفية استخدام منصة MCM لتحليل توزيع دورة الخلية. وقد ثبت أيضا أن تحليل دورة الخلية حساس للظروف التجريبية مثل الوقت ودرجة الحرارة ، وهو اعتبار مهم يجب على الباحثين اتخاذه عند التفكير في MCM لتحليل دورة الخلية14. العينات التي تترك في التخزين لفترة قصيرة من الزمن ، لا تزيد عن ساعة ، سيكون لها دمج IdU مماثل لحالتها الطبيعية. العينات في نظام مغلق لفترات طويلة من الزمن ، حوالي 2 ساعة ، ستقلل من دمج IdU ، ومع ذلك ، فإن الكسور النسبية للدورة وغير الدورية لن تتغير مما يسمح بتحليل دورة الخلية الخشنة. التخزين المبرد والذوبان اللاحق يعطلان التوزيع الطبيعي لدورة الخلية لفترة طويلة من الزمن. لوحظ سابقا أن التخزين المبرد يعطل توزيع البروتين والحمض النووي الريبي ولكن ثبت مؤخرا أنه يعطل دورة الخلية14،15،16،17. تشير هذه مجتمعة إلى أنه إذا كان من المتوقع حدوث أوقات تخزين طويلة أو حفظ مبرد للعينات ، فسيكون من الأفضل تلطيخ الخلايا باستخدام IdU قبل التخزين أو التخزين المبرد ، وإصلاح الخلايا وتخزينها حتى يمكن إجراء التحليل. نظرا لأن تحليل دورة الخلية بواسطة MCM لا يتطلب خلايا حية ، فإن هذا سيمكن الباحثين من تخزين عينات ثمينة وإجراء تحليل دقيق لدورة الخلية النهائية.
تحليل دورة الخلية بواسطة MCM هو نظام قوي قادر على الاستجواب العميق للنماذج التجريبية. نظرا لعدد المعلمات العالية MCM ، ما يقرب من 40-50 قناة كتلة ، يمكن أن يتضاعف تحليل دورة الخلية مع علامات أخرى داخل الخلايا أو خارج الخلية تتجاوز الحاجة إلى فرز الخلايا بناء على النمط المناعي الذي قد يتسبب في فقدان تأثيرات دورة الخلية الكبيرة. إن طبيعة المعلمات العالية ل MCM تفسح المجال لفحص التأثيرات في تطبيقات رسم الخرائط عالية الأبعاد مثل SPADE و viSNE. بينما يتم استخدام SPADE و viSNE عادة لتحديد مجموعات النمط المناعي التي يمكن بعد ذلك فحصها بحثا عن تغييرات دورة الخلية ، سيكون من الممكن أيضا تعيين علامات دورة الخلية. اعتمادا على الظروف التجريبية ، يمكن أن تظهر علامات دورة الخلية في مساحة عالية الأبعاد ارتباط دورة الخلية بتأثير الدواء أو ما هي مجموعات النمط المناعي التي قد تكون موضعية لكل حالةدورة 3,5. في حين أن MCM قد يكون محدودا بسبب نقص الأصباغ الفلورية المرتبطة بالحمض النووي ، يتم تعويضه عن طريق الدمج المباشر ل IdU خلال خلايا الطور S ويمكن استخدام بروتينات دورة الخلية داخل الخلايا لتحديد حالة دورة الخلية. يمكن أن تساعد بروتينات دورة الخلية هذه أيضا في التمييز بين مراحل توقف دورة الخلية التي قد تظهر على شكل 3N أو 4N في التدفق التقليدي باستخدام أصباغ ربط الحمض النووي. ومع ذلك ، فإن مثل هذه الأنظمة ذات المعلمات العالية لا تخلو من العيوب ، وهي حساسة للاضطرابات في دورة الخلية. لقد أظهرنا أن أوقات التخزين الطويلة والتخزين المبرد يمكن أن تؤثر بشكل كبير على توزيع دورة الخلية. هذا مهم بشكل خاص عند محاولة ترشيد التأثيرات التجريبية للأدوية التي قد تؤثر على توزيع دورة الخلية. قد تعطي معالجة الأدوية المصممة للتأثير على دورة الخلية على العينات الأولية المجمدة بيانات خاطئة عن تأثير دورة الخلية عند استخدامها مباشرة بعد الذوبان من التخزين المبرد. MCM هي تقنية متعددة الاستخدامات لتحليل دورة الخلية يمكن تطبيقها على عدد من النماذج التجريبية وهي مناسبة بشكل خاص للتنميط العميق للأنظمة غير المتجانسة. كما هو الحال مع الطرق الأخرى ذات المعلمات العالية ، من الضروري إجراء تجربة مصممة بعناية مع الاعتبارات المناسبة لكيفية تأثير المعالجة والتأثيرات التجريبية على تحليل دورة الخلية.
Disclosures
يتلقى الدكتور بهبهاني دعم السفر من Fluidigm. كما اشترت Fluidigm كواشف ومواد للاستخدام في المختبر.
Acknowledgements
يود المؤلفون أن يشكروا جهود بالاك صخري وحسام الخلايلة وهسياوتشي تشانغ وجوستين ليبرغر على دعمهم التجريبي. تم دعم هذا العمل من قبل برنامج زمالة بيلوتونيا. أي آراء ونتائج واستنتاجات يتم التعبير عنها في هذه المادة هي آراء المؤلف (المؤلفين) ولا تعكس بالضرورة آراء برنامج زمالة بيلوتونيا ".
Materials
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma | A3059 | Component of CSM |
| Centrifuge | Thermo Scientific | 75-217-420 | Sample centrifugation |
| Cleaved-PARP (D214) | BD Biosciences | F21-852 | Identification of apoptotic cells |
| Cyclin B1 | BD Biosciences | GNS-1 | G2 Resolution |
| Dimethylsulfoxide (DMSO) | Sigma | D2650 | Cryopreservative |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | Internal metal standard for CyTOF performance |
| FACS Tube w/ mesh strainer | Corning | 08-771-23 | Cell strainer to remove clumps/debris before CyTOF run |
| Fetal Bovine Serum (FBS) | VWR | 97068-085 | Cell culture growth supplement |
| Helios | Fluidigm | CyTOF System/Platform | |
| Heparin | Sigma | H3393 | Staining additive to prevent non-specific staining |
| IdU (5-Iodo-2′-deoxyuridine) | Sigma | I7125 | Incorporates in S-phase |
| Ki-67 | eBiosciences | SolA15 | Confirmation of G0/G1 |
| MaxPar Multi Label Kit | Fluidigm | 201300 | Metal labeling kit, attaches metals to antibodies |
| Microplate Shaker | Thermo Scientific | 88880023 | Mixing samples during staining |
| Paraformaldehyde (PFA) | Electron Microscopy Services | 15710 | Fixative |
| pentamethylcyclopentadienyl-Ir(III)-dipyridophenazine | Fluidigm | 201192 | Cell identification during CyTOF acquisition |
| p-H2AX (S139) | Millipore | JBW301 | Detection of DNA damage |
| p-HH3 (S28) | Biolegend | HTA28 | M-phase Resolution |
| Phosphate Buffered Saline (PBS) | Gibco | 14190-144 | Wash solution for cell culture and component of fixative solution |
| p-Rb (S807/811) | BD Biosciences | J112906 | G0/G1 Resolution |
| Proteomic Stabilizer | SmartTube Inc | PROT1 | Sample fixative |
| RPMI 1640 | Gibco | 21870-076 | Cell culture growth medium |
| Sodium Azide | Acros Organics | AC447810250 | Component of CSM/Antibody buffer, biocide |
References
- Ornatsky, O., Baranov, V. I., Bandura, D. R., Tanner, S. D., Dick, J. Multiple cellular antigen detection by ICP-MS. Journal of Immunological Methods. 308 (1-2), 68-76 (2006).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Analytical Chemistry. 80 (7), 2539-2547 (2008).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry A. 81 (7), 552-566 (2012).
- Raval, A., et al. Reversibility of Defective Hematopoiesis Caused by Telomere Shortening in Telomerase Knockout Mice. PLoS One. 10 (7), 0131722(2015).
- Behbehani, G. K., et al. Mass Cytometric Functional Profiling of Acute Myeloid Leukemia Defines Cell-Cycle and Immunophenotypic Properties That Correlate with Known Responses to Therapy. Cancer Discovery. 5 (9), 988-1003 (2015).
- Kimmey, S. C., Borges, L., Baskar, R., Bendall, S. C. Parallel analysis of tri-molecular biosynthesis with cell identity and function in single cells. Nature Communications. 10 (1), 1185(2019).
- Rabinovitch, P. S., Kubbies, M., Chen, Y. C., Schindler, D., Hoehn, H. BrdU-Hoechst flow cytometry: a unique tool for quantitative cell cycle analysis. Experimental Cell Research. 174 (2), 309-318 (1988).
- Rahman, A. H., Tordesillas, L., Berin, M. C. Heparin reduces nonspecific eosinophil staining artifacts in mass cytometry experiments. Cytometry A. 89 (6), 601-607 (2016).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample Preparation for Mass Cytometry Analysis. Journal of Visualized Experiments. (122), e54394(2017).
- Behbehani, G. K. Immunophenotyping by Mass Cytometry. Methods in Molecular Biology. 2032, 31-51 (2019).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. Journal of Visualized Experiments. (69), e4398(2012).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry A. 83 (5), 483-494 (2013).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Current Protocols in Cytometry. , Chapter 10, Unit10 17(2010).
- Devine, R. D., Sekhri, P., Behbehani, G. K. Effect of storage time and temperature on cell cycle analysis by mass cytometry. Cytometry A. 93 (11), 1141-1149 (2018).
- Campos, L., et al. Expression of immunological markers on leukemic cells before and after cryopreservation and thawing. Cryobiology. 25 (1), 18-22 (1988).
- Kadic, E., Moniz, R. J., Huo, Y., Chi, A., Kariv, I. Effect of cryopreservation on delineation of immune cell subpopulations in tumor specimens as determinated by multiparametric single cell mass cytometry analysis. BMC Immunology. 18 (1), 6(2017).
- Shabihkhani, M., et al. The procurement, storage, and quality assurance of frozen blood and tissue biospecimens in pathology, biorepository, and biobank settings. Clinical Biochemistry. 47 (4-5), 258-266 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved