Method Article
세포 주기 마커와 함께 피리미딘 유사체, 5-요오도-2′-데옥시우리딘(IdU)을 사용하여 질량 세포분석 플랫폼에서 세포 주기 단계 설정
요약
이 프로토콜은 질량 세포 분석 플랫폼에서 사용하기 위해 세포 주기 측정을 조정합니다. 질량 세포분석의 다중 파라미터 기능을 통해 요오드 결합을 직접 측정하면 S상에서 세포를 식별할 수 있으며 세포 내 사이클링 마커를 통해 다양한 실험 조건에서 각 세포 주기 상태를 특성화할 수 있습니다.
초록
세포주기 단계의 조절은 세포 증식 및 항상성의 중요한 측면입니다. 세포주기를 지배하는 조절 메커니즘의 붕괴는 암을 포함한 여러 질병의 특징입니다. 세포주기에 대한 연구는 세포주기 진행의 각 부분에서 세포 수를 정의하고 각 세포주기 단계 사이를 명확하게 묘사하는 능력을 필요로합니다. 질량 세포분석법(MCM)의 출현은 원소 동위원소의 직접 측정을 통해 고처리량 단일 세포 분석에 대한 엄청난 잠재력을 제공하며, MCM에 의한 세포 주기 상태를 측정하는 방법의 개발은 MCM의 유용성을 더욱 확장합니다. 여기에서는 MCM 시스템에서 5-브로모-2'-데옥시유리딘(BrdU)과 유사한 5-요오도-2'-데옥시우리딘(IdU)을 직접 측정하는 방법을 설명합니다. 이 IdU 기반 MCM을 사용하면 몇 가지 이점이 있습니다. 첫째, IdU는 합성 과정에서 DNA에 빠르게 통합되어 10-15분의 짧은 배양으로 S상 세포를 안정적으로 측정할 수 있습니다. 둘째, IdU는 2차 항체나 DNA 분해가 필요 없이 측정됩니다. 셋째, IdU 염색은 사이클린 B1, 인산화된 망막모세포종 단백질(pRb) 및 인산화된 히스톤 H3(pHH3)의 측정과 쉽게 결합될 수 있으며, 이는 5가지 세포 주기 단계를 집합적으로 명확하게 설명합니다. 이러한 세포 주기 마커와 MCM으로 가능한 많은 수의 매개변수의 조합은 수많은 다른 지표와 결합을 가능하게 합니다.
서문
질량 세포 분석은 질량 분광법의 고분해능 및 정량적 특성을 활용하여 약 40개의 파라미터를 검출할 수 있습니다. 더 많은 수의 채널을 허용하고 최소 스필오버(spillover)를 생성하는 형광단 접합 항체 대신 금속 표지 항체가 사용됩니다 1,2. MCM은 유세포 분석과 비교하여 세포 주기 분석과 관련하여 장점과 단점이 있습니다. MCM의 주요 이점 중 하나는 많은 수의 파라미터를 통해 매우 이질적인 샘플에서 많은 수의 면역 표현형으로 구별되는 T 세포 유형에 걸쳐 세포 주기 상태를 동시에 측정할 수 있다는 것입니다. MCM은 텔로머라아제 결핍증의 인간 골수3 및 형질전환 쥐 모델에서 정상적인 조혈 동안 세포 주기 상태를 측정하는 데 성공적으로 사용되었습니다4. 급성 골수성 백혈병(AML)의 세포 주기 상태를 분석한 결과, 세포 주기가 임상 요법에 대한 알려진 반응과 상관관계가 있는 것으로 나타났으며, 이는 치료법 선택에 정보를 제공할 수 있는 기능적 특성에 대한 생체 내 통찰력을 제공한다5. 질량 세포 분석 세포 주기 분석의 두 번째 이점은 세포 주기 상태와 상관관계가 있을 수 있는 많은 다른 기능적 마커를 측정할 수 있다는 것입니다. 최근 연구에서는 IdU 및 BRU 및 rRNA에 대한 금속 태그 항체를 사용하여 단백질 및 RNA 합성을 세포 주기 상태와 연관시킬 수 있었습니다6. 분화 연속체에서 수많은 집단에 걸쳐 세포 주기 상태를 측정하는 이러한 종류의 고도의 매개변수 분석은 현재의 유세포 분석 기술로는 거의 불가능합니다. MCM의 주요 단점은 형광 유세포 분석에 사용되는 것과 유사한 DNA 또는 RNA 염색(예: DAPI, Hoechst, Pyronin Y 등)이 없다는 것입니다. 형광 염료는 DNA 및 RNA 함량을 비교적 정밀하게 측정할 수 있지만, 이러한 정밀도는 뉴클레오티드 염기 사이의 삽입시 발생하는 이러한 염료의 형광 특성의 변화로 인해 가능합니다. 따라서 MCM 분석은 유사한 정밀도로 DNA 또는 RNA 함량을 측정할 수 없습니다. 대신, 질량 세포 분석 세포 주기 분석은 사이클린 B1, 인산화된 망막모세포종 단백질(pRb) 및 인산화된 히스톤 H3(pHH3)와 같은 세포 주기 상태와 관련된 단백질의 측정과 IdU 결합에서 S상 세포로의 요오드 원자의 직접 측정에 의존합니다. 이 두 가지 측정 접근법은 정상적인 세포 증식 동안 매우 유사한 결과를 산출하지만 세포주기 진행이 중단 될 때 잠재적으로 불일치 할 수 있습니다.
각 세포주기 단계에서 세포 수의 측정은 암 및 면역 질환에서 일반적으로 관찰되는 세포주기 파괴뿐만 아니라 정상적인 세포주기 발달을 이해하는 데 중요합니다. MCM은 금속 표지 항체를 사용하여 세포외 및 세포내 인자의 신뢰할 수 있는 측정을 제공합니다. 그러나 이리듐계 DNA 인터칼레이터는 2N과 4N DNA를 구별할 수 없었기 때문에 S상 측정이 제한적이었다. 세포주기 단계를 정의하기 위해 Behbehani는 질량 세포 분석기의 범위에 속하고 S 상3에서 세포를 직접 측정 할 수있는 질량 127의 IdU를 활용하는 방법을 개발했습니다. 이러한 직접 측정은 2차 항체의 필요성이나 산 또는 DNase와 같은 DNA 변성제의 사용을 우회합니다. 세포 내 사이클링 마커와 함께 실험 모델에서 세포주기 분포의 고분해능을 허용합니다.
이 프로토콜은 MCM에 대한 일반적인 유세포 분석 프로토콜의 세포 주기 측정을 조정합니다. 우리의 방법은 세포주기 매개 변수를 포함하는 편리하고 간단한 방법을 제공합니다. 시험관 내 샘플의 IdU 통합은 37°C에서 10-15분의 배양만 필요로 하며, 이는 수 시간의 배양 시간을 권장하는 대부분의 BrdU 염색 프로토콜보다 짧습니다 3,7. IdU 및 BrdU 혼입 샘플은 -80°C 냉동고에 일정 시간 동안 보관한 후 단백질체 안정화제를 사용하여 고정할 수 있습니다. 이를 통해 샘플 품질의 저하 없이 배치 분석을 위해 많은 수의 IdU 염색 샘플을 보관할 수 있습니다.
프로토콜
1. IdU 주식 준비
- 5-요오도-2'-데옥시유리딘(IdU)을 DMSO에 50mM의 농도로 용해시킨다. 멸균 필터, 10-50 μL 튜브에 분취량, -80 °C에서 보관
- 냉동실에서 IdU를 꺼내 실온에서 해동합니다. RPMI-1640에서 IdU를 희석하여 1mM의 최종 농도에서 작업 용액을 만듭니다. 피펫을 위아래로 또는 소용돌이 치며 혼합합니다.
- 일반적으로 농축된 IdU를 세포가 배양되는 배지(예: DMEM, IMDM 등)로 희석하거나 말초 혈액 또는 골수 흡인 샘플에 직접 추가하기 위해 PBS로 희석했습니다. 이 사전 희석 단계는 DMSO와 관심 세포의 수성 매질의 혼합을 용이하게 합니다.
참고: 배양 중 IdU의 최종 농도는 10μM이어야 합니다. 1mM의 용액을 배지 1mL마다 10μL의 비율로 첨가할 수 있습니다.
- 일반적으로 농축된 IdU를 세포가 배양되는 배지(예: DMEM, IMDM 등)로 희석하거나 말초 혈액 또는 골수 흡인 샘플에 직접 추가하기 위해 PBS로 희석했습니다. 이 사전 희석 단계는 DMSO와 관심 세포의 수성 매질의 혼합을 용이하게 합니다.
2. IdU 배양 및 시료 보존
- 가습된 37°C 인큐베이터에서 샘플을 보관합니다. 인큐베이터에서 샘플을 제거하고 샘플을 생물 안전 후드로 옮깁니다.
- 시료 1mL마다 1mM IdU 10μL를 추가합니다.
- 6-웰 플레이트의 경우, 각 웰의 3 mL 배양 배지에 1 mM IdU 30 μL를 첨가한다. IdU는 또한 골수 흡인과 쥐 연구에도 직접 사용할 수 있다4.
- 샘플을 37°C의 인큐베이터에 10-15분 동안 다시 넣습니다. S상을 가장 정확하게 측정하기 위해 IdU 노출 동안 관심 있는 최적의 성장 조건에서 세포를 유지합니다.
- IdU 배양 후 샘플을 제거하고 원추형 튜브로 옮깁니다.
- 샘플을 실온에서 10분 동안 400 x g 로 회전시킵니다.
- 상층액을 흡인하고 200μL의 PBS에 재현탁합니다.
- 필요한 경우 이 단계에서 라이브/데드 염색(시스플라틴 사용)을 수행하여 고정 및 동결 전에 죽은 세포를 표시합니다.
참고: 로듐 라이브/데드 염색은 메탄올 투과화 후 잘 수행되지 않으므로 세포 주기 분석에 사용하지 않는 것이 좋습니다.
- 필요한 경우 이 단계에서 라이브/데드 염색(시스플라틴 사용)을 수행하여 고정 및 동결 전에 죽은 세포를 표시합니다.
- 18.75 μL의 16 % 파라 포름 알데히드 (PFA)를 PBS에 첨가하여 1.5 % PFA의 최종 농도를 확보하십시오. 실온에서 10분 동안 배양합니다. 시료를 실온에서 400 x g 로 10분 동안 회전시킵니다.
- PBS/PFA 용액을 흡인하고 동결 전에 500μL의 Cell Staining Media(CSM, 0.5% BSA 및 0.02% 아지드화나트륨이 포함된 1x PBS) + 10% DMSO에 샘플을 다시 현탁합니다.
- 상업용 프로테오믹 안정제를 사용하는 경우 280 μL의 프로테오믹 안정제를 200 μL의 PBS(1:1.4)에 재현탁한 샘플에 추가합니다. 샘플을 실온에서 10분 동안 배양한 다음 -80°C에 직접 넣습니다.
참고: IdU는 37°C에서 10-15분 배양 내에서 효과적으로 통합되는 것으로 나타났습니다. 10-15분보다 긴 IdU 배양은 IdU 표지 세포가 S 단계를 떠나 G2 또는 M 단계로 진행함에 따라 S 및 G2 단계 집단의 분해능을 점진적으로 감소시킵니다. 우리는 또한 IdU를 사용한 장기 배양이 세포 사멸 및 세포 주기 아티팩트를 유발할 수 있음을 관찰했습니다. IdU 혼입에 따른 후속 세포 처리 및 항체 염색은 S상 세포에 혼입되지 않은 잔류 IdU를 씻어내기에 충분합니다. 우리는 여기에 설명된 시험관 내 프로토콜을 사용할 때 중요한 요오드 배경을 관찰하지 못했습니다. 그러나 우리는 임상 샘플에서 요오드 오염을 거의 관찰하지 못했습니다. 이것은 CT 스캔에서 요오드 조영제와 같은 의료 절차 또는 요오드 함유 의약품에서 발생할 수 있습니다. 많은 양의 IdU 배경이 관찰되는 경우 질량 세포분석기의 검출기가 손상되지 않도록 샘플을 실행해서는 안 됩니다.
- 상업용 프로테오믹 안정제를 사용하는 경우 280 μL의 프로테오믹 안정제를 200 μL의 PBS(1:1.4)에 재현탁한 샘플에 추가합니다. 샘플을 실온에서 10분 동안 배양한 다음 -80°C에 직접 넣습니다.
3. 질량 세포 분석을 위한 염색 샘플
- 샘플을 -80°C에서 제거하고, 표면 염색 전에 해동시킨다.
- SmartTube 고정 방법을 사용하는 경우 샘플을 0-4°C에서 해동하여 샘플이 예열될 때 추가 고정을 방지합니다.
- 샘플을 해동한 후 약 1-2백만 개의 세포를 5mL FACS 튜브에 옮깁니다.
- FACS 튜브를 600 x g 에서 5분 동안 원심분리하고, FACS 튜브를 세포 염색 배지(CSM)로 채워 세포를 세척합니다. 한 번 더 반복하십시오.
- 세포가 서로 달라붙는 것으로 알려진 경우 세포 간 접촉을 방지하기 위해 CSM 세척에 400U/mL의 헤파린을 추가하지만 반드시 필요한 것은 아닙니다.
- 실온에서 10분 동안 세포 100μL당 5μL의 FC-차단제와 함께 세포를 배양합니다.
- 세포의 표면 또는 세포 외 부분을 염색 할 항체 혼합물을 준비하십시오. 총 염색 혼합물은 각 시험에서 1-2백만 세포당 100 μL에 달할 것이다. 염색 혼합물은 칵테일 및 FACS 튜브에서 CSM 및 헤파린과 그에 따라 균형을 이룹니다.
참고: 이 단계에서 CSM을 추가하면 비특이적 염색 아티팩트도 감소합니다8. 이 염색 혼합물은 관심 대상 및 표면 표현형에 전적으로 의존합니다(예: T 세포와 관련된 연구에서는 CD45, CD3, CD4, CD8 등의 표면 혼합물을 사용합니다). 샘플 처리 및 염색에 대한 자세한 프로토콜은 Behbehani 및 McCarthy et al.9,10에서 찾을 수 있습니다. - 표면 염색 혼합물을 세포에 첨가하고 실온에서 30-60분 동안 연속 진탕하면서 배양합니다.
- 염색 후 FACS 튜브를 CSM으로 채우고 600 x g 에서 5분 동안 회전시킵니다.
- CSM으로 두 번 더 세척하고 샘플을 600 x g 에서 5분 동안 회전시키고 각 CSM 세척을 흡인합니다.
- 10% CSM 및 1.5% PFA가 포함된 PBS 1mL를 추가하여 세포외 항체를 고정합니다.
- PBS/CSM/PFA 혼합물이 들어 있는 FACS 튜브를 CSM으로 채웁니다. 600 x g 에서 5분 동안 회전하고 상층액을 흡인합니다.
- -20°C에서 메탄올을 첨가한다.
- 샘플을 1-2분 동안 소용돌이쳐 단일 세포 현탁액을 얻고 모든 세포 덩어리가 다시 현탁되었는지 확인합니다.
- 샘플이 천천히 소용돌이치는 동안 필터 팁이 있는 1,000μL 피펫을 사용하여 얼음처럼 차가운 메탄올 1mL를 빠르게 추가합니다.
- FAC 튜브를 빛에 비추고 눈에 보이는 덩어리가 없는지 확인하십시오. 흐림이 예상됩니다. 덩어리가 있으면 후속 MCM 분석에 샘플을 사용할 수 없게 됩니다.
- 샘플을 -20°C에서 10-20분 동안 보관합니다.
- 이 시간 동안 세포내 염색 혼합물을 준비한다. 세포내 염색 혼합물은 관심 대상에 따라 달라진다. 세포 주기 분석을 위해 이 염색 혼합물에 CyclinB1, pRb, Ki67 및 pHH3를 포함하되 필요에 따라 다른 세포 내 마커를 추가할 수 있습니다.
- -20°C에서 10-20분 후, 샘플을 제거하고, 1.5 mL의 PBS를 첨가하고, 나머지를 CSM으로 채운다.
- 시료를 600 x g 로 5분 동안 원심분리하고, 상층액을 흡인한다.
- CSM으로 두 번 더 세척하고 샘플을 600 x g 에서 5분 동안 회전시키고 매번 상층액을 흡인합니다.
- 마지막 CSM 세척 후 샘플을 원심분리하고 약 50μL의 잔류 부피를 남깁니다.
- 준비된 항체 혼합물(일반적으로 100μL의 최종 염색 부피를 얻기 위해 50μL의 항체 염색 칵테일을 추가)을 샘플에 추가하고 실온에서 30-60분 동안 진탕 플랫폼에서 배양합니다.
- 염색 후 CSM을 넣고 600 x g 에서 5분 동안 원심분리를 합니다.
- CSM을 흡인하고 CSM으로 다시 세척하고 600 x g 에서 5분 동안 회전하고 CSM을 흡인한 다음 PBS를 추가합니다.
- 세포 내 염색이 완료된 후 세포를 intercalator 용액에 넣어 항체를 세포에 고정하고 각 세포의 DNA를 염색하여 식별이 가능합니다. 인터칼레이터 용액은 500μM의 농도로 제조업체의 원액으로부터 첨가된 비동위원소 순수 이리듐 인터칼레이터(펜타메틸시클로펜타디에닐-Ir(III)-디피리도페나진)를 함유한다. 균일하게 염색하고 과염색을 방지하기 위해 백만 세포당 100-200 μL의 이리듐 삽입기 용액을 추가합니다.
참고: 이 삽입기 용액의 이리듐은 일중항 게이팅을 위한 세포를 식별하기 위한 것이며 살아있는/죽은 얼룩에는 사용해서는 안 됩니다. 살아있는/죽은 얼룩이 필요한 경우 위에서 언급한 바와 같이 McCarthy et al.9에서 언급한 대로 고정 전에 수행해야 합니다. - CyTOF에서 샘플을 수집하기 전에 최대 2주 동안 4°C 냉장고의 인터칼레이터 용액에 샘플을 보관합니다.
4. 질량 세포계 작동
참고: 질량 세포 분석 작업은 기계에 따라 다를 수 있습니다. 작동하기 전에 항상 CyTOF 사용 설명서를 확인하는 것이 좋습니다. 또한 현재 기계 시동 및 유지 보수 9,11을 다루는 두 개의 JoVE 기사가 있습니다.
- 질량 세포분석기를 작동하기 전에 분무기에 막힘, 균열 및 기타 불규칙성이 있는지 확인하십시오.
- 분무기를 세포계에 연결하고 워밍업 절차를 시작하십시오. 분무기가 제자리에 있지 않은 상태에서 질량 세포분석기를 시작하지 마십시오.
- 질량 세포분석기가 예열을 마치면 샘플 라인을 통해 물을 흘려보냅니다. 스프레이 챔버는 튜닝 또는 샘플 분석을 수행하기 전에 약 200°C에 도달해야 합니다.
- 5-10분 동안 물을 흘려보냅니다. 5-10분 후에 튜닝 솔루션을 로드하고 튜닝 관리자를 선택합니다. 튜닝 용액은 고정된 농도의 금속을 포함하는 용액이며 샘플 수집 전에 질량 세포분석기를 최적화하는 데 사용됩니다
- 튜닝 관리자에서 튜닝 솔루션이 안정적인 상태 히트 레코드에 도달하면 미리 보기를 선택하여 자동화된 튜닝 프로세스를 시작합니다.
- 튜닝이 완료되면 샘플러에 물을 로드하고 샘플 처리 중에 샘플 라인을 통해 물이 흐르도록 합니다. 일일 세포분석기 작동 및 조정에 대한 자세한 프로토콜은 Leipold11에서 확인할 수 있습니다.
- 경우에 따라 자동 튜닝이 최적의 기계 성능으로 조정되지 않습니다. 튜닝 절차를 반복하여 이 문제를 해결하십시오.
- 샘플 획득 전에 CSM으로 샘플을 한 번 세척하고 순수한 탈이온수로 두 번 세척합니다. PBS/CSM에서 잔류 염분을 제거하려면 물로 세척하는 것이 중요합니다.
- 감도 및 샘플 흐름을 사용하여 제조업체에서 제공한 평형 비드, 알려진 금속 농도가 로드된 폴리스티렌 비드를 사용합니다.
- 획득 모드를 튜닝에서 이벤트 캡처 모드로 변경합니다. 120초에서 수집을 중지하도록 시간 제한을 설정합니다. 녹화를 선택하기 전에 45초 동안 기다리십시오.
- 질량 세포분석기는 120초 후에 샘플 수집을 자동으로 중지합니다. 레인 플롯 뷰어를 사용하여 Eu151 및 Eu153 강도를 확인합니다.
- 순수한 탈이온수에 평형 비드를 1:20 비율로 희석합니다.
- 샘플 획득 전에 실험 관리자를 확인하십시오. 실험 관리자를 사용하여 채널에 이름을 지정하고 기록할 채널을 추가합니다.
- IdU를 사용하는 경우 127-I 채널이 추가되었는지 확인합니다.
- 시료 수집 전에 필요한 파라미터(예: IdU)를 측정하기 위해 질량세포분석기를 설정하는 것이 중요합니다. 채널을 미리 선택하지 않으면 선택하지 않은 채널에서 데이터가 수집되지 않으며 복구할 수 없습니다.
- 1:20 순수 탈이온수와 평형 비드 혼합물을 사용하여 약 1-2 x 106/mL의 농도로 세포를 희석합니다. 잔류 덩어리를 제거하기 위해 필터를 씌운 FACS 튜브를 통해 세포를 통과시킵니다.
- 샘플을 로드하고 획득 시간을 변경합니다.
- 미리보기를 누르고 초당 이벤트 수가 안정화될 때까지 기다립니다.
- 초당 400개 이상의 이벤트를 실행하지 마십시오., 이로 인해 상당한 양의 이중선과 파편이 발생합니다. 우리는 일반적으로 최소 20,000개에서 50,000개의 세포 이벤트를 수집하지만 최적의 수는 실험 설계에 따라 다릅니다. 최대 200만 개의 세포를 염색하면 일반적으로 300,000 내지 400,000개의 세포 이벤트가 생성됩니다. 모든 이벤트가 셀이 되는 것은 아닙니다(이벤트 수에 포함된 파편 및 비드 이벤트가 있음).
- 샘플 수집이 완료되면 세척 용액을 로드하고 샘플 유도를 시작하고 5-10분 동안 실행합니다. 5-10분 후 샘플 유도를 중지하고 10-20분 동안 물을 흘려보냅니다. 세척 용액은 샘플 라인에서 잔류 금속을 제거하도록 설계된 약한 불산 용액입니다.
- 질량 세포분석기를 종료하고 분무기를 제거합니다. 분무기는 뜨거울 수 있으므로 취급 시 주의하십시오.
5. 데이터 분석
- 비드를 제거하고 샘플 획득 중 신호 드리프트를 수정하려면 Fluidigm 소프트웨어 또는 Finck12에서 개발한 애플리케이션을 사용하여 FCS 파일을 정규화합니다.
- FCS를 Cytobank 또는 기타 유세포 분석 소프트웨어에 업로드합니다. FCS 파일은 모든 호환 소프트웨어에서 사용할 수 있으며, 이 프로토콜의 목적을 위해 모든 게이팅 및 추가 분석은 Cytobank13에서 수행되었습니다.
- 세포 주기 게이트를 그리기 전에 다운스트림 분석에서 이중선 또는 세포 파편을 제외하고, 이는 이벤트 길이 대 191-IR의 이축 플롯을 사용하여 수행할 수 있습니다(그림 1a). 세포는 이중선과 파편을 배제하는 데 사용할수 있는 뚜 렷하고 밝은 개체군을 형성합니다. 이것은 일중항 게이트입니다. 이 게이팅 방법은 일반적으로 이중항 셀 이벤트의 약 50-60%를 제거하므로 나머지 이중항 셀 이벤트를 제거하기 위해 추가 전략이 필요할 수 있습니다.
- 이벤트 길이 척도(최소 및 최대)를 변경하여 셀이 더 두드러지게 나타나도록 하여 일중항 게이팅을 지원합니다.
- Gaussian 파라미터인 Residual 및 Offset을 사용하여 이중선과 파편을 추가로 제거합니다. 오프셋이 낮고 잔차가 높을수록 파편과 이중선이 있으며, 이 모집단 주변의 게이팅은 이중선과 이중선을 추가로 제거할 수 있습니다(그림 1b,c).
- S상 게이팅 – S상은 그리기 가장 쉬운 게이트이지만 가장 중요한 게이트이기도 합니다. IdU 대 pRb, Ki67 또는 cyclinB1의 이축 플롯을 사용하여 이 게이트를 그립니다. S상 IdU+ 세포는 이러한 이축 플롯을 볼 때 뚜렷한 집단을 형성합니다(그림 2b).
- G0/G1상, G2/M상 게이팅 – IdU 대 CyclinB1 플롯에서 G0/G1 및 G2/M 위상 게이트를 설정하고 IdU 통합의 사용은 G0/G1 및 G2/M 위상 게이트 사이의 경계를 설정하는 데 중요합니다. G0/G1 단계는 CyclinB1낮음/IdU-이고 G2/M 단계는 CyclinB1높음/IdU-입니다. 양호한 CyclinB1 염색은 G0-G1과 G2-M 집단 사이의 자연 집단을 보여줄 것이다; 그러나 이것은 실험 조건에서 샘플 및 세포 유형에 따라 다릅니다. 세포 주기 분포가 영향을 받을 수 있고 CyclinB1 G0/G1 상과 G2/M 상 사이의 분리가 적은 실험 조건에서 S상을 활용하면 각 특정 실험에서 특정 세포 유형에 대해 일관된 게이팅이 가능합니다. 이 방법은 아래에 자세히 설명되어 있습니다.
- G0/G1 상과 G2/M 상 사이의 분리를 설정하는 데 도움이 되도록 CyclinB1 대 IdU의 S상 셀만 플로팅합니다. CyclinB1높은 모집단에 게이트를 그리고 S상 모집단의 약 상위 5%가 게이트 내부에 있을 때까지 조정합니다(그림 2c). 이렇게 하면 G0/G1 위상 게이트와 G2/M 위상 게이트 사이에 중단점이 설정됩니다(그림 2e,f). 활성 인구는 관심 인구로 변경되고 이전 게이트 내부에 거주하는 부분은 G2/M단계 인구가 되고 나머지는 G0/G1단계 인구가 됩니다.
- G0 위상 게이팅 – pRb 대 IdU 플롯에서 G0 위상을 설정합니다. G0 단계는 pRblow/IdU- 모집단으로 표시됩니다. 활성 사이클링 모집단은 pRb 및 IdU 통합의 높은 발현을 가질 것이며, G0 위상 게이트는 일반적으로 두 개의 별개의 모집단에서 표현되기 때문에 이 경계에 그릴 수 있습니다(그림 2g,i).
- 이전에 그려진 S-단계 모집단(그림 2b)을 활성 모집단으로 만들고 pRb높은 모집단의 상위 90-100%를 통합하는 게이트를 그려 G0 단계를 정의합니다. 이것은 pRb+ 순환 개체군(그림 2i)이고, 이 게이트 외부의pRb 낮은 개체군은 G0 개체군입니다(그림 2j).
- pRb를 사용할 수 없거나 기록할 수 없는 경우 Ki67 및 IdU를 사용하여 G0 단계 모집단을 설정합니다. S상 모집단의 대부분을 나타내는 게이트를 그리고 해당 게이트를 Ki67 대 IdU의 경계로 사용하면 나머지 모집단은 G0 위상이 됩니다(그림 3a).
- M-상 게이팅 – IdU 대 pH3 이축 플롯에서 M-상을 설정합니다. M상은 세포의 매우 작은 부분을 나타내며 pH3높은 집단에서 게이트됩니다(그림 2d).
- IdU 통합이 실패했거나 불가능함 – IdU를 사용할 수 없는 경우 Ki67 및 pRb를 사용하여 순환 분획이 아닌 세포 순환을 정의합니다. Ki67과 pRb는 정상 조건에서 Ki67 높음/pRb높음과 Ki67 낮음/pRb 낮음의 두 가지 별개의 모집단을 형성합니다. 이중 양성 모집단은 G1상, S상, G2상 및 M상과 상관관계가 있는 활성 순환 모집단을 나타냅니다. 이중 낮은 모집단은 G0 단계와 상관 관계가 있는 순환하지 않는 모집단을 나타냅니다(그림 3b).
참고: Ki67 대 pRb를 사용하여 각 개별 단계를 설명하는 것은 불가능하지만 상대적인 순환/비순환 모집단에 대한 실험적 효과를 결정할 수 있습니다. - 세포 주기 분석 – 게이트가 설정되면 추가 분석을 위해 게이트에서 숫자 값을 내보냅니다. 각 주기의 백분율은 결합된 모집단에서 단일 모집단을 빼서 달성할 수 있습니다. pRb 낮은 IdU 낮은 게이트 백분율에 그려진 G0 위상은 CyclinB1낮은IdU네거티브에 그려진 G0/G1 위상에서 빼서 G1 위상백분율을 찾을 수 있습니다. 유사하게, G2 위상 백분율은 G2 / M 위상 게이트에서 M 위상 게이트를 뺀 값에서 파생됩니다. 이렇게 하면 각 개별 세포 주기 단계에 대한 숫자 값이 생성됩니다. G0, G1, S, G2 및 M. 각 개별 세포주기 단계에 대해 생성 된 수치는 그래프 및 통계 분석과 같은 추가 분석에 사용될 수 있습니다.
결과
HL-60 세포와 인간 골수 흡인을 활용하여 실험 조건이 세포 주기 분포 및 분석에 어떤 영향을 미칠 수 있는지 보여줄 수 있습니다. 첫째, 세포주기 단계가 어떻게 도출되는지를 보여주기 위해 게이팅 전략을 수립해야합니다. 그림 1에서 우리는 세포 파편과 이중선을 분리하여 단일 세포 집단을 확립하는 데 중요한 일중항 게이트의 확립을 보여줍니다. 세포주의 경우 일중항 게이트만 있으면 세포 주기 분석으로 이동할 수 있습니다(그림 2a). 인간 샘플의 경우, 각 세포 주기 게이트의 정확한 경계가 세포 유형에 따라 다를 수 있기 때문에 일반적으로 세포 주기 분석 전에 면역 표현형 집단을 설정해야 합니다. 개체군이 설정되면(일반적으로 해당 개체군을 정의하는 표면 마커를 게이팅하여) 세포 주기 게이트를 설정해야 합니다. 그림 2b는 IdU 대 CyclinB1 이축 플롯에서 S-상의 설정을 보여줍니다. 이 플롯은 G2/M 위상 게이트의 경계를 설정하는 데에도 사용됩니다(그림 2f). G2/M 위상이 설정되면 나머지는 G0/G1 위상 게이트입니다(그림 2f). IdU 대 pRb는 IdU에 세포를 통합하는 게이트를 설정하여 먼저 pRb+ 순환 모집단을 설정하는 데 사용됩니다(그림 2g,i). 이 게이트 외부의 pRb+/IdU네거 모집단은 G0 위상입니다(그림 2j). M상 세포가 높은 수준의 pHH3를 발현하고 IdU 혼입을 나타내지 않는 IdU 대 pHH3에서 M상이 확립됩니다(그림 2k). pRb가 포함되지 않은 경우 위에서 설명한 방법과 유사한 방식으로 Ki67을 사용하여 G0 단계를 복제할 수 있습니다(그림 3a). IdU 통합이 실패했거나 수행되지 않은 경우에도 Ki67 및 pRb를 사용하여 상대적 순환 분율을 결정할 수 있습니다. Ki67 및 pRb 이축을 사용하여 pRb+/Ki67+ 이중 양성 및 pRb낮음/Ki67낮은 모집단이라는 두 개의 별개의 모집단이 형성됩니다. 이중 양성 집단은 주기에 있는 세포를 나타내고 낮은 집단은 주기에 없는 세포를 나타냅니다(그림 3b). IdU 통합 세포 및 IdU 통합이 없는 pRb낮은 세포를 사용하여 S상은 주로 pRb+/Ki67+ 모집단에 있는 반면 G0상은 주로 pRblow/Ki67저모집단에 있음을 보여줍니다.
세포 주기 분석은 특히 IdU 배양 단계에서 우수한 실험 기술에 의존합니다. IdU 통합은 유연하지만(세포 배양, 골수 흡인 및 쥐 연구에도 적용 가능) 실험 관심 있는 세포 주기 상태를 방해하지 않고 IdU 통합 및 고정을 수행해야 합니다. IdU 라벨링 및 이에 따른 다운스트림 세포 주기 분석은 그림 4에서 볼 수 있듯이 시간과 온도에 의해 크게 영향을 받을 수 있습니다. 밀폐된 용기에 너무 오래 남아 있거나 샘플 배송 또는 위치 간 샘플 운송 시 발생할 수 있는 세포는 S상 분율이 감소하고 세포 주기 분석에 적합하지 않습니다(그림 4a). 그러나 총 1시간 미만의 짧은 기간은 정상적인 세포 주기 분포를 가지므로 빠른 수송이 세포 주기 분석에 부정적인 영향을 미치지 않을 수 있음을 나타냅니다(그림 4b). 또 다른 중요한 수정자는 대부분의 실험실에서 일상적으로 사용되는 냉동 보존입니다. 냉동보존된 세포에서 세포 주기 상태를 검사할 때 세포가 활성 세포 주기로 돌아가기까지 긴 평형 기간이 필요할 수 있으며, 이는 여전히 사전 세포주기 상태를 반영하지 않을 수 있습니다(그림 4c).
1차 인간 샘플은 종종 여러 상이한 세포 유형의 복합체이며, 이러한 상이한 세포 유형은 상이한 세포 주기 게이팅으로 이어지는 처리에 대해 상이한 민감도를 가질 수 있다. IdU 표지를 즉시 수행하거나, IdU 표지 전에 30분 동안 보관하거나, Ficoll 분리 후 극저온으로 보관한 두 개의 골수 흡인물에서 각 샘플과 모집단 간에 차이가 있습니다(그림 5a,b). 2개의 면역표현형 집단을 IdU 통합의 차이에 대해 조사했습니다. T 세포(CD45 높음/CD3 높음) 및 단아세포(CD33+, HLADR+, CD11b낮음, CD14부정). 표면 표시의 올바른 조합으로 추가 면역 표현형 집단을 검사할 수 있습니다. 골수 #2에서는 30분 보관 후 동일한 환자의 단일모세포에서는 볼 수 없었던 눈에 띄는 T 세포 활성화 효과가 있었습니다(그림 5b). 배양된 세포와 마찬가지로 극저온 보관 후 IdU 라벨링에도 눈에 띄는 변화가 있었으며 이는 또한 개체군에 의존했습니다. 골수 #1은 기준선과 비교할 때 T 세포 집단이 감소했지만 단모세포 IdU 표지 분획이 증가했으며(그림 5 a,b), 골수 #2는 기준선과 비교할 때 T 세포와 단일모세포 모두에서 감소를 보였습니다(그림 5a,b). 그런 다음 냉동 세포는 정상 세포주기 상태로 돌아가기 전에 주목할만한 잠복기가 필요하며 이는 약물 또는 실험 효과의 척도로 세포주기 상태 또는 세포주기 상태를 수정하는 데 의존하는 연구에 영향을 미칠 수 있습니다.
MCM의 또 다른 이점은 세포 주기 정지 또는 비정상적인 세포 주기 분포를 가진 세포를 구별할 수 있다는 것입니다. 유세포 분석에 일반적으로 사용되는 DNA 염료는 2N과 4N DNA 함량을 구별할 수 있지만 매우 밝기 때문에 해당 레이저의 다른 파라미터를 측정하는 것이 매우 복잡할 수 있습니다. 그러나 IdU는 하나의 질량 채널만 사용하고 유출이 최소화되어 세포 주기 결정에 다른 마커를 사용할 수 있습니다. 조사된 MOLM13 세포는 대조군 세포와 비교할 때 IdU 혼입 감소 및 M상 감소를 보였다(그림 6). 정상적인 세포 주기 체크포인트의 중단은 MCM에 의해 명백한 세포 주기 상태를 변경할 수 있습니다. 조사되지 않은 세포에서 pH2AX 및 cPARP 집단을 살펴보면, pH2AX 낮은 집단 및 cPARP낮은 집단은 정상적인 세포 주기 분포를 나타내는 반면, 더 높은 수준의 pH2AX 또는 cPARP를 발현하는 세포는 주로 G0/G1-단계에서 국소화되며, 이는 예상된다 (도 6a). 그러나, 조사된 세포에서 pH2AX 낮음 및 cPARP낮음은 세포가 거의 전적으로 G0-상에 국한된 반면, pH2AX높음 및cPARP 낮은 세포는 IdU 혼입 및 M-상의 부재와 함께 G0/G1-상 및 G2-상으로의 국소화를 갖는 세포 주기 정지 표현형을 나타낸다. pH2AXhigh 및 cPARPhigh 세포는 또한 일부 IdU를 통합하고 방사선 손상을 나타내는 G0/G1 상으로 국한되는 세포를 보여줍니다(그림 6b).
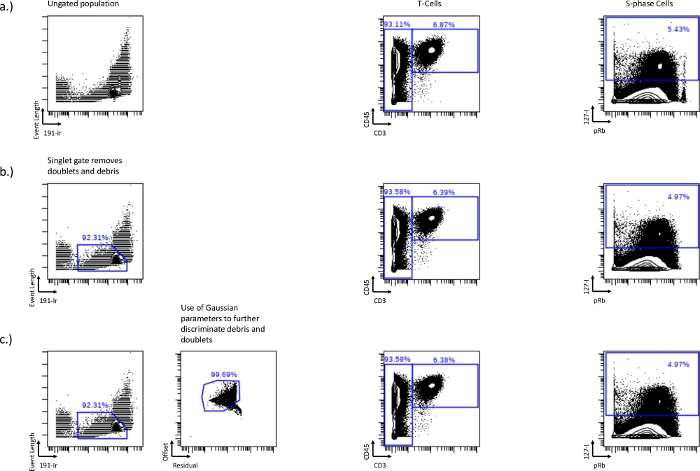
그림 1: 이벤트 길이와 가우스 매개변수, 잔차 및 오프셋에 의한 191-Ir을 사용하여 일중항 게이트 설정.
비정형 샘플(a), 이벤트 길이 대 191-Ir 일중항 게이트(b) 또는 가우스 매개변수, 잔차 및 오프셋(c)과 결합된 일중항 게이트 간의 T 세포(CD45+/CD3+) 및 S상(IdU+)의 차이. 단일항 게이팅은 이축의 오른쪽 모서리에 있는 pRb높은 모집단의 손실에 표시된 파편, 이중선 및 비드를 제거합니다. 이 일중항 게이트는 잔류 및 오프셋과 같은 가우스 파라미터를 포함하여 더 많은 파편을 제거함으로써 더욱 최적화할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
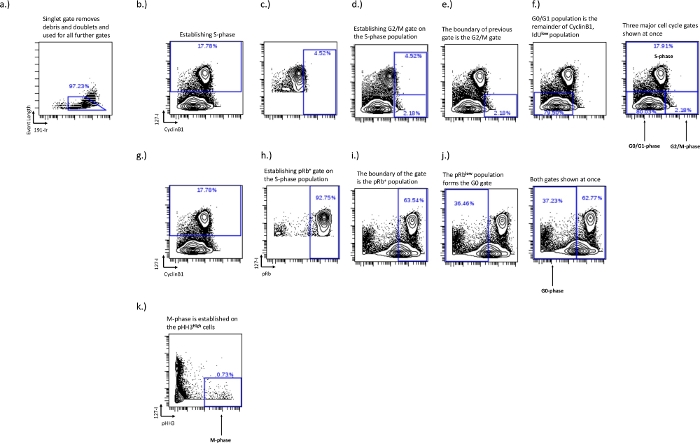
그림 2: IdU, CyclinB1, pRb, pHH3를 사용하여 G0, G1, S, G2 및 M 단계에 대한 세포 주기 게이트를 설정하기 위한 게이팅 스키마.
싱글렛 게이트는 이중선과 파편(a)을 제거하기 위해 설치됩니다. S상이 설정되어야 하며(b), S상이 설정되면 IdU+ 모집단을 사용하여 G2/M상 경계(c,d)를 설정할 수 있습니다. G2/M-단계 경계의 설정은 G0/G1-단계 모집단(f)의 경계를 설정합니다. pRb+ 및 G0 위상 모집단은 IdU 대 pRb 이축에서 설정됩니다. IdU+ 세포(h)는 pRb+ 모집단(i)의 경계를 설정하는 데 사용됩니다. pRb+ 모집단의 경계는 G0상 모집단(j)의 경계를 설정합니다. M-상은 IdU-(k)인 pHH3+ 세포에 확립됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
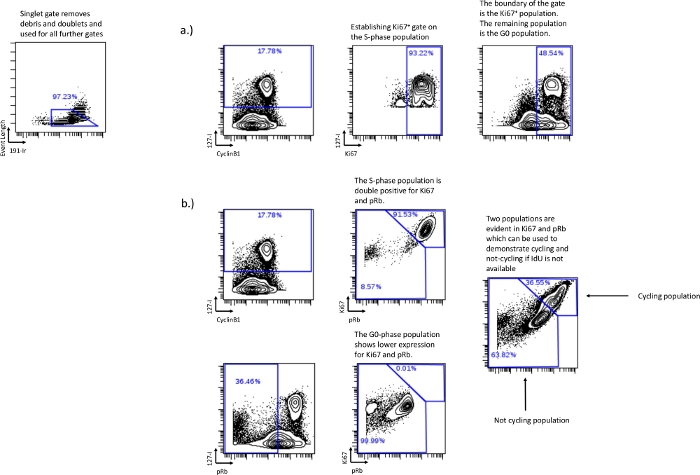
그림 3: pRb를 사용하거나 IdU 통합을 사용하지 않고 세포 주기 게이트를 설정합니다.
pRb가 실험(a)에 포함되지 않은 경우 pRb와 함께 사용된 것과 동일한 게이팅 전략에 따라 Ki-67을 사용하여 G0 위상을 그릴 수도 있습니다. IdU 결합이 실패하거나 수행되지 않은 경우 Ki67 및 pRb를 사용하여 상대적 세포 순환 분획을 여전히 회수할 수 있습니다. Ki67 및 pRb 이중 양성 발현은 IdU+ 세포가 이중 양성 집단에서 주로 발견됨을 입증함으로써 입증되는 바와 같이 주기의 세포와 상관관계가 있습니다(b). Ki67 및 pRb 낮은 집단은 Ki67 및 pRb 낮은 집단에서 발견되는 pRb낮음/IdU부정 세포에 의해 입증된 G0 단계 또는 순환하지 않는 집단과 상관관계가 있습니다. 이 방법은 개별 세포주기 단계를 구별 할 수 없지만 실험 조건에서 상대적 순환 분율을 결정하는 데 여전히 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: HL-60 세포의 세포 주기 분포에 대한 다양한 보관 조건의 영향에 대한 대표적인 그림.
세포를 밀봉된 튜브(a)에서 명시된 온도 조건에서 1시간 휴지시킨 후 1시간 동안 인큐베이션하였다. 대조군과 비교할 때 세포 주기 분포에 눈에 띄는 효과가 있습니다. HL60 세포는 IdU 혼입 전에 임상 환경에서 발생할 수 있는 상황인 30분 동안 실온에서 밀봉된 튜브에 보관되었습니다(b). 실온에서 30분 동안 보관된 밀봉된 튜브는 눈에 띄는 세포 주기 차이를 나타내지 않았습니다. 극저온 저장의 효과는 HL60 세포의 세포 주기에 대해 조사되었으며, 여기서 극저온 저장 전에 샘플을 채취하고 극저온 보관에서 일주일 후 한 시간 휴식 후 샘플을 채취했습니다(c). 해동 후 1시간이 지나면 세포 주기 분포가 영향을 받고 세포 주기 분포는 해동 후 약 일주일까지 정상으로 돌아오지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 처리는 환자 샘플에 영향을 미칠 수 있으며 (a) T 세포(CD45 높음/CD3 높음) 및 (b) 단모세포(CD33+, HLADR+, CD11b낮음, CD14neg)를 보여주는 두 명의 서로 다른 환자 사이에 대표 이미지가 표시됩니다.
골수 1과 골수 2 사이에서, 골수 2에서는 30 분 휴식 동안 T 세포 활성화 효과가 있었지만 골수 1에서는 그러한 효과가 없었음이 분명합니다. 골수 1은 30분 후에 단일모세포 개체군에서 가능한 활성화 효과를 보였지만 골수 2는 그렇지 않았습니다. 그러나 두 골수에서 극저온 저장이 세포 유형에 관계없이 세포 주기 분포에 영향을 미친다는 것이 분명했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: MOLM13 세포는 대조군으로 남겨두거나 10Gy에서 X선 조사기를 사용하여 조사되었습니다.
MOLM13 세포는 pH2AX 및 cPARP 발현의 4개의 상이한 집단에서 세포 주기 분포를 나타낸다. 대조군 세포는 최소 pH2AX 및 cPARP 염색을 나타내며, 정상 세포 주기 특성은 pH2AX 낮은 집단 및 cPARP낮은 집단에서 나타난다 (a). 조사된 세포는 대부분의 순환 세포가 pH2AX 높음 및 cPARP높음에 위치하여 비정상적인 세포 주기 분포를 나타내는 반면, 이는 세포 주기 중단을 나타냅니다(b). 손상되지 않은, pH2AX낮음 및 cPARP가낮은, 사이클링 특성의 결여를 보이는 세포는 주로 G0 단계에서 발견된다. 이러한 마커가 없으면 이러한 세포는 정상적인 유세포 분석에서 4N 및 2N 세포로 나타나 다운스트림 세포 주기 분석을 혼란스럽게 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 제시된 예는 MCM 플랫폼을 사용하여 세포 주기 분포를 분석하는 방법을 보여줍니다. 또한 세포 주기 분석은 시간 및 온도와 같은 실험 조건에 민감하다는 것이 입증되었으며, 이는 연구자들이 세포 주기 분석을 위해 MCM을 고려할 때 반드시 고려해야 할 중요한 사항이다14. 한 시간 이하의 짧은 기간 동안 보관된 샘플은 정상 상태와 유사한 IdU 통합을 갖습니다. 장기간(약 2시간) 동안 폐쇄된 시스템의 샘플은 IdU 혼입을 감소시키지만 상대적 순환 및 비순환 분획은 변하지 않아 거친 세포 주기 분석을 허용합니다. 극저온 저장 및 후속 해동은 상당한 기간 동안 정상적인 세포 주기 분포를 방해합니다. 극저온 저장은 이전에 단백질과 RNA 분포를 방해하는 것으로 나타났지만 최근에야 세포 주기14,15,16,17을 방해하는 것으로 나타났습니다. 종합하면, 긴 보관 시간이 예상되거나 샘플의 극저온 보존이 예상되는 경우 보관 또는 극저온 보관 전에 IdU로 세포를 염색하고 세포를 고정하고 분석이 완료될 때까지 보관하는 것이 더 낫다는 것을 나타냅니다. MCM에 의한 세포 주기 분석에는 살아있는 세포가 필요하지 않기 때문에 연구자들은 귀중한 샘플을 보관하고 정확한 다운스트림 세포 주기 분석을 수행할 수 있습니다.
MCM에 의한 세포 주기 분석은 실험 모델을 심층적으로 조사할 수 있는 강력한 시스템입니다. MCM의 높은 파라미터 수, 약 40-50개의 질량 채널로 인해 세포 주기 분석은 상당한 세포 주기 효과를 잃을 수 있는 면역 표현형에 기반한 세포 분류의 필요성을 우회하여 다른 세포내 또는 세포외 마커와 합성될 수 있습니다. MCM의 높은 파라미터 특성은 SPADE 및 viSNE와 같은 고차원 매핑 응용 분야에서 효과를 검사하는 데 적합합니다. SPADE 및 viSNE는 일반적으로 면역 표현형 집단을 정의하는 데 사용되며, 이를 통해 세포 주기 변화를 검사할 수 있지만 세포 주기 마커에 매핑하는 것도 가능합니다. 실험 조건에 따라, 고차원 공간에서 세포 주기 마커를 맵핑하면 세포 주기 상관관계, 약물 효과 또는 어떤 면역 표현형 집단이 각 주기 상태에 국한될 수 있는지를 보여줄 수 있다 3,5. MCM은 DNA 결합 형광 염료의 부족으로 인해 제한될 수 있지만, 이는 S상 세포 동안 직접적인 IdU 통합에 의해 보상되며 세포내 세포 주기 단백질을 사용하여 세포 주기 상태를 결정할 수 있습니다. 이러한 세포 주기 단백질은 또한 DNA 결합 염료를 사용하여 전통적인 흐름에서 3N 또는 4N으로 나타날 수 있는 세포 주기 정지 단계를 구별하는 데 도움이 될 수 있습니다. 그러나 이러한 고도의 파라메트릭 시스템에는 단점이 없는 것은 아니며 세포 주기의 중단에 민감합니다. 우리는 긴 보관 시간과 극저온 보관이 세포 주기 분포에 상당한 영향을 미칠 수 있음을 보여주었습니다. 이는 세포주기 분포에 영향을 줄 수있는 약물에 대한 실험 효과를 합리화하려고 할 때 특히 중요합니다. 냉동 1차 샘플에서 세포 주기에 영향을 미치도록 설계된 약물을 처리하면 극저온 저장고에서 해동한 직후에 사용할 때 세포 주기 효과에 대한 잘못된 데이터를 제공할 수 있습니다. MCM은 여러 실험 모델에 적용할 수 있는 세포 주기 분석을 위한 다목적 기술이며 특히 이기종 시스템의 심층 프로파일링에 적합합니다. 다른 고도의 모수적 방법과 마찬가지로 처리 및 실험 효과가 세포 주기 분석에 어떤 영향을 미치는지에 대한 적절한 고려 사항과 함께 신중하게 설계된 실험이 필요합니다.
공개
Behbehani 박사는 Fluidigm으로부터 여행 지원을 받습니다. Fluidigm은 실험실용 시약과 재료도 구입했습니다.
감사의 말
저자는 실험적 지원에 대해 Palak Sekhri, Hussam Alkhalaileh, Hsiaochi Chang 및 Justin Lyeberger의 노력에 감사드립니다. 이 작업은 Pelotonia Fellowship Program의 지원을 받았습니다. 이 자료에 표현된 모든 의견, 결과 및 결론은 저자의 것이며 반드시 Pelotonia Fellowship Program의 의견을 반영하는 것은 아닙니다."
자료
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma | A3059 | Component of CSM |
| Centrifuge | Thermo Scientific | 75-217-420 | Sample centrifugation |
| Cleaved-PARP (D214) | BD Biosciences | F21-852 | Identification of apoptotic cells |
| Cyclin B1 | BD Biosciences | GNS-1 | G2 Resolution |
| Dimethylsulfoxide (DMSO) | Sigma | D2650 | Cryopreservative |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | Internal metal standard for CyTOF performance |
| FACS Tube w/ mesh strainer | Corning | 08-771-23 | Cell strainer to remove clumps/debris before CyTOF run |
| Fetal Bovine Serum (FBS) | VWR | 97068-085 | Cell culture growth supplement |
| Helios | Fluidigm | CyTOF System/Platform | |
| Heparin | Sigma | H3393 | Staining additive to prevent non-specific staining |
| IdU (5-Iodo-2′-deoxyuridine) | Sigma | I7125 | Incorporates in S-phase |
| Ki-67 | eBiosciences | SolA15 | Confirmation of G0/G1 |
| MaxPar Multi Label Kit | Fluidigm | 201300 | Metal labeling kit, attaches metals to antibodies |
| Microplate Shaker | Thermo Scientific | 88880023 | Mixing samples during staining |
| Paraformaldehyde (PFA) | Electron Microscopy Services | 15710 | Fixative |
| pentamethylcyclopentadienyl-Ir(III)-dipyridophenazine | Fluidigm | 201192 | Cell identification during CyTOF acquisition |
| p-H2AX (S139) | Millipore | JBW301 | Detection of DNA damage |
| p-HH3 (S28) | Biolegend | HTA28 | M-phase Resolution |
| Phosphate Buffered Saline (PBS) | Gibco | 14190-144 | Wash solution for cell culture and component of fixative solution |
| p-Rb (S807/811) | BD Biosciences | J112906 | G0/G1 Resolution |
| Proteomic Stabilizer | SmartTube Inc | PROT1 | Sample fixative |
| RPMI 1640 | Gibco | 21870-076 | Cell culture growth medium |
| Sodium Azide | Acros Organics | AC447810250 | Component of CSM/Antibody buffer, biocide |
참고문헌
- Ornatsky, O., Baranov, V. I., Bandura, D. R., Tanner, S. D., Dick, J. Multiple cellular antigen detection by ICP-MS. Journal of Immunological Methods. 308 (1-2), 68-76 (2006).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Analytical Chemistry. 80 (7), 2539-2547 (2008).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry A. 81 (7), 552-566 (2012).
- Raval, A., et al. Reversibility of Defective Hematopoiesis Caused by Telomere Shortening in Telomerase Knockout Mice. PLoS One. 10 (7), 0131722 (2015).
- Behbehani, G. K., et al. Mass Cytometric Functional Profiling of Acute Myeloid Leukemia Defines Cell-Cycle and Immunophenotypic Properties That Correlate with Known Responses to Therapy. Cancer Discovery. 5 (9), 988-1003 (2015).
- Kimmey, S. C., Borges, L., Baskar, R., Bendall, S. C. Parallel analysis of tri-molecular biosynthesis with cell identity and function in single cells. Nature Communications. 10 (1), 1185 (2019).
- Rabinovitch, P. S., Kubbies, M., Chen, Y. C., Schindler, D., Hoehn, H. BrdU-Hoechst flow cytometry: a unique tool for quantitative cell cycle analysis. Experimental Cell Research. 174 (2), 309-318 (1988).
- Rahman, A. H., Tordesillas, L., Berin, M. C. Heparin reduces nonspecific eosinophil staining artifacts in mass cytometry experiments. Cytometry A. 89 (6), 601-607 (2016).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample Preparation for Mass Cytometry Analysis. Journal of Visualized Experiments. (122), e54394 (2017).
- Behbehani, G. K. Immunophenotyping by Mass Cytometry. Methods in Molecular Biology. 2032, 31-51 (2019).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. Journal of Visualized Experiments. (69), e4398 (2012).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry A. 83 (5), 483-494 (2013).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Current Protocols in Cytometry. , 17 (2010).
- Devine, R. D., Sekhri, P., Behbehani, G. K. Effect of storage time and temperature on cell cycle analysis by mass cytometry. Cytometry A. 93 (11), 1141-1149 (2018).
- Campos, L., et al. Expression of immunological markers on leukemic cells before and after cryopreservation and thawing. Cryobiology. 25 (1), 18-22 (1988).
- Kadic, E., Moniz, R. J., Huo, Y., Chi, A., Kariv, I. Effect of cryopreservation on delineation of immune cell subpopulations in tumor specimens as determinated by multiparametric single cell mass cytometry analysis. BMC Immunology. 18 (1), 6 (2017).
- Shabihkhani, M., et al. The procurement, storage, and quality assurance of frozen blood and tissue biospecimens in pathology, biorepository, and biobank settings. Clinical Biochemistry. 47 (4-5), 258-266 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유