Method Article
Uso dell'analogo della pirimidina, 5-iodo-2′-deossiuridina (IdU) con marcatori del ciclo cellulare per stabilire fasi del ciclo cellulare in una piattaforma di citometria di massa
In questo articolo
Riepilogo
Questo protocollo adatta le misurazioni del ciclo cellulare per l'uso in una piattaforma di citometria di massa. Con le capacità multiparametriche della citometria di massa, la misurazione diretta dell'incorporazione di iodio consente l'identificazione delle cellule in fase S, mentre i marcatori del ciclo intracellulare consentono la caratterizzazione di ogni stato del ciclo cellulare in una serie di condizioni sperimentali.
Abstract
La regolazione della fase del ciclo cellulare è un aspetto importante della proliferazione cellulare e dell'omeostasi. L'interruzione dei meccanismi regolatori che governano il ciclo cellulare è una caratteristica di una serie di malattie, incluso il cancro. Lo studio del ciclo cellulare richiede la capacità di definire il numero di cellule in ogni porzione della progressione del ciclo cellulare e di delineare chiaramente tra ciascuna fase del ciclo cellulare. L'avvento della citometria di massa (MCM) offre un enorme potenziale per l'analisi di singole cellule ad alto rendimento attraverso misurazioni dirette di isotopi elementari e lo sviluppo di un metodo per misurare lo stato del ciclo cellulare mediante MCM estende ulteriormente l'utilità dell'MCM. Qui descriviamo un metodo che misura direttamente la 5-iodo-2′-deossiuridina (IdU), simile alla 5-bromo-2'-deossiuridina (BrdU), in un sistema MCM. L'uso di questo MCM basato su IdU offre diversi vantaggi. In primo luogo, l'IdU viene rapidamente incorporata nel DNA durante la sua sintesi, consentendo una misurazione affidabile delle cellule nella fase S con incubazioni di soli 10-15 minuti. In secondo luogo, l'IDU viene misurata senza la necessità di anticorpi secondari o la necessità di degradazione del DNA. In terzo luogo, la colorazione IdU può essere facilmente combinata con la misurazione della ciclina B1, della proteina del retinoblastoma fosforilato (pRb) e dell'istone fosforilato H3 (pHH3), che fornisce collettivamente una chiara delineazione delle cinque fasi del ciclo cellulare. La combinazione di questi marcatori del ciclo cellulare con l'elevato numero di parametri possibili con MCM consente la combinazione con numerose altre metriche.
Introduzione
La citometria di massa consente di rilevare circa 40 parametri sfruttando l'alta risoluzione e la natura quantitativa della spettroscopia di massa. Gli anticorpi marcati con metallo vengono utilizzati al posto degli anticorpi coniugati con fluorofori che consentono un numero maggiore di canali e producono uno spillover minimo 1,2. MCM presenta vantaggi e svantaggi per quanto riguarda l'analisi del ciclo cellulare rispetto alla citometria a flusso. Uno dei principali vantaggi dell'MCM è che l'elevato numero di parametri consente la misurazione simultanea dello stato del ciclo cellulare in un gran numero di tipi di cellule T immunofenotipicamente distinti in campioni altamente eterogenei. MCM è stato utilizzato con successo per misurare lo stato del ciclo cellulare durante la normale emopoiesi nel midollo osseo umano3 e modelli murini transgenici di deficit di telomerasi4. L'analisi dello stato del ciclo cellulare nella leucemia mieloide acuta (LMA) ha mostrato che il ciclo cellulare è correlato alle risposte note alle terapie cliniche, fornendo una visione in vivo delle caratteristiche funzionali che possono informare le selezioni terapeutiche5. Un secondo vantaggio dell'analisi del ciclo cellulare citometrico di massa è la capacità di misurare un gran numero di altri marcatori funzionali che possono essere correlati con lo stato del ciclo cellulare. Recenti lavori sono stati in grado di correlare la sintesi di proteine e RNA con lo stato del ciclo cellulare attraverso l'uso di IdU e anticorpi marcati con metallo a BRU e rRNA6. Questo tipo di analisi altamente parametrica che misura lo stato del ciclo cellulare in numerose popolazioni in un continuum di differenziazione sarebbe quasi impossibile con l'attuale tecnologia di citometria a flusso. Il principale svantaggio dell'MCM è la mancanza di coloranti di DNA o RNA comparabili a quelli utilizzati nella citometria a flusso fluorescente (ad esempio, DAPI, Hoechst, Pyronin Y, ecc.). I coloranti fluorescenti possono fornire misurazioni relativamente precise del contenuto di DNA e RNA, ma questa precisione è possibile solo a causa dei cambiamenti nelle proprietà fluorescenti di questi coloranti che si verificano dopo l'intercalazione tra basi nucleotidiche. L'analisi MCM non è quindi in grado di misurare il contenuto di DNA o RNA con precisione simile. Invece, l'analisi del ciclo cellulare citometrico di massa si basa su misurazioni di proteine correlate allo stato del ciclo cellulare come la ciclina B1, la proteina del retinoblastoma fosforilato (pRb) e l'istone H3 fosforilato (pHH3) combinato con la misurazione diretta dell'atomo di iodio dall'incorporazione di IdU nelle cellule di fase S. Questi due approcci di misurazione producono risultati molto simili durante la normale proliferazione cellulare, ma possono potenzialmente essere discordanti quando la progressione del ciclo cellulare viene interrotta.
La misurazione del numero di cellule in ciascuna fase del ciclo cellulare è importante per comprendere il normale sviluppo del ciclo cellulare e l'interruzione del ciclo cellulare, che è comunemente osservato nei tumori e nelle malattie immunologiche. MCM fornisce una misurazione affidabile dei fattori extracellulari e intracellulari utilizzando anticorpi marcati con metallo; tuttavia, la misurazione della fase S era limitata in quanto l'intercalatore del DNA basato sull'iridio non era in grado di distinguere tra DNA 2N e 4N. Al fine di definire le fasi del ciclo cellulare, Behbehani ha sviluppato un metodo che utilizza IdU con una massa di 127, che rientra nell'intervallo del citometro di massa e consente la misurazione diretta delle cellule nella fase S3. Questa misurazione diretta elude la necessità di anticorpi secondari o l'uso di agenti denaturanti del DNA come acido o DNasi. In combinazione con marcatori di ciclo intracellulare, consente un'alta risoluzione della distribuzione del ciclo cellulare in modelli sperimentali.
Questo protocollo adatta le misurazioni del ciclo cellulare dai comuni protocolli di citometria a flusso per MCM. I nostri metodi forniscono un modo comodo e semplice per includere i parametri del ciclo cellulare. L'incorporazione di IdU di campioni in vitro richiede solo da 10 a 15 minuti di incubazione a 37 °C, che è più breve della maggior parte dei protocolli di colorazione BrdU che raccomandano tempi di incubazione di diverse ore 3,7. I campioni incorporati in IdU e BrdU possono essere fissati utilizzando uno stabilizzatore proteomico e quindi conservati per qualche tempo in un congelatore a -80 °C. Ciò consente di archiviare un gran numero di campioni colorati con IdU per l'analisi dei lotti senza ridurre la qualità del campione.
Protocollo
1. Preparazione delle scorte di IDU
- Sciogliere la 5-iodo-2'-deossiuridina (IdU) nel DMSO ad una concentrazione di 50 mM. Filtro sterile, aliquota in provette da 10-50 μL e conservare a -80 °C
- Rimuovere IdU dal congelatore e scongelare a temperatura ambiente. Diluire IdU in RPMI-1640 per ottenere una soluzione di lavoro ad una concentrazione finale di 1 mM. Pipetta su e giù o vortice da mescolare.
- Tipicamente, diluire l'IdU concentrata nel mezzo in cui le cellule vengono coltivate (ad esempio DMEM, IMDM, ecc.) o diluirla in PBS per l'aggiunta direttamente al sangue periferico o ai campioni di aspirato del midollo osseo. Questa fase di pre-diluizione facilita la miscelazione del DMSO con i mezzi acquosi delle cellule di interesse.
NOTA: la concentrazione finale di IdU durante l'incubazione deve essere di 10 μM; una soluzione di 1 mM può essere aggiunta con un rapporto di 10 μL per ogni 1 mL di mezzo.
- Tipicamente, diluire l'IdU concentrata nel mezzo in cui le cellule vengono coltivate (ad esempio DMEM, IMDM, ecc.) o diluirla in PBS per l'aggiunta direttamente al sangue periferico o ai campioni di aspirato del midollo osseo. Questa fase di pre-diluizione facilita la miscelazione del DMSO con i mezzi acquosi delle cellule di interesse.
2. Incubazione IDU e conservazione dei campioni
- Conservare i campioni in un incubatore umidificato a 37 °C. Rimuovere il campione dall'incubatore e spostarlo in una cappa di biosicurezza.
- Aggiungere 10 μL di 1 mM IdU a ogni 1 mL di campione.
- Per una piastra a 6 pozzetti, aggiungere 30 μL di 1 mM IdU ai 3 mL di terreno di coltura in ciascun pozzetto. IdU può anche essere utilizzato direttamente negli aspirati del midollo osseo e negli studi murini4.
- Introdurre nuovamente il campione nell'incubatore a 37 °C per 10-15 minuti. Mantenere le cellule nelle condizioni ottimali di crescita di interesse durante l'esposizione a IdU al fine di ottenere la misurazione più accurata della fase S.
- Dopo l'incubazione IdU, rimuovere il campione e trasferirlo in un tubo conico.
- Centrifugare il campione a 400 x g per 10 minuti a temperatura ambiente.
- Aspirare il surnatante e risospendere in 200 μL di PBS.
- Se necessario, eseguire una macchia viva / morta (usando cisplatino) in questa fase per contrassegnare le cellule morte prima della fissazione e del congelamento.
NOTA: La colorazione del rodio vivo / morto non funziona bene dopo la permeabilizzazione del metanolo, quindi non è raccomandato per l'uso nelle analisi del ciclo cellulare.
- Se necessario, eseguire una macchia viva / morta (usando cisplatino) in questa fase per contrassegnare le cellule morte prima della fissazione e del congelamento.
- Aggiungere 18,75 μL di paraformaldeide (PFA) al 16% al PBS per una concentrazione finale dell'1,5% di PFA. Incubare a temperatura ambiente per 10 min. Centrifugare il campione a 400 x g per 10 minuti a temperatura ambiente.
- Aspirare la soluzione di PBS/PFA e risospendere il campione in 500 μL di terreno di colorazione cellulare (CSM; 1x PBS con 0,5% BSA e 0,02% di azoturo di sodio) + 10% di DMSO prima del congelamento.
- Se si utilizza uno stabilizzatore proteomico commerciale, aggiungere 280 μL di stabilizzatore proteomico al campione risospeso in 200 μL di PBS (1:1.4). Incubare i campioni a temperatura ambiente per 10 minuti e quindi introdurre direttamente a -80 °C.
NOTA: È stato dimostrato che l'IDU si incorpora efficacemente entro 10-15 minuti di incubazione a 37 °C. Le incubazioni di IdU più lunghe di 10-15 minuti ridurranno progressivamente la risoluzione delle popolazioni in fase S e G2, poiché le cellule marcate con IdU lasciano la fase S e progrediscono verso la fase G2 o M. Abbiamo anche osservato che l'incubazione a lungo termine con IdU può causare morte cellulare e artefatti del ciclo cellulare. La successiva elaborazione cellulare e la colorazione degli anticorpi dopo l'incorporazione di IdU sono sufficienti per lavare via l'IdU residua che non è stata incorporata nelle cellule in fase S. Non abbiamo osservato un significativo background di iodio quando si utilizza il protocollo in vitro qui descritto; Tuttavia, abbiamo osservato molto raramente contaminazione da iodio nei campioni clinici. Ciò può verificarsi da procedure mediche, come il contrasto di iodio in una scansione TC, o da farmaci contenenti iodio. Se si osservano grandi quantità di fondo per via parenterale di Idrauli, il campione non deve essere eseguito per evitare danni al rilevatore del citometro di massa.
- Se si utilizza uno stabilizzatore proteomico commerciale, aggiungere 280 μL di stabilizzatore proteomico al campione risospeso in 200 μL di PBS (1:1.4). Incubare i campioni a temperatura ambiente per 10 minuti e quindi introdurre direttamente a -80 °C.
3. Campioni di colorazione per citometria di massa
- Rimuovere i campioni da -80 °C e lasciarli scongelare prima della colorazione superficiale.
- Se si utilizza il metodo di fissaggio SmartTube, scongelare i campioni a 0-4 °C per evitare ulteriori fissaggi mentre i campioni si riscaldano.
- Dopo che i campioni sono stati scongelati, trasferire circa 1-2 milioni di cellule in una provetta FACS da 5 ml.
- Centrifugare il tubo FACS a 600 x g per 5 minuti e riempire il tubo FACS con un mezzo di colorazione cellulare (CSM) per lavare le cellule. Ripeti un'altra volta.
- Se è noto che le cellule si attaccano insieme, aggiungere 400 U / mL di eparina ai lavaggi CSM per evitare il contatto cellula-cellula, ma questo non è strettamente necessario.
- Incubare le cellule con agente bloccante FC, 5 μL dell'agente per 100 μL di cellule, per 10 minuti a temperatura ambiente.
- Preparare una miscela di anticorpi che macchierà la superficie, o la porzione extracellulare, delle cellule. La miscela colorante totale ammonterà a 100 μL per 1-2 milioni di cellule in ciascun test. La miscela colorante sarà bilanciata di conseguenza con CSM ed eparina nel tubo del cocktail e FACS.
NOTA: l'aggiunta di CSM in questa fase ridurrà anche gli artefatti di colorazione non specifici8. Questa miscela colorante dipende interamente dai bersagli di interesse e dal fenotipo superficiale (ad esempio, uno studio che coinvolge le cellule T utilizzerà una miscela superficiale di CD45, CD3, CD4, CD8, ecc.). Un protocollo dettagliato di elaborazione e colorazione dei campioni può essere trovato in Behbehani e McCarthy et al.9,10. - Aggiungere la miscela colorante superficiale alle celle e incubare a temperatura ambiente con agitazione continua per 30-60 minuti.
- Dopo la colorazione, riempire il tubo FACS con CSM e centrifugare a 600 x g per 5 minuti.
- Lavare altre due volte con CSM, ruotando il campione a 600 x g per 5 minuti e aspirando ogni lavaggio CSM.
- Fissare gli anticorpi extracellulari aggiungendo 1 mL di PBS con 10% CSM e 1,5% PFA.
- Riempire il tubo FACS contenente la miscela PBS/CSM/PFA con CSM. Girare a 600 x g per 5 minuti e aspirare il surnatante.
- Aggiungere metanolo a -20 °C.
- Vortice il campione per 1-2 minuti per ottenere una sospensione a singola cellula e verificare che tutti i grumi cellulari siano stati nuovamente sospesi.
- Mentre il campione sta ruotando lentamente, aggiungere rapidamente 1 mL di metanolo ghiacciato utilizzando una pipetta da 1.000 μL con una punta del filtro.
- Tenere il tubo FAC verso la luce e assicurarsi che non ci siano grumi visibili; La nuvolosità è prevedibile. Eventuali grumi renderanno il campione inutilizzabile per la successiva analisi MCM.
- Conservare il campione a -20 °C per 10-20 minuti.
- Preparare la miscela di colorazione intracellulare durante questo periodo. La miscela di colorazione intracellulare dipenderà dagli obiettivi di interesse. Per l'analisi del ciclo cellulare, includere CyclinB1, pRb, Ki67 e pHH3 in questa miscela colorante, ma altri marcatori intracellulari possono essere aggiunti secondo necessità.
- Dopo 10-20 minuti a -20 °C, rimuovere il campione, aggiungere 1,5 mL di PBS e riempire il resto con CSM.
- Centrifugare il campione 600 x g per 5 minuti e aspirare il surnatante.
- Lavare altre due volte con CSM, ruotando il campione a 600 x g per 5 minuti e aspirando il surnatante ogni volta.
- Dopo l'ultimo lavaggio CSM, centrifugare il campione e lasciare un volume residuo di circa 50 μL.
- Aggiungere la miscela di anticorpi preparata (in genere aggiungere 50 μL di cocktail colorante anticorpale per ottenere un volume di colorazione finale di 100 μL) al campione e incubare su una piattaforma di agitazione per 30-60 minuti a temperatura ambiente.
- Dopo la colorazione aggiungere CSM e centrifugare a 600 x g per 5 min.
- Aspirare il CSM, lavare nuovamente con CSM, ruotando a 600 x g per 5 minuti, aspirando il CSM, quindi aggiungere PBS.
- Dopo il completamento della colorazione intracellulare, posizionare le cellule in una soluzione intercalator che fissa gli anticorpi alle cellule e colora il DNA di ciascuna cellula per consentire l'identificazione. La soluzione di intercalatore contiene intercalatore di iridio non isotopicamente puro (pentametilciclopentadienil-Ir(III)-dipiridosofenzina) aggiunto dalla soluzione madre del produttore ad una concentrazione di 500 μM. Diluire il brodo di Iridio 1:4000 in una soluzione di PBS e PFA all'1,5%. Aggiungere la soluzione di intercalatore di iridio a 100-200 μL per milione di cellule per colorare uniformemente e prevenire la sovracolorazione.
NOTA: L'iridio in questa soluzione intercalator ha lo scopo di identificare le cellule per il gating singoletto, non deve essere usato per macchie vive / morte. Se si desiderano macchie vive/morte, devono essere eseguite prima della fissazione come notato sopra e in McCarthy et al.9. - Conservare i campioni in soluzione di intercalatore in frigorifero a 4 °C per un massimo di due settimane prima dell'acquisizione del campione sul CyTOF.
4. Funzionamento del citometro di massa
NOTA: L'operazione di citometria di massa può essere specifica della macchina. Si consiglia sempre di controllare il manuale utente CyTOF prima dell'operazione. Inoltre, ci sono attualmente due articoli JoVE che trattano l'avviamento e la manutenzione della macchina 9,11.
- Controllare il nebulizzatore per eventuali intasamenti, crepe e altre irregolarità prima di utilizzare il citometro di massa.
- Collegare il nebulizzatore al citometro e iniziare la procedura di riscaldamento. Non avviare il citometro di massa senza il nebulizzatore in posizione.
- Far scorrere l'acqua attraverso le linee di campionamento una volta che il citometro di massa ha terminato il riscaldamento. La camera di spruzzatura deve raggiungere circa 200 °C prima di eseguire la regolazione o l'analisi del campione.
- Acqua corrente per 5-10 min. Dopo 5-10 minuti, caricare la soluzione di ottimizzazione e selezionare il gestore di ottimizzazione. La soluzione di sintonizzazione è una soluzione contenente concentrazioni fisse di metalli e utilizzata per ottimizzare il citometro di massa prima dell'acquisizione del campione
- In Gestione ottimizzazione, selezionare Anteprima una volta che la soluzione di ottimizzazione ha raggiunto un record di hit in stato stazionario per iniziare il processo di ottimizzazione automatica.
- Una volta terminata la messa a punto, caricare il campionatore con acqua e lasciare che l'acqua scorra attraverso le linee di campionamento durante l'elaborazione del campione. Il protocollo dettagliato per il funzionamento quotidiano del citometro e la messa a punto è disponibile su Leipold11.
- Occasionalmente, la messa a punto automatica non si sintonizza sulle prestazioni ottimali della macchina. Ripetere la procedura di ottimizzazione per correggere questo problema.
- Lavare il campione con CSM una volta e con acqua deionizzata pura due volte prima dell'acquisizione del campione. Il lavaggio con acqua è importante per rimuovere il sale residuo dal PBS / CSM.
- Controllare la sensibilità e il flusso del campione utilizzando sfere di equilibratura fornite dal produttore, perle di polistirene caricate con concentrazioni di metallo note.
- Modificare la modalità di acquisizione dalla modalità di ottimizzazione alla modalità di acquisizione degli eventi. Impostare il limite di tempo per interrompere l'acquisizione a 120 s. Attendere 45 secondi prima di selezionare Registra.
- Il citometro di massa interromperà automaticamente l'acquisizione del campione dopo 120 secondi. Utilizzare il visualizzatore di grafici a pioggia per controllare l'intensità di Eu151 e Eu153.
- Perle di equilibrio diluite in acqua deionizzata pura con un rapporto 1:20.
- Prima dell'acquisizione del campione, controllare il gestore dell'esperimento. Utilizza Gestione esperimenti per assegnare nomi ai canali e aggiungere canali da registrare.
- Assicurarsi che il canale 127-I sia aggiunto se si utilizza IdU.
- Si noti che è essenziale impostare il citometro di massa per misurare i parametri necessari (ad esempio, IdU) prima dell'acquisizione del campione. Se i canali non vengono selezionati in anticipo, i dati non verranno raccolti da alcun canale non selezionato e non possono essere recuperati.
- Diluire le cellule ad una concentrazione di circa 1-2 x 106/mL utilizzando l'acqua deionizzata pura 1:20 e la miscela di perline di equilibrio. Far passare le celle attraverso il tubo FACS sormontato dal filtro per rimuovere eventuali grumi residui.
- Caricare il campione e modificare il tempo di acquisizione.
- Premi Anteprima e attendi che il conteggio degli eventi al secondo si stabilizzi.
- Non eseguire eventi superiori a 400 eventi al secondo, questo porterà a quantità significative di doppietti e detriti. In genere raccogliamo almeno da 20.000 a 50.000 eventi cellulari, ma il numero ottimale dipenderà dal disegno sperimentale. La colorazione di un massimo di 2 milioni di cellule produrrà in genere da 300.000 a 400.000 eventi cellulari. Si noti che non tutti gli eventi saranno celle (nel conteggio degli eventi saranno inclusi detriti e eventi di perline).
- Una volta effettuata l'acquisizione del campione, caricare una soluzione di lavaggio, avviare l'induzione del campione ed eseguire per 5-10 minuti. Dopo 5-10 minuti interrompere l'induzione del campione e far scorrere l'acqua per 10-20 minuti. La soluzione di lavaggio è una soluzione debole di acido fluoridrico progettata per rimuovere il metallo residuo dalle linee del campione.
- Spegnere il citometro di massa e rimuovere il nebulizzatore. Il nebulizzatore sarà caldo, fare attenzione durante la manipolazione.
5. Analisi dei dati
- Al fine di rimuovere le perline e anche di correggere la deriva del segnale durante l'acquisizione del campione, normalizzare i file FCS utilizzando il software Fluidigm o l'applicazione sviluppata da Finck12.
- Caricare l'FCS su Cytobank o altro software di analisi della citometria a flusso. I file FCS possono essere utilizzati in qualsiasi software compatibile, ai fini di questo protocollo tutti i gating e ulteriori analisi sono stati eseguiti in Cytobank13.
- Prima di poter disegnare le porte del ciclo cellulare, escludere eventuali doppietti o detriti cellulari dall'analisi a valle, questo può essere fatto utilizzando il grafico biassiale di Lunghezza evento vs 191-Ir (Figura 1a). Le cellule formeranno una popolazione distinta eluminosa che può essere utilizzata per escludere doppietti e detriti. Questo è il cancello della canottiera. Questo metodo di gating rimuove in genere circa il 50-60% degli eventi di celle doppiette, quindi potrebbero essere necessarie strategie aggiuntive per rimuovere gli eventi rimanenti della cella doppietta.
- Modificare la scala di lunghezza dell'evento (minima e massima) per rendere le celle più prominenti per facilitare il gating singoletto.
- Rimuovete ulteriormente doppietti e detriti utilizzando i parametri gaussiani, residuo e offset. Un residuo più alto con offset inferiore è anche detriti e doppietti, e il gating intorno a questa popolazione può rimuovere ulteriormente doppietti e detriti (Figura 1b, c).
- Gating di fase S – La fase S è la porta più facile da disegnare, ma anche la più importante. Disegna questa porta usando un grafico biassiale di IdU vs pRb, Ki67 o cyclinB1. Le celle IdU+ in fase S formeranno una popolazione distinta quando si osservano questi grafici biassiali (Figura 2b).
- G0/G1-fase, G2/M-fase gating – Stabilire le porte di fase G0/G1 e G2/M sul grafico IdU vs CyclinB1 e l'uso dell'incorporazione IdU è fondamentale per stabilire il confine tra le porte di fase G0/G1 e G2/M. La fase G0/G1 sarà bassa di CyclinB1/IdU- e la fase G2/M sarà alta di CyclinB1/IdU-. Una buona colorazione della CiclinaB1 mostrerà una popolazione naturale tra le popolazioni G0-G1 e G2-M; Tuttavia, questo varierà tra i tipi di campioni e cellule in condizioni sperimentali. In condizioni sperimentali in cui la distribuzione del ciclo cellulare può essere influenzata e c'è meno separazione tra la fase G0/G1 di CyclinB1 e la fase G2/M, l'utilizzo della fase S consentirà un gating coerente per particolari tipi di cellule in ogni specifico esperimento. Questo metodo è dettagliato di seguito.
- Tracciare solo le celle di fase S su CyclinB1 vs IdU per aiutare a stabilire la separazione tra fase G0 / G1 e fase G2 / M. Disegnare un gatesull'alta popolazione di CyclinB1 e regolare fino a quando circa il 5% superiore della popolazione della fase S è all'interno del cancello (Figura 2c). Questo stabilisce il punto di interruzione tra le porte di fase G0/G1 e G2/M (Figura 2e,f). La popolazione attiva sarà cambiata nella popolazione di interesse e la porzione residente all'interno del cancello precedente sarà la popolazione della fase G2 / M mentre il resto sarà la popolazione della fase G0 / G1.
- Gating di fase G0 – Stabilisce la fase G0 sul grafico pRb vs IdU. La fase G0 sarà rappresentata da una popolazione pRbbassa/IdU-. La popolazione ciclica attiva avrà un'alta espressione di incorporazione di pRb e IdU, la porta di fase G0 può essere disegnata su questo confine in quanto si esprime tipicamente in due popolazioni distinte (Figura 2g,i).
- Definire la fase G0 rendendo la popolazione della fase S disegnata in precedenza (Figura 2b) la popolazione attiva e disegnando un gate che incorpora il 90-100% superiore della popolazionealta pRb. Questa è la popolazione ciclica pRb+ (Figura 2i), la popolazione bassa di pRb al di fuori di questo cancello èla popolazione G0 (Figura 2j).
- Se pRb non è disponibile o non può essere registrato, utilizzare Ki67 vs IdU per stabilire la popolazione in fase G0. Disegnando un gate che rappresenta la maggior parte della popolazione della fase S e usando quel gate come confine per Ki67 vs IdU il resto della popolazione sarà la fase G0 (Figura 3a).
- Gating di fase M – Stabilire la fase M nel grafico biassiale IdU vs pH3. La fase M rappresenta una frazione molto piccola di cellule ed è controllata sulla popolazioneelevata di pH3 (Figura 2d).
- L'incorporazione di IdU non è riuscita o non è stata possibile – Se l'IdU non è disponibile, definire il ciclo cellulare e non le frazioni cicliche usando Ki67 e pRb. Ki67 e pRb, in condizioni normali, formano due popolazioni distinte: Ki67 alto/pRbalto e Ki67 basso/pRbbasso. La doppia popolazione positiva rappresenta la popolazione ciclica attiva, correlata alla fase G1, alla fase S, alla fase G2 e alla fase M. La popolazione doppiamente bassa rappresenta la popolazione non ciclica, correlata alla fase G0 (Figura 3b).
NOTA: Non è possibile delineare ogni singola fase utilizzando Ki67 vs pRb ma è possibile determinare effetti sperimentali sulle relative popolazioni cicliche/non ciclistiche. - Analisi del ciclo cellulare – Una volta stabilite le porte, esportare i valori numerici dalle porte per ulteriori analisi. Le percentuali in ogni ciclo possono essere ottenute sottraendo le singole popolazioni dalle popolazioni combinate. La fase G0, disegnata sulla percentuale di gate bassoIdU basso di pRb, può essere sottratta dalla fase G0/G1, disegnata su CyclinB1bassoIdUneg, per trovare la percentuale di fase G1. Analogamente la percentuale di fase G2 è derivata dalla sottrazione della porta di fase M dalla porta di fase G2/M. Questo genererà valori numerici per ogni singola fase del ciclo cellulare; G0, G1, S, G2 e M. I valori numerici generati per ogni singola fase del ciclo cellulare possono essere utilizzati per ulteriori analisi come grafici e analisi statistiche.
Risultati
Utilizzando cellule HL-60 e un aspirato del midollo osseo umano è possibile mostrare come le condizioni sperimentali possono influenzare la distribuzione e l'analisi del ciclo cellulare. In primo luogo, la strategia di gating deve essere stabilita per dimostrare come vengono derivate le fasi del ciclo cellulare. Nella Figura 1 mostriamo l'istituzione della porta singoletto, che è importante per separare detriti cellulari e doppietti, stabilendo una singola popolazione cellulare. Per le linee cellulari il gate singoletto è tutto ciò che è necessario per passare all'analisi del ciclo cellulare (Figura 2a). Per i campioni umani le popolazioni immunofenotipiche in genere devono essere stabilite prima dell'analisi del ciclo cellulare, poiché i confini esatti di ciascun gate del ciclo cellulare possono variare tra i diversi tipi di cellule. Una volta che le popolazioni sono state stabilite (di solito gating su marcatori di superficie che definiscono quella popolazione) le porte del ciclo cellulare dovranno essere stabilite. La figura 2b mostra l'istituzione della fase S sul grafico biassiale IdU vs CyclinB1. Questo grafico viene utilizzato anche per stabilire il limite del gate di fase G2/M (Figura 2f). Una volta stabilita la fase G2/M, il resto è il gate di fase G0/G1 (Figura 2f). L'IdU vs pRb viene utilizzato per stabilire la popolazione ciclica pRb+ stabilendo prima un gate su IdU che incorpora celle (Figura 2g,i). La popolazione pRb+/IdUneg al di fuori di questo cancello è la fase G0 (Figura 2j). La fase M è stabilita sull'IdU rispetto a pHH3 dove le celle della fase M esprimono alti livelli di pHH3 e non mostrano alcuna incorporazione di IdU (Figura 2k). Nel caso in cui pRb non sia incluso, la fase G0 può essere replicata usando Ki67 in modo simile al metodo sopra descritto (Figura 3a). Se l'incorporazione di IdU fallisce o non è stata eseguita, è ancora possibile determinare le frazioni cicliche relative utilizzando Ki67 e pRb. Utilizzando il Ki67 e pRb biassiale si formano due distinte popolazioni, una popolazione pRb+/Ki67+ doppia positiva e una popolazione pRb bassa/Ki67bassa. La doppia popolazione positiva rappresenta le cellule in ciclo, mentre la bassa rappresenta le cellule non in ciclo (Figura 3b). Utilizzando IdU che incorpora celle e pRbbasse celle senza incorporazione di IdU, mostriamo che la fase S è principalmente nella popolazione pRb+/Ki67+ mentre la fase G0 è principalmente nella popolazione pRb bassa/Ki67 bassa.
L'analisi del ciclo cellulare si basa su una buona tecnica sperimentale soprattutto durante la fase di incubazione dell'IDU. Mentre l'incorporazione di IdU è flessibile (essendo applicabile in colture cellulari, aspirati del midollo osseo e persino studi murini), è necessario eseguire l'incorporazione e la fissazione di IdU senza interrompere lo stato del ciclo cellulare di interesse sperimentale. L'etichettatura IdU e quindi l'analisi del ciclo cellulare a valle possono essere influenzate in modo significativo dal tempo e dalla temperatura, come indicato nella Figura 4. Le cellule che rimangono troppo a lungo in recipienti chiusi o che potrebbero essere incontrate nella spedizione del campione o nel trasporto del campione tra le posizioni, avranno una frazione di fase S ridotta e non saranno accurate per l'analisi del ciclo cellulare (Figura 4a). I periodi di tempo brevi, tuttavia, quelli inferiori a un'ora in totale, avranno una distribuzione normale del ciclo cellulare, indicando che il trasporto rapido potrebbe non influire negativamente sull'analisi del ciclo cellulare (Figura 4b). Un altro importante modificatore è la crioconservazione che viene abitualmente utilizzata nella maggior parte dei laboratori. Quando si esamina lo stato del ciclo cellulare nelle cellule crioconservate, può essere necessario un lungo periodo di equilibrio prima che le cellule ritornino al ciclo cellulare attivo, che potrebbe ancora non riflettere lo stato del ciclo cellulare di pre-ciroconservazione (Figura 4c).
I campioni umani primari sono spesso composti di più tipi di cellule diverse, questi diversi tipi di cellule possono avere diverse sensibilità all'elaborazione che porta a diversi cicli cellulari gating. In due aspirati di midollo osseo che sono stati marcati IdU immediatamente, conservati per 30 minuti prima della marcatura IdU o conservati criogenicamente dopo la separazione di Ficoll ci sono differenze tra ciascun campione e popolazione (Figura 5a, b). Due popolazioni immunofenotipiche sono state esaminate per differenze nell'incorporazione di IDU; Cellule T (CD45 alto/CD3alto) e monoblasti (CD33+, HLADR+, CD11bbasso, CD14neg). Con la corretta combinazione di segni superficiali, è possibile esaminare ulteriori popolazioni immunofenotipiche. Nel midollo #2 c'è stato un notevole effetto di attivazione delle cellule T dopo 30 minuti di conservazione che non è stato visto nei monoblasti dello stesso paziente (Figura 5b). Come le cellule coltivate ci sono stati notevoli cambiamenti nell'etichettatura IdU dopo la conservazione criogenica che dipendeva anche dalla popolazione. Il midollo #1 ha avuto una riduzione della popolazione di cellule T, ma un aumento delle frazioni marcate con monoblasti IdU rispetto al basale (Figura 5 a,b), il midollo #2 ha mostrato una riduzione sia delle cellule T che dei monoblasti rispetto al basale (Figura 5a,b). Le cellule congelate richiedono quindi un notevole periodo di incubazione prima di tornare al normale stato del ciclo cellulare e questo può influenzare gli studi che si basano sulla modifica dello stato del ciclo cellulare o dello stato del ciclo cellulare come metrica del farmaco o dell'effetto sperimentale.
Un altro vantaggio di MCM è la capacità di discriminare le cellule nell'arresto del ciclo cellulare o che hanno una distribuzione anormale del ciclo cellulare. Mentre i coloranti di DNA comunemente usati nella citometria a flusso sono in grado di discriminare tra il contenuto di DNA 2N e 4N, sono molto luminosi, il che può complicare notevolmente la misurazione di altri parametri da quel laser. IdU, tuttavia, prende solo un canale di massa e ha una fuoriuscita minima che consente di utilizzare altri marcatori nella determinazione del ciclo cellulare. Le cellule MOLM13 che sono state irradiate mostrano una diminuzione dell'incorporazione di IdU e una diminuzione della fase M rispetto alle celle di controllo (Figura 6). L'interruzione dei normali checkpoint del ciclo cellulare potrebbe alterare lo stato apparente del ciclo cellulare da parte di MCM. Osservando le popolazioni di pH2AX e cPARP nelle cellule non irradiate, la popolazione pH2AX bassa e cPARPbassa mostra una normale distribuzione del ciclo cellulare, mentre le cellule che esprimono livelli più elevati di pH2AX o cPARP si localizzano principalmente nella fase G0/G1 prevista (Figura 6a). Nelle cellule irradiate pH2AX basso e cPARPbasso, tuttavia, le cellule sono quasi interamente localizzate nella fase G0, mentre le cellule pH2AXalte e cPARPbasse mostrano un fenotipo di arresto del ciclo cellulare con incorporazione e localizzazione di IdU nella fase G0/G1 e nella fase G2 con assenza di fase M. Le celle alte pH2AX e cPARPmostrano anche cellule che incorporano alcuni IdUe si localizzano nella fase G0 / G1 indicativa del danno da radiazioni (Figura 6b).
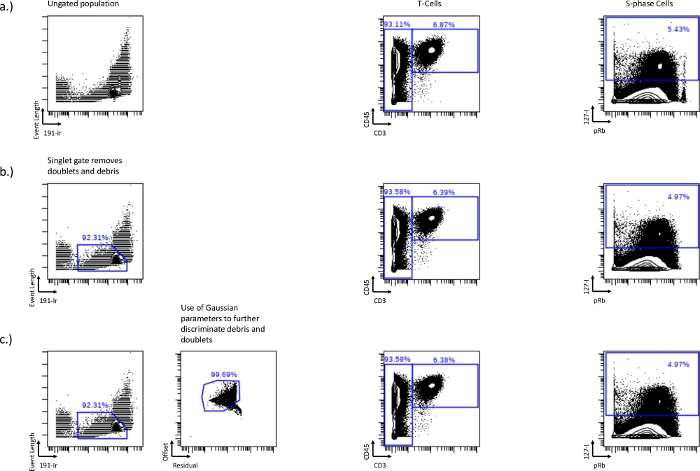
Figura 1: Stabilire le porte singoletto usando 191-Ir per lunghezza dell'evento e anche parametri gaussiani, residuo e offset.
Le differenze nelle cellule T (CD45+/CD3+) e nella fase S (IdU+) tra un campione non cantato (a), una lunghezza dell'evento rispetto al gate singoletto 191-Ir (b), o un gate singoletto combinato con parametri gaussiani, residuo e offset (c). Il gating singoletto rimuove detriti, doppietti e perline mostrati nella perdita della popolazioneelevata di pRb nell'angolo destro della biassiale. Questo cancello singoletto può essere ulteriormente ottimizzato includendo parametri gaussiani come residui e offset, rimuovendo più detriti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
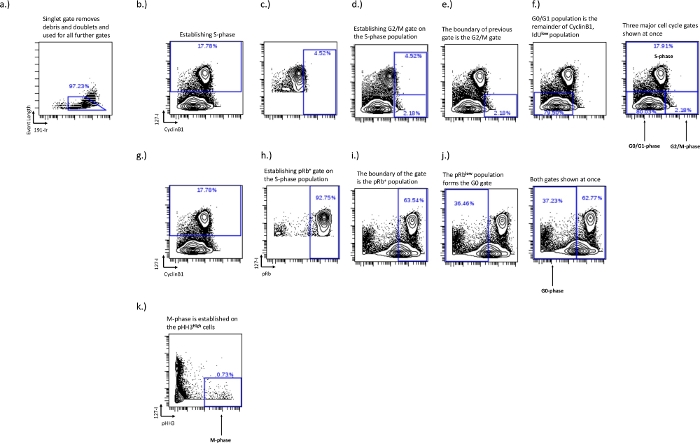
Figura 2: Lo schema di gating per stabilire le porte del ciclo cellulare per le fasi G0, G1, S, G2 e M utilizzando IdU, CyclinB1, pRb e pHH3.
Il cancello della canottiera è stabilito per rimuovere doppietti e detriti (a). La fase S deve essere stabilita (b), una volta stabilita la fase S la popolazione IdU+ può essere utilizzata per stabilire il limite della fase G2/M (c,d). La definizione del limite della fase G2/M stabilisce i limiti della popolazione della fase G0/G1 (f). La popolazione in fase pRb+ e G0 è stabilita sulla biassiale IdU vs pRb. Le celle IdU+ (h) sono usate per stabilire il confine per la popolazione pRb+ (i). Il confine della popolazione pRb+ stabilisce il confine della popolazione della fase G0 (j). La fase M è stabilita su cellule pHH3+ che sono IdU- (k). Fare clic qui per visualizzare una versione ingrandita di questa figura.
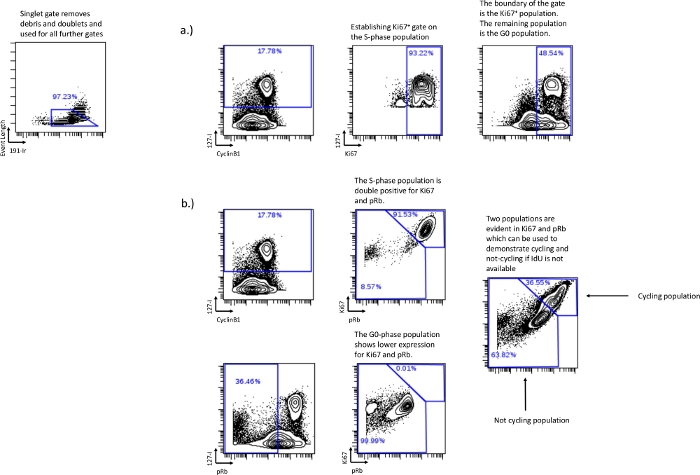
Figura 3: Stabilire porte del ciclo cellulare senza l'uso di pRb o senza l'uso dell'incorporazione di IdU.
Il disegno della fase G0 può anche essere fatto usando Ki-67 seguendo la stessa strategia di gating che è stata usata con pRb, se pRb non è incluso nell'esperimento (a). Se l'incorporazione di IdU fallisce o non viene eseguita, è possibile recuperare comunque le frazioni cicliche cellulari relative attraverso l'uso di Ki67 e pRb. La doppia espressione positiva di Ki67 e pRb è correlata alle cellule in ciclo, come evidenziato dimostrando che le cellule IdU+ si trovano principalmente nella popolazione doppia positiva (b). La bassa popolazione Ki67 e pRb è correlata con la popolazione in fase G0 o non ciclica dimostrata dalle cellule pRblow/IdUneg trovate nella popolazione bassa di Ki67 e pRb. Questo metodo non può discriminare le singole fasi del ciclo cellulare, ma può ancora essere utilizzato per determinare le frazioni cicliche relative in condizioni sperimentali. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Figure rappresentative dell'effetto delle diverse condizioni di conservazione sulla distribuzione del ciclo cellulare delle cellule HL-60.
Le cellule sono state incubate per un'ora seguita da un'ora di riposo alle condizioni di temperatura dichiarate in tubi sigillati (a). Ci sono effetti evidenti sulla distribuzione del ciclo cellulare rispetto al controllo. Le cellule HL60 sono state tenute in tubi sigillati a temperatura ambiente per 30 minuti, una situazione che può verificarsi in un contesto clinico, prima dell'incorporazione di IdU (b). I tubi sigillati tenuti a temperatura ambiente per 30 minuti non hanno mostrato differenze apprezzabili nel ciclo cellulare. L'effetto della conservazione criogenica è stato studiato sul ciclo cellulare nelle cellule HL60, dove un campione è stato prelevato prima della conservazione criogenica e un campione prelevato dopo un'ora di riposo dopo una settimana in conservazione criogenica (c). Un'ora dopo il disgelo la distribuzione del ciclo cellulare è influenzata e la distribuzione del ciclo cellulare non ritorna alla normalità fino a circa una settimana dopo il disgelo. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: L'elaborazione può avere un effetto sui campioni dei pazienti e vengono mostrate immagini rappresentative tra due pazienti diversi che mostrano (a) cellule T (CD45 alto/CD3alto) e (b) monoblasti (CD33+, HLADR+, CD11bbasso, CD14neg).
Tra il midollo uno e il midollo due è chiaro che nel midollo 2 c'è stato un effetto di attivazione delle cellule T durante i 30 minuti di riposo, mentre il midollo uno non ha avuto tale effetto. Il midollo uno ha mostrato un possibile effetto di attivazione nella popolazione di monoblasti dopo 30 minuti, mentre il midollo due no. In entrambi i midollo, tuttavia, era chiaro che lo stoccaggio criogenico influenzava la distribuzione del ciclo cellulare indipendentemente dal tipo di cellula. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 6: Le cellule MOLM13 sono state lasciate come controlli o irradiate utilizzando un irradiatore a raggi X a 10Gy.
Le cellule MOLM13 mostrano la distribuzione del ciclo cellulare in quattro diverse popolazioni di espressione di pH2AX e cPARP. Le celle di controllo mostrano una colorazione minima di pH2AX e cPARP, con caratteristiche normali del ciclo cellulare mostrate nella popolazione bassa di pH2AXe cPARPbassa (a). Mentre le cellule irradiate mostrano una distribuzione anomala del ciclo cellulare con la maggior parte delle cellule cicliche situate nel pH2AX alto e cPARPalto, indicando l'interruzione del ciclo cellulare (b). Le cellule non danneggiate, pH2AX basso e cPARPbasso, mostrano una mancanza di caratteristiche cicliche si trovano principalmente nella fase G0. Senza questi marcatori queste cellule apparirebbero come cellule 4N e 2N nella normale citometria a flusso, probabilmente confondendo l'analisi del ciclo cellulare a valle. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Gli esempi qui presentati dimostrano come utilizzare una piattaforma MCM per analizzare la distribuzione del ciclo cellulare. È stato anche dimostrato che l'analisi del ciclo cellulare è sensibile alle condizioni sperimentali come il tempo e la temperatura, che è una considerazione importante che i ricercatori devono prendere quando considerano MCM per la loro analisi del ciclo cellulare14. I campioni lasciati in deposito per un breve periodo di tempo, non più di un'ora, avranno un'incorporazione IdU paragonabile al loro stato normale. I campioni in un sistema chiuso per lunghi periodi di tempo, circa 2 ore, avranno ridotto l'incorporazione di IdU, tuttavia, le frazioni cicliche e non cicliche relative non cambieranno consentendo l'analisi del ciclo cellulare grossolano. Lo stoccaggio criogenico e il successivo scongelamento sono dannosi per la normale distribuzione del ciclo cellulare per un periodo di tempo significativo. È stato notato in precedenza che l'accumulo criogenico interrompe la distribuzione di proteine e RNA, ma solo recentemente è stato dimostrato che interrompe il ciclo cellulare14,15,16,17. Nel loro insieme, questi indicano che se si prevedono lunghi tempi di conservazione o conservazione criogenica dei campioni, sarebbe meglio colorare le cellule con IdU prima dello stoccaggio o della conservazione criogenica, fissare le cellule e conservarle fino a quando l'analisi può essere eseguita. Poiché l'analisi del ciclo cellulare mediante MCM non richiede cellule vive, ciò consentirebbe ai ricercatori di raccogliere campioni preziosi ed eseguire accurate analisi del ciclo cellulare a valle.
L'analisi del ciclo cellulare mediante MCM è un sistema robusto in grado di interrogare in profondità i modelli sperimentali. A causa dell'elevato numero di parametri MCM, circa 40-50 canali di massa, l'analisi del ciclo cellulare può essere combinata con altri marcatori intracellulari o extracellulari bypassando la necessità di selezionare le cellule in base all'immunofenotipo che può causare la perdita di significativi effetti del ciclo cellulare. La natura ad alto parametro di MCM si presta all'esame degli effetti in applicazioni di mappatura ad alta dimensione come SPADE e viSNE. Mentre SPADE e viSNE sono tipicamente utilizzati per definire popolazioni immunofenotipiche che possono quindi essere esaminate per i cambiamenti del ciclo cellulare, sarebbe anche possibile mappare i marcatori del ciclo cellulare. A seconda delle condizioni sperimentali, la mappatura dei marcatori del ciclo cellulare in uno spazio ad alta dimensione può mostrare la correlazione del ciclo cellulare con l'effetto del farmaco o quali popolazioni immunofenotipiche possono localizzare in ogni stato del ciclo 3,5. Mentre l'MCM può essere limitato dalla mancanza di coloranti fluorescenti leganti il DNA, questo è compensato dall'incorporazione diretta di IdU durante le cellule in fase S e le proteine del ciclo cellulare intracellulare possono essere utilizzate per determinare lo stato del ciclo cellulare. Queste proteine del ciclo cellulare possono anche aiutare a discriminare tra le fasi dell'arresto del ciclo cellulare che altrimenti apparirebbero come 3N o 4N nel flusso tradizionale usando coloranti leganti il DNA. Tali sistemi altamente parametrici non sono tuttavia privi di svantaggi ed è sensibile alle interruzioni del ciclo cellulare. Abbiamo dimostrato che lunghi tempi di conservazione e stoccaggio criogenico possono influenzare significativamente la distribuzione del ciclo cellulare. Ciò è particolarmente importante quando si cerca di razionalizzare gli effetti sperimentali per i farmaci che possono influenzare la distribuzione del ciclo cellulare. Il trattamento di farmaci progettati per influenzare il ciclo cellulare su campioni primari congelati può fornire dati falsi sull'effetto del ciclo cellulare se usato immediatamente dopo lo scongelamento dalla conservazione criogenica. MCM è una tecnologia versatile per l'analisi del ciclo cellulare che può essere applicata a numerosi modelli sperimentali ed è particolarmente adatta alla profilazione profonda di sistemi eterogenei. Come con altri metodi altamente parametrici, è necessario avere un esperimento attentamente progettato con considerazioni appropriate su come l'elaborazione e gli effetti sperimentali influenzeranno l'analisi del ciclo cellulare.
Divulgazioni
Il Dr. Behbehani riceve supporto di viaggio da Fluidigm. Fluidigm ha anche acquistato reagenti e materiali per uso di laboratorio.
Riconoscimenti
Gli autori desiderano ringraziare gli sforzi di Palak Sekhri, Hussam Alkhalaileh, Hsiaochi Chang e Justin Lyeberger per il loro supporto sperimentale. Questo lavoro è stato sostenuto dal Pelotonia Fellowship Program. Tutte le opinioni, i risultati e le conclusioni espressi in questo materiale sono quelli degli autori e non riflettono necessariamente quelli del Pelotonia Fellowship Program.
Materiali
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma | A3059 | Component of CSM |
| Centrifuge | Thermo Scientific | 75-217-420 | Sample centrifugation |
| Cleaved-PARP (D214) | BD Biosciences | F21-852 | Identification of apoptotic cells |
| Cyclin B1 | BD Biosciences | GNS-1 | G2 Resolution |
| Dimethylsulfoxide (DMSO) | Sigma | D2650 | Cryopreservative |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | Internal metal standard for CyTOF performance |
| FACS Tube w/ mesh strainer | Corning | 08-771-23 | Cell strainer to remove clumps/debris before CyTOF run |
| Fetal Bovine Serum (FBS) | VWR | 97068-085 | Cell culture growth supplement |
| Helios | Fluidigm | CyTOF System/Platform | |
| Heparin | Sigma | H3393 | Staining additive to prevent non-specific staining |
| IdU (5-Iodo-2′-deoxyuridine) | Sigma | I7125 | Incorporates in S-phase |
| Ki-67 | eBiosciences | SolA15 | Confirmation of G0/G1 |
| MaxPar Multi Label Kit | Fluidigm | 201300 | Metal labeling kit, attaches metals to antibodies |
| Microplate Shaker | Thermo Scientific | 88880023 | Mixing samples during staining |
| Paraformaldehyde (PFA) | Electron Microscopy Services | 15710 | Fixative |
| pentamethylcyclopentadienyl-Ir(III)-dipyridophenazine | Fluidigm | 201192 | Cell identification during CyTOF acquisition |
| p-H2AX (S139) | Millipore | JBW301 | Detection of DNA damage |
| p-HH3 (S28) | Biolegend | HTA28 | M-phase Resolution |
| Phosphate Buffered Saline (PBS) | Gibco | 14190-144 | Wash solution for cell culture and component of fixative solution |
| p-Rb (S807/811) | BD Biosciences | J112906 | G0/G1 Resolution |
| Proteomic Stabilizer | SmartTube Inc | PROT1 | Sample fixative |
| RPMI 1640 | Gibco | 21870-076 | Cell culture growth medium |
| Sodium Azide | Acros Organics | AC447810250 | Component of CSM/Antibody buffer, biocide |
Riferimenti
- Ornatsky, O., Baranov, V. I., Bandura, D. R., Tanner, S. D., Dick, J. Multiple cellular antigen detection by ICP-MS. Journal of Immunological Methods. 308 (1-2), 68-76 (2006).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Analytical Chemistry. 80 (7), 2539-2547 (2008).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry A. 81 (7), 552-566 (2012).
- Raval, A., et al. Reversibility of Defective Hematopoiesis Caused by Telomere Shortening in Telomerase Knockout Mice. PLoS One. 10 (7), 0131722 (2015).
- Behbehani, G. K., et al. Mass Cytometric Functional Profiling of Acute Myeloid Leukemia Defines Cell-Cycle and Immunophenotypic Properties That Correlate with Known Responses to Therapy. Cancer Discovery. 5 (9), 988-1003 (2015).
- Kimmey, S. C., Borges, L., Baskar, R., Bendall, S. C. Parallel analysis of tri-molecular biosynthesis with cell identity and function in single cells. Nature Communications. 10 (1), 1185 (2019).
- Rabinovitch, P. S., Kubbies, M., Chen, Y. C., Schindler, D., Hoehn, H. BrdU-Hoechst flow cytometry: a unique tool for quantitative cell cycle analysis. Experimental Cell Research. 174 (2), 309-318 (1988).
- Rahman, A. H., Tordesillas, L., Berin, M. C. Heparin reduces nonspecific eosinophil staining artifacts in mass cytometry experiments. Cytometry A. 89 (6), 601-607 (2016).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample Preparation for Mass Cytometry Analysis. Journal of Visualized Experiments. (122), e54394 (2017).
- Behbehani, G. K. Immunophenotyping by Mass Cytometry. Methods in Molecular Biology. 2032, 31-51 (2019).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. Journal of Visualized Experiments. (69), e4398 (2012).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry A. 83 (5), 483-494 (2013).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Current Protocols in Cytometry. , 17 (2010).
- Devine, R. D., Sekhri, P., Behbehani, G. K. Effect of storage time and temperature on cell cycle analysis by mass cytometry. Cytometry A. 93 (11), 1141-1149 (2018).
- Campos, L., et al. Expression of immunological markers on leukemic cells before and after cryopreservation and thawing. Cryobiology. 25 (1), 18-22 (1988).
- Kadic, E., Moniz, R. J., Huo, Y., Chi, A., Kariv, I. Effect of cryopreservation on delineation of immune cell subpopulations in tumor specimens as determinated by multiparametric single cell mass cytometry analysis. BMC Immunology. 18 (1), 6 (2017).
- Shabihkhani, M., et al. The procurement, storage, and quality assurance of frozen blood and tissue biospecimens in pathology, biorepository, and biobank settings. Clinical Biochemistry. 47 (4-5), 258-266 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon