Method Article
ピリミジン類似体である5-ヨード-2'-デオキシウリジン(IdU)と細胞周期マーカーを使用して、マスサイトメトリープラットフォームで細胞周期相を確立します(英語)
要約
このプロトコルは、マスサイトメトリープラットフォームで使用するために細胞周期測定に適合させます。マスサイトメトリーのマルチパラメータ機能により、ヨウ素取り込みを直接測定することでS期の細胞を同定でき、細胞内サイクリングマーカーはさまざまな実験条件で各細胞周期状態の特性評価を可能にします。
要約
細胞周期相の調節は、細胞増殖および恒常性の重要な側面である。細胞周期を支配する調節機構の破壊は、癌を含む多くの疾患の特徴である。細胞周期の研究には、細胞周期の進行の各部分の細胞数を定義し、各細胞周期段階を明確に描写する能力が必要です。マスサイトメトリー(MCM)の出現は、元素同位体の直接測定によるハイスループットシングルセル分析の大きな可能性を提供し、MCMによる細胞周期状態の測定方法の開発は、MCMの有用性をさらに拡大します。ここでは、MCMシステムで5-ブロモ-2'-デオキシウリジン(BrdU)と同様に、5-ヨード-2'-デオキシウリジン(IdU)を直接測定する方法について説明します。この IdU ベースの MCM を使用すると、いくつかの利点があります。まず、IdUは合成中にDNAに急速に取り込まれるため、10〜15分の短いインキュベーションでS期の細胞を確実に測定できます。第二に、IdUは二次抗体やDNA分解を必要とせずに測定されます。第三に、IdU染色は、サイクリンB1、リン酸化網膜芽細胞腫タンパク質(pRb)、およびリン酸化ヒストンH3(pHH3)の測定と簡単に組み合わせることができ、5つの細胞周期相の明確な描写をまとめて提供します。これらの細胞周期マーカーとMCMで可能な多数のパラメータとの組み合わせにより、他の多くの指標との組み合わせが可能になります。
概要
質量サイトメトリーは、質量分析法の高分解能と定量性を利用して、約40のパラメータの検出を可能にします。蛍光色素標識抗体の代わりに金属標識抗体が使用され、より多くのチャネルが可能で、スピルオーバーが最小限に抑えられます1,2。MCMには、フローサイトメトリーと比較して、細胞周期解析に関して長所と短所があります。MCMの主な利点の1つは、多数のパラメータにより、非常に不均一なサンプル中の多数の免疫表現型的に異なるT細胞タイプにわたる細胞周期状態を同時に測定できることです。MCMは、ヒト骨髄3およびテロメラーゼ欠損症4のトランスジェニックマウスモデルにおける正常造血中の細胞周期状態の測定に成功しています。急性骨髄性白血病(AML)における細胞周期状態の解析は、細胞周期が臨床療法に対する既知の反応と相関していることを示し、治療の選択に情報を提供できる機能的特徴へのin vivoの洞察を提供します5。マスサイトメトリー細胞周期分析の第2の利点は、細胞周期状態と相関し得る多数の他の機能マーカーを測定する能力である。最近の研究では、IdUとBRUおよびrRNA6に対する金属タグ付き抗体を使用することにより、タンパク質およびRNA合成を細胞周期状態と相関させることができました。分化の連続体における多数の集団にわたる細胞周期状態を測定するこの種の高度にパラメトリックな分析は、現在のフローサイトメトリー技術ではほぼ不可能です。MCMの主な欠点は、蛍光フローサイトメトリーで使用されるもの(DAPI、ヘキスト、ピロニンYなど)と同等のDNAまたはRNA染色がないことです。蛍光色素はDNAおよびRNA含量の比較的正確な測定を与えることができるが、この精度はヌクレオチド塩基間のインターカレーション時に生じるこれらの色素の蛍光特性の変化によってのみ可能である。したがって、MCM分析では、DNAまたはRNA含有量を同様の精度で測定することはできません。代わりに、マスサイトメトリー細胞周期分析は、サイクリンB1、リン酸化網膜芽細胞腫タンパク質(pRb)、リン酸化ヒストンH3(pHH3)などの細胞周期状態に関連するタンパク質の測定と、S期細胞へのIdU取り込みからのヨウ素原子の直接測定に依存しています。これら2つの測定アプローチは、正常な細胞増殖中に非常に類似した結果をもたらしますが、細胞周期の進行が破壊されると、潜在的に不一致になる可能性があります。
各細胞周期期の細胞数の測定は、正常な細胞周期の発達や、がんや免疫疾患でよく見られる細胞周期の破壊を理解する上で重要です。MCMは、金属タグ付き抗体を使用して細胞外および細胞内因子の信頼性の高い測定を提供します。しかし、イリジウムベースのDNAインターカレーターは2Nと4NのDNAを区別できなかったため、S相の測定は制限されていました。細胞周期の段階を定義するために、Behbehaniは、質量サイトメーターの範囲内に収まり、S期3の細胞を直接測定できる質量127のIdUを利用する方法を開発しました。この直接測定により、二次抗体の必要性や、酸やDNaseなどのDNA変性剤の使用を回避できます。細胞内サイクリングマーカーと組み合わせることで、実験モデルにおける細胞周期分布の高分解能を可能にします。
このプロトコルは、MCMの一般的なフローサイトメトリープロトコルからの細胞周期測定を適応させます。私たちの方法は、細胞周期パラメータを含めるための便利で簡単な方法を提供します。in vitroサンプルのIdU取り込みは、37°Cで10〜15分のインキュベーションしか必要とせず、数時間のインキュベーション時間を推奨するほとんどのBrdU染色プロトコルよりも短い3,7。IdUおよびBrdUに組み込まれたサンプルは、プロテオミクス安定剤を使用して固定し、-80°Cの冷凍庫にしばらく保存できます。これにより、サンプルの品質を低下させることなく、バッチ分析のために多数のIdU染色サンプルをアーカイブすることができます。
プロトコル
1. IdU銘柄の準備
- 5-ヨード-2'-デオキシウリジン(IdU)をDMSOに50 mMの濃度まで溶解します。滅菌フィルター、10-50 μLチューブに分注し、-80°Cで保存
- 冷凍庫からIdUを取り出し、室温で解凍します。IdUをRPMI-1640で希釈して、最終濃度1 mMの作業溶液を作ります。ピペットを上下にするか、ボルテックスして混合します。
- 通常、濃縮されたIdUを細胞が培養されている培地(DMEM、IMDMなど)に希釈するか、PBSに希釈して末梢血または骨髄穿刺サンプルに直接添加します。この予備希釈ステップは、DMSOと目的の細胞の水性媒体との混合を容易にする。
注:インキュベーション中のIdUの最終濃度は10μMである必要があります。1 mLの溶液を培地1 mLごとに10 μLの比率で添加できます。
- 通常、濃縮されたIdUを細胞が培養されている培地(DMEM、IMDMなど)に希釈するか、PBSに希釈して末梢血または骨髄穿刺サンプルに直接添加します。この予備希釈ステップは、DMSOと目的の細胞の水性媒体との混合を容易にする。
2. IdUインキュベーションとサンプル保存
- 加湿された37°Cのインキュベーターでサンプルを維持します。インキュベーターからサンプルを取り出し、サンプルをバイオセーフティフードに移動します。
- サンプル1 mLごとに1 μLの1 mM IdUを追加します。
- 6ウェルプレートの場合、各ウェルの3 mLの培地に30 μLの1 mM IdUを追加します。IdUは、骨髄穿刺液やマウスの研究に直接使用することもできます4。
- サンプルを37°Cのインキュベーターに10〜15分間戻します。S期の最も正確な測定を得るために、IdU曝露中は細胞を最適な増殖条件下で維持します。
- IdUインキュベーション後、サンプルを取り出し、円錐管に移します。
- サンプルを400 x g で室温で10分間回転させます。
- 上清を吸引し、200 μLのPBSに再懸濁します。
- 必要に応じて、このステップで生/死染色(シスプラチンを使用)を実行して、固定および凍結する前に死んだ細胞をマークします。
注:ロジウム生/死染色はメタノール透過処理後にはうまく機能しないため、細胞周期分析での使用はお勧めしません。
- 必要に応じて、このステップで生/死染色(シスプラチンを使用)を実行して、固定および凍結する前に死んだ細胞をマークします。
- 18.75 μLの16%パラホルムアルデヒド(PFA)をPBSに加え、最終濃度1.5%のPFAにします。室温で10分間インキュベートします。サンプルを400 x g で室温で10分間スピンダウンします。
- 凍結する前に、PBS/PFA溶液を吸引し、サンプルを500 μLの細胞染色培地(CSM、0.5%BSAおよび0.02%アジ化ナトリウムを含む1x PBS)+ 10%DMSOに再懸濁します。
- 市販のプロテオミクススタビライザーを使用する場合は、200 μLのPBS(1:1.4)に再懸濁したサンプルに280 μLのプロテオミクススタビライザーを追加します。サンプルを室温で10分間インキュベートし、-80°Cに直接入れます。
注:IdUは、37°Cで10〜15分のインキュベーションで効果的に組み込むことが示されています。 10〜15分を超えるIdUインキュベーションは、IdU標識細胞がS期を離れてG2期またはM期に進むため、S期およびG2期集団の分解能を徐々に低下させます。また、IdUとの長期インキュベーションは、細胞死や細胞周期アーチファクトを引き起こす可能性があることも観察されています。IdU取り込み後のその後の細胞プロセシングおよび抗体染色は、S期細胞に取り込まれなかった残留IdUを洗い流すのに十分である。ここで説明するin vitroプロトコルを使用した場合、有意なヨウ素バックグラウンドは観察されていません。しかし、臨床サンプルでヨウ素汚染が観察されることはほとんどありません。これは、CTスキャンでのヨウ素造影剤などの医療処置、またはヨウ素含有医薬品から発生する可能性があります。大量のIdUバックグラウンドが観察された場合は、マスサイトメーターの検出器への損傷を避けるためにサンプルを実行しないでください。
- 市販のプロテオミクススタビライザーを使用する場合は、200 μLのPBS(1:1.4)に再懸濁したサンプルに280 μLのプロテオミクススタビライザーを追加します。サンプルを室温で10分間インキュベートし、-80°Cに直接入れます。
3. マスサイトメトリー用サンプルの染色
- サンプルを-80°Cから取り出し、表面染色前に解凍します。
- SmartTube固定法を使用する場合は、サンプルがウォームアップするときに追加の固定を避けるために、サンプルを0〜4°Cで解凍します。
- サンプルを解凍した後、約1〜200万個の細胞を5 mLのFACSチューブに移します。
- FACSチューブを600 x g で5分間遠心分離し、FACSチューブに細胞染色培地(CSM)を充填して細胞を洗浄します。さらに1回繰り返します。
- 細胞同士がくっつくことがわかっている場合は、細胞間の接触を防ぐためにCSM洗浄液に400 U / mLのヘパリンを追加しますが、これは厳密には必要ありません。
- 細胞をFCブロッキング剤(細胞100 μLあたり5 μL)で室温で10分間インキュベートします。
- 細胞の表面または細胞外部分を染色する抗体の混合物を調製します。総染色混合物は、各テストで1〜200万細胞あたり100μLになります。染色混合物は、カクテルおよびFACSチューブ内のCSMおよびヘパリンとそれに応じてバランスが取れます。
注:このステップでCSMを追加すると、非特異的染色アーティファクトも減少します8。この染色混合物は、関心のあるターゲットと表面表現型に完全に依存します(たとえば、T細胞を含む研究では、CD45、CD3、CD4、CD8などの表面混合物を使用します)。サンプル処理と染色の詳細なプロトコルは、Behbehani and McCarthy et al.9,10にあります。 - 表面染色混合物を細胞に加え、室温で30〜60分間連続的に振とうしながらインキュベートします。
- 染色後、FACSチューブにCSMを充填し、600 x g で5分間スピンダウンします。
- CSMでさらに2回洗浄し、サンプルを600 x g で5分間回転させ、各CSM洗浄を吸引します。
- 10%CSMおよび1.5%PFAを含む1mLのPBSを添加して細胞外抗体を固定します。
- PBS / CSM / PFA混合物を含むFACSチューブにCSMを充填します。600 x g で5分間スピンダウンし、上清を吸引します。
- -20°Cでメタノールを加える。
- サンプルを1〜2分間ボルテックスして単一細胞懸濁液を達成し、すべての細胞凝集塊が再懸濁されていることを確認します。
- サンプルがゆっくりとボルテックスしている間に、フィルターチップ付きの1,000 μLピペットを使用して、1 mLの氷冷メタノールを急速に加えます。
- FACチューブをライトにかざし、目に見える塊がないことを確認します。曇りが予想されます。塊があると、サンプルは後続のMCM分析に使用できなくなります。
- サンプルを-20°Cで10〜20分間保管します。
- この間に細胞内染色混合物を調製する。細胞内染色混合物は、目的のターゲットに依存します。細胞周期解析には、この染色混合物にCyclinB1、pRb、Ki67、およびpHH3を含めますが、必要に応じて他の細胞内マーカーを追加することができます。
- -20°Cで10〜20分後、サンプルを取り出し、1.5 mLのPBSを加え、残りをCSMで満たします。
- サンプル600 x g を5分間遠心分離し、上清を吸引します。
- CSMでさらに2回洗浄し、サンプルを600 x g で5分間スピンダウンし、毎回上清を吸引します。
- 最後のCSM洗浄後、サンプルを遠心分離し、約50 μLの残留量を残します。
- 調製した抗体混合物をサンプルに加え(通常、最終染色量100 μLを達成するために50 μLの抗体染色カクテルを追加します)、振とうプラットフォームで室温で30〜60分間インキュベートします。
- 染色後、CSMを加え、600 x g で5分間遠心分離します。
- CSMを吸引し、CSMで再度洗浄し、600 x g で5分間回転させ、CSMを吸引してからPBSを追加します。
- 細胞内染色が完了したら、細胞に抗体を固定するインターカレーター溶液に細胞を入れ、各細胞のDNAを染色して同定できるようにします。インターカレーター溶液には、メーカーのストック溶液から添加した非同位体的に純粋なイリジウムインターカレーター(ペンタメチルシクロペンタジエニル-Ir(III)-ジピリドフェナジン)を500μMの濃度で含有します。 イリジウムストックをPBSと1.5%PFAの溶液で1:4000に希釈します。イリジウムインターカレーター溶液を100万細胞あたり100〜200μL添加して、均一に染色し、過剰染色を防ぎます。
注:このインターカレーター溶液中のイリジウムは、シングレットゲーティング用の細胞を識別することを目的としており、生/死染色には使用しないでください。生/死痕が望まれる場合は、上記およびMcCarthy et al.9に記載されているように、固定前に行う必要があります。 - サンプルを4°Cの冷蔵庫のインターカレーター溶液に最大2週間保存してから、CyTOFでサンプルを取得します。
4. マスサイトメーターの操作
注:マスサイトメトリーの操作は、マシン固有の操作が可能です。操作前にCyTOFユーザーズマニュアルを確認することを常にお勧めします。さらに、現在、機械の起動とメンテナンス9,11を扱う2つのJoVE記事があります。
- マスサイトメーターを操作する前に、ネブライザーに目詰まり、亀裂、その他の不規則性がないか確認してください。
- ネブライザーをサイトメーターに接続し、ウォームアップ手順を開始します。ネブライザーを取り付けずにマスサイトメーターを起動しないでください。
- マスサイトメーターのウォームアップが終了したら、サンプルラインに水を流します。スプレーチャンバーは、チューニングまたはサンプル分析を実行する前に、約200°Cに達する必要があります。
- 5〜10分間水を流します。5〜10分後、チューニングソリューションをロードし、チューニングマネージャーを選択します。チューニングソリューションは、固定濃度の金属を含む溶液であり、サンプル取得前にマスサイトメーターを最適化するために使用されます
- チューニング マネージャーで、チューニング ソリューションが定常状態のヒット レコードに達したら [ プレビュー ] を選択して、自動チューニング プロセスを開始します。
- チューニングが終了したら、サンプラーに水をロードし、サンプル処理中にサンプルラインに水を流します。毎日のサイトメーターの操作とチューニングのための詳細なプロトコルは、ライポルド11で見つけることができます。
- 場合によっては、自動チューニングが最適なマシンパフォーマンスにチューニングされないことがあります。チューニング手順を繰り返して、これを修正します。
- サンプルを取得する前に、CSMで1回、純粋な脱イオン水で2回サンプルを洗浄します。PBS / CSMから残留塩分を除去するには、水洗いが重要です。
- メーカー提供の平衡化ビーズ、既知の金属濃度を装填したポリスチレンビーズを使用して、感度とサンプルフローを確認します。
- 取得モードをチューニングモードからイベントキャプチャモードに変更します。集録を停止する制限時間を120秒に設定します。[ 記録]を選択する前に45秒待ちます。
- マスサイトメーターは、120秒後にサンプル取得を自動的に停止します。雨プロットビューアを使用して、Eu151とEu153の強度を確認します。
- 平衡化ビーズを純粋な脱イオン水で1:20の比率で希釈します。
- サンプル取得前に、実験マネージャーを確認してください。実験マネージャーを使用して、チャネルに名前を割り当てたり、記録するチャネルを追加したりします。
- IdUを使用している場合は、127-Iチャネルが追加されていることを確認してください。
- サンプル取得前に、必要なパラメータ(IdUなど)を測定するようにマスサイトメーターを設定することが不可欠です。事前にチャンネルが選択されていない場合、選択されていないチャンネルからデータは収集されず、復元できません。
- 1:20の純粋な脱イオン水と平衡化ビーズの混合物を使用して、細胞を約1〜2 x10 6 / mLの濃度に希釈します。残留塊を除去するために、フィルターで覆われたFACSチューブに細胞を通します。
- サンプルをロードし、取得時間を変更します。
- プレビューを押して、毎秒のイベント数が安定するのを待ちます。
- 毎秒400イベントを超えるイベントを実行しないでください、これはかなりの量のダブレットと破片につながります。通常、少なくとも20,000〜50,000の細胞イベントを収集しますが、最適な数は実験デザインによって異なります。最大200万個の細胞を染色すると、通常、300,000〜400,000個の細胞イベントが発生します。すべてのイベントがセルになるわけではないことに注意してください(イベント数には破片とビーズのイベントが含まれます)。
- サンプル取得が完了したら、洗浄液をロードし、サンプル誘導を開始し、5〜10分間実行します。5〜10分後、サンプル誘導を停止し、10〜20分間水を流します。洗浄液は、サンプルラインから残留金属を取り除くように設計されたフッ化水素酸の弱い溶液です。
- マスサイトメーターをシャットダウンし、ネブライザーを取り外します。ネブライザーは熱くなりますので、取り扱い中は注意してください。
5.データ分析
- ビーズを除去し、サンプル取得中の信号ドリフトを補正するには、FluidigmソフトウェアまたはFinck12が開発したアプリケーションを使用してFCSファイルを正規化します。
- FCSをサイトバンクまたは他のフローサイトメトリー解析ソフトウェアにアップロードします。FCSファイルは互換性のある任意のソフトウェアで使用でき、このプロトコルの目的のために、すべてのゲーティングとさらなる分析はCytobank13で行われています。
- 細胞周期ゲートを描画する前に、ダブレットまたは細胞破片を下流の分析から除外するには、イベント長対191-Irの二軸プロットを使用します(図1a)。細胞は、ダブレットや破片を排除するために使用できる明確で明るい集団Ir高 を形成します。これがシングレットゲートです。このゲーティング法は、典型的には、ダブレット細胞イベントの約50〜60%を除去するので、残りのダブレット細胞事象を除去するために追加の戦略が必要となる可能性がある。
- イベントの長さのスケール (最小値と最大値) を変更して、セルをより目立たせて、シングレット ゲーティングに役立てます。
- さらに、ガウスパラメータ、残差、オフセットを使用して、ダブレットと破片を除去します。オフセットが低いほど残差が高くなると、デブリとダブレットもなり、この母集団の周りのゲートはダブレットとデブリをさらに除去できます(図1b、c)。
- S相ゲーティング – S相は描画が最も簡単なゲートですが、最も重要です。IdU対pRb、Ki67、またはサイクリンB1の二軸プロットを使用してこのゲートを描画します。S期IdU+ 細胞は、これらの二軸プロットを見ると別個の集団を形成します(図2b)。
- G0/G1相、G2/M相ゲーティング – IdU対CyclinB1プロットでG0/G1およびG2/M相ゲートを確立し、G0/G1相ゲートとG2/M相ゲートの境界を確立するには、IdUの組み込みを使用することが重要です。G0 / G1相はサイクリンB1低/ IdU-であり、G2 / M相はサイクリンB1高/ IdU-になります。良好なサイクリンB1染色は、G0-G1集団とG2-M集団の間の自然集団を示します。ただし、これは実験条件下でのサンプルおよび細胞タイプによって異なります。細胞周期分布が影響を受ける可能性があり、CyclinB1 G0 / G1期とG2 / M期の分離が少ない実験条件では、S期を利用することで、特定の各実験で特定の細胞タイプに対して一貫したゲーティングが可能になります。このメソッドの詳細を以下に示します。
- CyclinB1対IdUのS期セルのみをプロットして、G0 / G1相とG2 / M相の分離を確立します。CyclinB1の高い集団にゲートを描き、S期ポピュレーションの上位5%がゲートの内側に入るまで調整します(図2c)。これにより、G0/G1とG2/Mのフェーズゲートの間にブレークポイントが確立されます(図2のe、f)。アクティブな集団は関心のある母集団に変更され、前のゲート内に存在する部分はG2 / M相の集団になり、残りはG0 / G1段階の母集団になります。
- G0相ゲーティング – pRb対IdUプロットでG0相を確立します。G0フェーズは、pRbの低/IdU- 集団によって表されます。活発なサイクリング集団はpRbとIdUの取り込みの発現が高く、G0相ゲートは通常2つの異なる集団で表されるため、この境界に描画できます(図2g、i)。
- 前に描いたS相の母集団(図2b)を活性母集団とし、pRbの高い母集団の上位90〜100%を組み込んだゲートを描くことで、G0相を定義します。これがpRb+サイクリング集団(図2i)であり、このゲートの外側のpRb低集団がG0集団である(図2j)。
- pRbが利用できないか、記録できない場合は、Ki67とIdUを使用してG0フェーズの母集団を確立します。S相の集団の大部分を表すゲートを描き、そのゲートをKi67対IdUの境界として使用すると、残りの母集団はG0相になります(図3a)。
- M相ゲーティング – IdU対pH3の二軸プロットでM相を確立します。M期は細胞のごく一部を表し、pH3の高い 集団にゲートされています(図2d)。
- IdUの取り込みが失敗したか、不可能でした– IdUが利用できない場合は、Ki67とpRbを使用してセルサイクリングを定義し、サイクルフラクションを定義しません。Ki67とpRbは、通常の状態では、Ki67高/pRb高とKi67低/pRb低の2つの異なる集団を形成します。二重正の母集団は、G1期、S期、G2期、およびM期と相関するアクティブなサイクル母集団を表します。二重低母集団は、G0期と相関する非循環集団を表します(図3b)。
注:Ki67とpRbを使用して個々のフェーズを描写することはできませんが、相対的なサイクリング/非サイクリング集団に対する実験的効果を決定できます。 - 細胞周期解析 – ゲートが確立されたら、ゲートから数値をエクスポートしてさらに分析します。各サイクルのパーセンテージは、結合された母集団から単一の母集団を差し引くことによって達成できます。pRb低IdU低で描かれたG0相をゲートパーセンテージから差し引いて、CyclinB1低IdUネグで描かれたG0 / G1相を差し引いて、G1相パーセンテージを見つけることができます。同様に、G2相の割合は、G2/M相ゲートからM相ゲートを差し引いたものから得られます。これにより、個々の細胞周期段階ごとに数値が生成されます。G0、G1、S、G2、および M です。個々の細胞周期相ごとに生成された数値は、グラフ作成や統計解析などのさらなる解析に使用できます。
結果
HL-60細胞とヒト骨髄穿刺液を利用することで、実験条件が細胞周期の分布と分析にどのように影響するかを示すことができます。まず、細胞周期相がどのように導出されるかを実証するために、ゲーティング戦略を確立する必要があります。図1では、細胞の破片とダブレットを分離し、単一細胞集団を確立するのに重要な一重項ゲートの確立を示しています。細胞株の場合、細胞周期解析に進むために必要なのは一重項ゲートだけです(図2a)。ヒトサンプルの場合、各細胞周期ゲートの正確な境界は細胞タイプによって異なる可能性があるため、通常、細胞周期解析の前に免疫表現型集団を確立する必要があります。集団が確立されたら(通常、その集団を定義する表面マーカーをゲーティングすることによって)、細胞周期ゲートを確立する必要があります。図2bは、IdU対CyclinB1二軸プロット上のS相の確立を示しています。このプロットは、G2/M相ゲートの境界を確立するためにも使用されます(図2f)。G2/M相が確立されると、残りはG0/G1相ゲートになります(図2f)。IdU対pRbは、細胞を組み込んだIdU上にゲートを確立することにより、最初にpRb+サイクリング集団を確立するために使用されます(図2g、i)。このゲートの外側のpRb+/IdU負のポピュレーションはG0相です(図2j)。M期はIdU対pHH3上に確立され、M期細胞は高レベルのpHH3を発現し、IdUの取り込みを示さない(図2k)。pRbが含まれていない場合、G0相は、上記の方法と同様の方法でKi67を使用して複製できます(図3a)。IdUの取り込みに失敗したか、実行されなかった場合でも、Ki67とpRbを使用して相対的なサイクリング分率を決定することは可能です。Ki67とpRbの二軸性を使用することにより、pRb + / Ki67 +の二重陽性とpRbの低い/ Ki67の低い集団の2つの異なる集団が形成されます。二重陽性集団は周期内の細胞を表し、低は周期内にない細胞を表します(図3b)。IdUを組み込んだ細胞とIdUを組み込まないpRb低細胞を使用して、S期は主にpRb+/Ki67+集団にあり、G0期は主にpRb低/Ki67低集団にあることを示しています。
細胞周期解析は、特にIdUインキュベーションステップ中の優れた実験技術に依存しています。IdUの取り込みは柔軟ですが(細胞培養、骨髄穿刺、さらにはマウスの研究にも適用できます)、実験対象の細胞周期状態を乱すことなくIdUの取り込みと固定を行う必要があります。IdU標識、したがって下流の細胞周期分析は、 図4に示すように、時間と温度の影響を大きく受ける可能性があります。密閉容器内に長すぎる細胞、またはサンプル輸送または場所間のサンプル輸送で遭遇する可能性のある細胞は、S期画分が減少し、細胞周期分析では正確ではありません(図4a)。ただし、短い期間、合計で1時間未満の期間は、正常な細胞周期分布を持ち、迅速な輸送が細胞周期分析に悪影響を与えない可能性があることを示しています(図4b)。もう一つの重要な修飾剤は、ほとんどの実験室で日常的に使用されている凍結保存です。凍結保存された細胞の細胞周期状態を調べる場合、細胞が活性細胞周期に戻るまでに長い平衡期間が必要な場合がありますが、これはサイロ保存前の細胞周期状態をまだ反映していない可能性があります(図4c)。
初代ヒト試料は、複数の異なる細胞型の複合体であることが多く、これらの異なる細胞型は、異なる細胞周期ゲーティングをもたらすプロセシングに対して異なる感度を有することができる。直ちにIdU標識した、IdU標識前に30分間保存した、またはFicoll分離後に極低温で保存された2つの骨髄穿刺液では、各サンプルおよび集団の間に差がある(図5a、b)。2つの免疫表現型集団について、IdU取り込みの違いを調べました。T細胞(CD45高/CD3高)および単芽細胞(CD33+、HLADR+、CD11b低、CD14陰性)。表面マークの正しい組み合わせにより、さらなる免疫表現型集団を調べることが可能である。骨髄#2では、同じ患者からの単芽細胞では見られなかった30分保存後に顕著なT細胞活性化効果があった(図5b)。培養細胞と同様に、極低温保存後のIdU標識にも顕著な変化があり、これも集団に依存していました。骨髄#1はT細胞集団の減少を有したが、ベースラインと比較した場合に単芽細胞IdU標識画分が増加し(図5a、b)、骨髄#2はベースラインと比較した場合にT細胞および単芽細胞の両方の減少を示した(図5a、b)。凍結細胞は、正常な細胞周期状態に戻る前に顕著な潜伏期間を必要とし、これは、薬物または実験効果の指標として細胞周期状態または細胞周期状態の変更に依存する研究に影響を与える可能性があります。
MCMのもう一つの利点は、細胞周期停止中の細胞または異常な細胞周期分布を有する細胞を識別できることである。フローサイトメトリーで一般的に使用されるDNA色素は、2Nと4NのDNA含有量を区別することができますが、非常に明るいため、そのレーザーからの他のパラメータの測定が非常に複雑になる可能性があります。ただし、IdUは1つの質量チャネルしか取りませんが、こぼれが最小限であるため、他のマーカーを細胞周期の決定に使用できます。照射されたMOLM13細胞は、対照細胞と比較した場合、IdU取り込みの減少およびM期の減少を示す(図6)。正常な細胞周期チェックポイントの中断は、MCMによって見かけの細胞周期状態を変化させる可能性がある。非照射細胞のpH2AXおよびcPARP集団を見ると、pH2AX低およびcPARP低集団は正常な細胞周期分布を示し、より高いレベルのpH2AXまたはcPARPを発現する細胞は主に予想されるG0/G1期に局在します(図6a)。しかし、pH2AXが低くcPARPが低い細胞では、細胞はほぼ完全にG0期に局在しているのに対し、pH2AX高細胞とcPARP低細胞では、IdUの取り込みとM期のないG0/G1期およびG2期への局在を伴う細胞周期停止表現型を示します。pH2AX高およびcPARP高細胞は、IdUを取り込み、放射線損傷を示すG0/G1期に局在する細胞も示しています(図6b)。
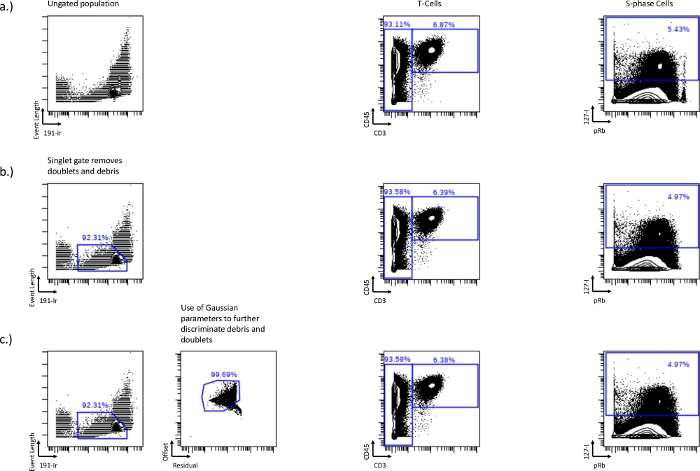
図1:イベント長による191-Irとガウスパラメータ、残差およびオフセットを使用したシングレットゲートの確立。
T細胞(CD45+/CD3+)とS相(IdU+)の違いは、未処理のサンプル(a)、イベント長と191-Irのシングルゲート(b)、またはガウスパラメータ、残差、オフセット(c)を組み合わせたシングレットゲートです。シングレットゲーティングは、二軸の右隅にあるpRb高集団の損失に示されている破片、ダブレット、およびビーズを除去します。このシングレットゲートは、残留やオフセットなどのガウスパラメータを含めることでさらに最適化し、より多くのデブリを除去することができます。この図の拡大版を表示するには、ここをクリックしてください。
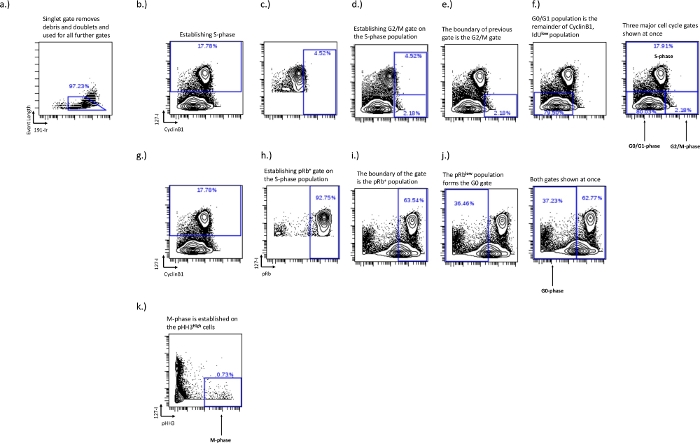
図2:IdU、CyclinB1、pRb、およびpHH3を使用して、G0、G1、S、G2、およびM相の細胞周期ゲートを確立するためのゲーティングスキーマ。
シングレットゲートは、ダブレットと破片を除去するために確立されます(a)。S相を確立する必要があり(b)、S相が確立されると、IdU+ポピュレーションを使用してG2 / M相境界を確立できます(c、d)。G2/M相境界の確立は、G0/G1相集団(f)の境界を確立する。pRb+およびG0相の集団は、IdU対pRbの二軸上に確立される。IdU+ 細胞 (h) は、pRb+ 集団 (i) の境界を確立するために使用されます。pRb+集団の境界は、G0期集団(j)の境界を確立します。M期は、IdU-(k)であるpHH3+細胞上に確立されます。この図の拡大版を表示するには、ここをクリックしてください。
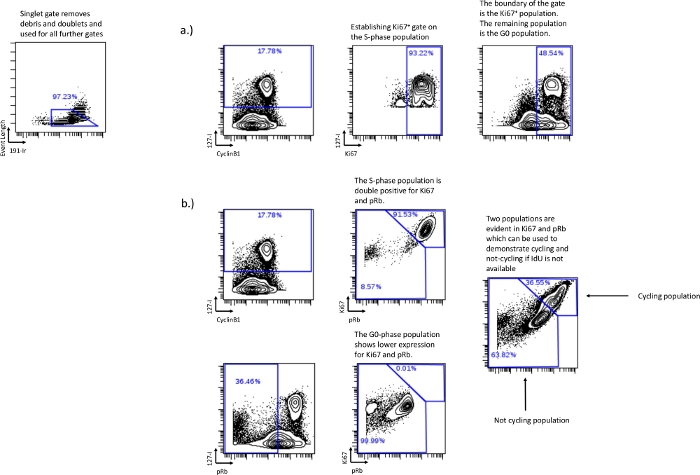
図3:pRbを使用せずに、またはIdU取り込みを使用せずに細胞周期ゲートを確立する。
pRbが実験に含まれていない場合、G0相の描画は、pRbで使用されたのと同じゲーティング戦略に従ってKi-67を使用して行うこともできます(a)。IdUの取り込みが失敗した場合、または実施されなかった場合でも、Ki67およびpRbの使用を通じて相対的な細胞サイクル画分を回収することが可能であった。Ki67およびpRb二重陽性発現は、IdU+ 細胞が主に二重陽性集団において見出されることを実証することによって証明されるように、サイクル中の細胞と相関する(b)。Ki67およびpRb低集団は、Ki67およびpRb低集団に見られるpRb低/IdUネグ 細胞によって実証されたG0期または非サイクリング集団と相関しています。この方法は、個々の細胞周期相を区別することはできませんが、実験条件で相対的なサイクル画分を決定するために使用できます。 この図の拡大版を表示するには、ここをクリックしてください。

図4:HL-60細胞の細胞周期分布に対する異なる保存条件の影響の代表的な図。
細胞を1時間インキュベートした後、密封チューブ(a)中で記載の温度条件で1時間静置した。対照と比較した場合、細胞周期分布に顕著な影響がある。HL60細胞は、IdU取り込み前の臨床現場で起こり得る状況を室温で30分間密閉チューブに保持した(b)。室温で30分間保持された密閉チューブは、顕著な細胞周期の違いを示さなかった。HL60細胞の細胞周期に対する極低温保存の影響を調べ、極低温保存前にサンプルを採取し、極低温保存で1週間後に1時間休んだ後にサンプルを採取しました(c)。融解後1時間で細胞周期分布が影響を受け、融解後約1週間まで細胞周期分布は正常に戻りません。 この図の拡大版を表示するには、ここをクリックしてください。

図5:処理は患者サンプルに影響を与える可能性があり、代表的な画像が2つの異なる患者の間で示され、(a)T細胞(CD45高/ CD3高)と(b)モノ芽細胞(CD33+、HLADR+、CD11b低、CD14陰性)を示します。
骨髄1と骨髄2の間では、骨髄2では30分間の休息中にT細胞活性化効果があったのに対し、骨髄1ではそのような効果がなかったことは明らかです。骨髄1は30分後に単芽細胞集団において可能な活性化効果を示したが、骨髄2は示さなかった。しかし、両方の骨髄では、極低温貯蔵が細胞の種類に関係なく細胞周期分布に影響を与えることは明らかでした。 この図の拡大版を表示するには、ここをクリックしてください。

図6:MOLM13細胞をコントロールとして残すか、X線照射器を用いて10Gyで照射した。
MOLM13細胞は、pH2AXおよびcPARP発現の4つの異なる集団における細胞周期分布を示す。対照細胞はpH2AXおよびcPARP染色が最小限であり、pH2AX低およびcPARP低集団では正常な細胞周期特性が示されています(a)。照射された細胞は異常な細胞周期分布を示し、周期細胞の大部分はpH2AX高とcPARP高に位置し、細胞周期の混乱を示しています(b)。非損傷では、pH2AX低およびcPARP低、サイクリング特性の欠如を示す細胞は、主にG0期に見られる。これらのマーカーがなければ、これらの細胞は通常のフローサイトメトリーで4Nおよび2N細胞として現れ、下流の細胞周期分析を混乱させる可能性があります。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここで紹介する例は、MCM プラットフォームを使用して細胞周期分布を分析する方法を示しています。また、細胞周期解析は時間や温度などの実験条件に敏感であることが実証されており、これは研究者が細胞周期解析にMCMを検討する際に取らなければならない重要な考慮事項です14。1時間以内の短期間保管されたサンプルは、通常の状態に匹敵するIdUの取り込みになります。クローズドシステム内のサンプルを約2時間長期間使用すると、IdUの取り込みは減少しますが、相対的なサイクル画分と非サイクル画分は変化せず、粗い細胞サイクル分析が可能になります。極低温保存とそれに続く融解は、かなりの期間、正常な細胞周期分布を破壊します。極低温保存は、タンパク質およびRNA分布を破壊することが以前に指摘されていたが、細胞周期を混乱させることが最近になってようやく示された14,15,16,17。これらを総合すると、サンプルの長期保存または極低温保存が予想される場合は、保存または極低温保存の前に細胞をIdUで染色し、細胞を固定して分析が可能になるまで保存する方がよいことを示しています。MCMによる細胞周期解析は生細胞を必要としないため、研究者は貴重なサンプルをバンクし、正確な下流の細胞周期解析を行うことができます。
MCMによる細胞周期解析は、実験モデルの深い調査が可能な堅牢なシステムです。MCMのパラメータ数が多く、約40〜50のマスチャネルがあるため、細胞周期分析は、有意な細胞周期効果が失われる可能性のある免疫表現型に基づく細胞の選別の必要性を回避して、他の細胞内または細胞外マーカーと組み合わせることができます。MCMの高パラメータ性は、SPADEやviSNEなどの高次元マッピングアプリケーションでの効果を調べるのに役立ちます。SPADEとviSNEは通常、免疫表現型集団を定義するために使用され、細胞周期の変化を調べることができますが、細胞周期マーカーにマッピングすることも可能です。高次元空間における細胞周期マーカーのマッピングは、実験条件に応じて、薬物効果またはどの免疫表現型集団が各周期状態に局在化しているかとの細胞周期相関を示すことができる3、5。MCMはDNA結合蛍光色素の欠如によって制限され得るが、これはS期細胞中の直接IdU取り込みによって補償され、細胞周期内細胞周期タンパク質は細胞周期状態を決定するために使用することができる。これらの細胞周期タンパク質は、DNA結合色素を用いた従来の流れでは3Nまたは4Nとして現れる細胞周期停止の段階を区別するのにも役立ちます。しかし、このような高度にパラメトリックなシステムには欠点がないわけではなく、細胞周期の混乱に敏感です。我々は、長い貯蔵時間と極低温貯蔵が細胞周期分布に大きな影響を与える可能性があることを示しました。これは、細胞周期分布に影響を与える可能性のある薬物の実験効果を合理化しようとする場合に特に重要です。凍結一次サンプルの細胞周期に影響を与えるように設計された薬物の処理は、極低温貯蔵からの解凍直後に使用した場合、細胞周期の影響に関する誤ったデータを与える可能性があります。MCMは、多くの実験モデルに適用できる細胞周期解析のための汎用性の高い技術であり、特に不均一系のディーププロファイリングに適しています。他の高度にパラメトリックな方法と同様に、処理と実験効果が細胞周期分析にどのように影響するかについて適切な考慮をした慎重に設計された実験が必要です。
開示事項
ベベハニ博士はFluidigmから旅行サポートを受けています。Fluidigmは、ラボで使用するための試薬や材料も購入しています。
謝辞
著者らは、Palak Sekhri、Hussam Alkhalaileh、Hsiaochi Chang、Justin Lyebergerの実験的支援の努力に感謝したい。この作業は、ペロトニアフェローシッププログラムによってサポートされました。この資料に記載されている意見、調査結果、結論は著者のものであり、必ずしもペロトニアフェローシッププログラムの意見、調査結果、結論を反映しているわけではありません。」
資料
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma | A3059 | Component of CSM |
| Centrifuge | Thermo Scientific | 75-217-420 | Sample centrifugation |
| Cleaved-PARP (D214) | BD Biosciences | F21-852 | Identification of apoptotic cells |
| Cyclin B1 | BD Biosciences | GNS-1 | G2 Resolution |
| Dimethylsulfoxide (DMSO) | Sigma | D2650 | Cryopreservative |
| EQ Four Element Calibration Beads | Fluidigm | 201078 | Internal metal standard for CyTOF performance |
| FACS Tube w/ mesh strainer | Corning | 08-771-23 | Cell strainer to remove clumps/debris before CyTOF run |
| Fetal Bovine Serum (FBS) | VWR | 97068-085 | Cell culture growth supplement |
| Helios | Fluidigm | CyTOF System/Platform | |
| Heparin | Sigma | H3393 | Staining additive to prevent non-specific staining |
| IdU (5-Iodo-2′-deoxyuridine) | Sigma | I7125 | Incorporates in S-phase |
| Ki-67 | eBiosciences | SolA15 | Confirmation of G0/G1 |
| MaxPar Multi Label Kit | Fluidigm | 201300 | Metal labeling kit, attaches metals to antibodies |
| Microplate Shaker | Thermo Scientific | 88880023 | Mixing samples during staining |
| Paraformaldehyde (PFA) | Electron Microscopy Services | 15710 | Fixative |
| pentamethylcyclopentadienyl-Ir(III)-dipyridophenazine | Fluidigm | 201192 | Cell identification during CyTOF acquisition |
| p-H2AX (S139) | Millipore | JBW301 | Detection of DNA damage |
| p-HH3 (S28) | Biolegend | HTA28 | M-phase Resolution |
| Phosphate Buffered Saline (PBS) | Gibco | 14190-144 | Wash solution for cell culture and component of fixative solution |
| p-Rb (S807/811) | BD Biosciences | J112906 | G0/G1 Resolution |
| Proteomic Stabilizer | SmartTube Inc | PROT1 | Sample fixative |
| RPMI 1640 | Gibco | 21870-076 | Cell culture growth medium |
| Sodium Azide | Acros Organics | AC447810250 | Component of CSM/Antibody buffer, biocide |
参考文献
- Ornatsky, O., Baranov, V. I., Bandura, D. R., Tanner, S. D., Dick, J. Multiple cellular antigen detection by ICP-MS. Journal of Immunological Methods. 308 (1-2), 68-76 (2006).
- Ornatsky, O. I., et al. Study of cell antigens and intracellular DNA by identification of element-containing labels and metallointercalators using inductively coupled plasma mass spectrometry. Analytical Chemistry. 80 (7), 2539-2547 (2008).
- Behbehani, G. K., Bendall, S. C., Clutter, M. R., Fantl, W. J., Nolan, G. P. Single-cell mass cytometry adapted to measurements of the cell cycle. Cytometry A. 81 (7), 552-566 (2012).
- Raval, A., et al. Reversibility of Defective Hematopoiesis Caused by Telomere Shortening in Telomerase Knockout Mice. PLoS One. 10 (7), 0131722 (2015).
- Behbehani, G. K., et al. Mass Cytometric Functional Profiling of Acute Myeloid Leukemia Defines Cell-Cycle and Immunophenotypic Properties That Correlate with Known Responses to Therapy. Cancer Discovery. 5 (9), 988-1003 (2015).
- Kimmey, S. C., Borges, L., Baskar, R., Bendall, S. C. Parallel analysis of tri-molecular biosynthesis with cell identity and function in single cells. Nature Communications. 10 (1), 1185 (2019).
- Rabinovitch, P. S., Kubbies, M., Chen, Y. C., Schindler, D., Hoehn, H. BrdU-Hoechst flow cytometry: a unique tool for quantitative cell cycle analysis. Experimental Cell Research. 174 (2), 309-318 (1988).
- Rahman, A. H., Tordesillas, L., Berin, M. C. Heparin reduces nonspecific eosinophil staining artifacts in mass cytometry experiments. Cytometry A. 89 (6), 601-607 (2016).
- McCarthy, R. L., Duncan, A. D., Barton, M. C. Sample Preparation for Mass Cytometry Analysis. Journal of Visualized Experiments. (122), e54394 (2017).
- Behbehani, G. K. Immunophenotyping by Mass Cytometry. Methods in Molecular Biology. 2032, 31-51 (2019).
- Leipold, M. D., Maecker, H. T. Mass cytometry: protocol for daily tuning and running cell samples on a CyTOF mass cytometer. Journal of Visualized Experiments. (69), e4398 (2012).
- Finck, R., et al. Normalization of mass cytometry data with bead standards. Cytometry A. 83 (5), 483-494 (2013).
- Kotecha, N., Krutzik, P. O., Irish, J. M. Web-based analysis and publication of flow cytometry experiments. Current Protocols in Cytometry. , 17 (2010).
- Devine, R. D., Sekhri, P., Behbehani, G. K. Effect of storage time and temperature on cell cycle analysis by mass cytometry. Cytometry A. 93 (11), 1141-1149 (2018).
- Campos, L., et al. Expression of immunological markers on leukemic cells before and after cryopreservation and thawing. Cryobiology. 25 (1), 18-22 (1988).
- Kadic, E., Moniz, R. J., Huo, Y., Chi, A., Kariv, I. Effect of cryopreservation on delineation of immune cell subpopulations in tumor specimens as determinated by multiparametric single cell mass cytometry analysis. BMC Immunology. 18 (1), 6 (2017).
- Shabihkhani, M., et al. The procurement, storage, and quality assurance of frozen blood and tissue biospecimens in pathology, biorepository, and biobank settings. Clinical Biochemistry. 47 (4-5), 258-266 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved