Method Article
Количественная оценка протеома общесистемной маркировки однородность на уровне одной молекулы
В этой статье
Резюме
Здесь мы представляем протокол для оценки маркировки однородности для каждого вида белка в образце комплекс белков на уровне одной молекулы.
Аннотация
Клетки протеомов часто характеризуется с помощью электрофореза анализов, где все виды белков в клетках не специально помечены Люминесцентную краску и запятнан фотоприемник после их разъединения. Одной молекулы флуоресценции изображений может обеспечить обнаружение сверхчувствительная белка с его способностью для визуализации отдельных флуоресцентных молекул. Однако применение этого мощного изображений метода для электрофореза анализов препятствует отсутствие способов охарактеризовать однородности люминесцентные маркировки каждого вида белка через протеома. Здесь мы разработали метод оценки маркировки однородности через протеом, основанный на одной молекулы флуоресценции изображений assay. В нашей измерения, используя образец клеток HeLa, доля белков, помечены по крайней мере одна краска, которой мы «размещение маркировки» (LO), было установлено в диапазоне от 50% до 90%, поддерживая высокий потенциал применения одной молекулы изображений для анализ чувствительным и точным протеома.
Введение
Протеома анализ, который призван определить весь набор белковых молекул, выраженные в ячейке, является ценным подход в текущих биологических и медицинских исследований. Этот анализ обычно полагается на масс-спектрометрии, который идентифицирует видов белков, основанный на спектры, порожденных через белка ионизации1,2,3. Альтернативный метод для анализа протеома-электрофорез, включая электрофореза геля полиакриламида (страница), капиллярного электрофореза и двухмерные (2D) гель-электрофорез. Этот метод полагается на неспецифические люминесцентные маркировки всех белковых молекул в анализируемом клетках, следуют электрофоретического разделения и обнаружения и количественного определения каждого вида белка. Для достижения требуемых неспецифических белков маркировки, одна из стратегий заключается в использовании флуоресцентных красителей, которые могут связываться с белками через электростатический и гидрофобных взаимодействий, например Кумасси синим и рубиново-Sypro4,5,6 . Альтернативная стратегия заключается в использовании ковалентных маркировки с красителями, содержащих эфира N-оксисукцинимидного (NHS) или maleimide, который можно ковалентно связывать белков через общие остатков таких первичных аминов и тиолы, соответственно7, 8.
Тем временем чувствительность флуоресценции обнаружения идеально подходит для анализа низкой обилие протеинов и небольшое количество клеток. Одной молекулы флуоресценции изображений является одним из наиболее чувствительных методов, что позволяет обнаружения отдельных флуоресцентных красителей и обозначенные протеины в пробирке и в естественных условиях9,10,11,12, 13,14,15. Ожидается, что применение этого метода визуализации для анализа на основе электрофорез протеома включить весьма деликатного и количественных анализов, считая индивидуальных белков-дневно обозначенных. Однако остается неясным, является ли маркировки с флуоресцентными красителями достаточно однородной во всех белковых молекул, и как эта однородность зависит от видов различных белков (рис. 1). Простые решения массовых измерений могут использоваться для получения молярное соотношение флуоресцентных красителей белков под названием «муфты эффективность»8 или «маркировки эффективности», но это свойство не содержится информации о однородность маркировки среди белковых молекул.
Здесь мы описываем протокол assay расследовать маркировки однородности для всех видов белка в ячейку (рис. 2)16. Два ключевых шагов этот assay очищение протеина и изображений. На первом шаге дневно помечены всех белков в клетках и биотинилированным, затем извлекали отдельно с помощью электрофореза геля следуют electroelution. На втором шаге флуоресценции свойства отдельных белковых молекул в извлеченной образцы оцениваются на основе изображений одной молекулы. Из этих данных, параметры, важные для подсчета анализа, такие, как процент белков помечены с по крайней мере одно краситель, который мы называем маркировки размещение (LO)16, и среднее количество флуоресцентных красителей привязаны к одной белковой молекулы (n̄ краска), можно охарактеризовать. В протоколе оптимизированная процедура для маркировки клеток HeLa протеома краской NHS основе цианиновые 3 (Cy3) представлена в качестве примера и может быть изменен с другими маркировки процедур согласно желаемой исследовательских целей.
протокол
1. Подготовка клетки
- Культивировать клетки HeLa в 10 см блюдо при 37 ° C под 5% CO2 в Дульбекко модифицированная орла в среде, содержащей плода бычьим сывороточным 10%.
- Соберите экспоненциально растущей клетки, как только они достигли 70% confluency, следуя инструкциям ATCC17.
- Промойте клетки с 5 мл 1 x-фосфатный буфер (PBS) (рН 7,4). Удаление PBS.
- Добавьте 1 мл 0,1% трипсина Этилендиаминтетрауксусная кислота (ЭДТА). Инкубировать 5 минут при 37 ° C.
- Контролировать прогрессирование диссоциации клеток при микроскопии.
- После того, как клетки становятся раунд и отдельно от блюдо, добавить 4 мл среднего роста и разорвать клеток агломерации, закупорить.
- Подсчитать количество ячеек с помощью счетчик соматических клеток.
- Центрифуга на 150 x g 10 мин в пластиковых пробирок. Удалите носитель и Ресуспензируйте клетки лепешка с 5 мл 1 x PBS (рН 7,4).
- Повторите шаг 1.2.6. Ресуспензируйте клетки в однократном ПБС (рН 7,4) до конечной концентрации 106 клеток/мл с помощью граф количество на шаге 1.2.5.
Примечание: Суспензию клеток может быть aliquoted и хранятся при температуре-80 ° C в течение нескольких месяцев. Следует избегать повторения цикла замораживания/оттаивания.
2. ячейки лизис и люминесцентные маркировки
- Сделать 10 мл лизировать буфер (0,1 М Борат, лаурилсульфат натрия 1% (СДП) и 1% 20 анимации). Приспособиться к рН 12, используя 2 M NaOH.
Предупреждение: Концентрации NaOH коррозионные. Надевайте защитные перчатки и очки при подготовке этого решения.
Примечание: Лизировать буфер может храниться до одной недели при комнатной температуре. - Смесь 100 мкл лизировать буфер с 1 мкл 1 М Дитиотреитол (DTT) и 4 мкл 50% 3-[(3-cholamidopropyl) dimethylammonio] -1-propanesulfonate (главы).
- Смешайте 1 мкл клеточной культуры (приблизительно 1000 ячеек) с смешанные лизировать буфер из шага 2.2. Однородный раствор, медленно закупорить избежать пузырей. Инкубируйте в темноте при комнатной температуре на 5 мин с нежным агитации. Повторно однородный раствор, закупорить медленно.
- Добавьте 1 мкл 2 мкг/мл Cy3 ГСЗ Эстер красителя. Однородный раствор, медленно закупорить избежать пузырей. Инкубируйте 5 мин в темноте при комнатной температуре с нежным агитации.
Примечание: Высокий рН этого буфера вызывает нейтрализация остатков лизина в белках, приводит к более высокой реактивности. - Повторите Добавление 1 мкл 2 мкг/мл Cy3 ГСЗ Эстер красителя. Однородный раствор, медленно закупорить избежать пузырей. Проинкубируйте втечение 10 мин в темноте при комнатной температуре с нежным агитации.
Примечание: Это повторные добавления красителя ГСЗ Эстер может увеличить маркировки энергоэффективности, потому что некоторые из красителя Cy3 ГСЗ Эстер гидролизованный и обезвредили высоким pH буфера реакции. - Приспособиться к рН 7,2, добавив 100 мкл 0,8 м 4-(2-hydroxyethyl)-1-piperazineethanesulfonic кислота (HEPES)-NaOH рН 7,2 утолить реакции. Однородный раствор, медленно закупорить избежать пузырей.
- Добавить 20 мкл 19 мг/мл биотин-(полиэтилен гликоль (PEG))2-Амин и 5 мкл 20 мг/мл 1-этил - 3-(3-dimethylaminopropyl) Карбодиимиды (EDC). Однородный раствор, медленно закупорить избежать пузырей. Инкубируйте 1 час в темноте при комнатной температуре с нежным агитации.
Примечание: Этот шаг biotinylation необходимо исправить белковых молекул на Микроскоп coverslip на фиксированной плотности и с без смещения для видов белков. - Удаление непрореагировавшего маркировки реагентов и сконцентрировать образца с помощью столбца ультрафильтрации с 10 кДа отсечения, следуя инструкциям производителя.
Примечание: Протокол может быть приостановлена здесь. Образец может храниться при температуре-80 ° C в течение нескольких недель.
3. протеома разделения и восстановления
- Добавьте 4 x буфер образца SDS (200 мм трис-HCl рН 6,8, 4% SDS, глицерина 4% и 0,4% бромфеноловый синий).
Примечание: Чтобы избежать повреждения краски, образец протеина не должен нагреваться как в стандартных SDS-PAGE и должны храниться при комнатной температуре. - Выполнение стандартных SDS-PAGE для Образец протеина и трапом молекулярного, с использованием 20% гель акриламида. Перенести образец в гель при постоянном напряжении (160 V) до миграции фронт просто выходит из геля.
- Изображения гель для определения местоположения белка полосы (рис. 3).
- Вырежьте части гель, включая белковых фракций интерес, используя острый нож, основанный на местах группы. Фракционирование на 16, 23, 55 и 120 кДа вершины и на 19 – 25, 25-32, 32-42, 42 – 54, 54-69, 69-97, 97 – 136 и 136 – 226 кДа, регионы, показаны на рисунке 3.
- Экстракт белков с помощью диализатор, electroelution с порами размером 6-8 кДа, следуя инструкциям производителя.
Примечание: Извлеченные образец может храниться при температуре-80 ° C в течение нескольких недель.
4. Микроскоп coverslip подготовка
- Подготовка 200 мкл буфера авидин (5 мм HEPES-NaOH pH 7.2, 10 нг/мл авидином и 2 мг/мл, бычьим сывороточным альбумином (БСА)) для каждого образца.
- Подготовка coverslips 22 x 22 мм и 0,15 мм толщиной. Разоблачить coverslips воздуха с помощью плазмы чистых за 1 мин чистить и активировать их поверхности плазмы.
- Пальто coverslips с авидин, спин покрытие 200 мкл авидин буфера с помощью спин coater 5 секунд на 500 об/мин, после чего 30 секунд при 1000 об/мин. Инкубируйте coverslips 15 мин при комнатной температуре, чтобы позволить им высохнуть.
- Подготовка coverslips образец протеина.
- Разбавьте образец протеина (от 3,5) 100 раз в 5 мм HEPES-NaOH pH 7.2.
- Место 100 мкл разбавленного образца на поверхности в центре авидин покрытием coverslip (из шага 4.3).
- Инкубируйте в темноте за 15 мин при комнатной температуре.
- Подготовьте положительный контроль.
- Место 100 мкл 10 нг/мл очищенной флуоресцентные биотина в 5 мм HEPES-NaOH рН 7,2 в центре авидин покрытием coverslip (из шага 4.3).
- Инкубируйте в темноте за 15 мин при комнатной температуре.
Примечание: Этот положительный контроль coverslip обеспечивает плотность авидин точек привязки, который используется для вычисления LO.
- Подготовьте отрицательного контроля.
- Спин пальто плазменной очистки coverslip с 200 мкл 5 мм HEPES NaOH и 2 мг/мл BSA (без авидин).
- Инкубируйте 15 мин при комнатной температуре в сухом.
- Добавьте 100 мкл 10 нг/мл очищенной флуоресцентные биотина в 5 мм HEPES-NaOH pH 7.2.
- Инкубируйте в темноте за 15 мин при комнатной температуре.
Примечание: Этот отрицательный контроль coverslip обеспечивает количество привязки неспецифической флуоресцентный биотина для coverslip без авидин.
- Промойте каждый coverslip с 200 мкл дистиллированной воды, дозирование по краям coverslip, чтобы не прикоснуться к середине coverslip с наконечником. Повторите это мыть три раза.
Примечание: После аспирационных воды на coverslip, воды следует немедленно помещаться обратно на coverslip, чтобы предотвратить его от высыхания полностью. - Разоблачить воздуха плазмы на такое же количество coverslips как в шаге 4.2.
- Уборка coverslip место на coverslip образца граница с шагом 4.7, чтобы избежать высыхания.
5. наблюдение с одной молекулы микроскопии флуоресцирования
- Запустите микроскопом флуоресценции-поля или затухающих поля.
Предупреждение: Прямые или рассеянного лазерного излучения может вызвать глаз или повреждения кожи. Носите подходящие защитные очки и щит на пути света лазера.
Примечание: Для установки Микроскоп, пожалуйста, обратитесь к нашей предыдущей публикации16. Вкратце оснащен мощной 488 нм лазер возбуждения, высокая числовая апертура объектива и высокая чувствительность камеры микроскопа флуоресценции-поля или затухающих поле может использоваться для этого измерения. Кроме того для автоматического измерения, управляемая компьютером стадии трансляционная образца XY, механические шторки для лазерной возбуждений и автоматический пистолет фокус системы рекомендуется установить. - Установите coverslip на микроскопе и найти фокус.
- Выполните проверку плитки, чтобы получить по крайней мере 100 изображений.
Примечание: Лазер освещения должны контролироваться с механическими жалюзи подвергаются образца только тогда, когда записи изображения с камеры, чтобы свести к минимуму Фотообесцвечивание. Если существует множество образцов, рекомендуется автоматизированное измерение, используя компьютерную программу для управления устройствами микроскопа. Каждое изображение обычно включает в себя 100 – 500 точек одной молекулы при использовании объектива 60 x.
6. анализ и извлечение информации изображений
- Если изображение имеет неровности благодаря лазерной подсветки шаблон, осуществляют это исправить18обработки изображений.
- Приобрести эталонный образ путем измерения с образцом coverslip, состоящий из равномерно распространение красители, с помощью камеры установка же шаг 5.3.
- Приобрести смещения изображения путем измерения с без лазерного возбуждения, используя те же настройки камеры.
- Вычтите значение каждого пикселя в каждый образец изображения и изображения ссылки со значением смещения изображения.
- Разделите значение каждого пикселя в вычитается образец изображения по значению в вычитается эталонного образа.
- Собирать должным образом приобретенные изображения и удалить фон изображения.
- Удаление изображений, содержащих большие флуоресцентные агрегатов вручную.
- Удаление фонового изображения, применив алгоритм шар преткновения19 с шар радиусом 50 пикселей с помощью ImageJ20.
- Резкость изображения путем вычитания размытые изображения, используя ImageJ (резкость изображения функция).
- Найти и проанализировать одной молекулы пятна в изображениях.
- Определите места одной молекулы с21 иен алгоритм порога с помощью ImageJ.
- Фильтр пятна с менее чем два пикселей, чтобы исключить темные шум камеры и пятна более 20 пикселей, чтобы исключить агрегаты белков с помощью ImageJ (ROI менеджер).
- Подсчитать количество точек в каждом изображении. Использование освещения, исправленные изображения (шаг 6.1.4), анализа всего интенсивности пикселей для каждого пятна с помощью ImageJ.
- Вычислите маркировки размещение (LO), с использованием следующей формулы:
LO = (число отсчетов в выборке / число отсчетов в положительный контроль) x 100 - Вычислите среднее количество флуоресцентных красителей, привязаны к одной белковой молекулы (n̄краска).
- Проанализируйте гистограмму интенсивности каждого пятна.
Примечание: Гистограмма обычно имеет несколько пиков, и каждый пик представляет различное количество красителя молекул, связан с белком. Первый, второй и третий пик в гистограмме соответствует 1, 2 и 3 молекулы, соответственно. - Расчет средней интенсивности от гистограммы. Также вычислить пика интенсивности первый пик, применяя Гаусса фитинга.
- N̄краска Рассчитайте путем деления средней интенсивности с максимальной интенсивностью.
- Проанализируйте гистограмму интенсивности каждого пятна.
Результаты
Рисунок 4 представляет изображения raw данные для различных низкомолекулярных фракций белков от lysate клетки HeLa, а также положительной и отрицательной контроля. Хотя как положительные, так и образец протеина управления выставка 100 – 500 пятна на изображении, негативные элемент управления отображает ни одна или несколько пятен, показаны, что протокол достаточно подавляет неспецифической привязки красителей на coverslip поверхность. Пятно света гистограммы для образцы протеина и позитивного управления представляют несколько пиков, представляющие стохастических привязки красителей для первичных аминов в белках и авидин Тетрамер структур22, соответственно. Все пятна показан мигающий и ступенчатой Фотообесцвечивание с непрерывной лазерного возбуждения, подчеркнув наблюдения на уровне одной молекулы (Рисунок 5AB).
LO рассчитывается от отношение числа мест в каждый образец протеина, позитивного управления. Ло измеряется от lysate образец клеток HeLa, варьировались от 50% меньший молекулярный вес (16 kDa) фракции до 90% для выше молекулярный вес дроби (120 кДа) и составила 72% для всего протеома образца без разделения (рис. 6). Соответственно n̄красителя , как правило, с увеличением молекулярной массы. Эти тенденции повышения считаются происходят из-за более широкого числа остатков лизина, приводит к увеличению ГСЗ Эстер красителя привязки. Например 23 кДа фракция имеет высокое значение LO из-за большого количества остатков лизина в гистоновых белков, содержащихся в этой фракции.
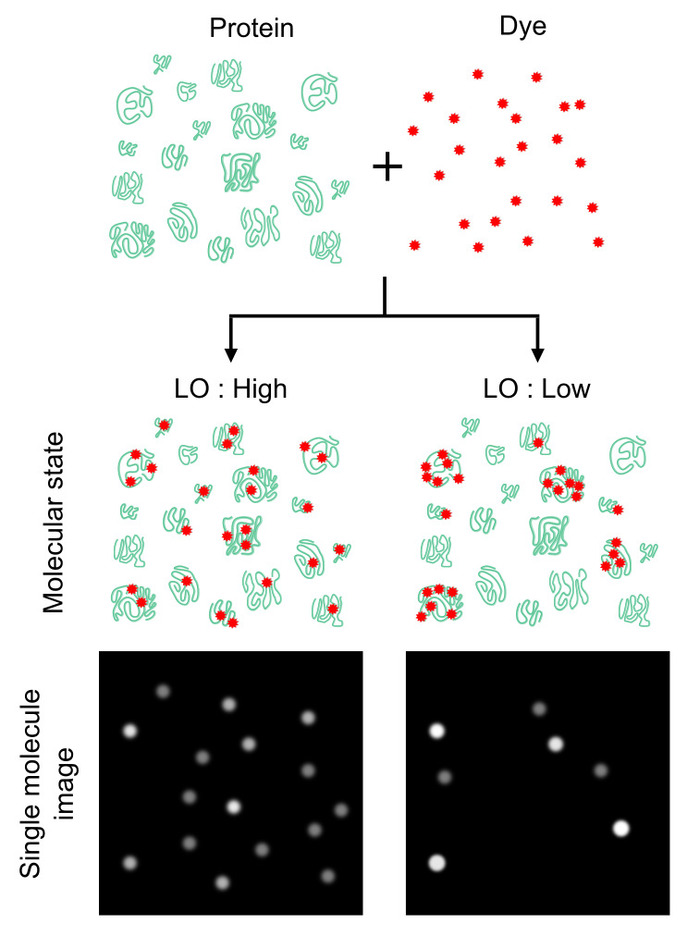
Рисунок 1: эффект протеома маркировки однородность на белок номер подсчета. Граф количество белка во многом зависит, насколько сильно и однородно помечены белковых молекул, вместо того, чтобы число соотношение белков к красителям. Однородность может быть забит с помощью параметра назвал размещение маркировки (LO), который определяет вероятность помечены белковых молекул против всего белковых молекул. Это значение обеспечивает эффективность белка подсчета (т.е. выше Ло урожайность выше количество чисел (слева) и вице-обратно (справа)). Хотя значение LO 100% идеально, Ло из < 100% может обеспечить коэффициент затухания для оценки числа абсолютным белка. Эта цифра была изменена от Леклерк et al.16 авторских 2018 американского химического общества. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: процесс Assay. Во-первых coverslips () и (b) обрабатываются авидин для достижения фиксированного плотности. Во-вторых, дневно меченых образца белки биотинилированным и придает coverslip () через взаимодействие авидин биотин. Параллельно почти 100%-дневно обозначенных очищенный биотина иммобилизованных на coverslip (b). В-третьих coverslips отражаются по микроскопии флуоресцирования сингл молекула получить номер и яркость распределение пятна флуоресценции. Наконец параметр однородности, Ло, рассчитывается из соотношения пятно чисел в (), (b). Эта цифра была изменена от Леклерк et al.16 авторских 2018 американского химического общества. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
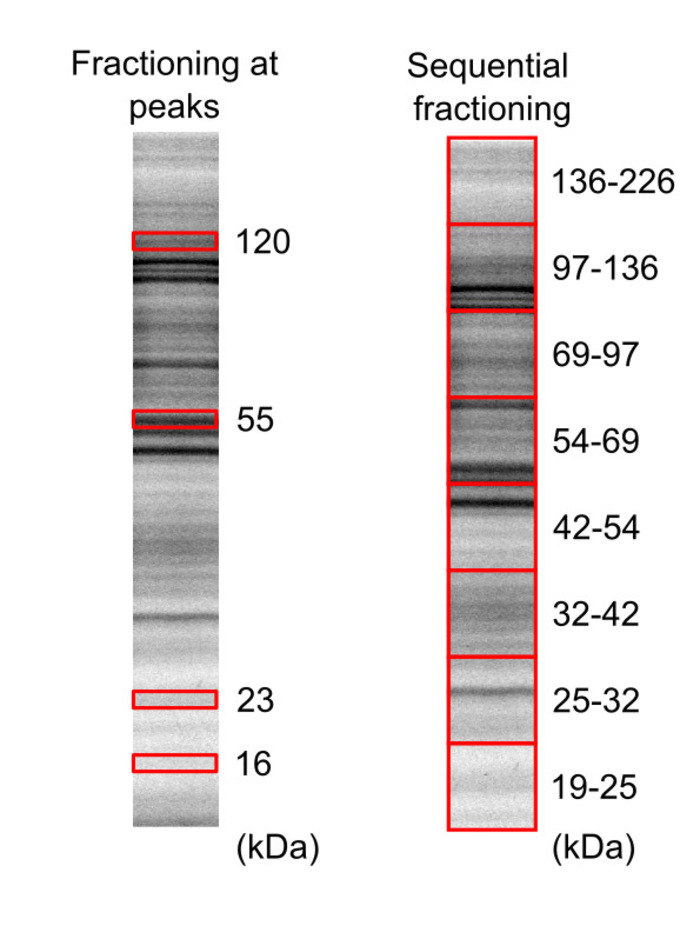
Рисунок 3: разделение клеток HeLa протеома образца с помощью SDS-PAGE. Дневно помечены lysate клетки биотинилированным были перенесены на двух различных гелях (20% акриламида) и белки, визуализируется с использованием геля зрителя, с 5 мин и 10 мин время экспозиции для гель 1 и гель 2, соответственно. Красные прямоугольники представляют гель регионов, которые были вырезать и извлечены. Эта цифра была изменена от Леклерк et al.16 авторских 2018 американского химического общества. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Одноместный молекулы изображения образцов протеома. Флуоресценции пятно изображения (слева) и гистограммы пятно света (справа), полученные из различных низкомолекулярных фракций протеома. Линейки шкалы — 10 мкм. Стрелки в положительных управления указывают различные маркировки шаг авидин. Эта цифра была изменена от Леклерк et al.16 авторских 2018 американского химического общества. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: Фотообесцвечивание флуоресцентные пятна. (A) промежуток времени изображения флуоресцентные пятна под непрерывной лазерного возбуждения. (B) время следы интенсивностью флюоресценции в разных местах. Следы показывают, либо один или два шаг Фотообесцвечивание, в о том, что соответствующие номера красителей были соединены к протеину в месте очищенный BSA образца. Эта цифра была изменена от Леклерк et al.16 авторских 2018 американского химического общества. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6: маркировки однородности выборок протеома. Ло (синий) и n̄краситель (темно-красный) получены из различных низкомолекулярных фракций. Данные выражаются как средний ± с.е., 98, 46, 27, 77, 44, 39, 62, 101, 65, 62, 82, 61 и 70 изображений были проанализированы для клеточных lysate, 16, 23, 55, 120, 19 – 25, 25-32, 32-42, 42 – 54, 54-69, 69-97, 97 – 136 и 136 – 226 кДа фракций , соответственно. Эта цифра была изменена от Леклерк et al.16 авторских 2018 американского химического общества. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Этот документ описывает протокол для количественного определения маркировки однородности каждого вида помечены белка в клетках после разделения с SDS-PAGE (шаг 3). Метод разделения может быть заменен с другими методами, такими как жидкостной хроматографии и капиллярного электрофореза, которые позволяют разделения и фракционирование клеточных белков с высоким разрешением, не требуя специального оборудования23. Обозначая метод, с помощью ГСЗ Эстер в текущий протокол могут быть заменены другими методами, например с помощью maleimide эфира или антител.
Требование в отношении маркировки анализ однородности зависит сколько маркировки отличается от простой случайный процесс, как предполагалось в анализе эффективности сцепления. Наши недавние исследования16 указано, что маркировка ГСЗ Эстер белков отходит от случайного процесса в зависимости от условий реакции рН и моющих средств. Мы отметили, что некоторые условия индуцированной неоднородность кооперативных привязки красителей белков или существование часть неактивные белки из-за неполной солюбилизация или пониженной сродство для красителя. Напротив другие условия уменьшена неоднородность полной привязкой реактивной остатков внутри белка для красителя.
Мы считаем, что рН является одним из самых влиятельных факторов на маркировке однородности. Высокий рН может привести к нейтрализации остатков лизина в белки, приводит к более высокой реактивности с красителем ГСЗ Эстер. Кроме того высокий рН может вызвать лизис клеток и может Денатурировать белки. Однако поскольку высокий рН делает отрицательный заряд белков и не подходит для некоторых экспериментов например изоэлектрической электрофореза или 2D электрофорезом, рН условие необходимо тщательно рассматривать в зависимости от цели исследования.
Чтобы точно измерить маркировки однородности в assay, важно использовать достаточно биотинилированным образец протеина. Это потому что assay предполагает, что белки связывают с насыщением каждый авидин молекулы на coverslip и недостаточно белка концентрации приводит к недооценке Ло. Наши предыдущие исследования16 показал, что обычно более 10 pg белка является необходимым для насыщенных привязки, и это может быть получен из около 1000 НеЬа клетки24, даже после ректификации. Рекомендуется создать серию разбавления образца белка для подтверждения насыщенность авидин пятна. Мы также отмечаем, что плотность авидин на coverslip может потребоваться быть оптимизированы так как не вызывают перекрытий между пятна в записанных образах, давая достаточное количество места для статистического анализа.
Этот assay предполагает, что один четырехвалентный авидин молекулы22 на coverslip можно связать один белок. Действительно положительный контроль данных в наших предыдущих исследований указали, что это одна молекула авидин можно связать до четырех дневно обозначенные biotins, но большинство (55%) авидин молекул связать только одну или две молекулы биотин. Потому что белки больше чем биотина, их их пространственной эффекты должно привести к меньше белков, привязаны к одной авидин. Наше предположение подтверждается тот факт что n̄краска остается неизменным, когда измерения смешанных образцов маркировкой и без маркировки белков в различных соотношениях16.
В зависимости от видов белков неспецифическая связывания белков в coverslip может произойти значительно даже с покрытием BSA. Если это так, одним из вариантов может быть измерить элемент управления где биотинилированным белки покрыты на coverslip без авидин, вместо флуоресцентные биотина в шаге 4.6.3. Эффект неспецифических привязки на Ло могут быть математически устранены путем вычитания числа точек данного элемента управления из этого образца протеина.
Этот протокол будет иметь неоценимое значение для протеома общесистемной сингл молекула белка подсчета анализы. Одной молекулы чувствительности позволит анализ количества белка для каждого белка видов независимо от их численности в ячейке25. Это может быть реализовано путем разделения протеома следуют количественной количество флуоресцирования пятен наряду с белков. Кроме того высокая чувствительность позволит также одну ячейку анализ, что позволяет исследователям изучить неоднородность по всей популяции клеток и сделать кластеризации сотовой связи государств25,26.
Раскрытие информации
Авторы заявляют следующие конкурирующих финансовых interest(s): RIKEN подал заявку на патент на эти результаты с с.л. и ю.ц., названный как сопредседатель изобретателей.
Благодарности
Авторы благодарят Масаэ Ohno и Нисимура Кадзуя для экспериментальной помощь и консультации. Эта работа была поддержана PRESTO (JPMJPR15F7), Япония агентство по науке и технологии, дотаций для молодых ученых (A) (24687022), сложных поисковых исследований (26650055) и научных исследований в инновационных областях (23115005), общество Японии Продвижение науки и гранты от фонда науки Такэда и Mochida Мемориальный фонд для медицинских и фармацевтических исследований. С.л. признает поддержку от программы RIKEN международной программы связать (IPA).
Материалы
| Name | Company | Catalog Number | Comments |
| 22x22x0.15 mm coverslip | VWR | 470019-004 | |
| 488 nm Argon laser | Coherent | Innova 70C | |
| 488 nm dichroic mirror | Semrock | FF495-Di03 | |
| 488 nm emission filter | Semrock | FF02-520/28 | |
| 560 nm dichroic filter | Semrock | Di02-R561 | |
| 560 nm emission filter | Semrock | FF02-617/73 | |
| 560 nm fiber laser | MBP Communications | F-04306-2 | |
| 60x oil immersion lens | Olympus | PLAPON 60x | |
| Avidin | Nacalai-tesque | 03553-64 | |
| Biotin-PEG-amine | Thermo Scientific | 21346 | |
| Biotinylated Alexa Fluor 488 | Nanocs | ||
| Borate | Nacalai-tesque | ||
| BSA | Sigma-Aldrich | A9547 | |
| CHAPS | Dojindo | C008-10 | |
| Cy3 NHS-ester dye | GE Healthcare | PA13101 | |
| Dialyzer - D-tube, 6-8 kDa | Merck Millipore | 71507-M | |
| DMEM | Sigma-Aldrich | ||
| DTT | Nacalai-tesque | 14112-94 | |
| EDC | Nacalai-tesque | ||
| EMCCD camera | Andor | IiXon 897 | |
| Epi fluorescence microscope | Olympus | IX81 | |
| Gel viewer | GE Healthcare | ImageQuant LAS 4000 | |
| Penicillin, streptomycine and Amphoterecin mix | Gibco | ||
| Plasma cleaner | Diener Electronic | ||
| SDS | Wako | NC0792960 | |
| Size purification column 10K | Merck Millipore | UFC5010 | |
| Tween 20 | Sigma-Aldrich | P9416 |
Ссылки
- Wilhelm, M., et al. Mass-spectrometry-based draft of the human proteome. Nature. 509 (7502), 582-587 (2014).
- Guo, A., et al. Immunoaffinity enrichment and mass spectrometry analysis of protein methylation. Molecular & Cellular Proteomics. 13 (1), 372-387 (2014).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- Berggren, K., et al. Background-free, high sensitivity staining of proteins in one- and two-dimensional sodium dodecyl sulfate-polyacrylamide gels using a luminescent ruthenium complex. Electrophoresis. 21 (12), 2509-2521 (2000).
- Butt, R. H., Coorssen, J. R. Coomassie blue as a near-infrared fluorescent stain: a systematic comparison with Sypro Ruby for in-gel protein detection. Molecular & cellular proteomics. 12 (12), 3834-3850 (2013).
- Nanda, J. S., Lorsch, J. R. Labeling a protein with fluorophores using NHS ester derivitization. Methods in Enzymology. , 87-94 (2014).
- Kim, Y., et al. Efficient site-specific labeling of proteins via cysteines. Bioconjugate chemistry. 19 (3), 786-791 (2008).
- Dickson, R. M., Cubitt, A. B., Tsien, R. Y., Moerner, W. E. On/off blinking and switching behaviour of single molecules of green fluorescent protein. Nature. 388 (6640), 355-358 (1997).
- Penna, A., et al. The CRAC channel consists of a tetramer formed by Stim-induced dimerization of Orai dimers. Nature. 456 (7218), 116-120 (2008).
- Ji, W., et al. Functional stoichiometry of the unitary calcium-release-activated calcium channel. Proceedings of the National Academy of Sciences of the United States of America. 105 (36), 13668-13673 (2008).
- Ulbrich, M. H., Isacoff, E. Y. Subunit counting in membrane-bound proteins. Nature Methods. 4 (4), 319-321 (2007).
- Sugiyama, Y., Kawabata, I., Sobue, K., Okabe, S. Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature Methods. 2 (9), 677-684 (2005).
- Puchner, E. M., Walter, J. M., Kasper, R., Huang, B., Lim, W. A. Counting molecules in single organelles with superresolution microscopy allows tracking of the endosome maturation trajectory. Proceedings of the National Academy of Sciences of the United States of America. 110 (40), 16015-16020 (2013).
- Grassart, A., et al. Actin and dynamin2 dynamics and interplay during clathrin-mediated endocytosis. The Journal of Cell Biology. 205 (5), 721-735 (2014).
- Leclerc, S., Arntz, Y., Taniguchi, Y. Extending Single Molecule Imaging to Proteome Analysis by Quantitation of Fluorescent Labeling Homogeneity in Complex Protein Samples. Bioconjugate chemistry. 29 (8), 2541-2549 (2018).
- Ian Freshney, R. Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , John Wiley & Sons. (2015).
- Taniguchi, Y., et al. Quantifying E. coli proteome and transcriptome with single-molecule sensitivity in single cells. Science. 329 (5991), 533-538 (2010).
- Sternberg, Biomedical Image Processing. Computer. 16 (1), 22-34 (1983).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Yen, J. C., Chang, F. J., Chang, S. A new criterion for automatic multilevel thresholding. IEEE Transactions on Image Processing. 4 (3), 370-378 (1995).
- Livnah, O., Bayer, E. A., Wilchek, M., Sussman, J. L. Three-dimensional structures of avidin and the avidin-biotin complex. Proceedings of the National Academy of Sciences of the United States of America. 90 (11), 5076-5080 (1993).
- Mostovenko, E., Hassan, C., Rattke, J., Deelder, A. M., van Veelen, P. A., Palmblad, M. Comparison of peptide and protein fractionation methods in proteomics. EuPA Open Proteomics. 1, 30-37 (2013).
- Volpe, P., Eremenko-Volpe, T. Quantitative studies on cell proteins in suspension cultures. European Journal of Biochemistry. 12 (1), 195-200 (1970).
- Huang, B., et al. Counting low-copy number proteins in a single cell. Science. 315 (5808), 81-84 (2007).
- Johnson, A. C., Bowser, M. T. H. igh- High-Speed, Comprehensive, Two Dimensional Separations of Peptides and Small Molecule Biological Amines Using Capillary Electrophoresis Coupled with Micro Free Flow Electrophoresis. Analytical Chemistry. 89 (3), 1665-1673 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены