Method Article
تحديد كمية البروتين على نطاق المنظومة وسم التجانس على مستوى جزيء واحد
In This Article
Summary
نقدم هنا، بروتوكولا لتقييم تجانس وضع العلامات لكل أنواع البروتين في عينة بروتين معقدة على مستوى جزيء واحد.
Abstract
غالباً ما تتصف بروتيوميس الخلية باستخدام فحوصات التفريد، حيث جميع الأنواع من البروتينات في الخلايا المسماة غير تحديداً مع صبغة فلورسنت ورصدت قبل فوتوديتيكتور بعد انفصالهما. تصوير fluorescence جزيء واحد يمكن أن توفر البروتين أولتراسينسيتيفي الكشف عن قدرته على تصور الأفراد الفلورسنت الجزيئات. ومع ذلك، تطبيق هذا الأسلوب التصوير قوية لفحوصات التفريد يعوقها الافتقار إلى سبل لتوصيف تجانس الفلورسنت وسم كل أنواع البروتين عبر البروتين. هنا، قمنا بتطوير أسلوب لتقييم تجانس وضع العلامات عبر البروتين استناداً مقايسة تصوير fluorescence جزيء واحد. لدينا قياس استخدام عينة خلية هيلا، نسبة البروتينات المسماة بصبغ واحد على الأقل، مما يمكننا وصف 'وسم شغل' (لو)، مصممة على مجموعة من 50% إلى 90%، إمكانات عالية لتطبيق تصوير جزيء واحد لدعم تحليل البروتين حساسة ودقيقة.
Introduction
تحليل البروتين، الذي يهدف إلى تحديد المجموعة من الجزيئات البروتينية التي أعرب عنها في الخلية بأكملها، ونهج قيمة في الدراسات البيولوجية والطبية الحالية. عادة يعتمد هذا التحليل على الكتلي، الذي يحدد أنواع البروتين استناداً إلى الأطياف التي تم إنشاؤها عن طريق البروتين التأين1،،من23. هو أسلوب بديل لتحليل البروتين الكهربي، بما في ذلك جل polyacrylamide التفريد (صفحة)، والتفريد الشعرية والتفريد هلام ثنائي الأبعاد (2D). يعتمد هذا الأسلوب على وضع العلامات الفلورية غير محددة من جميع جزيئات البروتين في خلايا تم تحليلها، يليها فصل الغرواني الكهربي والكشف والتحديد الكمي لكل أنواع البروتين. لتحقيق العلامات المطلوبة غير محددة البروتين، هو استراتيجية واحدة لاستخدام الأصباغ الفلورية الذي يمكن ربطه بالبروتينات عن طريق التفاعلات الكهرباء والماء، مثل أخذ الأزرق وسيبرو-روبي4،5،6 . هو استراتيجية بديلة لاستخدام التساهمي وسم مع الأصباغ التي تحتوي على إستر N-هيدروكسيسوكسينيميدي (NHS) أو ماليميدي، الذي يمكن ربط تساهمي البروتينات عن طريق المخلفات الشائعة مثل الأمينات الأولية وثيولس، على التوالي7، 8.
ومن ناحية أخرى، حساسية الكشف عن الأسفار مثالي لتحليل البروتينات المنخفضة-وفرة وعدد قليل من الخلايا. تصوير fluorescence جزيء واحد هو واحد من الأساليب الأكثر حساسية التي تتيح الكشف عن الأصباغ الفلورية الفردية والبروتينات المسمى في المختبر و المجراة في9،10،،من1112، 13،،من1415. ومن المتوقع تطبيق هذا الأسلوب التصوير للتحليل القائم على التفريد البروتين لتمكين فحوصات حساسة للغاية والكمية عن طريق العد الفردي البروتينات المسماة فلوريسسينتلي. ومع ذلك، فإنه لا يزال غير واضح ما إذا كان وضع العلامات مع الأصباغ الفلورية متجانسة ما يكفي عبر جميع جزيئات البروتين، وكيف يتأثر هذا التجانس في الأنواع المختلفة من البروتين (الشكل 1). قياسات حل غالبية بسيطة يمكن استخدامها للحصول على نسبة مولى من الأصباغ الفلورية للبروتينات التي تسمى 'اقتران الكفاءة'8 أو 'وسم الكفاءة'، ولكن هذه الخاصية لا توفر المعلومات على التجانس بين العلامات جزيئات البروتين.
هنا، يمكننا وصف البروتوكول المتعلق فحص للتحقيق في تجانس وضع العلامات لجميع أنواع البروتين في الخلية (الشكل 2)16. الخطوات الرئيسية اثنين من هذا التحليل هي تنقية البروتين والتصوير. في الخطوة الأولى، جميع البروتينات في الخلايا المسماة فلوريسسينتلي وبيوتينيلاتيد، ثم استخراج كل على حدة باستخدام هلام التفريد متبوعاً اليكترويلوشن. في الخطوة الثانية، يتم تقييم خصائص الأسفار من الجزيئات البروتينية الفردية في العينات المستخرجة استناداً إلى تصوير جزيء واحد. صبغ معالم هامة لتحليل عد الأصوات، مثل النسبة المئوية للبروتين المسمى مع واحد على أقل من هذه البيانات،، الذي نسميه التوسيم شغل (لو)16، ومتوسط عدد من الأصباغ الفلورية ملزمة لجزيء بروتين واحد (n̄ صبغ)، يمكن أن توصف. في البروتوكول، إجراء أمثل لوسم البروتين هيلا الخلية مع دائرة الصحة الوطنية المستندة إلى إستر صبغ Cyanine 3 (Cy3) يرد على سبيل مثال، ويمكن تعديلها مع الإجراءات الأخرى وضع العلامات وفقا للأهداف المرجوة من البحث.
Protocol
1-إعداد الخلية
- زراعة الخلايا الحلة في صحن 10 سم في 37 درجة مئوية تحت 5% CO2 في دولبيكو تعديل المتوسطة النسر التي تحتوي على 10% مصل بقرى الجنين.
- جمع الخلايا المتزايدة أضعافاً مضاعفة بمجرد أنها وصلت إلى 70% كونفلوينسي، عقب ATCC تعليمات17.
- شطف الخلايا مع 5 مل 1 × الفوسفات مخزنة المالحة (PBS) (الرقم الهيدروجيني 7.4). قم بإزالة برنامج تلفزيوني.
- أضف 1 مل حمض التربسين-الإيثيلين 0.1% (يدتا). احتضان 5 دقيقة عند 37 درجة مئوية.
- رصد تقدم تفكك الخلية بالفحص المجهري.
- حالما تصبح جولة الخلايا وهي بعيدة من الطبق، إضافة 4 مل متوسطة النمو، وكسر التكتل الخلية قبل بيبيتينج.
- حساب عدد الخلايا باستخدام عداد خلايا.
- الطرد المركزي في 150 x ز لمدة 10 دقائق في أنبوب الطرد مركزي. إزالة المتوسطة وريسوسبيند بيليه الخلية مع 5 مل من 1 x PBS (درجة الحموضة 7.4).
- كرر الخطوة 1.2.6. ريسوسبيند الخلايا في 1 x برنامج تلفزيوني (درجة الحموضة 7.4) بتركيز نهائي 106 خلايا/مل استخدام رقم حساب في الخطوة 1.2.5.
ملاحظة: تعليق خلية يمكن أن اليكووتيد والمخزنة في-80 درجة مئوية لعدة أشهر. وينبغي تجنب تكرار دورة تجميد/ذوبان الجليد.
2-خلية تفسخ ووسم نيون
- جعل 10 مل من ليسينج المخزن المؤقت (0.1 M بورات، 1% الصوديوم دوديسيل كبريتات (SDS) و 1% 20 توين). ضبط للأس الهيدروجيني 12 استخدام هيدروكسيد الصوديوم م 2.
تنبيه: هيدروكسيد الصوديوم المركزة من التآكل. ارتداء النظارات والقفازات المناسبة عند إعداد هذا الحل.
ملاحظة: يمكن تخزين المخزن المؤقت ليسينج لمدة تصل إلى أسبوع واحد في درجة حرارة الغرفة. - مزيج 100 ميكروليتر من ليسينج المخزن المؤقت مع ميكروليتر 1 من 1 م ديثيوثريتول (DTT) و 4 ميكروليتر من 50% 3-[(3-cholamidopropyl) ديميثيلامونيو]-1-بروبانيسولفوناتي (الفصول).
- ميكروليتر 1 مزيج من ثقافة الخلية (الخلايا 1,000 تقريبا) مع المخزن المؤقت ليسينج مختلطة من الخطوة 2، 2. مجانسة الحل قبل بيبيتينج ببطء لتجنب الفقاعات. احتضان في الظلام في درجة حرارة الغرفة لمدة 5 دقائق مع الانفعالات لطيف. إعادة تجانسه الحل قبل بيبيتينج ببطء.
- إضافة ميكروليتر 1 2 ميكروغرام/مل صبغة Cy3 دائرة الصحة الوطنية--إستر. مجانسة الحل قبل بيبيتينج ببطء لتجنب الفقاعات. احتضان لمدة 5 دقائق في الظلام في درجة حرارة الغرفة مع الانفعالات لطيف.
ملاحظة: درجة الحموضة العالية لهذا المخزن المؤقت يؤدي تحييد مخلفات يسين في البروتينات، مما يؤدي إلى مفاعليه أعلى. - كرر إضافة ميكروليتر 1 2 ميكروغرام/مل صبغة Cy3 دائرة الصحة الوطنية--إستر. مجانسة الحل قبل بيبيتينج ببطء لتجنب الفقاعات. احتضان لمدة 10 دقيقة في الظلام في درجة حرارة الغرفة مع الانفعالات لطيف.
ملاحظة: هذا تكرار إضافة صبغة دائرة الصحة الوطنية--إستر يمكن زيادة كفاءة وضع العلامات لأن بعض من صبغ Cy3 دائرة الصحة الوطنية--إستر تحلل وإبطال مفعولها بدرجة الحموضة العالية من رد فعل المخزن المؤقت. - ضبط للرقم الهيدروجيني 7.2 بإضافة 100 ميكروليتر من 0.8 م 4 حمض-(2-hydroxyethyl)-1-بيبيرازينيثانيسولفونيك (حبيس)-هيدروكسيد الصوديوم الهيدروجيني 7.2 إخماد رد فعل. مجانسة الحل قبل بيبيتينج ببطء لتجنب الفقاعات.
- إضافة 20 ميكروليتر من 19 مغ/مل البيوتين-(البولي إثيلين غليكول (شماعة))2-أمين وميكروليتر 5 20 ملغ/مل 1-إيثيل-3-(3-ديميثيلامينوبروبيل) كاربودييميدي (EDC). مجانسة الحل قبل بيبيتينج ببطء لتجنب الفقاعات. احتضانها ح 1 في الظلام في درجة حرارة الغرفة مع الانفعالات لطيف.
ملاحظة: هذه الخطوة بيوتينيليشن ضروري لإصلاح الجزيئات البروتينية على ساترة مجهر في كثافة ثابتة، ومع لا التحيز لأنواع البروتين. - إزالة الكواشف التوسيم الممتص وتركيز العينة باستخدام عمود ultrafiltration مع 10 قطع كاتشين، اتباع إرشادات الشركة المصنعة.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. ويمكن تخزين العينة في-80 درجة مئوية لعدة أسابيع.
3-الفصل البروتين والانتعاش
- إضافة 4 × الحزب الديمقراطي الصربي عينة المخزن المؤقت (pH 200 ملم تريس-HCl 6.8، 4% الحزب الديمقراطي الصربي، والغليسيرول 4% و 0.4% بروموفينول الأزرق).
ملاحظة: لتجنب إتلاف الصبغ، البروتين العينة لا ينبغي أن تكون ساخنة كما فعلت في الحزب الديمقراطي الصربي صفحة قياسية، وينبغي أن يوضع في درجة حرارة الغرفة. - أداء الحزب الديمقراطي الصربي صفحة قياسية للعينة البروتين وسلم جزيئية، استخدام هلام الاكريلاميد 20%. ترحيل العينة في الهلام في جهد مستمر (160 V) حتى الهجرة يخرج الجبهة مجرد الهلام.
- صورة الجل لتحديد موقع نطاقات البروتين (الشكل 3).
- قطع أجزاء هلام بما في ذلك أجزاء من البروتين من اهتمام باستخدام شفرة حادة، على أساس المواقع الفرقة. فراكتيونينج في 16 و 23، 55 و 120 من قمم كاتشين وفي كاتشين 19 – 25، 25 – 32، 32 – 42، 42 – 54، 54 – 69، 69-97، 97-136 و 136 – 226 المناطق هي هو موضح في الشكل 3.
- استخراج البروتينات استخدام دياليزير طريق اليكترويلوتيون مع حجم مسام من 6 – 8 كاتشين، اتباع إرشادات الشركة المصنعة.
ملاحظة: يمكن تخزين العينة المستخرجة في-80 درجة مئوية لعدة أسابيع.
4-المجهر إعداد ساترة
- إعداد 200 ميكروليتر من عبدين المخزن المؤقت (5 ملم حبيس-هيدروكسيد الصوديوم الهيدروجيني 7.2، 10 عبدين نانوغرام/مل و 2 ملغ/مل ألبومين المصل البقري (BSA)) لكل عينة.
- إعداد كوفيرسليبس لسمك 22 مم × 22 مم و 0.15 ملم. تعرض كوفيرسليبس للهواء البلازما باستخدام بلازما أنظف لمدة 1 دقيقة لتنظيف وتنشيط تلك السطوح.
- معطف كوفيرسليبس مع عبدين بطلاء تدور 200 ميكروليتر من عبدين المخزن المؤقت باستخدام المغطى تدور لمدة 5 ثوان 500 لفة في الدقيقة، تليها 30 ثانية 1,000 لفة في الدقيقة. احتضان كوفيرسليبس لمدة 15 دقيقة في درجة حرارة الغرفة للسماح لهم الجافة.
- إعداد كوفيرسليبس للعينة البروتين.
- تمييع عينة البروتين (من 3.5) 100 مرة في 5 مم هيبيس-هيدروكسيد الصوديوم الهيدروجيني 7.2.
- المكان 100 ميكروليتر من عينة مخففة على السطح في مركز ساترة المغلفة عبدين (من الخطوة 4، 3).
- احتضان في الظلام لمدة 15 دقيقة في درجة حرارة الغرفة.
- يعد عنصر إيجابي.
- المكان 100 ميكروليتر من 10 نانوغرام/مل تنقية البيوتين الفلورسنت في 5 مم هيدروكسيد الصوديوم حبيس الرقم الهيدروجيني 7.2 في مركز عبدين المغلفة ساترة (من الخطوة 4، 3).
- احتضان في الظلام لمدة 15 دقيقة في درجة حرارة الغرفة.
ملاحظة: هذا ساترة التحكم الإيجابي يوفر كثافة عبدين البقع ملزمة، الذي يستخدم لحساب لو.
- إعداد المراقبة السلبية.
- تنظيف تدور-معطف البلازما ساترة مع 200 ميكروليتر من 5 مم جيش صرب البوسنة حبيس-هيدروكسيد الصوديوم و 2 ملغ/مل (دون عبدين).
- احتضان لمدة 15 دقيقة في درجة حرارة الغرفة حتى تجف.
- إضافة 100 ميكروليتر من 10 نانوغرام/مل تنقية الفلورسنت البيوتين في 5 مم هيدروكسيد الصوديوم حبيس pH 7.2.
- احتضان في الظلام لمدة 15 دقيقة في درجة حرارة الغرفة.
ملاحظة: هذه المراقبة السلبية ساترة يوفر الكمية غير محددة ملزمة البيوتين الفلورية إلى ساترة دون أفيدين.
- أشطف كل ساترة مع 200 ميكروليتر من الماء المقطر قبل بيبيتينج على حواف ساترة حتى لا تتعرض للمس منتصف ساترة مع التلميح. كرر هذا يغسل ثلاث مرات.
ملاحظة: بعد يسفط على ساترة المياه، المياه يجب فورا وضع مرة أخرى على ساترة لمنعها من التجفيف شكل كامل. - كشف البلازما الجوية لنفس العدد من كوفيرسليبس كما في الخطوة 4، 2.
- ضع ساترة تنظيفها على ساترة عينة زمنياً من الخطوة 4، 7 لتجنب التجفيف.
5-المراقبة مع جزيء واحد fluorescence مجهرية
- بدء مجهر الأسفار ميدان واسع المجال أو زائل.
تنبيه: المباشرة أو إشعاع الليزر متفرقة يمكن أن يسبب العين أو الجلد الضرر. ارتداء نظارات واقية مناسبة ودرع مسار ضوء الليزر.
ملاحظة: للإعداد المجهر، يرجى الرجوع إلى موقعنا المنشور السابق16. بإيجاز، يمكن استخدام مجهر الأسفار ميدان واسع المجال أو زائل مجهزة عالية الطاقة 488 نانومتر ليزر إثارة وعدسة هدف فتحه عددية عالية وكاميرا عالية حساسية لهذا القياس. علاوة على ذلك، لقياس الآلي، ينصح بتثبيت مرحلة عينة متعدية الجنسيات تسيطر عليها الكمبيوتر س وص ومصاريع الميكانيكية للجسيمات الليزر ونظام التركيز التلقائي. - تعيين ساترة على المجهر والعثور على التركيز.
- إجراء فحص بلاط للحصول على صور على الأقل 100.
ملاحظة: ينبغي مراقبة الإضاءة الليزر مع مصاريع الميكانيكية يتعرضون للعينة فقط عند تسجيل الصور مع الكاميرا، للتقليل من فوتوبليتشينج. إذا كان هناك العديد من العينات، ينصح بالقياس الآلي باستخدام برنامج حاسوبي لمراقبة أجهزة المجهر. ويشمل كل صورة عادة 100 – 500 جزيء واحد البقع عند استخدام عدسة هدف 60 x.
6-صورة التحليل واستخراج المعلومات
- إذا كانت الصورة قد تعرج بسبب نمط الإضاءة الليزر، القيام بمعالجة الصور لتصحيح ذلك18.
- الحصول على صورة مرجعية بالقياس مع ساترة عينة تتكون من الأصباغ موحد-انتشار استخدام كاميرا الإعداد هي نفسها كما في الخطوة 5، 3.
- الحصول على صورة إزاحة عن طريق قياس مع لا الإثارة الليزر باستخدام نفس إعدادات الكاميرا.
- طرح كل قيمة بكسل في كل صورة عينة والصورة المرجعية مع قيمة إزاحة الصورة.
- تقسيم كل قيمة بكسل في الصور العينة المطروحة بالقيمة في صورة مرجعية المطروحة.
- جمع الصور المكتسبة بشكل صحيح وإزالة خلفية الصورة.
- إزالة الصور التي تحتوي على مجاميع الفلورسنت كبيرة يدوياً.
- إزالة خلفية الصورة بتطبيق خوارزمية الكرة المتداول19 مع نصف قطر كرة 50 بكسل باستخدام إيماجيج20.
- شحذ الصور عن طريق طرح الصور المموهة باستخدام إيماجيج (شحذ الصورة الدالة).
- البحث وتحليل البقع جزيء واحد في الصور.
- تحديد البقع جزيء واحد مع خوارزمية عتبة ين21 باستخدام إيماجيج.
- تصفية البقع بكسل أقل من اثنين استبعاد الضوضاء الظلام للكاميرا والبقع أكثر من 20 بكسل لاستبعاد المجموعات بروتينات باستخدام إيماجيج (إدارة العائد على الاستثمار).
- حساب عدد النقاط في كل صورة. استخدام الإضاءة الصور المصححة (الخطوة 6.1.4)، تحليل مجموع كثافات داخل وحدات البكسل لكل بقعة باستخدام إيماجيج.
- حساب شغل وضع العلامات (لو) باستخدام الصيغة التالية:
لو = (عدد من التهم الواردة في العينة/عدد من التهم الموجهة إليه في مراقبة إيجابية) x 100 - حساب متوسط عدد من الأصباغ الفلورية ملزمة لجزيء واحد من بروتين (n̄صبغ).
- تحليل الرسم بياني كثافات من كل بقعة.
ملاحظة: الرسم البياني عادة على قمم عدة، ويمثل كل ذروة عدد مختلف من جزيئات الصبغ ملزمة لبروتين. الأول، ويتوافق مع ذروة الثانية والثالثة في الرسم البياني لجزيئات 1 و 2 و 3، على التوالي. - حساب متوسط كثافة من الرسم البياني. أيضا حساب كثافة ذروة الذروة الأولى بتطبيق مناسب ضبابي.
- حساب n̄صبغ بقسمة متوسط كثافة مع كثافة الذروة.
- تحليل الرسم بياني كثافات من كل بقعة.
النتائج
ويمثل الرقم 4 بيانات الصورة الخام لكسور مختلفة الوزن الجزيئي للبروتينات من الخلية هيلا ليساتي، فضلا عن عنصر التحكم الإيجابي والسلبي. بينما عينة البروتين والإيجابية على السواء مراقبة البقع المعرض 100 – 500 كل صورة، يعرض عنصر التحكم السلبي لا شيء أو بقع قليلة، تبين أن البروتوكول بما فيه الكفاية يحول دون ربط غير محددة من الأصباغ إلى السطح ساترة. مدرجات تكرارية كثافة بقعة لعينات البروتين وعنصر التحكم الإيجابي الحالي قمم متعددة، يمثل الربط العشوائية من الأصباغ إلى الأمينات الأولية في البروتينات وهياكل avidin تيترامير22، على التوالي. وأظهرت جميع البقع فوتوبليتشينج وامض وتدريجي مع الإثارة الليزر المستمر، تسليط الضوء على المراقبة على مستوى جزيء واحد (الشكل 5 أ، ب).
لو يحسب من نسبة عدد النقاط في كل عينة البروتين لأن في مراقبة إيجابية. لو يقاس من العينة ليستي خلية هيلا تتراوح من 50% للكسر (كاتشين 16) الوزن الجزيئي الأصغر إلى 90% للكسر (120 كاتشين) الوزن الجزيئي أعلى وكان 72% للعينة البروتين كله دون فصل (الشكل 6). وفي المقابل، n̄صبغة تميل إلى زيادة مع زيادة الوزن الجزيئي. وتعتبر هذه زيادة النزعات أن تحدث نتيجة لأرقام أعلى من بقايا يسين، مما يؤدي إلى زيادة دائرة الصحة الوطنية--إستر صبغ ملزمة. على سبيل المثال، قد الكسر كاتشين 23 قيمة لو عالية بسبب الإعداد الكبيرة من مخلفات يسين في البروتينات هستون الوارد في هذا الكسر.
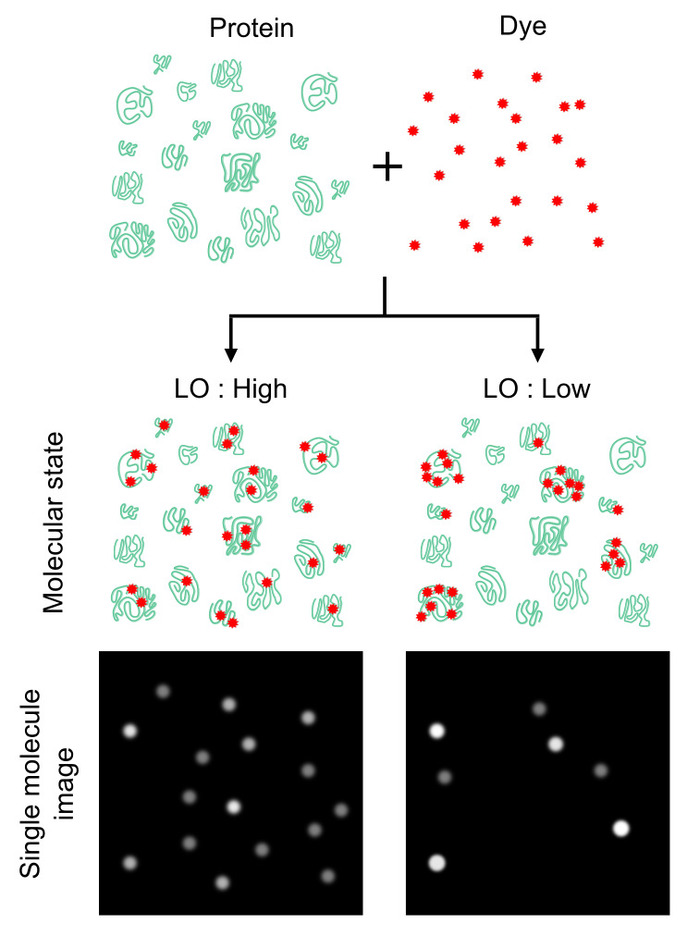
رقم 1: تأثير البروتين وسم التجانس في العد رقم البروتين. عدد العد البروتين يعتمد اعتماداً كبيرا على مدى قوة والبلوتينيوم المسمى الجزيئات البروتينية، بدلاً من نسبة عدد من البروتينات للأصباغ. يمكن سجل التجانس استخدام معلمة يسمى شغل وضع العلامات (لو)، الذي يحدد احتمال جزيئات البروتين المسمى ضد جزيئات البروتين الكلي. هذه القيمة ويوفر كفاءة البروتين العد (أي، عد لو غلات أعلى الأرقام (يسار) ونائب (يمين) بالعكس). بينما لو قيمة 100% يعد أمرا مثاليا، لو من < 100% يمكن أن توفر عامل توهين لتقدير إعداد البروتين المطلق. لقد تم تعديل هذا الرقم من لوكلير et al.16 الجمعية الكيميائية الأمريكية 2018 حقوق التأليف والنشر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 2: تحليل سير العمل. أولاً، كوفيرسليبس () و (ب) تعامل مع عبدين لتحقيق كثافة ثابتة. بروتينات العينة الثانية، والمسمى فلوريسسينتلي بيوتينيلاتيد ويعلق على ساترة () عن طريق تفاعل البيوتين عبدين. في موازاة ذلك، هو معطلة البيوتين المنقي المسمى فلوريسسينتلي 100% تقريبا في ساترة (ب). الثالث، يتم تصويرها في كوفيرسليبس قبل مجهرية fluorescence جزيء واحد للحصول على توزيع عدد وسطوع البقع الأسفار. وأخيراً، يحسب المعلمة التجانس، لو، من نسبة أرقام بقعة في () إلى أن في (ب). لقد تم تعديل هذا الرقم من لوكلير et al.16 الجمعية الكيميائية الأمريكية 2018 حقوق التأليف والنشر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
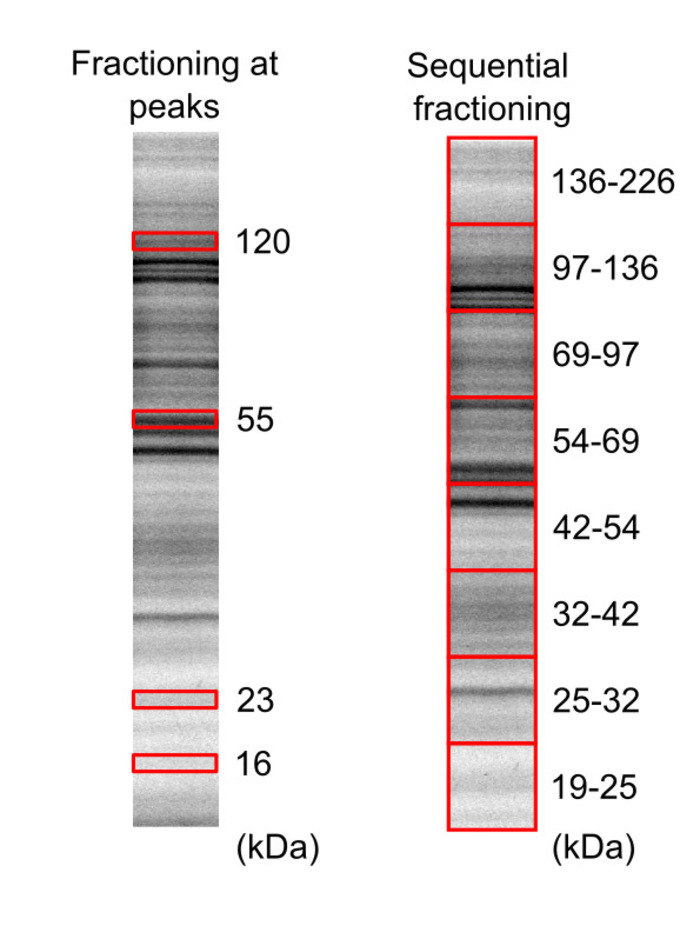
الشكل 3: الفصل بين عينة البروتين هيلا الخلية باستخدام مخزونات النشر الاستراتيجي-صفحة- المسمى فلوريسسينتلي وخلية بيوتينيلاتيد ليساتي تم ترحيلها في اثنين مختلفة المواد الهلامية (الاكريلاميد 20%)، والبروتينات التي تصور استخدام عارض هلام، مع وقت تعرض دقيقة 5 و 10 دقيقة لجل 1 وجل 2، على التوالي. مربعات حمراء تمثل جل المناطق التي تم قطع واستخراجها. لقد تم تعديل هذا الرقم من لوكلير et al.16 الجمعية الكيميائية الأمريكية 2018 حقوق التأليف والنشر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4: واحد الصور جزيء من عينات البروتين. بقعة fluorescence الصور (يسار) ورسوم بيانية من شدة بقعة (يمين) التي تم الحصول عليها من مختلف الوزن الجزيئي البروتين الكسور. شريط مقياس من 10 ميكرومتر. تشير الأسهم في مراقبة إيجابية إلى خطوة وصفها مختلفة من أفيدين. لقد تم تعديل هذا الرقم من لوكلير et al.16 الجمعية الكيميائية الأمريكية 2018 حقوق التأليف والنشر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 5: فوتوبليتشينج بقع الفلورسنت. (أ) الوقت الفاصل بين الصور البقع الفلورسنت تحت الإثارة الليزر المستمر. (ب) الوقت يتتبع من شدة الأسفار في مواقع مختلفة. وتظهر الآثار أما فوتوبليتشينج خطوة واحدة أو اثنين، تشير الأرقام الخاصة بكل منها من الأصباغ اقترنت بالبروتين في بقعة عينة جيش صرب البوسنة المنقي. لقد تم تعديل هذا الرقم من لوكلير et al.16 الجمعية الكيميائية الأمريكية 2018 حقوق التأليف والنشر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

رقم 6: وسم تجانس عينات البروتين. لو (أزرق) و n̄صبغ (أحمر داكن) تم الحصول عليها من كسور مختلفة الوزن الجزيئي. يتم التعبير عن البيانات يعني ± الصور المطران 98، 46، 27، 77، 44، 39، 62 و 101، 65، 62، 82، 61 و 70 حللت لخلية كله، 16، 23، 55، 120، 19 – 25، 25 – 32، 32 – 42، 42 – 54، 54 – 69، 69-97، 97-136 و 136-226 من الكسور كاتشين ، على التوالي. لقد تم تعديل هذا الرقم من لوكلير et al.16 الجمعية الكيميائية الأمريكية 2018 حقوق التأليف والنشر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
وتصف هذه الورقة وضع بروتوكول لتحديد مقدار تجانس وضع العلامات لكل نوع من الأنواع المسماة البروتين في الخلايا بعد الانفصال مع الحزب الديمقراطي الصربي صفحة (الخطوة 3). يمكن أن يكون محل أسلوب الفصل مع أساليب أخرى مثل كروماتوغرافيا سائلة أو التفريد الشعرية، التي تسمح بفصل وتجزئة البروتينات الخلوية بدقة عالية، بينما تتطلب معدات خاصة23. يمكن استبدال طريقة وضع العلامات باستخدام دائرة الصحة الوطنية--إستر في البروتوكول الحالي مع أساليب أخرى باستخدام ماليميدي--إستر أو الأجسام المضادة، على سبيل المثال.
الحاجة إلى وسم التحليل تجانس يعتمد على مقدار العلامات ينحرف عن عملية عشوائية بسيطة، كما يفترض في تحليل كفاءة اقتران. لدينا الدراسة الأخيرة16 أشارت إلى أن دائرة الصحة الوطنية--إستر وسم البروتينات ينحرف عن عملية عشوائية تبعاً لظروف رد فعل مثل درجة الحموضة والمنظفات. ولاحظنا أن بعض الشروط التي يسببها عدم التجانس ملزم التعاونية من الأصباغ للبروتينات أو وجود جزء صغير من البروتينات غير المتفاعلة بسبب سولوبيليزاتيون غير مكتملة أو النسب المخفضة للصبغ. على النقيض من ذلك، خفض الشروط الأخرى التغايرية بالربط الكامل من بقايا المتفاعلة داخل بروتين إلى الصبغ.
ونحن نعتبر هذا الرقم الهيدروجيني أحد العوامل الأكثر تأثيراً على تجانس وضع العلامات. يمكن أن يسبب ارتفاع درجة الحموضة تحييد مخلفات يسين في البروتينات، مما يؤدي إلى مفاعليه أعلى مع صبغ إستر دائرة الصحة الوطنية. وباﻹضافة إلى ذلك، درجة الحموضة العالية يمكن أن يحفز تحلل الخلية، ويمكن أن تؤذي البروتينات. ومع ذلك، منذ ارتفاع درجة الحموضة يجعل المسؤول عن البروتينات السلبي وهو غير مناسب لبعض التجارب مثل التفريد isoelectric أو التفريد 2D، يحتاج الشرط الأس الهيدروجيني النظر بعناية استناداً إلى الغرض من البحوث.
لقياس تجانس وضع العلامات في الفحص دقة، من المهم أن استخدام عينة البروتين بيوتينيلاتيد كافية. هذا سبب المقايسة يفترض أن البروتينات الربط مع التشبع لكل جزيء avidin ساترة، وعدم كفاية البروتين تركيز النتائج في تقدير لو. وقد أظهرت لنا الدراسة السابقة16 أن عادة أكثر من 10 بيكوغرام من البروتين ضروري لربط المشبعة، ويمكن الحصول على هذه من حوالي 1,000 خلايا هيلا24، حتى بعد تجزئة. من المستحسن لإنشاء سلسلة تمييع عينة البروتين للتأكد من تشبع البقع أفيدين. ونلاحظ أيضا أن على ساترة كثافة عبدين قد تحتاج إلى أن يكون الأمثل حتى لا تسبب التداخل بين بقع في الصور المسجلة، مع إعطاء أرقام الموضعية كافية لإجراء تحليل إحصائي.
ويفترض هذا التحليل أن أحد عبدين رباعي جزيء22 على ساترة يمكن ربط بروتين واحد. وفي الواقع، أوضحت بيانات عنصر التحكم الإيجابي في دراستنا السابقة يمكن ربط هذا الجزيء avidin واحد ليصل إلى أربعة بيوتينس المسمى فلوريسسينتلي، ولكن الأغلبية (55%) من جزيئات عبدين ربط جزيئات البيوتين واحد فقط أو اثنين. لأن البروتينات أكبر من البيوتين، ينبغي أن تؤدي آثارها الفراغية أقل البروتينات منضمة إلى عبدين واحد. لدينا افتراض يدعمه كذلك الحقيقة أن n̄صبغ يظل ثابتاً عند قياس العينات المختلطة من المسماة وغير المسماة البروتينات في نسب مختلفة16.
اعتماداً على هذه الأنواع من البروتين، قد يحدث الربط غير محدد من البروتينات ساترة إلى حد كبير حتى مع طلاء جيش صرب البوسنة. إذا كان هذا هو الحال، قد يكون خيار واحد لقياس عنصر تحكم حيث المغلفة البروتينات بيوتينيلاتيد في ساترة دون عبدين، بدلاً من البيوتين الفلورسنت في خطوة 4.6.3. يمكن القضاء أثر الملزم غير محدد على لو رياضيا بطرح عدد النقاط لعنصر التحكم هذا من أن العينة البروتين.
وسيكون هذا البروتوكول لا تقدر بثمن للبروتين على نطاق واحد-جزيء البروتين عد التحليلات. حساسية جزيء واحد سوف يسمح بتحليل لكميات البروتين لكل أنواع البروتين بغض النظر عن وفرة في الخلية25. ويمكن أن يتحقق هذا بفصل البروتين متبوعاً بالتحديد الكمي لعدد البقع fluorescence مقترنة بالبروتينات. علاوة على ذلك، حساسية عالية ستسمح أيضا تحليل خلية مفردة، تمكن الباحثين تفحص التغايرية عبر الخلية السكان والقيام بتجميع الخلوية الدول25،26.
Disclosures
الكتاب يعلن interest(s) المالية المتنافسة التالية: بتبريد قدم طلب براءة على هذه النتائج مع س. ل. و Y.T. واسمه المخترعين المشاركين.
Acknowledgements
يشكر المؤلفون أونو تغلبت ونيشيمورا كازويا للمشورة والمساعدة التجريبية. تم دعم هذا العمل من المعزوفة (JPMJPR15F7)، واليابان وكالة العلوم والتكنولوجيا، معونة للشباب العلماء (A) (24687022)، وتحدي البحوث الاستكشافية (26650055)، والبحوث العلمية في "المجالات المبتكرة" (23115005)، جمعية اليابان تعزيز العلوم، ومن المنح المقدمة من المؤسسة وتاكيدا للعلوم ومؤسسة النصب التذكاري موشيدا للبحوث الصيدلانية والطبية. س. ل. وتسلم الدعم المقدم من البرنامج بتبريد الدولي البرنامج المعاون (IPA).
Materials
| Name | Company | Catalog Number | Comments |
| 22x22x0.15 mm coverslip | VWR | 470019-004 | |
| 488 nm Argon laser | Coherent | Innova 70C | |
| 488 nm dichroic mirror | Semrock | FF495-Di03 | |
| 488 nm emission filter | Semrock | FF02-520/28 | |
| 560 nm dichroic filter | Semrock | Di02-R561 | |
| 560 nm emission filter | Semrock | FF02-617/73 | |
| 560 nm fiber laser | MBP Communications | F-04306-2 | |
| 60x oil immersion lens | Olympus | PLAPON 60x | |
| Avidin | Nacalai-tesque | 03553-64 | |
| Biotin-PEG-amine | Thermo Scientific | 21346 | |
| Biotinylated Alexa Fluor 488 | Nanocs | ||
| Borate | Nacalai-tesque | ||
| BSA | Sigma-Aldrich | A9547 | |
| CHAPS | Dojindo | C008-10 | |
| Cy3 NHS-ester dye | GE Healthcare | PA13101 | |
| Dialyzer - D-tube, 6-8 kDa | Merck Millipore | 71507-M | |
| DMEM | Sigma-Aldrich | ||
| DTT | Nacalai-tesque | 14112-94 | |
| EDC | Nacalai-tesque | ||
| EMCCD camera | Andor | IiXon 897 | |
| Epi fluorescence microscope | Olympus | IX81 | |
| Gel viewer | GE Healthcare | ImageQuant LAS 4000 | |
| Penicillin, streptomycine and Amphoterecin mix | Gibco | ||
| Plasma cleaner | Diener Electronic | ||
| SDS | Wako | NC0792960 | |
| Size purification column 10K | Merck Millipore | UFC5010 | |
| Tween 20 | Sigma-Aldrich | P9416 |
References
- Wilhelm, M., et al. Mass-spectrometry-based draft of the human proteome. Nature. 509 (7502), 582-587 (2014).
- Guo, A., et al. Immunoaffinity enrichment and mass spectrometry analysis of protein methylation. Molecular & Cellular Proteomics. 13 (1), 372-387 (2014).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- Berggren, K., et al. Background-free, high sensitivity staining of proteins in one- and two-dimensional sodium dodecyl sulfate-polyacrylamide gels using a luminescent ruthenium complex. Electrophoresis. 21 (12), 2509-2521 (2000).
- Butt, R. H., Coorssen, J. R. Coomassie blue as a near-infrared fluorescent stain: a systematic comparison with Sypro Ruby for in-gel protein detection. Molecular & cellular proteomics. 12 (12), 3834-3850 (2013).
- Nanda, J. S., Lorsch, J. R. Labeling a protein with fluorophores using NHS ester derivitization. Methods in Enzymology. , 87-94 (2014).
- Kim, Y., et al. Efficient site-specific labeling of proteins via cysteines. Bioconjugate chemistry. 19 (3), 786-791 (2008).
- Dickson, R. M., Cubitt, A. B., Tsien, R. Y., Moerner, W. E. On/off blinking and switching behaviour of single molecules of green fluorescent protein. Nature. 388 (6640), 355-358 (1997).
- Penna, A., et al. The CRAC channel consists of a tetramer formed by Stim-induced dimerization of Orai dimers. Nature. 456 (7218), 116-120 (2008).
- Ji, W., et al. Functional stoichiometry of the unitary calcium-release-activated calcium channel. Proceedings of the National Academy of Sciences of the United States of America. 105 (36), 13668-13673 (2008).
- Ulbrich, M. H., Isacoff, E. Y. Subunit counting in membrane-bound proteins. Nature Methods. 4 (4), 319-321 (2007).
- Sugiyama, Y., Kawabata, I., Sobue, K., Okabe, S. Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature Methods. 2 (9), 677-684 (2005).
- Puchner, E. M., Walter, J. M., Kasper, R., Huang, B., Lim, W. A. Counting molecules in single organelles with superresolution microscopy allows tracking of the endosome maturation trajectory. Proceedings of the National Academy of Sciences of the United States of America. 110 (40), 16015-16020 (2013).
- Grassart, A., et al. Actin and dynamin2 dynamics and interplay during clathrin-mediated endocytosis. The Journal of Cell Biology. 205 (5), 721-735 (2014).
- Leclerc, S., Arntz, Y., Taniguchi, Y. Extending Single Molecule Imaging to Proteome Analysis by Quantitation of Fluorescent Labeling Homogeneity in Complex Protein Samples. Bioconjugate chemistry. 29 (8), 2541-2549 (2018).
- Ian Freshney, R. Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , John Wiley & Sons. (2015).
- Taniguchi, Y., et al. Quantifying E. coli proteome and transcriptome with single-molecule sensitivity in single cells. Science. 329 (5991), 533-538 (2010).
- Sternberg, Biomedical Image Processing. Computer. 16 (1), 22-34 (1983).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Yen, J. C., Chang, F. J., Chang, S. A new criterion for automatic multilevel thresholding. IEEE Transactions on Image Processing. 4 (3), 370-378 (1995).
- Livnah, O., Bayer, E. A., Wilchek, M., Sussman, J. L. Three-dimensional structures of avidin and the avidin-biotin complex. Proceedings of the National Academy of Sciences of the United States of America. 90 (11), 5076-5080 (1993).
- Mostovenko, E., Hassan, C., Rattke, J., Deelder, A. M., van Veelen, P. A., Palmblad, M. Comparison of peptide and protein fractionation methods in proteomics. EuPA Open Proteomics. 1, 30-37 (2013).
- Volpe, P., Eremenko-Volpe, T. Quantitative studies on cell proteins in suspension cultures. European Journal of Biochemistry. 12 (1), 195-200 (1970).
- Huang, B., et al. Counting low-copy number proteins in a single cell. Science. 315 (5808), 81-84 (2007).
- Johnson, A. C., Bowser, M. T. H. igh- High-Speed, Comprehensive, Two Dimensional Separations of Peptides and Small Molecule Biological Amines Using Capillary Electrophoresis Coupled with Micro Free Flow Electrophoresis. Analytical Chemistry. 89 (3), 1665-1673 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved