Method Article
单分子水平标记均匀性的全蛋白质定量
摘要
在这里, 我们提出了一个协议, 以评估标签同质性的每个蛋白质物种在一个复杂的蛋白质样本在单分子水平。
摘要
细胞蛋白质组的特征通常使用电泳检测, 其中细胞中的所有种类的蛋白质都没有专门标记为荧光染料, 并在分离后被光电探测器发现。单分子荧光成像可以提供超敏感的蛋白质检测, 其能力, 可视化个别荧光分子。然而, 这种强大的成像方法在电泳检测中的应用受到了阻碍, 因为缺乏表征蛋白质组中每个蛋白质物种荧光标记的同质性的方法。在这里, 我们开发了一种基于单分子荧光成像分析的蛋白质组标记均匀性的方法。在我们使用 HeLa 细胞样本进行测量时, 用至少一种染料标记的蛋白质的比例被确定为50% 至 90%, 支持单分子成像应用于敏感而精确的蛋白质组分析。
引言
蛋白质组分析, 旨在量化在细胞中表达的整个蛋白质分子集, 是目前的生物和医学研究中的一个有价值的方法。这种分析通常依靠质谱技术, 根据通过蛋白质电离产生的光谱1,2,3来识别蛋白质物种。蛋白质组分析的另一种方法是电泳, 包括聚丙烯酰胺凝胶电泳 (PAGE)、毛细管电泳和二维凝胶电泳。这种方法依赖于分析细胞中所有蛋白质分子的非特异性荧光标记, 然后对每个蛋白质物种进行电泳分离、检测和定量。为了实现所需的非特异性蛋白质标记, 一种策略是使用荧光染料, 这些染料可以通过静电和疏水相互作用与蛋白质结合, 例如 coomassie blue 和 sypro-ruby4、5、6.另一种策略是对含有 n-羟基琥珀酰亚胺酯或马来酰亚胺的染料使用共价标记, 后者可以通过初级胺和硫醇等常见残留物与蛋白质共价结合,8。
同时, 荧光检测的灵敏度是分析低丰度蛋白质和少量细胞的理想选择。单分子荧光成像是最敏感的方法之一, 允许检测个别荧光染料和标记的蛋白质在体外和体内9, 10,11,12, 13,14,15。应用这种成像方法的电泳为基础蛋白质组分析, 预计通过计数单个荧光标记的蛋白质, 可以实现高度敏感和定量的检测。然而, 目前仍不清楚荧光染料的标记是否在所有蛋白质分子中都足够均匀, 以及不同的蛋白质种类如何影响这种同质性 (图 1)。简单的散装溶液测量可用于获得荧光染料与称为 "耦合效率" 8 或 "标记效率"的蛋白质的摩尔比, 但这一特性并不提供有关标记之间的均匀性的信息。蛋白质分子。
在这里, 我们描述了一种检测方案, 以研究细胞中所有蛋白质物种的标记同质性 (图 2)16。该检测的两个关键步骤是蛋白质纯化和成像。在第一步中, 细胞中的所有蛋白质都是荧光标记和生物素化的, 然后使用凝胶电泳然后进行电洗法提取。第二步, 在单分子成像的基础上, 对提取样品中单个蛋白质分子的荧光特性进行评价。从这些数据来看, 重要的参数对计数分析很重要, 例如用最少一种染料标记的蛋白质的百分比, 我们称之为标记占用率 (LO) 16, 以及与单个蛋白质分子结合的荧光染料的平均数量 (n~ n染料), 可以被描述。在该协议中, 以 NHS 酯为基础的氰氨酸 3 (Cy3) 染料标记 H待体细胞蛋白质组的优化程序为例, 并可根据所需的研究目标使用其他标记程序进行修改。
研究方案
1. 细胞制备
- 在杜尔贝科的改良鹰培养基中培养在37°c 以下的37厘米盘中的平底物中的平细胞, 其中含有10% 的胎儿牛血清。
- 收集指数生长的细胞, 一旦他们已经达到70% 的融合, 按照 ATCC 指令17。
- 用1毫升磷酸盐缓冲盐水 (pH 值 7.4) 冲洗细胞。删除 PBS。
- 加入1毫升0.1% 的胰蛋白酶-乙二胺四乙酸 (EDTA)。在37°c 下孵化5分钟。
- 用显微镜监测细胞离解的进展。
- 一旦细胞变得圆形并脱离盘子, 加入4毫升的生长介质, 并通过移液打破细胞聚集。
- 使用单元格计数器计数单元格数。
- 在离心管中以 150 x g 离心10分钟。取出培养基, 用 1x PBS (pH 7.4) 的5毫升重新悬浮细胞颗粒。
- 重复步骤1.2.6。使用步骤1.2.5 中的计数数将 1x PBS (pH 7.4) 中的细胞重新注入 10 6细胞的最终浓度。
注: 细胞悬浮液可在-80°c 下进行, 并储存数月。应避免重复冻融循环。
2. 细胞裂解和荧光标记
- 制备10毫升的裂解缓冲液 (0.1 M 硼酸盐、1% 十二烷基硫酸钠 (SDS) 和1% 特温 20)。使用 2m NaOH 调整至 ph 值12。
注意: 浓缩的 NaOH 具有腐蚀性。准备此解决方案时, 请佩戴合适的手套和眼镜。
注: 在室温下, 洗液缓冲液最多可以存放一周。 - 将100μl 的裂解缓冲液与1μl 的二硫代三醇 (DTT) 和4μl 的 50% 3-[(3-胆基丙基) 二甲基氨酸]-1-丙基磺酸 (CHAPS) 混合。
- 将细胞培养 (约 1, 000个细胞) 与步骤2.2 中的混合裂解缓冲液混合1Μl。通过缓慢移液使溶液同质化, 以避免气泡。在室温下在黑暗中孵化 5分钟, 搅拌温和。缓慢移液使溶液重新均质。
- 加入1μl 的 2μgml Cy3 Nhs-ster 染料。通过缓慢移液使溶液同质化, 以避免气泡。在室温下, 用温和的搅拌在黑暗中孵化5分钟。
注: 这种缓冲液的高 pH 值导致蛋白质中的赖氨酸残留物中和, 从而导致较高的反应性。 - 重复添加 1μml Cy3nhs-ster 染料1Μl。通过缓慢移液使溶液同质化, 以避免气泡。在室温下, 用温和的搅拌在黑暗中孵化10分钟。
注: 这种重复添加的 Nhs-ster 染料可以提高标记效率, 因为某些 Cy3 Nhs-ster 染料被水解并通过反应缓冲液的高 pH 值进行去除。 - 通过添加100μl 的 0.8 4-(2-羟乙基)-1-吡嗪磺酸 (HEPES)-NAOH ph 7.2 来淬火反应。通过缓慢移液使溶液同质化, 以避免气泡。
- 加入20μml 的 19 mgl 生物素-(聚乙二醇 (PEG)) 2胺和5μl 的 20Μml 1-e 1-Etl-3-(3-二甲基氨基丙基) 卡二酰亚胺 (edc)。通过缓慢移液使溶液同质化, 以避免气泡。在室温下, 用温和的搅拌在黑暗中孵化1小时。
注: 这种生物素化步骤是必要的, 以固定的密度固定在显微镜覆盖液上的蛋白质分子, 而不偏向于蛋白质物种。 - 按照制造商的说明, 取出未反应的标签试剂, 并使用带有 10 kDa 截止点的超滤柱浓缩样品。
注: 协议可以在此处暂停。样品可在-80°c 下保存数周。
3. 蛋白质组分离和恢复
- 加入 4x SDS 样品缓冲液 (200 mM Tris-HCl pH 值6.8、4% SDS、4% 甘油和0.4% 溴酚蓝)。
注: 为避免染料损坏, 蛋白质样品不应按照标准 SDS-PAGE 的要求加热, 应保持在室温下。 - 使用20% 丙烯酰胺凝胶, 对蛋白质样品和分子阶梯执行标准 SDS-PAGE。在恒定电压 (160 V) 下迁移凝胶中的样品, 直到迁移前部只退出凝胶。
- 将凝胶成像以识别蛋白质带的位置 (图 3)。
- 根据带位, 使用锋利的刀片切掉凝胶部分, 包括感兴趣的蛋白质部分。图 3显示16、23、55和 120 kda 峰以及19-25、25–32、32–42、42–54、54-69、69-97、97-136 和1362千平方公里的区域。
- 按照制造商的指示, 用孔径为 6-8 kDa 的镇静剂进行电解洗除蛋白质。
注: 提取的样品可在-80°c 下存储数周。
4. 显微镜盖板准备
- 为每个样品准备200μl 的阿维丁缓冲液 (5 mM HEPES-NaOH ph 值7.2、10 ngml l avidin 和 2 mg/mL 牛血清白蛋白 (BSA))。
- 准备22毫米 x 22 毫米和0.15 毫米厚度的盖板。使用等离子清洁剂将盖板暴露在空气等离子体中 1分钟, 以清洁和激活其表面。
- 用旋转涂布器用旋转涂布 5秒钟, 在500转/分的时候用旋转涂布将用 avidin 涂布200μl 的 avidin 缓冲液, 然后在 1, 000 转/分的时候用30秒的时间涂布。在室温下将盖板孵化 15分钟, 让它们干燥。
- 准备蛋白质样本的盖板。
- 在 5 mM HEPES-NaOH pH 7.2 中稀释蛋白样品 (3.5) 100次。
- 将稀释后的样品100Μl 放置在航空涂层盖板的中心表面 (从步骤4.3 开始)。
- 在黑暗中在室温下孵化15分钟。
- 准备积极的控制。
- 将100μml 的10ngml 纯化荧光生物素放入 5 mM HEPES-NaOH ph 7.2 中, 放在 avidin 涂层覆盖物的中心 (从步骤4.3 开始)。
- 在黑暗中在室温下孵化15分钟。
注: 此正控制覆盖液提供了航空蛋白结合点的密度, 用于计算 LO。
- 准备负控制。
- 用200μl 的 5Mm HEPES-NaOH 和 2 Mg/mM BSA (不含阿维丁) 对等离子体进行清洗。
- 在室温下孵化15分钟晾干。
- 在 5mm HEPES-NaOH ph 7.2 中加入100μl 的10Ngml 纯化荧光生物素。
- 在黑暗中在室温下孵化15分钟。
注: 此负控制盖板提供了荧光生物素与无 avidin 覆盖液的非特定结合量。
- 用200μl 的蒸馏水冲洗每个盖板, 在盖板边缘移液, 以免用尖端触摸盖板的中间。重复此清洗三次。
注: 吸气后, 水在盖板上, 应立即将水放回盖板上, 以防止其完全干涸。 - 将空气等离子体暴露在与步骤4.2 相同的覆盖件数量上。
- 将清洁后的盖板放在4.7 步的样品绑定盖板上, 以避免干燥。
5. 单分子荧光显微镜观察
- 启动广域或消失场荧光显微镜。
注意: 直接或分散的激光辐射会导致眼睛或皮肤损伤。佩戴合适的防护护目镜, 屏蔽激光路径。
注: 有关显微镜的设置, 请参阅我们以前的出版物16。简单地说, 配备大功率 488 nm 激光激发、高数值孔径物镜和高灵敏度相机的广域或消失场荧光显微镜可用于测量。此外, 对于自动测量, 建议安装计算机控制的 XY 平移样品级、用于激光激励的机械百叶窗和自动对焦系统。 - 将盖板放在显微镜上, 找到焦点。
- 执行磁贴扫描以获得至少100张图像。
注: 激光照明应使用机械百叶窗进行控制, 只有在用相机记录图像时才会暴露在样品中, 以最大限度地减少光漂白。如果有许多样品, 建议使用计算机程序自动测量显微镜设备。当使用60x 物镜时, 每个图像通常包括100–500个单分子点。
6. 图像分析和信息提取
- 如果图像由于激光照明模式而不均匀, 则进行图像处理以进行校正 18.
- 使用与步骤5.3 相同的相机设置的均匀分布染料组成的覆盖件样品进行测量, 从而获得参考图像。
- 通过使用相同的相机设置在不进行激光激发的情况下测量, 获取偏移图像。
- 用偏移图像的值减去每个示例图像和参考图像中的每个像素值。
- 将减去的示例图像中的每个像素值除以减去的参考图像中的值。
- 收集正确获取的图像并删除图像背景。
- 手动删除包含大型荧光聚合的图像。
- 通过使用 Imagej20 应用球半径为50像素的滚球算法19来删除图像背景.
- 通过使用 ImageJ (锐化图像功能) 减去模糊图像来锐化图像。
- 查找和分析图像中的单个分子点。
- 用 imagej 用 Yen 阈值算法21识别单个分子点。
- 使用 ImageJ (ROI 管理器) 筛选两个像素以下的斑点, 以排除相机的暗噪声, 并排除超过20个像素的蛋白质聚集。
- 计算每个图像中的点的数量。使用照明校正图像 (步骤 6.1.4), 使用 ImageJ 分析每个点的像素内的总强度。
- 使用以下公式计算标签占用率 (LO):
LO = (样本中的计数数/正控件中的计数数) x 100 - 计算与单个蛋白质分子 (nn 染料) 结合的荧光染料的平均数量。
- 分析每个地点的强度直方图。
注: 直方图通常有几个峰, 每个峰代表与蛋白质结合的染料分子的不同数量。直方图中的第一、第二和第三个峰分别对应1、2和3个分子。 - 计算直方图的平均强度。还可以应用高斯拟合计算第一峰的峰值强度。
- 通过将平均强度与峰值强度分开来计算染料 。
- 分析每个地点的强度直方图。
结果
图 4显示了来自 hela 细胞裂解液的蛋白质的不同分子量分数的原始图像数据, 以及正负对照。虽然蛋白质样本和阳性控制在每个图像中都表现出100-500 点, 但负控制不会显示任何点或几个点, 这表明该协议足以抑制染料与覆盖物表面的非特异性结合。蛋白质样品的点强直方图和阳性对照显示多个峰, 分别代表染料与蛋白质中的原胺的随机结合和阿维丁四聚体结构22。所有斑点均表现为连续激光激发的闪烁和逐步光漂白, 突出了单分子水平的观察 (图 5A, b)。
LO 是根据每个蛋白质样本中的斑点数与阳性对照中的斑点数之比计算得出的。从 HeLa 细胞裂解液样品中测量的 LO 从较小分子量 (16 kDa) 分数的50% 到较高分子量分数 (120 kDa) 的90% 不等, 而没有分离的整个蛋白质组样品的 lo 为 72% (图 6)。相应地,随着分子量的增加,染料也有增加的趋势。这些增加的趋势被认为是由于赖氨酸残留量增加, 导致 nhs 酯染料结合增加。例如, 23 kDa 分数具有较高的 LO 值, 因为该分数中包含组蛋白中的赖氨酸残基数量巨大。
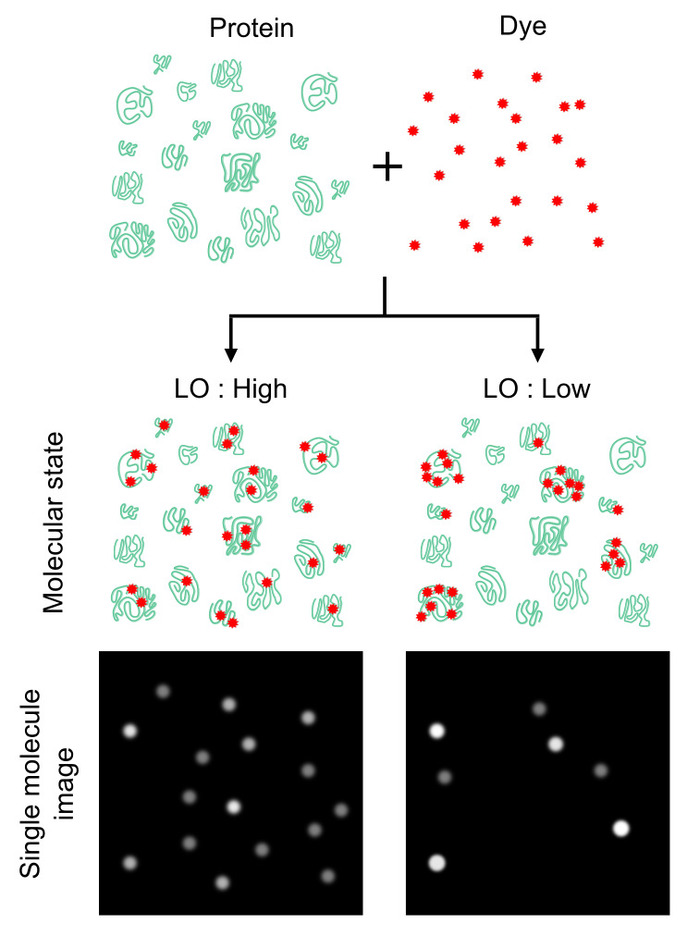
图 1: 蛋白质组标记均匀性对蛋白质数量计数的影响.蛋白质计数的数量在很大程度上取决于蛋白质分子被标记的强度和均匀程度, 而不是蛋白质与染料的数量比。同质性可以使用称为标记占用率 (LO) 的参数来评分, 该参数定义了标记蛋白质分子相对于总蛋白质分子的概率。此值提供了蛋白质计数的效率 (即, 较高的 LO 产生较高的计数数 (左), 反之亦然 (右))。虽然 LO 值100% 是理想的, 但 lo 的 LT;100% 可以为估计绝对蛋白质数量提供衰减因子。这一数字已从 Leclerc 等人16 版权所有2018年美国化学学会修改。请点击这里查看此图的较大版本.

图 2: 检测工作流.首先, 用 avidin 处理盖板 (a) 和 (b), 以达到固定的密度。其次, 荧光标记的样品蛋白是生物素化的, 并通过阿维丁-生物素相互作用附着在覆盖物 (a) 上。同时, 近100% 的荧光标记纯化生物素被固定在覆盖物 (b) 上。第三, 用单分子荧光显微镜对盖板进行成像, 得到荧光点的数量和亮度分布。最后, 均匀性参数 LO 是根据 (a) 中的点数与 (b) 中的光斑数的比率计算的。这一数字已从 Leclerc 等人16 版权所有2018年美国化学学会修改。请点击这里查看此图的较大版本.
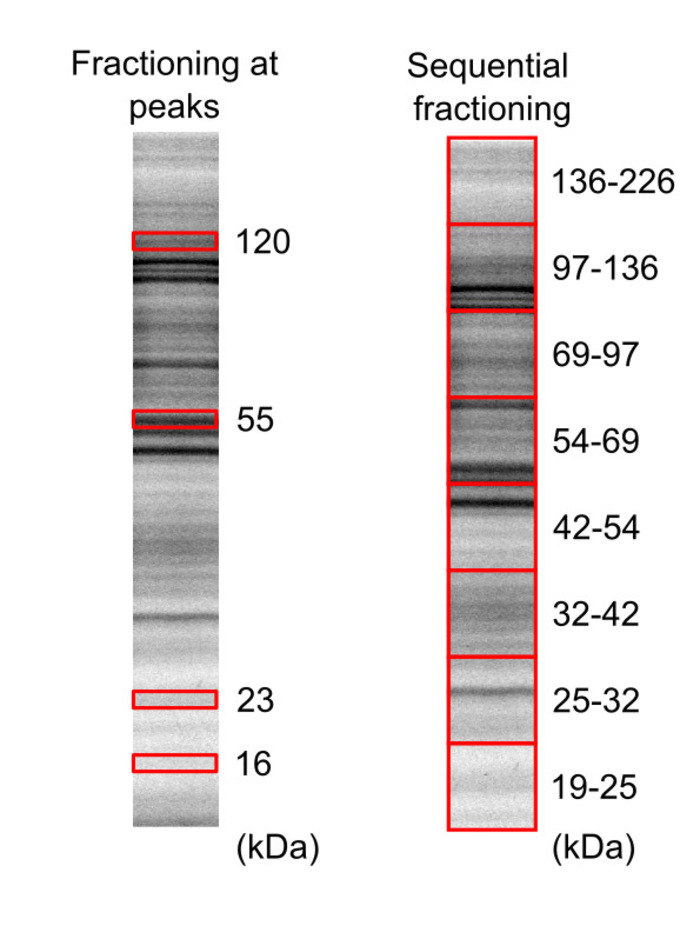
图 3: 使用 SDS-PAGE 分离平细胞蛋白体样本.荧光标记和生物素化细胞裂解液迁移到两种不同的凝胶 (20% 丙烯酰胺) 上, 蛋白质可视化使用凝胶观察器, 凝胶1和凝胶2分别有5分钟和10分钟的曝光时间。红色框表示被切割和提取的凝胶区域。这一数字已从 Leclerc 等人16 版权所有2018年美国化学学会修改。请点击这里查看此图的较大版本.

图 4: 蛋白质组样本的单分子图像.荧光点图像 (左) 和从不同分子量蛋白质组分获得的光斑强度 (右) 直方图。刻度杆为10μm。正对照中的箭头表示 avidin 的标记步骤不同。这一数字已从 Leclerc 等人16 版权所有2018年美国化学学会修改。请点击这里查看此图的较大版本.

图 5: 荧光斑点的光漂白.(A) 在连续激光激发下的荧光点延时图像。(B) 不同部位荧光强度的时间痕迹。这些痕迹显示了一步或两步光漂白, 表明在纯化的 BSA 样品点上, 相应数量的染料被耦合到蛋白质中。这一数字已从 Leclerc 等人16 版权所有2018年美国化学学会修改。请点击这里查看此图的较大版本.

图 6: 标记蛋白质组样本的均匀性.从不同分子量分数中获得 LO (蓝色) 和无染料(暗红色)。数据表示为平均值±. 例如 98, 46、27、77、44、39、62、101、65、62、82、61和70张图像分析了整个细胞裂解物、16、23、55、120、19–25、25–32、32–42、42-54、54-69、69-97、97-136 和 136-226 kDa fractions分别。这一数字已从 Leclerc 等人16 版权所有2018年美国化学学会修改。请点击这里查看此图的较大版本.
讨论
本文介绍了一种用 SDS-PAGE 分离后细胞中每个标记蛋白物种的标记同质性的量化方案 (步骤 3)。分离方法可替代其他方法, 如液相色谱或毛细管电泳, 允许分离和分馏的细胞蛋白与高分辨率, 同时需要特殊的设备23。例如, 在当前协议中使用 Nhs-ster 的标记方法可以用使用马来酰亚胺酯或抗体的其他方法取代。
标签均匀性分析的要求取决于标记在多大程度上偏离了一个简单的随机过程, 如耦合效率分析中所设想的那样。我们最近的研究16表明, Nhs-酯标记的蛋白质偏离随机过程, 这取决于反应条件, 如 ph 值和洗涤剂。我们观察到, 某些条件是通过与蛋白质合作结合染料或由于染料的不完全增溶或亲和力降低而存在一小部分非反应性蛋白质而导致异质性。相比之下, 其他条件通过将蛋白质内的反应残留物完全结合到染料中, 降低了异质性。
我们认为 ph 值是影响标签均匀性的最主要因素之一。高 pH 值可导致蛋白质中的赖氨酸残留物中和, 从而导致 Nhs-酯染料具有较高的反应性。此外, 高 pH 值可诱导细胞裂解并使蛋白质变性。然而, 由于高 pH 值使蛋白质的电荷为负, 不适合等电子电泳或二维电泳等一些实验, 因此需要根据研究目的仔细考虑 ph 值的条件。
为了精确测量检测中的标记均匀性, 使用足够的生物素化蛋白样品是非常重要的。这是因为该分析假设蛋白质与覆盖滑移上的每个 avidin 分子结合在一起, 而蛋白质浓度不足会导致对 LO 的低估。我们以前的研究16表明, 饱和结合通常需要超过10皮克的蛋白质, 即使在分馏之后, 这也可以从大约 1, 000个 hela 细胞24 中获得。建议创建一个稀释系列的蛋白质样品, 以确认阿维丁斑点的饱和度。我们还注意到, 盖板上的 avidin 密度可能需要优化, 以免导致记录图像中的点之间重叠, 同时提供足够的点号进行统计分析。
本试验假设在覆盖片上的一种四价阿维丁分子22可以结合一种蛋白质。事实上, 我们在先前的研究中的阳性控制数据表明, 一个阿维丁分子可以结合到多达四个荧光标记的生物素, 但大多数 (55%)只结合一个或两个生物素分子。由于蛋白质比生物素大, 它们的甾体效应应该会导致与一个阿维丁结合的蛋白质减少。我们的假设得到了进一步的支持, 即在测量不同比例的标记和未标记蛋白质的混合样本时,没有染料保持不变。
根据蛋白质的种类, 即使使用 BSA 涂层, 蛋白质与覆盖液的非特异性结合也可能显著发生。如果是这种情况, 一种选择可能是测量一种控制, 即生物素化蛋白被涂在没有 avidin 的盖板上, 而不是在4.6.3 的步骤中使用荧光生物素。通过从蛋白质样品中减去这种控制的斑点数量, 可以从数学上消除非特异性结合对 LO 的影响。
该方案对全蛋白质的单分子蛋白质计数分析具有重要价值。单分子敏感性将允许分析每个蛋白质物种的蛋白质数量, 而不论其在细胞 25中的丰度。这可以通过蛋白质组分离来实现, 然后对荧光斑点的数量与蛋白质结合进行量化。此外, 高灵敏度还将允许单细胞分析, 使研究人员能够检查整个细胞群的异质性, 并进行细胞状态25,26的聚类。
披露声明
作者声明了以下相互竞争的财务利益: RIKEN 已就这些结果向 s. l. 和 y. t. 被指定为共同发明人的公司提交了专利申请。
致谢
作者感谢大野正和和屋的实验协助和建议。这项工作得到了 PRESTO (JPMJPR15F7)、日本科学技术厅、青年科学家补助金 (a) (24687022)、挑战探索性研究 (26650055) 和日本信息社会创新领域科学研究 (23115005) 的支持。促进科学, 并由武田科学基金会和莫奇达医学和药物研究纪念基金会提供赠款。S. l. 感谢 RIKEN 国际项目助理 (IPA) 计划的支持。
材料
| Name | Company | Catalog Number | Comments |
| 22x22x0.15 mm coverslip | VWR | 470019-004 | |
| 488 nm Argon laser | Coherent | Innova 70C | |
| 488 nm dichroic mirror | Semrock | FF495-Di03 | |
| 488 nm emission filter | Semrock | FF02-520/28 | |
| 560 nm dichroic filter | Semrock | Di02-R561 | |
| 560 nm emission filter | Semrock | FF02-617/73 | |
| 560 nm fiber laser | MBP Communications | F-04306-2 | |
| 60x oil immersion lens | Olympus | PLAPON 60x | |
| Avidin | Nacalai-tesque | 03553-64 | |
| Biotin-PEG-amine | Thermo Scientific | 21346 | |
| Biotinylated Alexa Fluor 488 | Nanocs | ||
| Borate | Nacalai-tesque | ||
| BSA | Sigma-Aldrich | A9547 | |
| CHAPS | Dojindo | C008-10 | |
| Cy3 NHS-ester dye | GE Healthcare | PA13101 | |
| Dialyzer - D-tube, 6-8 kDa | Merck Millipore | 71507-M | |
| DMEM | Sigma-Aldrich | ||
| DTT | Nacalai-tesque | 14112-94 | |
| EDC | Nacalai-tesque | ||
| EMCCD camera | Andor | IiXon 897 | |
| Epi fluorescence microscope | Olympus | IX81 | |
| Gel viewer | GE Healthcare | ImageQuant LAS 4000 | |
| Penicillin, streptomycine and Amphoterecin mix | Gibco | ||
| Plasma cleaner | Diener Electronic | ||
| SDS | Wako | NC0792960 | |
| Size purification column 10K | Merck Millipore | UFC5010 | |
| Tween 20 | Sigma-Aldrich | P9416 |
参考文献
- Wilhelm, M., et al. Mass-spectrometry-based draft of the human proteome. Nature. 509 (7502), 582-587 (2014).
- Guo, A., et al. Immunoaffinity enrichment and mass spectrometry analysis of protein methylation. Molecular & Cellular Proteomics. 13 (1), 372-387 (2014).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- Berggren, K., et al. Background-free, high sensitivity staining of proteins in one- and two-dimensional sodium dodecyl sulfate-polyacrylamide gels using a luminescent ruthenium complex. Electrophoresis. 21 (12), 2509-2521 (2000).
- Butt, R. H., Coorssen, J. R. Coomassie blue as a near-infrared fluorescent stain: a systematic comparison with Sypro Ruby for in-gel protein detection. Molecular & cellular proteomics. 12 (12), 3834-3850 (2013).
- Nanda, J. S., Lorsch, J. R. Labeling a protein with fluorophores using NHS ester derivitization. Methods in Enzymology. , 87-94 (2014).
- Kim, Y., et al. Efficient site-specific labeling of proteins via cysteines. Bioconjugate chemistry. 19 (3), 786-791 (2008).
- Dickson, R. M., Cubitt, A. B., Tsien, R. Y., Moerner, W. E. On/off blinking and switching behaviour of single molecules of green fluorescent protein. Nature. 388 (6640), 355-358 (1997).
- Penna, A., et al. The CRAC channel consists of a tetramer formed by Stim-induced dimerization of Orai dimers. Nature. 456 (7218), 116-120 (2008).
- Ji, W., et al. Functional stoichiometry of the unitary calcium-release-activated calcium channel. Proceedings of the National Academy of Sciences of the United States of America. 105 (36), 13668-13673 (2008).
- Ulbrich, M. H., Isacoff, E. Y. Subunit counting in membrane-bound proteins. Nature Methods. 4 (4), 319-321 (2007).
- Sugiyama, Y., Kawabata, I., Sobue, K., Okabe, S. Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature Methods. 2 (9), 677-684 (2005).
- Puchner, E. M., Walter, J. M., Kasper, R., Huang, B., Lim, W. A. Counting molecules in single organelles with superresolution microscopy allows tracking of the endosome maturation trajectory. Proceedings of the National Academy of Sciences of the United States of America. 110 (40), 16015-16020 (2013).
- Grassart, A., et al. Actin and dynamin2 dynamics and interplay during clathrin-mediated endocytosis. The Journal of Cell Biology. 205 (5), 721-735 (2014).
- Leclerc, S., Arntz, Y., Taniguchi, Y. Extending Single Molecule Imaging to Proteome Analysis by Quantitation of Fluorescent Labeling Homogeneity in Complex Protein Samples. Bioconjugate chemistry. 29 (8), 2541-2549 (2018).
- Ian Freshney, R. Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , John Wiley & Sons. (2015).
- Taniguchi, Y., et al. Quantifying E. coli proteome and transcriptome with single-molecule sensitivity in single cells. Science. 329 (5991), 533-538 (2010).
- Sternberg, Biomedical Image Processing. Computer. 16 (1), 22-34 (1983).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Yen, J. C., Chang, F. J., Chang, S. A new criterion for automatic multilevel thresholding. IEEE Transactions on Image Processing. 4 (3), 370-378 (1995).
- Livnah, O., Bayer, E. A., Wilchek, M., Sussman, J. L. Three-dimensional structures of avidin and the avidin-biotin complex. Proceedings of the National Academy of Sciences of the United States of America. 90 (11), 5076-5080 (1993).
- Mostovenko, E., Hassan, C., Rattke, J., Deelder, A. M., van Veelen, P. A., Palmblad, M. Comparison of peptide and protein fractionation methods in proteomics. EuPA Open Proteomics. 1, 30-37 (2013).
- Volpe, P., Eremenko-Volpe, T. Quantitative studies on cell proteins in suspension cultures. European Journal of Biochemistry. 12 (1), 195-200 (1970).
- Huang, B., et al. Counting low-copy number proteins in a single cell. Science. 315 (5808), 81-84 (2007).
- Johnson, A. C., Bowser, M. T. H. igh- High-Speed, Comprehensive, Two Dimensional Separations of Peptides and Small Molecule Biological Amines Using Capillary Electrophoresis Coupled with Micro Free Flow Electrophoresis. Analytical Chemistry. 89 (3), 1665-1673 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。