Method Article
プロテオーム的分類の単一分子レベルでの均一性の定量化
要約
ここでは、単一分子レベルの複雑な蛋白質のサンプルのそれぞれのタンパク質種のラベリングの均質性を評価するためのプロトコルを提案する.
要約
細胞のプロテオームは細胞内蛋白質のすべての種が非具体的蛍光染料と分類され、次の彼らの分離器によって斑点を付けられる電気泳動法の試金を使用して頻繁に特徴付けられます。単一分子蛍光イメージングは、個々 の蛍光分子を可視化するための能力を超高感度タンパク質検出を提供できます。ただし、この強力なイメージング法の電気泳動の試金への応用はプロテオームの間でそれぞれの蛋白質種の蛍光標識の均一性を特徴付ける方法の欠乏によって妨げられます。ここでは、単一分子蛍光イメージング法に基づくプロテオームのラベリングの均質性を評価する方法を開発しました。HeLa 細胞サンプル、我々 は '占有ラベル' と呼ばれる少なくとも 1 つの色素の付いたタンパク質の割合を使用して私たちの測定 (LO)、決定された範囲に 50% から 90%、サポートする単一分子イメージングの応用の可能性が高いから高感度・高精度のプロテオーム解析。
概要
セルで表されるタンパク質分子の全体セットを定量化することを目的としたプロテオーム解析は、現在の生物学的および薬効がある研究の貴重なアプローチです。この分析は、よくタンパク質イオン1,2,3を介して生成されたスペクトルに基づく蛋白質種を識別する質量に依存します。プロテオーム解析の方法として、ポリアクリルアミドゲル電気泳動 (ページ) を含む電気泳動、キャピラリー電気泳動、二次元 (2 D) ゲルの電気泳動。このメソッドは、非固有電気泳動分離と検出および各蛋白質種の定量化分析の細胞のすべてのタンパク質分子の蛍光標識に依存します。必要な非特異的タンパク質ラベリングを実現、1 つの戦略はブルーと可視ルビー4,5,6 などの静電場と疎水性相互作用によるタンパク質に結合することができます蛍光染料を使用するには.代替戦略 N ヒドロキシスクシンイミド (NHS) エステルまたはマレイミド、第一級アミン、チオールなど一般的な残基をタンパク質に結合することができます共有、それぞれ7,を含む染料で共有結合性ラベリングを使用することです。8。
一方、蛍光検出の感度は、低豊富なタンパク質と細胞の小さな数字の分析に最適です。単一分子蛍光イメージングは個々 の蛍光染料と in vitro 試験および in vivo9,10、11,12、分類された蛋白質の検出を可能にする最も敏感な方法の一つです。 13,14,15。このイメージング法の電気泳動を用いたプロテオーム解析への応用は、個々 の蛍光標識したタンパク質をカウントすることにより高感度・定量的アッセイを有効にする予定です。ただし、不明のままかどうか蛍光染料と分類は十分なすべての蛋白質分子の間で、種のタンパク質 (図 1) は、この均質性の影響について。単純なバルク溶液測定を使用して、'結合効率'8または 『 効率をラベリング 』 と呼ばれるタンパク質に蛍光染料のモル比を取得できますが、このプロパティ間ラベルの均質性に関する情報は提供しません蛋白質分子。
ここでは、セル (図 2)16のすべての蛋白質種のラベリングの均質性を調査するための試金のためのプロトコルについて述べる。この試金の 2 つの手順では、蛋白質の浄化およびイメージング。最初のステップで、細胞のすべてのタンパク質を蛍光に分類し、ビオチン化、個別に電気泳動を使用して得られる electroelution が続きます。2 番目の手順では、単一分子イメージングに基づく抽出サンプル中の個々 のタンパク質分子の蛍光特性が評価されます。このデータからタンパク質の割合が少なくとも 1 つ付いたようカウント分析の重要なパラメーターを染める、これラベリング占有 (LO)16と呼んで、蛍光染料の平均数は単一のタンパク質分子にバインド (n̄色素)、特徴付けることができます。プロトコルでは、NHS エステル系シアニン 3 (Cy3) 染料と HeLa 細胞のプロテオームの分類のための最適化されたプロシージャは、例として提示し、希望する研究の目標によると他のラベルの手順で変更できます。
プロトコル
1. セル準備
- 37 ° C で 10 cm 皿に HeLa 細胞を養う 5% 未満ダルベッコの CO2のイーグル培地 10% 牛胎児血清を含む、変更されました。
- 70% の confluency、次の ATCC 手順17に達したら、指数関数的に成長のセルを収集します。
- リン酸緩衝生理食塩水 (PBS) (pH 7.4) x 1 の 5 mL の細胞をすすいでください。PBS を削除します。
- 0.1% トリプシン エチレンジアミン四酢酸 (EDTA) の 1 つの mL を追加します。37 ° C で 5 分間加温します。
- 顕微鏡による細胞解離の進行を監視します。
- 細胞は円形になるし、皿から切断されて、成長培地 4 mL を追加し、ピペッティングにより細胞の集積を破る。
- 細胞カウンターを使用してセルの数をカウントします。
- 150 x gで 10 分間遠心管中で遠心分離機します。メディアを削除し、5 ml の 1x PBS (pH 7.4) の細胞ペレットを再懸濁します。
- 1.2.6 のステップを繰り返します。1 × PBS (pH 7.4) 106セル/mL ステップ 1.2.5 でカウント数を使用しての最終濃度に細胞を再懸濁します。
注: 細胞懸濁液は、数ヶ月間、避けようと-80 ° C で保存されますを使用できます。フリーズ/フリーズ解除の繰り返しは避けてください。
2. 細胞の換散および蛍光標識
- 10 mL の溶解バッファーを作る (1%、1% ドデシル硫酸ナトリウム (SDS) 0.1 M ホウ酸トゥイーン 20)。12 2 M NaOH を使用して pH を調整します。
注意: 濃水酸化ナトリウムは腐食性です。このソリューションを準備するときは、適切な手袋、メガネを着用します。
注: 最大 1 週間室温で溶解バッファーを格納できます。 - 溶解バッファーを 1 M ジチオトレイトール (DTT) の 1 μ l と 4 のミックス 100 μ L の 50 %3 [(3-cholamidopropyl) dimethylammonio μ L]-1-propanesulfonate (チャップス)。
- ステップ 2.2 から混合 lysing バッファーを持つ細胞培養 (約 1,000 セル) のミックス 1 μ L。泡を避けるためにゆっくりとピペッティングによるソリューションを均質化します。穏やかな攪拌を 5 分間室温で暗闇の中で孵化させなさい。ゆっくりとピペッティングによるソリューションを再均質化します。
- 2 μ g/mL 色素 Cy3 NHS エステルの 1 μ L を追加します。泡を避けるためにゆっくりとピペッティングによるソリューションを均質化します。穏やかな攪拌と室温で暗闇の中で 5 分間インキュベートします。
注意: このバッファーの高い pH は高い反応性につながるタンパク質のリジン残基の中和を引き起こします。 - 2 μ g/mL 色素 Cy3 NHS エステルの 1 μ L 添加を繰り返します。泡を避けるためにゆっくりとピペッティングによるソリューションを均質化します。穏やかな攪拌と室温で暗闇の中で 10 分間インキュベートします。
注: これは、Cy3 NHS エステル色素の一部は加水分解、反応バッファーの高 pH が非アクティブに NHS エステル色素添加がラベル付けの効率を増やすことができます繰り返し。 - 4-(2-hydroxyethyl)-1-piperazineethanesulfonic 酸 (HEPES) 0.8 M の 100 μ L の追加によって ph 7.2 調整-NaOH pH 7.2 反応を抑制します。泡を避けるためにゆっくりとピペッティングによるソリューションを均質化します。
- 19 mg/mL ビオチン-(ポリエチレング リコール (PEG))2の 20 μ L を追加-アミン及び 20 mg/mL 1 の 5 μ L-エチル - 3-(3-dimethylaminopropyl) カルボジイミド (EDC)。泡を避けるためにゆっくりとピペッティングによるソリューションを均質化します。穏やかな攪拌と室温で暗闇の中で 1 時間インキュベートします。
メモ: このビオチン化ステップ固定密度と蛋白質種の顕微鏡観察でタンパク質分子を修正する必要が。 - 未反応ラベリング試薬を削除し、限外濾過カラムを用いた 10 kDa カットオフ、製造元の指示に従ってサンプルを集中します。
注: プロトコルはここで一時停止することができます。サンプルは数週の間-80 ° C で保存できます。
3. プロテオームの分離・回収
- SDS のサンプルバッファー (200 mM トリス塩酸 pH 6.8, 4 %sds、4% のグリセロールと 0.4% ブロモフェノール ブルー) x 4 を追加します。
注: 染料の損傷を避けるためには、蛋白質のサンプルは標準の SDS-PAGE で加熱しないと室温で保管する必要があります。 - 蛋白質のサンプルの 20% アクリルアミド ゲルを使用して分子ラダー標準 SDS ページを実行します。サンプルの移行移行までの定電圧 (160 V) でゲルでフロントだけゲルで終了します。
- タンパク質バンド (図 3) の場所を識別するためにゲルをイメージします。
- バンドの場所に基づいて、鋭い刃を使用して興味の蛋白を含むゲル部分をカットします。16、23、55、および 120 kDa のピーク、19-25、25-32、32-42、42-54、54-69、69-97、97-136、136-226 kDa の領域は、図 3に示すため。
- 製造元の指示に従って、6-8 kDa の孔径の electroelution でダイアライザーを使用して蛋白質を抽出します。
注: 抽出されたサンプルは-80 ° C で数週間保存できます。
4. 顕微鏡 coverslip の準備
- 各サンプルのアビジン バッファー (5 mM HEPES NaOH pH 7.2, 10 ng/mL アビジンと 2 mg/mL ウシ血清アルブミン (BSA)) の 200 μ L を準備します。
- 22 × 22 mm と 0.15 mm 厚の coverslips を準備します。空気をきれいにし、表面をアクティブにする 1 分クリーナー プラズマを用いたプラズマ coverslips を公開します。
- アビジン バッファー 1,000 rpm で 30 秒続く、500 rpm で 5 秒間スピン塗布装置を使用してスピン コーティング 200 μ l アビジンと coverslips のコート。Coverslips 乾燥させる、室温で 15 分間を、インキュベートします。
- 蛋白質のサンプルの coverslips を準備します。
- 5 mM HEPES NaOH ph 7.2 (3.5) から蛋白質のサンプル 100 倍に希釈します。
- (ステップ 4.3) からアビジン coverslip の中心に表面の希釈サンプルの場所 100 μ L。
- 暗闇のなか 15 分間室温でインキュベートします。
- 肯定的な制御を準備します。
- 場所 100 μ L 10 ng/mL の精製 (ステップ 4.3) から 5 mM HEPES NaOH pH 7.2 アビディンのセンターでコーティングされた coverslip で蛍光ビオチンです。
- 暗闇のなか 15 分間室温でインキュベートします。
注意: この肯定的な制御 coverslip 提供アビジンの密度バインディング スポット、LO を計算するものです。
- ネガティブ コントロールを準備します。
- スピンコート、プラズマ洗浄を 5 mM HEPES NaOH と 2 mg/mL BSA (アビジン) なしの 200 μ l coverslip。
- 乾燥するために室温で 15 分間インキュベートします。
- 5 mM HEPES NaOH ph 7.2 10 ng/mL 精製蛍光ビオチン 100 μ L を追加します。
- 暗闇のなか 15 分間室温でインキュベートします。
注: このネガティブ コントロール coverslip 蛍光ビオチンにアビジンなし coverslip の非特異的結合の量を提供します。
- ピペットの先端とカバーガラスの真ん中をタッチしないようにカバーガラスの端で 200 μ L の純水で各 coverslip をすすいでください。この洗浄を 3 回繰り返します。
注: 上、水を吸引後水必要がありますすぐに戻され完全に乾くことを防ぐために coverslip。 - 空気プラズマ coverslips ステップ 4.2 のように同じ数を公開します。
- 乾燥を防ぐためのステップ 4.7 からサンプル バインド coverslip のきれいにされた coverslip を配置します。
5. 単一分子蛍光顕微鏡による観察
- 広視野またはエバネッ セント フィールド蛍光顕微鏡を起動します。
注意: 直接または散乱レーザー放射は目が発生したり、皮膚障害。適切な保護メガネを着用し、レーザー光路を保護します。
注: 顕微鏡のセットアップ私たちの以前の文書16を参照してください。簡単に言えば、ハイパワー 488 nm レーザー励起、高開口数の対物レンズと高感度カメラ搭載ワイド フィールドまたはエバネッ セント フィールド蛍光顕微鏡は、この測定に使用できます。さらに、自動測定、コンピューター制御 XY 並進サンプル ステージ、レーザー励起の機械的なシャッター、オート フォーカスのシステムをインストールする推奨。 - 顕微鏡、coverslip を設定し、フォーカスを見つけます。
- 少なくとも 100 のイメージを取得するタイル スキャンを実行します。
注: レーザー照射は、退色を最小限に抑えるため、カメラで画像を記録するときだけサンプルにさらされる機械式シャッターの制御する必要があります。多くのサンプルがある場合自動測定顕微鏡デバイスを制御するコンピュータ プログラムを使用をお勧めします。60 倍対物レンズを使用する場合、各画像は通常 100-500 単一分子スポットを含まれます。
6. 画像解析と情報抽出
- イメージにレーザー照射パターンのムラがある場合は、イメージの18はそれを修正する処理を実行します。
- 設定ステップ 5.3 と同じカメラを使用して均一に広がり色素で構成される coverslip のサンプルを測定することにより、参照イメージを取得します。
- オフセット イメージを取得するには、同じカメラ設定を使用していないレーザー励起による測定します。
- オフセット イメージの値を持つすべてのサンプル画像とその参照画像の各ピクセル値を減算します。
- 控除参照イメージの値で減算サンプル画像の画素の値を分割します。
- 正しく取得した画像を収集し、画像の背景を削除します。
- 手動で大きな蛍光凝集体を含む画像を削除します。
- 画像の背景を削除するには、ローリング ボール法19 ImageJ20を使用して 50 ピクセルの球の半径を適用します。
- ImageJ を用いた画像のぼやけを減算することによって画像をシャープ (シャープ イメージ関数)。
- 検索して画像の単一分子スポットを分析します。
- 円しきい値アルゴリズム21 ImageJ を用いた単一分子のスポットを識別します。
- スポット ImageJ (ROI マネージャー) を使用して蛋白質の集計を除外するよりも 20 ピクセル カメラやスポットの暗騒音を除外するよりも小さい 2 つのピクセルをフィルター処理します。
- 各画像のスポットの数をカウントします。修正された画像 (6.1.4 ステップ)、分析照明を使用して合計すべてのスポットのピクセル内強度 ImageJ を用いたします。
- 次の数式を使用してラベリング占有 (LO) を計算します。
LO = (サンプル内のカウント数/肯定的な制御のカウント数) x 100 - 単一のタンパク質分子 (n̄色素) にバインドされている蛍光色素の数の平均値を計算します。
- すべてのスポットの強度のヒストグラムを分析します。
メモ: ヒストグラムは通常いくつかのピークを持って、すべてのピークはタンパク質と結合する色素分子の個数が異なるを表します。まず、ヒストグラムの 2 番目と 3 番目のピークがそれぞれ 1、2、3 の分子に対応します。 - ヒストグラムから平均強度を計算します。またガウスのフィットを適用することによって最初のピークのピーク強度を計算します。
- N̄色素を計算する、ピーク強度と平均強度を割る。
- すべてのスポットの強度のヒストグラムを分析します。
結果
図 4は、正と負のコントロールと同様に、HeLa 細胞の lysate からの蛋白質の分子量の異なる分数の raw 画像データを表します。蛋白質のサンプルとポジティブの両方は、画像ごとの 100-500 の展示スポットを制御、ネガティブ コントロールはどれもまたは coverslip の表面に十分に染料の非特異的結合が阻害するようにプロトコルを示すいくつかのスポットを表示します。蛋白質のサンプルと肯定的な制御のためのスポット強度ヒストグラムは、それぞれタンパク質のアビジン四量体構造22アミンへの染料の確率のバインディングを表す複数のピークを紹介します。すべてのスポットを示した連続レーザー励起、(図 5 a, B) の単一分子レベルでの観察を強調表示点滅と段階的フォトブリーチを行なった。
LO は、肯定的な制御をすべての蛋白質のサンプルのスポットの数の比率から計算されます。LO は、高い分子量 (120 kDa) 割合の 90% に 50% より小さい分子 (16 kDa) 分画からであった HeLa 細胞ライセート サンプルから測定し、(図 6) を分離することがなく全体のプロテオーム サンプル 72% であった。同様に、 n̄染料は、分子量の増加とともに増加する傾向があった。増加の NHS エステルにつながる、リジン残基の高い数のため発生する傾向の増加これら考慮されるバインディングを染めます。たとえば、23 kDa の分画は、この画分に含まれるヒストン蛋白質のリジン残基の多数のため高い LO 値を持ちます。
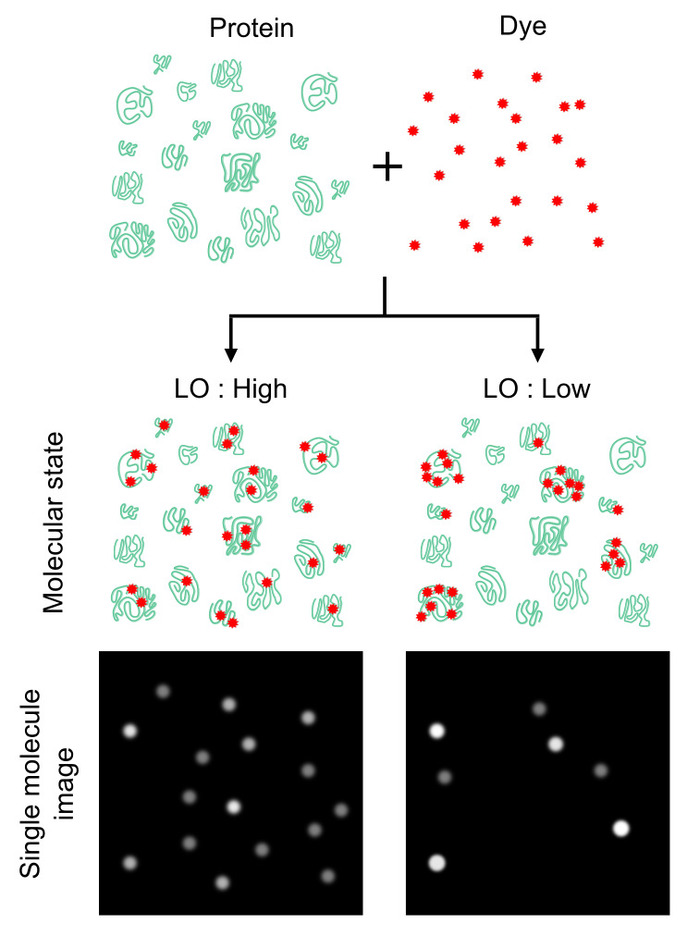
図 1: プロテオーム タンパク質数カウントで均質性をラベリングの効果。タンパク質数は依存度がどの程度強く、均一色素タンパク質の数の比ではなく、タンパク質分子が表されます。均一性は、総蛋白分子に対する分類された蛋白質分子の確率を定義しますラベリング占有率 (LO) と呼ばれるパラメーターを使用して得点することができます。この値は、タンパク質のカウントの効率を提供します (すなわち、LO 歩留まり高いカウント数字 (左) と副逆 (右))。100% のロー値が理想的な LO の < 100% は絶対タンパク質数算定減衰係数を提供することができます。この図は、ルクレールら16著作権 2018年アメリカ化学協会から変更されています。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 試金ワークフロー 。まず、coverslips (、) と (b) は、固定の密度を達成するためにアビジンと扱われます。第二に、蛍光標識したサンプル蛋白質ビオチン、アビジン-ビオチン相互作用を介して coverslip (、) に接続されています。並行して、ほぼ 100% 蛍光標識精製ビオチンが上、(b) 固定化します。第三に、蛍光スポットの数と明るさの分布を取得する単一分子蛍光顕微鏡による、coverslips が作成されます。最後に、LO、均質性パラメーターは (b) に (、) のスポット数比から計算されます。この図は、ルクレールら16著作権 2018年アメリカ化学協会から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
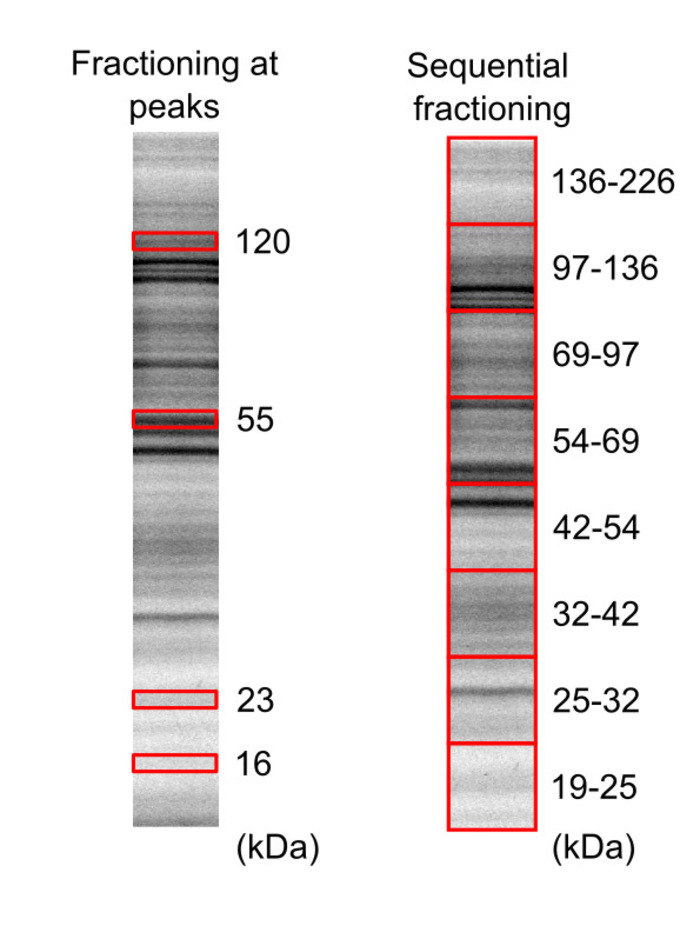
図 3: SDS ページを用いた HeLa 細胞プロテオーム サンプルの分離します。蛍光ラベルしビオチン標識細胞ライセートが 2 つの異なるゲル (20% アクリルアミド) に移行されたとの 5 分、10 分の露光時間でゲル ビューアーを用いて可視化する蛋白質ゲルの 1 と 2 をそれぞれゲルします。赤いボックスは、カットされ、抽出ゲル領域を表します。この図は、ルクレールら16著作権 2018年アメリカ化学協会から変更されています。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 単一のプロテオーム サンプルの分子イメージ。蛍光は、イメージ (左) と分子量の異なるプロテオーム留分から得られる (右) スポットの強度のヒストグラムを見つけます。スケール バーは、10 μ m です。肯定的な制御の矢印は、アビジンの異なるラベリング手順を示します。この図は、ルクレールら16著作権 2018年アメリカ化学協会から変更されています。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 蛍光スポットのフォトブリーチング。(A) 連続レーザー励起蛍光スポットのコマ撮り画像。(B) 時間を別のスポットでの蛍光強度のトレースします。トレースは、いずれか 1 つまたは二段階退色、精製された BSA のサンプルのスポットで蛋白質に結合された染料のそれぞれの数字を示すを表示します。この図は、ルクレールら16著作権 2018年アメリカ化学協会から変更されています。この図の拡大版を表示するのにはここをクリックしてください。

図 6: プロテオーム サンプルの均質性をラベリングします。LO (青) とn̄色素(濃い赤) 分子量の異なる画分から得られました。平均 ± 東南 98、46、27 カ国、77、44、39、62、101、65、62、82、61、70 の画像データを表現する、全細胞ライセート、分析を行った 16、23、55、120、19-25、25-32、32-42、42-54、54-69、69-97、97-136、136-226 kDa の分画、それぞれ。この図は、ルクレールら16著作権 2018年アメリカ化学協会から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
本稿では、SDS-PAGE (ステップ 3) を分離した後の分類された蛋白質種のセルのラベルの均質性を定量化するためのプロトコルについて説明します。分離法は、分離と23特別な装置を必要としながら高解像度の細胞蛋白質の分別を許可する液体クロマトグラフィーやキャピラリー電気泳動などの他の方法で置き換えることが。現在のプロトコルの NHS エステルを使用してラベリング法は、たとえばマレイミド エステルや抗体を使用して他の方法で置き換えることができます。
等質性分析を分類するための要件は、カップリング効率解析で想定されている簡単なランダムなプロセスから逸脱量ラベルに依存します。私たちの最近の研究16は、pH や洗剤などの反応条件によってランダムなプロセスから逸脱する蛋白質の NHS エステル分類を示されます。いくつかの条件がタンパク質に染料の協同的結合または不完全な可溶化や色素のため低親和性のための非反応性タンパク質の分画の存在による不均質を誘発を見ました。対照的に、その他の条件は、色素タンパク質内活性残基の完全なバインドによる不均質を減少します。
PH は、ラベリングの均質性に関する最も影響力のある要因の 1 つと考えています。高い pH は、NHS エステル染付高反応性につながるタンパク質のリジン残基の中和を可能性があります。さらに、高 pH はセル換散を引き起こすことができるおよび蛋白質を変化できます。ただし、高 pH、蛋白質の電荷を負等電点電気泳動、二次元電気泳動などのいくつかの実験には適していませんので、pH 条件は研究目的に応じて慎重に検討する必要があります。
アッセイのラベリングの均質性を正確に測定するには、十分なビオチン化タンパク質サンプルを使用することが重要です。これは試金は蛋白質を彩度のすべてアビジン分子観察と LO の過小評価の不十分なタンパク質濃度の結果にバインドすると前提としています。私たちの以前の研究16は、通常タンパク質の以上 10 pg が飽和結合に必要、これは分別後も約 1,000 の HeLa 細胞の24から取得できますを示しています。アビジン スポットの彩度を確認する蛋白質のサンプルの希釈系列を作成することをお勧めします。我々 はまた、coverslip のアビジン密度がなく発生する統計解析の十分な番号を与えている間、記録された画像にスポットが重なるので最適化する必要があります注意してください。
その一つにこの試金の前提としています価アビジン分子22上は一つの蛋白質をバインドできます。確かに、私たちの以前の研究では陽性対照データはアビジン分子を 1 つは、最大 4 つの蛍光に分類された biotins が大半 (55%) にバインドすることを示されるアビジン分子の 1 つまたは 2 つのビオチン分子をバインドします。ビオチンより大きい蛋白質であるため立体効果の少ないタンパク質アビジンの 1 つにバインドされている必要があります。私たちの仮定は事実によってサポートされてさらにラベル、縦横比の異なる16でタンパク質をラベルの混合試料を測定するとき、 n̄染料が一定します。
タンパク質種に応じて、coverslip に蛋白質の非特異的結合を大幅 BSA コーティングでも発生する可能性があります。この場合、1 つのオプションがありますコントロールを測定するステップ 4.6.3 で蛍光のビオチンの代わりにアビジンなし coverslip のビオチン化タンパク質をコーティングする場所。LO の非特異的結合の影響は蛋白質のサンプルのこのコントロールのスポットの数を減算することによって数学的に排除できます。
このプロトコルはプロテオーム的分子タンパク質解析のカウントのために貴重になります。単一分子感度セル25で豊かさに関係なくすべての蛋白質種の蛋白質量の分析になります。これは、蛋白質と結合した蛍光スポット数の数量化によるプロテオーム分離によって実現できます。さらに、感度の高いまた単一細胞解析、細胞集団間の多様性を調べる研究を有効にすることが可能し、25,26の状態は携帯のクラスタ リングを行う。
開示事項
著者宣言次競合金融利益のため: 理研が SL の共同発明者として名前を保とこれらの結果を特許出願を提出します。
謝辞
著者らは、実験の支援やアドバイスを大野雅恵と西村和哉をありがとうございます。この作品は、さきがけ (JPMJPR15F7)、日本科学技術振興機構、若い科学者 (A) (24687022)、挑戦的萌芽研究 (26650055)、革新的な領域 (23115005) 会科学研究費補助金に支えられ医療・創薬研究の推進学と武田科学財団持田記念財団からの補助金によって。S. l. は、理化学研究所国際プログラムに関連付ける (IPA) プログラムからのサポートを認めています。
資料
| Name | Company | Catalog Number | Comments |
| 22x22x0.15 mm coverslip | VWR | 470019-004 | |
| 488 nm Argon laser | Coherent | Innova 70C | |
| 488 nm dichroic mirror | Semrock | FF495-Di03 | |
| 488 nm emission filter | Semrock | FF02-520/28 | |
| 560 nm dichroic filter | Semrock | Di02-R561 | |
| 560 nm emission filter | Semrock | FF02-617/73 | |
| 560 nm fiber laser | MBP Communications | F-04306-2 | |
| 60x oil immersion lens | Olympus | PLAPON 60x | |
| Avidin | Nacalai-tesque | 03553-64 | |
| Biotin-PEG-amine | Thermo Scientific | 21346 | |
| Biotinylated Alexa Fluor 488 | Nanocs | ||
| Borate | Nacalai-tesque | ||
| BSA | Sigma-Aldrich | A9547 | |
| CHAPS | Dojindo | C008-10 | |
| Cy3 NHS-ester dye | GE Healthcare | PA13101 | |
| Dialyzer - D-tube, 6-8 kDa | Merck Millipore | 71507-M | |
| DMEM | Sigma-Aldrich | ||
| DTT | Nacalai-tesque | 14112-94 | |
| EDC | Nacalai-tesque | ||
| EMCCD camera | Andor | IiXon 897 | |
| Epi fluorescence microscope | Olympus | IX81 | |
| Gel viewer | GE Healthcare | ImageQuant LAS 4000 | |
| Penicillin, streptomycine and Amphoterecin mix | Gibco | ||
| Plasma cleaner | Diener Electronic | ||
| SDS | Wako | NC0792960 | |
| Size purification column 10K | Merck Millipore | UFC5010 | |
| Tween 20 | Sigma-Aldrich | P9416 |
参考文献
- Wilhelm, M., et al. Mass-spectrometry-based draft of the human proteome. Nature. 509 (7502), 582-587 (2014).
- Guo, A., et al. Immunoaffinity enrichment and mass spectrometry analysis of protein methylation. Molecular & Cellular Proteomics. 13 (1), 372-387 (2014).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- Berggren, K., et al. Background-free, high sensitivity staining of proteins in one- and two-dimensional sodium dodecyl sulfate-polyacrylamide gels using a luminescent ruthenium complex. Electrophoresis. 21 (12), 2509-2521 (2000).
- Butt, R. H., Coorssen, J. R. Coomassie blue as a near-infrared fluorescent stain: a systematic comparison with Sypro Ruby for in-gel protein detection. Molecular & cellular proteomics. 12 (12), 3834-3850 (2013).
- Nanda, J. S., Lorsch, J. R. Labeling a protein with fluorophores using NHS ester derivitization. Methods in Enzymology. , 87-94 (2014).
- Kim, Y., et al. Efficient site-specific labeling of proteins via cysteines. Bioconjugate chemistry. 19 (3), 786-791 (2008).
- Dickson, R. M., Cubitt, A. B., Tsien, R. Y., Moerner, W. E. On/off blinking and switching behaviour of single molecules of green fluorescent protein. Nature. 388 (6640), 355-358 (1997).
- Penna, A., et al. The CRAC channel consists of a tetramer formed by Stim-induced dimerization of Orai dimers. Nature. 456 (7218), 116-120 (2008).
- Ji, W., et al. Functional stoichiometry of the unitary calcium-release-activated calcium channel. Proceedings of the National Academy of Sciences of the United States of America. 105 (36), 13668-13673 (2008).
- Ulbrich, M. H., Isacoff, E. Y. Subunit counting in membrane-bound proteins. Nature Methods. 4 (4), 319-321 (2007).
- Sugiyama, Y., Kawabata, I., Sobue, K., Okabe, S. Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature Methods. 2 (9), 677-684 (2005).
- Puchner, E. M., Walter, J. M., Kasper, R., Huang, B., Lim, W. A. Counting molecules in single organelles with superresolution microscopy allows tracking of the endosome maturation trajectory. Proceedings of the National Academy of Sciences of the United States of America. 110 (40), 16015-16020 (2013).
- Grassart, A., et al. Actin and dynamin2 dynamics and interplay during clathrin-mediated endocytosis. The Journal of Cell Biology. 205 (5), 721-735 (2014).
- Leclerc, S., Arntz, Y., Taniguchi, Y. Extending Single Molecule Imaging to Proteome Analysis by Quantitation of Fluorescent Labeling Homogeneity in Complex Protein Samples. Bioconjugate chemistry. 29 (8), 2541-2549 (2018).
- Ian Freshney, R. Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , John Wiley & Sons. (2015).
- Taniguchi, Y., et al. Quantifying E. coli proteome and transcriptome with single-molecule sensitivity in single cells. Science. 329 (5991), 533-538 (2010).
- Sternberg, Biomedical Image Processing. Computer. 16 (1), 22-34 (1983).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Yen, J. C., Chang, F. J., Chang, S. A new criterion for automatic multilevel thresholding. IEEE Transactions on Image Processing. 4 (3), 370-378 (1995).
- Livnah, O., Bayer, E. A., Wilchek, M., Sussman, J. L. Three-dimensional structures of avidin and the avidin-biotin complex. Proceedings of the National Academy of Sciences of the United States of America. 90 (11), 5076-5080 (1993).
- Mostovenko, E., Hassan, C., Rattke, J., Deelder, A. M., van Veelen, P. A., Palmblad, M. Comparison of peptide and protein fractionation methods in proteomics. EuPA Open Proteomics. 1, 30-37 (2013).
- Volpe, P., Eremenko-Volpe, T. Quantitative studies on cell proteins in suspension cultures. European Journal of Biochemistry. 12 (1), 195-200 (1970).
- Huang, B., et al. Counting low-copy number proteins in a single cell. Science. 315 (5808), 81-84 (2007).
- Johnson, A. C., Bowser, M. T. H. igh- High-Speed, Comprehensive, Two Dimensional Separations of Peptides and Small Molecule Biological Amines Using Capillary Electrophoresis Coupled with Micro Free Flow Electrophoresis. Analytical Chemistry. 89 (3), 1665-1673 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved