Method Article
פרוטאום ברוחב כימות של תיוג הומוגניות ברמת מולקולה בודדת
In This Article
Summary
כאן, אנו מציגים פרוטוקול כדי להעריך את ההומוגניות תיוג עבור כל המינים חלבון במדגם חלבונים מורכבים ברמת מולקולה בודדת.
Abstract
תא proteomes מאופיינים לעיתים קרובות באמצעות מבחני אלקטרופורזה, שבו כל המינים של חלבונים בתאי מסומנים בכיתוב הלא ספציפית הפלורסנט, הם הבחינו מאת photodetector בעקבות הפירוד שלהם. מולקולה בודדת פלורסצנטיות הדמיה יכולים לספק זיהוי חלבונים העדינה יכולתה להמחשת מולקולות בודדות פלורסנט. עם זאת, היישום של שיטת הדמיה עוצמה אלקטרופורזה מבחני היא הקשו על ידי חוסר של דרכים כדי לאפיין את ההומוגניות של תיוג פלורסנט של כל מיני חלבונים על פני פרוטאום. . הנה, פיתחנו שיטה כדי להעריך את ההומוגניות תיוג פרוטאום בהתבסס על assay הדמיה קרינה פלואורסצנטית מולקולה בודדת. במדידה שלנו באמצעות מדגם הלה תא, היחס של חלבונים עם צבע אחד לפחות, שבו אנחנו כינה 'תיוג תפוסה' תוויות (לו), היה נחוש בדעתו טווח של 50% ל 90%, תומך הפוטנציאל הגבוה של היישום מולקולה בודדת הדמיה כדי ניתוח פרוטאום רגיש ומדויק.
Introduction
פרוטאום ניתוח, שמטרתו לכמת את כל סידרת מולקולות חלבון הביע בתא, היא גישה יקר במחקרים עדכניים ביולוגי ורפואי. ניתוח זה נפוץ מסתמך על ספקטרומטר מסה, אשר מזהה מינים חלבון מבוסס על הספקטרום שנוצר באמצעות חלבון יינון1,2,3. שיטה חלופית לניתוח פרוטאום הוא אלקטרופורזה, כולל לזיהוי בג'ל (עמוד), נימי אלקטרופורזה דו-ממדית בג'ל (2D). שיטה זו מתבססת על תיוג פלורסנט שאינם ספציפיים של כל מולקולות חלבון בתאים שנותחה, ואחריו electrophoretic ההפרדה, זיהוי, כימות של כל מיני חלבונים. כדי להשיג חלבון שאינם ספציפיים נדרש תיוג, אסטרטגיה אחת היא להשתמש צבעי פלורסנט ניתן לאגד חלבונים באמצעות אינטראקציות הידרופוביות אלקטרוסטטית, כגון כחול Coomassie ועברית4,5,6 . אסטרטגיית חלופית היא להשתמש תיוג קוולנטיות עם צבעי המכיל N-hydroxysuccinimide (NHS) אסתר או maleimide, אשר באפשרותך לאגוד covalently חלבונים באמצעות משקעים נפוצות כגון אמינים העיקרי תיולים, בהתאמה7, 8.
בינתיים, הרגישות של זיהוי קרינה פלואורסצנטית הינו אידיאלי עבור ניתוח נמוכה-שפע חלבונים מספר קטן של תאים. מולקולה בודדת פלורסצנטיות הדמיה היא אחת מהשיטות הרגישים ביותר המאפשר זיהוי הפרט צבעי פלורסנט, שכותרתו חלבונים חוץ גופית ו ויוו9,10,11,12, 13,14,15. היישום של שיטת ההדמיה מבוססת-אלקטרופורזה פרוטאום ניתוח צפוי לאפשר מבחני רגישה מאוד ומלאת כמותיים על ידי ספירת חלבונים בודדים עם התווית fluorescently. עם זאת, עדיין לא ברור תיוג עם צבעי פלורסנט היא הומוגנית מספיק על פני כל מולקולות חלבון, ואת ההשפעה הומוגניות זו על ידי חלבונים שונים מינים (איור 1). מדידות פתרון פשוט בצובר יכול לשמש כדי לקבל יחס טוחנת של צבעי פלורסנט כדי הנקרא "צימוד יעילות"8 או 'תיוג יעילות', אך מאפיין זה אינו מספק מידע על אחידות בין תיוג מולקולות חלבון.
כאן, אנו מתארים את פרוטוקול assay לחקור את ההומוגניות תיוג עבור כל המינים חלבון בה תא (איור 2)16. שני השלבים המפתח הזה assay הם הדמיה וטיהור חלבונים. בשלב הראשון, כל החלבונים בתאים מסומנות fluorescently, biotinylated, ואז חילוץ בנפרד באמצעות אלקטרופורזה בג'ל ואחריו electroelution. בשלב השני, קרינה פלואורסצנטית המאפיינים של מולקולות חלבון בודדים הדגימות שחולצו מוערכים בהתבסס על הדמיה מולקולה בודדת. מנתוני הזה, לצבוע פרמטרים חשובים לניתוח ספירה, כגון אחוז חלבונים המסומנת אחד לפחות, אשר אנו קוראים תפוסה (LO) תיוג16, המספר הממוצע של צבעי פלורסנט מאוגדים מולקולה של חלבון יחיד (n̄ צבע), ניתן לאפיין. בפרוטוקול, שגרת ממוטב עבור תיוג של פרוטאום הלה תא עם צבע 3 Cyanine (Cy3) המבוסס על אסתר NHS מוצג בתור דוגמה, שניתן יהיה לשנותה באמצעות הליכים אחרים תיוג בהתאם ליעדי המחקר הרצוי.
Protocol
1. תא הכנה
- לטפח הלה תאים בצלחת 10 ס מ- 37 מעלות צלזיוס מתחת 5% CO2 ב- Dulbecco המתואמת של בינוני הנשר המכיל 10% סרום שור בעובר.
- איסוף תאים גדל אקספוננציאלית, ברגע שהם הגיעו 70% confluency, בעקבות ההוראות בקרת האוויר17.
- לשטוף תאים עם 5 מ של 1 x buffered פוספט תמיסת מלח (PBS) (pH 7.4). הסר PBS.
- להוסיף 1 מ"ל של 0.1% טריפסין-ethylenediaminetetraacetic חומצה (EDTA). דגירה 5 דקות ב 37 º C.
- לעקוב אחר ההתקדמות של דיסוציאציה התא על ידי מיקרוסקופ.
- ברגע תאים יתעגל תלושים מתוך קערה, להוסיף 4 מיליליטר מדיום הגידול, לשבור את הצטברות תאים על-ידי pipetting.
- לספור את מספר תאים באמצעות מונה התא.
- צנטריפוגה ב x 150 גר' 10 דקות בתוך שפופרת צנטרפוגה. הסר את המדיום, resuspend בגדר תא עם 5 מ ל x 1 PBS (pH 7.4).
- חזור על שלב 1.2.6. Resuspend התאים ב- PBS 1 x (pH 7.4) כדי ריכוז סופי של 106 תאים למ"ל באמצעות ספירת מספר בשלב 1.2.5.
הערה: התליה תא ניתן aliquoted מאוחסנת ב-80 מעלות צלזיוס למשך מספר חודשים. חוזר מחזור ההקפאה/ההפשרה יש להימנע.
2. התא פירוק תיוג פלורסנט
- להפוך את 10 מ"ל של lysing מאגר (0.1 M בוראט, 1% dodecyl נתרן גופרתי (מרחביות) ו- 1% Tween 20). התאם ל pH 12 באמצעות 2 M NaOH.
זהירות: NaOH מרוכזת היא מאכל. ללבוש כפפות מתאימים וכוסות בעת הכנת פתרון זה.
הערה: ניתן לאחסן מאגר Lysing לשבוע עד אחד בטמפרטורת החדר. - מיקס 100 μL של lysing מאגר עם μL 1 של 1 מ' dithiothreitol (DTT) ו- 4 μL של dimethylammonio 3-[(3-cholamidopropyl) 50%]-1-propanesulfonate (בחורים).
- לערבב 1 μL של התרבות תאים (כ-1,000 תאים) עם המאגר lysing מעורבות של שלב 2.2. Homogenize את הפתרון על-ידי pipetting באיטיות כדי למנוע בועות. דגירה בחושך בטמפרטורת החדר במשך חמש דקות עם עצבנות עדין. Homogenize מחדש את הפתרון על-ידי pipetting לאט.
- להוסיף 1 μL של 2 μg/mL Cy3 NHS-אסתר לצבוע. Homogenize את הפתרון על-ידי pipetting באיטיות כדי למנוע בועות. תקופת דגירה של 5 דקות בחושך בטמפרטורת החדר עם עצבנות עדין.
הערה: ה-pH גבוה של מאגר זה גורם ניטרול של ליזין שאריות חלבונים, המוביל תגובתיות גבוהה יותר. - חזור על התוספת של 1 μL של 2 μg/mL Cy3 NHS-אסתר לצבוע. Homogenize את הפתרון על-ידי pipetting באיטיות כדי למנוע בועות. תקופת דגירה של 10 דקות בחושך בטמפרטורת החדר עם עצבנות עדין.
הערה: זה חזר על תוספת של צבע NHS-אסתר יכול להגביר את היעילות תיוג כי חלק לצבוע Cy3 NHS-אסתר הידרוליזה ולא לבטל את הפעלתם באמצעות ה-pH גבוה של המאגר התגובה. - להסתגל pH 7.2 על-ידי הוספת μL 100 של 0.8 מ'-(2-hydroxyethyl)-1-piperazineethanesulfonic 4 חומצה (HEPES)-NaOH pH 7.2 כדי להרוות את התגובה. Homogenize את הפתרון על-ידי pipetting באיטיות כדי למנוע בועות.
- הוסף 20 μL של 19 מ"ג/מ"ל ביוטין-(פוליאתילן גליקול (PEG))2-אמין, μL 5 של 20 מ"ג/מ"ל 1-אתיל - 3-(3-dimethylaminopropyl) carbodiimide (EDC). Homogenize את הפתרון על-ידי pipetting באיטיות כדי למנוע בועות. תקופת דגירה של h 1 בחושך בטמפרטורת החדר עם עצבנות עדין.
הערה: שלב זה biotinylation יש צורך לתקן את מולקולות חלבון על coverslip מיקרוסקופ צפיפות קבועה, עם הטייה לזן חלבון. - להסיר unreacted ריאגנטים תיוג ולרכז את הדגימה באמצעות עמודת אולטראפילטרציה עם ניתוק kDa 10, ההוראות של היצרן.
הערה: הפרוטוקול אפשר לעצור כאן. ניתן לאחסן את הדגימה ב-80 מעלות צלזיוס למשך מספר שבועות.
3. פרוטאום ההפרדה ושחזור
- להוסיף 4 x מרחביות דוגמת המאגר (200 מ"מ טריס-HCl pH 6.8, 4% מרחביות, גליצרול 4% ו- 0.4% bromophenol כחול).
הערה: כדי למנוע נזק לצבוע, המדגם חלבון צריך לא להיות מחומם כפי שנעשה מרחביות-דף רגיל, יש להשאירו בטמפרטורת החדר. - לבצע מרחביות-דף רגיל עבור המדגם חלבון וסולם מולקולרית, באמצעות ג'ל אקרילאמיד 20%. להעביר את הדגימה הג'ל על מתח קבוע (160 V) עד ההעברה הקדמי פשוט יוצא את הג'ל.
- תמונה של הג'ל כדי לזהות את המיקום של הלהקות חלבון (איור 3).
- גוזרים את החלקים ג'ל כולל שברים חלבון עניין בעזרת סכין חדה, בהתבסס על המיקומים הלהקה. Fractioning 16, 23, 55 ו 120 kDa פסגות, ובבית kDa 19-25, 25-32, 32-42, 42 – 54, 54 – 69, 69 – 97, 97 – 136 ו 136 – 226 האזורים מוצגים באיור3.
- תמצית חלבונים באמצעות dialyzer של electroelution עם גודל הנקבוביות של 6-8 kDa, ההוראות של היצרן.
הערה: המדגם שחולצו ניתן לאחסן ב-80 מעלות צלזיוס למשך מספר שבועות.
4. מיקרוסקופ coverslip הכנה
- להכין μL 200 אבידין מאגר (5 מ מ HEPES-NaOH pH 7.2, 10 ננוגרם למ"ל אבידין ו- 2 מ"ג/מ"ל אלבומין שור (BSA)) עבור כל דגימה.
- להכין coverslips של 22 מ"מ x 22 מ"מ ו- 0.15 מ מ עובי. לחשוף את coverslips מהאוויר פלזמה באמצעות מסך פלזמה המנקה 1 דקות לנקות ולהפעיל משטחים שלהם.
- המעיל coverslips עם אבידין מאת μL 200 ציפוי ספין אבידין המאגר באמצעות coater ספין למשך 5 שניות ב 500 סל ד, ואחריו 30 שניות ב- 1000 סל ד. דגירה על coverslips למשך 15 דקות בטמפרטורת החדר, כדי לאפשר להן להתייבש.
- היכונו coverslips המדגם חלבון.
- לדלל את הדגימה חלבון (מ- 3.5) 100 פעמים ב- 5 מ מ HEPES-NaOH pH 7.2.
- ΜL מקום 100 המדגם מדולל על פני השטח במרכז coverslip מצופים אבידין (מתוך שלב 4.3).
- דגירה בחושך למשך 15 דקות בטמפרטורת החדר.
- להכין את הפקד חיובי.
- המקום 100 μL של 10 ng/mL טהור ביוטין פלורסנט ב- 5 מ מ HEPES-NaOH coverslip pH 7.2 במרכז אבידין מצופה (מתוך שלב 4.3).
- דגירה בחושך למשך 15 דקות בטמפרטורת החדר.
הערה: coverslip בקרה חיובית זה מספק צפיפות אבידין נקודות קשירה, אשר נמצא בשימוש כדי לחשב את לו.
- להכין את הפקד שלילי.
- ספין-קואט הפלזמה לנקות coverslip עם μL 200 של 5 מ מ BSA HEPES-NaOH ו- 2 מ"ג/מ"ל (ללא אבידין).
- תקופת דגירה של 15 דקות בטמפרטורת החדר להתייבש.
- להוסיף 100 μL של 10 ng/mL מטוהרים ביוטין פלורסנט 5 מ מ HEPES-NaOH pH 7.2.
- דגירה בחושך למשך 15 דקות בטמפרטורת החדר.
הערה: coverslip שליטה שלילי זה מספק את הכמות של איגוד שאינם ספציפיים של ביוטין פלורסנט coverslip ללא אבידין.
- לשטוף כל coverslip עם 200 μL של מים מזוקקים על-ידי pipetting בקצוות של coverslip כדי לא לגעת אמצע coverslip עם הקצה. חזור על שטיפת זה שלוש פעמים.
הערה: לאחר כ רפה בעברית מים על coverslip, מים מיד יוצב בחזרה על coverslip כדי למנוע את זה ממנו להתייבש לחלוטין. - חושפים את האוויר פלזמה לאותו מספר על coverslips כמו שלב 4.2.
- מניחים את coverslip נקי על coverslip הדגימה מכורך מהשלב 4.7 כדי למנוע ייבוש.
5. תצפית עם מיקרוסקופ פלורסצנטיות מולקולה בודדת
- הפעלת מיקרוסקופ פלורסצנטיות שדה רחב-שדה או evanescent.
התראה: ישיר או קרינת לייזר פזורים יכול לגרום לעין או העור נזק. ללבוש משקפי מגן מתאימים, לחסום את נתיב אור לייזר.
הערה: עבור ההתקנה מיקרוסקופ, עיין שלנו הפרסום הקודם16. בקצרה, מיקרוסקופ פלורסצנטיות שדה רחב-שדה או evanescent מצוידים של ובעוצמת 488 ננומטר לייזר עירור, עדשה המטרה מפתח נומרי גבוהה, מצלמה רגישות גבוהה יכול לשמש עבור יחידת מידה זו. עוד, למדידה אוטומטיות, שלב מבוקר-מחשב מדגם translational XY, תריסי לייזר excitations מכני, מערכת מיקוד אוטומטי מומלץ להתקנה. - להגדיר את coverslip על המיקרוסקופ וחפש את המוקד.
- בצע סריקה אריח כדי לקבל לפחות 100 תמונות.
הערה: ההארה לייזר צריך להיות נשלט עם תריסים מכני להיחשף המדגם רק בעת הקלטת תמונות עם המצלמה, כדי למזער את photobleaching. אם קיימות דוגמאות רבות, מדידה אוטומטיות באמצעות תוכנת מחשב כדי לשלוט בהתקנים מיקרוסקופ מומלץ. כל תמונה בדרך כלל כולל 100 – 500 נקודות מולקולה בודדת כאשר משתמשים בעדשה המטרה 60 x.
6. תמונת ניתוח והפקת מידע
- אם התמונה לא שווה בגלל התבנית תאורה לייזר, לבצע עיבוד תמונה כדי לתקנה18.
- רוכשים את תמונת ייחוס על ידי מדידת עם מדגם coverslip המורכב בצורה אחידה-התפשטות צבע בעזרת מצלמה הגדרת כמו שלב 5.3.
- רוכשים תמונה נגדי על ידי מדידת עם אין עירור לייזר באמצעות מצלמת אותה הגדרה.
- לחסר כל ערך פיקסל כל תמונה לדוגמה, הייחוס עם הערך של התמונה היסט.
- מחלקים כל ערך הפיקסל של תמונות לדוגמה החיבור על-ידי ערך הייחוס החיבור.
- לאסוף תמונות שנרכשו כהלכה, להסיר את הרקע של התמונה.
- הסר תמונות המכילות צבירות פלורסנט גדולים באופן ידני.
- להסיר את הרקע של התמונה על-ידי החלת אלגוריתם בעקבות הכדור19 עם רדיוס הכדור של 50 פיקסלים בעזרת ImageJ20.
- חידוד תמונות על-ידי חיסור תמונות מטושטשות באמצעות ImageJ (לחדד את פונקציית תמונה).
- נמצא וניתוח מולקולה בודדת כתמים בתמונות.
- לזהות נקודות מולקולה בודדת עם יין הסף אלגוריתם21 באמצעות ImageJ.
- לסנן כתמים עם פחות משני פיקסלים כדי לא לכלול רעש כהה של המצלמה, כתמים יותר מ 20 פיקסלים כדי לא לכלול מצבורים של חלבונים באמצעות ImageJ (רועי מנהל).
- לספור את מספר הנקודות של כל תמונה. באמצעות תמונות המתוקן (שלב 6.1.4), לנתח את ההארה סה כ עוצמות בתוך פיקסלים עבור כל נקודה באמצעות ImageJ.
- לחשב והתפוסה תיוג (LO) באמצעות הנוסחה הבאה:
LO = (מספר עבירות במדגם / מספר עבירות של הפקד חיובי) x 100 - לחשב את המספר הממוצע של צבעי פלורסנט מאוגדים מולקולה חלבון יחיד (n̄צבע).
- לנתח היסטוגרמה של עוצמות של כל נקודה.
הערה: ההיסטוגרמה בדרך כלל יש מספר פסגות, ומייצג את שיא כל מספר שונה של מולקולות צבען מאוגדים חלבון. הראשון, השני והשלישי שיא בהיסטוגרמה מקביל מולקולות 1, 2 ו-3, בהתאמה. - לחשב את העוצמה הממוצעת של ההיסטוגרמה. גם לחשב את עוצמת השיא של השיא הראשון על-ידי החלת התאמה לפי עקומת גאוס.
- חישוב n̄צבע על-ידי חלוקת העוצמה ממוצע עם עוצמת שיא.
- לנתח היסטוגרמה של עוצמות של כל נקודה.
תוצאות
איור 4 מייצג את נתוני התמונה הגולמיים לשברים שונים משקל מולקולרי של חלבונים מן התא הלה lysate, כמו גם את הפקד חיוביים ושליליים. בעוד חלבון לדוגמה והן חיוביות לשלוט בנספח 100 – 500 נקודות לכל תמונה, הפקד שלילי מציג אף אחד או כמה נקודות, מראה כי הפרוטוקול מעכב מספיק שאינם ספציפיים קשירה של צבעי השטח coverslip. עוצמת ספוט היסטוגרמות הדגימות חלבון, הפקד חיובי להציג מספר פסגות, המייצג איגוד סטוכסטי של צבעים אמינים העיקרי חלבונים ו אבידין tetramer במבנים22, בהתאמה. כל נקודות הראה מהבהב, stepwise photobleaching עם עירור לייזר מתמשך, הדגשת תצפית ברמת מולקולה בודדת (איור 5 אב').
לו מחושבת על פי היחס בין מספר המקומות בכל מדגם חלבון לזה בפקד חיובי. LO נמדד הלה תא מדגם lysate נע בין 50% עבור השבר קטן יותר (16 kDa) משקל מולקולרי ל 90% עבור השבר (120 kDa) משקל מולקולרי גבוה והיה 72% עבור המדגם פרוטאום שלם ללא הפרדה (איור 6). בהתאמה, n̄צבע נטו להגדיל עם הגדלת משקל מולקולרי. הגדלת נטיות אלה נחשבים להתרחש עקב מספר גבוה יותר של שאריות ליזין, שמוביל NHS מוגבר-אסתר לצבוע את הכריכה. לדוגמה, השבר 23 kDa יש ערך גבוה לו בגלל מספרם של שאריות ליזין חלבוני היסטון הכלול השבר הזה.
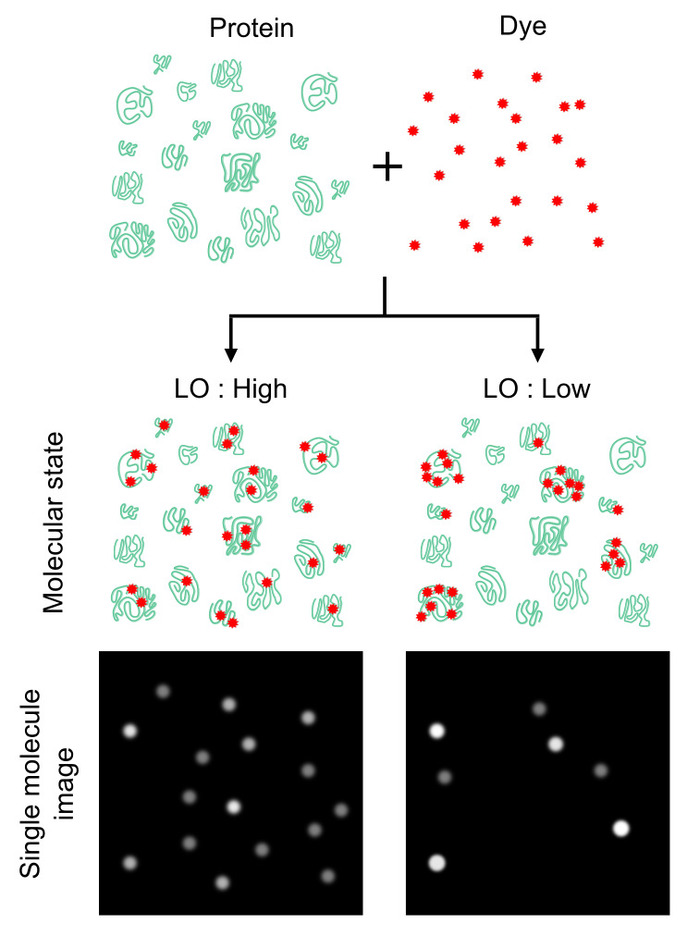
איור 1: השפעת פרוטאום תיוג הומוגניות על ספירת מספר חלבונים. המספר שהתקבל במונה חלבון תלויים במידה רבה כמה חזקה, homogeneously מולקולות חלבון מסומנות, ולא יחס מספר של חלבונים צבעי. ההומוגניות can be הבקיע באמצעות פרמטר כינה תפוסת תיוג (LO), אשר מגדיר את ההסתברות של מולקולות חלבון שכותרתו כנגד מולקולות חלבון הכולל. ערך זה מספק את היעילות של חלבון סופר (קרי, תשואות גבוהות LO גבוה יותר לספור מספרים (משמאל) ולהיפך להיפך (מימין)). בעוד לו ערך של 100% הוא אידיאלי, LO של < 100% יכול לספק גורם הנחתה אומדן מספרים מוחלטים חלבון. איור זה השתנה מ לקלרק ואח16 יוצרים 2018 אמריקאי כימית בחברה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: זרימת העבודה Assay. ראשית, coverslips () ו- (b) מטופלים עם אבידין כדי להשיג צפיפות קבועה. הדוגמה השניה, שכותרתו fluorescently חלבונים biotinylated, מצורף () coverslip באמצעות האינטראקציה אבידין-ביוטין. במקביל, כמעט 100% fluorescently-ידי מטוהרים ביוטין הוא משותק-coverslip (b). שלישית, coverslips הם צילמו על-ידי קרינה פלואורסצנטית מולקולה בודדת מיקרוסקופ לקביעת התפלגות מספר והבהירות של קרינה פלואורסצנטית כתמים. לבסוף, הפרמטר הומוגניות, LO, מחושבת על פי היחס בין המספרים ספוט ב () לזה ב (b). איור זה השתנה מ לקלרק ואח16 יוצרים 2018 אמריקאי כימית בחברה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
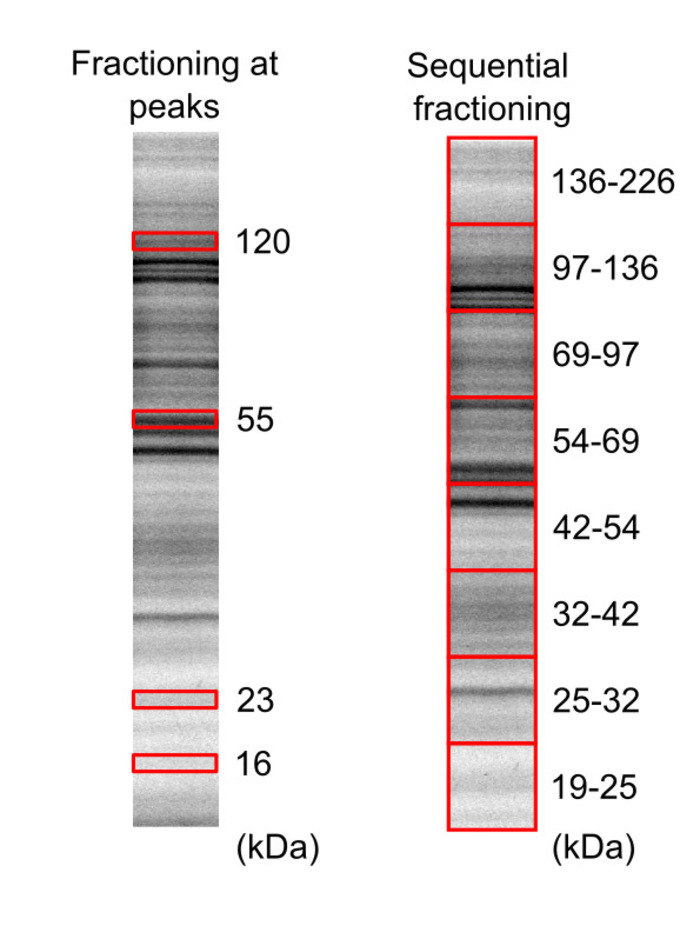
איור 3: ההפרדה של מדגם פרוטאום הלה תא באמצעות עמודים מרחביות. Fluorescently הנקרא biotinylated תא lysate הועברו על שני ג'לים שונים (20% אקרילאמיד) ו חלבונים visualized באמצעות ג'ל הצופה, עם זמן של 5 דקות, 10 דקות חשיפה עבור ג'ל 1 ו ג'ל 2, בהתאמה. בתיבות אדום מייצגים את האזורים ג'ל היו לגזור, חילוץ. איור זה השתנה מ לקלרק ואח16 יוצרים 2018 אמריקאי כימית בחברה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: יחיד מולקולה תמונות של דוגמאות פרוטאום. קרינה פלואורסצנטית במקום תמונות (משמאל), היסטוגרמות של עוצמות ספוט (מימין) המתקבל משקל מולקולרי שונה פרוטאום שברים. סרגל קנה מידה הוא 10 μm. חיצים בפקד חיובי מציינים את הצעד תיוג שונים אבידין. איור זה השתנה מ לקלרק ואח16 יוצרים 2018 אמריקאי כימית בחברה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 5: Photobleaching המקומות פלורסנט. (א) תמונות בצילום מואץ של כתמים פלורסנט תחת עירור לייזר מתמשך. (B) זמן עקבות של עוצמות קרינה פלואורסצנטית בנקודות שונות. העקבות מראים גם step אחת או שתיים photobleaching, המציין את המספרים המתאימים של צבעי היו מצמידים החלבון במקום מדגם BSA מטוהרים. איור זה השתנה מ לקלרק ואח16 יוצרים 2018 אמריקאי כימית בחברה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 6: תיוג ההומוגניות של דגימות פרוטאום. LO (כחול), n̄צבע (אדום כהה) המתקבל משקל מולקולרי שונה שברים. הנתונים מבוטאים אומר ± s.e. 98, 46, 27, 77, 44, 39, 62, 101, 65, 62, 82, 61 ו 70 תמונות נותחו עבור התא כולו lysate, 16, 23, 55, 120, 19-25, 25-32, 32-42, 42 – 54, 54 – 69, 69 – 97, 97 – 136 ו- 136 – 226 kDa שברים , בהתאמה. איור זה השתנה מ לקלרק ואח16 יוצרים 2018 אמריקאי כימית בחברה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
מאמר זה מתאר פרוטוקול לכמת אחידות תיוג כל מין שכותרתו החלבון בתאים לאחר ההפרדה עם מרחביות-דף (שלב 3). ניתן להחליף את שיטת ההפרדה עם שיטות אחרות כגון כרומטוגרפיה נוזלית או אלקטרופורזה נימי, המאפשרים הפרדה, fractionation של החלבונים עם רזולוציה גבוהה, תוך דרישת ציוד מיוחד23. ניתן להחליף את שיטת תיוג באמצעות NHS-אסתר בפרוטוקול הנוכחי עם שיטות אחרות באמצעות maleimide-אסתר או נוגדנים, לדוגמה.
הדרישה תיוג הומוגניות ניתוח תלוי כמה תיוג סוטה תהליך אקראי פשוט, כמו ההנחה בניתוח יעילות צימוד. המחקר האחרון שלנו16 ציינו כי NHS-אסתר תיוג של חלבונים סוטה תהליך אקראי בהתאם לתנאי תגובה כגון pH וחומרי ניקוי. הבחנו כי כמה תנאים המושרה הטרוגניות על-ידי קישור קואופרטיבי של צבעי חלבונים או קיומו של שבר של חלבונים לובשת solubilization לא שלם או הוריד אהדה לצבוע. לעומת זאת, תנאים אחרים מופחת הטרוגניות על-ידי האיגוד מלאה של שאריות תגובתית בתוך חלבון כדי לצבוע.
אנו רואים שאת ה-pH הוא אחד הגורמים המשפיעים ביותר על אחדות תיוג. ה-pH גבוה יכול לגרום ניטרול של ליזין שאריות חלבונים, המוביל תגובתיות גבוהה יותר עם לצבוע NHS-אסתר. בנוסף, ה-pH גבוה יכול לגרום פירוק התא, יכול denature חלבונים. עם זאת, מאז ה-pH גבוה שהופך את המטען של חלבונים שלילית אינה מתאימה לצורכי ניסויים כגון אלקטרופורזה לגירויי כאב או אלקטרופורזה דו-ממדית, התנאי pH צריך להישקל בזהירות בהתאם מטרת המחקר.
כדי למדוד במדויק את עניי תיוג וזמינותו, חשוב להשתמש במדגם חלבון מספיק biotinylated. הדבר נובע וזמינותו מבוסס על ההנחה כי חלבונים לאגד עם רוויה כדי בכל מולקולה אבידין על coverslip, ועל ריכוז חלבון מספקת תוצאות underestimation של LO... המחקר הקודם שלנו16 הראו כי בדרך כלל יותר מ-10 pg של חלבון הוא הכרחי עבור איגוד רווי, זה ניתן להשיג תאים בסביבות 1000 הלה24, גם לאחר fractionation. מומלץ כדי ליצור סדרה דילול של המדגם חלבון כדי לאשר את הרוויה אבידין נקודות. נציין גם כי הצפיפות אבידין על coverslip ייתכן שיהיה צורך ניתן למטב כל כך לא לגרום חופפת בין נקודות תמונות מוקלטות, תוך מתן ספוט מספיקים לשם ניתוח סטטיסטי.
Assay זה מבוסס על ההנחה זה מולקולה אבידין tetravalent22 -coverslip באפשרותך לאגוד חלבון אחד. ואכן, הנתונים בקרה חיובית במחקר הקודם שלנו המצוין שהזה מולקולה אבידין אחת ניתן לאגד biotins fluorescently שכותרתו עד ארבע, אבל הרוב (55%) של מולקולות אבידין לאגד מולקולות ביוטין אחד או שניים בלבד. כי החלבונים הם גדולים יותר מאשר ביוטין, האפקטים הסטריים שלהם צריך לגרום פחות חלבונים מאוגדים אבידין אחד. ההנחה שלנו נתמך נוסף על ידי העובדה הזאת n̄צבע נשאר קבוע כאשר מדידת מעורב דוגמאות מתויג ללא תווית חלבונים שונים יחסי16.
תלוי בזן חלבון, האיגוד לא ספציפי של חלבונים כדי coverslip עשויה להתרחש באופן משמעותי אפילו עם ציפוי BSA. אם זה המקרה, ייתכן אפשרות אחת כדי למדוד את פקד שבו biotinylated חלבונים הם מצופה ב- coverslip ללא אבידין, במקום פלורסנט ביוטין בשלב 4.6.3. ההשפעה של האיגוד לא ספציפי-LO ניתן לסלק מתמטית על ידי הפחתת מספר כתמים של פקד זה מזו של המדגם חלבון.
פרוטוקול זה יהיה יקר ערך עבור פרוטאום ברוחב יחיד-מולקולת חלבון סופר ניתוחים הרגישות מולקולה בודדת יאפשר ניתוח של כמויות חלבון עבור כל המינים חלבון ללא התחשבות שפע שלהם התא25. זה יכול להיות ממומש על ידי פרוטאום ההפרדה ואחריו כימות של מספר נקודות פלורסצנטיות יחד עם חלבונים. עוד יותר, רגישות גבוהה גם יאפשר ניתוח תא בודד, המאפשר לחוקרים לבחון הטרוגניות על פני אוכלוסיות תאים, לעשות קיבוץ באשכולות של הסלולר קובע25,26.
Disclosures
המחברים מצהירים את interest(s) הפיננסיים מתחרים הבאים: RIKEN הגיש בקשה לרישום פטנט על תוצאות אלו עם ס ו Y.T. בשם ממציאים.
Acknowledgements
המחברים מודים Masae אונו, Kazuya נישימורה על ניסיוני סיוע וייעוץ. עבודה זו נתמכה על ידי אוטם (JPMJPR15F7), יפן המדע, הטכנולוגיה סוכנות, Grants-in-aid יאנג מדענים (א) (24687022), מאתגר מחקר גישוש (26650055) של מחקר מדעי בתחומים חדשניים (23115005), יפן האגודה קידום המדע, ועל ידי המענקים של קרן המדע טקדה וקרן ההנצחה Mochida רפואי ומחקר התרופות. ס מאשר תמיכה מתוכנית RIKEN הבינלאומי תוכנית לשייך (IPA).
Materials
| Name | Company | Catalog Number | Comments |
| 22x22x0.15 mm coverslip | VWR | 470019-004 | |
| 488 nm Argon laser | Coherent | Innova 70C | |
| 488 nm dichroic mirror | Semrock | FF495-Di03 | |
| 488 nm emission filter | Semrock | FF02-520/28 | |
| 560 nm dichroic filter | Semrock | Di02-R561 | |
| 560 nm emission filter | Semrock | FF02-617/73 | |
| 560 nm fiber laser | MBP Communications | F-04306-2 | |
| 60x oil immersion lens | Olympus | PLAPON 60x | |
| Avidin | Nacalai-tesque | 03553-64 | |
| Biotin-PEG-amine | Thermo Scientific | 21346 | |
| Biotinylated Alexa Fluor 488 | Nanocs | ||
| Borate | Nacalai-tesque | ||
| BSA | Sigma-Aldrich | A9547 | |
| CHAPS | Dojindo | C008-10 | |
| Cy3 NHS-ester dye | GE Healthcare | PA13101 | |
| Dialyzer - D-tube, 6-8 kDa | Merck Millipore | 71507-M | |
| DMEM | Sigma-Aldrich | ||
| DTT | Nacalai-tesque | 14112-94 | |
| EDC | Nacalai-tesque | ||
| EMCCD camera | Andor | IiXon 897 | |
| Epi fluorescence microscope | Olympus | IX81 | |
| Gel viewer | GE Healthcare | ImageQuant LAS 4000 | |
| Penicillin, streptomycine and Amphoterecin mix | Gibco | ||
| Plasma cleaner | Diener Electronic | ||
| SDS | Wako | NC0792960 | |
| Size purification column 10K | Merck Millipore | UFC5010 | |
| Tween 20 | Sigma-Aldrich | P9416 |
References
- Wilhelm, M., et al. Mass-spectrometry-based draft of the human proteome. Nature. 509 (7502), 582-587 (2014).
- Guo, A., et al. Immunoaffinity enrichment and mass spectrometry analysis of protein methylation. Molecular & Cellular Proteomics. 13 (1), 372-387 (2014).
- Tyanova, S., Temu, T., Cox, J. The MaxQuant computational platform for mass spectrometry-based shotgun proteomics. Nature Protocols. 11 (12), 2301-2319 (2016).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- Berggren, K., et al. Background-free, high sensitivity staining of proteins in one- and two-dimensional sodium dodecyl sulfate-polyacrylamide gels using a luminescent ruthenium complex. Electrophoresis. 21 (12), 2509-2521 (2000).
- Butt, R. H., Coorssen, J. R. Coomassie blue as a near-infrared fluorescent stain: a systematic comparison with Sypro Ruby for in-gel protein detection. Molecular & cellular proteomics. 12 (12), 3834-3850 (2013).
- Nanda, J. S., Lorsch, J. R. Labeling a protein with fluorophores using NHS ester derivitization. Methods in Enzymology. , 87-94 (2014).
- Kim, Y., et al. Efficient site-specific labeling of proteins via cysteines. Bioconjugate chemistry. 19 (3), 786-791 (2008).
- Dickson, R. M., Cubitt, A. B., Tsien, R. Y., Moerner, W. E. On/off blinking and switching behaviour of single molecules of green fluorescent protein. Nature. 388 (6640), 355-358 (1997).
- Penna, A., et al. The CRAC channel consists of a tetramer formed by Stim-induced dimerization of Orai dimers. Nature. 456 (7218), 116-120 (2008).
- Ji, W., et al. Functional stoichiometry of the unitary calcium-release-activated calcium channel. Proceedings of the National Academy of Sciences of the United States of America. 105 (36), 13668-13673 (2008).
- Ulbrich, M. H., Isacoff, E. Y. Subunit counting in membrane-bound proteins. Nature Methods. 4 (4), 319-321 (2007).
- Sugiyama, Y., Kawabata, I., Sobue, K., Okabe, S. Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature Methods. 2 (9), 677-684 (2005).
- Puchner, E. M., Walter, J. M., Kasper, R., Huang, B., Lim, W. A. Counting molecules in single organelles with superresolution microscopy allows tracking of the endosome maturation trajectory. Proceedings of the National Academy of Sciences of the United States of America. 110 (40), 16015-16020 (2013).
- Grassart, A., et al. Actin and dynamin2 dynamics and interplay during clathrin-mediated endocytosis. The Journal of Cell Biology. 205 (5), 721-735 (2014).
- Leclerc, S., Arntz, Y., Taniguchi, Y. Extending Single Molecule Imaging to Proteome Analysis by Quantitation of Fluorescent Labeling Homogeneity in Complex Protein Samples. Bioconjugate chemistry. 29 (8), 2541-2549 (2018).
- Ian Freshney, R. Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications. , John Wiley & Sons. (2015).
- Taniguchi, Y., et al. Quantifying E. coli proteome and transcriptome with single-molecule sensitivity in single cells. Science. 329 (5991), 533-538 (2010).
- Sternberg, Biomedical Image Processing. Computer. 16 (1), 22-34 (1983).
- Rueden, C. T., et al. ImageJ2: ImageJ for the next generation of scientific image data. BMC Bioinformatics. 18 (1), 529(2017).
- Yen, J. C., Chang, F. J., Chang, S. A new criterion for automatic multilevel thresholding. IEEE Transactions on Image Processing. 4 (3), 370-378 (1995).
- Livnah, O., Bayer, E. A., Wilchek, M., Sussman, J. L. Three-dimensional structures of avidin and the avidin-biotin complex. Proceedings of the National Academy of Sciences of the United States of America. 90 (11), 5076-5080 (1993).
- Mostovenko, E., Hassan, C., Rattke, J., Deelder, A. M., van Veelen, P. A., Palmblad, M. Comparison of peptide and protein fractionation methods in proteomics. EuPA Open Proteomics. 1, 30-37 (2013).
- Volpe, P., Eremenko-Volpe, T. Quantitative studies on cell proteins in suspension cultures. European Journal of Biochemistry. 12 (1), 195-200 (1970).
- Huang, B., et al. Counting low-copy number proteins in a single cell. Science. 315 (5808), 81-84 (2007).
- Johnson, A. C., Bowser, M. T. H. igh- High-Speed, Comprehensive, Two Dimensional Separations of Peptides and Small Molecule Biological Amines Using Capillary Electrophoresis Coupled with Micro Free Flow Electrophoresis. Analytical Chemistry. 89 (3), 1665-1673 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved