Method Article
Определенных Xeno бесплатно и фидер свободной культуры условия для моделей клеток поколения прав человека iPSC производные сетчатки
В этой статье
Резюме
Производство специализированных клеток сетчатки от плюрипотентных стволовых клеток является поворотным моментом в развитии на основе стволовых клеток лечение заболеваний сетчатки. В настоящем документе описывается простой метод для эффективного поколения сетчатки organoids и пигментированной эпителия сетчатки для основных, поступательные и клинических исследований.
Аннотация
Производство специализированных клеток от плюрипотентных стволовых клеток предоставляет мощный инструмент для разработки новых подходов для регенеративной медицины. Использование человека индуцированных плюрипотентных стволовых клеток (iPSCs) является особенно привлекательным для нейродегенеративные болезни исследований, в том числе дистрофий сетчатки, где iPSC производные сетчатки клетки модели Марк крупный шаг вперед для понимания и бороться слепоты. В этой статье мы опишем простой и масштабируемый протокол для создания, Зрелые и криоконсервировать сетчатки organoids. На основании среднего изменения, основным преимуществом этого метода является избежание несколько и времени шаги обычно требуются в управляемое дифференциации iPSCs. Подражая на ранних этапах развития сетчатки последовательных изменений определенных СМИ на адэрентных человека iPSC культур, этот протокол позволяет одновременное поколения самостоятельного формирования структур neuroretinal и сетчатки пигментные клетки эпителия (ПЭС) в воспроизводимость и эффективным образом в 4 недели. Эти структуры, содержащие сетчатки прогениторных клеток (RPC) может быть легко изолированы для дальнейшего созревания в состоянии плавающей культуры, обеспечивая дифференцирование RPC в семи типы клеток сетчатки, присутствующих в взрослого человека сетчатки. Кроме того мы описываем, быстрые методы криоконсервирования сетчатки organoids и ПЭС клетки для длительного хранения. Сложенные вместе, методы, описанные здесь будет полезным для производства и банк человека iPSC производные сетчатки клетки или ткани для фундаментальных и клинических исследований.
Введение
Сетчатка является неотъемлемой частью центральной нервной системы (ЦНС) и имеет ограниченные возможности для самопроизвольно восстанавливаться после травмы или заболеваний. Таким образом дегенеративных патологий, вызывая потери окончательного клеток сетчатки, например возрастной макулярной дегенерации (AMD) и пигментный ретинит (RP), глаукома, диабетическая ретинопатия, обычно приводит к необратимой слепоте. Спасая выродились сетчатки является одной из основных задач, для которых на основе стволовых клеток лечение, направленный для замены поврежденного или утраченного клетки являются одним из наиболее перспективных подходов1,2,3. Плюрипотентных стволовых клеток как клетки человеческих эмбриональных стволовых клеток (ЭСК) или человека индуцированных плюрипотентных стволовых клеток (iPSCs) имеют способность расширяться бесконечно в культуре, и они имеют потенциал для производства любых типов клеток. Достижения в наше понимание сетчатки развития и совершенствования в vitro протоколы для человека iPSC дифференциация привели к поколения сетчатки organoids7,8,9, 10,,1112. Все крупные сетчатки клеток, включая клетки сетчатки ганглии (РГК) и фоторецепторов сетчатки пигментные клетки эпителия (ПЭС) были успешно дифференцированы от человеческих ЭСК и iPSCs4,5, 6. основанный на SFEB (сыворотка свободной культуры embryoid тела, как агрегатов) метод, разработанный Eiraku и др. 13, самостоятельное формирование сетчатки organoids могут быть получены ESC или iPSC, полученных embryoid тела, как агрегатов в определенных внеклеточный матрикс компонентов7,10,14. Но эти протоколы являются сложные, требующие большое количество шагов, не всегда совместимы с большим производства клеток для терапевтических подходов или наркотиков скрининг. Таким образом выбор метода для получения человеческих клеток сетчатки имеет решающее значение и метод должен быть надежным, масштабируемым и эффективным.
Здесь основываясь на нашей предыдущей публикации15, опишем каждый шаг для простой и эффективной поколения клетки сетчатки через сетчатки органоид самостоятельного формирования от адэрентных человеческого iPSCs, культивируемый в фидер свободных и без Зенона состояние. Начиная от рутинных культур адэрентных человеческого iPSCs, этот протокол требует лишь простой последовательных среднего разрешена поколения клетки iPS производные ПЭС (hiRPE) и neuroretinal структур в течение 4 недель. После ручной изоляции hiRPE может быть расширена и сетчатки структуры можно культивировали как плавающие organoids где клетки сетчатки прародитель способны дифференцироваться в все типы клеток сетчатки в последовательном порядке в соответствии с человека в естественных условиях retinogenesis. Наконец для исследований или клинический перевод, мы описываем криоконсервирования метод, позволяющий длительного хранения всей сетчатки organoids и hiRPE клеток не затрагивая их фенотипические характеристики и функциональность.
протокол
Протокол, описанные в настоящем документе соответствует руководящим принципам Комитета по этике исследований Institut de la Vision. Institut de la видение позволило манипуляции человека образца согласно текущей французский. Образец обработки следует защиты данных пациента в соответствии с принципами Хельсинки и национальных правил после этические утверждения «Comité de защиты des Personnes (CPP) Иль-де-V».
1. Подготовка культуры средств массовой информации и блюда
-
Средства массовой информации культуры
- Использование в iPSC средний, химически определенных среднего, посвященный культуре плюрипотентных стволовых клеток в фидер свободных условий16. Подготовка 500 мл среды согласно протоколу производителя.
- Использование базальной iPSC (Bi) среднего, iPSC химически определены среднего без фактора роста фибробластов 2 (FGF2) или преобразование фактор роста бета (TGFß).
- Подготовка 500 мл среды Bi, дополнена дополнение 1% N2 (BiN2 средний), 10 единиц/мл пенициллин, и 10 мг/мл стрептомицина.
- Подготовка 500 мл proneural N2-основе среды (средний ProN2) состоит из F-12 DMEM:Nutrient смеси (DMEM/F12, 1:1, L-глютамин), 1% MEM заменимые аминокислоты, дополнение 1% N2, 10 единиц/мл пенициллина и 10 мг/мл стрептомицина.
- Подготовка proneural на основе B27 среднего (ProB27 средний) состоит из смеси DMEM:Nutrient F-12 (DMEM/F12, 1:1, L-глютамин), 1% MEM заменимые аминокислоты, 2% B27 дополнение, 10 единиц/мл пенициллина и 10 мг/мл стрептомицина.
-
Подготовка судна культура
-
Для человека iPSC культуры
- Подготовка 10 мл vitronectin раствора, содержащего 5 мкг/мл vitronectin в ПБС. В 10 мл ПБС добавьте 100 мкл раствора талой vitronectin акций (100 x).
- Распространение 2 мл раствора vitronectin в 6-см культуры блюдо соответствует 0,5 мкг/см2. Инкубируйте 1 ч при комнатной температуре (RT). Удаление vitronectin решения путем аспирации, используя систему вакуум аспирации или 5 мл пипетки.
- Добавьте 4 мл iPSC среднего за 6-см блюдо.
- Инкубируйте блюда в инкубатор культуры клеток при 37 ° C и 5% CO2 минимум 30 мин перед использованием.
- Для культуры клеток человека iPSC производные ПЭС (hiRPE)
- Используйте плюрипотентных стволовых клеток квалифицированные матрицы или субстрат для пальто скважин согласно протоколу производителя. Добавьте достаточно матрицы или субстрат для покрытия площади поверхности весь рост. Например положил 300 мкл матрицы за хорошо в пластине 24-Ну и 3 мл матрицы в колбе2 T-25 см.
- Инкубировать покрытием культуры судов как минимум 1 ч при 37 ° C. Удаление матрицы с помощью вакуум аспирации систем или 5 мл пипетки.
- Добавьте 1 mL ProN2 среды в колодец на 24-ну пластины и вернуть инкубатора для как минимум 30 минут, чтобы тепло и сбалансировать носителя культуры судна. Для T-25 см2 фляги смотрите шаг 5.2.
-
Для человека iPSC культуры
2. поддержание и расширение прав человека iPSCs
-
Поддержание человеческого iPSCs
- Подготовка 3 мл среды iPSC в 15 мл трубку и держать его в RT как минимум 15 минут перед использованием. Подготовьте покрытием 6-см блюдо, как описано в разделе 1.2.1.
- Оттепель криогенных образцов человеческой iPSCs от бака жидким азотом или морозильник-150 ° C по инкубации в водяной бане при 37 ° C за 30 s.
- Тщательно дезинфицировать криогенных флакон с помощью спрей дезинфицирующим раствором. Передача талой человека iPSCs от cryotube до 15 мл пробирку, содержащую 3 мл среды iPSC, предварительно нагретой на RT.
- Центрифуга трубки на 110 x g 3 мин удалить супернатант стремление с помощью вакуум аспирации системы или 5 мл пипетки.
- Ресуспензируйте клетки лепешка с 1 мл iPSC среды с покрытием vitronectin 6-см культуры блюдо с помощью пипетки 2 мл и передать клетки обратно в блюдо. Возвращение блюдо в инкубатор при 37 ° C и 5% CO2 для минимум 24 часа перед изменением среды.
Примечание: Ингибитор рок, таких как Y-27632 на 10 мкм, могут добавляться iPSC средний блюдах-6см культуры для уменьшения апоптоз. - Изменения среды ежедневно и передайте человека iPSCs каждую неделю.
-
Пассированый из человека iPSCs
- Передайте человека iPSC при впадении в 70-80%, классически после 7 дней в культуре.
- Готовить блюда 6-см для пассированый как описано в пункте 1.2.1. Удалите средство iPSC из блюда с вырожденная iPSCs и добавьте 2 мл раствора диссоциации для 6 мин на RT.
Примечание: Время инкубации зависит от клонов iPSC. Попробуйте 6 мин инкубации как начало. - Удаление диссоциации решения с помощью вакуум аспирации систем или 5 мл пипетки и добавить 2 мл среды iPSC предварительно нагревается на RT. Ресуспензируйте iPSC колоний закупорить их вверх и вниз 5-10 x с 1000 мкл пипетки.
Предостережение: Избегайте одноклеточного диссоциации от чрезмерного закупорить. - Передача 30-200 мкл ресуспензированы клеток сгустки в новой культуры 6-см блюдо. Возвращение блюда в инкубатор культуры клеток при 37 ° C и 5% CO2 для минимум 24 часа перед изменением среды.
Примечание: Объем сгустки ресуспензированы клеток, необходимых для пассированый зависит от клонов iPSC. - Изменения среды ежедневно и передайте человека iPSCs каждую неделю.
3. поколение сетчатки Organoids
- Запустите дифференциация iPSC после протокол, схематизируются на рисунке 1A , когда колонии достигают слияния 60-70% (рис. 1B).
- Подготовка 4 мл среды Bi за 6-см блюдо. Теплый Bi средне-37 ° C. Измените iPSC среднего би среднего. Обратите внимание на этот раз как день 0 (D0).
- В D2 переключитесь культур в среде Bi BiN2 средний, ранее нагревается при 37 ° C. Измените носитель каждые 2-3 дня.
- Выявления возникающих самостоятельного формирования сетчатки organoids с neuroepithelium почки, как показано на рисунке 1 c -1E.
Примечание: Эти ранние сетчатки organoids, соответствующих их стадии развития зрительного Кубок, может быть вручную изолированы для вниз по течению экспериментов.
4. созревания сетчатки Organoids
- D28, подготовит 6-ну пластины, содержащий 4 мл/хорошо ProB27 среды, первоначально дополнена 10 нг/мл FGF2 (рис. 1A).
Примечание: Добавьте FGF2 непосредственно перед СМИ добавляется к пластинам.
Предупреждение: Не фильтровать FGF2. - Вручную восстановить структуру сетчатки от блюда 6-см. Чтобы сделать это, изолировать структур, делая перпендикулярно страт с иглой вокруг почки нейроэпителиальных, как показано на рисунке 1Eи отсоедините organoids, нежно царапая их с иглой.
- Аспирационная 10-15 organoids с помощью пипетки 1000 мкл и передавать их в один хорошо пластины 6-Ну, содержащие ProB27 среднего.
- Держите сетчатки organoids плавающей культуры в в условиях ProB27 среды в инкубатор культуры клеток при 37 ° C и 5% CO2. Измените половина среды каждые 2-3 дня.
Примечание: Лечить organoids с FGF2 до D35. - На D35 удалить половину среды и добавить свежие подогретую среднего ProB27 при 37 ° C без FGF2.
- Измените половина среды каждые 2-3 дня в течение времени, необходимого для получения желаемого клеток сетчатки согласно появление видов типов клеток сетчатки, как показано на рисунке 2.
5. генерации и усиления прав человека iPSC производный клетки ПЭС (hiRPE)
-
Поколение клеток человека hiRPE
- Участие iPSCs в дифференциации когда колонии достигают 60-70% слияния, следуя протоколу, схематизируются в Рисунок 3A.
- Подготовка 4 мл 6-см блюдо среды Bi и теплая среда Bi на 37 ° C. Измените iPSC среднего би среднего. Обратите внимание на этот раз как день 0 (D0).
- В D2 переключитесь культур в среде Bi BiN2 среднего, ранее нагревается при 37 ° C. Измените носитель каждые 2-3 дня.
- В D28 измените среднего свежие среднего ProN2, ранее нагревается при 37 ° C, как показано на рисунке 3A.
Примечание: Этот шаг может быть сделано после собирание органоид, описанные в шаге 4. - Изменение среднего ProN2 каждые 2-3 дня.
- На D42 определите эмерджентных hiRPE клетки замечанием пигментные пятна, как показано на рисунок 3B.
Примечание: Между D35 D56 в зависимости от клонов iPSC появляется пигментация hiRPE клеток.
-
Усиление hiRPE клеток
- D42 подготовит 24-ну пластины, ранее покрытые матрицы, как описано в шаге 1.2.2 и содержащие 1 мл ProN2 среды в колодец. Поместите пластины для 15 мин в инкубаторе при 37 ° C и 5% CO2 перед использованием.
- Восстановить hiRPE патчи от 6-см блюдо вручную. Чтобы изолировать патчи, сделать перпендикулярно полосе с иглой вокруг пигментированной эпителия и отсоединение лист аккуратно царапин с иглой. Аспирационная 10 пигментированной патчи, используя 1000 мкл пипетки и передают их в один колодец 24-ну пластины.
- Держите патчи hiRPE в ProN2 среде в инкубатор культуры клеток при 37 ° C и 5% CO2 в течение 48 часов перед изменением среды. Обратите внимание, этот проход hiRPE клетки как 0 (hiRPEp0). Измените носитель каждые 2-3 дня с ProN2 средой.
- Пройти hiRPEp0 клетки, когда клетки вырожденная.
- Удалите носитель, с помощью систем вакуум аспирации и мыть каждый хорошо 1 x с 1 мл раствора PBS с помощью пипетки 5 мл.
- Отказаться от PBS с помощью вакуум аспирации систем, 200 мкл на хорошо трипсин 0.25% и проинкубируйте минимум 15 мин в инкубаторе при 37 ° C. 800 мкл ProB27 среды для инактивации трипсина.
Примечание: Не рекомендуется использовать ProN2 среды остановить активность трипсина. - Отделить лист hiRPE клеток, закупорить вверх и вниз. Суспензию клеток в 15 мл и центрифуги для 5 мин при 110 x g.
Примечание: Дополнительная мойка может быть сделано с ProN2 средних удалить избыток ProB27 среды. - Удалить супернатант и нежно ресуспензируйте Пелле клеток в 2 мл ProN2 среды, предварительно нагревают при 37 ° C. Подсчет количества ячеек с счетчик соматических клеток.
- Возьмите 1,25 миллиона клеток и поместите их в колбе с покрытием матрица2 см T-25 (см. шаг 2.2.2) содержащий 5 мл ProN2 среды предварительно нагревают при 37 ° C. Обратите внимание, этот проход hiRPE клетки как 1 (hiRPEp1).
- Держите клетки hiRPE в ProN2 среде в инкубатор культуры клеток при 37 ° C и 5% CO2 в течение 48 часов перед изменением среды.
- Измените СМИ каждые 2-3 дня. Когда hiRPEp1 клетки достигают слияния, выполните следующий отрывок или криоконсервирования.
6. криоконсервирования Organoids сетчатки и hiRPE клеток
-
Для всей сетчатки organoids
- Выбрать 5 до 20 сетчатки organoids с помощью пипетки передачи и поместите их в криогенных флаконе. Удалить любые излишки среды с 1000 мкл пипетки без касатьться organoids в нижней части трубки и 250 мкл холодной криоконсервирования среды (см. Таблицу материалы).
- Заморозить флаконов в контейнере замораживания изопропиловый спирт на основе в-80 ° C не менее 4 ч. Передача замороженных флаконов в морозильник-150 ° C или жидким азотом цистерна для длительного хранения.
-
Для hiRPE клеток
- При прохождении 1 отделить hiRPE клетки, когда клетки вырожденная.
Примечание: Криоконсервирования клеток hiRPEp0 не рекомендуется. - Аспирационная средство от T-25 колбу2 см, с использованием систем вакуум аспирации и мыть его 1 x 3 мл PBS с помощью пипетки 5 мл.
- Удаление PBS с помощью вакуум аспирации систем, добавляют 1 мл 0,25% трипсина и проинкубируйте минимум 15 мин в инкубаторе при 37 ° C. Добавьте 5 мл ProB27 среды остановить активность трипсина.
Примечание: Не рекомендуется использовать ProN2 среды для инактивации трипсина. - Отделить лист hiRPE клеток, закупорить вверх и вниз с помощью пипетки 10 мл. Подсчет количества ячеек с счетчик соматических клеток. Суспензию клеток в 15 мл и центрифуги для 5 мин при 110 x g.
Примечание: Дополнительная мойка может выполняться с ProN2 средних удалить избыток ProB27 среды. - Аспирационная супернатанта, с помощью вакуум аспирации и нежно ресуспензируйте клеток для получения 2 миллиона клеток в 250 мкл криоконсервирования среды.
- Передача 250 мкл суспензии клеток на криогенных флакон. Заморозить флаконов в контейнере замораживания изопропиловый спирт на основе в-80 ° C для минимум 4 часа.
- Передать морозильник-150 ° C или жидким азотом цистерна для длительного хранения замороженных флаконов.
- При прохождении 1 отделить hiRPE клетки, когда клетки вырожденная.
7. размораживание Organoids сетчатки и hiRPE клеток
-
Оттаивания целом сетчатки organoids
- Теплый ProB27 среднего при 37 ° C (2 мл потребуются для каждого криогенных флакона).
- От бака жидким азотом или морозильник-150 ° C оттепель криогенных флакон, содержащий сетчатки organoids в водяной бане при 37 ° C за 30 с. лечить криогенных флакона тщательно используя дезинфицирующий раствор спрей.
- Откройте флакон и добавьте 1 mL подогретым ProB27 среды. Передать organoids 1,5 мл с пипеткой передачи.
- Осторожно извлеките носитель, закупорить не касаясь сетчатки структуры в нижней части трубки. Вымойте organoids 1 больше времени с 1 мл подогретым ProB27 среды.
- Аспирационная organoids с передачей пипетки и поместите их в 1 хорошо 6-ну пластины, содержащие ProB27 среднего предварительно нагревают и достижение равновесного уровня в инкубаторе при 37 ° C и 5% CO2.
Примечание: Место сетчатки organoids 10-15 на хорошо 6-ну плиты. - Измените половина среды каждые 2-3 дня в течение времени, необходимого для получения желаемого клеток сетчатки типы согласно их появление, как описано на рисунке 2.
-
Размораживание hiRPE клеток
- Теплый ProN2 среднего при 37 ° C (8 мл потребуются для каждого криогенных флакона).
- От бака жидким азотом или морозильник-150 ° C оттепель криогенных образцов hiRPEp1 клеток по инкубации в водяной бане при 37 ° C за 30 с. лечить криогенных флакона тщательно используя дезинфицирующий раствор спрей.
- Откройте трубки и добавьте 1 mL подогретым ProN2 среды и передаче суспензию клеток тубы 15 мл с 2 мл подогретым ProN2 среды. Центрифуга для 5 мин при 110 x g.
- Удалить супернатант и нежно ресуспензируйте Пелле клеток в 2 мл ProN2 среды, предварительно нагревают при 37 ° C.
- Подсчет количества ячеек с счетчик соматических клеток.
- Возьмите 1,25 миллиона клеток и поместите их в колбу с покрытием матрица2 см T-25 (см. шаг 2.2.2) содержащий 5 мл ProN2 среды предварительно нагревают при 37 ° C. На этом этапе внимание проход 2 (hiRPEp2).
- Держите клетки hiRPEp2 в ProN2 среде в инкубатор культуры клеток при 37 ° C и 5% CO2 в течение 48 часов перед изменением среды.
- Измените СМИ каждые 2-3 дня. Когда hiRPE клетки достигают слияния, выполните следующий отрывок или криоконсервирования.
Примечание: После 2 недель в культуре, 8-10 миллионов hiRPE клетки могут быть собраны для дальнейших экспериментов.
Результаты
Первым шагом для человека iPSC дифференциации, культивируемые фидер свободных условий16 — закрыть самообновлению механизм, с помощью среды Bi поощрять спонтанное дифференциации (рис. 1A). Затем, в D2, дополняется среды Bi с N2 дополнение для дифференциации iPSCs клетки к линий нервных и сетчатки. Этот процесс приводит к появлению neuroretinal почки в окрестностях D28 (рис. 1 c - 1E). Самостоятельного формирования neuroretinal структуры могут быть изолированы с помощью иглы, как показано на рисунке 1E и переданы культуры пластины позволяют созревания сетчатки organoids в плавающей культуры условиях с использованием ProB27 среднего (Рисунок 1F). В пользу роста и развития нейронных сетчатки, FGF2 добавляется к средству за 1 неделю (рис. 1A).
В D28 возникающих сетчатки структуры содержат главным образом сетчатки прогениторных клеток, которые совместно Экспресс ключевых транскрипционный фактор как PAX6, Ракс и VSX215. Эти предшественники порождают семи основных классов типов клеток сетчатки в плавающей культуры условия в порядке эволюционно сохранены рождения согласуется с развитием человека сетчатки. На основе qRT-PCR и иммуногистохимии, ранее описанных в Райхман и др. 15, широкий кривых на рисунке 2 шоу волны раннего и позднего родился поколений сетчатки клетки во время процесса созревания в пробирке . Таким образом время культуры определяет типы клеток в organoids.
Изоляция hiRPE клеток для дальнейшего усиления может быть выполнена только при пигментации ощутимый, потому что это окрашивание клеток позволяет их визуализации. Таким образом средний ProN2 используется от D28 D42 в пользу пигментация ПЭС клетки15.
В зависимости от человека iPSC клон пигментные пятна могут быть обнаружены до или после самостоятельного формирования сетчатки структур; но главным образом 1 или 2 недели после использования ProN2 среды в D28 (рис. 3а, B). Образ представителя яркие поля hiRPE клеток из изолированных патчи на проход 0 показано на рисунке 3 c и 3D. Затем hiRPE клетки могут быть расширены до прохождения 4, сохраняя их НПП фенотип без эпителия мезенхимальных перехода (EMT). Тем не менее EMT можно предотвратить с помощью рок ингибиторы, такие как Y-27632, позволяя также увеличение ячейку число проходов17. Долгосрочные культуры клеток после оттаивания могут легко выполняться в условиях, описанных здесь, для получения зрелой и функциональных эпителия15hiRPE. Зрелые hiRPEp2 клеток на 52 недели с классической шестигранника булыжником морфология примером в рисунке 3E.

Рисунок 1: формирования и созревания сетчатки organoids с приверженцами человеческого iPSCs. (A) дифференциация протокол, позволяющий поколения сетчатки organoids. (B) человека iPSCs в D0. (C) новые neuroretinal эпителия в D15. (D) самостоятельного формирования нейронных структур сетчатки как на D22. (E) здесь, neuroretinal бутон изолирован с помощью иглы. (F) представитель образы сетчатки organoids в плавающей состояния культуры в D35. Масштаб баров = 200 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
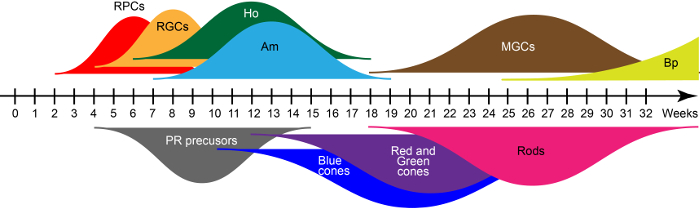
Рисунок 2: волны человека iPSC производные сетчатки клетки поколения. Сокращения: Клетки-предшественники сетчатки (RPC), сетчатки клетки ганглии (РГК), горизонтальные клетки (Ho), Амакриновые клетки (Am), Мюллер глиальные клетки (MGC), Биполярные клетки (Bp) и фоторецепторов (PR). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
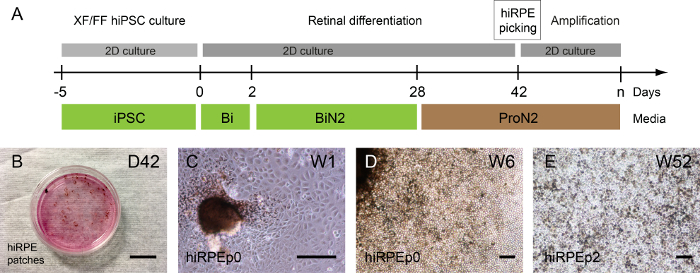
Рисунок 3: генерации и усиления человека iPSC производные ПЭС. (A) Иллюстрация дифференциация протокола, позволяя генерации клеток человеческого hiRPE. (B) фазово контрастной фото показаны пигментированные патчи, переживших дифференциации адэрентных человека iPSCs в неделю 6 (Рейсы W6). (C) hiRPEp0 клетки культивировали одна неделя (W1) после выбора пигментированной патч. (D) hiRPEp0 клетки в неделю 6 (Рейсы W6) после выбора пигментированной патч. (E) A представитель изображение hiRPEp2 клеток после оттаивания, выращивают для 52 недель (W52) в ProN2 среде. Масштаб баров = 200 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Этот протокол описывает, как производить НПП клетки и сетчатки organoids, содержащий сетчатки РГК и фоторецепторов, от человеческих плюрипотентных стволовых клеток в условиях xeno свободных и без подачи. Совместим с процесс надлежащей производственной практики (GMP), метод выращивают здесь представлены позволяет большое производство iPSC производные клеток сетчатки клетки ПЭС, РГК и фоторецепторных клеток для развития на основе стволовых клеток лечение и наркотиков Открытие подходы для будущего лечения дегенеративных заболеваний сетчатки. Криоконсервация целом сетчатки organoids или hiRPE клетки также предоставляет основным преимуществом в создании банков промежуточных клеток, важным шагом для будущего использования в терапии на основе стволовых клеток.
Производство больших запасов типов конкретных клеток сетчатки на определенной стадии дифференцировки потребуются для будущих клинических перевода. В этой связи поколения в три месяца CD73-позитивных фоторецепторных прекурсоров описал как трансплантация совместимых клеток населения18и возможность генерировать эти незрелые фоторецепторы от замораживания размораживания сетчатки organoids15 укрепить надежду для использования этих клеток в терапевтических целях. Относительно пигментированной сетчатки эпителия hiRPE клеток способность размножаться в vitro позволяет крупноклеточный производств в банк их. Главное талой iPSC производные НПП клетки человека сохраняют свои НПП фенотип и функции, поэтому, как трофического фактора секреции или фоторецепторных наружный сегмент фагоцитоза15, проверка их простоту использования для отбора стратегий, а также как для будущие терапевтические подходы.
Существует множество протоколов для поколения iPSC производные сетчатки organoids7,8,9,10,11,12,15 , различаются в Культура методы (embryoid тело, как агрегатов против адэрентных клеток), а также эффективность и надежность. Метод, описанный здесь начинается с приверженцами человеческого iPSCs и показывает воспроизводимый эффективность, приспособляемость и применимости к широкому спектру человеческой iPSC линии15. Этот процесс, основанный на последовательных изменений сыворотки свободных СМИ, резюмирует основные этапы развития сетчатки, используя встроенные подсказки системы для дифференциации. Важным преимуществом этого протокола является отсутствие эмбриональных тела формирования и Добавление матрицы для будущих GMP-совместимый сетчатки клетки, протоколы для получения производных терапии клеток для производства. Таким образом, никакой разницы в эффективности сетчатки органоид поколения и созревания были найдены между культивированная и без культивированная культуры условий с помощью системы терапии клеток (CTS) добавки или нет, сформулированы исключительно с рекомбинантной или гуманизированные компонентов.
Успех метода сетчатки дифференциация во многом зависит от качества человека iPSC культур. Перепрограммирования метод не влияет на эффективность дифференциация человеческого iPSCs клетки сетчатки8, но их статус stemness нужно быть оптимальным. Кратко регулярно обрабатываемых человека iPSCs не должна иметь каких-либо признаков дифференциации. Колонии не должны перекрываться и должны отображать их характерных циклические морфологии. Хотя эффективность сетчатки дифференциация зависит от клонов, как минимум двух сетчатки структур за см2 можно выбрали на D28, соответствующий 50-60 neuroretinal структур для одного 6-см блюдо. Для созревания сетчатки органоид условиях плавающего культуры ограничивая количество структур за хорошо избегает структуры fusion и средних чрезмерное. В этих условиях культуры сетчатки organoids можно вызревшие обширные время, необходимые для получения конце типы клеток сетчатки.
Заглядывая вперед, сетчатки organoids генерируется в vitro этим методом представляют собой мощные инструменты для модели заболевания сетчатки. Пациент конкретных iPSC производные сетчатки клетки модели будет использоваться лучше понять сложные или генетических заболеваний по исследованию их молекулярных и клеточных механизмов. Эти модели будут особенно подходит для обнаружения наркотиков через высокопроизводительного скрининга, клеточной и генной терапии или геном редактирования подходы, разрабатывать новаторские методы лечения дистрофий сетчатки.
Раскрытие информации
Райхман SACHA, Оливье Goureau и Хосе-Ален Сахеля ожидающих изобретателей на патентов, связанных с поколения клетки сетчатки от человеческих плюрипотентных стволовых клеток.
Благодарности
Авторы хотели бы поблагодарить членов группы Goureau за их вклад во время настройки методов, описанных здесь и G. Гальярди и м. Garita за их критического чтения. Эта работа была поддержана от грантов от НРУ (GPiPS: АНР-2010-RFCS005; SightREPAIR: АНР-16-CE17-008-02), Ассоциация Франции сетчатки и передачи технологии компании SATT Lutech. Она также была проведена в рамках LABEX LIFESENSES (АНР-10-LABX-65) поддерживается НРУ в рамках программы будущее Investissements (АНР-11-IDEX-0004-02).
Материалы
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
Ссылки
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены