Method Article
Definidos Xeno-free e livre de alimentador condições de cultura para a geração de humanos iPSC-derivado da retina célula modelos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A produção de células especializadas da retina, de células-tronco pluripotentes é um ponto de viragem no desenvolvimento da terapia baseada em células-tronco para doenças da retina. O presente documento descreve um método simples para uma eficiente geração de organoids da retina e Epitélio pigmentado da retina para pesquisa básica, translacional e clínica.
Resumo
A produção de células especializadas de células-tronco pluripotentes fornece uma ferramenta poderosa para desenvolver novas abordagens para a medicina regenerativa. O uso de células-tronco pluripotentes induzidas pelo homem (iPSCs) é particularmente atraente para estudos de doenças neurodegenerativas, incluindo distrofias da retina, onde modelos de iPSC-derivado de células da retina marcam um grande passo em frente para compreender e lutar contra a cegueira. Neste trabalho, descrevemos um protocolo simples e escalável para gerar, maduro e cryopreserve organoids da retina. Baseado nas alterações de médio, a principal vantagem deste método é evitar múltiplas e comumente necessárias etapas demoradas em uma diferenciação guiada de iPSCs. Imitando as primeiras fases do desenvolvimento da retina por sucessivas mudanças de meios definidos em culturas de iPSC humana aderente, este protocolo permite a geração simultânea de automoldável estruturas neuroretinal e da retina pigmentada (RPE) as células epiteliais em um maneira eficiente e reproduzível em 4 semanas. Estas estruturas contendo células progenitoras da retina (RPCs) podem ser facilmente isoladas para maturação ainda mais em uma condição de cultura flutuante, permitindo a diferenciação de RPCs nos sete tipos de célula da retina presentes na retina humana adulta. Além disso, descrevemos os métodos rápidos para a criopreservação de organoids da retina e as células RPE para armazenamento a longo prazo. Combinados, os métodos descritos aqui será útil para produzir e banco iPSC-derivado da retina células ou tecidos para a investigação básica e clínica.
Introdução
A retina é uma parte integrante do sistema nervoso central (SNC) e tem uma capacidade limitada para regenerar espontaneamente após uma lesão traumática ou doenças. Portanto, patologias degenerativas, causando a perda definitiva de células da retina, como a degeneração macular relacionada à idade (DMRI), retinite pigmentosa (RP), glaucoma e retinopatia diabética, normalmente levam a cegueira irreversível. Resgatando a retina degenerada é um grande desafio para o qual terapias baseadas em células-tronco, com o objetivo de substituir as células danificadas ou perdidas são uma das mais promissoras abordagens1,2,3. Células-tronco pluripotentes como células-tronco embrionárias humanas (CES) células ou células-tronco pluripotentes induzidas pelo homem (iPSCs) têm a capacidade de ser expandido indefinidamente em cultura, e eles têm potencial para produzir quaisquer tipos de células. Avanços em nossa compreensão do desenvolvimento da retina e a melhoria do in vitro protocolos para diferenciação de iPSC humana resultaram na geração de retina organoids7,8,9, 10,11,12. Todas as principais células da retina, incluindo células ganglionares da retina (RGCs), fotorreceptores e células da retina pigmentadas epiteliais (RPE), tem sido com sucesso diferenciadas da humana CES e iPSCs4,5, 6. baseado no método desenvolvido por Eiraku et al SFEB (cultura dos agregados do embryoid do corpo-como isento de soro) 13, auto formação de organoids da retina pode ser obtida ESC ou iPSC-derivado do embryoid corpo-como agregados em componentes de matriz extracelular definidos a7,10,14. Mas estes protocolos são complexas, que exigem um grande número de passos não é sempre compatíveis com a grande produção de células para abordagens terapêuticas ou triagem de drogas. Assim, a escolha do método para a produção de células da retina humanas é crítica e o método precisa ser robusto, escalável e eficiente.
Aqui, com base na nossa anterior publicação15, descrevemos cada passo para uma simples e eficiente geração de células da retina através da retina organoides auto formação de aderentes iPSCs humana cultivada em uma condição livre de alimentador e xeno. A partir de culturas de rotina de iPSCs humana aderente, este protocolo requer apenas um simples meio sucessivo mudando para permitir a geração de células iPS-derivado de RPE (hiRPE) e neuroretinal estruturas em 4 semanas. Após um isolamento manual, hiRPE pode ser expandido e as estruturas da retina podem ser cultivadas como flutuante organoids onde as células progenitoras da retina são capazes de se diferenciar em todos os tipos de células da retina em ordem sequencial consistente com o humano na vivo retinogenesis. Finalmente, para o avanço de pesquisa ou clínica tradução, descrevemos um método de criopreservação, permitindo o armazenamento a longo prazo do organoids inteiro da retina e células hiRPE sem afetar suas características fenotípicas e funcionalidade.
Protocolo
O protocolo descrito neste documento segue as diretrizes do Comitê de ética de pesquisa do Institut de la Vision. O Institut de la Vision foi autorizada a manipulação de espécime humano de acordo com o actual regulamento francês. Manipulação de amostra segue a proteção de dados do paciente em conformidade com os princípios de Helsínquia e regulamentações nacionais após a aprovação ética do "Comité de Protection des Personnes (CPP) de V".
1. preparação de meios de cultura e pratos
-
Meios de cultura
- Usar meio de iPSC, um meio quimicamente definido, dedicado à cultura de células-tronco pluripotentes no alimentador-free condições16. Prepare 500 mL de meio de acordo com o protocolo do fabricante.
- Médio de iPSC Basal (Bi) de uso, o iPSC quimicamente definido meio sem fator de crescimento fibroblástico 2 (FGF2) ou fator de crescimento transformador Beta (TGFß).
- Preparar 500 mL de meio de Bi suplementado com suplemento 1% N2 (BiN2 médio), 10 unidades/mL de penicilina e 10 mg/mL de estreptomicina.
- Prepare 500 mL de proneural baseado em N2 medium (médio ProN2) composto de mistura de DMEM:Nutrient F-12 (DMEM/F12, 1:1, L-glutamina), 1% MEM aminoácidos não essenciais, suplemento 1% N2, 10 unidades/mL de penicilina e 10 mg/mL de estreptomicina.
- Preparar proneural B27-baseado meio (meio ProB27) composto de mistura de DMEM:Nutrient F-12 (DMEM/F12, 1:1, L-glutamina), 1% MEM aminoácidos não essenciais, suplemento de 2% B27, 10 unidades/mL de penicilina e 10 mg/mL de estreptomicina.
-
Preparação de navio de cultura
-
Para a cultura humana iPSC
- Prepare-se 10 mL de uma solução de vitronectina contendo 5 μg/mL de vitronectina na 1X PBS. Em 10 mL de 1X PBS, adicione 100 µ l de solução-mãe vitronectina descongeladas (100 x).
- Distribua 2 mL da solução vitronectina por placa de cultura de 6 cm, correspondente a 0,5 µ g/cm2. -Incube por 1h à temperatura ambiente (RT). Remova a solução vitronectina por aspiração usando um sistema de vácuo-aspiração ou uma pipeta de 5 mL.
- Adicione 4 mL de meio de iPSC por prato de 6 cm.
- Incube os pratos em uma incubadora de cultura celular em 37 ° C e 5% de CO2 por um período mínimo de 30 min antes de usar.
- Para cultura celular RPE (hiRPE) humana derivado de iPSC
- Use uma matriz de qualificado de células-tronco pluripotentes ou substrato para revestimento de poços, de acordo com o protocolo do fabricante. Adicione suficiente matriz ou substrato para cobrir a superfície inteira de crescimento. Por exemplo, colocar 300 µ l de matriz por bem em placa de 24 e 3 mL de matriz em um balão de2 cm T-25.
- Incubar os vasos revestidos de cultura por um período mínimo de 1 h a 37 ° C. Remova a matriz usando uma pipeta de 5 mL ou sistemas de vácuo-aspiração.
- Adicionar 1 mL de meio de ProN2 por bem em placas de 24 poços e retornar a embarcação de cultura para a incubadora para um mínimo de 30 min para aquecer e equilibrar o meio. Para balões de2 cm T-25, consulte a etapa 5.2.
-
Para a cultura humana iPSC
2. manutenção e expansão do humano iPSCs
-
Manutenção de iPSCs humana
- Prepare-se 3 mL de meio de iPSC em um tubo de 15 mL e mantê-lo em RT para um mínimo de 15 min antes do uso. Prepare um prato de 6 cm revestido, conforme descrito no ponto 1.2.1.
- Descongelar uma amostra criogênica de iPSCs humana de um tanque de nitrogênio líquido ou de um congelador de-150 º C por incubação em banho-maria a 37 ° C por 30 s.
- Desinfecte cuidadosamente o frasco criogênico usando um spray de solução desinfetante. Transferir o descongeladas iPSCs humana do criotubo para o tubo de 15 mL contendo 3 mL do meio de iPSC pré aquecido no RT
- Centrifugar o tubo a 110 x g por 3 min. Retire o sobrenadante por aspiração usando um sistema de vácuo-aspiração ou uma pipeta de 5 mL.
- Ressuspender as células com 1 mL de meio de iPSC de um prato de cultura vitronectina revestido de 6 cm, com uma pipeta 2 mL e transferir as células volta ao prato. Devolver o prato para a incubadora a 37 ° C e 5% de CO2 por um período mínimo de 24 h antes de mudar o meio.
Nota: Um inibidor ROCK, como Y-27632 a 10 µM, pode ser adicionado ao meio de iPSC nos pratos de cultura de 6 cm para reduzir a apoptose. - Mudar o meio dia e passar as iPSCs humana toda semana.
-
Passagem de iPSCs humana
- Passe o iPSC humana em uma confluência de 70-80%, classicamente após 7 dias em cultura.
- Prepare pratos de 6 cm para a passagem, conforme descrito na etapa 1.2.1. Retire os pratos com confluentes iPSCs meio de iPSC e adicione 2 mL de uma solução de dissociação para 6 min no RT
Nota: O tempo de incubação varia de acordo com os clones de iPSC. Tente uma incubação de 6 min como ponto de partida. - Remova a solução de dissociação usando sistemas de vácuo-aspiração ou uma pipeta de 5 mL e adicione 2 mL do meio de iPSC pré aquecido em RT. Ressuspender as colônias de iPSC pipetando-los acima e abaixo de 5-10 x com uma pipeta de 1.000 µ l.
Atenção: Evite dissociação única célula de pipetagem excessiva. - Transferi 30 a 200 µ l de aglomerados de ressuspensão de célula em uma nova placa de cultura de 6 cm. Retorne os pratos para a incubadora de cultura celular em 37 ° C e 5% de CO2 por um período mínimo de 24 h antes de mudar o meio.
Nota: O volume de aglomerados de ressuspensão celular necessária para a passagem depende dos clones de iPSC. - Mudar o meio dia e passar as iPSCs humana toda semana.
3. geração de Organoids da retina
- Inicie a diferenciação de iPSC, seguindo o protocolo esquematizado na figura 1A , quando as colónias atingir uma confluência de 60-70% (figura 1B).
- Prepare-se 4 mL de meio de Bi por prato de 6 cm. Aquecer o meio Bi a 37 ° C. Altere o meio de iPSC para médio de Bi. Observe este tempo como dia 0 (D0).
- Em D2, mudar as culturas em meio de Bi para um BiN2 médio, previamente aquecido a 37 ° C. Altere o meio de cada 2-3 dias.
- Identificar emergent auto-formação organoids da retina por botões de neuroepithelium, como mostrado na Figura 1 -1E.
Nota: Estes primeiros organoids da retina, correspondente em seu estágio do desenvolvimento para a Copa de óptica, pode ser manualmente isolados para experimentação a jusante.
4. a maturação de Organoids da retina
- No D28, prepare-se bem-6 placas contendo 4 mL/poço das ProB27 inicialmente suplementado com 10 ng/mL de FGF2 (figura 1A).
Nota: Adicione FGF2 imediatamente antes que a mídia é adicionada às placas.
Cuidado: Não filtro FGF2. - Recupere as estruturas da retina manualmente os pratos de 6 cm. Para fazer isso, isolar as estruturas fazer estrias perpendiculares com a agulha ao redor do botão neuroepithelial, conforme mostrado na Figura 1Ee separe o organoids riscando-os delicadamente com a agulha.
- Aspire organoids de 10-15, usando uma pipeta de 1.000 µ l e transferi-los em um único poço da placa de 6-poços contendo meio de ProB27.
- Manter o organoids da retina em condições de cultura flutuante no meio de ProB27 em uma incubadora de cultura celular em 37 ° C e 5% de CO2. Metade do meio de mudar a cada 2-3 dias.
Nota: Trate o organoids com FGF2 até D35. - No D35, retire metade do meio e adicione meio fresco de ProB27 escaldado a 37 ° C, sem FGF2.
- Metade do meio de mudar a cada 2-3 dias durante o tempo necessário para obter os tipos de célula da retina desejada de acordo com o surgimento de tipos de células da retina, como ilustrado na Figura 2.
5. geração e amplificação de iPSC-derivado RPE (hiRPE) células de origem humana
-
Geração de células humanas hiRPE
- Envolver as iPSCs em diferenciação, quando as colónias atingir uma confluência de 60-70%, seguindo o protocolo esquematizado na Figura 3A.
- Preparar 4 mL por prato de 6 cm do meio Bi e aquecer o meio Bi a 37 ° C. Altere o meio de iPSC para médio de Bi. Observe este tempo como dia 0 (D0).
- Em D2, mudar as culturas em meio de Bi para um meio BiN2 previamente aquecido a 37 ° C. Altere o meio de cada 2-3 dias.
- D28, altere o meio para um meio fresco de ProN2 previamente aquecido a 37 ° C, conforme representado na Figura 3A.
Nota: Este passo pode ser feito após a colheita de organoides descrita na etapa 4. - Mude o meio ProN2 cada 2-3 dias.
- A D42, identifica células hiRPE emergentes pela observação de manchas pigmentadas como mostrado na Figura 3B.
Nota: A pigmentação das células hiRPE aparece entre D35 para D56 dependendo dos clones de iPSC.
-
Amplificação de células hiRPE
- No D42, prepare uma placa de 24 previamente revestido com a matriz, conforme descrito na etapa 1.2.2 e contendo 1 mL de meio de ProN2 por bem. Coloque a placa por 15 min na incubadora a 37 ° C e 5% CO2 antes de usar.
- Recupere os patches hiRPE manualmente o prato de 6 cm. Para isolar os patches, fazer uma faixa perpendicular com a agulha ao redor do epitélio pigmentado e separe a folha por arranhá-lo suavemente com a agulha. Aspirar 10 manchas pigmentadas utilizando uma pipeta de 1.000 µ l e transferi-los em um único poço da placa de 24 poços.
- Mantenha os patches hiRPE ProN2 médio em uma incubadora de cultura celular em 37 ° C e 5% CO2 por 48 h antes de mudar o meio. Observe esta passagem de célula hiRPE como 0 (hiRPEp0). Altere o meio de cada 2-3 dias com ProN2 médio.
- Quando as células são confluentes, passe as células hiRPEp0.
- Retire o meio usando sistemas de vácuo-aspiração e lave cada bem 1 x com 1 mL de PBS usando uma pipeta de 5 mL.
- Descartar a PBS usando sistemas de vácuo-aspiração, adicionar 200 µ l por alvéolo de tripsina 0,25% e incube-lo por um período mínimo de 15 min em uma incubadora a 37 ° C. Adicione 800 µ l de meio ProB27 para inactivar a tripsina.
Nota: Não é recomendado o uso de ProN2 meio de parar a atividade de tripsina. - Dissocia a folha de hiRPE células pipetando-lo acima e para baixo. Coloque a suspensão de células em um tubo de 15 mL e centrifugue por 5 min a 110 x g.
Nota: Uma lavagem adicional pode ser feita com ProN2 médio para remover o excesso de ProB27 médio. - Remover o sobrenadante e suavemente Ressuspender as células em 2 mL do meio de ProN2 pré aquecido a 37 ° C. Conte as células com um contador de célula.
- Levar a 1,25 milhões de células e colocá-los em um frasco de2 matriz-revestido da T-25 cm (consulte a etapa 2.2.2) contendo 5 mL de meio ProN2 pré aquecido a 37 ° C. Observe esta passagem de célula hiRPE como 1 (hiRPEp1).
- Manter as células de hiRPE no meio de ProN2 em uma incubadora de cultura celular em 37 ° C e 5% CO2 por 48 h antes de mudar o meio.
- Mude os meios de comunicação a cada 2-3 dias. Quando as células de hiRPEp1 chegarem a confluência, execute a seguinte passagem ou criopreservação.
6. criopreservação de Organoids da retina e células hiRPE
-
Para organoids toda da retina
- Selecione o organoids da retina de 5 a 20 usando uma pipeta de transferência e colocá-los em um frasco criogênico. Remova qualquer excesso com uma pipeta de 1.000 µ l de meio sem tocar o organoids na parte inferior do tubo e adicionar 250 µ l de meio frio criopreservação (ver Tabela de materiais).
- Congele os frascos em um recipiente de congelação baseada em isopropanol a-80 ° C durante um período mínimo de 4 h. transferência os frascos congelados para um congelador de-150 º C ou tanque de nitrogênio líquido para armazenamento a longo prazo.
-
Para as células hiRPE
- Na passagem 1, dissocia as células hiRPE quando as células são confluentes.
Nota: Não é recomendada uma criopreservação de células hiRPEp0. - Aspire o meio do balão de T-25 cm2 usando sistemas de vácuo-aspiração e lavá-lo 1x com 3 mL de PBS usando uma pipeta de 5 mL.
- Remover a PBS usando sistemas de vácuo-aspiração, adicionar 1 mL de tripsina 0,25% e incube-lo por um período mínimo de 15 min em uma incubadora a 37 ° C. Adicione 5 mL de meio de ProB27 para parar a atividade de tripsina.
Nota: Não é recomendado o uso de ProN2 médio para inactivar a tripsina. - Dissocia a folha de hiRPE células pipetando-lo acima e para baixo com uma pipeta de 10 mL. Conte as células com contador de célula. Coloque a suspensão de células em um tubo de 15 mL e centrifugue por 5 min a 110 x g.
Nota: Uma lavagem adicional pode ser executada com ProN2 médio para remover o excesso de ProB27 médio. - Aspirar o sobrenadante usando vácuo-aspiração e ressuspender delicadamente as células para obter 2 milhões de células em 250 µ l de meio de criopreservação.
- Transferência de 250 µ l de suspensão de células por frasco criogênico. Congele os frascos em um recipiente de congelação baseada em isopropanol a-80 ° C por um período mínimo de 4h.
- Transferi os frascos congelados para um freezer de-150 º C ou um tanque de nitrogênio líquido para armazenamento a longo prazo.
- Na passagem 1, dissocia as células hiRPE quando as células são confluentes.
7. descongelamento de Organoids da retina e células hiRPE
-
Descongelamento de toda retina organoids
- Médio de ProB27 aquecido a 37 ° C (2ml será necessário para cada frasco criogênico).
- Congelador de-150 º C ou do tanque de nitrogênio líquido, descongele um frasco criogênico contendo organoids da retina em banho-maria a 37 ° C por 30 s. desinfectar o frasco criogênico com cuidado usando um spray de solução desinfetante.
- Abrir o frasco e adicione 1 mL de meio de ProB27 previamente aquecido. Transferi o organoids para um tubo de 1,5 mL com uma pipeta de transferência.
- Retire o meio suavemente pipetando-lo sem tocar as estruturas da retina no fundo do tubo. Lave o organoids 1 mais uma vez com 1 mL do meio de ProB27 previamente aquecido.
- Aspirar o organoids com uma pipeta de transferência e colocá-los em 1 bem de uma placa de 6 contendo ProB27 médio pré aquecido e equilibrado numa incubadora a 37 ° C e 5% de CO2.
Nota: Coloque organoids da retina de 10-15 por alvéolo de uma placa de 6. - Metade do meio de mudar a cada 2-3 dias durante o tempo necessário para obter os tipos de células da retina desejada de acordo com o seu surgimento, conforme descrito na Figura 2.
-
Descongelamento das células hiRPE
- Médio de ProN2 aquecido a 37 ° C (8 mL será necessário para cada frasco criogênico).
- -150 º C congelador ou do tanque de nitrogênio líquido, descongele uma amostra criogênica de células hiRPEp1 por uma incubação em banho-maria a 37 ° C por 30 s. desinfectar o frasco criogênico cuidadosamente usando spray de solução desinfetante.
- Abra o tubo e adicionar 1 mL de meio de ProN2 previamente aquecido e transfira a suspensão de células para um tubo de 15 mL contendo 2 mL do meio de ProN2 previamente aquecido. -Centrifugar durante 5 min à 110 x g.
- Remover o sobrenadante e suavemente Ressuspender as células em 2 mL do meio de ProN2 pré aquecido a 37 ° C.
- Conte as células com um contador de célula.
- Pegue a 1,25 milhões de células e colocá-los o matriz revestidos T-25 cm2 balão (ver passo 2.2.2) contendo 5 mL de meio ProN2 pré aquecido a 37 ° C. Nesta fase, note a passagem 2 (hiRPEp2).
- Manter as células de hiRPEp2 no meio de ProN2 na incubadora de cultura celular em 37 ° C e 5% CO2 por 48 h antes de mudar o meio.
- Mude os meios de comunicação a cada 2-3 dias. Quando as células hiRPE alcançar confluência, execute a seguinte passagem ou criopreservação.
Nota: Depois de 2 semanas na cultura, 8 milhões hiRPE células podem ser coletadas para novas experimentações.
Resultados
O primeiro passo para a diferenciação de iPSC humana cultivada em condições de alimentador-livre16 é para desligar máquinas de auto-renovação usando meio de Bi para incentivar uma diferenciação espontânea (figura 1A). Em seguida, no D2, o meio de Bi é complementado com um suplemento de N2 para guiar diferenciando as células de iPSCs para as linhagens neurais e da retina. Este processo leva ao aparecimento de botões de neuroretinal no próximo D28 (Figura 1 - 1E). Auto-formação neuroretinal estruturas podem ser isoladas, usando uma agulha, como ilustrado na Figura 1E e transferido para placas de cultura para permitir o amadurecimento do organoids da retina em condições de cultura flutuante usando o meio de ProB27 (Figura 1F). Para favorecer o crescimento e desenvolvimento da retina neural, FGF2 é adicionado ao meio para 1 semana (figura 1A).
No D28, as estruturas emergentes da retina contêm principalmente as células progenitoras da retina que co expressam o fator de transcrição chave como PAX6, RAX e VSX215. Estes progenitores dão origem às sete classes principais tipos de células da retina em condições de cultura a flutuar em uma ordem de nascimento evolutivamente conservada consistente com o desenvolvimento da retina humano. Com base em qRT-PCR e imunohistoquímica descrito anteriormente na Reichman et al 15, as curvas amplas na Figura 2 mostram ondas de gerações de células da retina cedo e tarde-nascido durante um processo de maturação in vitro . Assim, o tempo de cultura define os tipos de células presentes no organoids.
O isolamento de células hiRPE para qualquer outra amplificação pode ser executado somente quando a pigmentação é perceptível porque esta coloração celular permite sua visualização. Desta forma, o meio de ProN2 é usado de D28 para D42 para favorecer a pigmentação da RPE células15.
Dependendo o clone humano iPSC, as manchas pigmentadas podem ser detectadas antes ou depois da auto formação de estruturas da retina; Mas na maior parte 1 ou 2 semanas após o uso de ProN2 médio no D28 (Figura 3A, B). Uma imagem representativa de campo brilhante de células hiRPE expandido desde os patches isolados na passagem 0 é mostrada na Figura 3 e 3D. Em seguida, as células de hiRPE podem ser expandidas até passagem 4, mantendo seu fenótipo RPE sem uma transição epitelial-mesenquimal (EMT). Não obstante, EMT pode ser evitado pelo uso de inibidores ROCK tais como Y-27632, permitindo, também, um aumento de passagens número17da célula. A longo prazo culturas de células hiRPE após o descongelamento podem ser facilmente efectuadas nas condições descritas aqui para obter um epitélio maduro e funcional15. Um exemplo de células maduras hiRPEp2 na semana 52 com uma morfologia clássica cuboidal paralelepípedos é ilustrado na Figura 3E.

Figura 1: geração e maturação de organoids da retina de aderentes iPSCs humana. (A) protocolo de diferenciação que permite a geração de organoids da retina. (B) humano iPSCs em D0. (C) emergentes neuroretinal epitélio em D15. (D) auto-formação retina-como estruturas neurais no D22. (E) aqui, o broto de neuroretinal é isolado usando uma agulha. (F) imagens representativas do organoids da retina em condição de cultura de flutuação em D35. Escala de barras = 200 µm. clique aqui para ver uma versão maior desta figura.
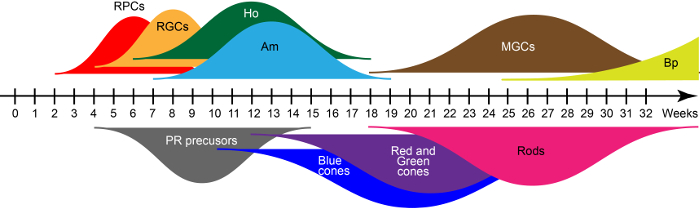
Figura 2: ondas de retina humana iPSC-derivado de célula geração. Abreviaturas: Células progenitoras de Retinal (RPCs), células de ganglionares da retina (RGCs), células horizontais (Ho), células de amacrine (Am), células gliais de Müller (MGCs), células bipolares (Bp) e fotorreceptores (PR). Clique aqui para ver uma versão maior desta figura.
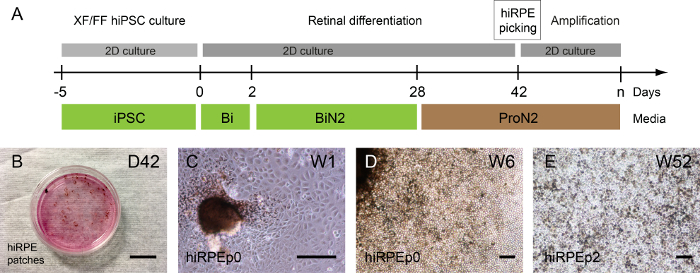
Figura 3: geração e amplificação de RPE iPSC-derivado humana. (A) uma ilustração do protocolo de diferenciação que permite a geração de células hiRPE humanas. (B) imagens de contraste de fase apresentando pigmentado patches emergindo diferenciando aderentes iPSCs humana na semana 6 (W6). (C) hiRPEp0 células cultivaram uma semana (W1) após a colheita de remendo pigmentadas. (D) hiRPEp0 células na semana 6 (W6) após a colheita de remendo pigmentadas. (E) A imagem representativa de hiRPEp2 células após o descongelamento, cultivadas por 52 semanas (W52) ProN2 médio. Escala de barras = 200 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve como produzir as células RPE e organoids da retina, contendo RGCs da retina e fotorreceptores, de células-tronco pluripotentes humanas em condições de livre de xeno e alimentador. Compatível com o processo de boas práticas de fabricação (BPF), o método cultivado aqui apresentada permite uma grande produção de iPSC-derivado de células da retina como RPE células RGCs e fotorreceptores para o desenvolvimento de terapias baseadas em células-tronco e drogas abordagens de descoberta para o tratamento futuro de doenças degenerativas da retina. A criopreservação de toda retina organoids ou células hiRPE também oferece uma grande vantagem na criação de bancos de células intermediárias, um passo importante para uso futuro em terapias baseadas em células-tronco.
A produção de grandes estoques de tipos específicos de células da retina em um estágio específico de diferenciação será exigida para futura tradução clínica. A este respeito, a geração nos três meses de precursores de fotorreceptoras CD73 positivo descrito como um celular compatível com o transplante de população18e a possibilidade de gerar esses fotorreceptores imaturos de congelamento-descongelamento da retina organoids15 reforçar a esperança de usar essas células para fins terapêuticos. Sobre o epitélio pigmentado da retina, a capacidade de hiRPE células a proliferar em vitro permite produções de grandes células para o banco deles. Importante, descongeladas células RPE de iPSC-derivado humanas retêm seu fenótipo RPE e função, portanto, como fator trófico secreção ou fotorreceptoras segmento externo fagocitose15, validando a sua facilidade de uso para a seleção de estratégias, bem como para abordagens terapêuticas futuras.
Há uma variedade de protocolos para a geração de iPSC-derivado da retina organoids7,8,9,10,11,12,15 que variam em cultura de métodos (embryoid corpo-como agrega vs células aderentes) bem como a eficiência e robustez. O método descrito aqui começa a partir de iPSCs humana aderentes e mostra uma eficácia reprodutível, adaptabilidade e aplicabilidade para uma ampla gama de linhas de iPSC humana15. Este processo, com base em sucessiva mudança de mídia livre de soro, recapitula as principais etapas do desenvolvimento da retina, explorando as pistas intrínsecas do sistema para orientar a diferenciação. Uma importante vantagem deste protocolo é a ausência de formação do corpo embrionário e a adição da matriz para futura célula da retina GMP-compatível com protocolos para produzir derivados de terapia de célula de fabricação. Desta forma, não há diferença na eficiência da geração da retina organoides e maturação foram encontrados entre as condições de cultura xenogénica e não-xenogénica usando suplementos sistema de terapia celular (CTS), ou não, formulado exclusivamente com recombinante ou componentes humanizados.
O sucesso do método de diferenciação da retina depende em grande medida a qualidade das culturas humanas iPSC. O método de reprogramação não influencia a eficiência de diferenciação de iPSCs humana para células da retina8, mas seu status de stemness precisa ser o ideal. Brevemente, rotineiramente cultivada iPSCs humano não deve apresentar sinais de diferenciação. As colônias não devem se sobrepor e devem exibir sua morfologia característica circular. Embora a eficiência da diferenciação da retina é dependente do clone, um mínimo de duas estruturas da retina por cm2 pode ser cutucado D28, correspondente a 50-60 neuroretinal estruturas para um prato de 6 cm. Para a maturação da retina organoides em condições de cultura flutuante, limitando o número de estruturas por alvéolo evita a fusão de estrutura e excesso de consumo médio. Nestas condições de cultura, organoids da retina pode ser maturada por um tempo extenso, exigidas para a obtenção final tipos de células da retina.
Olhando para a frente, organoids da retina gerado em vitro por esse método constituem ferramentas poderosas para doenças da retina do modelo. Modelos específicos do paciente iPSC-derivado de célula da retina serão usados para compreender melhor as doenças complexas ou genéticas pela exploração de seus mecanismos moleculares e celulares. Esses modelos serão particularmente apropriados para descoberta de drogas através da seleção da elevado-produção, terapias celulares e gene ou genoma edição de abordagens, para desenvolver tratamentos inovadores para distrofias da retina.
Divulgações
Sacha Reichman, Olivier Goureau e José-Alain Sahel são inventores na pendente patentes relacionadas com a geração de células da retina a partir células-tronco pluripotentes humanas.
Agradecimentos
Os autores gostaria de agradecer aos membros da equipe do Goureau para sua entrada durante o set-up dos métodos descritos aqui e G. Gagliardi e M. Garita para sua leitura crítica. Este trabalho foi apoiado por concessões do ANR (GPiPS: ANR-2010-RFCS005; SightREPAIR: ANR-16-CE17-008-02), a associação de França de Retina e a transferência de tecnologia empresa Lutech SATT. Também foi realizada no quadro do LABEX LIFESENSES (ANR-10-LABX-65) suportado pela ANR dentro do programa de d'Avenir de Investissements (ANR-11-IDEX-0004-02).
Materiais
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
Referências
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados