Method Article
定义的无异和无饲养培养条件的人 iPSC 视网膜细胞模型的生成
摘要
多潜能干细胞的专业视网膜细胞的产生是干细胞治疗视网膜疾病的一个转折点。本文介绍了一种有效生成视网膜 organoids 和视网膜色素上皮的简单方法, 用于基础、平移和临床研究。
摘要
多潜能干细胞的专业细胞的生产为再生医学的发展提供了有力的工具。使用人类诱导的多能干细胞 (iPSCs) 对神经退行性疾病研究特别有吸引力, 其中包括视网膜白斑, iPSC 视网膜细胞模型标志着一个重要的步骤, 以了解和消除失明。在本文中, 我们描述了一个简单和可扩展的协议, 以生成, 成熟, cryopreserve 视网膜 organoids。在媒介变化的基础上, 该方法的主要优点是避免了在 iPSCs 的引导分化过程中通常需要的多次和耗时的步骤。模拟视网膜发育的早期阶段由被定义的媒介的连续的变动在黏附人的 iPSC 文化, 这个协议允许同时产生自已形成的 neuroretinal 结构和视网膜色素上皮 (RPE) 细胞在4周内重现性和高效的方式。这些结构包含视网膜祖细胞 (rpc) 可以很容易地分离, 以进一步成熟的漂浮培养条件, 使 rpc 分化为七视网膜细胞类型存在于成人视网膜。此外, 我们还描述了快速保存视网膜 organoids 和视网膜色素上皮细胞长期贮存的方法。结合起来, 这里描述的方法将是有用的生产和银行人类 iPSC 的视网膜细胞或组织的基础和临床研究。
引言
视网膜是中枢神经系统的一个组成部分, 在外伤或疾病后自发再生的能力有限。因此, 退行性病变导致明确的视网膜细胞丢失, 如年龄相关黄斑变性 (AMD), 视网膜色素变性 (RP), 青光眼和糖尿病视网膜病变, 通常导致不可逆转的失明。抢救视网膜退化是一个主要的挑战, 以干细胞为基础的治疗, 旨在取代受损或丢失的细胞是最有希望的方法1,2,3。多潜能干细胞作为人类胚胎干细胞 (ESCs) 细胞或人类诱导的多潜能干细胞 (iPSCs) 有能力在培养中无限期扩展, 它们有可能产生任何细胞类型。我们对视网膜发育的认识和改善人 iPSC 分化的体外协议的进展, 导致了视网膜 organoids7,8,9的产生, 10,11,12。所有的主要视网膜细胞, 包括视网膜神经节细胞 (RGCs), 感光细胞, 视网膜色素上皮 (RPE), 已经成功地分化为人类 ESCs 和 iPSCs4,5, 6. 以 Eiraku等为基础, 建立了 SFEB (胚状体样骨料) 的无血清培养方法。13、在定义的胞外基质成分7、10、14中, 可从 ESC 或 iPSC 衍生的胚体样骨料中获得视网膜 organoids 的自形成。但是这些协议是错综复杂的, 需要大量的步骤并不总是与大规模生产细胞的治疗方法或药物筛选。因此, 人类视网膜细胞生成方法的选择是至关重要的, 该方法需要健壮、可伸缩性和高效性。
在这里, 根据我们以前的出版物15, 我们描述了一个简单和高效的视网膜细胞的每一个步骤, 通过视网膜 organoid 自形成从黏附人 iPSCs 培养在无饲养和异的条件。从人类 iPSCs 的常规文化出发, 该协议只需要一个简单的连续培养基改变, 以允许在4周内生成 iPS 源性 RPE (hiRPE) 细胞和 neuroretinal 结构。人工隔离后, hiRPE 可以扩展, 视网膜结构可以培养为漂浮 organoids, 在那里视网膜祖细胞能够按照与体内人一致的顺序依次分化为所有视网膜细胞类型。retinogenesis。最后, 对于研究进展或临床翻译, 我们描述了一种冷冻方法, 允许长期储存的整个视网膜 organoids 和 hiRPE 细胞不影响其表型特征和功能。
研究方案
本文件所述的议定书遵循了 la 远景研究伦理学委员会的指导方针。根据目前的法国规定, 该研究所的视觉被允许操纵人体标本。标本处理遵循赫尔辛基的原则, 并在 "保护联合会 (CPP) 法国 V" 的伦理批准后的国家条例的情况下, 病人数据保护。
1. 培养培养基和菜肴的准备
-
文化媒体
- 使用 iPSC 培养基, 一种化学定义的培养基, 专门用于无馈线条件下的多潜能干细胞培养16。根据制造商的协议, 准备500毫升的培养基。
- 使用基底 iPSC (Bi) 培养基, iPSC 化学定义培养基无成纤维细胞生长因子 2 (FGF2) 或转化生长因子β (TGFß)。
- 准备500毫升的双介质, 辅以 1% N2 补充剂 (BiN2 培养基), 10 单位/毫升青霉素, 和10毫克/毫升链霉素。
- 准备500毫升的 proneural N2-based 培养基 (ProN2 培养基) 由 DMEM 组成: 营养混合物 F-12 (DMEM/F12, 1:1, l-谷氨酰胺), 1% 个不必要的氨基酸, 1% N2 补充, 10 单位/毫升青霉素, 和10毫克/毫升链霉素。
- 制备 proneural B27-based 培养基 (ProB27 培养基), 由 DMEM 组成: 营养混合物 F-12 (DMEM/F12, 1:1, l-谷氨酰胺), 1% 个不必要氨基酸, 2% B27 补充剂, 10 单位/毫升青霉素和10毫克/毫升链霉素。
-
培养容器的制备
-
人类 iPSC 文化
- 在 1x PBS 中准备10毫升含有5微克/毫升及其与受精的及其与受精溶液。在10毫升的 1x PBS, 添加100µL 解冻及其与受精库存解决方案 (100x)。
- 2毫升的及其与受精溶液每6厘米培养皿对应于0.5 µg/厘米2。在室温下孵化1小时 (RT)。用抽吸系统或5毫升吸管去除及其与受精溶液。
- 添加4毫升的 iPSC 培养基每6厘米菜。
- 在37摄氏度和 5% CO2的细胞培养孵化器中孵化菜肴, 使用前至少要30分钟。
- 人类 iPSC 的视网膜色素 (hiRPE) 细胞培养
- 根据制造商的协议, 使用多能干细胞合格的基质或基底来涂水井。添加足够的基质或基底覆盖整个生长表面积。例如, 在 T-25 cm2瓶中, 在24井板和3毫升矩阵中放入300µL 矩阵。
- 至少在37摄氏度的1小时内孵化出涂层培养容器。使用真空吸入系统或5毫升吸管去除基体。
- 在24井板上添加1毫升的 ProN2 培养基, 并将培养容器返回到孵化箱, 使培养基的温度和平衡最小30分钟。对于 T-25 厘米2烧瓶, 请参阅步骤5.2。
-
人类 iPSC 文化
2. 人类 iPSCs 的维护和扩大
-
人类 iPSCs 的维护
- 在15毫升管中准备3毫升的 iPSC 培养基, 在使用前将其保持在 RT 中至少15分钟。按照1.2.1 的描述, 准备一盘涂有6厘米的盘子。
- 在三十年代37摄氏度的水浴中, 从液氮罐或-150 °c 冷冻室解冻人体 iPSCs 的低温样品。
- 用消毒液喷雾剂对低温小瓶进行仔细消毒。将解冻的人类 iPSCs 从 cryotube 转移到15毫升管, 其中3毫升的 iPSC 培养基在 RT 前预热。
- 离心管在 110 x g 3 分钟, 用吸吸系统或5毫升吸管取出上清液。
- 并用重悬细胞颗粒与1毫升的 iPSC 培养基从及其与受精涂层的6厘米培养皿使用2毫升吸管和转移细胞回到盘子。在改变培养基之前, 将盘子在37摄氏度和 5% CO2的情况下返回到孵化箱, 最小为24小时。
注: 一种岩石抑制剂, 如 Y-27632 在10µM, 可以添加到 iPSC 培养基中的6厘米培养皿, 以减少凋亡。 - 每天改变媒体, 每周通过人类 iPSCs。
-
人类 iPSCs 的传代
- 通过人类的 iPSC 在 70-80% 汇合, 经典后7天的文化。
- 按照步骤1.2.1 中的描述, 为传代准备6厘米的菜肴。用汇合的 iPSCs 从盘子中取出 iPSC 培养基, 在 RT 中加入2毫升的离解溶液, 6 分钟。
注意: 孵化时间取决于 iPSC 克隆。尝试6分钟的孵化作为一个开始。 - 使用真空吸入系统或5毫升吸管去除离解溶液, 并在 RT 中加入2毫升的 iPSC 培养基预热. 并用重悬 iPSC 殖民地吹打他们上下 5-10x 与1000µL 吸管。
注意: 避免单细胞从过量吹打分离。 - 在新的6厘米培养皿中转移30到200µL 的悬浮细胞团簇。在改变培养基之前, 将盘子在37摄氏度和 5% CO2的细胞培养孵化器中返回到最小24小时。
注意: 传代所需的悬浮细胞团簇数量取决于 iPSC 克隆。 - 每天改变媒体, 每周通过人类 iPSCs。
3. 视网膜 Organoids 的产生
- 开始 iPSC 差异后的协议图解在图 1A , 当殖民地达到 60-70% 汇合 (图 1B)。
- 每6厘米的盘子准备4毫升的双介质。将双介质加热至37摄氏度。将 iPSC 介质改为双介质。请注意此时间为0天 (D0)。
- 在 D2, 将双介质中的培养基转换为 BiN2 培养基, 以前以摄氏37摄氏度的温度加热。每 2-3 天更换培养基。
- 用 neuroepithelium 芽识别紧急自成视网膜 organoids, 如图 1C -1E所示。
注: 这些早期视网膜 organoids, 对应于他们的发展阶段, 视杯, 可以手动隔离的下游实验。
4. 视网膜 Organoids 的成熟
- 在 D28, 准备6井板包含4毫升/井的 ProB27 介质最初补充 10 ng/毫升的 FGF2 (图 1A)。
注: 在将介质添加到印版之前, 立即添加 FGF2。
警告: 不要过滤 FGF2。 - 手动从6厘米的盘子中恢复视网膜结构。要做到这一点, 隔离的结构, 使垂直条纹与针周围的神经上皮芽, 如图 1E所示, 并分离 organoids 通过轻轻地划伤他们与针。
- 用1000µL 吸管吸入 10-15 organoids, 并将其转移到含有 ProB27 介质的6井板的单个井中。
- 保持视网膜 organoids 在 ProB27 培养基中的漂浮培养条件在37°c 和 5% CO2的细胞培养孵化器。每 2-3 天改变一半的培养基。
注: 治疗 organoids 与 FGF2, 直到 D35。 - 在 D35, 去除一半的培养基, 并添加新鲜的 prewarmed ProB27 培养基在37摄氏度, 没有 FGF2。
- 根据视网膜细胞类型的出现, 每 2-3 天在需要的时间内改变一半的培养基, 如图 2所示, 以获得所需的视网膜细胞类型。
5. 人 iPSC 视网膜色素 (hiRPE) 细胞的生成和扩增
-
人类 hiRPE 细胞的生成
- 按照图 3A中的协议图解, 当菌落达到 60-70% 汇合时, iPSCs 进行分化。
- 准备每6厘米的4毫升的双层培养基和温暖的双介质在37摄氏度。将 iPSC 介质改为双介质。请注意此时间为0天 (D0)。
- 在 D2, 将双介质中的区域性转换为以前在摄氏37摄氏度处加热的 BiN2 介质。每 2-3 天更换培养基。
- 在 D28, 改变培养基到一个新鲜的 ProN2 培养基以前温暖的37摄氏度, 如图 3A所示。
注意: 此步骤可在步骤4中描述的 organoid 领料后完成。 - 每 2-3 天更改 ProN2 介质。
- 在 D42, 通过观察色素斑块来识别紧急 hiRPE 细胞, 如图 3B所示。
注意: hiRPE 细胞的色素沉着会出现在 D35 与 D56 之间, 具体取决于 iPSC 克隆。
-
hiRPE 细胞的扩增
- 在 D42, 准备一个24井板以前涂上的矩阵, 如步骤1.2.2 中所述, 并包含1毫升的 ProN2 介质每井。在37°c 和 5% CO2在使用之前安置板材为15分钟在孵化器。
- 手动从6厘米的盘子中恢复 hiRPE 补丁。要隔离斑块, 用针在色素上皮周围做一个垂直的条纹, 然后用针轻轻地搔它, 将床单分离。使用1000µL 吸管吸入10色素斑块, 并将其转移到24井板的单个井中。
- 在改变培养基之前, 在37摄氏度和 5% CO2的细胞培养孵化器中保持 hiRPE 补丁在 ProN2 培养基中。注意这个 hiRPE 细胞通道为 0 (hiRPEp0)。每 2-3 天用 ProN2 培养基改变培养基。
- 当细胞汇合时, 传递 hiRPEp0 细胞。
- 使用5毫升吸管, 用真空吸尘系统去除介质, 并用1毫升的 PBS 清洗每个井1x。
- 使用真空吸入系统丢弃 PBS, 添加200µL 每井0.25% 胰蛋白酶, 并孵化它至少15分钟的孵化器在37摄氏度。添加800µL ProB27 培养基, 使胰蛋白酶失效。
注: 不推荐使用 ProN2 培养基停止胰蛋白酶活性。 - 将 hiRPE 细胞的表吹打上下分离。将细胞悬浮在15毫升管中, 在 110 x g 处离心5分钟。
注: 可以用 ProN2 培养基进行额外洗涤, 以去除 ProB27 培养基的过量。 - 取出上清, 并轻轻并用重悬细胞颗粒在2毫升的 ProN2 培养基前预热37摄氏度。用单元格计数器计数单元格。
- 采取125万细胞, 并将其放置在基质涂层 T-25 cm2瓶 (见步骤 2.2.2) 包含5毫升的 ProN2 培养基预热37摄氏度。注意这个 hiRPE 细胞通道为 1 (hiRPEp1)。
- 将 hiRPE 细胞保存在细胞培养孵化器中的 ProN2 培养基中, 在37摄氏度和 5% CO2处, 在改变培养基前保持48小时。
- 每 2-3 天更改媒体。当 hiRPEp1 细胞到达汇合处时, 执行下一段或超低温保存。
6. 视网膜 Organoids 和 hiRPE 细胞的超低温保存
-
全视网膜 organoids
- 选择5到20视网膜 organoids 使用转移吸管和放置在一个低温小瓶。用1000µL 吸管去除任何多余的介质, 而不触及管子底部的 organoids, 并添加250µL 的冷冻存介质 (见材料表)。
- 在-80 摄氏度的基异丙醇冷冻容器中冷冻小瓶, 至少4小时. 将冷冻瓶转移到-150 °c 冷藏柜或液氮罐中进行长期贮存。
-
对于 hiRPE 细胞
- 在1通道, 当细胞汇合时, hiRPE 细胞离解。
注意: 不推荐 hiRPEp0 细胞的超低温保存。 - 使用真空吸入系统从 T-25 cm2瓶中吸取培养基, 并用5毫升吸管将其1x 与3毫升的 PBS 清洗。
- 使用真空吸入系统去除 PBS, 加入1毫升0.25% 胰蛋白酶, 并在15分钟内将其孵化为37摄氏度。加入5毫升的 ProB27 培养基以停止胰蛋白酶活性。
注意: 不推荐使用 ProN2 培养基来灭活胰蛋白酶。 - 用10毫升的吸管将 hiRPE 细胞吹打。用单元格计数器计数单元格。将细胞悬浮在15毫升管中, 在 110 x g 处离心5分钟。
注: 可使用 ProN2 培养基进行额外洗涤, 以去除 ProB27 培养基的过量。 - 用真空吸入和轻轻并用重悬细胞在250µL 的冷冻培养基中获得200万细胞。
- 每低温小瓶转移250µL 细胞悬浮液。以异丙醇为基础的冷冻容器中的小瓶冷冻, 最低为4小时,-80 摄氏度。
- 将冷冻小瓶转移到-150 摄氏度冷藏柜或液氮贮罐中, 用于长期贮存。
- 在1通道, 当细胞汇合时, hiRPE 细胞离解。
7. 视网膜 Organoids 和 hiRPE 细胞的解冻
-
全视网膜 organoids 的解冻
- 温暖的 ProB27 培养基在37°c (每一个低温小瓶需要2毫升)。
- 从液氮罐或-150 °c 冷藏柜中, 将含有视网膜 organoids 的低温小瓶在37摄氏度的水浴中解冻, 三十年代. 用消毒剂喷雾剂小心消毒低温小瓶。
- 打开药瓶, 加入1毫升预热的 ProB27 培养基。用转移吸管将 organoids 转移到1.5 毫升管。
- 通过吹打, 轻轻地移开培养基, 而不接触管底部的视网膜结构。再用1毫升的预热 ProB27 培养基清洗 organoids 1 次。
- 吸入 organoids 与转移吸管并且安置他们在1井一个6井板包含 ProB27 中等预热和平衡在孵化器在37°c 和 5% CO2。
注: 放置 10-15 视网膜 organoids 每井6井板。 - 根据图 2所述, 在需要的时间内, 每 2-3 天改变一半的培养基以获得所需的视网膜细胞类型。
-
hiRPE 细胞的解冻
- 温暖的 ProN2 培养基在37°c (每一个低温小瓶需要8毫升)。
- 从液氮罐或-150 °c 冷冻机, 解冻一个低温样品的 hiRPEp1 细胞由孵化成水浴在37°c 在三十年代. 用消毒剂喷雾剂小心消毒低温小瓶。
- 打开管并加入1毫升预热的 ProN2 培养基, 将细胞悬浮液转移至15毫升, 含2毫升预热的 ProN2 培养基。离心机5分钟, 110 x 克。
- 取出上清, 并轻轻并用重悬细胞颗粒在2毫升的 ProN2 培养基前预热37摄氏度。
- 用单元格计数器计数单元格。
- 采取125万细胞和放置在基质涂层 T-25 cm2瓶 (见步骤 2.2.2) 包含5毫升的 ProN2 培养基预热37摄氏度。在这个阶段, 注意段落作为 2 (hiRPEp2)。
- 在改变培养基前, 将细胞培养孵化器中的 hiRPEp2 细胞保持在37摄氏度和 5% CO2的 ProN2 培养基中。
- 每 2-3 天更改媒体。当 hiRPE 细胞到达汇合处时, 执行下一段或超低温保存。
注意: 在培养2周后, 可以收集 8-1000万 hiRPE 细胞进行进一步的实验。
结果
在无馈线条件下培养的人类 iPSC 分化的第一步是关闭使用双介质的自我更新机械, 以鼓励自发分化 (图 1A)。然后, 在 D2, 双介质辅以 N2 补充, 以指导分化 iPSCs 细胞对神经和视网膜血统。这个过程导致 neuroretinal 芽的出现在 D28 附近 (图 1C - 1E)。自形成的 neuroretinal 结构可以用针来隔离, 如图 1E所示, 并转移到培养板上, 以允许在漂浮培养条件下使用 ProB27 培养基来成熟视网膜 organoids (图 1F)。为了支持神经视网膜的生长和发育, FGF2 被添加到培养基中1周 (图 1A)。
在 D28, 新兴的视网膜结构主要包括视网膜祖细胞, 它们共同表达关键转录因子为 PAX6、RAX 和 VSX215。这些祖细胞在漂浮培养条件下产生七种主要的视网膜体细胞类型, 这与人类视网膜发育的进化保守的出生顺序一致。基于 qRT PCR 和免疫组化赖希曼等。15、图 2中的宽曲线显示了在体外成熟过程中早期和晚期视网膜细胞世代的波浪。因此, 区域性时间定义了 organoids 中存在的单元格类型。
只有当色素沉着可见时, 才可以对 hiRPE 细胞进行进一步放大的隔离, 因为这种细胞着色允许它们的可视化。用这种方法, ProN2 培养基从 D28 到 D42, 有利于视网膜色素上皮细胞15。
根据人类 iPSC 克隆, 可在视网膜结构自形成之前或之后检测色素斑块;但主要是在 D28 使用 ProN2 培养基后1或2周 (图 3A, B)。图 3C和3D显示了在通道0中从隔离补丁中扩展的 hiRPE 细胞的典型明亮场图像。然后, hiRPE 细胞可以扩展到 4, 保持其视网膜色素表型没有上皮间质的过渡 (急诊室)。然而, 急诊室可以通过使用 Y-27632 等岩石抑制剂来预防, 也允许增加细胞数通道17。hiRPE 细胞在解冻后的长期培养可以很容易地在这里描述的条件下获得成熟和功能性上皮15。52周的成熟 hiRPEp2 细胞以经典的立方鹅卵石形态学为例, 如图 3E所示。

图 1: 人 iPSCs 的视网膜 organoids 的产生和成熟.(A) 分化协议允许产生视网膜 organoids。(B) D0 的人类 iPSCs。(C) D15 新出现的 neuroretinal 上皮。(D) D22 的自形成神经视网膜样结构。(E) 在这里, neuroretinal 芽是用针隔离。(F) D35 的漂浮培养条件下视网膜 organoids 的代表性图像。刻度条 = 200 µm.请点击这里查看这个数字的大版本.
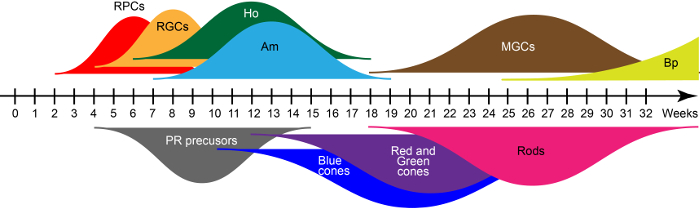
图 2: 人类 iPSC 衍生的视网膜细胞产生的波浪.缩写: 视网膜祖细胞 (rpc), 视网膜神经节细胞 (RGCs), 水平细胞 (Ho), 无长突细胞 (Am), 穆勒胶质细胞 (MGCs), 双极细胞 (Bp), 和光感光 (PR)。请单击此处查看此图的较大版本.
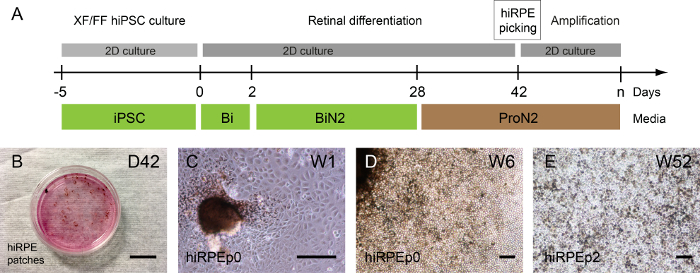
图 3: 人类 iPSC 视网膜色素的生成和扩增.(A) 说明允许生成人类 hiRPE 细胞的分化协议。(B) 相对比图像, 显示在6周 (W6), 在区分粘附人体 iPSCs 时出现的色素斑块。(C) hiRPEp0 细胞培养一周 (W1) 后色素斑块采摘。(D) hiRPEp0 细胞在6周 (W6) 后色素斑块采摘。(E) 在 ProN2 培养基中培养52周 (W52) 后, 在解冻后 hiRPEp2 细胞的代表性图像。刻度条 = 200 µm.请点击这里查看这个数字的大版本.
讨论
该协议描述了如何在无异和无饲养条件下, 从人类多能干细胞中产生视网膜 RGCs 和感光细胞的视网膜色素 organoids。与良好的生产实践 (GMP) 过程兼容, 这里提出的方法允许大量生产 iPSC 视网膜细胞作为 RPE 细胞, RGCs, 和光传感器, 以发展干细胞为基础的治疗和药物未来治疗视网膜退行性疾病的发现方法。整个视网膜 organoids 或 hiRPE 细胞的超低温保存也为建立中间细胞库提供了一个重要的优势, 这是今后在干细胞基础治疗中应用的一大步骤。
未来的临床翻译需要在特定的分化阶段生产大量特定的视网膜细胞类型。在这方面, 在三月的 CD73-positive 感光前体的世代被描述作为移植兼容的细胞人口18, 并且可能从冻融视网膜产生这些未成熟的光感受器官organoids15加强了希望使用这些细胞的治疗目的。关于视网膜色素上皮, hiRPE 细胞体外增殖的能力允许大细胞生产的银行。重要的是, 解冻的人类 iPSC 视网膜色素上皮细胞保留其视网膜色素表型和功能, 因此, 作为营养因子分泌或感光外段吞噬功能15, 验证其易于使用的筛选策略, 以及未来治疗方法。
有各种各样的协议为世代 iPSC 衍生的视网膜 organoids7,8,9,10,11,12,15 , 变化在培养方法 (胚状体样骨料与黏附细胞) 以及效率和健壮性。这里描述的方法从黏附人的 iPSCs 开始并且显示可再生的功效、适应力和适用性对广泛的人 iPSC 线15。这一过程, 基于无血清培养基的连续变化, 通过利用系统的内在线索来指导分化, 概括了视网膜发育的主要步骤。该协议的一个重要优点是缺乏胚胎体形成, 并增加了基质用于未来符合 GMP 要求的视网膜细胞制造协议, 以产生细胞治疗衍生物。这样, 利用细胞治疗系统 (CTS) 补充剂或 no, 在异种和非异种培养条件下发现视网膜 organoid 生成和成熟的效率没有差异, 完全采用重组或人性化的组件。
视网膜分化方法的成功在很大程度上取决于人类 iPSC 文化的质量。重新编程方法不影响人 iPSCs 对视网膜细胞的分化效率8, 但其 stemness 状态需要优化。简言之, 常规栽培的人类 iPSCs 不应显示任何分化的迹象。菌落不应重叠, 必须显示其特征圆形形态。尽管视网膜分化的效率是克隆依赖性的, 但每厘米2的视网膜结构至少可以在 D28 上摘下, 对应于 50-60 neuroretinal 结构, 用于一个6厘米的盘子。对于漂浮培养条件下的视网膜 organoid 成熟, 限制每井结构的数量, 避免结构融合和培养基过度消耗。在这些培养条件下, 视网膜 organoids 可以成熟广泛的时间, 需要获得晚期视网膜细胞类型。
展望未来, 这种方法体外产生的视网膜 organoids 是视网膜疾病模型的有力工具。患者特异的 iPSC 视网膜细胞模型将被用来更好地理解复杂或遗传疾病的分子和细胞机制的探索。这些模型将特别适合药物发现通过高通量筛选, 细胞和基因治疗, 或基因组编辑方法, 以发展创新治疗视网膜白斑。
披露声明
沙赖希曼, 奥利弗 Goureau, 和何塞-阿兰-萨赫勒是发明人在等待的专利相关的视网膜细胞从人类多潜能干细胞的产生。
致谢
作者感谢 Goureau 小组成员在这里所描述的方法的建立过程中的投入, 以及 g. Gagliardi 和 m. 拉·加里对他们的批判性阅读。这项工作得到了来自情报局 (GPiPS: ANR-2010-RFCS005 的赠款的支持;SightREPAIR: ANR-16-CE17-008-02), 视网膜法国协会和技术转让公司 SATT Lutech。它还在 Investissements d ' 艾文莉计划 (ANR-11-IDEX-0004-02) 的 LABEX LIFESENSES (ANR-10-LABX-65) 的框架内执行。
材料
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
参考文献
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。