Method Article
Xeno-libre défini et exempte d’engraissement des Conditions de Culture pour les modèles de cellule rétinienne Generation of Human dérivés iPSC
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La production de cellules spécialisées de la rétine de cellules souches pluripotentes est un tournant dans le développement de la thérapie à base de cellules souches pour les maladies de la rétine. Le présent document décrit une méthode simple pour une génération efficace d’organoïdes rétinienne et l’épithélium pigmentaire rétinien pour la recherche fondamentale, translationnelle et clinique.
Résumé
La production de cellules spécialisées de cellules souches pluripotentes fournit un outil puissant pour développer de nouvelles approches pour la médecine régénérative. L’utilisation des cellules souches pluripotentes humaines (CISP) est particulièrement intéressante pour des études de maladies neurodégénératives, y compris les dystrophies rétiniennes, où les modèles de cellules rétiniennes dérivées iPSC marquent une avancée majeure pour comprendre et lutter contre la cécité. Dans cet article, nous décrivons un protocole simple et évolutif pour générer, mature et cryoconservé organoïdes rétinienne. Basé sur l’évolution des moyennes, le principal avantage de cette méthode est d’éviter de multiples et fastidieuses étapes généralement exigés dans une différenciation guidée du CISP. Imitant les phases précoces de développement rétinienne par modifications successives des milieux définis sur des cultures de l’iPSC humaine adhérentes, ce protocole permet la production simultanée de former des structures neuroretinal et rétine pigmentées cellules épithéliales (RPE) dans un manière efficace et reproductible en 4 semaines. Ces structures contenant des cellules souches rétiniennes (RPC) peuvent être facilement isolés pour davantage de maturation dans un état de culture flottante permettant la différenciation des appels de procédure distante dans les sept types de cellules rétiniennes présents dans la rétine humaine adulte. En outre, les auteurs décrivent des méthodes rapides pour la cryoconservation d’organoïdes rétinienne et cellules RPE pour le stockage à long terme. Combinés ensemble, les méthodes décrites ici seront utiles pour produire et bancaires dérivés iPSC rétiniens cellules ou tissus humains pour la recherche fondamentale et clinique.
Introduction
La rétine fait partie intégrante du système nerveux central (CNS) et a une capacité limitée à se régénérer spontanément suite à un traumatisme ou de maladies. Par conséquent, les pathologies dégénératives entraînant la perte de cellules rétiniennes définitives, telles que la dégénérescence maculaire liée à l’âge (DMLA), la rétinite pigmentaire (RP), glaucome et la rétinopathie diabétique, typiquement entraîner une cécité irréversible. Sauver la rétine dégénérée est un enjeu majeur pour lequel des thérapies à base de cellules souches visant à remplacer les cellules endommagées ou perdues sont l’une des plus prometteuses approches1,2,3. Cellules souches pluripotentes comme les cellules souches embryonnaires (CSE) cellules ou les cellules souches pluripotentes humaines (CISP) ont la capacité d’étendre indéfiniment en culture, et ils ont le potentiel de produire tous les types de cellules. Progrès dans notre compréhension du développement rétinienne et l’amélioration de in vitro protocoles pour iPSC humaine différenciation ont donné lieu à la génération de rétine organoïdes7,8,9, 10,11,12. Toutes les cellules rétiniennes majeurs, y compris les cellules ganglionnaires rétiniennes (CGR) et photorécepteurs rétiniens cellules épithéliales pigmentées (RPE), ont été correctement différenciés des humains ESCs et CISP4,5, 6. basé sur la méthode SFEB (culture sans sérum des agrégats de type corps embryoïdes) développée par Eiraku et al. 13, autoformation d’organoïdes rétiniennes peut être obtenue de dérivés ESC ou iPSC embryoïdes corps-comme agrégats dans la matrice extracellulaire définis composants7,10,14. Mais ces protocoles sont complexes, nécessitant un grand nombre d’étapes n’est pas toujours compatibles avec la grande production de cellules pour les approches thérapeutiques ou de dépistage des drogues. Ainsi, le choix de la méthode pour produire des cellules de la rétine humaines est critique et la méthode doit être robuste, évolutive et efficace.
Basé sur notre précédente publication15, nous décrivons ici chaque étape pour une génération simple et efficace des cellules rétiniennes par autoformation organoïde rétinienne d’adhérents CISP humaine cultivée dans une condition de xeno-sans et sans chargeur. À partir de cultures systématiques des adhérents CISP humaine, ce protocole requiert uniquement un milieu simple successive changer pour permettre la génération de cellules iPS RPE (hiRPE) et des structures neuroretinal en 4 semaines. Après un isolement manuel, hiRPE peut être développé et les structures rétiniennes peuvent être cultivées comme flottant organoïdes où les cellules souches rétiniennes sont capables de se différencier en tous types de cellules rétiniennes dans un ordre séquentiel compatible avec l’homme en vivo retinogenesis. Enfin, pour la promotion de la recherche ou la traduction clinique, nous décrivons une méthode de cryoconservation permettant le stockage à long terme d’ensemble rétinienne organoïdes et hiRPE cellules sans affecter leurs caractéristiques phénotypiques et fonctionnalités.
Protocole
Le protocole décrit dans le présent document suit les directives du Comité d’éthique de l’Institut de la Vision recherche. L’Institut de la Vision a été autorisée à la manipulation de l’échantillon humain selon le règlement Français actuel. Spécimen de manutention suit la protection des données des patients selon les principes d’Helsinki et des réglementations nationales après l’approbation éthique du « Comité de Protection des Personnes (CPP) Ile-de-France V ».
1. préparation des milieux de Culture et de la vaisselle
-
Milieux de culture
- Utilisez iPSC moyenne, un milieu chimiquement défini, dédié à la culture de cellules souches pluripotentes dans des conditions sans chargeur16. Préparer 500 mL de milieu selon le protocole du fabricant.
- Moyen d’utilisation de basale iPSC (Bi), l’iPSC chimiquement défini moyen sans facteur de croissance fibroblastique 2 (FGF2) ou facteur de croissance transformant bêta (TGFβ).
- Préparer 500 mL de milieu Bi supplémenté avec supplément de 1 % de N2 (BiN2 moyen), 10 unités/mL de pénicilline et 10 mg/mL de streptomycine.
- Préparer 500 mL de milieu des Control de base N2 (moyenne ProN2) composé de mélange de DMEM:Nutrient F-12 (DMEM/F12, 1:1, L-Glutamine), 1 % MEM des acides aminés non essentiels, Supplément 1 % N2, 10 unités/mL de pénicilline et 10 mg/mL de streptomycine.
- Préparer Control axée sur la B27 moyen (moyenne ProB27) composé de mélange de DMEM:Nutrient F-12 (DMEM/F12, 1:1, L-Glutamine), 1 % MEM des acides aminés non essentiels, Supplément de 2 % B27, 10 unités/mL de pénicilline et de 10 mg/mL de streptomycine.
-
Préparation de bateau de la culture
-
Pour la culture humaine iPSC
- Préparer 10 mL d’une solution de vitronectine contenant 5 μg/mL de vitronectine dans 1 x PBS. Dans 10 mL de PBS 1 x, ajouter 100 µL de la solution mère de vitronectine décongelés (100 x).
- Distribuer 2 mL de la solution de la vitronectine par Petri 6 cm correspondant à 0,5 µg/cm2. Il incuber pendant 1 heure à température ambiante (RT). Enlever la solution de la vitronectine par aspiration à l’aide d’un système d’aspiration sous vide ou une pipette de 5 mL.
- Ajouter 4 mL de milieu d’iPSC par plat de 6 cm.
- Incuber les plats dans un incubateur de culture cellulaire à 37 ° C et 5 % de CO2 pendant au moins 30 min avant utilisation.
- Pour iPSC dérivé humaine culture cellulaire pre (hiRPE)
- Utilisez une matrice de qualifié par cellules souches pluripotentes ou substrat pour enrober les puits selon le protocole du fabricant. Ajouter suffisamment de matrice ou de substrat pour couvrir la surface entière de croissance. Par exemple, mettre 300 µL de matrice / puits en plaque 24 puits et 3 mL de matrice dans une fiole de2 cm T-25.
- Incuber les récipients de culture couché pendant au moins 1 h à 37 ° C. Enlever la matrice à l’aide de systèmes d’aspiration-aspiration ou une pipette de 5 mL.
- Ajouter 1 mL de milieu ProN2 / puits sur plaques 24 puits et remettez le récipient de culture dans l’incubateur pendant au moins 30 min pour chauffer et pour équilibrer le milieu. Pour ballons de T-25 cm2 , reportez-vous à l’étape 5.2.
-
Pour la culture humaine iPSC
2. le maintien et Expansion of Human CISP
-
Entretien du CISP humaine
- Préparer 3 mL de milieu d’iPSC dans un tube de 15 mL et gardez-le à ta pendant au moins 15 min avant utilisation. Préparer un plat de 6 cm enduit tel que décrit à la section 1.2.1.
- Décongeler un échantillon cryogénique de CISP humaine d’un réservoir d’azote liquide ou d’un congélateur à-150 ° C par une incubation dans un bain-marie à 37 ° C pendant 30 s.
- Soigneusement désinfecter la cuvette cryogénique à l’aide d’un spray désinfectant. Transférez le cryotube le CISP humaine décongelés dans le tube de 15 mL contenant 3 mL de milieu d’iPSC préchauffée à température ambiante.
- Centrifuger le tube à 110 x g pendant 3 min. Retirez le surnageant par aspiration à l’aide d’un système d’aspiration sous vide ou une pipette de 5 mL.
- Resuspendre le culot cellulaire avec 1 mL de milieu iPSC d’un plat enduit de vitronectine la culture de 6 cm à l’aide d’une pipette de 2 mL et transférer les cellules vers le plat. Retourner le plat dans l’incubateur à 37 ° C et 5 % de CO2 pendant au moins 24h avant de changer le support.
Remarque : Un inhibiteur de la roche, comme Y-27632 à 10 µM, peut être ajouté au milieu iPSC dans les récipients de culture de 6 cm pour réduire l’apoptose. - Changer le support de tous les jours et passez la CISP humaine chaque semaine.
-
Passage des humains CISP
- Passez l’iPSC humain à une confluence de 70 à 80 %, classiquement après 7 jours de culture.
- Préparer des plats de 6 cm pour le passage comme indiqué au point 1.2.1. Enlever le support de l’iPSC de la vaisselle avec le CISP confluentes et ajouter 2 mL d’une solution de dissociation pendant 6 min à température ambiante.
Remarque : Le temps d’incubation dépend des clones de l’iPSC. Essayez une incubation de 6 min dans un premier temps. - Enlever la solution de dissociation à l’aide de systèmes d’aspiration-aspiration ou une pipette de 5 mL et ajouter 2 mL de milieu de l’iPSC préchauffée à RT. remettre en suspension les colonies iPSC en pipettant également leur haut et bas de 5-10 x avec une pipette 1 000 µL.
ATTENTION : Éviter la dissociation cellulaire unique de pipetage excessive. - Transférer 30 à 200 µL d’amas de cellules resuspendues dans une autre boite de culture de 6 cm. Remettez les boîtes dans l’incubateur de culture cellulaire à 37 ° C et 5 % de CO2 pendant au moins 24h avant de changer le support.
Remarque : Le volume des amas de cellules resuspendues nécessaires pour le passage dépend des clones de l’iPSC. - Changer le support de tous les jours et passez la CISP humaine chaque semaine.
3. génération d’organoïdes rétinienne
- Commencer la différenciation de l’iPSC suivant le protocole schématisé à la Figure 1 a , quand les colonies atteignent une confluence de 60 à 70 % (Figure 1 b).
- Préparer 4 mL de milieu de Bi par plat de 6 cm. Chauffer le milieu Bi à 37 ° C. Changer le support de l’iPSC au milieu de la Bi. Notez cette fois comme jour 0 (D0).
- À D2, basculez les cultures dans le milieu Bi vers un milieu BiN2, préalablement chauffé à 37 ° C. Changer le milieu tous les 2-3 jours.
- Identifier émergente organoïdes rétinienne auto-formation neuroépithélium buds, comme illustré à la Figure 1 -1E.
Remarque : Ces premiers organoïdes rétiniennes, correspondant à leur stade de développement de la cupule optique, peuvent être manuellement isolés d’expérimentation en aval.
4. maturation des organoïdes rétinienne
- D28, préparer les plaques 6 puits contenant 4 mL/puits de ProB27 additionné au départ de FGF2 10 ng/mL (Figure 1 a).
NOTE : Ajouter FGF2, juste avant que les médias sont ajouté aux plaques.
ATTENTION : Ne pas filtrer FGF2. - Récupérer manuellement les structures rétiniennes de la vaisselle de 6 cm. Pour ce faire, isoler les structures faisant des stries perpendiculaires avec l’aiguille autour du bourgeon neuroépithéliales, comme sur la Figure 1Eet détacher l’organoïdes en les grattant délicatement avec l’aiguille.
- Aspirer les 10-15 organoïdes à l’aide d’une pipette µL 1 000 et de les transférer dans un seul puits de la plaque 6 puits contenant le support ProB27.
- Garder l’organoïdes rétinienne dans des conditions de culture flottante dans un milieu ProB27 dans un incubateur de culture cellulaire à 37 ° C et 5 % de CO2. La moitié du milieu de changer tous les 2-3 jours.
Remarque : Considérer l’organoïdes avec FGF2 jusqu’en D35. - À D35, retirer la moitié de la moyenne et ajouter un milieu frais ProB27 préchauffée à 37 ° C sans FGF2.
- La moitié du milieu de changer tous les 2-3 jours pendant le temps nécessaire pour obtenir les types de cellules rétiniennes désiré selon l’émergence des types de cellules rétiniennes, comme illustré à la Figure 2.
5. génération et Amplification of Human iPSC dérivés des cellules RPE (hiRPE)
-
Génération de cellules humaines hiRPE
- Engager la CISP dans la différenciation, quand les colonies atteignent une confluence de 60 à 70 %, suivant le protocole schématisé à la Figure 3 a.
- Préparer 4 mL par 6 cm plat de support Bi et réchauffer le milieu Bi à 37 ° C. Changer le support de l’iPSC au milieu de la Bi. Notez cette fois comme jour 0 (D0).
- À D2, basculez les cultures dans le milieu Bi vers un milieu BiN2 préalablement chauffé à 37 ° C. Changer le milieu tous les 2-3 jours.
- À J28, changer le milieu un milieu ProN2 frais, préalablement chauffé à 37 ° C, comme illustré à la Figure 3 a.
Remarque : Cette étape peut être faite après la cueillette organoïde décrite à l’étape 4. - Changer le support de ProN2 tous les 2-3 jours.
- À D42, identifier les cellules hiRPE émergents par l’observation des taches pigmentées comme illustré à la Figure 3 b.
Remarque : La pigmentation des cellules hiRPE apparaît entre D35 à D56 selon les clones de l’iPSC.
-
Amplification des cellules hiRPE
- D42, préparer une plaque 24 puits préalablement revêtu avec la matrice comme indiqué au point 1.2.2 et contenant 1 mL de milieu ProN2 par puits. Placer la plaque pendant 15 minutes dans l’incubateur à 37 ° C et 5 % de CO2 avant utilisation.
- Récupérer manuellement les correctifs hiRPE du plat 6 cm. Pour isoler les taches, faire une striation perpendiculaire avec l’aiguille autour de l’épithélium pigmenté et détacher la feuille en grattant doucement il avec l’aiguille. Aspirer 10 taches pigmentées à l’aide d’une pipette µL 1 000 et de les transférer dans un seul puits de la plaque 24 puits.
- Gardez les patchs hiRPE en milieu ProN2 dans un incubateur de culture cellulaire à 37 ° C et 5 % de CO2 pendant 48 h avant de changer le support. Notez ce passage de cellule hiRPE 0 (hiRPEp0). Changer le milieu tous les 2-3 jours avec ProN2 moyen.
- Passez les cellules hiRPEp0 lorsque les cellules sont confluentes.
- Enlever le support à l’aide de systèmes d’aspiration-aspiration et laver chaque bien 1 x 1 ml de PBS à l’aide d’une pipette de 5 mL.
- Jetez les PBS à l’aide de systèmes d’aspiration sous vide, ajouter 200 µL / puits de 0,25 % de trypsine et il incuber pendant au moins 15 min dans un incubateur à 37 ° C. Ajouter 800 µL de milieu ProB27 pour inactiver la trypsine.
Remarque : L’utilisation de ProN2 moyen d’arrêter l’activité de la trypsine n’est pas recommandée. - Dissocier la feuille de hiRPE cellules de pipetage il monte et descend. Placer la suspension de cellules dans un tube de 15 mL et il Centrifuger pendant 5 min à 110 x g.
Remarque : Un lavage supplémentaire peut être fait avec ProN2 moyen pour enlever l’excès de ProB27 moyen. - Retirez le surnageant et doucement Resuspendre le culot dans 2 mL de milieu de ProN2 préchauffée à 37 ° C. Compter les cellules avec un compteur de cellules.
- Prendre de 1,25 millions de cellules et les placer dans une fiole de2 matrice-enduit T-25 cm (Voir l’étape 2.2.2) contenant 5 mL de milieu de ProN2 préchauffée à 37 ° C. Notez ce passage de cellule hiRPE 1 (hiRPEp1).
- Garder les cellules hiRPE dans le milieu de ProN2 dans un incubateur de culture cellulaire à 37 ° C et 5 % de CO2 pendant 48 h avant de changer le support.
- Modifier les médias tous les 2-3 jours. Lorsque les cellules de hiRPEp1 atteint le confluent, effectuer le prochain passage ou cryoconservation.
6. cryopreservation of Retinal organoïdes et hiRPE cellules
-
Pour organoïdes ensemble rétinienne
- Sélectionnez 5 à 20 organoïdes rétiniennes à l’aide d’une pipette de transfert et les placer dans une fiole cryogénique. Enlever tout excès du milieu avec une pipette 1 000 µL sans toucher l’organoïdes au fond du tube et ajouter 250 µL de milieu de cryoconservation froid (voir Table des matières).
- Geler les flacons dans un récipient froid axée sur l’isopropanol à-80 ° C pendant au moins 4 h. transfert les flacons congelés à un congélateur de-150 ° C ou un réservoir d’azote liquide pour le stockage à long terme.
-
Pour les cellules de hiRPE
- Au passage 1, se dissocient les cellules hiRPE lorsque les cellules sont confluentes.
Remarque : Il est déconseillée d’une cryoconservation des cellules hiRPEp0. - Aspirer le milieu du flacon de2 cm de T-25 à l’aide de systèmes d’aspiration-aspiration et lavez-le 1 x avec 3 mL de PBS à l’aide d’une pipette de 5 mL.
- Supprimer les PBS à l’aide de systèmes d’aspiration sous vide, ajouter 1 mL de 0,25 % de trypsine et il incuber pendant au moins 15 min dans un incubateur à 37 ° C. Ajouter 5 mL de ProB27 moyen d’arrêter l’activité de la trypsine.
Remarque : L’utilisation du milieu ProN2 pour inactiver la trypsine n’est pas recommandée. - Dissocier la feuille de hiRPE cellules de pipetage il et descendre à l’aide d’une pipette 10 mL. Compter les cellules avec compteur de cellules. Placer la suspension de cellules dans un tube de 15 mL et il Centrifuger pendant 5 min à 110 x g.
Remarque : Un lavage supplémentaire peut être effectué avec ProN2 moyen pour enlever l’excès de ProB27 moyen. - Aspirer le surnageant à l’aide d’aspiration-aspiration et doucement remettre en suspension les cellules pour obtenir 2 millions de cellules en 250 µL de milieu de cryoconservation.
- Transférer 250 µL de suspension cellulaire par flacon cryogénique. Geler les flacons dans un conteneur congélation axée sur l’isopropanol à-80 ° C pendant au moins 4 h.
- Transférer les flacons congelés dans un congélateur à-150 ° C ou un réservoir d’azote liquide pour le stockage à long terme.
- Au passage 1, se dissocient les cellules hiRPE lorsque les cellules sont confluentes.
7. dégel du rétinal organoïdes et hiRPE cellules
-
Dégel du organoïdes ensemble rétinienne
- Moyen de ProB27 chaud à 37 ° C (2 mL seront exigé pour chaque flacon cryogénique).
- Dans le réservoir d’azote liquide ou le congélateur-150 ° C, décongeler un flacon cryogénique contenant organoïdes rétinienne dans un bain-marie à 37 ° C pour 30 s. désinfecter la cuvette cryogénique soigneusement à l’aide d’un spray désinfectant.
- Ouvrir le flacon et ajouter 1 mL de milieu de ProB27 préchauffé. Transférer l’organoïdes dans un tube de 1,5 mL avec une pipette de transfert.
- Enlever doucement le support en pipettant également, il sans toucher les structures rétiniennes au fond du tube. Laver l’organoïdes 1 fois de plus avec 1 mL du milieu ProB27 préchauffé.
- Aspirer l’organoïdes avec une pipette de transfert et les placer dans 1 bien sur une plaque de 6 puits contenant le support ProB27 préchauffée et équilibrées dans un incubateur à 37 ° C et 5 % de CO2.
Remarque : Placez 10-15 organoïdes rétiniennes / puits d’une plaque de 6 puits. - La moitié du milieu de changer tous les 2-3 jours pendant le temps nécessaire pour obtenir les types de cellules rétiniennes désiré selon leur émergence, comme décrit à la Figure 2.
-
Décongélation des cellules hiRPE
- Moyen de ProN2 chaud à 37 ° C (8 mL seront exigé pour chaque flacon cryogénique).
- Dans le réservoir d’azote liquide ou le congélateur-150 ° C, décongeler un échantillon cryogénique de cellules hiRPEp1 par une incubation dans un bain-marie à 37 ° C pendant 30 s. désinfecter le flacon cryogénique soigneusement à l’aide de pulvérisation de la solution désinfectante.
- Ouvrir le tube et ajouter 1 mL de milieu de ProN2 préchauffé et transférer la suspension de cellules dans un tube de 15 mL contenant 2 mL de préchauffé ProN2 milieu. Il Centrifuger pendant 5 min à 110 x g.
- Retirez le surnageant et doucement Resuspendre le culot dans 2 mL de milieu de ProN2 préchauffée à 37 ° C.
- Compter les cellules avec un compteur de cellules.
- Prendre de 1,25 millions de cellules et les placer dans le ballon de2 cm enduit de matrice des T-25 (Voir l’étape 2.2.2) contenant 5 mL de milieu de ProN2 préchauffée à 37 ° C. À ce stade, notez au passage que 2 (hiRPEp2).
- Garder les cellules hiRPEp2 en milieu ProN2 dans l’incubateur de culture cellulaire à 37 ° C et 5 % de CO2 pendant 48 h avant de changer le support.
- Modifier les médias tous les 2-3 jours. Lorsque les cellules de hiRPE atteint le confluent, effectuer le prochain passage ou cryoconservation.
Remarque : Après 2 semaines de culture, 8 millions de cellules hiRPE peuvent être collectées pour les autres expérimentations.
Résultats
La première étape de différenciation iPSC humaine cultivée dans des conditions sans chargeur16 est de fermer l’auto-renouvellement machines utilisant le milieu Bi pour encourager une différenciation spontanée (Figure 1 a). Puis, à la D2, le milieu Bi est complété avec un supplément de N2 pour orienter la différenciation CISP cellules vers les lignées nerveuses et rétiniennes. Ce processus entraîne l’apparition des bourgeons neuroretinal à travers D28 (Figure 1 - 1E). Auto-formation neuroretinal structures peuvent être isolés à l’aide d’une aiguille comme illustré dans la Figure 1E et transféré à plaques de culture pour permettre la maturation de la rétine organoïdes dans des conditions de culture flottante à l’aide de ProB27 moyen (Figure 1F). Afin de favoriser la croissance et le développement de la rétine neuronale, FGF2 est ajouté au milieu pendant 1 semaine (Figure 1 a).
À J28, les structures émergentes rétiniennes contiennent principalement des cellules souches rétiniennes qui expriment conjointement le facteur de transcription clé PAX6, RAX et VSX215. Ces cellules souches donnent naissance aux sept grandes catégories de types de cellules rétiniennes dans des conditions de culture dans un ordre de naissance évolutivement conservés conforme au développement de rétine humain. Basé sur qRT-PCR et l’immunohistochimie précédemment décrit dans Reichman et al. 15, les larges courbes Figure 2 montrent des vagues de début et de fin-nés des générations de cellules rétiniennes lors d’un processus de maturation in vitro . Ainsi, le temps de la culture définit les types de cellules présents dans l’organoids.
L’isolement de cellules hiRPE pour d’autres l’amplification peut être effectuée que lorsque la pigmentation est perceptible car cette coloration de la cellule permet leur visualisation. De cette façon, le milieu de ProN2 sert de D28 à D42 pour favoriser la pigmentation de RPE cellules15.
Selon le clone humain iPSC, les taches pigmentaires peuvent être détectées avant ou après la formation autonome des structures rétiniennes ; mais surtout 1 ou 2 semaines après l’utilisation de moyen de ProN2 à J28 (Figure 3 a, B). Une image représentative de champ lumineux de hiRPE cellules passée les taches isolées au passage 0 est montrée en Figure 3 et 3D. Ensuite, les cellules de hiRPE peuvent être étendus jusqu’au passage 4, conservant leur phénotype RPE sans une transition épithéliale-mésenchymateuse (EMT). Néanmoins, les EMT peut être évitée par l’utilisation d’inhibiteurs ROCK tels que Y-27632, ce qui permet également une augmentation des cellules passages numéro17. Les cultures à long terme des cellules hiRPE après décongélation peuvent être facilement effectuées dans les conditions décrites ici pour obtenir un épithélium mature et fonctionnel15. Un exemple des cellules matures hiRPEp2 à la semaine 52, avec une morphologie classique de pavés cubiques est illustré dans la Figure 3E.

Figure 1 : génération et la maturation des organoïdes rétinienne de CISP humaine adhérentes. (A) Protocole de différenciation qui permet la génération d’organoïdes rétinienne. (B) le CISP humaine en D0. (C) émergents épithélium neuroretinal à D15. (D) auto-formation rétine-comme des structures neurales à D22. (E) ici, le bourgeon de neuroretinal est isolé à l’aide d’une aiguille. (F) des images représentatives d’organoïdes rétinienne en flottant condition de culture à D35. Barreaux de l’échelle = 200 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
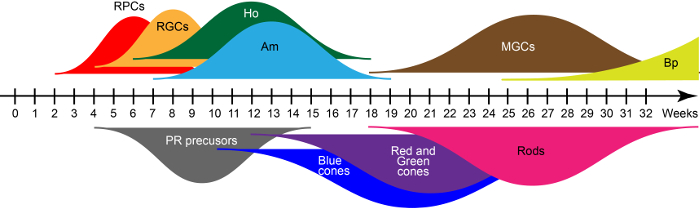
Figure 2 : génération de cellules de vagues d’humain rétinien dérivé iPSC. Abréviations : Cellules progénitrices de rétinal (RPC), les cellules ganglionnaires rétiniennes (CGR), cellules horizontales (Ho), cellules amacrines (Am), cellules gliales Müller (MSG), cellules bipolaires (Bp) et photorécepteurs (PR). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
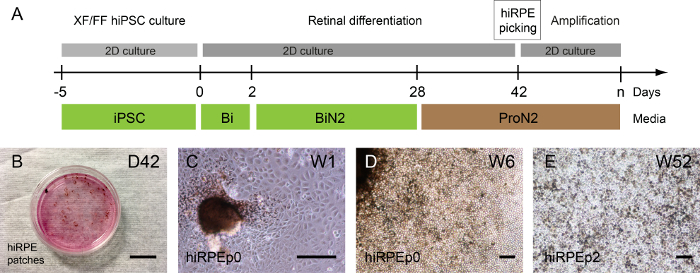
Figure 3 : génération et amplification des humain RPE dérivés iPSC. (A) une illustration du protocole différenciation permettant la génération de cellules humaines de hiRPE. (B) contraste de Phase des images montrant pigmenté correctifs émanant de différencier les adhérents CISP humaine à la semaine 6 (W6). (C) hiRPEp0 cellules cultivent une semaine (W1) après la cueillette patch pigmentées. (D) hiRPEp0 des cellules à la semaine 6 (W6) après la cueillette patch pigmentées. (E), une image représentative des cellules hiRPEp2 après décongélation, cultivées pendant 52 semaines (W52) dans un milieu ProN2. Barreaux de l’échelle = 200 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ce protocole décrit comment produire des cellules RPE et organoïdes rétinienne, contenant les CGR rétiniennes et photorécepteurs, de cellules souches pluripotentes humaines dans des conditions de xeno-gratuit et sans chargeur. Compatible avec le processus de bonnes pratiques de fabrication (BPF), la méthode cultivé présenté ici permet une grande production de cellules rétiniennes dérivées iPSC comme cellules RPE, CGR et photorécepteurs pour le développement de thérapies à base de cellules souches et de la drogue découverte des approches pour le traitement futur des maladies dégénératives de la rétine. La cryoconservation d’organoïdes ensemble rétinienne ou cellules hiRPE fournit également un atout majeur dans l’établissement de banques de cellules intermédiaires, une étape importante pour utilisation future dans les thérapies à base de cellules souches.
La production d’importants stocks de types de cellules rétiniennes spécifiques à un stade particulier de différenciation sera nécessaire pour la future traduction clinique. À cet égard, la génération de trois mois des précurseurs de photorécepteur CD73 séropositifs décrit comme une population de cell transplantation compatible18et la possibilité de générer ces photorécepteurs immatures de gel-dégel rétinienne organoïdes15 renforcent l’espoir d’utiliser ces cellules à des fins thérapeutiques. En ce qui concerne l’épithélium pigmenté rétinien, la capacité des cellules de hiRPE de proliférer dans vitro permet aux productions de grandes cellules à leur banque. Ce qui est important, décongelés humains cellules dérivées d’iPSC RPE conservent leur phénotype RPE et fonction, donc, comme facteur trophique sécrétion ou photorécepteur segment externe phagocytose15, leur facilité d’utilisation pour le dépistage des stratégies aussi bien en ce qui concerne la validation approches thérapeutiques futures.
Il existe une variété de protocoles pour la production de dérivés iPSC rétinienne organoïdes7,8,9,10,11,12,15 qui varient en la culture de méthodes (embryoïdes corps-comme agrégats vs cellules adhérentes) ainsi que l’efficacité et de robustesse. La méthode décrite ici commence à partir d’adhérents CISP humaine et montre une efficacité reproductible, adaptabilité et l’applicabilité à un large éventail d’iPSC humain lignes15. Ce processus, basé sur la variation successive des milieux sans sérum, récapitule les principales étapes du développement rétinienne en exploitant les signaux intrinsèques du système pour orienter la différenciation. Un avantage important du présent protocole est l’absence de formation de corps embryonnaire et l’ajout de la matrice pour les futures cellules rétiniennes GMP conforme aux protocoles pour produire des dérivés de la thérapie de cellules de fabrication. De cette façon, aucune différence dans l’efficacité de la génération organoïde rétinienne et de maturation ont été trouvés entre les conditions de culture xénogénique et non-xénogéniques à l’aide de suppléments Cell Therapy System (CTS) ou non, formulé exclusivement avec recombinant ou composants humanisés.
Le succès de la méthode de différenciation rétinienne dépend largement de la qualité des cultures humaines iPSC. La méthode de reprogrammation n’influence pas l’efficacité de la différenciation du CISP humain à cellules rétiniennes8, mais leur statut de stemness doivent être optimales. Brièvement, couramment cultivée CISP humaine ne doit pas afficher des signes de différenciation. Les colonies ne doivent pas se chevaucher et indiquer leur morphologie circulaire caractéristique. Bien que l’efficacité de la différenciation rétinienne dépend du clone, un minimum de deux structures rétiniennes par cm2 peut être retiré à la D28, correspondant aux structures neuroretinal 50-60 pour un plat de 6 cm. Pour la maturation de la rétine organoïde dans des conditions de culture flottante, limitant le nombre d’ouvrages d’art / puits évite la fusion de la structure et la surconsommation moyenne. Dans ces conditions de culture, organoïdes rétinienne peut être maturé pendant une période étendue, nécessaire pour obtenir des types de cellules rétiniennes fin.
Impatient, rétinienne organoïdes généré in vitro par cette méthode constituent des outils puissants pour les maladies de la rétine modèle. Des modèles spécifiques au patient les cellules rétiniennes dérivées iPSC serviront à mieux comprendre les maladies génétiques ou complexes par l’exploration de leurs mécanismes moléculaires et cellulaires. Ces modèles seront particulièrement adaptés à la découverte de médicaments par le biais de criblage à haut débit, thérapies cellulaires et géniques ou génome édition approches, pour développer des traitements innovants pour les dystrophies rétiniennes.
Déclarations de divulgation
Sacha Reichman, Olivier Goureau et José-Alain Sahel sont inventeurs sur en attente de brevets liés à la génération des cellules rétiniennes de cellules souches pluripotentes humaines.
Remerciements
Les auteurs tiennent à remercier les membres de l’équipe de Goureau pour leur contribution au cours de la mise en place des méthodes décrites ici et G. Gagliardi et M. Garita pour leur lecture critique. Ce travail a été soutenu par des subventions de l’ANR (GPiPS : ANR-2010-RFCS005 ; SightREPAIR : ANR-16-CE17-008-02), l’Association de Retina France et la transfert de technologie société SATT Lutech. Il a également été effectuée dans le cadre de la LIFESENSES LABEX (ANR-10-LABX-65), soutenu par l’ANR dans le programme d’Investissements d’avenir (ANR-11-IDEX-0004-02).
matériels
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
Références
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon