Method Article
Definierten Xeno-frei und Feeder-freie Kulturbedingungen für die Generation der menschlichen iPSC-abgeleitete Retinal Zellmodellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Produktion von spezialisierten netzhautzellen aus pluripotenten Stammzellen ist ein Wendepunkt in der Entwicklung der Stammzell-Therapie für Erkrankungen der Netzhaut. Der vorliegende Beitrag beschreibt eine einfache Methode für eine effiziente Erzeugung von retinalen Organellen und retinalen Pigment Epithel für Grund-, translationalen und klinischen Forschung.
Zusammenfassung
Die Produktion von spezialisierten Zellen aus pluripotenten Stammzellen ist ein leistungsstarkes Tool, um neue Ansätze für die regenerative Medizin zu entwickeln. Die Verwendung von Human-induzierte pluripotente Stammzellen (iPSCs) ist besonders attraktiv für Neurodegenerative Krankheit Studien, einschließlich retinale Dystrophien, wo mark iPSC-abgeleitete retinalen zellmodelle einen großen Schritt nach vorn zu verstehen und zu bekämpfen Blindheit. In diesem Artikel beschreiben wir eine einfache und skalierbare Protokoll zu generieren, Reifen und Tiefgefrieren retinale Organellen. Basierend auf mittlere ändern, der Hauptvorteil dieser Methode ist es, mehrere zu vermeiden und zeitaufwändigen Schritte häufig in eine geführte Differenzierung der iPSCs erforderlich. Imitiert die frühen Phasen der retinalen Entwicklung durch aufeinander folgende Veränderungen der definierten Medien auf anhaftende menschlichen iPSC Kulturen, dieses Protokoll ermöglicht die gleichzeitige Erzeugung von selbst-Bildung neuroretinale Strukturen und Netzhaut pigmentiert (RPE) Epithelzellen in eine reproduzierbare und effiziente Weise in 4 Wochen. Diese Strukturen mit retinale Vorläuferzellen (RPCs) können für die weitere Reifung in einem schwimmenden Kultur Zustand ermöglicht die Differenzierung von RPCs in sieben retinalen Zelltypen im Erwachsenen menschlichen Netzhaut leicht isoliert werden. Darüber hinaus beschreiben wir schnelle Methoden für die Kryokonservierung von retinalen Organellen und RPE-Zellen für die langfristige Lagerung. Die hier beschriebenen Methoden werden miteinander kombiniert, zu produzieren und bank menschlichen iPSC-abgeleitete retinalen Zellen oder Gewebe für Grundlagenforschung und klinische Forschung nützlich.
Einleitung
Die Netzhaut ist Bestandteil des zentralen Nervensystems (ZNS) und hat eine begrenzte Kapazität, spontan nach einer traumatischen Verletzung oder Krankheiten zu regenerieren. Daher führen degenerative Pathologien verursachen definitive retinalen Zellverlust, wie Altersbedingte Makula-Degeneration (AMD), Retinitis Pigmentosa (RP), Glaukom und Diabetische Retinopathie, in der Regel zur irreversiblen Erblindung. Rettung der degenerierten Netzhaut ist eine große Herausforderung für die stammzellbasierte Therapien mit dem Ziel, ersetzen Sie die beschädigten oder verloren gegangene Zellen eine der vielversprechendsten Ansätze1,2,3 sind. Pluripotente Stammzellen als menschlicher embryonaler Stammzellen (WSR) Zellen oder Mensch-induzierte pluripotente Stammzellen (iPSCs) haben die Fähigkeit, auf unbestimmte Zeit in Kultur erweitert werden, und sie haben das Potenzial, alle Arten von Zellen zu produzieren. Fortschritte im Verständnis der retinalen Entwicklung und die Verbesserung der in-vitro- Protokolle für menschlichen iPSC Differenzierung führten zu der Generation von retinalen Organellen7,8,9, 10,11,12. Alle wichtigen retinalen Zellen, einschließlich der retinalen Ganglienzellen (Routinggruppenconnectors), Photorezeptoren und Netzhaut pigmentiert (RPE) Epithelzellen, haben erfolgreich unterschieden von menschlichen WSR und iPSCs4,5, 6. basierend auf der SFEB (serumfreien Kultur Embryoid Körper-wie Aggregate)-Methode, entwickelt von Eiraku Et Al. 13, erhalten Sie zur Bildung von retinalen Organellen von ESC oder iPSC abgeleitet Embryoid Körper-ähnlichen Aggregaten in definierten extrazelluläre Matrix Komponenten7,10,14. Aber diese Protokolle sind kompliziert, erfordert eine große Anzahl von Schritten nicht immer kompatibel mit der Großserienfertigung von Zellen für therapeutische Ansätze oder Drogen-Screening. So, die Wahl der Methode, menschliche netzhautzellen zu produzieren ist von entscheidender Bedeutung und die Methode muss robuste, skalierbare und effizient sein.
Hier, beschreiben basierend auf unseren vorherigen Veröffentlichung15, wir alle notwendigen Schritte für eine einfache und effiziente Generation von netzhautzellen durch Netzhaut organoide Self Bildung von anhaftenden menschlichen iPSCs in einem Feeder frei und Xeno Zustand gepflegt. Ausgehend von routinemäßigen Kulturen der anhaftende menschliche iPSCs, erfordert dieses Protokoll nur eine einfache aufeinanderfolgenden Medium ändern, um die Erzeugung von iPS-gewonnenen RPE (HiRPE) Zellen und neuroretinale Strukturen in 4 Wochen zu ermöglichen. Nach einer manuellen Isolierung HiRPE erweitert werden kann und die Netzhaut Strukturen können gezüchtet werden, als schwimmende Organellen wo sind die retinale Vorläuferzellen in alle retinale Zelltypen in einer sequentiellen Reihenfolge Einklang mit der in-Vivo -Mensch zu unterscheiden Retinogenesis. Zu guter Letzt für Forschung Fortschritt oder Übersetzung klinischer beschreiben wir eine Kryokonservierung Methode ermöglicht die langfristige Lagerung der gesamten Netzhaut Organellen und HiRPE Zellen ohne Beeinträchtigung ihrer phänotypischen Eigenschaften und Funktionalität.
Protokoll
Das Protokoll in diesem Dokument beschriebenen folgt den Richtlinien des Institut De La Vision forschungsethikkommission. Das Institut De La Vision wurde die Manipulation des menschlichen Probe gemäß der aktuellen französischen Verordnung zugelassen. Handhabung der Proben folgt Patientendaten Schutz im Einklang mit den Grundsätzen von Helsinki und nationalen Regelungen nach der ethischen Genehmigung des "Comité de Protection des Personnes (CPP) Ile V".
1. Vorbereitung der Kultur, Medien und Gerichte
-
Kultur, Medien
- Verwenden Sie iPSC Medium, ein chemisch definiertes Medium pluripotente Stammzelle-Kultur im Feeder-freien Bedingungen16gewidmet. 500 mL Medium gemäß Protokoll des Herstellers vorbereiten.
- Verwendung basale iPSC (Bi) Medium definiert die iPSC chemisch Medium ohne Fibroblasten-Wachstumsfaktor 2 (FGF2) oder transformierende Wachstumsfaktor Beta (TGFß).
- Bereiten Sie 500 mL Bi Medium ergänzt mit Zuschlag von 1 % N2 (BiN2 Mittel), 10 Einheiten/mL Penicillin und 10 mg/mL von Streptomycin.
- Bereiten Sie 500 mL proneuronaler N2-basierte Medium (ProN2 Mittel), bestehend aus DMEM:Nutrient Mischung f-12 (DMEM/F12, 1:1, L-Glutamin), 1 % MEM nichtessentiellen Aminosäuren, Zuschlag von 1 % N2, 10 Einheiten/mL Penicillin und 10 mg/mL von Streptomycin vor.
- Bereiten Sie proneuronaler B27-basierte Medium (ProB27 Mittel) bestehend aus DMEM:Nutrient Mischung f-12 (DMEM/F12, 1:1, L-Glutamin), 1 % MEM nichtessentiellen Aminosäuren, 2 % B27 ergänzen, 10 Einheiten/mL Penicillin und 10 mg/mL von Streptomycin.
-
Kultur-Schiff-Vorbereitung
-
Für die menschlichen iPSC-Kultur
- Bereiten Sie 10 mL einer Vitronectin Lösung mit 5 μg/mL Vitronectin mit 1 X PBS-Puffer vor. Fügen Sie in 10 mL 1 X PBS 100 µL der Stammlösung aufgetauten Vitronectin (100 X).
- 2 mL der Lösung pro 6 cm Kulturschale entspricht 0,5 µg/cm2Vitronectin zu verteilen. 1 h bei Raumtemperatur (RT) inkubieren. Entfernen Sie die Vitronectin-Lösung durch Absaugen mit einem Vakuum-Aspiration-System oder eine 5-mL-Pipette.
- 4 mL iPSC Medium pro 6 cm Schale hinzugeben.
- Inkubieren Sie die Gerichte in einer Zelle Kultur Inkubator bei 37 ° C und 5 % CO2 für mindestens 30 min vor Gebrauch.
- Für die menschlichen iPSC gewonnenen RPE (HiRPE) Zellkultur
- Verwenden Sie pluripotente Stammzellen qualifiziert Matrix oder Substrat zur Beschichtung von Brunnen nach Protokoll des Herstellers. Fügen Sie ausreichend Matrix oder Substrat für das Wachstum der gesamten Fläche. Legen Sie beispielsweise 300 µL der Matrix pro Bohrloch in 24-Well-Platte und 3 mL Matrix in einem t-25 cm2 Kolben.
- Inkubieren Sie die beschichteten Kulturgefäße für ein Minimum von 1 h bei 37 ° c Entfernen Sie die Matrix mit Vakuum-Absaugsysteme oder eine 5-mL-Pipette.
- Fügen Sie 1 mL des ProN2 Mediums pro Bohrloch auf 24-Well-Platten und das Kulturgefäß in den Inkubator für ein Minimum von 30 min bis warm und equilibrate das Medium zurück. Für t-25 cm2 Fläschchen siehe Punkt 5.2.
-
Für die menschlichen iPSC-Kultur
2. Wartung und Erweiterung der menschlichen iPSCs
-
Aufrechterhaltung der menschlichen iPSCs
- Bereiten Sie 3 mL iPSC Medium in einer 15 mL Tube vor und halten Sie es für mindestens 15 Minuten vor der Verwendung bei RT. Bereiten Sie eine beschichtete 6-cm-Schüssel, wie in 1.2.1 beschrieben.
- Auftauen eine kryogene Stichprobe von menschlichen iPSCs aus einem flüssigen Stickstoff-Tank oder ein-150 ° C Gefrierschrank durch Inkubation in einem Wasserbad bei 37 ° C für 30 s.
- Desinfizieren Sie sorgfältig die kryogene Fläschchen mit einer Desinfektionslösung Spray. Übertragen Sie die aufgetauten menschlichen iPSCs von der Cryotube auf der 15 mL Tube mit 3 mL iPSC Medium bei RT vorgewärmt
- Zentrifuge das Rohr auf 110 X g für 3 min. Überstands durch Absaugen mit einem Vakuum-Aspiration-System oder eine 5-mL-Pipette entfernen
- Aufschwemmen der Zelle Pellet mit 1 mL der iPSC Medium aus der Vitronectin-beschichtete 6 cm Kulturschale mit einer 2 mL-Pipette und übertragen die Zellen wieder in die Schale. Das Gericht in den Inkubator bei 37 ° C und 5 % CO2 für mindestens 24 h vor dem Ändern des Mediums zurück.
Hinweis: Ein ROCK-Hemmer, z. B. Y-27632 bei 10 µM, kann auf das iPSC-Medium in der 6-cm-Kultur-Gerichte, Apoptose zu reduzieren hinzugefügt werden. - Verändern Sie das Medium täglich und weitergeben Sie der menschlichen iPSCs jede Woche.
-
Der menschliche iPSCs passagierung
- Übergeben Sie der menschlichen iPSC an einer 70-80 %-Mündung, klassisch nach 7 Tagen in der Kultur.
- Bereiten Sie 6 cm Gerichte für die passagierung wie unter Punkt 1.2.1 beschrieben. Das iPSC-Medium aus der Gerichte mit konfluierende iPSCs entfernen und Hinzufügen von 2 mL einer Dissoziation-Lösung für 6 min bei RT
Hinweis: Die Inkubationszeit hängt die iPSC-Klone. Versuchen Sie eine 6 min Inkubation als Start. - Entfernen Sie die Dissoziation-Lösung mit Vakuum-Absaugsysteme oder eine 5-mL-Pipette, und fügen Sie 2 mL iPSC Medium bei RT Aufschwemmen der iPSC-Kolonien vorgewärmt durch sie nach oben und unten 5-10 X mit einer 1.000 µL Pipette pipettieren.
Achtung: Vermeiden Sie einzelne Zelle Dissoziation von übermäßigen pipettieren. - 30 bis 200 µL resuspendierte Zelle Klumpen in einer neuen 6-cm-Kulturschale zu übertragen. Die Gerichte in der Zelle Kultur Inkubator bei 37 ° C und 5 % CO2 für mindestens 24 h vor dem Ändern des Mediums zurück.
Hinweis: Das Volumen der resuspendierte Zelle Klumpen benötigt für die passagierung richtet sich nach der iPSC-Klone. - Verändern Sie das Medium täglich und weitergeben Sie der menschlichen iPSCs jede Woche.
3. Generation der Netzhaut Organellen
- Starten Sie die iPSC-Differenzierung nach dem Protokoll schematisiert in Figur 1A , wenn die Kolonien einen Zusammenfluss von 60-70 % (Abbildung 1 b) erreichen.
- 4 mL Bi Medium pro 6-cm Schüssel vorbereiten. Das Bi-Medium auf 37 ° c warm Verändern Sie das iPSC-Medium Bi Medium. Beachten Sie dieses Mal als Tag 0 (D0).
- Bei D2 wechseln Sie die Kulturen in der Bi-Medium zu einem BiN2 Medium, zuvor bei 37 ° c erwärmt Verändern Sie alle 2-3 Tage das Medium.
- Emergente Self bildende retinale Organellen durch Neuroepithelium Knospen, zu identifizieren, wie in Abbildung 1 dargestellt -1E.
Hinweis: Diese frühen retinalen Organellen, entspricht in ihrer Entwicklungsphase Optik Cup, können manuell für nachgeschaltete Experimente isoliert werden.
(4) die Reifung der Netzhaut Organellen
- Bereiten Sie am D28, 6-Well-Platten mit 4 mL/Well des ProB27 Mediums zunächst mit 10 ng/mL des FGF2 ergänzt (Abb. 1A).
Hinweis: Fügen Sie FGF2 hinzu, unmittelbar vor die Medien zu den Platten hinzugefügt werden.
Achtung: Filtern Sie FGF2 nicht. - Die retinalen Strukturen manuell von der 6-cm-Gerichte zu erholen. Um dies zu tun, isolieren Sie die Strukturen machen senkrechte Rillen mit der Nadel um die Gliazellen Knospe zu, wie in Abbildung 1Egezeigt, und lösen Sie die Organellen durch Kratzen sie vorsichtig mit der Nadel.
- 10-15 Organellen mit einer 1.000 µL Pipette abzusaugen und in einem einzigen Brunnen von der 6-Well-Platte mit ProB27 Medium zu übertragen.
- Halten Sie die Netzhaut Organellen in schwimmenden Kulturbedingungen in ProB27 Medium in einer Zelle Kultur Inkubator bei 37 ° C und 5 % CO2. Ändern Sie die Hälfte des Mediums alle 2-3 Tage.
Hinweis: Behandeln Sie die Organellen mit FGF2 bis D35. - D35 nehmen Sie die Hälfte des Mediums und fügen Sie frisches vorgewärmte ProB27-Medium bei 37 ° C ohne FGF2.
- Ändern Sie die Hälfte des Mediums alle 2-3 Tage während der Zeit erforderlich, um die gewünschte retinalen Zelltypen nach der Entstehung des retinalen Zelltypen zu erhalten, wie in Abbildung 2dargestellt.
5. Erzeugung und Verstärkung der menschlichen iPSC gewonnenen RPE (HiRPE) Zellen
-
Generation von menschlichen HiRPE Zellen
- Die iPSCs in Abgrenzung zu engagieren, wenn die Kolonien einen Zusammenfluss von 60-70 %, nach dem Protokoll schematisiert in Abbildung 3Aerreichen.
- 4 mL pro 6-cm-Schüssel Bi Medium vorzubereiten und das Bi-Medium bei 37 ° c warm Verändern Sie das iPSC-Medium Bi Medium. Beachten Sie dieses Mal als Tag 0 (D0).
- Bei D2 wechseln Sie die Kulturen Mittel-und Bi BiN2 Medium zuvor bei 37 ° c erwärmt Verändern Sie alle 2-3 Tage das Medium.
- D28 ändern Sie das Medium zu einem frischen ProN2 Medium zuvor bei 37 ° C erwärmt, wie in Abbildung 3Adargestellt.
Hinweis: Dieser Schritt kann nach der organoide Ernte in Schritt 4 beschrieben erfolgen. - Ändern Sie das ProN2 Medium alle 2-3 Tage.
- D42 erkennen Sie emergent HiRPE Zellen durch die Beobachtung der pigmentierten Flecken wie in Abb. 3 bgezeigt.
Hinweis: Die Pigmentierung von HiRPE Zellen erscheint zwischen D35, D56 je nach iPSC-Klone.
-
Verstärkung der HiRPE Zellen
- Am D42 bereiten Sie eine 24-Well-Platte zuvor beschichtet mit der Matrix wie in Schritt 1.2.2 beschrieben und enthält 1 mL des ProN2 Mediums pro Bohrloch vor. Platzieren Sie die Platte für 15 min. im Inkubator bei 37 ° C und 5 % CO2 vor Gebrauch.
- Die HiRPE-Patches manuell von der 6-cm-Schüssel zu erholen. Um Patches zu isolieren, machen Sie eine senkrecht Rasterung mit der Nadel um die pigmentierten Epithel und lösen Sie das Blatt durch kratzen es vorsichtig mit der Nadel zu. 10 pigmentierte Flecken mit einer 1.000 µL Pipette abzusaugen und in einem einzigen gut 24-Well-Platte zu übertragen.
- Halten Sie die HiRPE-Patches in ProN2 Medium in einer Zelle Kultur Inkubator bei 37 ° C und 5 % CO2 für 48 h vor dem Ändern des Mediums. Beachten Sie diese HiRPE Zelle Passage als 0 (hiRPEp0). Verändern Sie das Medium alle 2-3 Tage mit ProN2 Medium.
- Übergeben Sie die hiRPEp0 Zellen, wenn die Zellen konfluierende sind.
- Entfernen Sie das Medium mit Vakuum-Absaugsysteme und waschen Sie jeweils gut 1 X mit 1 mL PBS mit einer 5 mL-Pipette zu.
- Entsorgen Sie die PBS mit Vakuum-Absaugsysteme, fügen Sie 200 µL pro Bohrloch von 0,25 % Trypsin und mindestens 15 min. im Inkubator bei 37 ° c inkubieren Fügen Sie 800 µL des ProB27 Mediums, die Trypsin zu inaktivieren.
Hinweis: Die Verwendung des ProN2 Mediums zu stoppen die Trypsin-Aktivität wird nicht empfohlen. - Trennen Sie das Blatt der HiRPE Zellen durch pipettieren es rauf und runter. Legen Sie die Zellsuspension in einer 15 mL Tube und für 5 min bei 110 X g zentrifugieren.
Hinweis: Eine zusätzliche Wäsche kann mit ProN2 Medium zu entfernen, die Überschreitung des ProB27 Mediums erfolgen. - Entfernen Sie den überstand und sanft Aufschwemmen der Zelle Pellet in 2 mL ProN2-Medium bei 37 ° c vorgewärmt Zählen Sie die Zellen mit einer Zelle Zähler.
- 1,25 Millionen Zellen und legen Sie sie in einem Matrix-beschichtete t-25 cm2 Kolben (siehe Punkt 2.2.2), enthält 5 mL ProN2-Medium bei 37 ° c vorgewärmt Beachten Sie diese HiRPE Zelle Passage als 1 (hiRPEp1).
- Halten Sie die HiRPE Zellen im ProN2 Medium in einer Zelle Kultur Inkubator bei 37 ° C und 5 % CO2 für 48 h vor dem Ändern des Mediums.
- Wechseln Sie das Medium alle 2-3 Tage. Wenn die hiRPEp1 Zellen Zusammenfluss erreichen, führen Sie den nächsten Durchgang oder Kryokonservierung.
6. die Kryokonservierung von Retinal Organellen und HiRPE Zellen
-
Für die gesamte Netzhaut Organellen
- Wählen Sie 5 bis 20 retinale Organellen mit einem transferpipette und legen Sie sie in einem kryogenen Fläschchen. Jedes überschüssige Medium mit einer 1.000 µL Pipette zu entfernen, ohne Berührung der Organellen am unteren Ende der Röhre und fügen Sie 250 µL kalter Kryokonservierung Medium (siehe Tabelle der Materialien).
- Frieren Sie den Fläschchen in einem Isopropanol-basierte Einfrieren Behälter bei-80 ° C für mindestens 4 Std. Transfer die gefrorenen Fläschchen zu einem-150 ° C Gefrierschrank oder flüssigem Stickstoff-Tank für langfristige Lagerung.
-
HiRPE Zellen
- Distanzieren Sie in der Passage 1 die HiRPE Zellen wenn die Zellen konfluierende sind.
Hinweis: Eine Kryokonservierung von hiRPEp0 Zellen wird nicht empfohlen. - Aspirieren Sie das Medium aus der t-25 cm2 Flasche mit Vakuum-Absaugsysteme und waschen Sie es 1 X mit 3 mL PBS mit einer 5 mL-Pipette.
- Entfernen Sie die PBS mit Vakuum-Absaugsysteme, fügen Sie 1 mL Trypsin 0,25 % und mindestens 15 min. im Inkubator bei 37 ° c inkubieren Fügen Sie 5 mL des ProB27 Mediums, die Trypsin-Aktivität zu stoppen.
Hinweis: Die Verwendung des ProN2 Mediums, Trypsin zu inaktivieren wird nicht empfohlen. - Trennen Sie das Blatt der HiRPE Zellen durch nach oben und unten mit einer 10 mL-Pipette pipettieren. Zählen Sie die Zellen mit Zelle Zähler. Legen Sie die Zellsuspension in einer 15 mL Tube und für 5 min bei 110 X g zentrifugieren.
Hinweis: Eine zusätzliche Wäsche kann mit ProN2 Medium zu entfernen, die Überschreitung des ProB27 Mediums erfolgen. - Aspirieren Sie des Überstands mit Vakuum-Aspiration und Aufschwemmen Sie sanft Zellen um 2 Millionen Zellen in 250 µL der Kryokonservierung Medium zu erhalten.
- 250 µL Zellsuspension pro kryogenen Fläschchen zu übertragen. Die Fläschchen in einem Isopropanol-basierte Einfrieren Behälter bei-80 ° C für mindestens 4 Stunden einfrieren.
- Übertragen Sie die gefrorenen Fläschchen auf-150 ° C Gefrierschrank oder ein flüssiger Stickstoff-Tank für die Langzeitspeicherung.
- Distanzieren Sie in der Passage 1 die HiRPE Zellen wenn die Zellen konfluierende sind.
(7) Auftauen von Retinal Organellen und HiRPE Zellen
-
Auftauen der gesamten Netzhaut Organellen
- Warm ProB27-Medium bei 37 ° C (2 mL wird für jedes kryogenen Fläschchen verlangt werden).
- Tauen Sie aus dem flüssigen Stickstoff-Tank oder-150 ° C Gefrierschrank eine kryogene Fläschchen mit retinalen Organellen in einem Wasserbad bei 37 ° C für 30 S. desinfizieren die kryogene Fläschchen vorsichtig mit einer Desinfektionslösung Spray auf.
- Öffnen Sie das Fläschchen und 1 mL vorgewärmten ProB27 Medium. Übertragen Sie die Organellen auf einen 1,5 mL-Tube mit einer transferpipette.
- Entfernen Sie das Medium sanft ohne Berührung der retinalen Strukturen an der Unterseite des Rohres pipettieren. Waschen Sie die Organellen 1 mehr Zeit mit 1 mL des Mediums vorgewärmten ProB27.
- Aspirieren der Organellen mit einem transferpipette und legen Sie sie in 1 auch von einer 6-Well-Platte mit ProB27 Medium vorgewärmt und in einem Inkubator bei 37 ° C und 5 % CO2equilibriert.
Hinweis: Platzieren Sie 10-15 retinale Organellen pro Bohrloch einer 6-Well-Platte. - Ändern Sie die Hälfte des Mediums alle 2-3 Tage während der Zeit benötigt um die gewünschte retinalen Zelltypen nach ihrer Entstehung zu erhalten, wie in Abbildung 2beschrieben.
-
Auftauen von HiRPE Zellen
- Warm ProN2-Medium bei 37 ° C (8 mL wird für jedes kryogenen Fläschchen verlangt werden).
- Aus dem flüssigen Stickstoff-Tank oder-150 ° C Gefrierschrank Auftauen einer kryogenen Stichprobe von hiRPEp1 Zellen durch eine Inkubation in einem Wasserbad bei 37 ° C für 30 S. desinfizieren die kryogene Ampulle sorgfältig mit Desinfektionslösung Spray.
- Öffnen Sie die Tube und fügen Sie 1 mL vorgewärmten ProN2 Medium und übertragen Sie die Zellsuspension auf eine 15 mL Röhrchen mit 2 mL vorgewärmten ProN2 Medium. Für 5 min bei 110 X g zentrifugieren.
- Entfernen Sie den überstand und sanft Aufschwemmen der Zelle Pellet in 2 mL ProN2-Medium bei 37 ° c vorgewärmt
- Zählen Sie die Zellen mit einer Zelle Zähler.
- 1,25 Millionen Zellen nehmen und legen Sie sie in der Matrix-beschichtete t-25 cm2 Kolben (siehe Punkt 2.2.2), enthält 5 mL ProN2-Medium bei 37 ° c vorgewärmt Beachten Sie in diesem Stadium die Passage als 2 (hiRPEp2).
- Halten Sie die hiRPEp2-Zellen in ProN2 Medium in die Zelle Kultur Inkubator bei 37 ° C und 5 % CO2 für 48 h vor dem Ändern des Mediums.
- Wechseln Sie das Medium alle 2-3 Tage. Wenn die HiRPE Zellen Zusammenfluss erreichen, führen Sie den nächsten Durchgang oder Kryokonservierung.
Hinweis: Nach 2 Wochen in Kultur, können 8 Millionen HiRPE Zellen für weitere Experimente gesammelt werden.
Ergebnisse
Der erste Schritt zur menschlichen iPSC Differenzierung im Feeder-freien Bedingungen16 angebaut ist zum Herunterfahren Selbsterneuerung Maschinen mit Bi-Medium um zu ermutigen, eine spontane Differenzierung (Abbildung 1A). Dann, bei D2, das Bi-Medium wird ergänzt mit eine N2-Ergänzung zur differenzierenden iPSCs Zellen in Richtung der neuronalen und Netzhaut Linien führen. Dieser Prozess führt zum Auftreten von neuroretinale Knospen an um D28 (Abbildung 1 - 1E). Selbst bilden neuroretinale Strukturen können isoliert mit einer Nadel, wie in Abbildung 1E dargestellt werden und auf Kultur Platten erlauben die Reifung der Netzhaut Organellen in schwimmenden Kulturbedingungen mit ProB27 Medium (Abb. 1F) übertragen. Um Wachstum und Entwicklung der neuronale Netzhaut bevorzugen, ist das Medium für 1 Woche (Abbildung 1A) FGF2 hinzugefügt.
Die aufstrebenden retinalen Strukturen enthalten D28 hauptsächlich retinale Vorläuferzellen, die wichtigen Transkriptionsfaktors als PAX6, RAX und VSX215Co zum Ausdruck zu bringen. Diese Vorfahren ergeben sich sieben Hauptgruppen der Netzhaut Zelltypen in schwimmenden Kulturbedingungen in eine evolutionär konservierte geburtenfolge Einklang mit retinalen Bildungsforschung. Basierend auf qRT-PCR und Immunohistochemistry zuvor beschrieben in Reichman Et al. 15, die weiten Kurven in Abbildung 2 zeigen Wellen des frühen und späten-geborene retinalen Zelle Generationen während einer in-vitro- Reifung. Die Kulturzeit definiert die Zelltypen in der Organellen vorhanden.
Die Isolation der HiRPE Zellen für weitere Verstärkung kann durchgeführt werden, nur wenn Pigmentierung wahrnehmbar ist, weil diese Zelle Färbung ihrer Visualisierung ermöglicht. Auf diese Weise das ProN2 Medium von D28 D42 wird zugunsten der Pigmentierung der RPE Zellen15.
Abhängig von der menschlichen iPSC-Klon können die pigmentierten Flecken vor oder nach der Self Bildung der retinalen Strukturen erkannt werden; aber meistens 1 oder 2 Wochen nach der Verwendung des ProN2 Mediums bei D28 (Abb. 3A, B). Abbildung 3 und 3Dzeigt eine repräsentative Hellfeld-Bild von HiRPE Zellen von den isolierten Patches in der Passage 0 erweitert. Dann können die HiRPE Zellen bis zum Durchgang 4, behalten ihre RPE-Phänotyp ohne eine epitheliale-Mesenchymale Transition (EMT) erweitert werden. EMT kann jedoch durch die Verwendung von ROCK-Hemmer wie Y-27632, so dass auch eine Erhöhung der Zelle Nummer Passagen17verhindert werden. Langfristige Kulturen von HiRPE Zellen nach dem Auftauen können leicht in eine ausgereifte und funktionelle Epithel15erhalten hier beschriebenen Bedingungen durchgeführt werden. Ein Beispiel für Reife hiRPEp2 Zellen in Woche 52 mit einem klassischen quaderförmigen Kopfsteinpflaster Morphologie ist in Abbildung 3Edargestellt.

Abbildung 1: Generation und Reifung der Netzhaut Organellen von anhaftenden menschlichen iPSCs. (A) Differenzierung Protokoll ermöglicht die Generierung von retinalen Organellen. (B) menschlichen iPSCs an D0. (C) Emerging neuroretinale Epithel in D15. (D) selbst bilden neuronale Netzhaut-ähnliche Strukturen auf D22. (E) hier, ist neuroretinale Keim isoliert mit einer Nadel. (F) repräsentative Bilder von retinalen Organellen in schwimmende Kultur Zustand am D35. Skalieren von Balken = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
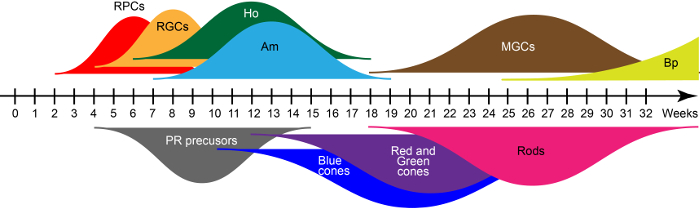
Abbildung 2: Wellen der menschlichen Netzhaut iPSC-abgeleitete Zellen Generation. Abkürzungen: Retinal Vorläuferzellen (RPCs), retinalen Ganglienzellen (Routinggruppenconnectors) horizontalen Zellen (Ho), amakrinen Zellen (morgens), Müller-Gliazellen (MGCs), Bipolarzellen (Bp) und Photorezeptoren (PR). Bitte klicken Sie hier für eine größere Version dieser Figur.
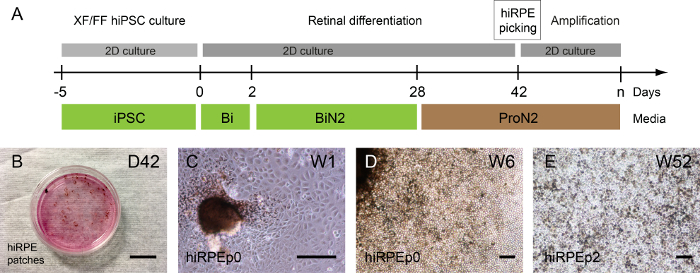
Abbildung 3: Erzeugung und Verstärkung der menschlichen iPSC gewonnenen RPE. (A) eine Darstellung des Protokolls Differenzierung ermöglicht die Erzeugung von menschlichen HiRPE Zellen. (B) Phasenkontrast-Bilder zeigen pigmentierte Flecken aus anhaftende menschliche iPSCs in Woche 6 (W6) zu unterscheiden. (C) hiRPEp0-Zellen kultiviert eine Woche (W1) nach der Ernte pigmentierten Patch. (D) hiRPEp0 Zellen in Woche 6 (W6) nach der Ernte pigmentierten Patch. (E) ein repräsentatives Bild der hiRPEp2 Zellen nach dem Auftauen kultiviert für 52 Wochen (W52) in ProN2 Medium. Skalieren von Balken = 200 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Dieses Protokoll beschreibt die RPE-Zellen und Netzhaut Organellen mit retinalen Routinggruppenconnectors und Photorezeptoren, aus menschlicher pluripotenter Stammzellen im Xeno frei und Feeder Bedingungen produzieren. Kompatibel mit der Good Manufacturing Practice (GMP), die Methode kultiviert hier vorgestellten ermöglicht eine große Produktion von iPSC-abgeleitete netzhautzellen RPE Zellen Routinggruppenconnectors und Photorezeptoren für die Entwicklung der stammzellbasierte Therapien und Medikamenten Entdeckung-Ansätze für die künftige Behandlung von degenerativen Erkrankungen der Netzhaut. Die Kryokonservierung der gesamten Netzhaut Organellen oder HiRPE Zellen bietet auch einen großen Vorteil bei der Festlegung der mittleren zellbanken, ein wichtiger Schritt für die zukünftige Verwendung in stammzellbasierte Therapien.
Die Produktion von großposten Netzhaut bestimmte Zelltypen in einem bestimmten Stadium der Differenzierung wird für zukünftige klinische Übersetzung erforderlich. In diesem Zusammenhang beschrieben die Generation in drei Monaten CD73-Positive Photorezeptor Vorstufen einer Transplantation-kompatiblen Zelle Bevölkerung18, sowie die Möglichkeit, diese unreifen Photorezeptoren aus Einfrieren aufgetaut Retinal generieren Organellen15 verstärken die Hoffnung, diese Zellen zu therapeutischen Zwecken zu verwenden. Bei retinalen Pigment Epithel ermöglicht die Fähigkeit der HiRPE Zellen in Vitro vermehren großzellige Produktionen sie per Banküberweisung. Wichtig ist, behalten aufgetaute menschlichen iPSC gewonnenen RPE-Zellen ihre RPE Phänotyp und Funktion, deshalb, wie trophischen Faktor Sekretion oder Photorezeptor äußere Segment Phagozytose15, Validierung ihrer Benutzerfreundlichkeit für das screening von Strategien sowie zukünftige Therapieansätze.
Es gibt eine Vielzahl von Protokollen für die Generation der iPSC-abgeleitete retinalen Organellen7,8,9,10,11,12,15 , die in variieren Kultur (Embryoid Körper-wie Aggregate vs. adhärente Zellen) Methoden sowie Effizienz und Robustheit. Die hier beschriebene Methode von anhaftenden menschlichen iPSCs beginnt und zeigt eine reproduzierbare Wirksamkeit, die Anpassungsfähigkeit und die Anwendbarkeit auf den unterschiedlichsten menschlichen iPSC Linien15. Dieser Prozess, basierend auf der aufeinander folgenden Änderung der serumfreien Medien, rekapituliert die wichtigsten Schritte des retinalen Entwicklung durch Ausnutzung die intrinsische Signale des Systems, Differenzierung zu führen. Ein wichtiger Vorteil dieses Protokolls ist das Fehlen von embryonalen Körper Bildung und die Zugabe von Matrix für zukünftige GMP-konforme retinalen Zelle Herstellung Protokolle, um Zelle Therapie Derivate zu produzieren. Auf diese Weise fanden keinen Unterschied in der Effizienz der Netzhaut organoide Generation und Reifung zwischen xenogene und keine-xenogene Kulturbedingungen Zelle Therapie System (CTS) Ergänzungen oder nicht, ausschließlich mit rekombinanten formuliert oder humanisierten Komponenten.
Der Erfolg der Netzhaut Differenzierung Methode hängt weitgehend von der Qualität der menschlichen iPSC Kulturen. Die Neuprogrammierung Methode hat keinen Einfluss auf die Effizienz der Differenzierung der menschlichen iPSCs netzhautzellen8, aber deren Stemness Status müssen optimal zu sein. Kurz gesagt, sollte routinemäßig kultivierten menschlichen iPSCs keine Anzeichen der Differenzierung aufweisen. Die Kolonien sollten sich nicht überschneiden und müssen ihre charakteristischen kreisförmigen Morphologie zeigt. Obwohl die Effizienz der Netzhaut Differenzierung Klon-abhängig ist, kann ein Minimum von zwei retinalen Strukturen pro cm2 D28, abgeholt entspricht 50-60 neuroretinale Strukturen für eine 6-cm-Schüssel. Für die Netzhaut organoide Reifung in schwimmenden Kulturbedingungen vermeidet die Beschränkung der Anzahl von Strukturen pro Bohrloch Struktur Fusion und mittlere Überkonsum. In diesen Kulturbedingungen können Netzhaut Organellen für eine umfangreiche Zeit gereift, verpflichtet, späten retinalen Zelltypen zu erhalten.
Wir freuen uns, darstellen retinale Organellen generiert in Vitro durch diese Methode leistungsstarke Tools für Modell Netzhauterkrankungen. Patientenspezifische iPSC-abgeleitete retinalen zellmodelle werden um komplexe oder genetischen Krankheiten besser zu verstehen durch die Erforschung der molekularen und zellulären Mechanismen verwendet werden. Diese Modelle werden besonders geeignet für die Wirkstoffforschung durch Hochdurchsatz-Screening, Zell- und Gentherapie Therapien oder Genom Bearbeitung Ansätze, um innovative Behandlungen für Netzhaut Dystrophien zu entwickeln.
Offenlegungen
Sacha Reichman, Olivier Goureau und José-Alain Sahel sind Erfinder auf angemeldete Patente im Zusammenhang mit der Erzeugung von netzhautzellen aus menschlicher pluripotenter Stammzellen.
Danksagungen
Die Autoren möchten beim Aufbau der hier beschriebenen Methoden und G. Gagliardi und M. Garita für ihre kritischen Lektüre Goureau Team für ihre Beiträge danken. Diese Arbeit wurde unterstützt durch Zuschüsse aus dem ANR (GPiPS: ANR-2010-RFCS005; SightREPAIR: ANR-16-CE17-008-02), die Netzhaut Frankreich Association und der Technologietransfer Unternehmen SATT Lutech. Es wurde auch im Rahmen der LABEX LIFESENSES (ANR-10-LABX-65) unterstützt durch die ANR programmintern Investissements Avenir (ANR-11-IDEX-0004-02) durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
Referenzen
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten