Method Article
Xeno 無料の定義された、人間の世代の iPSC 由来網膜細胞モデル フィーダー フリー培養条件
要約
多能性幹細胞から特殊な網膜細胞の生産は、網膜疾患の幹細胞を用いた治療法の開発のターニング ポイントです。本稿は、並進、基礎および臨床研究のオルガノイドの網膜と網膜色素上皮の効率的な生成の単純な方法をについて説明します。
要約
特殊化した細胞から多能性幹細胞の生産には、再生医療のための新しいアプローチを開発する強力なツールが用意されています。人間誘導された多能性幹細胞 (Ips) の使用は、iPSC 由来網膜細胞モデルが理解し失明を戦う主要な一歩前進をマーク網膜ジストロフィーを含む神経変性疾患研究に特に魅力的です。生成、成熟、および網膜オルガノイドを凍結するシンプルかつスケーラブルなプロトコルについて述べる。媒体を変更するに基づいて、このメソッドの主な利点は複数を避けるために、時間のかかる手順は、Ips の誘導分化で要求される一般的。付着性人間 iPSC 文化に定義されているメディアの継時的変化による網膜の開発の初期の段階を模倣、このプロトコルにより上方構造と網膜色素上皮 (RPE) 細胞を自己形成の同時発生、4 週間で再現性のある、効果的な方法。これらの構造体を含む網膜前駆細胞 (Rpc) は、Rpc の大人の人間の網膜内にある 7 網膜細胞型への分化を有効に浮遊培養条件でさらに成熟簡単に分離できます。また、網膜オルガノイドの凍結保存法と長期保存のための網膜色素上皮細胞について述べる。一緒に組み合わせることで、ここで説明する方法は、銀行の iPSC 由来網膜細胞または基礎・臨床研究のためのティッシュを制作し役に立つでしょう。
概要
網膜は中枢神経系 (CNS) の不可欠な部分で、自発的に次の外傷性の傷害または病気を再生する限られた容量。したがって、糖尿病網膜症、緑内障、網膜色素変性症 (RP) 加齢に伴う黄斑変性症 (AMD) などの決定的な網膜細胞の損失を引き起こす退行性の病態は、通常、不可逆的な失明に します。変性網膜を救出、破損したまたは失われた細胞を置き換えることを目指して幹細胞ベースの治療が最も有望なアプローチ1,2,3の 1 つで、主要な課題です。ヒト胚性幹細胞 (Esc) 細胞と多能性幹細胞または人間誘導された多能性幹細胞 (Ips) は、文化では、無限に拡張する能力を持っているし、任意のセルの種類を生成する可能性があります。網膜の開発の私達の理解と体外の改善の進歩人間 iPSC 分化がにより網膜 organoids7,8,9の生成のためのプロトコルします。 10、11,12。主要な網膜細胞、網膜神経節細胞 (Rgc)、光受容体、網膜色素上皮 (RPE) 細胞などのすべてが人間 Esc と Ips4,ので5,から正常に分化されている6. 永楽らによって開発された SFEB (胚様体のような骨材の無血清培養) 法に基づく13、網膜オルガノイドの自己形成は、定義された細胞外マトリックス成分7,10,14esc キーまたは iPSC 由来胚様体のような集計から入手できます。しかし、これらのプロトコルは複雑な治療法や創薬スクリーニングのため細胞の大量生産と常に互換性がないステップの多数を必要とします。したがって、人間の網膜の細胞を生成するメソッドの選択が重要とメソッドは、堅牢で拡張性が高く、かつ効率的なする必要があります。
ここでは、当社の以前の文書15に基づいて、我々 はフィーダー、xeno フリー状態で栽培される付着人間 Ips から網膜における自己形成を通じて網膜細胞のシンプルかつ効率的な世代のため各ステップをについて説明します。付着性人間 Ips の日常文化から始まって、このプロトコルは 4 週間で iPS 由来 RPE (hiRPE) 細胞と上方の構造の両方の世代を変更する単純な連続媒体のみを必要があります。手動分離後 hiRPE を展開して網膜の構造は浮動 organoids 網膜前駆細胞が生体内で人間と一貫性のある順番にすべての網膜細胞のタイプに区別することで培養できます。retinogenesis。最後に、研究の進歩や臨床の翻訳は、彼らの表現の特性と機能に影響を与えずに網膜全体 organoids と hiRPE 細胞の長期貯蔵を許可する凍結方法をについて説明します。
プロトコル
このペーパーで説明したプロトコルの Institut de la ビジョンの研究倫理委員会のガイドラインに従います。Institut de la ビジョンは、現在のフランス語の規則に従って人間の標本の操作を許可されています。検体の取り扱い"Comité デ保護デ Personnes (CPP) イル V"の倫理的な承認後にヘルシンキの教義に従って患者データ保護と国民の規則に従います。
1. 文化メディアと料理の準備
-
文化メディア
- IPSC 媒体、専用のフィーダー無料条件16多能性幹細胞の培養に化学的に培地を使用します。製造元のプロトコルに従って媒体の 500 mL を準備します。
- 使用基底 iPSC (Bi) 媒体 iPSC は化学的に線維芽細胞成長因子 2 (FGF2) や変形の成長要因ベータ (β) なし媒体を定義されています。
- 500 ml 1 %n2 サプリメント (BiN2 中)、Bi 培の 10 単位/ml、ペニシリンとストレプトマイシンの 10 mg/mL。
- 視覚 N2 ベース (ProN2 中) からなる媒質の DMEM:Nutrient 混合 F-12 (DMEM/f12 キーを 1:1、L グルタミン)、1% メモリ必須でないアミノ酸、1 %n2 サプリメント、10 単位/mL ペニシリンとストレプトマイシンの 10 mg/mL の 500 mL を準備します。
- 視覚 B27 ベース メディア (ProB27 中) を DMEM:Nutrient 混合 F-12 (DMEM/f12 キー、1:1、L グルタミン)、1% メモリ必須でないアミノ酸の構成の準備、2 %b27 を補う、10 単位/mL ペニシリンとストレプトマイシンの 10 mg/mL。
-
培養容器の準備
-
人間 iPSC 文化の
- ビトロネクチン溶液 5 μ g/mL の 1x PBS でビトロネクチンの 10 mL を準備します。10 mL の 1x PBS、解凍ビトロネクチン原液 (100 x) の 100 μ L を追加します。
- 0.5 μ g/cm2に対応する 6 cm 培養皿ごとビトロネクチン溶液 2 mL を配布します。それを室温 (RT) で 1 時間インキュベートします。真空吸引システムまたは 5 mL ピペットを使用して誤嚥によるビトロネクチン ソリューションを削除します。
- 6 cm 皿あたり iPSC 培地 4 mL を追加します。
- 料理使用前に 30 分以上の 37 ° C、5% CO2セル文化のインキュベーターで孵化させなさい。
- 人間の iPSC 由来 RPE (hiRPE) 細胞培養
- 製造元のプロトコルによると井戸をコートするのに多能性幹細胞修飾マトリックスまたは基板を使用します。十分なマトリックスまたは全体の成長の表面領域をカバーする基板を追加します。たとえば、よく 24 ウェル プレート、T-25 cm2フラスコで行列の 3 mL あたり行列の 300 μ L を入れてください。
- 37 ° C で 1 時間の最小値のためコーティング培養容器を孵化させなさい真空吸引のシステムまたは 5 mL ピペットを使用してマトリックスを削除します。
- 24 ウェルプレートのウェルあたり ProN2 培地 1 mL を追加し、暖かいし、媒体を平衡に 30 分間の最小値のためのインキュベーターに培養器を戻ります。T-25 cm2フラスコ、5.2 を参照してください。
-
人間 iPSC 文化の
2. メンテナンスおよび拡張の人間の Ips
-
人間 Ips のメンテナンス
- IPSC 15 mL チューブ中の 3 mL を準備し、使用前に 15 分以上の RT でそれを維持します。1.2.1 に従ってコーティング 6 センチメートルの皿を準備します。
- 30 37 ° C の水浴中で-150 ° C のフリーザーまたは液体窒素タンクから人間 Ips の極低温サンプルを解凍 s。
- 慎重に消毒消毒液スプレーを使用してセラム。室温で加温 iPSC 媒体の 3 mL を含む 15 の mL の管に、cryotube から解凍人間 Ips を転送します。
- 3 分間遠心 110 x g でチューブ吸引真空吸引システムまたは 5 mL ピペットを使用して上清を削除します。
- IPSC 培地 2 mL ピペットを使用してビトロネクチン コーティング 6 cm 培養皿から 1 mL の細胞ペレットを再懸濁し、セルを皿に転送します。24 h 以上の 37 ° C、5% CO2インキュベーターに媒体を変更する前に皿を戻ります。
注: ROCK 阻害剤の Y-27632 10 μ M でなどは、アポトーシスを抑える 6 cm 培養皿で iPSC 媒体に追加できます。 - 毎日媒体を変更し、毎週ヒトの Ips を渡します。
-
人間 Ips の継
- 7 日間の培養後古典的な 70-80% の合流点で人間の iPSC を渡します。
- 1.2.1 の手順で説明されているように継 6 cm 料理を準備します。合流 Ips で皿から iPSC 媒体を削除し、室温 6 分間解離液 2 mL を追加
注: インキュベーション時間は iPSC クローンに依存します。スタートとして 6 分インキュベーションをしてみてください。 - 真空吸引のシステムまたは 5 mL ピペットを使用して解離ソリューションを削除し、iPSC 培地 2 mL 加温した再懸濁しますで iPSC 植民地 1,000 μ L ピペットで 5-10 倍上下それらをピペッティングでを追加します。
注意: は、過剰なピペッティングから単一細胞解離を避けます。 - 新しい 6 cm 培養皿で再懸濁細胞塊の 30 を 200 μ L を転送します。24 h 以上の 37 ° C、5% CO2セル文化インキュベーターに媒体を変更する前に皿を戻ります。
注: 再懸濁細胞塊の通過に必要な量は、iPSC クローンに依存します。 - 毎日媒体を変更し、毎週ヒトの Ips を渡します。
3. 網膜オルガノイドの世代
- 植民地が 60-70% の合流点 (図 1 b) に達したら、図 1 aに描き出しましたプロトコルに従う iPSC 分化を開始します。
- 6 cm 皿あたり Bi 媒体の 4 mL を準備します。37 ° c. に Bi 媒体をウォーム アップします。IPSC 媒体を双方向メディアに変更します。0 (D0) の日として、この時間に注意してください。
- D2 で Bi 培地での文化を以前 37 ° C で暖め、BiN2 中に切り替える2-3 日毎に媒体を変更します。
- 図 1に示すように, 神経上皮芽によって創発的自己形成網膜オルガノイドを識別する-1E。
注: 光学カップに、発達段階に対応するこれらの初期網膜 organoids は下流の実験のため手動で分離できます。
4. 網膜オルガノイドの成熟
- D28、準備 ProB27 培最初 FGF2 の 10 ng/ml の 4 mL/井戸を含む 6 ウェル プレート (図 1 a)。
注: は、プレートにメディアを追加する前にすぐに融合 FGF2 を追加します。
注意: FGF2 フィルターを適用しません。 - 6 cm 料理から網膜構造を手動で回復します。図 1Eに示すように針と上皮細胞内芽のまわりを垂直縞を作る構造を分離し、そっと針でそれらをスクラッチして、オルガノイドをデタッチします。
- 1,000 μ L ピペットを使用して 10-15 オルガノイドを吸引し、ProB27 媒体を含んでいる 6 ウェル プレートの単一の井戸のそれらを転送します。
- ProB27 中細胞文化のインキュベーターで浮遊培養条件で 37 ° C、5% CO2で網膜オルガノイドを維持します。培地の半分に 2 〜 3 日ごとを変更します。
注: は、D35 まで FGF2 とオルガノイドを扱います。 - D35 で培地の半分を削除し、FGF2 なし 37 ° C で新鮮な prewarmed ProB27 媒体を追加します。
- 培地の半分に網膜のセルタイプの出現によると必要な網膜細胞の種類を取得する必要が、図 2で示した時間の間に 2 〜 3 日ごとを変更します。
5 世代と増幅人間 iPSC 由来網膜色素上皮 (hiRPE) 細胞
-
人間 hiRPE 細胞の生成
- 植民地が3 a を図の図式プロトコルに従う、60-70% の合流点に達したら、Ips を分化に従事します。
- 双方向メディアの 6 cm 皿あたり 4 mL を準備し、37 ° C で Bi 媒体を温めるIPSC 媒体を双方向メディアに変更します。0 (D0) の日として、この時間に注意してください。
- D2 で Bi 培地での文化を 37 ° C で暖められた以前 BiN2 媒体に切り替える2-3 日毎に媒体を変更します。
- D28 で媒体を図 3 aに示すように以前、37 ° C で暖められた新鮮な ProN2 ミディアムに変更します。
注: この手順は、手順 4 で説明した organoid ピッキング後行うことができます。 - 2-3 日毎に ProN2 媒体を変更します。
- D42 で図 3Bに示すように、色素性パッチの観測による創発的 hiRPE セルを識別します。
注: hiRPE 細胞の色素沈着は、iPSC クローンによって D56 に D35 間表示されます。
-
HiRPE 細胞の増幅
- D42 で以前手順 1.2.2 マトリックスでコーティングし、ウェルあたり ProN2 培地 1 mL を含む 24 ウェル プレートを準備します。使用する前に CO2を 37 ° C、5% でインキュベーターで 15 分のプレートを配置します。
- 6 センチメートルの皿から hiRPE パッチを手動で回復します。パッチを分離、色素上皮を針で垂直紋を行い、慎重に針を掻くことによってシートを切断します。1,000 μ L ピペットを使用して色素の 10 のパッチを吸引し、24 ウェル プレートの単一の井戸のそれらを転送します。
- 媒体を変更する前に 48 h の CO2を 37 ° C、5% で ProN2 中細胞文化のインキュベーターで hiRPE パッチをしてください。0 (hiRPEp0) としてこの hiRPE 細胞の一節に注意してください。ProN2 培地で 2-3 日毎に媒体を変更します。
- HiRPEp0 セルを渡すという、セルが合流。
- 真空吸引システムを使用してメディアを削除し、5 mL のピペットを使用して PBS の 1 mL でも 1 x を洗ってください。
- 真空吸引システムを使用して PBS を破棄、0.25% トリプシンの井戸あたり 200 μ L を追加し、37 ° C でインキュベーターで 15 分以上インキュベートトリプシンを不活化する ProB27 媒体の 800 μ L を追加します。
注: トリプシン処理を停止する ProN2 媒体の使用はお勧めしません。 - それを上下にピペッティングによる hiRPE 細胞のシートを切り離して考えます。15 mL チューブに細胞懸濁液を置き、110 x g で 5 分間遠心します。
注: ProB27 中の過剰を削除する ProN2 メディア追加洗浄を行うことができます。 - 上澄みを除去し、37 ° C に加温 ProN2 培地 2 mL に優しく細胞ペレットを再懸濁します細胞カウンターでセルをカウントします。
- 125 万の細胞を取るし、マトリックス コーティング T-25 cm2フラスコに置いて (手順 2.2.2 参照) ProN2 培地 5 mL を含む 37 ° C に加温1 (hiRPEp1) としてこの hiRPE 細胞の一節に注意してください。
- 媒体を変更する前に 48 h の CO2を 37 ° C、5% で細胞文化のインキュベーターで ProN2 中の hiRPE 細胞を維持します。
- 2-3 日毎にメディアを変更します。HiRPEp1 細胞が合流点に達したら、次の通路または凍結保存を実行します。
6. 網膜 Organoids と hiRPE 細胞の凍結保存
-
網膜全体オルガノイドの
- 5 に 20 網膜 organoids、ピペットを使用してを選択し、極低温バイアル内に配置します。チューブの下部オルガノイドを触れることがなく 1,000 μ L ピペットを持つ任意の余分なメディアを削除し、冷たい凍結保存中の 250 μ L を追加 (材料の表を参照してください)。
- 4 h の転送の最小-80 ° C のイソプロパノール ベースの凍結容器でバイアル-150 ° C のフリーザーや長期保存用液体窒素タンクに凍結バイアルをフリーズします。
-
HiRPE セル
- 通路 1、セルが合流 hiRPE 細胞を分離します。
注: hiRPEp0 細胞の凍結保存はお勧めできません。 - 真空吸引システムを使用して T-25 cm2フラスコから培地を吸引し、それを洗って 3 mL の 5 mL のピペットを使用して PBS で 1 x。
- 真空吸引システムを使用して PBS を削除、0.25% トリプシンの 1 mL を追加し、37 ° C でインキュベーターで 15 分以上インキュベートトリプシン処理を停止する ProB27 培地 5 mL を追加します。
注: トリプシンを不活化する ProN2 媒体の使用はお勧めしません。 - 10 mL のピペットを使用して上下ピペッティングによる hiRPE 細胞のシートを切り離して考えます。細胞カウンターにセルをカウントします。15 mL チューブに細胞懸濁液を置き、110 x g で 5 分間遠心します。
注: ProB27 中の過剰を削除する ProN2 メディア追加洗浄が行えます。 - 真空吸引を使用して上清を吸引し、軽く 200 万細胞凍結保存中の 250 μ L を取得する細胞を再懸濁します。
- 転送極低温バイアルあたり細胞懸濁液を 250 μ l 添加します。4 h の最小-80 ° C のイソプロパノール ベースの凍結容器でバイアルを凍結します。
- -150 ° C のフリーザーや長期保存用液体窒素タンクに凍結バイアルを転送します。
- 通路 1、セルが合流 hiRPE 細胞を分離します。
7. 融解網膜オルガノイドの hiRPE セル
-
網膜全体オルガノイドの融解
- 37 ° C で温かい ProB27 媒体 (2 mL セラム チューブごとに必要となります)。
- -150 ° C のフリーザーまたは液体窒素タンク、極低温バイアル網膜 organoids 37 ° c の水浴中 30 s. 駆除の消毒液スプレーを使用して慎重にセラムを解凍します。
- バイアル、予め温めておいた ProB27 培地 1 mL を追加します。転送ピペットを 1.5 mL チューブに、オルガノイドを転送します。
- チューブの底の網膜の構造に触れることがなくピペッティング媒体をそっと取り外します。予め温めておいた ProB27 媒体のより多くの時間 1 mL 1 オルガノイドを洗います。
- 転送ピペットを使い、オルガノイドを吸引し、ProB27 中で加温し、37 ° C、5% CO2でインキュベーターで平衡を含む 6 ウェル プレートの 1 で配置します。
注: は、6 ウェル プレートのウェルあたり 10-15 網膜オルガノイドを配置します。 - 半分媒体の出現、に従って必要な網膜のセルタイプを取得する必要がある図 2で説明した時間の間に 2 〜 3 日ごとを変更します。
-
HiRPE 細胞の融解
- 37 ° C で温かい ProN2 媒体 (8 mL セラム チューブごとに必要となります)。
- -150 ° C のフリーザーまたは液体窒素タンク、雪解けの hiRPEp1 細胞の低温サンプル 37 ° c の水浴に孵化によって 30 s. 駆除のセラム慎重に消毒液スプレーを使用します。
- チューブを開きと予め温めておいた ProN2 培地 1 mL を追加、予め温めておいた ProN2 培地 2 mL を含む 15 mL チューブに細胞懸濁液を転送します。それを 110 x g で 5 分間遠心します。
- 上澄みを除去し、37 ° C に加温 ProN2 培地 2 mL に優しく細胞ペレットを再懸濁します
- 細胞カウンターでセルをカウントします。
- 125 万の細胞を取るし、マトリックス コーティング T-25 cm2フラスコに置いて (手順 2.2.2 参照) ProN2 培地 5 mL を含む 37 ° C に加温この段階で 2 (hiRPEp2) として、通路に注意してください。
- 媒体を変更する前に 48 h の CO2を 37 ° C、5% で ProN2 中細胞文化のインキュベーターで hiRPEp2 細胞を保ちます。
- 2-3 日毎にメディアを変更します。HiRPE 細胞が合流点に達したら、次の通路または凍結保存を実行します。
注: 培養 2 週間後支柱 800 万 hiRPE 細胞を収集できます。
結果
フィーダー無料条件16で培った人間 iPSC の差別化のための最初のステップです (図 1 a) の分化を促進する双方向の媒体を使用して自己複製機械をシャット ダウンします。双方向メディアを補完する D2 での Ips 細胞神経および網膜の系統へのガイドに N2 サプリメントで。この過程は D28 の周りで上方芽の外観につながります (図 1 - 1E)。自己形成の上方の構造は図 1Eに示すように針を使用して分離することができます、ProB27 媒体 (図 1 f) を使用して浮動小数点の培養条件で網膜オルガノイドの成熟を許可する培養皿に転送。成長と神経網膜の開発を支持するには、FGF2 は 1 週間 (図 1 a)、媒体に追加されます。
D28、新興の網膜構造共同 VSX2、RAX、PAX615として重要な転写因子を表現する網膜前駆細胞主に含まれます。これらの前駆細胞は、網膜の発達を一貫性のある進化上保存された生れ順序で培養条件を浮網膜のセルタイプの 7 つの主要なクラスに上昇を与えます。QRT PCR およびライマンらで前述の免疫組織化学に基づく15図 2の広範なカーブは、初期と後期-生まれ網膜細胞世代体外成熟プロセス中の波を示します。したがって、培養時間は細胞の種類、オルガノイドの存在を定義します。
このセルの着色の可視化を可能にするため、色素沈着が知覚の場合のみ、任意のさらなる拡大のための hiRPE 細胞の分離を実行できます。このように、網膜色素上皮細胞15の色素沈着を支持する ProN2 メディアは D28 から D42 に使用されます。
人間 iPSC クローンによって網膜構造の自己形成の前後に色素のパッチは検出できます。ほとんど 1 または 2 週間 ProN2 培地で D28 の使用後 (図 3 a, B)。通過 0 で孤立から拡大した hiRPE 細胞の代表的な明るいフィールド画像は、図 3と3 Dで表示されます。その後、hiRPE 細胞は経過 4、上皮間葉移行 (EMT) なし、RPE の表現型を保持するまで拡張できます。それにもかかわらず、EMT はセル番号通路17の増加を許しても Y-27632 など ROCK 阻害薬の使用によって防ぐことができます。解凍後 hiRPE 細胞の長期培養は、機能的な成熟した上皮15を取得するここで説明した条件で簡単に実行できます。図 3Eに古典的な立方石畳形態で 52 週で成熟した hiRPEp2 細胞の例を示します。

図 1: 生成・付着性人間 Ips から網膜オルガノイドの成熟します。(A) 分化プロトコル網膜オルガノイドの生成を許可します。(B) D0 の人間の Ips。(C) D15 で上方上皮を新興します。(D) D22 で自己形成神経網膜のような構造。(E) ここで、上方の芽は、針を使用して分離されます。(F) D35 で培養条件を浮網膜オルガノイドの代表的なイメージ。スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。
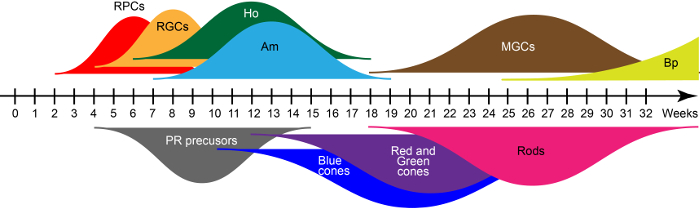
図 2: 波 iPSC 由来網膜の細胞生成します。省略: 網膜前駆細胞 (Rpc)、網膜神経節細胞 (Rgc)、水平細胞 (Ho)、アマクリン細胞 (午前)、ミュラー グリア細胞 (MGCs)、双極細胞 (Bp) および光受容体 (PR)。この図の拡大版を表示するのにはここをクリックしてください。
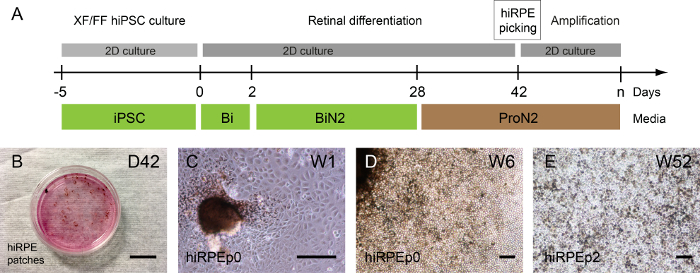
図 3: 世代と人間 iPSC 由来 RPE の増幅します。(A) 人間の hiRPE 細胞の生成を許可する分化プロトコルのイラスト。(B) 位相差画像発色表示パッチ週 6 (W6) 付着性人間 Ips の差別化から新興します。(C) hiRPEp0 細胞は、色素のパッチ選択の後 1 週間 (W1) を栽培しました。(D) hiRPEp0 細胞 6 週時 (W6) 色素性パッチ選択の後。A (E) 解凍後、hiRPEp2 細胞の代表的な画像は、52 週間 (W52) ProN2 培地で栽培。スケール バー = 200 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
このプロトコルでは、網膜色素上皮細胞と網膜 Rgc と xeno、フィーダー フリー条件のひと多能性幹細胞から視細胞を含む網膜のオルガノイドを生成する方法について説明します。ここに示すよい製造業練習 (GMP) プロセス、栽培法との互換性により、RPE 細胞、Rgc、幹細胞ベースの治療法や薬の開発のための視細胞と iPSC 由来の網膜細胞の大規模な生産網膜変性疾患の将来の治療発見アプローチ。網膜全体 organoids または hiRPE 細胞の凍結保存は、中間細胞銀行を確立するの主な利点は、幹細胞ベースの治療で将来使用するための重要なステップを提供します。
分化の特定のステージで特定の網膜細胞型の大型株の生産は、今後臨床的翻訳の必要があります。この点で、CD73 正視細胞前駆体の 3ヶ月で世代が移植-互換性のある細胞人口18, と凍結融解の網膜からこれらの未熟な光受容体を生成する可能性として記述organoids15強化治療目的のためのこれらの細胞を使用するために希望します。網膜の色素上皮に関する hiRPE 細胞の体外増殖能力はそれらを銀行に大細胞生産をことができます。重要なは、解凍の人間 iPSC 由来網膜色素上皮細胞保持 RPE 表現型、関数、したがって、栄養因子分泌や視細胞外側セグメント貪食15、同様の戦略をスクリーニングのための使用の容易さを検証します。今後の治療法。
IPSC 由来網膜 organoids7,8,9,10,11,12,の15の異なる世代のプロトコルのさまざまながあります。効率と堅牢性だけでなく、文化のメソッド (胚様体誘導体のような付着性のセル対を集約)。ここで説明する方法は、付着性人間 Ips から始まり、再現性、適応性、および人間の iPSC 行15の広い範囲への適用性を示しています。血清無料メディアの経年的変化に基づく、このプロセスは、分化をガイドするシステムの本質的な手がかりを利用することで網膜の開発の主な手順を繰り返します。このプロトコルの重要な利点は、胚体形成の有無と将来の GMP に準拠した網膜細胞を細胞療法誘導体を生産するためのプロトコルを製造については、マトリックスの追加です。この方法で網膜における生成と成熟の効率の違いが見つかりませんでした異種との異種文化条件細胞治療システム (CTS) のサプリメントを使用してか、組換えのみ配合の間またはヒトのコンポーネント。
網膜の微分法の成功は、人間の iPSC 文化の質によって大きく異なります。リプログラミング法に、8の網膜細胞人間 Ips の分化効率は影響しませんが、その未分化状態が最適なする必要があります。簡潔に、日常的に培われた人間の Ips では、分化の兆候が表示する必要があります。植民地と重ならないようにし、特徴的な円形の形態を表示する必要があります。網膜の分化の効率はクローンに依存したが、cm2あたり 2 つの網膜の構造の最小選択できる D28 で 6 cm の料理は 1 つ 50 60 上方構造に対応します。浮遊培養条件の網膜における成熟、井戸ごとの構造体の数を制限する構造融合と中の過剰消費を回避できます。これらの培養条件で網膜 organoids できますが maturated 広範な時間に遅れて網膜細胞の種類を取得する必要があります。
生成された網膜オルガノイド培養このメソッドによって楽しみ、モデル網膜疾患の強力なツールを構成します。患者固有の iPSC 由来網膜細胞モデルは、その分子・細胞機構の探査によって複雑なまたは遺伝的疾患を理解する使用されます。これらのモデルは特に高スループット スクリーニング、細胞、遺伝子治療、網膜ジストロフィーの革新的な治療法の開発へのアプローチを編集ゲノム、創に適してになります。
開示事項
サシャ ライヒマン、オリヴィエ ・ Goureau、ホセ ・ アラン ・ サヘルひと多能性幹細胞からの網膜細胞の生成に関連する特許発明に。
謝辞
著者は、彼らの重要な読書のため、ここで説明する方法と G. ガリアルディ M. Garita の設定時に、入力のための Goureau のチームのメンバーに感謝したいと思います。この作品は、ANR からの補助金によって支えられた (GPiPS: ANR-2010-RFCS005;SightREPAIR: ANR-16-CE17-008-02)、網膜フランス協会との技術移転会社船型研究 Lutech。それはまた Investissements d'Avenir プログラム (ANR-11-アイデックス-0004-02) 内で ANR 支え LABEX LIFESENSES (ANR-10-LABX-65) のフレームで行われました。
資料
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
参考文献
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved