Method Article
Alimentador-libre las condiciones de cultivo para la generación de humanos derivados de iPSC de modelos de celulares de retina y definido sin Xeno
* Estos autores han contribuido por igual
En este artículo
Resumen
La producción de células especializadas de la retina de células madre pluripotentes es un punto de inflexión en el desarrollo de la terapia basada en células madre para enfermedades de la retina. El presente trabajo describe un método sencillo para una generación eficiente de organoides de retina y epitelio pigmentado retiniano para investigación básica, traslacional y clínica.
Resumen
La producción de células especializadas de las células de vástago pluripotent proporciona una poderosa herramienta para desarrollar nuevos enfoques para la medicina regenerativa. El uso de las células de vástago pluripotent humanas (iPSCs) es particularmente atractivo para estudios de enfermedades neurodegenerativas, incluyendo distrofias retinianas, donde modelos de células retinianas iPSC marcan un importante paso adelante para entender y combatir la ceguera. En este papel, describimos un protocolo simple y escalable para generar, madurar y criopreservar organitas retiniana. Basado en el cambio de medio, la principal ventaja de este método es evitar múltiples y lentos pasos comúnmente necesitan una diferenciación guiada de iPSCs. Imitando las primeras fases de desarrollo retiniano por sucesivos cambios de medios definidos en iPSC humanas adherente culturas, este protocolo permite la generación simultánea de uno mismo-formar del neuroretinal estructuras y retiniano epitelial (RPE) las células pigmentadas en una manera eficiente y reproducible en 4 semanas. Estas estructuras que contienen células progenitoras de retina (RPC) pueden ser fácilmente aisladas de mayor maduración en una condición de cultura flotante que permite la diferenciación de RPC en los siete tipos de células retinianas presentes en la retina humana adulta. Asimismo, describen métodos rápidos para la criopreservación de los organoides retiniano y las células RPE para almacenamiento a largo plazo. Combinados, los métodos descritos aquí será útiles para producir y Banco humanas derivado de iPSC retinianas células o tejidos para investigación básica y clínica.
Introducción
La retina es una parte integral del sistema nervioso central (SNC) y tiene una capacidad limitada para regenerar espontáneamente después de una lesión traumática o de enfermedades. Por lo tanto, patologías degenerativas que causan pérdida definitiva de la célula retiniana, como degeneración macular senil (DMS), retinitis pigmentosa (RP), glaucoma y retinopatía diabética, suele llevan a la ceguera irreversible. Rescatar la retina degenerada es un gran desafío para que las terapias basadas en células madre con el objetivo de reemplazar las células dañadas o perdidas son uno de los más prometedores enfoques1,2,3. Células pluripotentes como las células células de vástago embrionarias humanas (ESCs) o las células de vástago pluripotent humanas (iPSCs) tienen la capacidad de ampliarse indefinidamente en la cultura, y tienen el potencial para producir cualquier tipo de célula. Avances en nuestra comprensión del desarrollo retiniano y la mejora de in vitro los protocolos de diferenciación de iPSC humanas han dado como resultado la generación de retina organitas7,8,9, 10,11,12. Todas las células retinianas principales, incluyendo las células ganglionares de la retina (RGCs), fotorreceptores y retiniano epitelial (RPE) las células pigmentadas, han diferenciado con éxito humano CES y iPSCs4,5, 6. basado en el método SFEB (cultivo libre de suero de embryoid cuerpo-como los agregados) desarrollado por Eiraku et al. 13, formación autodidacta de organoides retiniana puede obtenerse derivado de ESC o iPSC embryoid cuerpo-como los agregados definidos matriz extracelular componentes7,10,14. Pero estos protocolos son intrincados, requiriendo una gran cantidad de pasos no es siempre compatibles con la gran producción de células para enfoques terapéuticos o detección de drogas. Así, la elección del método para producir células de la retina humanas es fundamental y el método debe ser robusto, escalable y eficiente.
Aquí, en base a nuestra anterior publicación15, describir cada paso para una simple y eficiente generación de células de la retina a través de la formación autodidacta de retina organoide de adherente iPSCs humana cultivada en una condición libre de alimentador y xeno. A partir de rutina culturas de iPSCs humano adherentes, este protocolo requiere solamente un simple medio sucesivo cambiando para permitir la generación de las células RPE (hiRPE) derivadas de iPS y estructuras del neuroretinal en 4 semanas. Después de un aislamiento manual, hiRPE pueden ampliarse y las estructuras retinianas pueden cultivarse como flotando organoides donde las células progenitoras de retina son capaces de diferenciarse en todos los tipos de células retinianas en un orden secuencial y coherente con el ser humano en vivo retinogénesis. Finalmente, para el avance de la investigación o traducción clínica, se describe un método de criopreservación que permite el almacenamiento a largo plazo de toda retina organoides y hiRPE células sin afectar su funcionalidad y características fenotípicas.
Protocolo
El protocolo descrito en este documento sigue las directrices del Comité de ética de investigación del Instituto de la Vision. El Instituto de la visión se ha permitido la manipulación del espécimen humano de acuerdo a la norma francesa. Muestra de manejo sigue protección de datos de los pacientes con arreglo a los principios de Helsinki y las normas nacionales después de la aprobación ética del "Comité de protección des Personnes (CPP) Ile V".
1. preparación de medios de cultivo y platos
-
Medios de cultivo
- Uso medio de iPSC, un medio químicamente definido dedicado a la cultura de células madre pluripotentes en condiciones libres de alimentador de16. Preparar 500 mL de medio según protocolo del fabricante.
- Medio Basal iPSC (Bi) de uso, el iPSC químicamente definido medio sin factor de crecimiento fibroblástico 2 (FGF2) o el factor transformador de crecimiento Beta (TGFß).
- Preparar 500 mL de medio de Bi suplementado con 1% N2 suplemento (BiN2 medio), 10 unidades/mL de penicilina y 10 mg/mL de estreptomicina.
- Preparar 500 mL de proneurales N2 base medio (ProN2) compuesto de DMEM:Nutrient mezcla F-12 (DMEM/F12, 1:1, L-glutamina), 1% MEM aminoácidos no esenciales, suplemento de 1% N2, 10 unidades/mL de penicilina y 10 mg/mL de estreptomicina.
- Preparar proneurales B27-base medio (ProB27) compuesto por mezcla de DMEM:Nutrient F-12 (DMEM/F12, 1:1, L-glutamina), aminoácidos no esenciales de la MEM de 1%, 2% B27 suplemento, 10 unidades/mL de penicilina y 10 mg/mL de estreptomicina.
-
Preparación del vaso de la cultura
-
Para la cultura humana iPSC
- Preparar 10 mL de una solución de vitronectina que contiene 5 μg/mL de vitronectina en 1 x PBS. En 10 mL de PBS 1 x, agregue 100 μl de la solución madre de vitronectina descongelado (100 x).
- Distribuir 2 mL de la solución de vitronectina por placa de cultivo de 6 cm, correspondiente a 0,5 μg/cm2. Incubar durante 1 h a temperatura ambiente (RT). Retirar la solución de vitronectina por aspiración mediante un sistema de aspiración del vacío o una pipeta de 5 mL.
- Añadir 4 mL de medio de iPSC por caja de 6 cm.
- Incubar los platos en una incubadora de cultura de célula a 37 ° C y 5% CO2 para un mínimo de 30 minutos antes de su uso.
- Para el cultivo de células RPE (hiRPE) derivados de iPSC humana
- Use una matriz calificada de células madre pluripotentes o sustrato para cubrir pozos según protocolo del fabricante. Agregar suficiente matriz o sustrato para cubrir la superficie entera del crecimiento. Por ejemplo, poner 300 μL de matriz por pozo de placa de 24 pozos y 3 mL de matriz en un matraz de2 cm de T-25.
- Incubar los recipientes de cultivo cubierto por un mínimo de 1 h a 37 ° C. Quitar la matriz, utilizando sistemas de la vacío-aspiración o una pipeta de 5 mL.
- Añadir 1 mL de medio de ProN2 por pozo en placas de 24 pocillos y vuelva la vasija de la cultura a la incubadora por un mínimo de 30 minutos para calentar y equilibrar el medio. Para frascos de2 cm T-25, consulte el paso 5.2.
-
Para la cultura humana iPSC
2. mantenimiento y expansión de humanos iPSCs
-
Mantenimiento de iPSCs humana
- Preparar 3 mL de medio de iPSC en un tubo de 15 mL y guardar a temperatura ambiente durante un mínimo de 15 minutos antes de usar. Preparar un plato recubierto de 6 cm como se ha descrito en 1.2.1.
- Descongelar una muestra criogénica de iPSCs humana de un tanque de nitrógeno líquido o de un congelador de-150 ° C por la incubación en baño de agua a 37 ° C por 30 s.
- Desinfectar cuidadosamente el frasco criogénico usando un aerosol de solución desinfectante. Transferir la descongelado iPSCs humana desde el criotubo en el tubo de 15 mL que contiene 3 mL de medio de iPSC, previamente calentado a TA.
- Centrifugar el tubo 110 x g durante 3 minutos Retire el sobrenadante por aspiración mediante un sistema de aspiración del vacío o una pipeta de 5 mL.
- Resuspender el precipitado de células con 1 mL de medio de iPSC de una placa de cultivo de 6 cm recubierto de vitronectina usando una pipeta de 2 mL y transferir a las células hacia el plato. Regresar el plato a la incubadora a 37 ° C y 5% CO2 para un mínimo de 24 h antes de cambiar el medio.
Nota: Un inhibidor de la roca, como Y-27632 en 10 μm, se puede añadir al medio de iPSC en los platos de la cultura de 6 cm para reducir la apoptosis. - Cambiar diariamente el medio y pasar la iPSCs humano cada semana.
-
Pases de iPSCs humana
- Pasar el iPSC humano en una confluencia de 70-80%, clásico después de 7 días en cultivo.
- Preparar platos de 6 cm para los pases como se describe en el paso 1.2.1. Retire el medio de iPSC de los platos con iPSCs confluente y añadir 2 mL de una solución de disociación durante 6 min a TA.
Nota: El tiempo de incubación depende de los clones de iPSC. Trate de una incubación de 6 min como un comienzo. - Retirar la solución de disociación mediante sistemas de aspiración de vacío o una pipeta de 5 mL y añadir 2 mL de medio de iPSC previamente calentado en RT. resuspender las colonias de iPSC por les y bajar 5-10 x el pipeteo con una pipeta de 1000 μl.
PRECAUCIÓN: Evitar la disociación unicelular de pipeteo excesiva. - Transferencia 30 a 200 μL de nidos de células resuspendidos en una nueva placa de cultivo de 6 cm. Vuelva los platos a la célula cultura incubadora a 37 ° C y 5% CO2 para un mínimo de 24 h antes de cambiar el medio.
Nota: El volumen de celular resuspendidos macizos para los pases depende de los clones de iPSC. - Cambiar diariamente el medio y pasar la iPSCs humano cada semana.
3. generación de retina organitas
- Iniciar la diferenciación de iPSC siguiendo el protocolo esquematizado en la figura 1A , cuando las colonias a una confluencia de 60-70% (figura 1B).
- Preparar 4 mL de medio de Bi por caja de 6 cm. Caliente el medio Bi a 37 ° C. Cambiar el medio de iPSC a medio Bi. Tenga en cuenta este tiempo como día 0 (D0).
- En la D2, cambiar las culturas en el medio de Bi a BiN2 medio, previamente calentado a 37 ° C. Cambiar el medio cada 2-3 días.
- Identificar emergentes auto formando organoides retiniana por brotes del neuroepitelio, como se muestra en la figura 1 -1E.
Nota: Estos organoides retinianas tempranas, correspondiente en su etapa de desarrollo de la Copa óptica, pueden ser manualmente aisladas para la posterior experimentación.
4. maduración de la retina organitas
- En el D28, preparar placas de 6 pocillos conteniendo 4 mL/pozo ProB27 suplementado inicialmente con 10 ng/mL de FGF2 (figura 1A).
Nota: Agregar FGF2 inmediatamente antes de que los medios de comunicación se añade a las placas.
PRECAUCIÓN: No filtrar FGF2. - Recuperar las estructuras retinianas de los cm 6 platos manualmente. Para ello, aislar las estructuras haciendo estrías perpendiculares con la aguja alrededor de la yema neuroepiteliales, como se muestra en la Figura 1Ey separe las organitas suavemente los arañazos con la aguja.
- Aspire organoides de 10-15 con una pipeta μL 1.000 y transferir en un solo pocillo de la placa de 6 pozos que contiene medio de ProB27.
- Mantenga la retina organitas en condiciones de cultivo flotantes en medio de la ProB27 en una incubadora de cultivo de células a 37 ° C y 5% CO2. Cambiar la mitad del medio cada 2-3 días.
Nota: Tratar los organoides con FGF2 hasta D35. - D35, quitar la mitad del medio y añadir medio fresco de ProB27 precalentado a 37 ° C sin FGF2.
- Cambiar la mitad del medio cada 2-3 días durante el tiempo necesario para obtener los tipos de células retinianas deseado según la aparición de tipos de células retinianas, como se muestra en la figura 2.
5. generación y amplificación de humano iPSC RPE (hiRPE) las células derivadas de
-
Generación de células de humano hiRPE
- Realizar las iPSCs diferenciación cuando las colonias a una confluencia de 60-70%, siguiendo el protocolo esquematizado en la Figura 3A.
- Preparar 4 mL por caja de 6 cm de medio Bi y calentar el medio Bi a 37 ° C. Cambiar el medio de iPSC a medio Bi. Tenga en cuenta este tiempo como día 0 (D0).
- En D2, cambiar las culturas en el medio de Bi a un medio de BiN2 calentado previamente a 37 ° C. Cambiar el medio cada 2-3 días.
- En el D28, cambiar el medio a un medio fresco de ProN2 previamente calentado a 37 ° C como se muestra en la Figura 3A.
Nota: Este paso puede realizarse después de la cosecha de organoide que se describe en el paso 4. - Cambiar el medio ProN2 cada 2-3 días.
- En D42, identificar células de hiRPE emergente por la observación de manchas pigmentadas, como se muestra en la figura 3B.
Nota: La pigmentación de las células de hiRPE aparece entre D35 a D56 dependiendo de los clones de iPSC.
-
Amplificación de las células de hiRPE
- En D42, prepare una placa de 24 pocillos previamente cubierto con la matriz como se describe en el paso 1.2.2 y que contiene 1 mL de medio de ProN2 por pozo. Coloque la placa durante 15 min en la incubadora a 37 ° C y 5% de CO2 antes de usar.
- Recuperar manualmente los parches hiRPE desde el plato de 6 cm. Aislar parches, hacer una estría perpendicularmente con la aguja en el epitelio pigmentado y separar la hoja rasguñando suavemente con la aguja. Aspire 10 Parches pigmentados con una pipeta μL 1.000 y transferir en un solo pocillo de la placa de 24 pocillos.
- Mantenga los parches de hiRPE en medio ProN2 en una incubadora de cultivo de células a 37 ° C y 5% de CO2 durante 48 h antes de cambiar el medio. Tenga en cuenta este pasaje de la célula de hiRPE como 0 (hiRPEp0). Cambiar el medio cada 2-3 días con medio ProN2.
- Pasar las células de hiRPEp0 cuando las células son confluentes.
- Retire el medio utilizando sistemas de la vacío-aspiración y lavar cada pozo 1 x con 1 mL de PBS con una pipeta de 5 mL.
- Descartar el PBS utilizando sistemas de la vacío-aspiración, añada 200 μL por pocillo de la tripsina 0,25% e incube durante un mínimo de 15 minutos en una incubadora a 37 ° C. Añadir 800 μl de medio de ProB27 para hacer inactivo de la tripsina.
Nota: No se recomienda el uso de ProN2 medio para detener la actividad de la tripsina. - Disociar la hoja de hiRPE células mediante pipeteo arriba y abajo. Poner la suspensión de células en un tubo de 15 mL y centrifugar durante 5 min a 110 g de x.
Nota: Puede hacerse un lavado adicional con ProN2 medio para retirar el exceso de ProB27 medio. - Quite el sobrenadante y resuspender suavemente el precipitado de células en 2 mL de medio de ProN2 calentado previamente a 37 ° C. Contar las células con un contador de células.
- Tomar 1,25 millones de células y colocarlos en un matraz de2 de cm T-25 recubiertos por la matriz (ver paso 2.2.2) que contiene 5 mL de medio de ProN2 calentado previamente a 37 ° C. Tenga en cuenta este pasaje de la célula de hiRPE 1 (hiRPEp1).
- Mantener las células de hiRPE en el medio de ProN2 en una incubadora de cultivo de células a 37 ° C y 5% de CO2 durante 48 h antes de cambiar el medio.
- Cambiar el medio cada 2-3 días. Cuando las células de hiRPEp1 llegar a confluencia, realice el siguiente paso o criopreservación.
6. criopreservación de organoides de la retina y las células hiRPE
-
Para toda retina organitas
- Seleccionar 5 a 20 organitas retinianas utilizando una pipeta de transferencia y colocarlos en un frasco de criogénico. Retire cualquier medio exceso con una pipeta de 1000 μl sin tocar el organitas en la parte inferior del tubo y añadir 250 μl de medio de congelación frío (véase Tabla de materiales).
- Congelar los frascos en un recipiente de congelación basado en isopropanol a-80 ° C durante un mínimo de 4 h. transferencia los viales congelados a un congelador de-150 ° C o tanque de nitrógeno líquido para el almacenamiento a largo plazo.
-
Para las células hiRPE
- En el paso 1, disociar las células hiRPE cuando las células son confluentes.
Nota: No se recomienda la criopreservación de las células hiRPEp0. - Aspire el medio del frasco de2 cm T-25 utilizando sistemas de la vacío-aspiración y lavar 1 x con 3 mL de PBS con una pipeta de 5 mL.
- Retirar el PBS utilizando sistemas de aspiración del vacío, añada 1 mL de tripsina 0.25% e incube durante un mínimo de 15 minutos en una incubadora a 37 ° C. Añadir 5 mL de medio de ProB27 para detener la actividad de la tripsina.
Nota: No se recomienda el uso de medio de ProN2 inactivación de la tripsina. - Disociar la hoja de hiRPE células mediante pipeteo arriba y abajo con una pipeta de 10 mL. Contar las células con el contador de células. Poner la suspensión de células en un tubo de 15 mL y centrifugar durante 5 min a 110 g de x.
Nota: Puede realizarse un lavado adicional con ProN2 medio para retirar el exceso de ProB27 medio. - Aspirar el sobrenadante mediante aspiración del vacío y resuspender suavemente las células para obtener 2 millones de células en 250 μl de medio de congelación.
- Transferir 250 μl de suspensión celular por vial criogénico. Congelar los frascos en un recipiente de congelación basado en isopropanol a-80 ° C durante un mínimo de 4 h.
- Transferir los viales congelados a un congelador de-150 ° C o en un tanque de nitrógeno líquido para el almacenamiento a largo plazo.
- En el paso 1, disociar las células hiRPE cuando las células son confluentes.
7. descongelación de organoides de la retina y células hiRPE
-
Descongelación de organoides toda retina
- Medio de ProB27 caliente a 37 ° C (2 mL se requiere para cada frasco criogénico).
- Desde el tanque de nitrógeno líquido o -150 ° C congelador, descongelar un vial criogénico que contiene organitas retiniana en un baño de agua a 37 ° C para 30 s. desinfectar el frasco criogénico cuidadosamente con un solución desinfectante aerosol.
- Abra el frasco y añadir 1 mL de medio ProB27 precalentado. A un tubo de 1,5 mL con una pipeta de transferencia transferencia de los organoides.
- Saque el medio suavemente mediante pipeteo sin tocar las estructuras retinianas en el fondo del tubo. Lave las organitas 1 más tiempo con 1 mL del medio ProB27 precalentado.
- Aspire los organoides con una pipeta de transferencia y colocarlos en 1 pozo de una placa de 6 pozos con ProB27 medio previamente calentado y equilibrados en una incubadora a 37 ° C y 5% CO2.
Nota: Coloque organitas retinianas 10-15 por pozo de una placa de 6 pozos. - Cambiar la mitad del medio cada 2-3 días durante el tiempo necesario para obtener los tipos de células retinianas deseado según su aparición, como se describe en la figura 2.
-
Descongelación de células hiRPE
- Medio de ProN2 caliente a 37 ° C (8 mL se requiere para cada frasco criogénico).
- Desde el tanque de nitrógeno líquido o congelador de-150 ° C, descongelar una muestra criogénica de células hiRPEp1 por una incubación en baño de agua a 37 ° C para 30 s. desinfectar el vial criogénico cuidadosamente usando un atomizador de solución desinfectante.
- Abra el tubo y agregue 1 mL de medio de ProN2 precalentado y transferir la suspensión de células a un tubo de 15 mL que contiene 2 mL de medio de ProN2 precalentado. Centrifugar 5 min a 110 g de x.
- Quite el sobrenadante y resuspender suavemente el precipitado de células en 2 mL de medio de ProN2 calentado previamente a 37 ° C.
- Contar las células con un contador de células.
- Tomar 1,25 millones de células y colocarlos en el frasco de2 de cm T-25 recubiertos por la matriz (ver paso 2.2.2) que contiene 5 mL de medio de ProN2 calentado previamente a 37 ° C. En esta fase, tenga en cuenta el paso 2 (hiRPEp2).
- Mantener las células de hiRPEp2 en ProN2 medio en la incubadora de cultivo celular en 37 ° C y 5% de CO2 durante 48 h antes de cambiar el medio.
- Cambiar el medio cada 2-3 días. Cuando las células de hiRPE llegar a confluencia, realice el siguiente paso o criopreservación.
Nota: Después de 2 semanas en la cultura, se pueden recoger células hiRPE 8 millones para más experimentos.
Resultados
El primer paso para la diferenciación de iPSC humanas cultivada en condiciones libres de alimentador de16 es cerrar maquinaria de auto renovación mediante medio Bi a una diferenciación espontánea (figura 1A). Luego, en la D2, el medio Bi se complementa con un suplemento de N2 para diferenciar células iPSCs hacia los linajes neuronales y retinianas. Este proceso conduce a la aparición de brotes del neuroretinal en torno a D28 (figura 1 - 1E). La formación de las estructuras del neuroretinal se puede aisladas utilizando una aguja como se muestra en la Figura 1E y transfirieron a placas para permitir la maduración de la retina organitas en condiciones de cultivo flotantes por medio de ProB27 (Figura 1F). Para favorecer el crecimiento y el desarrollo de la retina neural, FGF2 se agrega al medio para 1 semana (figura 1A).
En el D28, las emergentes estructuras retinianas contienen principalmente células progenitoras de retina que conjuntamente expresan el factor de transcripción clave PAX6, RAX y VSX215. Estos progenitores dan lugar a las siete clases principales de tipos de células retinianas en flotación de las condiciones de cultivo en el orden de nacimiento evolutivamente conservado consistente el desarrollo retiniano humano. Basado en qRT-PCR e inmunohistoquímica descrito previamente en Reichman et al. 15, las amplias curvas en la figura 2 muestran ondas de generaciones de células retinianas temprano y último nació durante un proceso de maduración en vitro . Así, el tiempo de la cultura define los tipos de células presentes en el organitas.
El aislamiento de células hiRPE para más amplificación puede realizarse sólo cuando la pigmentación es perceptible porque esta coloración celular permite su visualización. De esta manera, el medio ProN2 permite de D28 D42 para favorecer la pigmentación de las células RPE15.
Según el clon humano iPSC, los parches pigmentados pueden ser detectados antes o después de la uno mismo-formación de las estructuras retinianas; pero sobre todo 1 o 2 semanas después del uso de medio de ProN2 a D28 (Figura 3A, B). Una imagen de campo claro representante de hiRPE células ampliado de los parches aislados en el paso 0 se muestra en la figura 3 y 3D. Luego, las células de hiRPE pueden ampliarse hasta el paso 4, conserva su fenotipo RPE sin una transición epitelial-mesenquimal (EMT). Sin embargo, la EMT puede prevenirse por el uso de inhibidores de la roca como Y-27632, que permite también un aumento de la célula número pasajes17. Cultivos a largo plazo de hiRPE células después de la descongelación pueden realizarse fácilmente en las condiciones descritas aquí para obtener un epitelio maduro y funcional15. Un ejemplo de células hiRPEp2 maduro en la semana 52 con una morfología clásica guijarro cuboidal se ilustra en la figura 3E.

Figura 1: generación y maduración de la retina organoides de adherente iPSCs humano. (A) protocolo de diferenciación que permite la generación de retina organitas. (B) iPSCs humano en D0. (C) emergentes del neuroretinal epitelio en D15. (D) la formación retina-como las estructuras neurales en la D22. (E) aquí, el brote del neuroretinal es aislado mediante una aguja. (F) imágenes representativas de retina organitas en flotación de estado de cultura en D35. Barras de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
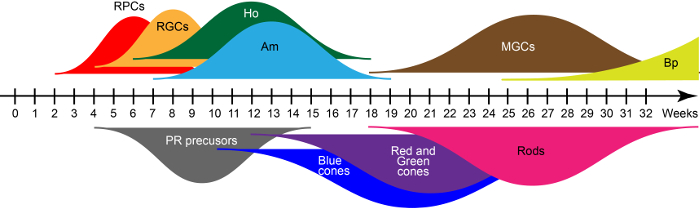
Figura 2: ondas de retina humana deriva de iPSC celular generación. Abreviaturas: Células progenitoras de retina (RPC), las células retinianas del ganglio (RGCs), las células horizontales (Ho), células amacrinas (Am), las células gliales de Müller (MGCs), células bipolares (Bp) y fotorreceptores (PR). Haga clic aquí para ver una versión más grande de esta figura.
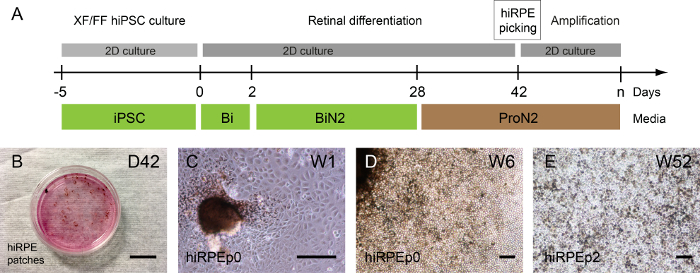
Figura 3: generación y amplificación de RPE derivadas de iPSC humana. (A) una ilustración del Protocolo de diferenciación que permite la generación de células humanas hiRPE. (B) fase-ponga en contraste imágenes mostrando pigmentado parches de diferenciar adherente iPSCs humano en semana 6 (W6). (C) hiRPEp0 las células cultivan (W1) de una semana después de la cosecha de remiendo pigmentado. (D) hiRPEp0 las células en la semana 6 (W6) después de la cosecha de remiendo pigmentado. (E) A imagen representativa de las células de hiRPEp2 después de descongelar, cultivada para 52 semanas (W52) en medio ProN2. Barras de escala = 200 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe cómo producir células RPE y organitas retiniana, que contiene RGCs retinales y los fotorreceptores, de células de vástago pluripotent humanas en condiciones libre de xeno y alimentador. Compatible con el proceso de buenas prácticas de manufactura (GMP), el método cultivado presentada aquí permite una gran producción de células de la retina derivadas de iPSC como células RPE, RGCs y fotorreceptores para el desarrollo de terapias basadas en células madre y de la droga descubrimiento de métodos para el tratamiento futuro de enfermedades degenerativas de la retina. La criopreservación de organoides toda retina o de células de hiRPE también proporciona una ventaja importante en el establecimiento de los bancos de células intermedio, un paso importante para su futuro uso en terapias basadas en células madre.
La producción de grandes cantidades de tipos de células retinianas específicas en una etapa específica de la diferenciación será necesaria para la futura traducción clínica. En este sentido, la generación de tres meses de precursores de fotorreceptor CD73 positivo descrito como un celular compatible con trasplante de población18y la posibilidad de generar estos fotorreceptores inmaduros de congelar-descongelar retiniana organoides15 refuerzan la esperanza de utilizar estas células con fines terapéuticos. En cuanto a epitelio pigmentado retiniano, la capacidad de hiRPE células para proliferar en vitro permite producciones grandes de la célula al les Banco. Lo importante, descongelado humano iPSC RPE las células derivadas de conservan su RPE fenotipo y función, por lo tanto, como factor trófico secreción o fotorreceptores segmento externo fagocitosis15, validando su facilidad de uso para la detección de estrategias, así como para enfoques terapéuticos futuros.
Hay una variedad de protocolos para la generación de organoides retiniano derivado de iPSC7,8,9,10,11,12,15 que varían en métodos (embryoid cuerpo como agregados vs células adherentes) de la cultura así como eficiencia y robustez. El método descrito aquí comienza con adherente iPSCs humana y muestra una eficacia reproducible, adaptabilidad y aplicabilidad a una amplia gama de líneas de iPSC humana15. Este proceso, basado en el cambio sucesivo de medios libres de suero, recapitula las etapas principales del desarrollo retiniano explotando las señales intrínsecas del sistema para guiar la diferenciación. Una ventaja importante de este protocolo es la ausencia de formación del cuerpo embrionario y la adición de la matriz de fabricación protocolos para producir derivados de la terapia de la célula de células retinianas compatibles con GMP futuro. De esta manera, ninguna diferencia en la eficiencia de la generación de organoide retiniana y la maduración se encontraron entre las condiciones de cultivo xenogeneicos y no xenogeneicos con sistema de terapia celular (TC) suplementos o no, formulado exclusivamente con recombinante o componentes humanizados.
El éxito del método diferenciación retiniana depende en gran medida la calidad de las culturas humanas iPSC. El método de reprogramación no influye en la eficiencia de la diferenciación de iPSCs humana a células de la retina8, pero su estado de troncalidad deba ser óptimo. Brevemente, iPSCs humano habitualmente cultivadas no deben presentar señales de diferenciación. Las colonias no deben solaparse y deben mostrar su característica morfología circular. Aunque la eficacia de la diferenciación de la retina depende del clon, un mínimo de dos estructuras retinianas por cm2 se puede seleccionar en el D28, corresponden a 50-60 del neuroretinal estructuras para un plato de 6 cm. Para la maduración retiniana organoide en condiciones de cultivo flotantes, limitar el número de estructuras por pozo evita la fusión de estructura y medio consumo excesivo. En estas condiciones de cultivo, organitas retiniana pueden ser madurado durante un tiempo extenso, necesaria para obtener los tipos de célula retiniana tardía.
Mirando adelante, organitas retiniana generada en vitro por este método constituyen herramientas potentes para enfermedades de la retina modelo. Modelos de células retinianas específicas de paciente iPSC se utilizará para entender enfermedades complejas o genéticas por la exploración de sus mecanismos moleculares y celulares. Estos modelos estarán particularmente convenientes para el descubrimiento de fármacos a través de proyección de alto rendimiento, las terapias celular y génica o genoma edición de enfoques, para desarrollar tratamientos innovadores para distrofias retinianas.
Divulgaciones
José-Alain Sahel, Sacha Reichman y Olivier Goureau son inventores en espera de patentes relacionadas con la generación de células de la retina de células madre pluripotentes humanas.
Agradecimientos
Los autores desean agradecer a los miembros del equipo de Goureau su entrada durante la instalación de los métodos descritos aquí y G. Gagliardi y M. Garita por su lectura crítica. Este trabajo fue apoyado por subvenciones de la ANR (GPiPS: ANR-2010-RFCS005; SightREPAIR: ANR-16-CE17-008-02), la Asociación de Francia de la Retina y la transferencia de tecnología empresa SATT Lutech. También se realizó en el marco de la LIFESENSES LABEX (ANR-10-LABX-65) apoyado por la ANR en el programa de Avenir Investissements (ANR-11-IDEX-0004-02).
Materiales
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
Referencias
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados