Method Article
קסנו נטולת מוגדר ותנאים מזין ללא תרבות לדגמי הדור של האדם נגזר iPSC רשתית תא
In This Article
Summary
הייצור של תאים ברשתית מתמחה מתאי גזע pluripotent היא נקודת מפנה בהתפתחות מבוססי תאי גזע טיפול למחלות רשתית. המאמר הנוכחי מתאר שיטה פשוטה לדור יעיל של organoids ברשתית, אפיתל פיגמנט הרשתית למחקר בסיסי translational, קליניים.
Abstract
הייצור של תאים מיוחדים מתאי גזע pluripotent מספק כלי רב עוצמה כדי לפתח גישות חדשות עבור רפואה רגנרטיבית. השימוש בתאי גזע pluripotent הנוצרות על-ידי האדם (iPSCs) הוא אטרקטיבי במיוחד ללימודים מחלות ניווניות, כולל dystrophies ברשתית, נגזר iPSC התא רשתית מודלים כדי לסמן היכן צעד חשוב להבין ולהילחם עיוורון. בנייר זה, אנו מתארים פרוטוקול פשוט ומדרגי צור, בוגר של cryopreserve organoids ברשתית. מבוסס על שינוי בינוני, היתרון העיקרי של שיטה זו הוא להימנע מרובים ודרשה זמן רב שלבים בדרך כלל בהבחנה מודרכים של iPSCs. מחקה את השלבים הראשונים של התפתחות הרשתית על ידי שינויים רצופים של מדיה מוגדרים על תרבויות iPSC האדם חסיד, פרוטוקול זה מאפשר הדור בו זמנית של עצמי ויוצרים מבנים neuroretinal, פיגמנט אפיתל (RPE) תאים ברשתית ב באופן יעיל הדירים ב- 4 שבועות. מבנים אלה המכילים ובתאים ברשתית (Rpc) ניתן לבודד בקלות על התבגרות נוספת במצב תרבות צף המאפשר את הבידול של Rpc לתוך סוגי תאים ברשתית שבע נוכח הרשתית האנושית למבוגרים. בנוסף, אנו מתארים שיטות מהירה הקפאה קריוגנית של הרשתית organoids ואת תאי RPE לאחסון לטווח ארוך. יחד בשיטות המתוארות כאן יהיה שימושי כדי לייצר, בנק תאים ברשתית, נגזר iPSC אדם או רקמות לצורך מחקר בסיסי וקליני.
Introduction
הרשתית היא חלק אינטגרלי של מערכת העצבים המרכזית (CNS) לבין בעל קיבולת מוגבלת להתחדש באופן ספונטני לאחר פציעה טראומטית או מחלות. לכן, פתולוגיות ניוונית גרימת איבוד תאים ברשתית סופית, כגון הקשורות לגיל ניוון מקולרי (AMD), רטיניטיס פיגמנטוזה (RP), גלאוקומה, רטינופתיה סוכרתית, בדרך כלל להוביל לעיוורון בלתי הפיך. הצלת הרשתית מנוונת היא אתגר גדול עבורה טיפולים מבוססי תאי גזע במטרה להחליף את התאים ניזוק או אבד הם אחד של המבטיחים ביותר גישות1,2,3. גזע pluripotent כתאי תאי גזע עובריים (ESCs) או בתאי גזע pluripotent הנוצרות על-ידי האדם (iPSCs) יש את היכולת להיות מורחב ללא הגבלת זמן, תרבות, ויש להם את היכולת לייצר כל סוגי תאים. ההתקדמות ההבנה שלנו של התפתחות הרשתית ושיפור במבחנה פרוטוקולים עבור בידול iPSC אנושי גרמו הדור של הרשתית organoids7,8,9, 10,11,12. כל התאים ברשתית העיקריים, כולל תאי גנגליון (RGCs), photoreceptors של פיגמנט אפיתל (RPE) תאים ברשתית, יש כבר בהצלחה תריז האנושי ESCs ו- iPSCs4,5, 6. מבוסס על שיטת SFEB (ללא סרום תרבות של אגרגטים גוף דמוי embryoid) שפותחה על ידי. של איראקא et al. 13, היווצרות עצמית של הרשתית organoids ניתן להשיג ESC או iPSC-נגזר אגרגטים גוף דמוי embryoid מטריצה חוץ-תאית מוגדר רכיבים7,10,14. אבל פרוטוקולים אלה מורכבות, הדורשות מספר רב של צעדים אינו תמיד תואם עם ייצור גדול של תאים עבור גישות טיפוליות או והתרופות הקרנה. לכן, הבחירה של השיטה כדי לייצר תאים ברשתית האנושי הוא קריטי, השיטה צריכה להיות חזקה, מדרגי ויעיל.
כאן, בהתבסס על הפרסום הקודם שלנו15, נתאר כל שלב לדור פשוטה ויעילה של תאים ברשתית דרך תא צורב ברשתית היווצרות עצמית של חסיד iPSCs האנושי מעובדות במצב מזין ו קסנו-חופשית. החל מתרבויות שגרתית של חסיד iPSCs האנושי, פרוטוקול זה דורש רק מדיום רצופים פשוט שינוי כדי לאפשר את הדור של תאי RPE (hiRPE) שב ס-derived ומבני neuroretinal ב 4 שבועות. לאחר בידוד ידני, hiRPE ניתן להרחיב ותרבותית המבנים ברשתית יכולה להיות צפים organoids איפה הרשתית ובתאים הם מסוגלים להבדיל לתוך כל סוגי תאים ברשתית סדר רציפים בקנה אחד עם האדם אין ויוו retinogenesis. לבסוף, לקידום המחקר או תרגום קליני, נתאר שיטת הקפאה קריוגנית המאפשר אחסון לטווח ארוך של organoids כל רשתית ותאים hiRPE מבלי להשפיע על מאפייני פנוטיפי והפונקציונליות שלהם.
Protocol
הפרוטוקול המתואר במאמר זה עוקב אחר הקווים המנחים של ועדת האתיקה של החזון de la אינסטיטוט מחקר. החזון de la אינסטיטוט אפשרה המניפולציה של הדגימה האנושי על פי התקנון צרפתי הנוכחי. הדגימה טיפול עוקב אחר הגנה על נתונים החולה לפי העיקרים של הלסינקי, ולתקנות הלאומית לאחר אישור מוסרי ה Comité דה הגנה des Personnes (CPP) ile-de-וי.
1. הכנת מנות ומדיה תרבות
-
תרבות המדיה
- השתמש iPSC בינוני, בינוני מוגדרים כימי מוקדש לתרבות תאי גזע pluripotent מזין ללא תנאים16. הכנת 500 מ"ל של מדיום על פי הפרוטוקול של היצרן.
- שימוש באמצעי iPSC הבזליים (Bi), iPSC מוגדרים כימי בינוני ללא פיברובלסט גורם גידול 2 (FGF2) או הפיכת גורם הגדילה בטא (TGFß).
- הכנת 500 מ"ל של מדיום Bi עם תוספת של 1% N2 (BiN2 בינוני), 10 יחידות מ"ל של פניצילין, ו- 10 מ"ג/מ"ל של סטרפטומיצין.
- הכנת 500 מ"ל proneural מבוסס-N2 בינוני (ProN2 בינוני) המורכב F-12 DMEM:Nutrient תערובת (DMEM/F12, 1:1, -גלוטמין), חומצות אמינו שאינן חיוניות MEM 1%, תוספת של 1% N2, 10 יחידות/mL פנצילין ולאחר 10 מ"ג/מ"ל של סטרפטומיצין.
- הכנת proneural מבוססי B27 בינוני (ProB27 בינוני) המורכב DMEM:Nutrient תערובת F-12 (DMEM/F12, 1:1,-גלוטמין), חומצות אמינו שאינן חיוניות MEM 1%, 2% B27 תוספת, 10 יחידות/mL של פניצילין ו- 10 מ"ג/מ"ל של סטרפטומיצין.
-
תרבות כלי הכנה
-
לתרבות האנושית iPSC
- הכינו 10 מ"ל של פתרון vitronectin המכיל 5 μg/mL של vitronectin ב- 1 x PBS. ב- 10 מ"ל של PBS 1 x, להוסיף 100 µL של הפתרון מניות vitronectin המופשרים (100 x).
- להפיץ 2 מ"ל של הפתרון vitronectin לכל מאכל תרבות 6 ס מ המתאים µg/ס מ 0.52. תקופת דגירה זה של h 1 בטמפרטורת החדר (RT). הסר את הפתרון vitronectin על ידי השאיפה באמצעות מערכת בשאיבה או פיפטה 5 מ.
- להוסיף 4 מיליליטר iPSC בינוני לכל מנה 6 ס מ.
- דגירה את הכלים חממה התרבות התא-CO של 37 ° C ו- 5%-2 למשך תקופה מינימלית של 30 דקות לפני השימוש.
- לתרבות האנושית נגזר iPSC RPE (hiRPE) תא
- השתמש מטריקס מוסמך בתאי גזע pluripotent או המצע כדי המעיל בארות על פי הפרוטוקול של היצרן. הוסף מספקת מטריקס או מצע כדי לכסות את פני השטח כולו צמיחה. לדוגמה, לשים 300 µL של מטריקס לכל טוב בצלחת. ובכן 24 ו- 3 מ"ל של מטריקס בבקבוקון2 ס מ T-25.
- דגירה כלי מצופה תרבות למשך תקופה מינימלית של 1 h ב- 37 מעלות צלזיוס. הסר את המטריצה באמצעות מערכות בשאיבה או על פיפטה 5 מ.
- להוסיף 1 מ"ל ProN2 בינוני לכל טוב על. ובכן 24 צלחות וחוזרים הספינה תרבות החממה במשך לפחות 30 דקות כדי לחמם, equilibrate של המדיום. עבור T-25 ס מ2 מבחנות, ראה שלב 5.2.
-
לתרבות האנושית iPSC
2. תחזוקה, הרחבה של זכויות iPSCs
-
תחזוקה של האדם iPSCs
- להכין 3 מ"ל של מדיום iPSC בשפופרת 15 מ"ל ולשמור אותו ב RT לפחות 15 דקות לפני השימוש. להכין תבשיל 6 ס מ מצופה כפי שמתואר 1.2.1.
- הפשרת מדגם קריוגני של האדם iPSCs מיכל חנקן נוזלי או מקפיא-150 מעלות צלזיוס על ידי דגירה באמבט מים בטמפרטורה 37 ° C ל 30 s.
- בזהירות לחטא את המבחנה קריוגני באמצעות תרסיס צבע פתרון החיטוי. להעביר את iPSCs האנושית המופשרים cryotube הצינור 15 מ"ל המכיל 3 מ"ל של מדיום iPSC חימם טרום-RT.
- צנטריפוגה הצינור ב 110 x g במשך 3 דקות להסיר את תגובת שיקוע על ידי השאיפה באמצעות מערכת בשאיבה או על פיפטה 5 מ.
- Resuspend בגדר תא עם 1 מ"ל של מדיום iPSC מתוך קערה מצופה vitronectin 6 ס מ תרבות באמצעות פיפטה 2 מ"ל ולהעביר את התאים חזרה לצלחת. להחזיר את המנה החממה-CO של 37 ° C ו- 5%-2 לפחות 24 שעות לפני שינוי המדיום.
הערה: ניתן להוסיף מעכב רוק, כגון Y-27632 ב- 10 מיקרומטר, למדיום iPSC במנות תרבות 6 ס מ כדי להפחית אפופטוזיס. - לשנות את המדיום מדי יום ולהעביר את iPSCs האנושית בכל שבוע.
-
Passaging של iPSCs אנושי
- עוברים iPSC האנושי ב- 70-80% זרימה, בסגנון קלאסי לאחר 7 ימים בתרבות.
- להכין מנות 6 ס מ passaging כפי שמתואר בשלב 1.2.1. המדיום iPSC להסיר הכלים עם confluent iPSCs ולהוסיף 2 מיליליטר דיסוציאציה פתרון 6 דקות ב- RT.
הערה: זמן הדגירה תלוי iPSC שיבוטים. נסה דגירה של 6 דקות בתור התחלה. - להסיר את הפתרון דיסוציאציה באמצעות מערכות בשאיבה או פיפטה 5 מ ל ולהוסיף 2 מיליליטר iPSC בינוני מראש להתחמם ב RT. Resuspend המושבות iPSC על-ידי pipetting אותם לכל אורך 5-10 x עם פיפטה 1,000 µL.
זהירות: הימנעו תא בודד דיסוציאציה של pipetting מוגזמת. - העברת µL 30-200 של גושים תא resuspended בקערה 6 ס מ תרבות חדשה. להחזיר את הכלים תרבות תא החממה-CO של 37 ° C ו- 5%-2 לפחות 24 שעות לפני שינוי המדיום.
הערה: הנפח של גושים תא resuspended הדרושים של passaging תלוי iPSC שיבוטים. - לשנות את המדיום מדי יום ולהעביר את iPSCs האנושית בכל שבוע.
3. הדור של הרשתית Organoids
- התחל את הבידול iPSC בעקבות פרוטוקול schematized ב איור 1A כאשר המושבות מגיעים זרימה 60-70% (איור 1B).
- להכין מ 4 ל Bi בינוני לכל מנה 6 ס מ. לחמם את המדיום Bi כדי 37 מעלות צלזיוס. שנה המדיום iPSC לבינונית Bi. שימו לב הפעם כמו ביום 0 (D0).
- ב- D2, לעבור את התרבויות במדיום Bi מדיום BiN2, חימם בעבר ב 37 º C. לשנות את המדיום כל 2-3 ימים.
- לזהות מתהווים organoids הרשתית ויוצרים עצמית על ידי ניצנים neuroepithelium, כפי שמוצג באיור 1C -1E.
הערה: אלה organoids רשתית מוקדם, המתאים בשלב ההתפתחותי שלהם לגביע אופטיים, ניתן לבודד ידנית לניסויים במורד הזרם.
4. ההבשלה של הרשתית Organoids
- ב D28, הכנת לוחות 6-ובכן המכיל 4 מ"ל/טוב של ProB27 בינוני בתחילה בתוספת 10 ננוגרם למ"ל של FGF2 (איור 1 א').
הערה: הוסף FGF2 מיד לפני התקשורת מתווסף הלוחות.
התראה: אל תסנן את FGF2. - לשחזר את המבנים ברשתית המנות 6 ס מ באופן ידני. כדי לעשות זאת, לבודד את המבנים שהופך לקווקוו בניצב עם המחט סביב ניצן neuroepithelial, כפי שמוצג באיור 1E, לנתק את organoids על ידי גירוד אותם בעדינות עם המחט.
- האחות organoids 10-15 באמצעות פיפטה µL 1,000 ולהעביר אותם לבאר בודדת של צלחת 6-ובכן המכיל ProB27 בינונית.
- שמור את organoids ברשתית תרבות צף, בתנאי ProB27 במדיום חממה התרבות התא-CO 37 ° C ו-5%2. שנה וחצי של המדיום כל 2-3 ימים.
הערה: לפנק את organoids עם FGF2 עד D35. - ב D35, להסיר חצי של המדיום ולהוסיף בינוני ProB27 prewarmed טריים ב 37 ° C ללא FGF2.
- שנה וחצי של המדיום כל 2-3 ימים במהלך הזמן הדרוש כדי להשיג את סוגי תאים ברשתית הרצוי על פי הופעתם של סוגי תאים ברשתית, כפי שהיא מתוארת באיור 2.
5. דור, תאי RPE (hiRPE) נגזר iPSC הגברה של אדם
-
הדור של תאים אנושיים hiRPE
- לעסוק iPSCs של בידול כאשר המושבות מגיעים זרימה 60-70%, בעקבות פרוטוקול schematized ב איור 3 א.
- להכין 4 מ"ל לכל צלחת 6 ס מ של Bi בינוני, לחמם את המדיום Bi ב 37 º C. שנה המדיום iPSC לבינונית Bi. שימו לב הפעם כמו ביום 0 (D0).
- ב- D2, לעבור את התרבויות במדיום Bi מדיום BiN2 חימם בעבר ב 37 º C. לשנות את המדיום כל 2-3 ימים.
- ב D28, לשנות את המדיום מדיום ProN2 טריים חימם בעבר ב 37 ° C כפי שהיא מתוארת באיור 3 א.
הערה: שלב זה יכול להיעשות לאחר האיסוף תא צורב המתוארים בשלב 4. - לשנות את המדיום ProN2 כל 2-3 ימים.
- ב D42, לזהות תאים hiRPE מתהווה על ידי התבוננות פיגמנט תיקונים כפי שמוצג איור 3B.
הערה: הפיגמנטציה של תאים hiRPE מופיע בין D35 ל D56 בהתאם iPSC שיבוטים.
-
הגברה של תאים hiRPE
- ב D42, להכין צלחת 24-ובכן בעבר מצופה המטריקס כפי שמתואר בשלב 1.2.2, המכיל 1 מ ל ProN2 בינוני לכל טוב. מקם את הצלחת. בשביל 15 דקות בחממה-37 מעלות צלזיוס ו-5% CO2 לפני השימוש.
- לשחזר את המדבקות hiRPE המנה 6 ס מ באופן ידני. כדי לבודד טלאים, להפוך striation בניצב עם המחט סביב פיגמנט האפיתל ולנתק את הגיליון על ידי בעדינות לגרד את זה עם המחט. האחות 10 תיקונים פיגמנט באמצעות פיפטה µL 1,000 ולהעביר אותם לבאר בודדת של צלחת 24-. טוב.
- שמור את המדבקות hiRPE ProN2 במדיום חממה התרבות התא-37 מעלות צלזיוס ו-5% CO2 במשך 48 שעות לפני שינוי המדיום. הערה מעבר תא hiRPE זה כ- 0 (hiRPEp0). לשנות את המדיום כל 2-3 ימים ProN2 בינונית.
- עוברים את התאים hiRPEp0 כאשר התאים נמצאים confluent.
- להסיר את המדיום שימוש במערכות בשאיבה ולשטוף כל x 1 טוב עם 1 מ"ל של PBS באמצעות פיפטה 5 מ.
- למחוק את PBS שימוש במערכות בשאיבה, להוסיף µL 200 לאדם טוב של 0.25% טריפסין, דגירה זה לפחות 15 דקות בתוך אינקובטור ב 37 º C. הוסף µL 800 ProB27 בינוני כדי להשבית את טריפסין.
הערה: השימוש ProN2 בינוני כדי להפסיק את הפעילות טריפסין אינה מומלצת. - מביצועם הגיליון של תאים hiRPE על ידי pipetting זה למעלה ולמטה. למקם את התליה תא בשפופרת 15 מ"ל, centrifuge זה עבור 5 דקות ב 110 x g.
הערה: ושטוף נוספים יכול להיעשות עם ProN2 בינוני להסיר את עודף של ProB27 בינונית. - הסר את תגובת שיקוע, בעדינות resuspend בגדר תא ב- mL 2 בינוני ProN2 להתחמם מראש ב- 37 מעלות צלזיוס. לספור את התאים עם מונה התא.
- קח 1.25 מיליון תאים ולמקם אותם בבקבוקון מצופים מטריצה T-25 ס מ2 (ראה שלב 2.2.2) המכיל 5 מ של ProN2 בינוני להתחמם מראש ב- 37 מעלות צלזיוס. שימו לב hiRPE תא קטע 1 (hiRPEp1).
- שמור את התאים hiRPE המדיום ProN2 ב חממה התרבות תאים-37 מעלות צלזיוס ו-5% CO2 במשך 48 שעות לפני שינוי המדיום.
- לשנות את המדיה כל 2-3 ימים. כאשר התאים hiRPEp1 להגיע למפגש, לבצע את המעבר הבא או הקפאה קריוגנית.
6. הקפאה קריוגנית של הרשתית Organoids ותאים hiRPE
-
עבור כל רשתית organoids
- בחר 5 עד 20 רשתית organoids באמצעות pipet של העברת ומניחים בקבוקון ההקפאה. להסיר כל מדיום עודף עם פיפטה 1,000 µL בלי לגעת את organoids בחלק התחתון של הצינור ולהוסיף µL 250 הקפאה קריוגנית קר בינוני (ראה טבלה של חומרים).
- להקפיא הבקבוקונים בכלי מבוססי אלכוהול איזופרופיל לאוויר הקפוא ב-80 מעלות צלזיוס למשך תקופה מינימלית של 4 h העברה הבקבוקונים קפואים במקפיא-150 º C או מיכל חנקן נוזלי לאחסון לטווח ארוך.
-
עבור תאים hiRPE
- -מעבר 1, לנתק את התאים hiRPE כאשר התאים נמצאים confluent.
הערה: לא מומלץ הקפאה קריוגנית של תאים hiRPEp0. - האחות האמצעי הבקבוקון2 ס מ T-25 שימוש במערכות בשאיבה ולשטוף אותו x 1 עם 3 מ"ל של PBS באמצעות פיפטה 5 מ של.
- להסיר את PBS שימוש במערכות בשאיבה, להוסיף 1 מ"ל של 0.25% טריפסין, דגירה זה לפחות 15 דקות בתוך אינקובטור ב 37 º C. הוסף 5 מ של ProB27 בינוני כדי להפסיק את הפעילות טריפסין.
הערה: השימוש ProN2 בינוני כדי להשבית טריפסין אינה מומלצת. - מביצועם הגיליון של תאים hiRPE על ידי pipetting זה למעלה ולמטה באמצעות פיפטה של 10 מ"ל. לספור את התאים עם תא מונה. למקם את התליה תא בשפופרת 15 מ"ל, centrifuge זה עבור 5 דקות ב 110 x g.
הערה: ניתן לבצע ושטוף נוספים ProN2 בינונית כדי להסיר את עודף של ProB27 בינונית. - וארוקן את תגובת שיקוע באמצעות בשאיבה, בעדינות resuspend תאים כדי להשיג 2 מיליון תאים µL 250 הקפאה קריוגנית בינוני.
- העברה 250 µL תא השעיה לכל מבחנה ההקפאה. להקפיא את הבקבוקונים בכלי מבוססי אלכוהול איזופרופיל לאוויר הקפוא ב-80 מעלות צלזיוס למשך 4 שעות לפחות.
- להעביר את הבקבוקונים קפוא מקפיא-150 º C או חנקן נוזלי אקווריום לאחסון לטווח ארוך.
- -מעבר 1, לנתק את התאים hiRPE כאשר התאים נמצאים confluent.
7. מפשיר של הרשתית Organoids ותאים hiRPE
-
הפשרתו של organoids כל רשתית
- מדיום חם ProB27 ב 37 מעלות צלזיוס (2 מ ל יהיה נדרש עבור כל בקבוקון ההקפאה).
- מיכל חנקן נוזלי או מקפיא-150 º C, להפשיר בקבוקון קריוגני המכילה organoids ברשתית באמבט מים בטמפרטורה 37 ° C Disinfect ס' 30 המבחנה קריוגני בזהירות באמצעות תרסיס צבע פתרון החיטוי.
- פתח את המבחנה והוסף 1 מ"ל של מדיום ProB27 מראש ומחוממת. להעביר את organoids צינור 1.5 מ עם פיפטה העברה.
- להסיר את המדיום בעדינות על-ידי pipetting אותו מבלי לגעת המבנים ברשתית בתחתית הצינורית. לשטוף את organoids 1 יותר זמן עם 1 מ"ל של המדיום ProB27 מראש ומחוממת.
- מחוק לגמרי את organoids עם pipet העברת ומניחים 1 טוב של צלחת 6-ובכן המכילות בינוני ProB27 מראש חימם ו equilibrated באינקובטור 37 ° C ו- 5% CO2.
הערה: המקום organoids ברשתית 10-15 לכל טוב של צלחת 6-. טוב. - שנה וחצי של המדיום כל 2-3 ימים במהלך הזמן הדרוש כדי להשיג את סוגי תאים ברשתית הרצוי על פי הופעתם שלהם, כמתואר באיור2.
-
הפשרתו של תאים hiRPE
- מדיום חם ProN2 ב 37 מעלות צלזיוס (8 מ ל יהיה נדרש עבור כל בקבוקון ההקפאה).
- מיכל חנקן נוזלי או מקפיא-150 º C, להפשיר מדגם קריוגני של תאים hiRPEp1 על ידי דגירה לתוך אמבט מים ב 37 ° C עבור Disinfect ס' 30 המבחנה קריוגני בזהירות באמצעות תרסיס חיטוי פתרון.
- פתח הצינור, להוסיף 1 מ"ל של מדיום ProN2 מראש ומחוממת ולהעביר התליה תא צינור 15 מ"ל המכיל 2 מיליליטר ומחוממת מראש ProN2 בינונית. Centrifuge זה עבור 5 דקות ב 110 x g.
- הסר את תגובת שיקוע, בעדינות resuspend בגדר תא ב- mL 2 בינוני ProN2 להתחמם מראש ב- 37 מעלות צלזיוס.
- לספור את התאים עם מונה התא.
- קח 1.25 מיליון תאים ומניחים מצופים מטריצה T-25 ס"מ2 . הבקבוק (ראה שלב 2.2.2) המכיל 5 מ של ProN2 בינוני להתחמם מראש ב- 37 מעלות צלזיוס. בשלב הזה, הערה המעבר כ- 2 (hiRPEp2).
- לשמור את התאים hiRPEp2 ProN2 בינוני בחממה התרבות התא-37 מעלות צלזיוס ו-5% CO2 במשך 48 שעות לפני שינוי המדיום.
- לשנות את המדיה כל 2-3 ימים. כאשר התאים hiRPE להגיע למפגש, לבצע את המעבר הבא או הקפאה קריוגנית.
הערה: לאחר 2 שבועות בתרבות, 8-10 מיליון תאים hiRPE ניתן לאסוף עבור עוד יותר experimentations.
תוצאות
הצעד הראשון עבור בידול iPSC האדם טיפח מזין ללא תנאים16 הוא לסגור את מכונות התחדשות עצמית באמצעות Bi בינוני לעודד הבחנה ספונטנית (איור 1 א'). לאחר מכן, ב- D2, המדיום Bi הוא השלים עם תוספת N2 להנחות המבדילים iPSCs התאים לכיוון שושלות עצבית ו ברשתית. תהליך זה מוביל המראה של ניצנים neuroretinal-סביב D28 (איור 1C - 1E). מבנים neuroretinal ויוצרים עצמית ניתן לבודד באמצעות מחט כמופיע באיור 1E והועבר ללוחות תרבות כדי לאפשר את התבגרותם של organoids ברשתית בתנאים תרבות צף באמצעות ProB27 בינוני (איור 1F). לטובת צמיחה והתפתחות של הרשתית עצבית, FGF2 מתווסף המדיום במשך שבוע (איור 1 א').
ב D28, המבנים ברשתית המתעוררים מכילים בעיקר ברשתית ובתאים המבטאות במשותף את גורם שעתוק מפתח PAX6 RAX, VSX215. אבות אלה להצמיח המחלקות הגדולות שבעה סוגי התא רשתית בצפה התרבות התנאים בצו לידה אבולוציונית שנשמרת בקנה אחד עם התפתחות הרשתית האנושית. מבוסס על לרביעיית-PCR אימונוהיסטוכימיה שתואר קודם לכן ברייכמן ואח . 15. עקומות רחבה באיור 2 הצג גלים של דורות התא רשתית מוקדם, מאוחר-יליד במהלך תהליך ההבשלה במבחנה . לכן, הזמן תרבות מגדירה את סוגי תאים נוכח organoids.
בידודו של תאים hiRPE נוספות הגברה יכול להתבצע רק כאשר פיגמנטציה הוא מורגש כי זה הגיוון התא מאפשר הדמיה שלהם. בדרך זו, משמש המדיום ProN2 מ D28 כדי D42 את האמונים על הפיגמנטציה של תאי RPE15.
בהתאם, שיבוט אנושי iPSC המדבקות פיגמנט ניתן להבחין לפני או אחרי היווצרות עצמית של מבנים ברשתית; אבל בעיקר 1-2 שבועות לאחר השימוש ProN2 בינוני-D28 (איור 3 א, ב'). תמונת שדה בהיר נציג של תאים hiRPE מורחבת של המדבקות מבודד-המעבר 0 מוצג 3C איור ותלת מימד. לאחר מכן, ניתן להרחיב את התאים hiRPE עד מעבר 4, שמירה על פנוטיפ RPE שלהם ללא מעבר אפיתל-mesenchymal (החובשים). למרות זאת, החובשים ניתנת למניעה על ידי שימוש רוק מעכבי כגון Y-27632, ומאפשר גם גידול של תאים קטעים מספר17. תרבויות ארוכת טווח של תאים hiRPE לאחר מפשיר ניתן לבצע בקלות בתנאים המתוארים כאן כדי להשיג אפיתל בוגרת ופונקציונליים15. דוגמה של תאים בוגרים hiRPEp2 בשבוע 52 עם מורפולוגיה המרוצף cuboidal קלאסית מודגם ב- 3E איור.

איור 1: דור, ההבשלה של הרשתית organoids מן iPSCs האדם חסיד. (א) בידול פרוטוקול המאפשר את הדור של organoids ברשתית. (B) iPSCs האנושי-D0. (ג) המתעוררים neuroretinal אפיתל-D15. (ד) עצמית ויוצרים מבנים דמויי-רשתית עצבית-D22. (E) כאן, ניצן neuroretinal היא מבודדת באמצעות מחט. (F) תמונות נציג של organoids רשתית בצפה מצב התרבות ב- D35. גודל ברים = 200 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
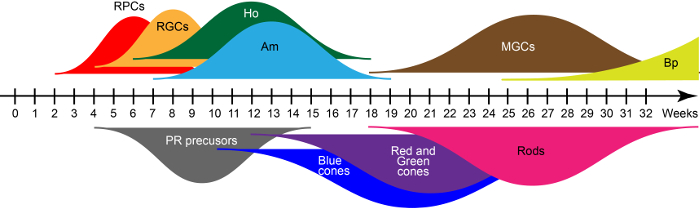
איור 2: גלים של הרשתית האנושית נגזר iPSC תא דור. קיצורים: רשתית ובתאים (Rpc) רשתית תאי גנגליון (RGCs), תאים אופקיים (Ho), תאי אמקרין (Am), תאי גליה מולר (MGCs), תאים דו-קוטביים (Bp), photoreceptors (PR). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
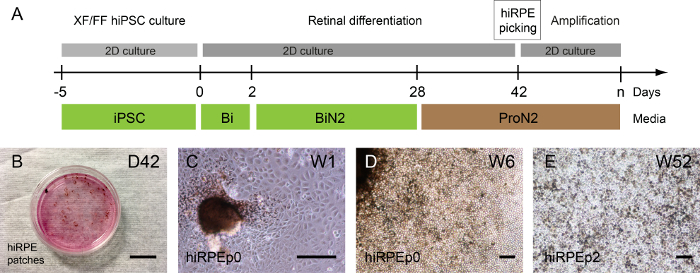
איור 3: דור, הגברה של האדם נגזר iPSC RPE- (א) איור של פרוטוקול בידול ומאפשר את הדור של תאים hiRPE האנושית. (B) ניגודיות שלב תמונות מראה פיגמנט תיקונים הבוקע המבדילים iPSCs האדם חסיד-שבוע 6 (W6). (ג) hiRPEp0 תאים טיפח שבוע אחד (W1) לאחר תיקון פיגמנט. (ד) hiRPEp0 תאים בשבוע 6 (W6) לאחר תיקון פיגמנט. (E) A תמונת הנציגה של תאים hiRPEp2 לאחר מפשיר, טיפח במשך 52 שבועות (W52) ב ProN2 בינונית. גודל ברים = 200 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
פרוטוקול זה מתאר כיצד לייצר תאי RPE, organoids ברשתית, המכילה RGCs ברשתית, photoreceptors, מתאי גזע pluripotent האנושי בתנאים קסנו-חופשית, נטולת מזין. תואם עם תהליך אימון ייצור טוב (GMP), השיטה מעובדות המובאת כאן מאפשר הפקה גדולה של נגזר iPSC תאים ברשתית תאי RPE, RGCs ו photoreceptors לפיתוח טיפולים מבוססי תאי גזע, סמים גילוי גישות לטיפול עתידי של מחלות ניווניות של הרשתית. הקפאה קריוגנית של organoids כל ברשתית או תאים hiRPE מספק גם היתרון העיקרי בהקמת בנקים תא ביניים, צעד חשוב לשימוש עתידי טיפולים מבוססי תאי גזע.
הייצור של מלאי גדול של סוגי תאים ברשתית מסוימים בשלב מסוים של בידול יידרש לתרגום קליניים עתידיים. בהקשר זה, הדור תוך שלושה חודשים של CD73-חיוביות קולט אור מבשרי מתואר של האוכלוסייה התואמים להשתלת תאים18, ועל האפשרות לייצר אלה photoreceptors ילדותי הקרת ההקפאה רשתית organoids15 לחזק את התקווה להשתמש תאים אלה למטרות טיפוליות. בנוגע אפיתל פיגמנט הרשתית, מאפשר היכולת של תאי hiRPE להתרבות במבחנה הפקות תא גדול להפקיד אותם. חשוב, המופשרים תאי RPE אדם נגזר iPSC שומרים על פנוטיפ RPE והתפקוד שלהם, לכן, גורם עם מחלות הפרשת או קולט אור פלח החיצוני phagocytosis15, אימות שלהם נוחות השימוש לסינון אסטרטגיות באותה מידה כמו עבור גישות טיפוליות עתידיות.
יש מגוון של פרוטוקולים לדור של נגזר iPSC organoids ברשתית7,8,9,10,11,12,15 זה להשתנות תרבות שיטות (embryoid גוף דמוי אגרגטים לעומת תאים חסיד) כמו גם יעילות ועמידות. השיטה המתוארת כאן מתחיל מ iPSCs האדם חסיד ומראה היעילות לשחזור, הסתגלות, ישימות למגוון רחב של האדם iPSC שורות15. תהליך זה, המבוסס על השינוי רצופים של סרום ללא מדיה, recapitulates את השלבים העיקריים של התפתחות הרשתית על ידי ניצול הותאם פנימיים של המערכת כדי להנחות בידול. יתרון חשוב של פרוטוקול זה הוא העדר גוף עובריים היווצרות ותוספת של מטריקס עבור העתיד התא רשתית תואמי GMP בייצור פרוטוקולים לייצר תא טיפול נגזרים. בדרך זו, אין הבדל היעילות של דור תא צורב ברשתית, ההבשלה נמצאו בין תנאי התרבות xenogeneic לא-xenogeneic באמצעות מערכת טיפול תא (CTS) תוספי מזון או לא, מנוסחים באופן בלעדי עם רקומביננטי או רכיבי humanized.
ההצלחה של השיטה בידול ברשתית תלויה, במידה רבה האיכות של התרבויות iPSC אנושי. השיטה התיכנות אינה משפיעה את היעילות בידול של האדם iPSCs תאים ברשתית8, אך מעמדם stemness צריך להיות אופטימלית. בקצרה, מעובדים באופן שגרתי iPSCs האדם לא צריך להראות סימנים של בידול. המושבות צריכה אינם חופפים, עליך להציג מורפולוגיה המעגלית האופיינית שלהם. למרות היעילות של הבידול ברשתית תלויי-שיבוט, מינימום של שני מבנים ברשתית לכל ס מ2 יכולים לבחור בהם ב D28, המתאים למבנים neuroretinal 50-60 על צלחת אחת של 6 ס מ. עבור תא צורב ברשתית התבגרותו בתנאים תרבות צף, הגבלת מספר מבנים לכל טוב מונע מבנה פיוז'ן וצריכת בינוני. בתנאים אלה תרבות ', organoids ברשתית יכולה להיות maturated למשך זמן רב, הנדרשים על מנת לקבל סוגי תאים ברשתית מאוחר.
. מצפה בקוצר רוח, organoids ברשתית שנוצר במבחנה בשיטה זו מהווים כלים רבי-עוצמה למחלות רשתית מודל. מודלים נגזר iPSC תא ברשתית החולה הספציפי ישמש כדי להבין טוב יותר מחלות גנטיות מורכבים על ידי חקר מנגנונים מולקולריים וסלולריות שלהם. מודלים אלה יהיה מתאים במיוחד עבור גילוי תרופות באמצעות הקרנה תפוקה גבוהה, טיפולים התא ואת ג'ין או גנום עריכה גישות, לפתח טיפולים חדשניים dystrophies ברשתית.
Disclosures
סשה רייכמן, אוליבייה Goureau, חוסה-אלן סאהל ממתינים ממציאים על פטנטים הקשורים הדור של תאים ברשתית מתאי גזע pluripotent אנושי.
Acknowledgements
המחברים רוצה להודות חברי הצוות של Goureau לקבל את התשומה שלהם במהלך הסידור של השיטות המתוארות כאן, ו Gagliardi ג ו מ Garita לקריאה ביקורתית שלהם. עבודה זו נתמכה על ידי מענקים ANR (GPiPS: ANR-2010-RFCS005; SightREPAIR: ANR-16-CE17-008-02), האגודה צרפת הרשתית ואת הטכנולוגיה העברת החברה הם העלו יחד Lutech. זה בוצע גם במסגרת LIFESENSES LABEX (ANR-10-LABX-65) נתמכת על-ידי ANR בתוך התוכנית d'Avenir Investissements (ANR-11-IDEX-0004-02).
Materials
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
References
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved