Method Article
Condizioni di coltura privo di alimentatore per i modelli di cellula retinica iPSC-derivato generazione umana e definito privo di Xeno
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La produzione di cellule specializzate della retina da cellule staminali pluripotenti è un punto di svolta nello sviluppo della terapia a base di cellule staminali per malattie retiniche. Il presente documento descrive un metodo semplice per una generazione efficiente dei organoids della retina e dell'epitelio pigmentato retinico per la ricerca di base, traslazionale e clinica.
Abstract
La produzione di cellule specializzate da cellule staminali pluripotenti fornisce un potente strumento per sviluppare nuovi approcci per la medicina rigenerativa. L'uso di cellule staminali pluripotenti indotte dall'uomo (iPSCs) è particolarmente interessante per gli studi di malattie neurodegenerative, tra cui distrofie retiniche, dove modelli iPSC-derivato delle cellule retiniche segnano un importante passo avanti per capire e combattere la cecità. In questo articolo, descriviamo un protocollo semplice e scalabile per generare, maturo e crioconservare organoids retinica. Basate sul cambiamento medio, il vantaggio principale di questo metodo è quello di evitare più e passaggi che richiede tempo comunemente richiesti in una differenziazione guidata delle iPSCs. Imitando le prime fasi di sviluppo retinico da successive modifiche dei media definiti sulle culture aderente iPSC umana, questo protocollo permette la generazione simultanea di self-formando strutture di neuroretinal e le cellule epiteliali pigmentate della retina (RPE) in un in modo riproducibile ed efficiente in 4 settimane. Queste strutture contenenti cellule progenitrici retinica (RPC) possono essere facilmente isolate di ulteriore maturazione in una condizione di cultura galleggiante che permette la differenziazione di RPC in sette tipi retinica delle cellule presenti nella retina umana adulta. Inoltre, vengono descritti metodi rapidi per la crioconservazione dei organoids retinica e cellule RPE per immagazzinaggio a lungo termine. Combinati insieme, i metodi descritti qui sarà utili per produrre e Banca iPSC-derivato della retina cellule o tessuti umani per la ricerca clinica e di base.
Introduzione
La retina è parte integrante del sistema nervoso centrale (SNC) e ha una capacità limitata di rigenerarsi spontaneamente a seguito di una lesione traumatica o malattie. Di conseguenza, patologie degenerative, causando la perdita definitiva delle cellule della retina, come la degenerazione maculare senile (AMD), retinite pigmentosa (RP), il glaucoma e la retinopatia diabetica, in genere portano a cecità irreversibile. Salvataggio della retina degenerata è una sfida importante per i quali terapie basate sulle cellule staminali che mira a sostituire le cellule danneggiate o perse sono uno dei più promettenti approcci1,2,3. Cellule staminali pluripotenti come cellule staminali embrionali umane (CES) o cellule staminali pluripotenti indotte dall'uomo (iPSCs) hanno la capacità di essere espansa all'infinito nella cultura, e hanno il potenziale per produrre qualsiasi tipo di cellula. Progressi nella nostra comprensione dello sviluppo della retina e il miglioramento in vitro di protocolli per differenziazione umana iPSC hanno provocato la generazione di organoids retinica7,8,9, 10,11,12. Tutte le principali cellule della retina, incluse le cellule retiniche del ganglio (RGCs) fotorecettori e cellule epiteliali pigmentate retiniche di (RPE), sono state correttamente differenziate dai umano CES e iPSCs4,5, 6. sulla base del metodo SFEB (coltura privo di siero di embryoid corpo-come aggregati) sviluppato da Eiraku et al. 13, autoformazione dei organoids retinica sono ottenibili da ESC - o iPSC-derivati embryoid corpo-come aggregati nella matrice extracellulare definiti componenti7,10,14. Ma questi protocolli sono complessi, che richiedono un numero elevato di passaggi non sempre compatibili con la grande produzione di cellule per approcci terapeutici o lo screening di stupefacenti. Così, la scelta del metodo per la produzione di cellule della retina umane è fondamentale e il metodo deve essere robusta, scalabile ed efficiente.
Qui, sulla nostra precedente pubblicazione15, descriviamo ogni passo per una generazione semplice ed efficiente di cellule retiniche attraverso autoformazione organoid retinico da aderente iPSCs umane coltivate in una condizione di alimentatore e xeno-free. A partire da colture sistematiche di aderente iPSCs umane, questo protocollo richiede solo un semplice mezzo successivo cambiando per consentire la generazione di cellule iPS-derivate di RPE (hiRPE) e di neuroretinal strutture in 4 settimane. Dopo un isolamento manuale, hiRPE può essere espansa e strutture retiniche possono essere coltivate come galleggiante organoids dove le cellule progenitrici della retina sono in grado di differenziarsi in tutti i tipi di cellule retiniche in un ordine sequenziale coerenza con l'essere umano in vivo retinogenesis. Infine, per avanzamento di ricerca o traduzione clinica, descriviamo un metodo di crioconservazione consentendo l'archiviazione a lungo termine dei organoids intero retinica e hiRPE delle cellule senza influire sulle loro caratteristiche fenotipiche e funzionalità.
Protocollo
Il protocollo descritto in questo documento segue le linee guida del comitato etico dell'Institut de la Vision ricerca. L'Institut de la Vision è stato permesso la manipolazione del campione umano secondo la norma francese. Trattamento del campione segue la protezione dei dati del paziente in conformità con i principi di Helsinki e ai regolamenti nazionali dopo l'approvazione etica del "Comité de Protection des Personnes (CPP) Ile-de-V".
1. preparazione di terreni di coltura e piatti
-
Terreni di coltura
- Usano iPSC medium, un terreno chimicamente definito dedicata alla cultura di cellule staminali pluripotenti in circostanze senza alimentatore16. Preparare 500 mL di terreno secondo il protocollo del produttore.
- Utilizzo medio basale iPSC (Bi), iPSC chimicamente definito mezzo senza il fattore di crescita del fibroblasto 2 (FGF2) o fattore di crescita trasformante Beta (Tgf1s).
- Preparare 500 mL di medium Bi completate con supplemento di 1% N2 (BiN2 medio), 10 unità/mL di penicillina e 10 mg/mL di streptomicina.
- Preparare 500 mL di proneurale basati su N2 medio (medio ProN2) composto da miscela di DMEM:Nutrient F-12 (DMEM/F12, 1:1, L-Glutammina), 1% MEM aminoacidi non essenziali, supplemento 1% N2, 10 unità/mL di penicillina e 10 mg/mL di streptomicina.
- Preparare proneurale B27-base medio (medio ProB27) composto da miscela di DMEM:Nutrient F-12 (DMEM/F12, 1:1, L-Glutammina), 1% MEM aminoacidi non essenziali, supplemento 2% B27, 10 unità/mL di penicillina e 10 mg/mL di streptomicina.
-
Preparazione di vaso di cultura
-
Per la cultura umana iPSC
- Preparare 10 mL di una soluzione di vitronectin contenente 5 μg/mL di vitronectin in 1X PBS. In 10 mL di PBS 1X, aggiungere 100 µ l di soluzione madre vitronectina scongelati (100x).
- Distribuire 2 mL della soluzione di vitronectin per ogni piatto 6-cm cultura corrispondente a 0,5 µ g/cm2. Incubare per 1 h a temperatura ambiente (TA). Rimuovere la soluzione di vitronectin dall'aspirazione utilizzando un sistema di aspirazione di vuoto o di una pipetta da 5 mL.
- Aggiungere 4 mL di terreno di iPSC per ogni piatto di 6 cm.
- Incubare i piatti in un'incubatrice di coltura cellulare a 37 ° C e 5% CO2 per un minimo di 30 minuti prima dell'uso.
- Per umano iPSC-derivato di coltura di cellule RPE (hiRPE)
- Utilizzare una matrice di qualificato come cellule staminali pluripotenti o substrato per rivestire pozzi secondo il protocollo del produttore. Aggiungere sufficiente matrix o substrato per coprire l'area di superficie di crescita intero. Ad esempio, mettere 300 µ l di matrice per pozzetto in piastre da 24 e 3 mL di matrice in una boccetta di2 cm T-25.
- Incubare i recipienti di coltura rivestito per un minimo di 1 h a 37 ° C. Rimuovere la matrice utilizzando sistemi di aspirazione di vuoto o di una pipetta da 5 mL.
- Aggiungere 1 mL di mezzo di ProN2 per pozzetto in piastre da 24 pozzetti e riconsegnare l'imbarcazione di cultura nell'incubatore per un minimo di 30 minuti per scaldare ed equilibrare il medium. Per boccette di T-25 cm2 , vedere il punto 5.2.
-
Per la cultura umana iPSC
2. manutenzione ed espansione di umani iPSCs
-
Manutenzione di iPSCs umane
- Preparare 3 mL di terreno di iPSC in una provetta da 15 mL e tenerlo a temperatura ambiente per un minimo di 15 min prima dell'uso. Preparare un piatto di 6 cm rivestito come descritto al punto 1.2.1.
- Scongelare un campione criogenico di iPSCs umane da un serbatoio di azoto liquido o di un congelatore a-150 ° C mediante incubazione a bagnomaria a 37 ° C per 30 s.
- Disinfettare accuratamente il flaconcino criogenico utilizzando uno spray di soluzione disinfettante. Trasferire lo scongelati iPSCs umane dallo stoccaggio provette criogenia per il tubo da 15 mL contenente 3 mL di terreno di iPSC pre-riscaldato a TA.
- Centrifugare la provetta a 110 x g per 3 min. eliminare il surnatante tramite aspirazione utilizzando un sistema di aspirazione di vuoto o di una pipetta da 5 mL.
- Risospendere il pellet cellulare con 1 mL di mezzo di iPSC da una piastra di coltura di 6 cm rivestite con vitronectina utilizzando una pipetta 2ml e trasferire le cellule torna al piatto. Riporre la piastra nell'incubatore a 37 ° C e 5% CO2 per un minimo di 24 h prima di cambiare il mezzo.
Nota: Un inibitore della roccia, come Y-27632 a 10 µM, possa essere aggiunti al mezzo iPSC nei piatti di cultura di 6 cm per ridurre gli apoptosi. - Cambio medio giornaliero e passare il iPSCs umane ogni settimana.
-
Passaggio di iPSCs umane
- Passare l'iPSC umana in una confluenza di 70-80%, classicamente dopo 7 giorni nella cultura.
- Preparare piatti 6 cm per il passaggio come descritto al punto 1.2.1. Rimuovere il mezzo di iPSC dai piatti con iPSCs confluenti e aggiungere 2 mL di una soluzione di dissociazione per 6 minuti a TA.
Nota: Il tempo di incubazione dipende i cloni di iPSC. Provare un'incubazione di 6 min come un inizio. - Rimuovere la soluzione di dissociazione con sistemi di aspirazione di vuoto o una pipetta da 5 mL e aggiungere 2 mL di terreno di iPSC pre-riscaldati a RT. Risospendere le colonie di iPSC pipettando su e giù per 5-10 volte con una pipetta di 1.000 µ l.
Attenzione: Evitare di dissociazione singola cella pipettatura eccessivo. - Trasferire 30 a 200 µ l di sedimento cellulare ciuffi in una nuova piastra di coltura di 6 cm. Restituire i piatti per l'incubatrice della coltura cellulare a 37 ° C e 5% CO2 per un minimo di 24 h prima di cambiare il mezzo.
Nota: Il volume di sedimento cellulare ciuffi necessari per il passaggio dipende i cloni di iPSC. - Cambio medio giornaliero e passare il iPSCs umane ogni settimana.
3. generazione dei Organoids retinica
- Avviare la differenziazione di iPSC seguendo il protocollo schematizzato in Figura 1A quando le colonie raggiungono una confluenza del 60-70% (Figura 1B).
- Preparare 4 mL di terreno di Bi per ogni piatto di 6 cm. Riscaldare il mezzo Bi a 37 ° C. Modificare il mezzo iPSC medium Bi. Nota Questa volta come giorno 0 (D0).
- D2, passare le culture nel medium Bi a mezzo di BiN2, precedentemente riscaldato a 37 ° C. Modificare il mezzo ogni 2-3 giorni.
- Identificare organoids retinica self-formatura emergente dal neuroepithelium germogli, come mostrato in Figura 1 -1E.
Nota: Questi primi organoids retinica, corrispondente nel loro stadio di sviluppo alla Coppa ottica, può essere manualmente isolato per la sperimentazione a valle.
4. maturazione dei Organoids retinica
- A D28, preparare piastre da 6 pozzetti contenente 4 mL/pozzetto di ProB27 inizialmente supplementato con 10 ng/mL di FGF2 (Figura 1A).
Nota: Aggiungere FGF2 immediatamente prima l'elemento multimediale è aggiunto ai piatti.
Attenzione: Non filtrare FGF2. - Recuperare manualmente le strutture retiniche dai piatti di 6 cm. Per effettuare questa operazione, isolare le strutture fare striature perpendicolare con l'ago intorno il germoglio di neuroepithelial, come mostrato in Figura 1Ee staccare il organoids graffiando delicatamente con l'ago.
- 10-15 organoids usando una pipetta a 1.000 µ l di aspirare e trasferirli in un unico pozzetto della piastra 6 pozzetti contenenti ProB27 mezzo.
- Mantenere il organoids retinica in condizioni di coltura galleggiante nel mezzo di ProB27 in un'incubatrice di coltura cellulare a 37 ° C e 5% CO2. Modificare la metà del mezzo ogni 2-3 giorni.
Nota: Considerare il organoids con FGF2 fino D35. - A D35, rimuovere la metà del mezzo e aggiungere mezzo ProB27 preriscaldato fresco a 37 ° C senza FGF2.
- Modificare la metà del mezzo ogni 2-3 giorni durante il tempo necessario per ottenere i tipi di cellule retiniche desiderato secondo l'emersione di tipi delle cellule retiniche, come raffigurato in Figura 2.
5. generazione e amplificazione di umano iPSC-derivato delle cellule RPE (hiRPE)
-
Generazione di cellule umane hiRPE
- Esercitare la iPSCs differenziazione quando le colonie raggiungono una confluenza del 60-70%, seguendo il protocollo schematizzato in Figura 3A.
- Preparare 4 mL ogni 6 cm piatto di mezzo Bi e riscaldare il mezzo Bi a 37 ° C. Modificare il mezzo iPSC medium Bi. Nota Questa volta come giorno 0 (D0).
- D2, passare le culture nel medium Bi su un supporto di BiN2 precedentemente riscaldato a 37 ° C. Modificare il mezzo ogni 2-3 giorni.
- A D28, cambiare il mezzo a un terreno di ProN2 nuovo precedentemente riscaldato a 37 ° C, come illustrato nella Figura 3A.
Nota: Questo passaggio può essere fatto dopo la raccolta di organoid descritta nel passaggio 4. - Cambiare il mezzo di ProN2 ogni 2-3 giorni.
- D42, identificare le cellule hiRPE emergente tramite l'osservazione di zone pigmentate come illustrato in Figura 3B.
Nota: La pigmentazione delle cellule hiRPE appare tra D35 per D56 a seconda i cloni di iPSC.
-
Amplificazione delle cellule hiRPE
- A D42, preparare una piastra a 24 pozzetti precedentemente rivestito con la matrice come descritto al punto 1.2.2 e contenente 1 mL di mezzo di ProN2 per pozzetto. Posizionare la piastra per 15 min in incubatore a 37 ° C e 5% CO2 prima dell'uso.
- Recuperare manualmente le patch di hiRPE dal piatto di 6 cm. Per isolare le patch, fare una striatura perpendicolare con l'ago intorno l'epitelio pigmentato e staccare il foglio graffiando delicatamente con l'ago. Aspirare 10 zone pigmentate usando una pipetta a 1.000 µ l e trasferirli in un unico pozzetto della piastra 24 pozzetti.
- Tenere le patch hiRPE ProN2 medio in un'incubatrice di coltura cellulare a 37 ° C e 5% di CO2 per 48 h prima di cambiare il mezzo. Nota Questo passaggio di cella hiRPE come 0 (hiRPEp0). Modificare il mezzo ogni 2-3 giorni con il mezzo di ProN2.
- Passare le cellule di hiRPEp0 quando le cellule sono confluenti.
- Rimuovere il supporto utilizzando sistemi di aspirazione di vuoto e lavare ogni pozzo 1 x con 1 mL di PBS utilizzando una pipetta da 5 mL.
- Scartare il PBS utilizzando sistemi di aspirazione di vuoto, aggiungere 200 µ l di 0,25% tripsina e viene quindi incubato per un minimo di 15 min in un incubatore a 37 ° C. Aggiungere 800 µ l di terreno di ProB27 per inattivare la tripsina.
Nota: L'uso del mezzo di ProN2 per interrompere l'attività della tripsina non è raccomandato. - Dissociare il foglio di hiRPE cellule pipettando su e giù. Posizionare la sospensione cellulare in una provetta da 15 mL e si centrifuga per 5 min a 110 x g.
Nota: Un lavaggio supplementare può essere fatto con il mezzo di ProN2 per rimuovere l'eccesso di ProB27 medio. - Rimuovere il supernatante e Risospendere delicatamente il pellet cellulare in 2 mL di terreno di ProN2 pre-riscaldato a 37 ° C. Contare le celle con un contatore di cellule.
- Prendere cellule 1,25 milioni e metterli in una boccetta di rivestite con matrice T-25 cm2 (Vedi punto 2.2.2) contenente 5 mL di mezzo di ProN2 pre-riscaldato a 37 ° C. Nota Questo passaggio di cella hiRPE come 1 (hiRPEp1).
- Mantenere le cellule hiRPE nel medio ProN2 in un'incubatrice di coltura cellulare a 37 ° C e 5% di CO2 per 48 h prima di cambiare il mezzo.
- Modificare i media ogni 2-3 giorni. Quando le cellule di hiRPEp1 raggiungere la confluenza, eseguire il passaggio successivo o la crioconservazione.
6. Crioconservazione di cellule hiRPE e retinico Organoids
-
Per intero retinica organoids
- Selezionare 5 a 20 organoids retinica utilizzando una pipetta da trasferimento e metterli in un vial criogeniche. Rimuovere ogni eccesso di terreno con una pipetta di 1.000 µ l senza toccare il organoids nella parte inferiore del tubo e aggiungere 250 µ l di terreno di crioconservazione freddo (Vedi Tabella materiali).
- Congelare le fiale in un contenitore di congelamento isopropanolo-basato a-80 ° C per un minimo di 4 h. trasferimento i flaconcini congelati in un congelatore a-150 ° C o serbatoio di azoto liquido per la conservazione a lungo termine.
-
Per le cellule hiRPE
- Al passaggio 1, è necessario dissociare le cellule di hiRPE quando le cellule sono confluenti.
Nota: Non è raccomandato un crioconservazione delle cellule hiRPEp0. - Aspirare il mezzo nel matraccio di2 cm di T-25 utilizzando sistemi di aspirazione di vuoto e lavarlo 1x con 3 mL di PBS utilizzando una pipetta da 5 mL.
- Rimuovere il PBS utilizzando sistemi di aspirazione di vuoto, aggiungere 1 mL di tripsina 0,25% e incubare per un minimo di 15 min in un incubatore a 37 ° C. Aggiungere 5 mL di terreno di ProB27 per interrompere l'attività della tripsina.
Nota: L'uso del mezzo ProN2 per inattivare tripsina non è raccomandato. - Dissociare il foglietto di cellule hiRPE esso pipettando su e giù per mezzo di una pipetta 10ml. Contare le celle con contatore di cellule. Posizionare la sospensione cellulare in una provetta da 15 mL e si centrifuga per 5 min a 110 x g.
Nota: Un lavaggio supplementare può essere eseguito con il mezzo di ProN2 per rimuovere l'eccesso di ProB27 medio. - Aspirare il supernatante mediante aspirazione di vuoto e Risospendere delicatamente le cellule per ottenere 2 milioni di cellule in 250 µ l di terreno di crioconservazione.
- Trasferire 250 µ l di sospensione cellulare per flaconcino criogenico. Congelare le fiale in un contenitore di congelamento isopropanolo-basato a-80 ° C per un minimo di 4 h.
- Trasferire i flaconcini congelati a-150 ° C congelatore o un serbatoio di azoto liquido per la conservazione a lungo termine.
- Al passaggio 1, è necessario dissociare le cellule di hiRPE quando le cellule sono confluenti.
7. lo scongelamento dei Organoids retinica e hiRPE delle cellule
-
Lo scongelamento dei organoids intero retinica
- Caldo ProB27 mezzo a 37 ° C (2 mL sarà richiesto per ogni flaconcino criogenico).
- Dal serbatoio di azoto liquido o congelatore-150 ° C, scongelare un criogenico flaconcino contenente organoids retinica in un bagno di acqua a 37 ° C per 30 s. disinfetta il flaconcino criogenico accuratamente con un getto di soluzione disinfettante.
- Aprire il flacone e aggiungere 1 mL di terreno di ProB27 pre-riscaldato. Trasferire il organoids una provetta da 1,5 mL con una pipetta di trasferimento.
- Rimuovere delicatamente il mezzo pipettando esso senza toccare le strutture retiniche nella parte inferiore del tubo. Lavare il organoids 1 più tempo con 1 mL di medium ProB27 pre-riscaldato.
- Aspirare il organoids con una pipetta da trasferimento e metterli in 1 bene di una piastra a 6 pozzetti contenenti ProB27 mezzo preriscaldato ed equilibrato in un incubatore a 37 ° C e 5% CO2.
Nota: Inserire 10-15 organoids retinica per pozzetto di una piastra a 6 pozzetti. - Modificare la metà del mezzo ogni 2-3 giorni durante il tempo necessario per ottenere i tipi di cellule retiniche desiderata secondo la loro emersione, come descritto nella Figura 2.
-
Lo scongelamento delle cellule hiRPE
- Caldo ProN2 mezzo a 37 ° C (8 mL sarà richiesto per ogni flaconcino criogenico).
- Dal serbatoio di azoto liquido o congelatore-150 ° C, scongelare un campione criogenico di cellule hiRPEp1 da un'incubazione in bagnomaria a 37 ° C per 30 s. disinfetta il flaconcino criogenico accuratamente con soluzione disinfettante spray.
- Aprire il tubetto e aggiungere 1 mL di terreno di ProN2 pre-riscaldato e trasferire la sospensione cellulare per un tubo da 15 mL contenente 2 mL di terreno di ProN2 pre-riscaldato. Si centrifuga per 5 min a 110 x g.
- Rimuovere il supernatante e Risospendere delicatamente il pellet cellulare in 2 mL di terreno di ProN2 pre-riscaldato a 37 ° C.
- Contare le celle con un contatore di cellule.
- Prendere cellule 1,25 milioni e metterli nella beuta di rivestite con matrice T-25 cm2 (Vedi punto 2.2.2) contenente 5 mL di mezzo di ProN2 pre-riscaldato a 37 ° C. In questa fase, è possibile notare il passaggio come 2 (hiRPEp2).
- Mantenere le cellule hiRPEp2 nel mezzo di ProN2 nell'incubatrice di coltura cellulare a 37 ° C e 5% di CO2 per 48 h prima di cambiare il mezzo.
- Modificare i media ogni 2-3 giorni. Quando le cellule di hiRPE raggiungere la confluenza, eseguire il passaggio successivo o la crioconservazione.
Nota: Dopo 2 settimane nella cultura, 8 milioni hiRPE cellule possono essere raccolti per ulteriori sperimentazioni.
Risultati
Il primo passo per la differenziazione di iPSC umano coltivato in condizioni privo di alimentatore16 è di chiudere la pagina di auto-rinnovamento macchinari usando Bi mezzo per incoraggiare una differenziazione spontanea (Figura 1A). Quindi, a D2, il mezzo di Bi è completato con un supplemento di N2 per guidare la differenziazione iPSCs cellule verso i lignaggi neurale e retiniche. Questo processo porta alla comparsa dei germogli di neuroretinal presso intorno D28 (Figura 1 - 1E). Auto-formanti strutture di neuroretinal possono essere isolati utilizzando un ago come illustrato in Figura 1E e trasferito a piastre di coltura per consentire la maturazione della organoids retinica in condizioni di coltura mobile utilizzando ProB27 medio (Figura 1F). Per favorire la crescita e lo sviluppo della retina neurale, FGF2 è aggiunto al medium per 1 settimana (Figura 1A).
A D28, strutture retiniche emergenti contengono principalmente cellule progenitrici della retina che co-esprimono il fattore di trascrizione come PAX6, RAX e VSX215. Questi progenitori danno luogo a sette classi principali di tipi delle cellule retiniche in condizioni di coltura che galleggia in un ordine di nascita evolutivamente conservati coerente con lo sviluppo della retina umano. Basato su qRT-PCR e immunohistochemistry precedentemente descritto in Reichman et al. 15, le ampie curve nella Figura 2 Visualizza ondate di generazioni di cellule retiniche precoce e tardiva-Nato durante un processo di maturazione in vitro . Così, il tempo di cultura definisce i tipi di cellule presenti nella organoids.
L'isolamento di cellule hiRPE per qualsiasi ulteriore amplificazione può essere eseguita solo quando la pigmentazione è percepibile perché questa colorazione cellulare permette la loro visualizzazione. In questo modo, il mezzo di ProN2 viene utilizzato da D28 per D42 a favorire la pigmentazione di RPE cellule15.
A seconda il clone umano iPSC, le zone pigmentate possono essere rilevati prima o dopo l'auto-formazione di strutture retiniche; ma per lo più 1 o 2 settimane dopo l'uso di ProN2 mezzo alle D28 (Figura 3A, B). Un'immagine rappresentativa campo luminoso delle cellule di hiRPE espanso dai cerotti isolati al passaggio 0 è mostrata in Figura 3 e 3D. Quindi, le cellule di hiRPE possono essere ampliate fino al passaggio 4, mantenendo il loro fenotipo RPE senza una transizione epiteliale-mesenchimale (EMT). Tuttavia, EMT può essere evitata mediante l'uso di inibitori di roccia come Y-27632, consentendo anche un aumento del numero delle cellule passaggi17. Colture a lungo termine delle cellule hiRPE dopo lo scongelamento possono essere facilmente eseguite nelle condizioni descritte qui per ottenere un epitelio maturo e funzionale15. Un esempio di cellule mature hiRPEp2 alla settimana 52 con una morfologia di ciottoli cuboidali classica è illustrato nella Figura 3E.

Figura 1: generazione e maturazione dei organoids retinico da aderente iPSCs umane. (A) protocollo di differenziazione che permette la generazione di organoids retinica. (B) umano iPSCs a D0. (C) emergenti neuroretinal epitelio a D15. (D) auto-formanti neurale retina-come le strutture a D22. (E) qui, il germoglio di neuroretinal è isolato con un ago. (F) immagini rappresentative dei organoids retinica in condizione di cultura che galleggia a D35. Scala bar = 200 µm. Clicca qui per visualizzare una versione più grande di questa figura.
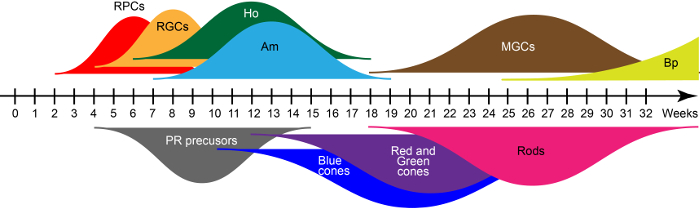
Figura 2: ondate di retinico umano iPSC-derivato delle cellule generazione. Abbreviazioni: Cellule progenitrici della retina (RPC), cellule gangliari della retina (RGCs), cellule orizzontali (Ho), cellule amacrine (Am), cellule gliali Müller (MGCs), cellule bipolari (Bp) e fotorecettori (PR). Clicca qui per visualizzare una versione più grande di questa figura.
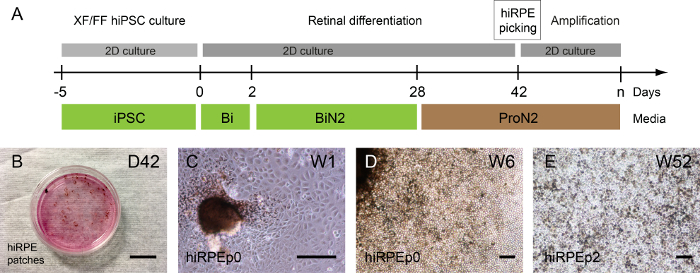
Figura 3: generazione e amplificazione di RPE iPSC-derivati umani. (A) un'illustrazione del protocollo di differenziazione che permette la generazione di cellule umane hiRPE. (B) visualizzando pigmentata patch emergenti da differenziare iPSCs umana aderente alla settimana 6 (W6) immagini per contrasto di fase. (C) hiRPEp0 cellule coltivate una settimana (W1) dopo la raccolta zona pigmentata. (D) hiRPEp0 cellule alla settimana 6 (W6) dopo la raccolta zona pigmentata. (E), A immagine rappresentativa delle cellule hiRPEp2 dopo lo scongelamento, coltivato per 52 settimane (W52) nel mezzo di ProN2. Scala bar = 200 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo descrive come produrre cellule RPE e organoids retinica, contenente RGCs retinico e fotorecettori, da cellule staminali pluripotenti umane in condizioni di xeno e alimentatore-free. Compatibile con il processo di buona fabbricazione (GMP), il metodo coltivato qui presentato permette un'ampia produzione di cellule retiniche iPSC-derivati come cellule RPE, RGCs e fotorecettori per lo sviluppo di terapie basate sulle cellule staminali e droga individuazione di approcci per il trattamento futuro di malattie degenerative retiniche. La crioconservazione di organoids intero della retina o cellule hiRPE fornisce inoltre un importante vantaggio nella creazione di banche di cellule intermedie, un passo importante per un utilizzo futuro in terapie basate sulle cellule staminali.
La produzione di grandi scorte di tipi specifici delle cellule retiniche in una fase specifica di differenziazione sarà richiesta per la traduzione clinica futura. A questo proposito, la generazione in tre mesi dei precursori del fotoricettore CD73-positivo descritto come un cellulare compatibile con trapianto popolazione18e la possibilità di generare questi fotorecettori immaturi da congelare-sciolto retinica organoids15 rafforzare la speranza di utilizzare queste cellule per scopi terapeutici. Per quanto riguarda dell'epitelio pigmentato retinico, la capacità di hiRPE cellule di proliferare in vitro permette produzioni di grandi cellule bancario li. D'importanza, scongelate cellule RPE iPSC-derivate umane mantengono loro RPE fenotipo e la funzione, pertanto, come fattore trofico secrezione o del fotoricettore segmento esterno fagocitosi15, convalida la loro facilità d'uso per lo screening di strategie pure come per futuri approcci terapeutici.
Ci sono una varietà di protocolli per la generazione di iPSC-derivato della retina organoids7,8,9,10,11,12,15 che variano in Metodi (embryoid corpo-come aggregati vs cellule aderenti) della cultura così come efficienza e robustezza. Il metodo qui descritto parte da aderenti iPSCs umane e Mostra un'efficacia riproducibile, adattabilità e applicabilità ad una vasta gamma di iPSC umano linee15. Questo processo, basato sul cambiamento successivo dei media senza siero, ricapitola le fasi principali di sviluppo retinico sfruttando gli spunti intrinseci del sistema per guidare la differenziazione. Un importante vantaggio di questo protocollo è l'assenza di formazione del corpo embrionale e l'aggiunta della matrice per futuri protocolli per produrre derivati di terapia cellulare di produzione di celle retinica secondo GMP. In questo modo, è stata trovata alcuna differenza nell'efficienza generazione organoid retinica e la maturazione di fra condizioni di coltura xenogeniche e no-xenogeniche utilizzando integratori di sistema di terapia cellulare (CTS) o non, formulato esclusivamente con ricombinante o componenti umanizzati.
Il successo del metodo differenziazione retinica in gran parte dipende dalla qualità delle culture umane iPSC. Il metodo di riprogrammazione non influenza l'efficienza di differenziazione delle iPSCs umane a cellule retiniche8, ma il loro status di staminalità devono essere ottimali. Brevemente, iPSCs umane coltivate ordinariamente non dovrebbe mostrare alcun segno di differenziazione. Le colonie non devono sovrapporsi e devono visualizzare loro morfologia caratteristica circolare. Anche se l'efficienza della differenziazione retinica è clone-dipendente, un minimo di due strutture retiniche a cm2 possa essere selezionato a D28, corrispondente a 50-60 strutture di neuroretinal per un piatto di 6 cm. Per la maturazione di organoid retinica in condizioni di coltura galleggiante, limitando il numero di strutture per pozzetto evita la struttura fusion e medio consumo eccessivo. In queste condizioni di coltura, organoids retinica può essere maturata per un tempo esteso, deve ottenere tardi tipi di cellule retiniche.
Guardando al futuro, retinica organoids generati in vitro da questo metodo costituiscono potenti strumenti per malattie retiniche modello. Modelli di paziente-specifici iPSC-derivato delle cellule retiniche serviranno a comprendere meglio le malattie complesse o genetiche dall'esplorazione dei loro meccanismi molecolari e cellulari. Questi modelli saranno particolarmente adatti per la scoperta della droga attraverso high throughput screening, terapie geniche e cellulari o genoma approcci, per lo sviluppo di trattamenti innovativi per distrofie retiniche di editing.
Divulgazioni
Sacha Reichman, Olivier Goureau e José-Alain Sahel sono inventori su in attesa di brevetti relazionati alla generazione di cellule retiniche da cellule staminali pluripotenti umane.
Riconoscimenti
Gli autori vorrei ringraziare i membri del team di Goureau per il loro contributo durante la messa a punto dei metodi descritti qui e G. Gagliardi e M. Garita per loro lettura critica. Questo lavoro è stato sostenuto da sovvenzioni da ANR (GPiPS: RFCS005-2010-ANR; SightREPAIR: ANR-16-CE17-008-02), la Retina France Association e la tecnologia di trasferimento azienda Lutech SATT. Inoltre è stata effettuata nell'ambito della LABEX LIFESENSES (ANR-10-LABX-65) supportato da ANR all'interno del programma di Investissements d'Avenir (ANR-11-IDEX-0004-02).
Materiali
| Name | Company | Catalog Number | Comments |
| Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A14700 | Coating |
| CTS Vitronectin (VTN-N) Recombinant Human Protein, Truncated | ThermoFisher Scientific | A27940 | Coating |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | medium |
| Essential 6 Medium | ThermoFisher Scientific | A1516401 | medium |
| CTS (Cell Therapy Systems) N-2 Supplement | ThermoFisher Scientific | A1370701 | supplement CTS |
| N-2 Supplement (100X) | ThermoFisher Scientific | 17502048 | supplement |
| B-27 Supplement (50X), serum free | ThermoFisher Scientific | 17504044 | supplement |
| CTS B-27 Supplement, XenoFree | ThermoFisher Scientific | A1486701 | supplement CTS |
| DMEM/F-12 | ThermoFisher Scientific | 11320074 | medium |
| MEM Non-Essential Amino Acids Solution (100X) | ThermoFisher Scientific | 11140035 | supplement |
| Penicillin-Streptomycin (10,000 U/mL) | ThermoFisher Scientific | 15140122 | antibiotic |
| CellStart CTS | ThermoFisher Scientific | A1014201 | Matrix CTS |
| Geltrex hESC-Qualified, Ready-To-Use, Reduced Growth Factor Basement Membrane Matrix | ThermoFisher Scientific | A1569601 | Matrix |
| Gentle Cell Dissociation Reagent | Stemcell Technologies | 7174 | dissociation solution |
| Cryostem Freezing Media | clinisciences | 05-710-1D | Cryopreservation medium |
| Fibroblast growth factor 2 (FGF2) | Preprotech | 100-18B | FGF2 |
| Fibroblast growth factor 2 (FGF2) animal free | Preprotech | AF-100-18B | FGF2 Xeno free |
| AGANI needle 23G | Terumo | AN*2332R1 | Needle |
| Flask 25 cm² Tissue Culture Treated | Falcon | 353109 | T-25 cm² |
| 24 well plate Tissue Culture Treated | Costar | 3526 | 24-well plate |
| 6 well plate Tissue Culture Treated | Costar | 3516 | 6-well plate |
Riferimenti
- Zhao, C., Wang, Q., Temple, S. Stem cell therapies for retinal diseases: recapitulating development to replace degenerated cells. Development. 144, 1368-1381 (2017).
- Dalkara, D., Goureau, O., Marazova, K., Sahel, J. -A. Let There Be Light: Gene and Cell Therapy for Blindness. Human Gene Therapy. 27, 134-147 (2016).
- Wright, L. S., Phillips, M. J., Pinilla, I., Hei, D., Gamm, D. M. Induced pluripotent stem cells as custom therapeutics for retinal repair: Progress and rationale. Experimental Eye Research. 123, 161-172 (2014).
- Leach, L. L., Clegg, D. O. Making Stem Cells Retinal: Methods for Deriving Retinal Pigment Epithelium and Implications for Patients with Ocular Disease. Stem Cells. 33, 2363-2373 (2015).
- Gill, K. P., Hewitt, A. W., Davidson, K. C., Pébay, A., Wong, R. C. B. Methods of Retinal Ganglion Cell Differentiation From Pluripotent Stem Cells. Translational Vision Science and Technology. 3, 2(2014).
- Giacalone, J. C., Wiley, L. A., et al. Concise review: Patient-specific stem cells to interrogate inherited eye disease. STEM CELLS Translational Medicine. 5, 132-140 (2016).
- Nakano, T., Ando, S., et al. Self-formation of optic cups and storable stratified neural retina from human ESCs. Cell Stem Cell. 10, 771-785 (2012).
- Reichman, S., Terray, A., et al. From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium. Proceedings of the National Academy of Sciences of the United States of America. 111, 8518-8523 (2014).
- Meyer, J. S., Howden, S. E., et al. Optic vesicle-like structures derived from human pluripotent stem cells facilitate a customized approach to retinal disease treatment. Stem Cells. 29, 1206-1218 (2011).
- Zhong, X., Gutierrez, C., et al. Generation of three-dimensional retinal tissue with functional photoreceptors from human iPSCs. Nature Communications. 5, 4047(2014).
- Mellough, C. B., Collin, J., et al. IGF-1 Signalling plays an important role in the formation of three dimensional laminated neural retina and other ocular structures from human embryonic stem cells. Stem Cells. 33, 2416-2430 (2015).
- Gonzalez-Cordero, A., Kruczek, K., et al. Recapitulation of human retinal development from human pluripotent stem cells generates transplantable populations of cone photoreceptors. Stem Cell Reports. 9, 820-837 (2017).
- Eiraku, M., Takata, N., et al. Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature. 472, 51-56 (2011).
- Meyer, J. S., Shearer, R. L., et al. Modeling early retinal development with human embryonic and induced pluripotent stem cells. Proceedings of the National Academy of Sciences of the United States of America. , 16698-16703 (2009).
- Reichman, S., Slembrouck, A., et al. Generation of storable retinal organoids and retinal pigmented epithelium from adherent human ips cells in xeno-free and feeder-free conditions. Stem Cells. 35, 1176-1188 (2017).
- Chen, G., Gulbranson, D. R., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8, 424-429 (2011).
- Croze, R. H., Buchholz, D. E., et al. ROCK inhibition extends passage of pluripotent stem cell-derived retinal pigmented epithelium. Stem Cells Translational Medicine. 3, 1066-1078 (2014).
- Eberle, D., Schubert, S., Postel, K., Corbeil, D., Ader, M. Increased integration of transplanted CD73-positive photoreceptor precursors into adult mouse retina. Investigative Ophthalmology & Visual Science. 52, 6462-6471 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon