Method Article
Производство белка эластина как гидрогели для инкапсуляции и иммуноокрашивания клеток в 3D
В этой статье
Резюме
Рекомбинантный белок инженерии гидрогели являются выгодными для 3D клеточной культуры, поскольку они позволяют для полной перестройки полимера позвоночника и, следовательно, микроокружения клеток. Здесь мы описываем процесс очистки рекомбинантных белков эластина как и его применение в 3D гидрогеля клеток инкапсуляции.
Аннотация
Двухмерный (2D) культуры ткани методы имели важнейшее значение для нашего понимания фундаментальных клеточной биологии. Однако отсутствие систем традиционные 2D культуры ткани, матрицу трехмерного (3D), что привело к значительному разрыв между результаты собраны в пробирке и в естественных условиях. Чтобы устранить это ограничение, исследователи инженерии 3D гидрогеля культуры ткани платформ, которые могут имитировать биофизических и биохимических свойств микроокружения клеток в естественных условиях . Это исследование побудило необходимость разработки материалов платформ, которые поддерживают 3D клеток инкапсуляции и ниже по течению биохимических анализов. Рекомбинантный белок Инжиниринг предлагает уникальный набор инструментов для 3D гидрогеля материал дизайн и развития, позволяя для определенного контроля последовательности белка и, следовательно, выдвижением, потенциальные механических и биохимических свойств результирующей Матрица. Здесь мы представляем протокол для выражения recombinantly производные эластин как белка (ELP), который может использоваться для формы гидрогели самостоятельно перестраиваемый механических свойств и концентрации клеток клей лиганда. Мы далее представить методологию для инкапсуляции ячейки в пределах ELP гидрогелей и последующего immunofluorescent окрашивание встроенных клетки течению анализа и количественной оценки.
Введение
За последнее столетие двухмерный (2D) тканевой культуры превратился в составной набор инструментов для изучения основных клеток биологии в пробирке. Кроме того относительно недорогих и простых протоколов для 2D клеточной культуры привели к его принятию во многих биологических и медицинских дисциплин. Однако последние исследования показали, что традиционные 2D платформы может привести к результатам, что отклоняться заметно от этих собранных в естественных условиях, вызывая драгоценное время и средства впустую клинически ориентированных исследований1,2, 3. Мы и другие предполагают, что это расхождение может объясняться отсутствием родной биохимические и биофизические подсказки для ячейки, культивируемых на 2D-поверхностей, которые могут быть необходимы для оптимального распространения и созревания различных типов клеток.
Для устранения этих ограничений и помочь мост разрыва между 2D in vitro и in vivo исследования, исследователи имеют развитые трехмерные (3D) гидрогеля платформ для клеток инкапсуляции1,4,5 ,6. Гидрогели являются идеальным материалами для пилки эндогенного микроокружения внеклеточного матрикса (ECM) в естественных условиях из-за их механические свойства ткани, как и вода опухшие структуры, которая позволяет быстрый транспорт питательных веществ и сигнализации факторы7,8. Кроме того 3D гидрогели могут быть разработаны для независимого контроля над механических и биохимических свойств леса. Матрица механика9,10,,1112 и клеток клей лигандов13,,1415 хорошо известны влиять на клетки поведение в пробирке и в vivo. Таким образом 3D гидрогели с перестраиваемой свойства предлагают платформу для изучения причинно-следственных связей между клетками и их микроокружения. Критерии для идеального 3D гидрогеля матрицы включают простой, не цитотоксических клеток инкапсуляции, а также независимые перестройки физиологически соответствующих механических свойств и имитирует родной клеток клей мотивов.
Оба синтетические (например., полиэтиленгликоль, полимолочной кислоты, поли (гликолевая кислота)) и естественно производные (например., альгинат, коллаген, Matrigel) гидрогели имеют преимущества над 2D в vitro культуры платформ; Однако они также имеют существенные недостатки, ограничивающие их применимости. Во-первых, многие синтетические и естественно производные платформ требуют суровых сшивки условий, которые могут быть потенциально токсичными для клеток млекопитающих, ведущих к снижение жизнеспособности клеток7. Кроме того многие синтетические платформ не хватает родной биологическую и нужно быть функционализированных через вторичных химических реакций, которые можно добавить повышение стоимости и сложности16. Наконец в то время как естественно производные материалы обычно содержат встроенные био активных доменов, они часто страдают от высокой изменчивости партии к партии и часто ограничиваются формирования относительно слабый гели7,17.
Рекомбинантный белок инженерии представляет уникальный набор инструментов для дизайна материалов, позволяя явный контроль над последовательности белка и выдвижением, потенциальные механических и биохимических свойств окончательного гидрогеля эшафот18. Кроме того используя известные биологического механизма Escherichia coli (E. coli) выразить белков, могут изготавливаться материалы эффективно и последовательно с ограниченной Интер - и интра Пакетная изменчивости. Эластин подобных белков (ELP) представлены здесь имеет три инженерии доменов: (1 T7 и His6 тег, который позволяет для маркировки через дневно меткой антител, (2 «эластин как» регион, который наделяет упругой механических свойств и позволяет для химического сшивки и (3) «био активных» регион, который кодирует для клеток клей мотивы.
Наш регион эластин как основана на канонической (Валь-Pro-Gly-Xaa-Gly)5 эластина последовательности, где четыре из Xaa сайты аминокислоты изолейцина (Ile), но может быть разработан, чтобы быть любой аминокислот Кроме пролина. Эта последовательность наделяет рекомбинантных ELPs с нижней температуры (СМЕШЕНИЯ) поведением критические решения, которые могут быть использованы для простой очистки после выражения через тепловые Велоспорт19,20. Это свойство СМЕШЕНИЯ могут быть настроены для термически совокупных при разных температурах, изменяя гость «Xaa» остатков21,22.
Здесь «Xaa» позиции на одном из пяти повторений эластин как была заменена Амин представляя лизина (Lys) аминокислота, которая используется для сшивания гидрогеля. Наши предыдущие работы показал не цитотоксических и надежные сшивки реакции с Амин реактивный сшивателя тетракис (гидроксиметил) фосфониевых хлорид (THPC)23. По различной общее содержание и сшивателя концентрацию белка мы в состоянии производить гидрогели, которые могут быть настроены для диапазона23,9,физиологически соответствующей жесткости диапазона (~0.5-50 кПа)24. Помимо Тюнинг механических свойств, клеточной адгезии в пределах гидрогеля результаты от интеграции канонических клеток клей домены в пределах костяк ELP белка. Например включение расширенной фибронектин производные «RGDS» аминокислотной последовательности позволяет для клеточной адгезии и конформационные гибкость, а омлет, обязательной «RDGS» вариант ограничивает ячейки матрицы адгезии24. Путем модулирования соотношение клеток клей для не клей белков, а также концентрации общего белка, мы способны эффективно производить гидрогели, которые охватывают широкий спектр лигандом концентрации. Resultantly мы разработали платформу гидрогеля с развязкой биохимические и биофизические свойства, которые могут быть настроены независимо для оптимального 3D культуры различных типов клеток.
Помимо матрицы жесткости и клей лигандом перестройки рекомбинантных гидрогели предлагают возможности для разработки конкретных деградации материала профилей, который необходим для распространения клеток, распространением и миграции в рамках 3D контексте4 , 9. Эта деградация обеспечивается клеток секрецию протеаз, которые специально направлены на расширенной «RGDS»9 или эластин как последовательность25. ELP гидрогели, также было показано, для поддержки последующих биохимических анализов, которые необходимы для изучения жизнеспособности клеток и функции, включая immunocytochemistry, а также извлечения ДНК/РНК/белков для количественных реверс транскрипции полимеразной цепной реакции (qRT-PCR) и западной помарки9. ELP варианты также были использованы в ряде моделей в естественных условиях и, как известно, быть хорошо переносится иммунной системы26.
Вместе взятые, ELP как материальный платформу для исследования клеток инкапсуляции предлагает широкий спектр преимуществ по сравнению с синтетической или естественно производного материала платформы, которые зачастую не имеют такую же степень биохимические и биофизические перестройки и воспроизводимость. Кроме того, ПЭП простой и не цитотоксических использования с широкий спектр типов клеток (например., куриных Спинной корень ганглиев14,24, мышиных нейронных прародитель клетки9, человека мезенхимальных стволовых клеток27, говяжьи новорожденных хондроцитов28, человека эндотелиальных клеток29,30) позволяет для более физиологически соответствующие модели эндогенного 3D ECM, по сравнению с 2D клеточной культуры. Здесь мы представляем протокол для выражения recombinantly производные, ELPs для использования в качестве платформы перестраиваемый Гидрогель для 3D мобильных инкапсуляции. Далее мы представляем методологии вниз по течению люминесцентные маркировки и confocal микроскопии инкапсулированных клеток.
протокол
1. ELP выражение протокол
- День 1: Рост колонии стартера
- Подготовьте Ампициллин и Хлорамфеникол Агар пластины, автоклавирования 25 g Лурия бульон и 15 г агара на 1 Л ультрачистая вода. После того, как раствор остынет до ~ 60 ° C, добавьте 1 mL ампициллин запасов (100 мг/мл в ультрачистая вода) и 1 мл бульона Хлорамфеникол (34 мг/мл в 70% этиловом спирте) до 1 Л раствора агар для окончательного концентрации 100 мкг/мл и 34 мкг/мл , соответственно. 20 мл окончательного решения передать 10 см Петри с Серологические Пипетки и позволяют агар затвердеть. Оберните Петри с парафина и хранить при 4 ° C.
Примечание: Петри могут храниться при температуре 4 ° C на срок до двух недель. - Полоска небольшой образец BL21 pLysS E. coli (DE3) из готовых бактериальных запасов, содержащих pET15b вектор кодирования ELP интерес на Ампициллин и Хлорамфеникол Агар пластины.
Примечание: Ампициллин и хлорамфеникол выбрать для бактерии, содержащие векторов pET15b и pLysS, соответственно. - Переверните пластину прожилками в инкубаторе при 37 ° C. Разрешить колонии бактерий расти на ночь.
Примечание: Не инкубировать пластины для более чем 16 h, как Ампициллин будет деградировать и могут образовывать колонии, которые не осуществляют ампициллин сопротивления.
- Подготовьте Ампициллин и Хлорамфеникол Агар пластины, автоклавирования 25 g Лурия бульон и 15 г агара на 1 Л ультрачистая вода. После того, как раствор остынет до ~ 60 ° C, добавьте 1 mL ампициллин запасов (100 мг/мл в ультрачистая вода) и 1 мл бульона Хлорамфеникол (34 мг/мл в 70% этиловом спирте) до 1 Л раствора агар для окончательного концентрации 100 мкг/мл и 34 мкг/мл , соответственно. 20 мл окончательного решения передать 10 см Петри с Серологические Пипетки и позволяют агар затвердеть. Оберните Петри с парафина и хранить при 4 ° C.
- День 2: Подготовка начинающих культуры и выражения СМИ
- Удалите из инкубатора культуры е. coli . Парафина пластину и хранилище для максимум 4 дней при 4 ° C.
- Подготовьте стартовые культуры колбу (250 мл) и выражения культуры колбы (12 x 1 Л) и автоклав. На 1 Л выражения СМИ добавить 47.6 g потрясающий бульона и 4 мл глицерина в 1 Л сверхчистой воды в колбу озадачен культуры 2 Л и крышка с алюминиевой фольгой.
Примечание: Типичный урожаи, 60-100 мг/Л белка выражения СМИ. - Загрузить газобетона стартер в подогретым, пожимая инкубатора 37 ° C и инкубировать без агитации.
- Добавьте 250 мкл акций стерильной фильтрации (0.22 мкм фильтром) ампициллин (100 мг/мл в ультрачистая вода) для закваски для конечной концентрации 100 мкг/мл. Немедленно начнете, агитируя закваски на 250 об/мин.
Примечание: Хлорамфеникол используется только для выбора колонии на плитах агара и не включается для жидких культур. - Прививок закваски, добавив один ELP плазмида содержащих E. coli колонии с прожилками плиты и позволяют закваски пожать при 37 ° C для 16 h.
- Поместите выражение культуры средств массовой информации, которую колбы в предварительно разогретую, 37 ° C, автоклавы-смесители и инкубировать на ночь без агитации, так что колбы готовы прививок на следующее утро.
- День 3: Склонение выражение протеина в E. coli
- Сделайте свежий, стерильной фильтрации ампициллин фондовой (100 мг/мл в ультрачистая вода). Добавьте 1 mL ампициллин запасов для каждого настой выражения СМИ для конечной концентрации 100 мкг/мл.
- Начните, агитируя выражение СМИ на 250 об/мин.
- Взять образец 2 мл средства массовой информации из любого выражения колбу и добавить в кювет как пропуск для оптической плотности, чтение на 600 Нм (600OD).
- После завершения 16 h стартовые культуры инкубации прививать каждое выражение колбу путем передачи 20 мл закваски для каждого выражения настой через Серологические Пипетки.
- После завершения 1 h агитации Измерьте ОД600 одного из фляги выражение. После этого шага Измерьте ОД600 каждые 20 мин, проверка другой колбе каждый раз.
- В ОД600 0,6 Снизьте температуру шейкеры, содержащий выражение колбы до 32 ° C.
- Проверка ОД600 каждые 10 мин. В ОД600 0,8 побудить выражение, добавив 1 мл 1 м, стерильной фильтрации β-изопропиловый thiogalactoside (IPTG) в сверхчистого воды для каждого выражения колбу.
- Разрешить E. coli в колбах выражение выразить за 7 мин.
- 20 мин до конца выражения, предварительно охлаждать большие напольные центрифуги до 4 ° C.
- Соберите все 12 L выражение СМИ в отдельных центрифуги контейнеров и баланса.
- Центрифуга для выражения СМИ на > g 12000 x 15 мин при 4 ° C, с помощью напольные центрифуги.
- Слить супернатант из каждого контейнера центрифуги. С помощью шпателя, соберите клетки окатышей в предварительно взвешенный zip lock мешок.
- Вновь приостановить гранулы в стерильной фильтрации десять буфера (100 мл буфера на 25 г гранул) и удалите избыток воздушные пузыри, массируя гранулы. На 1 Л десяти буфера добавьте 5,8 г натрия хлорида, 1.21 g tris база и 0,37 g Этилендиамин tetraacetic кислоты (ЭДТА) динатриевой соли дигидрат 900 мл ультрачистая вода. Отрегулируйте пэ-аш до 8.0 и довести до 1 л. Для этого шага рН полоски являются достаточными.
- Поместите zip-lock мешок, содержащий вновь приостановлено клеток Пелле в вторичный контейнер и заморозить при температуре-80 ° C на ночь.
- 4-6 день: сверлении клеточной стенки бактерий через циклов замораживания оттаивания
- Удаление замороженных гранулы из морозильника и позволить ему медленно оттепели на 4 ° C с нежным агитация с использованием орбитальный шейкер.
- Разрешить Пелле таять до тех пор, пока некоторые жидкости присутствует. Добавить ~ 30-40 мг в дезоксирибонуклеаза я (DNase), чтобы разморозить lysate. Кроме того добавьте 1 мл 100 мм phenylmethylsulphonyl фтора (PMSF; ингибитор протеазы) в изопропаноле на 100 мл lysate клетки. Разрешить lysate трясти на ночь.
Примечание: Добавление DNase и PMSF необходим только для первого цикла замораживания оттаивания.
Предупреждение: PMSF токсичен при вдыхании. Маска должна использоваться при обработке PMSF порошок. - После того, как полностью разморожен lysate клетки, заморозить lysate-80 ° c на ночь, или до полностью заморожены.
- Повторите процедуру замораживания оттаивания для в общей сложности трех циклов. Оставьте lysate разморозить при температуре 4 ° C после последнего замораживания оттаивания. Магазин 100 мкл сырья lysate анализа натрия Додециловый сульфат полиакриламидных гель электрофореза (SDS-PAGE) по завершении очистки.
- После последнего оттепель скорректировать рН талой lysate 9.0 с помощью 1 M NaOH. Для этого шага рН полоски являются достаточными. Инкубируйте на 4 ° C, по крайней мере 1 часа (ночь подходит) на орбитальный шейкер.
- 7-9 день: ELP очищение через холодного и горячего отжима тепловой Велоспорт
- Прохладный пол центрифуге до 4 ° C 20 мин до центрифугирования.
- Алиготе и баланс талой lysate в центрифуге контейнеры.
- Центрифугуйте образцы на > 15000 x g за 1 час при 4 ° C. Магазин 100 мкл супернатант для анализа SDS-PAGE после завершения очистки.
Примечание: После центрифугирования, ELP белка должны оставаться в надосадке из-за его высокой растворимости в воде при температуре ниже ее СМЕШЕНИЯ (< 32 ° C). - Передача супернатант новых центрифуг контейнеров и надлежащим образом сбалансировать.
- Добавление хлорида натрия (NaCl) в трех частях в конечной концентрации 1 м (5.84 г NaCl на каждые 100 мл супернатант). Убедитесь, что NaCl добавляется в трех частях для достаточного растворения.
- Агитируйте за 3 ч при 37 ° C на 250 об/мин в тряску инкубатора.
- 1 час до конца агитации, предварительно теплый пол центрифуге до 37 ° C.
- Центрифуга на > 15000 x g за 1 ч при 37 ° C. Хранить 100 мкл супернатант для анализа SDS-PAGE после завершения очистки и отменить оставшиеся супернатант.
Примечание: После центрифугирования, белок ELP следует гранулированных в из-за его низкой растворимостью в воде при температуре выше его СМЕШЕНИЯ (> 32 ° C). - Вновь приостановите гранулы, добавив 10 мл газобетона, сверхчистый воды на 1 г гранул. Использование металлической лопаткой пюре гранулы для помощи в распада белка.
- Отрегулируйте pH талой lysate 9.0 с помощью 1 M NaOH. Для этого шага рН полоски являются достаточными.
- Агитируйте на ночь при 4 ° C на орбитальный шейкер.
- Повторить процедуру циклирования, холодного и горячего отжима тепловой для в общей сложности трех циклов (т.е., повторите шаги 1.5.1 через 1.5.11 три всего цикла).
- 10-15 день: ELP диализа и лиофилизации
- Центрифуга вновь приостановлено гранулы в предварительно охлажденной центрифуге на > 15000 x g за 1 час при 4 ° C. Магазин 100 мкл супернатант для анализа SDS-PAGE после завершения очистки.
- Опреснения раствор белка, dialyzing оставшиеся супернатант в мембране диализа 3.5 кДа против 4 L предварительно охлажденные ультрачистая вода при 4 ° C. Меняйте воду диализа дважды в день в течение в общей сложности 6 раз на 3 дня.
Примечание: Типичный супернатанта томов, между 5 и 30 мл. - Центрифуга dialyzed решение в центрифугу предварительно охлажденным в > 15000 x g за 1 час при 4 ° C. Магазин 100 мкл супернатант для анализа SDS-PAGE в конце очистки.
- Заморозить результирующей супернатант в-80 ° C в предварительно взвешенный конические трубы.
- Lyophilize замороженные решение для 3 дней и массы конечного продукта для определения белка урожая.
- Парафина пробирки, содержащие финале лиофилизированный ELP продукта и хранить при 4 ° C.
- Запустите SDS-PAGE чтобы определить чистоту белка.
Примечание: Протоколы для SDS-PAGE будет различаться в зависимости от условий конкретных агарозы гель. Для наших экспериментов окончательный лиофилизированные белка был распущен в концентрации 0,5 мг/мл в деионизированной воде и работать на 140 V для 70-100 мин в гель акриламида 12% (w/v) под денатурации условий.
2. ячейки Инкапсуляция в 3D эластин подобных белков гидрогели
- Подготовка силиконовые формы
- Используйте биопсии удар с нужного диаметра для создания отверстия в листе силиконовые толщиной 0,5 мм и Вырезать квадрат вокруг каждого отверстия. Повторите для количество требуемой формы.
Примечание: Диаметр и толщину формы могут корректироваться для конкретного приложения и условий культуры клеток. На практике, для культур клеток 50 106 клеток/мл, толщиной 0,5 мм прессформы с 4 мм и диаметром 5 мм, рекомендуется для достаточно ДНК/РНК и белка добычу, соответственно. Для иммуноокрашивания 2 мм биопсии удар может использоваться вместо этого создавать три смежных отверстий за квадратный плесень, так что три реплицирует могут быть окрашены в хорошо. - Удаление полиэтиленовой пленкой на каждой стороне отдельных форм с помощью пинцета.
Примечание: Избегайте контакта с поверхности подвергаются силикона, как загрязнение может уменьшить будущие плазмы, склеивание эффективности. - С помощью пинцета, организовать одинаковое количество голые силиконовые формы и coverslips стекла (№ 1, диаметр 12 мм) в чередующихся строках на крышке Перевернутый 48-ну плиты. После завершения, покрывают крышкой пластину 48-хорошо, чтобы избежать загрязнения.
- Кислородная плазма лечить весь 48-ну пластина крышки (т.е., плесени и стеклянных скольжениях). Сразу же после этого используйте щипцы для инвертировать силиконовые формы на прилегающих стекла coverslip. Нажмите твердо на плесень, чтобы обеспечить надлежащую степень склеиваемости. Пусть формы инкубации при комнатной температуре в течение 1 ч.
Примечание: Продолжительность кислородной плазмы лечения будет варьироваться в зависимости от инструмент используется. Типичные условия для нашего инструмента являются рабочее окно давления газа между 0,3-4 мбар, кислорода газового потока в3мин. 20 см и пример воздействия плазмы для s 10-20. - Стерилизация автоклавированием формы. Магазин формы при комнатной температуре в стерильных условиях до использования.
Примечание: Формы может храниться на данном этапе на неопределенный срок.
- Используйте биопсии удар с нужного диаметра для создания отверстия в листе силиконовые толщиной 0,5 мм и Вырезать квадрат вокруг каждого отверстия. Повторите для количество требуемой формы.
- Подготовка Стоковый раствор белка эластина как
- Удаление лиофилизированные ELP из 4 ° C для хранения. Теплый белка до комнатной температуры перед открытием трубки для обеспечения без конденсации основывается на белок над многократного использования.
- Растворить в Дульбекко фосфат амортизированное saline (DPBS) на 4 ° C с постоянным перемешиванием ELP (т.е., спиннинг) на ночь.
Примечание: ELP Стоковый раствор концентрации будет дополнительно разрежается с добавлением раствора сшивателя на определяемые пользователем объемный коэффициент. Например для окончательного ELP концентрации 3% (w/v), подготовьте 3,75% (w/v) ELP запасов решение, которое будет разведен в соотношении 4:1 объемного решения решение: сшивателя ELP. Отрегулируйте концентрацию как необходимые для нужного приложения. - Стерильные фильтр ELP Стоковый раствор с помощью шприца фильтра 0.22 мкм. Хранить ELP на льду когда не в пользе.
- В области биобезопасности кабинета передачи стерильных форм, с использованием стерильных пинцетов к пластине 24-ну культуры ткани.
- Подготовка THPC раствор
- Развести THPC в DPBS просто предварительного использования. Отрегулируйте концентрацию раствора THPC согласно конечная концентрация ELP и желаемого сшивки соотношение.
Примечание: Для протокола, окончательный ELP концентрации 3% (w/v) производится путем смешивания ELP Стоковый раствор с THPC раствора в объемном соотношении 4:1. Корректировать по мере необходимости. - 2.6 мкл раствора THPC (80% в воде), для 997.4 мкл DPBS.
Примечание: Эта концентрация THPC соответствует стехиометрического соотношения 1:1 гидрокси метильных групп на THPC и первичных аминов ELP белка при смешивании решения на описанных объемный коэффициент 4:1 для окончательного гидрогеля ELP 3% (w/v). Решение THPC вязкой и капель раствора может прилипнуть к стороне кончика пипетки. Точные концентрации Избегайте таких капель когда разбавления в DPBS. Очистите контейнер штока THPC азотом для предотвращения окисления фосфина и инактивации сшивателя. - Вихрь решение смешивать и держать на льду.
- Стерильные фильтр THPC складе решения с помощью шприца фильтра 0.22 мкм. Разбавить THPC Стоковый раствор далее с стерильных DPBS для достижения более низкое соотношение стехиометрическим сшивки (например., 0.5:1 или 0.75:1).
Примечание: THPC кислород чувствительной, и разбавленный раствор следует использовать в течение нескольких часов после приготовления.
- Развести THPC в DPBS просто предварительного использования. Отрегулируйте концентрацию раствора THPC согласно конечная концентрация ELP и желаемого сшивки соотношение.
- Разбить ячейки по инкубации с трипсина-ЭДТА в одну ячейку подвеска, Пелле клетки и подсчитать ячейки, вновь приостановлено в среде с помощью Горяева.
Примечание: Точное протоколы для этого шага будет зависеть сильно нужной ячейки типа и приложения. Для нейронных прародитель ячеек, которые используются на протяжении всего этого протокола было проведено 0,025% трипсина-ЭДТА инкубации при комнатной температуре для 1,5 мин. Клетки были гранулированных на 200 x g на 2 мин. Для жизнеспособности рост клеток клеток должно быть приостановлено в обычных средних условиях. Типичный клеток плотности используется для инкапсуляции диапазон ячеек от 1-50 106 клеток/мл окончательного гидрогеля тома. Корректировать по мере необходимости. - Алиготе нужное количество клеток в стерильных 1,5 мл пластиковых пробирок.
- Центрифуга клетки на ~ 200 x g на 3 мин тщательно, аспирационная супернатант и сохранить клетки гранул на льду.
Примечание: Важно, чтобы полностью удалить все супернатант смягчения дальнейшего разбавления ELP и THPC сшивателя. Конкретные центрифугирования скорости будут зависеть от типа ячейки. - Вновь приостановить Пелле клеток в ELP Стоковый раствор, таким образом, что объем составляет 80% от конечного объема (предполагая в соотношении 4:1 ELP решение: THPC раствора). Пипетка микс 20 - 25 раз для получения однородной смеси клеток и ELP.
Примечание: Во избежание захвата в нижней части трубки для смягчения последствий повышения температуры и последующих фазового перехода ELP. Плесень каждый 2 мм с тремя реплицирует требует 7.5 мкл заключительного тома (т.е., 6 мкл ELP Стоковый раствор и 1,5 мкл THPC раствор) поровну разделены на 3 отверстия (т.е., 2.5 мкл окончательный объем в отверстие). Для формы 4 и 5 мм окончательный объем 7,5 мкл и 15,5 мкл требуется, соответственно. - THPC запасов решение добавьте ячейки/ELP подвеска для окончательный объем оставшихся 20%. Пипетка микс 20 - 25 раз для получения однородной смеси.
- Сразу же Пипетка соответствующие окончательные объемы клеток/ELP/THPC смеси в каждом плесень на круговом движении. Повторите для всех форм.
- Проинкубируйте образцы при комнатной температуре 15 мин, следуют дополнительные инкубации при 37 ° C 15 мин.
Примечание: Первый инкубационный период поможет облегчить первоначальный сшивки гидрогеля перед повышением температуры, выше ELP СМЕШЕНИЯ и заставить его тепловой фазы сегрегации. - Медленно мкл 750 теплых клеток питательной среды для каждой скважины 24-ну пластины, избегая нарушая гели.
- Инкубируйте гидрогели при 37 ° C в течение 7 дней.
Примечание: Полный среднего изменения рекомендуется каждые 1-2 дней в зависимости от типа ячейки. Ограничить нагрузку на гель, используйте стекло, пипетка Пастера, проставленный с кончиком пипетки 200 мкл, когда аспирационных среднего из колодца.
3. Immunocytochemistry клеток в 3D ELP гидрогели
- Приготовляют раствор фиксации, смешивая параформальдегида 16% (w/v) 10 мл (PFA) в 30 мл DPBS. Теплый раствор до 37 ° C.
- Аспирационная среднего от 24-ну пластины и осторожно промыть с 1 мл DPBS.
- 750 мкл раствора фиксации для каждой скважины и инкубировать при 37 ° C за 30 мин. Не использовать инкубатор культуры ткани во избежание загрязнения других культур с PFA паров.
- Тщательно удалить решение фиксации от каждой скважины, отбрасывая ПФА в контейнере соответствующего опасных отходов.
Предупреждение: Воздействие PFA может вызвать раздражение кожи и глаз. Носите перчатки/очки и работать в химической зонта. - Добавьте 1 мл DPBS для каждого образца. Немедленно аспирационная DPBS и отбросить в PFA контейнер для отходов.
- Стирайте образцы дважды с 1 мл DPBS за 10 мин.
Примечание: Образцы можно хранить в DPBS на 4 ° C на срок до недели после запаечная пластина с парафина. - Разрушения каждого образца с 750 мкл раствора permeabilization (100 мл DPBS и 0,25 мл Тритон X-100; PBST) за 1 ч при комнатной температуре на рокер на 15 об/мин.
- Аспирационная PBST и 750 мкл преграждая разрешение (95 мл PBS, 5 g бычьим сывороточным альбумином (БСА), 5 мл сыворотки и 0,5 мл Тритон X-100) для каждого образца. Инкубации при комнатной температуре 3 h на рокер на 15 об/мин.
Примечание: Блокирование решения должен содержать сыворотки от видов хост, в котором были подняты вторичные антитела (например., коза, осел) и стерильные фильтруют через 0,22 мкм фильтр перед использованием. - Приготовляют раствор разбавления антитела (97 мл DPBS, 2,5 г BSA, 2,5 мл сыворотки (от же хост видов как шаг 3,8) и 0,5 мл Тритон X-100). Разбавить основное антитело, используя раствор антител разрежения и 500 мкл раствора для каждого образца. Печать пластины с парафина и инкубировать на ночь при 4 ° C на рокер.
Примечание: Нестин и Sox2 первичного антитела были разбавленных 1: 400 в растворе разбавления антитела от производителей оригинальных концентрации. - Аспирационная раствор антител от каждого образца и стирать образцы с PBST 60 мин при комнатной температуре на рокер на 15 об/мин. Мыть повторите 3 раза.
- Разбавленных вторичных антител и 5 мг/мл фондовая DAPI (1:2, 000) с использованием решения разбавления антитела и 500 мкл раствора для каждого образца. Крышка 24-а с алюминиевой фольгой и инкубировать на ночь при 4 ° C на рокер.
Примечание: Как вторичные антитела светочувствительных, образцы должны быть защищены от Фотообесцвечивание для всех последующих шагов. Анти мыши и коза анти кролик вторичные антитела козочки были разбавленных 1: 500 в растворе разбавления антитела от производителей оригинальных концентрации. - Аспирационная раствор антител от каждого образца и стирать образцы с PBST за 30 мин при комнатной температуре на коромысле. Мыть повторите 3 раза.
- Расположите капли среднего hard-set монтажа на поверхность стекла слайда. С помощью щипцов, удалите излишки раствора из формы, слегка промокательной край плесень на бумажное полотенце. Тщательно место плесень вниз на носитель монтажа и избежать пузырей.
- Разрешить монтажа средних и затвердеть в течение 48 ч при комнатной температуре. Хранить образцы при комнатной температуре или 4 ° C. Позволяют монтаж среднего полностью установить за 48 ч до изображений как показатель преломления среды будет меняться в течение упрочнения. Печать образцов стекла Крышка слайд с четкой Лак для уменьшения загрязнения или образец движения.
- Изображения образцов с помощью конфокального микроскопа.
Результаты
ELPs, используемые в настоящем Протоколе состоят из пяти регионов: тег T7, тег His6, сайт расщепления enterokinase (EK), био активных региона и эластина как региона (рис. 1). Теги T7 и His6 позволяют легко идентифицировать через стандартный иммуноблоттинга методов. Введение на сайте расщепления ЭК позволяет для ферментативного удаления тега региона, при необходимости. Био активные региона кодирует для расширенного, фибронектин, полученных клеток клей («RGDS») или не клей («RDGS») последовательности. Наконец Центральный повтор эластин как региона содержит лизина группу остатков гость на сайте, который позволяет сшивки через THPC, в то время как фланкируя повторяет содержат изолейцина для достижения СМЕШЕНИЯ ~ 32 ° C31.
Пост выражение, SDS-PAGE или Западная помарка может использоваться для визуализации молекулярный вес и подтвердить личность ELPs, которые содержат антитела теги, например T7 (MASMTGGQQMG) или His6 (HHHHHH) (рис. 2). Успешный выражение в контролируемых условиях дает весьма однородной продукции, представленной присутствие одной темные полосы на приблизительное молекулярный вес (~ 37 кДа) этих белков, используя оба SDS-PAGE (рисунок 2A) и западной помарке) Рисунок 2B).
В неконтролируемых условиях наличие нижней молекулярного веса полос на западной помарке предполагает, что некоторые фракции белков не была полностью переведена и/или были деградировавших после выражения (рис. 2 c). В частности масс здесь равномерно распределены по ~ 9 кДа, который примерно соответствует вес одного региона био активных и трех эластин подобных регионов («повторить»), или приблизительно четвертая часть целевого белка. Эти небольшие фрагменты белка обычно присутствуют, когда выражение осуществляется при более высокой температуре (> 32 ° C) как показано на рисунке 2 c. Наличие этих нижней низкомолекулярных белков может привести к непредсказуемым механических свойств. Таким образом регулярного скрининга выражение пост рекомендуется обеспечить высокое качество конечного продукта.
Механическая жесткость гидрогели на основе ELP может быть изменен путем манипулирования концентрации ELP или отношение THPC реактивной группы: ELP первичных аминов. Одновременно концентрация клеток клей лигандов могут быть настроены путем изменения соотношения ELP варианты с клетки клей (RGDS) для не клей (RDGS) последовательности в рамках любого режима жесткость. Изменяя эти две переменные, мы можем производить гели, которые имеют спектр механических свойств и лигандом концентрации (рис. 3).
Для инкапсуляции клетки внутри 3D ELP гидрогели, требуемое количество клеток приостановлено в средне- и центрифугировали производить гранулы клеток (рис. 4A). Средний придыханием из трубки, и клетки являются вновь приостановлено равномерно в решении ELP желаемой концентрации. Далее THPC раствор добавляется подвеска клеток/ELP и тщательно накапаны до образования однородной смеси. Это решение быстро переведен в стерильных силиконовые формы в пределах 24-ну пластину с помощью пипетки и разрешено crosslink при комнатной температуре и 37 ° C 15 мин каждый (рис. 4В). Наконец средство добавляется хорошо пластины и инкубировали при 37 ° C в эксперименте.
Пятнать жить/мертвые может использоваться для оценки жизнеспособности клеток и инкапсуляции успешных ячейки в пределах гидрогели ELP. Как показано на рисунке 5, взрослых мышиных прародитель нейронных клеток (НПС) Показать жизнеспособность клеток высокой свыше 7 дней в течение 3% (w/v) ELP гидрогеля.
3D ELP гидрогели было ранее показано, к обслуживанию NPC ствола измеряется через выражение канонических NPC белковых маркеров SRY (секс определение региона Y)-Вставка 2 (Sox2) и Нестин9. НИПы, инкапсулированные в 3% (w/v) ELP гидрогели с низкой THPC сшивки шоу высокая экспрессия-локализованных Sox2 и цитоплазматических Нестин нити через иммуноокрашивания и конфокальная томография (рис. 6).

Рисунок 1 : Схематическое представление ELP и соответствующие аминокислотных последовательностей. ELP, используемые в данном исследовании содержится тег T7 и His6 для обработки изображений на основе антител, биоактивных региона для введения клеток клей доменов и эластин как региона, которая наделяет упругой механических свойств и позволяет для химической сшивки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
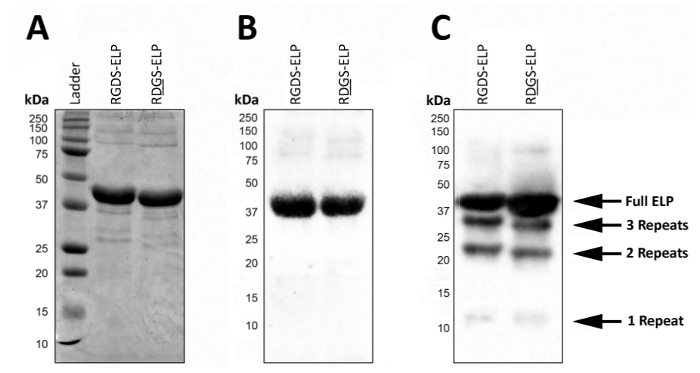
Рисунок 2 : Целевое выражение протеина могут быть проверены с SDS-PAGE и западную помарку для подтверждения молекулярная масса и личность конечного продукта лиофилизированные. Чисто полнометражного ELP работает на молекулярный вес 37 кДа, как сообщает SDS-PAGE (A) и Западная помарка, используя T7 (MASMTGGQQMG) или гистидина 6 тег (HHHHHH) (B). (C). Impure партий ELP из-за отклонений в протоколе ELP выражение может привести к выражение ELPs с ниже, молекулярным весом. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
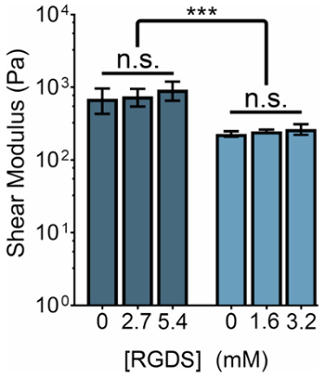
Рисунок 3: RGDS лигандом содержание могут быть настроены независимо от механических свойств в пределах ELP гидрогели. 5% (w/v) и 3% (w/v) ELP гидрогели имеют модули сдвига ~ 800 ПА и ~ 400 ПА, соответственно. Гидрогели с соотношением 1:1 THPC реактивной группы: ELP первичных аминов были высокоструктурированные при комнатной температуре в течение 15 мин, подогретой до 37 ° C и возможность сбалансировать 5 минут перед измерением. Данные являются среднее ± с.д., *p < 0,001. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Схема ячейки инкапсуляции в ELP гидрогели. (A). клетки первоначально отделить в одну ячейку подвеска в средне- и гранулированных с помощью центрифуги. Средний придыханием из трубки, и клетки являются вновь приостановлено в растворе ELP на желаемой концентрации и хорошо перемешивают. Наконец решение сшивки THPC и хорошо перемешивают. (B). сразу же после добавления THPC, решение будет брошена в силиконовые формы с пипеткой. Решение разрешается crosslink при комнатной температуре 15 мин, после чего второй инкубации 15 мин при температуре 37 ° C. Средний затем добавляется к культуре хорошо в течение всего эксперимента. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: Нейронных прогениторных клеток поддерживать высокую жизнеспособность в ELP гидрогели. Представитель изображение нейронных прогениторных клеток инкапсулированы в 3% (w/v) ELP гидрогели с 1:1 сшивки (THPC реактивной группы: ELP первичных аминов) после 7 дней в культуре. Зеленый: жить окрашивание (Флуорексон AM); Красный: мертвые окрашивание (ethidium Антуану). Шкалы бар = 100 мкм.
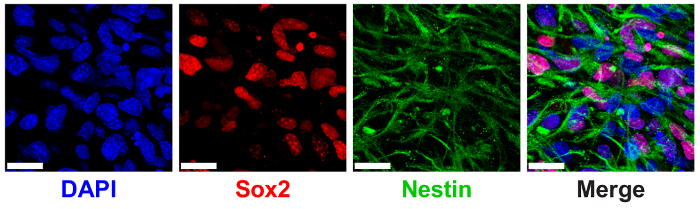
Рисунок 6 : 3D ELP гидрогели поддерживают нейронных прогениторных клеток стволовых чайник выражение. Иммунофлюоресценции изображение нейронных прогениторных клеток выражая Sox2 и Нестин белков после 7 дней культуры в гидрогели ELP. Изображения показывают ячейки, инкапсулированные в 3% (w/v) ELP гели с 0.5:1 сшивки (THPC реактивной группы: ELP первичных аминов). Синий: DAPI (ядер); Красный: Sox2; Зеленый: Нестин. Шкалы бар = 25 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Рекомбинантных белков и очистки является мощным инструментом для синтеза биоматериалов с высокой воспроизводимостью. Во многом обусловлено появлением коммерциализированной молекулярное клонирование, пользовательские рекомбинантных плазмид можно приобрести от нескольких поставщиков, что значительно сокращает время для работы с материалами, такими как ELPs. Аналогично плазмиды может запрашиваться непосредственно из источника лаборатории когда оригинальное произведение было поддержано Федеральным контракт и будущая работа будет для некоммерческого использования. Полная последовательность аминокислот ELP ранее опубликовал несколько вариантов ELP31. Однако процесс от выражения для окончательной очистки рекомбинантных белков включает в себя ряд важных шагов, которые часто может привести к снижение урожайности или ниже качества продукта. Некоторые из наиболее распространенных проблем для подготовки ELP возникают в одном из следующих действий: (1) качество хранимых бактериальных запасов, (2 первого замораживания оттаивания цикл сорвать бактериальной мембраны и очистки (3) белка через тепловые Велоспорт.
Основное различие между выражения протеина и других-биологических средств производства материалов является, что мы используя биологического механизма рекомбинантных хостов синтезировать полимеры. Впоследствии эта техника поставляется с уникальным ограничение: клеточную смерть или повреждения. Смерть клетки чаще всего проявляется как ограниченное количество бактериальных колоний после мелирование тарелку или аномально небольшими колониями, которые растут довольно медленно. Бактериальные запасов, если внимательно, может оставаться стабильным лет; Однако циклы последовательных замораживания оттаивания сбоя повторного использования или морозильник может уменьшить жизнеспособность клеток или приводят к повреждению ДНК. Типичный BL21 бактерий запасы использовать между 10% и 40% глицерина по объему, смешанного с отсрочкой клеток. Глицерин призвана уменьшить повреждение мембраны от Нуклеатор кристаллы льда при замерзании. Таким образом, использование низких концентрациях (< 10%) может привести к ослабленной мембраны, при более высоких концентрациях (> 40%) может подавить точки замерзания воды достаточно, чтобы где запасы никогда не замерзает приводит к гибели клеток. Однако даже в пределах оптимального глицерин уровней, бактериальных запасов должно не быть позволено полностью что оттепель как сочетание мембраны ущерба от повторного замораживания и цитотоксических эффектов от глицерина может привести к снижение жизнеспособности запасов и повреждение ДНК. Таким образом если видно, что бактериальные фондовом приводит к низкой колонии счетчик или что клетки делят последовательно медленными темпами (проявляется как медленный темп рамп600 ОД во время выражения), повторное преобразование плазмида и сделать новый запас является простой Первый подход для устранения этой проблемы. Имея это в виду и обеспечить долгосрочное содержание бактериальных запасов и целостности ДНК, лучше всего хранить копии ваших плазмида как очищенная ДНК, замороженные в воде и не внутри клетки. Хранение ДНК таким образом обеспечит что в непредвиденные события, такие как неудачной акции или морозильник неудачи, надежный источник оригинального ДНК может использоваться для преобразования.
Еще один важный шаг в изготовление ELP является очистка целевого белка от хоста выражение. Экстракции белка от кишечной палочки достигается путем ломать стены клетки с помощью затравок кристаллы льда, которые формируют течение приостановленных ячейки lysate после замораживания, который усугубляет с циклов подряд замораживания оттаивания. Альтернативные методы для сверлении клеточной стенки могут быть использованы как sonication или прессом. В частности подряд замораживания оттаивания lysate выгодно как только требует морозильной камерой и нет другого оборудования специальности. Однако эта процедура nonspecifically освобождает ДНК, РНК и белков загрязнителей, помимо протеаз, которые могут ухудшить целевого белка. Таким образом, чтобы избежать загрязнения и снижение урожайности, дезоксирибонуклеаза, я (DNase) и phenylmethanesulfonyl фтор (PMSF) добавляются к ячейке lysate деградации ДНК и препятствует протеаз, соответственно. Присутствие ДНК перед добавлением DNase можно наблюдать визуально как «тягучий» внешний вид на протяжении повторно подвесной клетки lysate после первой оттепели. DNase активно снижает ДНК и таким образом уменьшает вязкость ячейки lysate, что делает его легче очистить через центрифугирования. Оптимальное сломать ДНК может быть визуально подтверждена обеспечения что lysate клетки, как представляется, полностью жидкого и тягучий появление больше не видна. На практике мы наблюдали, что добавление ~0.1 мг DNase в lysate клетки мл достаточно для достижения необходимых деградации. Однако если по-прежнему наблюдается присутствие ДНК, больше DNase могут быть добавлены последовали еще два-три часа агитации. Аналогичная проблема может также возникнуть, если DNase добавляется преждевременно до любого из lysate имеет потенциал, чтобы достаточно оттепели. В этом случае холоднее температура может ограничить эффективность деградации ДНК из-за преждевременной инактивации DNase. Чтобы избежать этой проблемы, это часто лучший способ позволить вновь приостановлено Пелле таять приблизительно 8 часов до начала лечения с DNase. Кроме того Если сообщается низкопротеиновое урожайности и распад ДНК был недостаточным, Добавление более PMSF для дальнейшего снижения потенциальной деградации белка от протеаз могут потребоваться.
Дополнительные соображения для обеспечения оптимального выражение ELPs включают в себя тщательное понимание преимуществ и ограничений выбранной антибиотика. Здесь pET15b векторов, содержащий ампициллина сопротивления гена были использованы для выражения протеина. Функционально серии ПЭТ вектор предусматривают значительные белков с 50% экспрессии белков бактерий, посвященный целевого белка после успешного индукции32,33. Однако ампициллин как антибиотик выбор приходит с некоторыми ограничениями, которые могут помешать с оптимальным выражением. Во-первых деградации ампициллина присутствии E. coli быстро может произойти из-за выпуска бета лактамаз. Если достаточное количество ампициллин разлагается, ампициллина кодирования плазмида (т.е. плазмида ELP-кодирование) могут быть потеряны полностью. В результате когда выражая ELPs для более длинней продолжительности, уровнях выражения протеина должно тщательно контролироваться в точках раз подряд, чтобы обеспечить достаточное количество ELP-кодирование гена остается для обеспечения желательной выражения. Возможные методы для устранения неполадок накопление бета лактамаз включают спиннинг вниз закваски и повторного приостановления клетки антибиотик свободной среде до прививки средство выражения. Этот процесс эффективно ограничивает передачу унижающего достоинство антибиотикам ферментов и обеспечивает большую часть клетки содержат вектор кодирования целевого белка. Кроме того ампициллин имеет ограниченный срок годности около двух-трех недель. Таким образом культура пластины для выражения протеина должны храниться при температуре 4 ° C для максимум до двух недель использования. Наконец для обеспечения эффективности ампициллина в средствах стартера и выражение, ампициллин Стоковый раствор следует быть производства свежих сразу перед употреблением, длительного хранения может привести к менее эффективный антибиотик.
Наличие СМЕШЕНИЯ позволяет для простой очистки ELPs через тепловые Велоспорт. В частности при более высокой температуре и в присутствии солей энтропийной силы вызывают ELPs становятся менее растворимы и впоследствии формируют фазу coacervate полимер богатые. С другой стороны при низких температурах, ELPs остаются растворимых и легко растворяются в решение. Велоспорт между этих двух температурных режимов, в сочетании с центрифугированием шаги для сбора и отбросить этапа не содержащих ELP последовательно концентрирует белка и одновременно уменьшает существование не ELP загрязнений.
Однако существует ряд этапов, где ELPs могут быть потеряны в этот процесс очистки. Во-первых до каждый холодного отжима, белковые решение является алкализованный к рН 9,0. Этот высокий рН служит для deprotonate некоторые аминокислоты на хребте белка, эффективно оставляя их в заряженном состоянии и дальнейшего повышения их растворимость. Следовательно вышеизложенного этот шаг или не обеспечивают достаточное время для растворения белков может привести к сокращению урожайности, как-солюбилизирован белки будут гранулированных во время центрифугирования и отбрасывается.
Аналогичным образом целевых белков могут быть потеряны во время процедуры горячего отжима при гранулированных ELP. Первоначально NaCl добавляется в надосадке богатых белком для уменьшения растворимости ELP. Соли работать в том, чтобы оградить электростатического взаимодействия между молекулами белков и воды, вызывая белок отделить от водной фазе. Этот эффект усиливается путем нагревать решение, которое, благодаря энтропийной эффекты, далее ломает hydrous «Кейдж» окружающих ELPs и сил агрегации белков. При более низких концентрациях белка (т.е., первый тепловой цикл), добавлением солей только часто недостаточно, чтобы вызвать этот этап разделения. Однако, как концентрация белка увеличивается (т.е., позднее тепловых циклов) и есть меньше вторичных загрязнителей, взаимодействовать с солями, ПЭП, легче будет выпадать в осадок. В результате соли при добавлении слишком быстро, они могут стать физически ловушке путем агрегирования белки, который эффективно снижает концентрации соли раствора и ограничивает дальнейшее осадков белок. Таким образом следует добавить соль в трех небольших партий, чтобы убедиться, что они имеют достаточно времени для содержанием однородно распространять через решение. Как окончательное примечание вариации ELP основу, либо путем дальнейшего изменения остатков гость эластин как региона или изменения в области био активных может значительно влияют на поведение СМЕШЕНИЯ. Следовательно, для обеспечения оптимальной белка урожай через варианты белка, важно оптимизировать рН, концентрации соли и соли типа (например., моновалентная или двухвалентной) для холодной и горячей спинов.
Запуск SDS-PAGE по завершении протокол рекомендуется как он может использоваться, чтобы легко определить, если значительные потери ELP происходит во время любого из шагов очистки. Вкратце если ELP обнаружен в надосадке после горячего отжима, затем белок не будучи осаждается эффективно. Аналогично Если ELPs определены в образце растворимых гранул после холодного отжима, затем белок не распускается эффективно.
ELP гидрогели предлагают много преимуществ над синтетических или естественно производные материалы. В частности использование сшивателя Амин реактивный THPC дает лоу кост, простой и настраиваемый механизм белка сшивки. Однако существуют различные ограничения в рамках протокола сшивки, который следует отметить. THPC это кислород чувствительной, и если хранятся в несоответствующих условиях, он может быстро ухудшиться в эффективности реакции. Кроме того из-за его реактивность с первичных аминов, THPC могут реагировать с окружающими белков в СМИ или те на поверхности клеток, которые богаты амины. Таким образом при формировании ELP гидрогели, рекомендуется избегать загрязнения СМИ с Пелле ячейки для уменьшения возможных внешних белков перекрестной реактивности и, таким образом, снижение эффективности сшивки. Наконец, этот механизм сшивки исключает последовательность био активные области, содержащие нет остатков лизина и таким образом, ограничивает потенциал интеграции некоторых клеток клей мотивы (например., IKVAV-34). Для устранения этих недостатков, изменения к ELP магистрали с азидом и bicyclononyne (BCN) реакции партнеров позволяет для Био ортогональных сшивки, как описано выше27.
Следует отметить, что поведение ELP СМЕШЕНИЯ играет важную роль в диктует гидрогеля микроструктуры. В температурных режимов выше СМЕШЕНИЯ ELPs осадок из решения, ведущего к формированию богатые белком и белка недостаточным фаз, которые могут влиять на матричная пористость и сшивки эффективность матрицы9. Поскольку большинство клеток культуры эксперименты проводятся при физиологически соответствующей температуре (~ 37 ° C) выше ELP СМЕШЕНИЯ, эти эффекты должны рассматриваться. Для гидрогели эффективно crosslink и формы сети взаимосвязанных белка, Первичные амины из лизина должны быть физически доступны для THPC сшивателя. Если ELP агрегации происходит до достижения достаточного сшивки, ELPs, захваченных в течение этапа богатых белком может быть недоступным и таким образом не в состоянии участвовать в сшивки. Чтобы устранить это ограничение, наш протокол требует сшивки период первоначального 15 мин при комнатной температуре, которая позволяет для предварительного сшивки гидрогеля, прежде чем ELP проходит его тепловой фазового перехода. Этот комнатной температуре инкубации следуют дополнительные 15 минут инкубации при 37 ° C доработать гидрогеля сшивки. Эта процедура имеет решающее значение для достаточно сшивки и надежные, воспроизводимые гелеобразования ELP материала.
В заключение гидрогели рекомбинантных белков, изготовленные с использованием ELP предлагают исключительные перестройки последовательности белка и, следовательно, 3D ячейки микроокружения. ELP полимеры были показано быть выражаются в высоких урожаев, легко очищаются из-за их поведение СМЕШЕНИЯ и биосовместимых в самых разнообразных систем in vitro и in vivo . Использование E. coli рекомбинантных принимающей обеспечивает простой и недорогой процедуру, которая вызывает почти идеальный контроль молекулярной массы полимера и функциональности. В совокупности эта техника позволяет для надежной перестройки и воспроизводимость гидрогеля платформы, позволяя для культуры широкого круга типов клеток в 3D. Наконец эта платформа гидрогеля ELP поддаются многие течению биохимических анализов, включая qRT-PCR, Западная помарка, экстракции ДНК и клетки иммуноокрашивания9.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы благодарят т. Палмер и H. Бабу (Stanford нейрохирургия) для предоставления мышиных РНУ. вектор искусства на рисунке 4 был использован и адаптированный Servier медицинского искусства под Creative Commons Attribution 3.0 Unported License (https://creativecommons.org/ Licenses/by/3.0/legalcode). Часть этой работы была выполнена в Стэнфордском Nano общий зал (SNSF), поддержке Национального научного фонда под награду ECCS-1542152. Металлофизики признает поддержку от национального института Генеральной медицинских наук национальных институтов здравоохранения (32GM 008412). C.M.M. признает поддержку от НРСА низ предварительного докторских стипендий (F31 EB020502) и программу Siebel ученых. S.C.H. признает поддержку от национальных институтов здравоохранения (U19 AI116484 и R21 EB018407), Национальный научный фонд (DMR 1508006) и Калифорнийского института регенеративной медицины (RT3-07948). Это исследование получил финансирование от Альянса для восстановительной реабилитации исследования и обучение (AR3T), который поддерживается Юнис Кеннеди Шрайвер национального института детского здоровья и развития человека (NICHD), Национальный институт Неврологических нарушений и инсульта (NINDS) и Национальный институт биомедицинских изображений и биоинженерии (NIBIB) национальных институтов здравоохранения под номером P2CHD086843 премии. Содержание является исключительно ответственности авторов и не обязательно отражают мнения национальных институтов здоровья.
Материалы
| Name | Company | Catalog Number | Comments |
| Elastin-Like Protein Expression and Purification | |||
| 10 cm Petri Dishes | Thermo Fisher Scientific | FB0875713 | |
| 70% Ethanol | RICCA Chemical | 2546.70-1 | |
| Ammonium Sulfate | Sigma-Aldrich | A3920-500G | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25G | |
| Bacto Agar | Thermo Fisher Scientific | 9002-18-0 | |
| BL21(DE3)pLysS Competent Cells | Invitrogen | C606003 | |
| Chloramphenicol | Amresco | 0230-100G | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| EDTA disodium salt, dihydrate | Thermo Fisher Scientific | O2793-500 | |
| Glycerol | Thermo Fisher Scientific | BP229-4 | |
| Isopropanol | Thermo Fisher Scientific | A451-4 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | BP1755-10G | |
| Luria Broth | EMD Millipore | 1.10285.5007 | |
| Parafilm | VWR | 52858-000 | |
| Phenylmethanesulfonyl fluoride (PMSF) | MP Biomedicals | 195381 | |
| Sodium Chloride | Thermo Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Sigma-Aldrich | S 8045-1KG | |
| Syringe Filter Unit (0.22 μm) | Millipore | SLGP033RB | |
| Terrific Broth | Millipore | 71754-4 | |
| Tris Base | Thermo Fisher Scientific | BP152-1 | |
| Cell Encapsulation in 3D ELP Hydrogels | |||
| 0.22 μm syringe filters | Millipore | SLGV004SL | |
| 0.5 mm thick silicone sheet | Electron Microscopy Science | 70338-05 | |
| 24-well tissue culture plates | Corning | 353047 | |
| Disposable Biopsy Punch (2 mm) | Integra Miltex | 33-31 | |
| Disposable Biopsy Punch (4 mm) | Integra Miltex | 33-34 | |
| Disposable Biopsy Punch (5 mm) | Integra Miltex | 33-35 | |
| Dulbecco’s phosphate buffered saline (DPBS) | Corning | 21-031-CM | |
| No. 1 12 mm glass coverslips | Thermo Fisher Scientific | 12-545-80 | |
| Tetrakis(hydroxymethyl)phosphonium chloride (THPC) | Sigma-Aldrich | 404861-100ML | |
| 0.5% Tryspin/EDTA | Thermo Fisher | 15400054 | |
| Immunocytochemistry of Cells in 3D ELP Hydrogels | |||
| 16% (w/v) Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15701 | |
| Bovine Serum Albumin (BSA) | Roche | 3116956001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Donkey Serum | Lampire Biological Labs | 7332100 | |
| Goat anti-mouse Secondary Antibody (AF488) | Molecular Probes | A-11017 | |
| Goat anti-rabbit Secondary Antibody (AF546) | Molecular Probes | A-11071 | |
| Goat Serum | Gibco | 16210-072 | |
| Mouse Nestin Primary Antibody | BD Pharmingen | 556309 | |
| Mouse Sox2 Primary Antibody | Cell Signaling Technology | 23064S | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Vectashield Hardset Mounting Medium | Vector Labs | H-1400 |
Ссылки
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294 (5547), 1708-1712 (2001).
- Birgersdotter, A., Sandberg, R., Ernberg, I. Gene expression perturbation in vitro-A growing case for three-dimensional (3D) culture systems. Seminars in Cancer Biology. 15 (5), 405-412 (2005).
- Gómez-Lechón, M. J., et al. Long-term expression of differentiated functions in hepatocytes cultured in three-dimensional collagen matrix. Journal of Cellular Physiology. 177 (4), 553-562 (1998).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Justice, B. A., Badr, N. A., Felder, R. A. 3D cell culture opens new dimensions in cell-based assays. Drug Discovery Today. 14 (1-2), 102-107 (2009).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Madl, C. M., et al. Maintenance of neural progenitor cell stemness in 3D hydrogels requires matrix remodelling. Nature Materials. 16 (12), 1233-1242 (2017).
- Discher, D. E., Janmey, P., Wang, Y. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Sun, Y., Villa-Diaz, L. G., Lam, R. H. W., Chen, W., Krebsbach, P. H., Fu, J. Mechanics Regulates Fate Decisions of Human Embryonic Stem Cells. PLoS ONE. 7 (5), e37178 (2012).
- Ehrbar, M., et al. Elucidating the Role of Matrix Stiffness in 3D Cell Migration and Remodeling. Biophysical Journal. 100 (2), 284-293 (2011).
- Rowlands, A. S., George, P. A., Cooper-White, J. J. Directing osteogenic and myogenic differentiation of MSCs: interplay of stiffness and adhesive ligand presentation. American Journal of Physiology - Cell Physiology. 295 (4), 1037-1044 (2008).
- Lampe, K. J., Antaris, A. L., Heilshorn, S. C. Design of three-dimensional engineered protein hydrogels for tailored control of neurite growth. Acta Biomaterialia. 9 (3), 5590-5599 (2013).
- Kilian, K. A., Mrksich, M. Directing Stem Cell Fate by Controlling the Affinity and Density of Ligand-Receptor Interactions at the Biomaterials Interface. Angewandte Chemie International Edition. 51 (20), 4891-4895 (2012).
- Tse, J. R., Engler, A. J. Preparation of Hydrogel Substrates with Tunable Mechanical Properties. Current Protocols in Cell Biology. , 10.16.1-10.16.16 (2010).
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: A complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- DiMarco, R. L., Heilshorn, S. C. Multifunctional Materials through Modular Protein Engineering. Advanced Materials. 24 (29), 3923-3940 (2012).
- Meyer, D. E., Chilkoti, A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nature Biotechnology. 17 (11), 1112-1115 (1999).
- Aladini, F., Araman, C., Becker, C. F. W. Chemical synthesis and characterization of elastin-like polypeptides (ELPs) with variable guest residues. Journal of Peptide Science. 22 (5), 334-342 (2016).
- McMillan, R. A., Caran, K. L., Apkarian, R. P., Conticello, V. P. High-Resolution Topographic Imaging of Environmentally Responsive, Elastin-Mimetic Hydrogels. Macromolecules. 32 (26), 9067-9070 (1999).
- McMillan, R. A., Conticello, V. P. Synthesis and Characterization of Elastin-Mimetic Protein Gels Derived from a Well-Defined Polypeptide Precursor. Macromolecules. 33 (13), 4809-4821 (2000).
- Chung, C., Lampe, K. J., Heilshorn, S. C. Tetrakis(hydroxymethyl) Phosphonium Chloride as a Covalent Cross-Linking Agent for Cell Encapsulation within Protein-Based Hydrogels. Biomacromolecules. 13 (12), 3912-3916 (2012).
- Romano, N. H., Madl, C. M., Heilshorn, S. C. Matrix RGD ligand density and L1CAM-mediated Schwann cell interactions synergistically enhance neurite outgrowth. Acta Biomaterialia. 11, 48-57 (2015).
- Shah, M., Hsueh, P. Y., Sun, G., Chang, H. Y., Janib, S. M., MacKay, J. A. Biodegradation of elastin-like polypeptide nanoparticles. Protein Science. 21 (6), 743-750 (2012).
- Nettles, D. L., Chilkoti, A., Setton, L. A. Applications of elastin-like polypeptides in tissue engineering. Advanced Drug Delivery Reviews. 62 (15), 1479-1485 (2010).
- Madl, C. M., Heilshorn, S. C. Tyrosine-Selective Functionalization for Bio-Orthogonal Cross-Linking of Engineered Protein Hydrogels. Bioconjugate Chemistry. 28 (3), 724-730 (2017).
- Zhu, D., Wang, H., Trinh, P., Heilshorn, S. C., Yang, F. Elastin-like protein-hyaluronic acid (ELP-HA) hydrogels with decoupled mechanical and biochemical cues for cartilage regeneration. Biomaterials. , 132-140 (2017).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Bio-Orthogonally Crosslinked, Engineered Protein Hydrogels with Tunable Mechanics and Biochemistry for Cell Encapsulation. Advanced Functional Materials. 26 (21), 3612-3620 (2016).
- Cai, L., Dinh, C. B., Heilshorn, S. C. One-pot synthesis of elastin-like polypeptide hydrogels with grafted VEGF-mimetic peptides. Biomater Sci. 2 (5), 757-765 (2014).
- Straley, K. S., Heilshorn, S. C. Independent tuning of multiple biomaterial properties using protein engineering. Soft Matter. 5 (1), 114-124 (2009).
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current Opinion in Biotechnology. 10 (5), 411-421 (1999).
- Graumann, K., Premstaller, A. Manufacturing of recombinant therapeutic proteins in microbial systems. Biotechnology Journal. 1 (2), 164-186 (2006).
- Tashiro, K., et al. A Synthetic Peptide Containing the IKVAV Sequence from the A Chain of Laminin Mediates Cell Attachment, Migration, and Neurite Outgrowth. Journal of Biological Chemistry. 264 (27), 16174-16182 (1989).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены