Method Article
Produzione di elastina-come proteina idrogeli per incapsulamento e Immunostaining delle cellule in 3D
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Idrogeli di ingegneria della proteina ricombinanti sono vantaggiosi per la coltura cellulare 3D poiché consentono completa accordabilità della catena polimerica e di conseguenza, il microambiente delle cellule. Qui, descriviamo il processo di purificazione della proteina ricombinante elastino-simili e la sua applicazione in incapsulamento cella 3D idrogel.
Abstract
Tecniche di coltura tissutale (2D) bidimensionali sono stati essenziali per la nostra comprensione della biologia delle cellule fondamentali. Tuttavia, la mancanza di sistemi di coltura del tessuto 2D tradizionale una matrice tridimensionale (3D), risultante in un significativo scollamento tra risultati raccolti in vitro e in vivo. Per risolvere questa limitazione, i ricercatori hanno creato piattaforme di coltura del tessuto 3D idrogel che possono imitare le proprietà biochimiche e biofisiche del microambiente delle cellule in vivo . Questa ricerca ha motivato la necessità di sviluppare materiale piattaforme che supportano incapsulamento cella 3D e analisi biochimiche a valle. Ingegneria delle proteine ricombinanti offre un unico set di strumenti per disegno materiale idrogel 3D e sviluppo, consentendo il controllo specifico di sequenza della proteina e quindi, per estensione, le potenziali proprietà meccaniche e biochimiche della risultante matrice. Qui, presentiamo un protocollo per l'espressione di recombinantly-elastina-come proteina derivata (ELP), che può essere utilizzato per forma idrogel con proprietà meccaniche regolabili in modo indipendente e concentrazione del ligando delle cellule-adesivo. Presentiamo inoltre una metodologia per l'incapsulamento di cellule all'interno di ELP idrogeli e macchiatura immunofluorescente successive di embedded cellule per analisi a valle e la quantificazione.
Introduzione
Durante il secolo passato, coltura del tessuto bidimensionale (2D) è sviluppato in un set di strumenti integrato per lo studio della biologia fondamentale delle cellule in vitro. Inoltre, i protocolli relativamente basso costo e semplici per la coltura cellulare 2D hanno condotto alla sua adozione attraverso molte discipline biologiche e mediche. Tuttavia, ricerca passata ha dimostrato che le tradizionali piattaforme 2D possono portare a risultati che si discostano sensibilmente da quelli raccolti in vivo, causando tempo prezioso e finanziamenti sprecati per ricerca clinicamente orientata1,2, 3. Noi ed altri suppongono che questa discrepanza può essere attribuita alla mancanza di nativi biochimiche e biofisiche spunti forniti per le cellule coltivate su superfici 2D, che possono essere necessarie per la proliferazione ottimale e maturazione dei vari tipi di cellule.
Per risolvere queste limitazioni e aiuto ponte il divario tra 2D in vitro e in vivo gli studi, i ricercatori hanno sviluppato idrogel tridimensionale (3D) piattaforme per cellulari-incapsulamento1,4,5 ,6. Idrogeli sono materiali ideali per ricapitolare il microambiente endogeno della matrice extracellulare (ECM) in vivo a causa di loro proprietà meccaniche del tessuto-come e struttura gonfio d'acqua che consente il rapido trasporto di nutrienti e segnalazione fattori7,8. Inoltre, idrogeli 3D possono essere progettati per avere controllo indipendente sulle proprietà meccaniche e biochimiche dell'impalcatura. Sia matrice meccanica9,10,11,12 e ligandi cellulari-adesivo13,14,15 sono ben noti per influenzare la cella comportamento in vitro e in vivo. Così, idrogeli 3D con proprietà sintonizzabile offrono una piattaforma per studiare le relazioni causali tra cellule e loro microambiente. Criteri per una matrice di idrogel 3D ideale includono semplice, non citotossica delle cellule-incapsulamento come pure accordabilità indipendente di proprietà meccaniche fisiologicamente rilevanti e mimici di nativi cella-adesivo motivi.
Entrambi sintetico (ad es., polietilenglicole, acido polilattico, poli (acido glicolico)) e di derivazione naturale (ad es., alginato, collagene, Matrigel) idrogeli presentano vantaggi rispetto 2D in vitro piattaforme di cultura; Tuttavia, essi hanno anche notevoli lacune che limitano la loro applicabilità. Primo, molte piattaforme di derivazione naturale e sintetiche richiedono condizioni di reticolazione duro che possono essere potenzialmente tossiche per le cellule di mammiferi, che porta alla diminuzione di attuabilità delle cellule7. Inoltre, molte piattaforme sintetici mancano nativa bioattività e bisogno di essere funzionalizzate attraverso reazioni chimiche secondarie, che possono aggiungere maggiore costo e complessità16. Infine, mentre materiali di derivazione naturale contengono tipicamente intrinseche bio-attivi domini, essi sono spesso afflitti da un'elevata variabilità lotto e spesso sono limitate a formare gel relativamente debole7,17.
Ingegneria delle proteine ricombinanti presenta un unico set di strumenti per la progettazione di materiali consentendo controllo esplicito sulla sequenza della proteina e, per estensione, le potenziali proprietà meccaniche e biochimiche dell'idrogel finale dell'impalcatura18. Inoltre, sfruttando il ben nota macchine biologiche di Escherichia coli (Escherichia coli) per esprimere proteine, materiali possono essere prodotto in modo conveniente e coerente con la variabilità limitata inter - e intra-batch. La proteina elastina-come (ELP) presentata qui ha tre domini ingegnerizzati: (1) un tag T7 e His6 che consente per etichettatura tramite fluorescente contrassegnati gli anticorpi, (2) una regione 'elastin-like' che conferisce proprietà meccaniche elastiche e consente per l'industria chimica reticolazione e (3) una regione 'bio-attivi' che codifica per motivi di cella-adesivo.
Nostra regione di elastina-come si basa sulla canonica sequenza di elastina (Val-Pro-Gly-Xaa-Gly)5 dove quattro dei 'Xaa' siti dell'amminoacido isoleucina (Ile), ma potrebbero essere progettato per essere qualsiasi amminoacido ad eccezione della prolina. Questa sequenza dota ricombinante ELPs con comportamento di temperatura (LCST) soluzione critica inferiore che può essere sfruttata per post-l'espressione purificazione semplice via19,20di cicli termici. Questa proprietà LCST può essere sintonizzata per termicamente aggregato a temperature diverse modificando l'ospite 'Xaa' residuo21,22.
Qui, la posizione di 'Xaa' su una delle cinque ripetizioni elastina-come è stata sostituita con la presentazione di ammina lisina (Lys) dell'aminoacido, che è utilizzata per la reticolazione di idrogel. Il nostro lavoro precedente ha indicato non citotossica e robusto reticolazione tramite reazione con l'ammina-reattivo crosslinker tetrachis (idrossimetil) fosfonio cloruro (THPC)23. Di varie proteine contenuti e crosslinker concentrazione complessiva, siamo in grado di produrre idrogel che può essere sintonizzato per estendersi su una rigidità fisiologicamente rilevanti gamma (~0.5-50 kPa)9,23,24. Oltre alle proprietà meccaniche di tuning, cellula adesione all'interno dei risultati di idrogel dall'integrazione dei domini canonici di cella-adesivo all'interno la spina dorsale della proteina ELP. Ad esempio, l'incorporazione di estesa fibronectin-derivato 'RGDS' sequenza dell'amminoacido permette delle cellule adesione e flessibilità conformazionale, mentre le uova strapazzate, variante di 'RDGS' non vincolante limita di adesione cellula-matrice24. Modulando il rapporto di cella-adesivo non adesivo proteine come pure la concentrazione nella proteina totale, siamo in grado di produrre in modo efficace gli idrogel che abbracciano una vasta gamma di concentrazione del ligando. Resultantly, abbiamo sviluppato una piattaforma di idrogel con proprietà biochimiche e biofisiche disaccoppiate, che può essere regolato in modo indipendente per coltura ottima 3D di vari tipi cellulari.
Oltre alla matrice di rigidezza e accordabilità legante adesivo, ricombinante idrogel offrono la possibilità di profili di degrado del materiale specifico design, che è necessaria per la diffusione delle cellule, la proliferazione e la migrazione all'interno di un contesto 3D4 , 9. questo degrado è garantito dalla secrezione delle cellule delle proteasi che si rivolgono specificamente elastina-come sequenza25o estesa 'RGDS'9 . ELP idrogeli inoltre sono stati indicati per sostenere le successive analisi biochimiche che sono necessari per lo studio di attuabilità delle cellule e la funzione compreso immunocytochemistry così come estrazione di DNA/RNA/proteine per inversione quantitativa reazione a catena della polimerasi della trascrizione (qRT-PCR) e Western blot9. ELP varianti inoltre sono stati usati in un certo numero di modelli in vivo e sono noti per essere tollerato dal sistema immunitario26.
Presi insieme, ELP come una piattaforma di materiale per gli studi delle cellule-incapsulamento vanta una vasta gamma di vantaggi rispetto alle piattaforme di materiale sintetiche o di derivazione naturale, che spesso non hanno lo stesso grado di accordabilità biochimiche e biofisiche e riproducibilità. Inoltre, non citotossica un di ELP uso semplice e con un'ampia varietà di tipi cellulari (ad es., pulcino radice dorsale dei gangli14,24, progenitrici neurali murini cellule9, cellule staminali mesenchimali umane27, bovino condrociti neonatale28, human endothelial cells29,30) consente per un modello più fisiologicamente rilevante del ECM 3D endogeno rispetto alla coltura delle cellule 2D. Qui, presentiamo un protocollo per l'espressione di recombinantly-derivati, ELPs per l'uso come una piattaforma di idrogel sintonizzabile per 3D cell incapsulamento. Vi presentiamo ulteriormente la metodologia per l'etichettatura fluorescente downstream e microscopia confocale delle cellule incapsulate.
Protocollo
1. protocollo di espressione ELP
- Giorno 1: Cresce la colonia di avviamento
- Preparare le piastre di agar di ampicillina e cloramfenicolo in autoclave 25 g di Luria brodo e 15 g di agar per 1 L di acqua ultrapura. Una volta che la soluzione è raffreddata a ~ 60 ° C, aggiungere 1 mL di brodo di ampicillina (100 mg/mL in acqua ultrapura) e 1 mL di brodo di cloramfenicolo (34 mg/mL di etanolo al 70%) a 1 L di soluzione di agar per concentrazioni finali di 100 µ g/mL e 34 µ g/mL , rispettivamente. Trasferire 20 mL di soluzione finale per 10 cm di Petri con una pipetta sierologica e consentire l'agar solidificare. Avvolgere le capsule di Petri con parafilm e conservare a 4 ° C.
Nota: capsule di Petri può essere memorizzato a 4 ° C fino a due settimane. - Striscia un piccolo campione di BL21 (DE3) pLysS e. coli da uno stock di batterico pre-fatto che contiene un vettore pET15b codifica l'ELP di interesse su una piastra di agar di ampicillina e cloramfenicolo.
Nota: L'ampicillina e cloramfenicolo selezionare per batteri contenenti vettori sia la pET15b e pLysS, rispettivamente. - Posizionare la piastra striata testa in giù in un incubatore a 37 ° C. Consentire le colonie batteriche a crescere durante la notte.
Nota: Non Incubare le piastre per più di 16 h come ampicillina si degrada e si possono formare le colonie che non trasportano resistenza all'ampicillina.
- Preparare le piastre di agar di ampicillina e cloramfenicolo in autoclave 25 g di Luria brodo e 15 g di agar per 1 L di acqua ultrapura. Una volta che la soluzione è raffreddata a ~ 60 ° C, aggiungere 1 mL di brodo di ampicillina (100 mg/mL in acqua ultrapura) e 1 mL di brodo di cloramfenicolo (34 mg/mL di etanolo al 70%) a 1 L di soluzione di agar per concentrazioni finali di 100 µ g/mL e 34 µ g/mL , rispettivamente. Trasferire 20 mL di soluzione finale per 10 cm di Petri con una pipetta sierologica e consentire l'agar solidificare. Avvolgere le capsule di Petri con parafilm e conservare a 4 ° C.
- Giorno 2: Preparazione dei media di cultura ed espressione di avviamento
- Rimuovere la coltura di Escherichia coli dall'incubatrice. Parafilm la piastra e negozio per un massimo di 4 giorni a 4 ° C.
- Preparare un matraccio di cultura starter (250 mL) e matracci di cultura di espressione (12 x 1 L) e autoclave. Per 1 L di expression media, aggiungere 47,6 g di brodo formidabile e 4 mL di glicerolo a 1 L di acqua distillata in un matraccio di cultura sconcertato 2L e tappo con foglio di alluminio.
Nota: Rendimenti tipici sono 60-100 mg/L proteina di expression media. - Caricare il dispositivo d'avviamento in autoclave in pre-riscaldato, incubatore agitazione a 37 ° C ed incubare senza agitazione.
- Aggiungere 250 µ l di brodo di sterile filtrata (filtro di 0,22 µm) ampicillina (100 mg/mL in acqua ultrapura) per la coltura starter per una concentrazione finale di 100 µ g/mL. Iniziare immediatamente agitando la coltura starter a 250 giri/min.
Nota: Cloramfenicolo è utilizzato solo per la selezione di Colonia su piastre di agar e per colture liquide non è incluso. - Inoculare la coltura starter con l'aggiunta di una singola colonia di e. coli plasmide contenente ELP dalla piastra striata e consentire la coltura starter scuotere a 37 ° C per 16 h.
- Posizionare il supporto di cultura espressione boccette in pre-riscaldati, 37 ° C in agitazione incubatori e incubare per una notte senza agitazione affinché le beute sono pronte inoculare la mattina successiva.
- Giorno 3: Inducendo l'espressione della proteina in e. coli
- Fare magazzino fresco, filtrato sterile ampicillina (100 mg/mL in acqua ultrapura). Aggiungere 1 mL di brodo di ampicillina per ogni beuta di expression media per una concentrazione finale di 100 µ g/mL.
- Iniziare agitando i mezzi di espressione a 250 giri/min.
- Prelevare un campione di 2 mL di media da ogni boccetta di espressione e aggiungere una cuvetta come uno spazio vuoto per una densità ottica di lettura a 600 nm (OD600).
- Al termine dell'incubazione di cultura starter 16h, inoculare ciascuna beuta espressione trasferendo 20 mL della coltura starter ad ogni boccetta di espressione tramite una pipetta sierologica.
- Dopo il completamento dell'agitazione di 1h, misurare il OD600 di uno dei palloni espressione. A seguito di questo passaggio, misurare il OD600 ogni 20 min, verificando un pallone diverso ogni volta.
- A un OD600 di 0,6, ridurre la temperatura degli shakers contenente le beute di espressione a 32 ° C.
- Verifica il OD600 ogni 10 min. A un OD600 di 0,8, inducono l'espressione aggiungendo 1 mL di 1 M, sterile filtrata β-isopropil thiogalactoside (IPTG) nell'acqua ultrapura per ciascuna beuta di espressione.
- Consentire l' e. coli in boccette di espressione esprimere per 7 h.
- 20 min prima della fine dell'espressione, pre-raffreddare una centrifuga di grande piano a 4 ° C.
- Raccogliere tutti i 12L di expression media in equilibrio e individuali dei recipienti.
- Centrifugare i mezzi di espressione al > 12.000 x g per 15 min a 4 ° C, utilizzando una centrifuga di piano.
- Versare il sovranatante da ciascun contenitore centrifuga. Con una spatola, raccogliere le palline delle cellule in un sacchetto a chiusura zip pre-pesati.
- Risospendere il pellet in sterile filtrata dieci buffer (100 mL di tampone per 25 g di pellet) e rimuovere eventuali bolle d'aria in eccesso da massaggiare il pellet. Per 1 L di tampone dieci, aggiungere 5,8 g di cloruro di sodio, 1,21 g di tris base e 0,37 g di disco sale acido etilendiammina etilendiamminotetraacetico (EDTA) sodio dibasico diidrato a 900 mL di acqua ultrapura. Aggiustare il pH a 8.0 e portare a 1 L. Per questo passaggio, strisce pH sono sufficienti.
- Posizionare il sacchetto a chiusura lampo contenente il pellet cellulare risospeso in un contenitore secondario e congelare a-80 ° C durante la notte.
- Giorno 4-6: rottura della parete cellulare batterica tramite cicli di gelo-disgelo
- Rimuovere il pellet congelato dal congelatore e lasciarla scongelare lentamente a 4 ° C con agitazione delicata utilizzando un agitatore orbitale.
- Lasciar scongelare fino a quando un po' di liquido è presente il pellet. Aggiungi ~ 30-40 mg di desossiribonucleasi I (DNasi) a scongelati lisato. Inoltre, è possibile aggiungere 1 mL di fenilmetilsufonilfluoruro di 100 mM (PMSF; un inibitore della proteasi) in isopropanolo 100 millilitri di lysate delle cellule. Consentire il lisato di scuotere durante la notte.
Nota: Aggiunta la DNasi e PMSF è necessaria solo per il primo ciclo di congelamento-scongelamento.
Attenzione: PMSF è tossico se inalato. Una maschera facciale deve essere utilizzata durante la manipolazione della polvere PMSF. - Una volta che il lisato cellulare è completamente sciolto, congelare il lisato a-80 ° C durante la notte, o fino a quando completamente congelato.
- Ripetere la procedura di congelamento-scongelamento per un totale di tre cicli. Lasciare il lisato scongelati a 4 ° C dopo l'ultimo gelo-disgelo. Memorizzare 100 µ l di crudo lisato per sodio dodecil solfato-poliacrilammide gel elettroforesi (SDS-PAGE) analisi al termine della purificazione.
- Dopo il disgelo ultimo, regolare il pH della scongelati lisato 9.0 utilizzando 1 M NaOH. Per questo passaggio, strisce pH sono sufficienti. Incubare a 4 ° C per almeno 1 h (durante la notte è appropriato) su agitatore orbitale.
- Giorno 7-9: purificazione di ELP attraverso cicli termici spin freddo e caldo
- Raffreddare la centrifuga di piano a 4 ° C 20 min prima della centrifugazione.
- Aliquotare ed equilibrio lo scongelati lisato in recipienti della centrifuga.
- Centrifugare i campioni a > 15.000 x g per 1 h a 4 ° C. Dopo il completamento della purificazione, conservare 100 µ l del surnatante per analisi SDS-PAGE.
Nota: Dopo la centrifugazione, la proteina ELP dovrebbe rimanere nel surnatante a causa della sua elevata solubilità in acqua a temperature inferiori a sua LCST (< 32 ° C). - Trasferire il surnatante a nuovo dei recipienti e bilanciare in modo appropriato.
- Aggiungere cloruro di sodio (NaCl) in tre parti ad una concentrazione finale di 1 M (5,84 g di NaCl per ogni 100 mL di surnatante). Verificare che il NaCl è aggiunto in tre parti per consentire per dissoluzione sufficiente.
- Agitare per 3 h a 37 ° C a 250 rpm in un incubatore d'agitazione.
- 1 h prima della fine dell'agitazione, pre-riscaldare una centrifuga di piano a 37 ° C.
- Centrifugare a > 15.000 x g per 1 h a 37 ° C. Dopo il completamento di purificazione conservare 100 µ l del surnatante per analisi SDS-PAGE e scartare il surnatante rimanente.
Nota: Dopo centrifugazione, la proteina ELP dovrebbe essere pellettata a causa della sua bassa solubilità in acqua a temperature superiori a sua LCST (> 32 ° C). - Risospendere il pellet con l'aggiunta di 10 mL di acqua ultrapura, sterilizzato nell'autoclave per 1 g di pellet. Utilizzare una spatola di metallo per schiacciare la pallina per facilitare la dissoluzione della proteina.
- Regolare il pH della scongelati lisato 9.0 utilizzando 1 M NaOH. Per questo passaggio, strisce pH sono sufficienti.
- Agitare durante la notte a 4 ° C su agitatore orbitale.
- Ripetere la procedura di ciclismo termica spin caldi e freddi per un totale di tre cicli (cioè., ripetere i passaggi da 1.5.1 attraverso 1.5.11 per tre cicli totali).
- Giorno 10-15: ELP dialisi e liofilizzazione
- Centrifuga risospeso in una centrifuga pre-refrigerata a > 15.000 x g per 1 h a 4 ° C. Dopo il completamento della purificazione, conservare 100 µ l del surnatante per analisi SDS-PAGE.
- Dissalare la soluzione della proteina di dialisi il surnatante rimanente in una membrana di dialisi di 3,5 kDa contro 4 L di acqua ultrapura pre-refrigerato a 4 ° C. Cambiare l'acqua di dialisi due volte al giorno per un totale di 6 volte in 3 giorni.
Nota: I volumi surnatante tipici sono tra 5 e 30 mL. - Centrifugare la soluzione dializzata in una centrifuga pre-raffreddata a > 15.000 x g per 1 h a 4 ° C. Memorizzare 100 µ l del surnatante per analisi di SDS-PAGE alla fine della purificazione.
- Congelare il risultante surnatante a-80 ° C in provette coniche da pre-pesati.
- Lyophilize la soluzione congelata per 3 giorni e la massa del prodotto finale per determinare il rendimento di proteina.
- Parafilm le provette contenenti la finale liofilizzato prodotto ELP e conservare a 4 ° C.
- Eseguire SDS-PAGE per determinare la purezza della proteina.
Nota: Protocolli per SDS-PAGE varierà in base alle condizioni del gel dell'agarosi specifici. Per i nostri esperimenti, finale liofilizzato di proteine è stato disciolto ad una concentrazione di 0,5 mg/mL in acqua deionizzata e correre a 140 V per 70-100 min in un gel di acrilammide 12% (p/v) sotto condizioni di denaturazione.
2. cellula incapsulamento in 3D elastina-come proteina idrogeli
- Preparazione di stampi in silicone
- Usare un punzone di biopsia con il diametro desiderato per creare fori in un foglio di silicone spessa 0,5 mm e tagliare un quadrato intorno a ogni buca. Ripetere per il numero di stampi desiderato.
Nota: Il diametro e lo spessore degli stampi può essere regolate per la particolare applicazione e condizioni di coltura delle cellule. In pratica, per colture cellulari di 50 106 cellule/mL, 0,5 mm spessore stampi con diametri di 5 mm e 4 mm sono raccomandati per sufficiente DNA/RNA ed estrazione della proteina, rispettivamente. Per immunostaining, un pugno di biopsia di 2 mm utilizzabile per creare invece tre fori adiacenti per stampo quadrato in modo che tre replicati possono essere macchiati per pozzetto. - Rimuovere l'involucro di plastica su ogni lato dello stampo individuale con le pinzette.
Nota: Evitare il contatto con la superficie esposta del silicone come contaminazione può diminuire l'efficienza di incollaggio al plasma futuro. - Con una pinzetta, organizzare lo stesso numero di stampi in silicone nuda e vetrini coprioggetti (n ° 1, diametro 12 mm) a righe sul coperchio rovesciato di una piastra a 48 pozzetti alternate. Una volta completato, coprire il coperchio della piastra 48 pozzetti per evitare la contaminazione.
- Il plasma ad ossigeno trattare il coperchio intero 48 pozzetti (cioè., stampi e lastre di vetro). Subito dopo, usare pinze per invertire lo stampo in silicone sull'adiacente vetrino coprioggetti. Premere con forza sullo stampo per garantire l'incollaggio. Lasciate che gli stampi Incubare a temperatura ambiente per 1 h.
Nota: La durata del trattamento al plasma di ossigeno variano a seconda dello strumento utilizzato. Condizioni tipiche per il nostro strumento sono una finestra di pressione gas funzionamento tra 0,3-4 mbar, flusso di gas di ossigeno/min 20 cm3, e l'esposizione del campione a plasma per 10-20 s. - Sterilizzare gli stampi in autoclave. Conservare gli stampi a temperatura ambiente in un ambiente sterile fino all'utilizzo.
Nota: Gli stampi possono essere memorizzati in questa fase a tempo indeterminato.
- Usare un punzone di biopsia con il diametro desiderato per creare fori in un foglio di silicone spessa 0,5 mm e tagliare un quadrato intorno a ogni buca. Ripetere per il numero di stampi desiderato.
- Preparazione della soluzione di riserva di proteina elastina-like
- Rimuovere liofilizzato ELP dal deposito di 4 ° C. Caldo la proteina a temperatura ambiente prima dell'apertura del tubo per non garantire condensa si basa sulla proteina sopra uso ripetuto.
- Sciogliere ELP in soluzione tampone fosfato di Dulbecco (DPBS) a 4 ° C con agitazione costante (i. e., filatura) durante la notte.
Nota: Concentrazione della soluzione stock di ELP sarà ulteriormente diluito con l'aggiunta di soluzione di reticolante a un rapporto volumetrico definito dall'utente. Ad esempio, per una concentrazione finale di ELP di 3% (p/v), preparare una soluzione stock di ELP 3,75% (p/v) che sarà diluita in un rapporto volumetrico di 4:1 di soluzione di soluzione: crosslinker ELP. Regolare la concentrazione necessaria per l'applicazione desiderata. - Filtro sterile soluzione di riserva di ELP utilizzando un filtro per siringa da 0,22 µm. Memorizzare ELP su ghiaccio quando non in uso.
- Nella cappa di biosicurezza, trasferire gli stampi sterili con pinzette sterili ad una piastra di coltura del tessuto 24 pozzetti.
- Preparazione della soluzione di riserva THPC
- Diluire il THPC in DPBS appena prima di utilizzare. Regolare la concentrazione della soluzione THPC secondo la concentrazione finale di ELP e rapporto di reticolazione desiderata.
Nota: Per il protocollo, una concentrazione finale di ELP del 3% (p/v) sarà essere fatto mescolando la soluzione madre di ELP con la soluzione THPC un rapporto volumetrico di 4:1. Regolare, se necessario. - Aggiungere 2,6 µ l di soluzione THPC (80% in acqua) a 997.4 µ l di DPBS.
Nota: Questa concentrazione di THPC corrisponde a un rapporto stechiometrico di 1:1 dei gruppi idrossi metil su THPC e ammine primarie sulla proteina ELP quando mescolando soluzioni al descritto 4:1 rapporto volumetrico per un finale idrogel ELP 3% (p/v). La soluzione THPC è viscosa e goccioline di soluzione potrebbero aderire al lato della punta della pipetta. Per precise concentrazioni, evitare tali goccioline quando si diluisce in DPBS. Eliminare il contenitore di stock THPC con gas azoto per prevenire l'ossidazione della fosfina e inattivazione del reticolante. - Vortex la soluzione di mescolare e tenere sul ghiaccio.
- Filtro sterile il THPC scorta soluzione utilizzando un filtro per siringa da 0,22 µm. Diluire la soluzione di riserva THPC ulteriormente con DPBS sterile per ottenere rapporti stechiometrici reticolazione più bassi (ad es., 0.5:1 o 0.75:1).
Nota: THPC è sensibili all'ossigeno, e la soluzione diluita deve essere usata entro poche ore dopo la preparazione.
- Diluire il THPC in DPBS appena prima di utilizzare. Regolare la concentrazione della soluzione THPC secondo la concentrazione finale di ELP e rapporto di reticolazione desiderata.
- Dissociare le cellule mediante incubazione con tripsina-EDTA in una sospensione unicellulare, agglomerare le cellule e contare le celle nuovamente sospese in mezzo utilizzando un emocitometro.
Nota: Protocolli esatte per questo passaggio dipenderà pesantemente il tipo cellulare desiderato e applicazione. Per le cellule progenitrici neurali usate in tutto questo protocollo, è stata condotta un'incubazione di tripsina-EDTA 0.025% a temperatura ambiente per 1,5 min. Le cellule erano pellettate a 200 x g per 2 min. Per la vitalità aumentata delle cellule cellule dovrebbero essere sospesi in condizioni medie normali. Densità tipica della cella utilizzata per intervallo di incapsulamento celle da 1-50 106 cellule/mL di volume finale idrogel. Regolare, se necessario. - Aliquotare il numero desiderato di cellule in una provetta da centrifuga sterili da 1,5 mL.
- Centrifugare le cellule a ~ 200 x g per 3 min. con attenzione, aspirare il supernatante e tenere il pellet cellulare sul ghiaccio.
Nota: È fondamentale per aspirare completamente tutto il supernatante per attenuare l'ulteriore diluizione del reticolante ELP e THPC. Velocità di centrifugazione specifici variano con il tipo di cella. - Risospendere il pellet cellulare della soluzione stock di ELP tale che il volume è 80% del volume finale (supponendo un rapporto di 4:1 di soluzione di soluzione: THPC ELP). Pipettare mix 20 - 25 volte per produrre una miscela omogenea delle cellule ed ELP.
Nota: Evitare il fondo della provetta per mitigare l'aumento della temperatura e transizione di fase successive di ELP di presa. Ogni stampo di 2 mm con tre replicati richiede 7,5 µ l di volume finale (cioè., 6 µ l di soluzione madre di ELP e 1,5 µ l di soluzione madre THPC) diviso in parti uguali nei 3 fori (cioè., 2,5 µ l di volume finale per foro). Per gli stampi di mm 4 e 5, un volume finale di 7,5 µ l e µ l 15,5 è richiesto, rispettivamente. - Aggiungere soluzione stock THPC alla sospensione cellulare/ELP per il restante volume finale di 20%. Pipettare mix 20 - 25 volte per produrre una miscela omogenea.
- Pipettare immediatamente gli ultimi volumi corrispondenti della cella/ELP/THPC miscela in ogni stampo con un movimento circolare. Ripetere per tutti gli stampi.
- Incubare i campioni a temperatura ambiente per 15 minuti, seguito da un'ulteriore incubazione a 37 ° C per 15 min.
Nota: Il primo periodo di incubazione contribuiranno a facilitare la reticolazione iniziale dell'idrogel prima di aumentare la temperatura a quella sopra LCST di ELP e indurre la sua segregazione di fase termica. - Lentamente aggiungere 750 µ l di terreno di coltura cellulare caldo in ciascun pozzetto della piastra 24 pozzetti, evitando di interrompere i gel.
- Incubare gli idrogeli a 37 ° C per 7 giorni.
Nota: Completo medio modifiche sono consigliate ogni 1-2 giorni a seconda del tipo di cella. Per limitare lo stress sul gel, è possibile utilizzare un vetro pipetta Pasteur apposto con una punta di pipetta 200 µ l quando aspirando medio dal pozzo.
3. immunocitochimica di cellule in 3D ELP idrogeli
- Preparare la soluzione di fissazione del paraformaldeide (PFA) del 16% (p/v) di 10 mL in 30 ml di DPBS. Riscaldare la soluzione a 37 ° C.
- Aspirare il mezzo dalla piastra a 24 pozzetti e lavare delicatamente con 1 mL di DPBS.
- Aggiungere 750 µ l della soluzione di fissazione ad ogni pozzetto e incubare a 37 ° C per 30 min. Non utilizzare l'incubatrice di coltura del tessuto per evitare la contaminazione di altre culture con il vapore PFA.
- Aspirare accuratamente la soluzione di fissaggio da ogni pozzetto, scartando il PFA a un contenitore appropriato di rifiuti pericolosi.
Attenzione: L'esposizione a PFA può causare irritazione cutanea e oculare. Indossare guanti/occhiali e lavorare in una cappa chimica. - Aggiungere 1 mL di DPBS per ogni campione. Immediatamente aspirare il DPBS ed eliminare nel contenitore scarti PFA.
- Lavare due volte con 1 mL di DPBS per 10 minuti ciascuno, i campioni.
Nota: I campioni possono essere conservati in DPBS a 4 ° C per fino ad una settimana dopo aver sigillato la piastra con Parafilm. - Permeabilize ogni campione con 750 µ l di soluzione di permeabilizzazione (100 mL di DPBS e 0,25 mL di Triton X-100; PBST) per 1 h a temperatura ambiente su un rocker 15 giri/min.
- Aspirare il PBST e 750 µ l di soluzione (95 mL di PBS, 5 g di albumina di siero bovino (BSA), 5 mL di siero e 0,5 mL di Triton X-100) di blocco per ogni campione. Incubare a temperatura ambiente per 3 ore su un rocker 15 giri/min.
Nota: La soluzione bloccante deve contenere siero da specie ospiti in cui sono cresciuti gli anticorpi secondari (ad es., capra, asino) e sterile filtrata attraverso un 0,22 µm filtrare prima dell'uso. - Preparare la soluzione di diluizione di anticorpo (97 mL di DPBS, 2,5 g di BSA, 2,5 mL di siero (dalla stessa specie ospite come al punto 3.8) e 0,5 mL di Triton X-100). Diluire l'anticorpo primario utilizzando la soluzione di diluizione dell'anticorpo e aggiungere 500 µ l della soluzione di ogni campione. Sigillare la piastra con Parafilm e incubare per una notte a 4 ° C su un agitatore meccanico.
Nota: La nestina e Sox2 anticorpi primari sono stati diluiti 1: 400 in soluzione di diluizione di anticorpo da concentrazione originale del produttore. - Aspirare la soluzione di anticorpo da ogni campione e lavare i campioni con PBST per 60 min a temperatura ambiente su un rocker 15 giri/min. Ripetere il passaggio di lavaggio 3 volte.
- Diluire il brodo secondario di anticorpi e 5 mg/mL DAPI (1:2, 000) utilizzando la soluzione di diluizione dell'anticorpo e aggiungere 500 µ l della soluzione di ogni campione. Coprire la piastra a 24 pozzetti con carta stagnola e incubare per una notte a 4 ° C su un agitatore meccanico.
Nota: Come gli anticorpi secondari sono sensibili alla luce, i campioni devono essere protetti da photobleaching per tutti i passaggi successivi. Capra anti-topo e capra anti-coniglio gli anticorpi secondari sono stati diluiti 1: 500 in soluzione di diluizione di anticorpo da concentrazione originale del produttore. - Aspirare la soluzione di anticorpo da ogni campione e lavare i campioni con PBST per 30 min a temperatura ambiente sul rocker. Ripetere il passaggio di lavaggio 3 volte.
- Posizionare una goccia di mezzo di montaggio salterà sulla superficie di un vetrino. Usando il forcipe, rimuovere la soluzione in eccesso dallo stampo tamponando leggermente il bordo dello stampo su un tovagliolo di carta. Posizionare lo stampo capovolto sul supporto montaggio ed evitare di introdurre bolle.
- Consentire la soluzione di montaggio indurire per 48 h a temperatura ambiente. Conservare i campioni a temperatura ambiente o a 4 ° C. Consentire il mezzo di montaggio completamente impostare per 48 h prima dell'imaging come indice di rifrazione del mezzo cambierà nel corso dell'indurimento. Sigillare i campioni sul vetrino di copertura con smalto trasparente per mitigare il movimento di contaminazione o campione.
- Immagine i campioni utilizzando un microscopio confocale.
Risultati
Il ELPs utilizzata nel presente protocollo sono costituite da cinque regioni: un tag di T7, His6 tag, sito di clivaggio Enterochinasi (EK), una regione di bio-attivi e una regione di elastina-like (Figura 1). I tag T7 e His6 consentono per una facile identificazione mediante tecniche di Western blot standard. Introduzione del sito di clivaggio EK permette la rimozione enzimatica della regione tag, se necessario. La regione di bio-attivi codifica per l'estesa, fibronectin-derivato delle cellule-adesivo ('RGDS') o sequenze non-adesivo ('RDGS'). Infine, la ripetizione centrale di elastina-come regione contiene un gruppo di lisina presso il sito di residuo di ospiti che permette la reticolazione tramite THPC mentre le ripetizioni fiancheggianti contengono isoleucina per ottenere un LCST di ~ 32 ° C31.
Espressione di post, SDS-PAGE o Western blot può essere utilizzato per visualizzare il peso molecolare e confermare l'identità di ELPs che contengono tag di anticorpo, come T7 (MASMTGGQQMG) o His6 (Filippo) (Figura 2). Un prodotto altamente omogeneo rappresentato dalla presenza di una singola banda scura al peso molecolare approssimativo (~ 37 kDa) risultato dell'espressione di successo in condizioni controllate di queste proteine usando entrambi SDS-PAGE (Figura 2A) e Western blot ( Figura 2B).
In condizioni non controllate, la presenza di fasce di peso molecolare inferiore su una macchia occidentale suggerisce che alcune frazioni delle proteine non è stato completamente tradotto e/o sono stati degradati dopo espressione (Figura 2). In particolare, le masse qui sono spaziate uniformemente da ~ 9 kDa che corrisponde al peso di una regione bio-attivi e tre regioni di elastina-come (una ' ripetizione'), o circa un quarto della proteina bersaglio. Questi piccoli frammenti di proteine sono solitamente presenti quando l'espressione viene effettuata ad una temperatura superiore (> 32 ° C) come in Figura 2. La presenza di queste proteine di peso molecolare inferiore può condurre alle proprietà meccaniche imprevedibile. Così, screening regolari post espressione raccomanda di garantire un prodotto finale di alta qualità.
La rigidità meccanica di idrogeli ELP-base può essere modificata modificando la concentrazione di ELP o il rapporto delle ammine primarie di THPC gruppi reattivi: ELP. Contemporaneamente, la concentrazione di ligandi cellulari-adesivo può essere regolata modificando il rapporto di varianti ELP con il cellulare-adesivo (RGDS) alle sequenze (RDGS) non adesiva all'interno di qualsiasi regime di rigidità. Manipolando queste due variabili, possiamo produrre gel che hanno uno spettro di proprietà meccaniche e concentrazioni di ligando (Figura 3).
Per incapsulare le celle all'interno di 3D ELP idrogeli, il numero di celle desiderato è sospese nel mezzo e centrifugato per produrre un pellet cellulare (Figura 4A). Il mezzo è aspirato dal tubo, e le cellule sono risospese in modo uniforme nella soluzione ELP della concentrazione desiderata. Successivamente, THPC soluzione è aggiunto alla sospensione cellulare/ELP e pipettato accuratamente per formare un impasto omogeneo. Questa soluzione è rapidamente trasferita a stampi di silicone sterile all'interno di una piastra a 24 pozzetti usando una pipetta e permesso di reticolano a temperatura ambiente e 37 ° C per 15 min ciascuna (Figura 4B). Infine, il mezzo è aggiunto alla piastra ben e incubato a 37 ° C nell'esperimento.
Live/dead macchiatura può essere utilizzata per valutare la vitalità cellulare e incapsulamento riuscito della cellula all'interno di idrogeli ELP. Come illustrato nella Figura 5, le cellule progenitrici neurali murino adulto (NPC) mostrano la vitalità cellulare alta oltre 7 giorni all'interno di un idrogel ELP del 3% (p/v).
3D ELP idrogeli sono stati precedentemente indicati per sostenere la manutenzione di staminali NPC misurato attraverso l'espressione di marcatori di canonico NPC proteina SRY (sesso che determina regione Y)-box 2 (Sox2) e nestina9. NPC incapsulato in idrogel ELP 3% (p/v) con basso THPC reticolazione Visualizza alta espressione del nucleare localizzato Sox2 e filamenti citoplasmici nestina via immunostaining e imaging confocale (Figura 6).

Figura 1 : Una rappresentazione schematica della ELP e sequenze dell'amminoacido corrispondente. L'ELP utilizzato in questo studio contiene un tag T7 e His6 per imaging basati su anticorpi, una regione bioattiva per introduzione di cella-adesivo domini e una regione di elastina-come che conferisce proprietà meccaniche elastiche e permette per la reticolazione chimica. Clicca qui per visualizzare una versione più grande di questa figura.
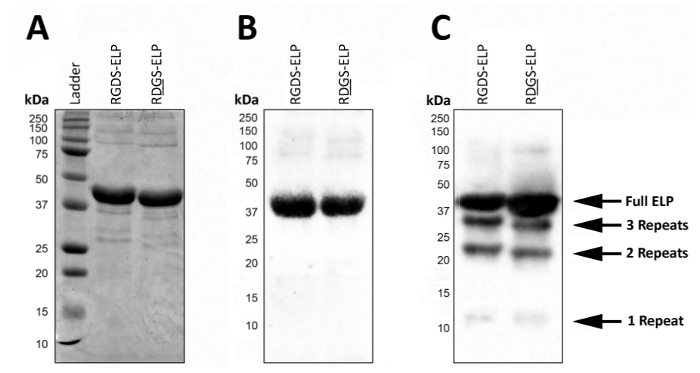
Figura 2 : L'espressione della proteina target possa essere convalidato con SDS-PAGE e Western blot per confermare il peso molecolare e l'identità del prodotto liofilizzato finale. ELP full-length puro viene eseguito a un peso molecolare di kDa 37 come riportato da entrambe le SDS-PAGE (A) e Western blot utilizzando il T7 (MASMTGGQQMG) o istidina tag (ALTHEO) 6 (B). (C). lotti impuri di ELP dovuto le deviazioni dal protocollo di espressione di ELP possono portare all'espressione di ELPs con peso molecolare inferiore. Clicca qui per visualizzare una versione più grande di questa figura.
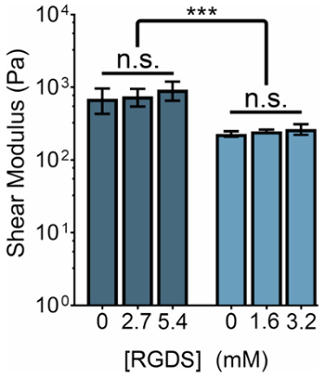
Figura 3: Contenuto di legante RGDS può essere regolato in modo indipendente da proprietà meccaniche all'interno di idrogeli ELP. 5% (p/v) e il 3% (p/v) ELP idrogeli hanno moduli di taglio di ~ 800 Pa e ~ 400 Pa, rispettivamente. Idrogel con un rapporto di 1:1 delle ammine primarie di gruppi reattivi: ELP THPC erano reticolato a temperatura ambiente per 15 min, riscaldata a 37 ° C e permesso di equilibrare per 5 minuti prima della misurazione. I dati sono la media ± SD, *p < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Schematica di incapsulamento di cellule in idrogel ELP. (A). le cellule sono dissociate inizialmente in una sospensione unicellulare a medio e pellettato utilizzando una centrifuga. Il mezzo è aspirato dal tubo, e le cellule sono ri-sospese in soluzione ELP alla concentrazione desiderata e mescolare bene. Infine, la soluzione di reticolazione THPC è aggiunto e mescolata bene. (B). immediatamente dopo l'aggiunta di THPC, la soluzione viene colata in uno stampo in silicone con una pipetta. La soluzione è consentita reticolano a temperatura ambiente per 15 minuti, seguita da una seconda incubazione di 15 min a 37 ° C. Il mezzo viene quindi aggiunto alla cultura bene per tutta la durata dell'esperimento. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Cellule progenitrici neurali mantengono alta redditività in idrogel ELP. Immagine rappresentativa di cellule progenitrici neurali incapsulato nel 3% (p/v) ELP idrogel con reticolazione di 1:1 (ammine primarie di gruppi reattivi: ELP THPC) dopo 7 giorni nella cultura. Verde: vivere colorazione (calceina-AM); Rosso: morti macchiatura (omodimero di etidio). Barra della scala = 100 µm.
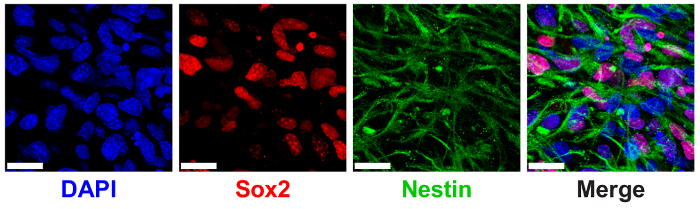
Figura 6 : Supportano 3D ELP idrogeli espressione progenitrici neurali delle cellule staminali maker. Immagine di immunofluorescenza delle cellule progenitrici neurali esprimendo Sox2 e nestina proteine dopo 7 giorni di cultura in idrogel ELP. Le immagini mostrano cellule incapsulate in gel ELP 3% (p/v) con 0.5:1 reticolazione (ammine primarie di gruppi reattivi: ELP THPC). Blu: DAPI (nuclei); Rosso: Sox2; Verde: nestina. Barra della scala = 25 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Purificazione ed espressione recombinant della proteina è un potente strumento per sintetizzare biomateriali con elevata riproducibilità. A causa dell'avvento della clonazione molecolare commercializzato in gran parte, plasmidi ricombinanti personalizzati possono essere acquistati da diversi fornitori, che riduce significativamente il tempo di lavorare con materiali come ELPs. Allo stesso modo, plasmidi possono essere richiesti direttamente dal laboratorio di origine quando l'opera originale è stata sostenuta da un contratto federale e il lavoro futuro sarà per uso no-profit. La sequenza dell'amminoacido ELP precedentemente è stata pubblicata per diverse varianti ELP31. Tuttavia, il processo da espressione a eventuale purificazione delle proteine ricombinanti coinvolge un numero di passaggi critici che comunemente può portare alla diminuzione della resa o un prodotto di qualità inferiore. Alcuni dei problemi più comuni per la preparazione di ELP derivano in uno dei seguenti: (1) la qualità delle scorte batteriche stored, (2) il primo gelo-disgelo ciclo per disturbare la membrana batterica e purificazione (3) della proteina attraverso cicli termici.
Una grande differenza tra l'espressione della proteina e altri mezzi non-biologici di produzione di materiali è che noi stiamo sfruttando le macchine biologiche degli eserciti ricombinante per sintetizzare polimeri. Successivamente, questa tecnica viene fornito con un unico limite: danni o morte cellulare. Morte delle cellule più comunemente si manifesta come un ridotto numero di colonie batteriche dopo striature una piastra o anormalmente piccole colonie che si sviluppano relativamente lentamente. Batterica delle scorte, se mantenute con attenzione, possono rimanere stabile per anni; Tuttavia, cicli di gelività successivi a causa di ripetuti fallimenti di uso o congelatore possono ridurre la vitalità cellulare o portare a danni al DNA. Scorte di batteri tipiche BL21 utilizzano tra 10% e 40% glicerolo in volume miscelato con cellule sospese. Lo scopo del glicerolo è di ridurre il danno della membrana da nucleanti cristalli di ghiaccio durante il congelamento. Pertanto, l'utilizzo di basse concentrazioni (< 10%) può portare ad una membrana compromessa, mentre le più alte concentrazioni (> 40%) può sopprimere il punto di congelamento sufficientemente a dove lo stock non gela mai che porta alla morte delle cellule. Tuttavia, anche all'interno di livelli ottimali di glicerolo, scorte batteriche non essere debba completamente disgelo come una combinazione di danno della membrana dagli effetti citotossici e ri-congelamento dal glicerolo può portare a ridotta redditività stock e danno del DNA. Pertanto, se si osserva che uno stock batterico provoca un conteggio basso Colonia o che le cellule si dividono a una velocità costantemente lenta (che si manifesta come una lenta velocità di rampa600 OD durante espressione), ri-trasformando il plasmide e fare un nuovo stock è un semplice primo approccio per risolvere questo problema. Con questo in mente, per assicurare il mantenimento a lungo termine delle scorte batteriche e integrità del DNA, si consiglia di archiviare le copie del vostro plasmide come DNA purificato congelato in acqua e non all'interno delle cellule. Conservazione del DNA in questo modo farà in modo che in eventi imprevisti come un magazzino non riuscita o il fallimento di congelatore, una fonte affidabile di DNA originale può essere utilizzata per la trasformazione.
Un altro passo fondamentale nella fabbricazione di ELP è la purificazione della proteina dell'obiettivo dall'host espressione. Estrazione di proteine da e. coli è raggiunto dalla rottura della parete cellulare utilizzando nucleanti cristalli di ghiaccio che si formano in tutta la cellula sospesa lisata al congelamento, che è ulteriormente aggravata con cicli di gelo-disgelo successivi. Metodi alternativi per la rottura della parete cellulare possono essere utilizzati ad esempio sonicazione o un tasto. In particolare, consecutivo congelamento-scongelamento del lisato è vantaggioso in quanto richiede solo un congelatore e senza altre attrezzature speciali. Tuttavia, questa procedura rilascia non specifico di DNA, RNA e proteine contaminanti, oltre alle proteasi che hanno il potenziale per degradare la proteina bersaglio. Pertanto, per evitare la contaminazione e ridotto rendimento, desossiribonucleasi I (DNasi) ed il fluoruro di fenilmetanosolfonil (PMSF) stiamo aggiunta la cella lysata di degradare il DNA e di inibire le proteasi, rispettivamente. La presenza di DNA prima dell'aggiunta della dnasi può essere osservata visivamente come un aspetto 'filante' in tutta la cellula ri-sospensione lisata seguendo il primo disgelo. Dnasi attivamente degrada questo DNA e così riduce la viscosità della cella lysata rendendo più facile per purificare tramite centrifugazione. Abbattere ottimale del DNA può essere confermata visivamente facendo in modo che il lisato cellulare sembra essere completamente liquido e che l'aspetto filante non è più visibile. In pratica abbiamo osservato che l'aggiunta di ~0.1 mg di dnasi al lysate delle cellule mL è sufficiente per raggiungere la necessaria degradazione. Tuttavia, se ancora si osserva la presenza di DNA, DNasi ulteriori possono essere aggiunti seguita da ulteriori due o tre ore di agitazione. Un problema simile può verificarsi anche se dnasi viene aggiunto in modo anomalo prima di qualsiasi del lisato ha avuto il potenziale sufficientemente scongelare. In questo caso, le temperature più fredde possono limitare l'efficienza di degradazione del DNA a causa dell'inattivazione precoce della dnasi. Per evitare questo problema, è spesso consigliabile consentire risospeso a scongelare per circa 8 ore prima del trattamento con dnasi. Inoltre, se rese povere in proteine sono segnalate e la ripartizione del DNA è stata sufficiente, l'aggiunta di ulteriori PMSF per contribuire a ridurre ulteriormente il potenziale degradazione proteica da proteasi può essere richiesto.
Considerazioni aggiuntive per garantire l'espressione ottimale di ELPs includono un'attenta comprensione dei benefici e le limitazioni di un antibiotico scelto. Qui, i vettori di pET15b contenente un gene di resistenza all'ampicillina sono stati utilizzati per l'espressione della proteina. Funzionalmente, la serie di animali vettore consentono l'espressione della proteina significativo con oltre il 50% dell'espressione della proteina di un batterio dedicato alla proteina bersaglio seguendo una riuscita induzione32,33. Tuttavia, ampicillina come antibiotico di selezione viene fornito con alcune limitazioni che potrebbero interferire con l'espressione ottimale. In primo luogo, la degradazione di ampicillina in presenza di Escherichia coli può accadere rapidamente a causa del rilascio di beta-lactamase. Se una quantità sufficiente di all'ampicillina è degradata, il plasmide che codifica ampicillina (cioè il plasmide che codifica ELP) vadano perso completamente. Di conseguenza, quando esprimendo ELPs per periodi più lunghi, i livelli di espressione di proteine devono essere attentamente monitorati in momenti successivi per garantire una quantità sufficiente del gene codifica ELP rimane per consentire l'espressione desiderabile. Possibili metodi per la risoluzione dei problemi l'accumulo di beta-lattamasi includono filatura giù la coltura starter e ri-sospende le cellule in medium senza antibiotico prima di inoculare il mezzo di espressione. Questo processo in modo efficace limita il trasferimento degli enzimi degradanti Antibiotico e assicura una maggiore porzione di cellule contengano il vettore di codifica di destinazione-proteina. Inoltre, ampicillina ha una durata limitata di circa due o tre settimane. Pertanto, piastre di coltura per l'espressione della proteina dovrebbero essere conservati a 4 ° C per un massimo di due settimane prima di utilizzare. Infine, per garantire l'efficacia di ampicillina nei media starter ed espressione, la soluzione di riserva di ampicillina dovrebbe essere fresco prodotto immediatamente prima dell'uso, come stoccaggio a lungo termine può portare a un antibiotico meno efficace.
La presenza di un LCST consente la semplice purificazione di ELPs attraverso cicli termici. In particolare, ad una temperatura superiore e in presenza di sali, forze entropiche causano ELPs diventare meno solubili e successivamente formano una fase di coacervate ricca di polimero. D'altra parte, a temperature più basse, ELPs rimangono solubili e prontamente si dissolvono nella soluzione. In bicicletta tra questi regimi di due temperatura accoppiati con procedura di centrifugazione per raccogliere e scartare la fase non contenente ELP successivamente si concentra la proteina e contemporaneamente riduce l'esistenza di contaminanti non-ELP.
Tuttavia, ci sono una serie di fasi, dove ELPs può essere perso in questo processo di purificazione. In primo luogo, prima di ogni giro freddo, la soluzione contenente proteine è alcalinizzata ad un pH di 9,0. Questo pH superiore serve a deprotonate alcuni aminoacidi sulla spina dorsale della proteina, efficacemente lasciandoli in uno stato di caricato e rafforzare ulteriormente la loro solubilità. Di conseguenza, precede questo passaggio o non consentire tempo sufficiente per lo scioglimento di proteine può portare a una diminuzione delle rese come proteine solubilizzate non saranno pellettati durante la centrifugazione e scartati.
Allo stesso modo, proteine bersaglio possono essere persi durante la procedura di rotazione caldo quando l'ELP è pellettati. Inizialmente, NaCl è aggiunto al supernatante ricco di proteine per ridurre la solubilità del PEL. I sali di lavorano per proteggere interazioni elettrostatiche tra le molecole di acqua e proteine, causando la proteina separare dalla fase acquosa. Questo effetto è amplificato riscaldando la soluzione, che, a causa di effetti entropici, ulteriormente l'idrato 'gabbia' che circonda ELPs si rompe e costringe l'aggregazione delle proteine. Alle concentrazioni più basse di proteina (cioè., il primo ciclo termico), l'aggiunta di sali da solo spesso non è sufficiente a causare questa separazione di fase. Tuttavia, come la concentrazione di proteina aumenta (cioè., più tardi i cicli termici) e ci sono meno contaminanti secondari per interagire con i sali, l'ELP precipiterà più prontamente. Di conseguenza, se sali vengono aggiunti troppo rapidamente, essi potrebbe diventare fisicamente intrappolati mediante l'aggregazione di proteine, che efficacemente riduce la concentrazione salina della soluzione e limita ulteriore precipitazione della proteina. Così, il sale deve essere aggiunto in tre piccoli lotti per garantire che abbiano il tempo sufficiente per distribuire omogeneamente attraverso la soluzione. Come nota finale, variazioni per la spina dorsale ELP, sia attraverso ulteriori modifiche al residuo degli ospiti della regione elastino-simili o cambiamenti nella regione di bio-attivi possono influenzare notevolmente il comportamento LCST. Di conseguenza, per garantire rendimenti ottimali della proteina in varianti della proteina, è fondamentale ottimizzare il pH e la concentrazione di sale sale tipo (ad es., monovalenti o bivalenti) per i giri caldi e freddi.
Come può essere utilizzato per determinare facilmente se perdita significativa di ELP si verifica durante una qualsiasi delle fasi di purificazione, è consigliabile eseguire SDS-PAGE al completamento del protocollo. Brevemente, se ELP è rilevato nel surnatante seguendo un giro caldo, quindi la proteina non è essere efficacemente precipitata. Allo stesso modo, se ELPs sono identificati in un campione di pellet solubilizzate seguendo un giro freddo, quindi la proteina non viene efficacemente dissolto.
ELP idrogel offrono molti vantaggi rispetto ai materiali sintetici o di derivazione naturale. In particolare, l'uso dell'ammina-reattivo crosslinker THPC offre un meccanismo di basso costo, semplice e sintonizzabile di reticolazione della proteina. Tuttavia, esistono limitazioni distinte all'interno del protocollo di reticolazione che dovrebbe essere notato. THPC è ossigeno sensibile, e se conservati in condizioni non adeguate, può rapidamente deteriorarsi in efficienza di reazione. Inoltre, a causa della sua reattività con le ammine primarie, THPC può reagire con circostante proteine nei media o quelli sulla superficie delle cellule che sono ricche di ammine. Di conseguenza, quando si formano gli idrogeli ELP, è consigliabile per evitare la contaminazione di media con il pellet cellulare per ridurre la reattività crociata possibili proteine esogene e così, una riduzione nell'efficienza di reticolazione. Infine, questo meccanismo di reticolazione preclude la sequenza di bio-attivi regione a quelli non contenenti residui di lisina e limita quindi, potenziale integrazione di alcuni motivi di cella-adesivo (ad es., IKVAV34). Per risolvere queste limitazioni, modifiche per la spina dorsale ELP con azide e bicyclononyne (BCN) soci di reazione permette di reticolazione bio-ortogonali, come descritto in precedenza27.
Si deve osservare che il comportamento di ELP LCST svolge un ruolo importante nel dettare idrogel microstruttura. A regimi di temperatura sopra il LCST, ELPs precipitare dalla soluzione la formazione di fasi ricche in proteine e proteina-carente che possono influenzare la porosità della matrice e dell'efficienza di reticolazione della matrice9. Perché maggior parte degli esperimenti di coltura cellulare sono condotti a temperature fisiologicamente rilevanti (~ 37 ° C) sopra il LCST ELP, questi effetti dovrebbero essere considerati. Nel caso degli idrogeli efficacemente crosslink e forma una rete interconnessa di proteina, l'ammina primaria dalla lisina deve essere fisicamente accessibile per il reticolante THPC. Se l'aggregazione di ELP si verifica prima di raggiungere la reticolazione sufficienti, ELPs intrappolato all'interno della fase ricca di proteine può essere inaccessibile e quindi incapace di partecipare a reticolazione. Per risolvere questa limitazione, il nostro protocollo richiede un periodo di reticolazione iniziale 15 min a temperatura ambiente, che consente di reticolazione preliminare dell'idrogel prima l'ELP subisce la transizione di fase termica. Questa incubazione a temperatura ambiente è seguita da un'incubazione di ulteriori 15 min a 37 ° C per finalizzare la reticolazione di idrogel. Questa procedura è fondamentale per reticolazione sufficienti e robusto, riproducibile gelificazione del materiale ELP.
In conclusione, la proteina ricombinante idrogeli fabbricati con ELP offrono eccezionale accordabilità della sequenza della proteina e quindi il microambiente cellulare 3D. Polimeri ELP sono stati dimostrato di essere esprimibili in alti rendimenti, facilmente purificati a causa del loro comportamento LCST e biocompatibile in un'ampia varietà di sistemi in vitro e in vivo . L'uso di e. coli come un host ricombinante fornisce una procedura semplice e poco costoso che dà origine al vicino perfetto controllo del peso molecolare del polimero e la funzionalità. In concomitanza, questa tecnica permette di accordabilità robusto e riproducibilità della piattaforma idrogel permettendo per la cultura di una vasta gamma di tipi di cellule in 3D. Infine, questa piattaforma di idrogel ELP è suscettibile di molti saggi biochimici a valle tra cui qRT-PCR, Western blot, estrazione del DNA e delle cellule che immunostaining9.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano T. Palmer e H. Basile (Stanford neurochirurgia) per la fornitura di murino NPC. Vector art nella Figura 4 è stato usato e adattato da Servier arte medica sotto Creative Commons Attribution 3.0 Unported License (https://creativecommons.org/ licenses/by/3.0/legalcode). Parte di questo lavoro è stato effettuato presso la Stanford Nano ha condiviso strutture (FNS), sostenuto dalla National Science Foundation sotto Premio ECCS-1542152. N.a.s. riconosce sostegno dal National Institute of General Medical Sciences, della National Institutes of Health (32GM 008412). C.m.m. riconosce il supporto da un NRSA NIH pre-dottorato (F31 EB020502) e il programma di studiosi di Siebel. S.C.H riconosce sostegno dal National Institutes of Health (U19 AI116484 ed EB018407 R21), National Science Foundation (DMR 1508006) e il California Institute for Regenerative Medicine (RT3-07948). Questa ricerca ha ricevuto finanziamenti dall'alleanza rigenerativa riabilitazione Research & Training (AR3T), che è sostenuta dalla Eunice Kennedy Shriver National Institute of Child Health e Human Development (NICHD), Istituto nazionale di Disordini neurologici e colpo (NINDS) e Istituto nazionale di Imaging biomedico e Bioingegneria (NIBIB) degli istituti nazionali di salute sotto Premio numero P2CHD086843. Il contenuto è di esclusiva responsabilità degli autori e non rappresentano necessariamente le opinioni del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Elastin-Like Protein Expression and Purification | |||
| 10 cm Petri Dishes | Thermo Fisher Scientific | FB0875713 | |
| 70% Ethanol | RICCA Chemical | 2546.70-1 | |
| Ammonium Sulfate | Sigma-Aldrich | A3920-500G | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25G | |
| Bacto Agar | Thermo Fisher Scientific | 9002-18-0 | |
| BL21(DE3)pLysS Competent Cells | Invitrogen | C606003 | |
| Chloramphenicol | Amresco | 0230-100G | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| EDTA disodium salt, dihydrate | Thermo Fisher Scientific | O2793-500 | |
| Glycerol | Thermo Fisher Scientific | BP229-4 | |
| Isopropanol | Thermo Fisher Scientific | A451-4 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | BP1755-10G | |
| Luria Broth | EMD Millipore | 1.10285.5007 | |
| Parafilm | VWR | 52858-000 | |
| Phenylmethanesulfonyl fluoride (PMSF) | MP Biomedicals | 195381 | |
| Sodium Chloride | Thermo Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Sigma-Aldrich | S 8045-1KG | |
| Syringe Filter Unit (0.22 μm) | Millipore | SLGP033RB | |
| Terrific Broth | Millipore | 71754-4 | |
| Tris Base | Thermo Fisher Scientific | BP152-1 | |
| Cell Encapsulation in 3D ELP Hydrogels | |||
| 0.22 μm syringe filters | Millipore | SLGV004SL | |
| 0.5 mm thick silicone sheet | Electron Microscopy Science | 70338-05 | |
| 24-well tissue culture plates | Corning | 353047 | |
| Disposable Biopsy Punch (2 mm) | Integra Miltex | 33-31 | |
| Disposable Biopsy Punch (4 mm) | Integra Miltex | 33-34 | |
| Disposable Biopsy Punch (5 mm) | Integra Miltex | 33-35 | |
| Dulbecco’s phosphate buffered saline (DPBS) | Corning | 21-031-CM | |
| No. 1 12 mm glass coverslips | Thermo Fisher Scientific | 12-545-80 | |
| Tetrakis(hydroxymethyl)phosphonium chloride (THPC) | Sigma-Aldrich | 404861-100ML | |
| 0.5% Tryspin/EDTA | Thermo Fisher | 15400054 | |
| Immunocytochemistry of Cells in 3D ELP Hydrogels | |||
| 16% (w/v) Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15701 | |
| Bovine Serum Albumin (BSA) | Roche | 3116956001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Donkey Serum | Lampire Biological Labs | 7332100 | |
| Goat anti-mouse Secondary Antibody (AF488) | Molecular Probes | A-11017 | |
| Goat anti-rabbit Secondary Antibody (AF546) | Molecular Probes | A-11071 | |
| Goat Serum | Gibco | 16210-072 | |
| Mouse Nestin Primary Antibody | BD Pharmingen | 556309 | |
| Mouse Sox2 Primary Antibody | Cell Signaling Technology | 23064S | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Vectashield Hardset Mounting Medium | Vector Labs | H-1400 |
Riferimenti
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294 (5547), 1708-1712 (2001).
- Birgersdotter, A., Sandberg, R., Ernberg, I. Gene expression perturbation in vitro-A growing case for three-dimensional (3D) culture systems. Seminars in Cancer Biology. 15 (5), 405-412 (2005).
- Gómez-Lechón, M. J., et al. Long-term expression of differentiated functions in hepatocytes cultured in three-dimensional collagen matrix. Journal of Cellular Physiology. 177 (4), 553-562 (1998).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Justice, B. A., Badr, N. A., Felder, R. A. 3D cell culture opens new dimensions in cell-based assays. Drug Discovery Today. 14 (1-2), 102-107 (2009).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Madl, C. M., et al. Maintenance of neural progenitor cell stemness in 3D hydrogels requires matrix remodelling. Nature Materials. 16 (12), 1233-1242 (2017).
- Discher, D. E., Janmey, P., Wang, Y. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Sun, Y., Villa-Diaz, L. G., Lam, R. H. W., Chen, W., Krebsbach, P. H., Fu, J. Mechanics Regulates Fate Decisions of Human Embryonic Stem Cells. PLoS ONE. 7 (5), e37178 (2012).
- Ehrbar, M., et al. Elucidating the Role of Matrix Stiffness in 3D Cell Migration and Remodeling. Biophysical Journal. 100 (2), 284-293 (2011).
- Rowlands, A. S., George, P. A., Cooper-White, J. J. Directing osteogenic and myogenic differentiation of MSCs: interplay of stiffness and adhesive ligand presentation. American Journal of Physiology - Cell Physiology. 295 (4), 1037-1044 (2008).
- Lampe, K. J., Antaris, A. L., Heilshorn, S. C. Design of three-dimensional engineered protein hydrogels for tailored control of neurite growth. Acta Biomaterialia. 9 (3), 5590-5599 (2013).
- Kilian, K. A., Mrksich, M. Directing Stem Cell Fate by Controlling the Affinity and Density of Ligand-Receptor Interactions at the Biomaterials Interface. Angewandte Chemie International Edition. 51 (20), 4891-4895 (2012).
- Tse, J. R., Engler, A. J. Preparation of Hydrogel Substrates with Tunable Mechanical Properties. Current Protocols in Cell Biology. , 10.16.1-10.16.16 (2010).
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: A complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- DiMarco, R. L., Heilshorn, S. C. Multifunctional Materials through Modular Protein Engineering. Advanced Materials. 24 (29), 3923-3940 (2012).
- Meyer, D. E., Chilkoti, A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nature Biotechnology. 17 (11), 1112-1115 (1999).
- Aladini, F., Araman, C., Becker, C. F. W. Chemical synthesis and characterization of elastin-like polypeptides (ELPs) with variable guest residues. Journal of Peptide Science. 22 (5), 334-342 (2016).
- McMillan, R. A., Caran, K. L., Apkarian, R. P., Conticello, V. P. High-Resolution Topographic Imaging of Environmentally Responsive, Elastin-Mimetic Hydrogels. Macromolecules. 32 (26), 9067-9070 (1999).
- McMillan, R. A., Conticello, V. P. Synthesis and Characterization of Elastin-Mimetic Protein Gels Derived from a Well-Defined Polypeptide Precursor. Macromolecules. 33 (13), 4809-4821 (2000).
- Chung, C., Lampe, K. J., Heilshorn, S. C. Tetrakis(hydroxymethyl) Phosphonium Chloride as a Covalent Cross-Linking Agent for Cell Encapsulation within Protein-Based Hydrogels. Biomacromolecules. 13 (12), 3912-3916 (2012).
- Romano, N. H., Madl, C. M., Heilshorn, S. C. Matrix RGD ligand density and L1CAM-mediated Schwann cell interactions synergistically enhance neurite outgrowth. Acta Biomaterialia. 11, 48-57 (2015).
- Shah, M., Hsueh, P. Y., Sun, G., Chang, H. Y., Janib, S. M., MacKay, J. A. Biodegradation of elastin-like polypeptide nanoparticles. Protein Science. 21 (6), 743-750 (2012).
- Nettles, D. L., Chilkoti, A., Setton, L. A. Applications of elastin-like polypeptides in tissue engineering. Advanced Drug Delivery Reviews. 62 (15), 1479-1485 (2010).
- Madl, C. M., Heilshorn, S. C. Tyrosine-Selective Functionalization for Bio-Orthogonal Cross-Linking of Engineered Protein Hydrogels. Bioconjugate Chemistry. 28 (3), 724-730 (2017).
- Zhu, D., Wang, H., Trinh, P., Heilshorn, S. C., Yang, F. Elastin-like protein-hyaluronic acid (ELP-HA) hydrogels with decoupled mechanical and biochemical cues for cartilage regeneration. Biomaterials. , 132-140 (2017).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Bio-Orthogonally Crosslinked, Engineered Protein Hydrogels with Tunable Mechanics and Biochemistry for Cell Encapsulation. Advanced Functional Materials. 26 (21), 3612-3620 (2016).
- Cai, L., Dinh, C. B., Heilshorn, S. C. One-pot synthesis of elastin-like polypeptide hydrogels with grafted VEGF-mimetic peptides. Biomater Sci. 2 (5), 757-765 (2014).
- Straley, K. S., Heilshorn, S. C. Independent tuning of multiple biomaterial properties using protein engineering. Soft Matter. 5 (1), 114-124 (2009).
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current Opinion in Biotechnology. 10 (5), 411-421 (1999).
- Graumann, K., Premstaller, A. Manufacturing of recombinant therapeutic proteins in microbial systems. Biotechnology Journal. 1 (2), 164-186 (2006).
- Tashiro, K., et al. A Synthetic Peptide Containing the IKVAV Sequence from the A Chain of Laminin Mediates Cell Attachment, Migration, and Neurite Outgrowth. Journal of Biological Chemistry. 264 (27), 16174-16182 (1989).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon