Method Article
カプセル化と 3 D の細胞の免疫染色のエラスチン様タンパク質ゲルの生産
要約
組換え蛋白質設計ヒドロゲルは、ポリマー主鎖としたがって、細胞の微小環境の完全な可変性を可能にする彼ら 3 D 細胞培養のために有利です。ここでは、組換えのエラスチンのような蛋白質の浄化のプロセスと 3 D ゲル電池封止材への応用について述べる。
要約
二次元 (2 D) 組織培養技術は、基礎的な細胞生物学の私達の理解に不可欠されています。ただし、従来の 2次元培養システムに欠けて結果の間で重要な結果として、三次元 (3 D) マトリックス切断収集の in vitroおよびin vivo。この制限に対処するため、研究者は体内細胞微小環境の生化学的および生物物理学的特性を模倣することができます 3 D のハイドロゲル培養プラットフォームを設計しました。この研究、3 D の細胞のカプセル化と下流の生化学的アッセイをサポートする材料のプラットフォームを開発する必要が動機となった。組換えタンパク質工学 3 D ゲル材料の設計と開発のユニークなツールセットを提供は、蛋白質シーケンスの特定のコントロールを可能にするあり、拡張子、合力の潜在的な力学的および生化学的特性行列。ここでは、recombinantly 由来エラスチン様タンパク質 (ELP) 独立可変の機械的性質と細胞接着リガンド濃度フォーム ヒドロゲルを使用ことができますの表現のためのプロトコルを提案する.さらに ELP ヒドロゲル内細胞のカプセル化の方法論を提案して、下流の分析と定量化のための細胞を埋め込まれたの後蛍光抗体染色します。
概要
過去世紀にわたって基礎的な細胞生物学の研究のための不可欠なツールセットに二次元 (2 D) 組織文化を開発しました。さらに、2 D の細胞培養のため比較的低コストでシンプルなプロトコルは、多くの生物的および医学の分野での採用につながっています。しかし、過去の研究を示しています伝統的な 2 D のプラットフォームは、それら収集した体内から著しく逸脱、原因の貴重な時間と資金を無駄に臨床的に方向づけられた研究1,2のための結果につながること 3。我々 と他のこの不一致は最適な増殖と種々 の細胞の成熟に必要なことができる 2D サーフェス上で培養した細胞に提供されるネイティブ生化学的および生物物理学的手がかりの不足に帰因するかもしれないことを仮定します。
これらの制限および助け橋 2 D の間のギャップに対処するための in vitroとin vivoの研究、研究者がある電池封止材1,4,5 の開発した三次元 (3 D) ゲル プラットフォーム ,6。ヒドロゲルは細胞外マトリックス (ECM) の生体内での組織のような機械的性質と栄養素の急速な輸送を可能にする構造の水膨潤により内因性の微小環境を要約する理想的な材料と7,8の要因シグナリングします。さらに、足場の力学的および生化学的特性を独立に制御する 3 D ゲルを設計できます。行列力学9,10、11,12と細胞接着配位子13,14,15の両方がよくセルに影響を与える知られています。生体外で動作し、体内。したがって、可変プロパティと 3 D ゲルは、セルとその微小環境の因果関係を研究するためのプラットフォームを提供しています。理想的な 3 D ゲルのマトリックスのための基準は、単純な非細胞電池封止材、生理学的に関連する機械的性質の独立した可変性およびネイティブな細胞接着モチーフの模倣者に含まれます。
両方合成 (e.g、ポリエチレング リコール、ポリ乳酸、ポリ (グリコール酸)) および自然由来 (e.g。、アルギン酸、コラーゲン、マトリゲル) ヒドロゲル文化プラットフォーム 2D体外に利点があります。しかし、また適用性を限る重大な欠点があります。まず、合成と天然物由来の多くのプラットフォームが必要な哺乳類細胞に潜在的に有毒することができます過酷な架橋条件につながる減少した細胞の生存率の7。また、多くの合成プラットフォームはネイティブ活性を欠いている、増加コストと複雑さの16を追加することができますセカンダリの化学反応によって修飾する必要があります。最後に、天然由来原料は通常本質的な生体活性ドメインを含みますが、しばしば高いバッチごとに変動に悩まされているため、比較的弱いゲル7,17を形成に制限が多い。
組換えタンパク質工学タンパク質シーケンスを明示的に制御により材料設計のためのユニークなツールセットを提示し、延長によって、最終的なハイドロゲルの潜在的な力学的および生化学的特性足場18。また、エシェリヒア属大腸菌(E. 大腸菌) 蛋白質を表現するためのよく知られている生物学的機械を活用し、材料生産できる低コストで一貫して限られたインター-内-バッチ可変。ここで紹介するエラスチン様タンパク質 (ELP) は 3 つのエンジニア リング ドメイン: 抗体のタグを介して蛍光ラベリングを可能に (1) の T7 および His6 タグ、弾性力学特性を付与し、化学のエラスチンのような地域 (2)架橋、(3) 細胞接着モチーフのエンコード 'バイオ アクティブ' 地域。
エラスチンのような地域は、'効きます' アミノ酸サイト イソロイシン (イル) がある可能性がありますの 4 つはプロリンを除くすべてのアミノ酸に設計されている標準 (ヴァル Pro Gly 効きます-ペプチド-)5エラスチン シーケンスに基づいています。このシーケンスは、熱循環19,20を介して簡単な浄化後式の利用できる下の臨界溶液温度 (LCST) 行動と遺伝子組換え ELPs を与えます。この LCST プロパティは、異なる温度で熱骨材へゲスト '効きます' 残渣21,22を変更することでチューニングできます。
ここでは、5 つのエラスチンのような繰り返しの 1 つに「効きます」位置はリシン (Lys) アミノ酸のアミン提示酸架橋ハイドロゲルを利用されるに置き換えられていますいます。我々 の以前の仕事は、アミン反応性架橋剤テトラキス (ヒドロキシメチル) ホスホニウム塩 (THPC)23の反応特異性と堅牢な架橋を示しています。さまざまな全体蛋白質内容と架橋剤濃度による、生理学的に関連する剛性の範囲 (~0.5-50 kPa)9,23,24にまたがることチューニングできるゲルを生成することができるがおります。機械的特性をチューニングに加えて ELP 蛋白質のバックボーン内の標準的な細胞接着ドメインの統合から、ハイドロゲル内細胞接着の結果します。たとえば、非バインド 'RDGS' バリアント拡張フィブロネクチン由来 'RGDS' アミノ酸シーケンスの組み込むことで柔軟な形態、スクランブル中の細胞接着と細胞-マトリックス接着24が制限されます。総蛋白濃度と同様に、非接着タンパク質に細胞接着の比率を調節することによって効果的に配位子濃度の広い範囲でゲルを生成することができるがおります。その結果、種々 の細胞の最適な 3 D 文化のため個別にチューニングできる分離された生化学的および生物物理プロパティを持つハイドロゲル プラットフォームを開発しました。
剛性マトリックスと接着性リガンドの可変性に加え組換えヒドロゲルは細胞拡散、増殖、および4の 3 D のコンテキスト内での移行に必要なデザイン特定の材料劣化プロファイル機能を提供します。,9. この劣化は拡張 'RGDS'9またはエラスチンのようなシーケンス25を標的プロテアーゼの細胞分泌によって与えられます。ELP ヒドロゲルは、細胞生存率及び量的な逆の DNA ・ RNA ・ タンパク質抽出と同様に、免疫細胞化学を含む関数を勉強するために必要なその後の生化学的アッセイをサポートに示されています。トランスクリプション ポリメラーゼの連鎖反応 (qRT PCR) と西9 をしみ。ELP の亜種も、生体内でのモデルの数で使用されているし、免疫システム26忍容性が知られています。
一緒に取られて、ELP 電池封止材研究材料プラットフォームを誇るさまざまな生化学的および生物物理可変性のと同じ程度に欠ける、合成や天然物由来の素材プラットフォームと比較しての利点として、再現性。さらに、ELP のシンプルで非細胞毒性を使用さまざまな種類の細胞 (e.gひよこ後根神経節14,24、マウス神経前駆細胞9、ヒト間葉系幹細胞27、牛。新生児軟骨細胞28、ひと血管内皮細胞細胞29,30) 2 D 細胞培養と比較して内因性 3 D ECM のもっと生理学的に関連するモデルのことができます。ここで、recombinantly 由来の表現のためのプロトコルを提案する、3 d 可変ハイドロゲルのプラットフォームとして使用するための非細胞カプセル化。さらにダウン ストリームの蛍光標識とカプセル化された細胞の共焦点顕微鏡観察の方法論を提案します。
プロトコル
1. ELP の表現のプロトコル
- 1 日目: 成長スターター コロニー
- スープと純水 1 L あたり寒天 15 g オートクレーブ ルリアの 25 g、アンピシリン、クロラムフェニ コール寒天を準備します。ソリューションは、〜 60 ° C に冷却して、最終濃度 100 μ G/ml と 34 μ g/mL の寒天液の 1 L に 1 mL アンピシリン株式 (100 mg/mL の純水) とクロラムフェニ コール証券 (70% エタノールで 34 mg/mL) 1 mL を追加します。、それぞれ。血清ピペットで 10 cm シャーレに最終溶液 20 mL を転送でき、寒天を固める。パラフィルム 4 ° C でストアとペトリ皿をラップします。
注: ペトリ皿は 4 ° C で 2 週間保存できます。 - BL21 の小さなサンプルを連勝 (DE3) pLysS大腸菌アンピシリン、クロラムフェニ コール寒天利息の ELP のエンコーディング pET15b ベクターを含む既製細菌の在庫から。
注記: アンピシリン、クロラムフェニ コールは、pET15b と pLysS の両方のベクトルをそれぞれ含んでいる細菌の選択します。 - 37 ° C でインキュベーターで逆さま縞板を場所します。一晩培養する細菌のコロニーを許可します。
注: 16 時間以上板孵化しないで、アンピシリンが劣化、アンピシリン抵抗しない行う植民地を形成することができます。
- スープと純水 1 L あたり寒天 15 g オートクレーブ ルリアの 25 g、アンピシリン、クロラムフェニ コール寒天を準備します。ソリューションは、〜 60 ° C に冷却して、最終濃度 100 μ G/ml と 34 μ g/mL の寒天液の 1 L に 1 mL アンピシリン株式 (100 mg/mL の純水) とクロラムフェニ コール証券 (70% エタノールで 34 mg/mL) 1 mL を追加します。、それぞれ。血清ピペットで 10 cm シャーレに最終溶液 20 mL を転送でき、寒天を固める。パラフィルム 4 ° C でストアとペトリ皿をラップします。
- 2 日目: スターター文化・表現メディアの準備
- インキュベーターから大腸菌文化を削除します。パラフィルム プレートと最大 4 ° C で 4 日間のための店
- スターターの培養用フラスコ (250 mL) と式培養フラスコ (12 x 1 L) とオートクレーブを準備します。Expression media の 1 L は、純水 2 L 困惑して培養フラスコでの 1 L に素晴らしいスープの 47.6 g、グリセリンの 4 つの mL を追加し、アルミ箔とキャップします。
注: 典型的な収穫は、expression media の 60-100 mg/L タンパク質です。 - 予め温めておいた、37 ° C の振動インキュベーターにオートクレーブのスターターを読み込むし、撹拌せず孵化させなさい。
- 最終濃度 100 μ G/ml のスターター文化に無菌ろ過 (0.22 μ m フィルター) アンピシリン株式 (100 mg/mL の純水) の 250 μ L を追加します。すぐに 250 rpm でスターター文化を攪拌を開始します。
注: クロラムフェニ コール寒天で植民地選択は、液体文化のため含まれていません。 - 縞板から単一 ELP プラスミドを含む大腸菌コロニーを追加してスターター文化を接種し、37 ° C 16 h で振るようにスターター文化を許可します。
- フラスコで加温、インキュベーター 37 ° C 式培地を配置し、フラスコは次の朝を接種する準備ができているように撹拌せず一晩インキュベートします。
- 3 日目:大腸菌でのタンパク質発現を誘導します。
- 新鮮な無菌ろ過アンピシリン株式 (純水 100 mg/mL) を作る。最終濃度 100 μ G/ml の expression media の各フラスコにアンピシリン株式の 1 つの mL を追加します。
- 250 回転式メディア攪拌を開始します。
- 任意の式のフラスコからメディアの 2 mL サンプルを取り出して、600 に読み取る光学密度の空白としてキュベットに追加 nm (外径600)。
- 16 時間スターター文化培養終了後血清ピペットを介して各式フラスコにスターター文化の 20 mL を転送することによって各式フラスコを接種します。
- 1 時間攪拌終了後 OD600式フラスコの 1 つを測定します。この手順では、次の OD600たびに異なるフラスコをチェック、すべての 20 分を測定します。
- 0.6 の600を OD、32 ° c. に式フラスコを含むシェーカーの温度を下げる
- 外径600 10 分毎に確認してください。0.8 の600を OD、無菌ろ過 β イソプロピル thiogalactoside (IPTG) 各式フラスコに純水 1 M の 1 つの mL を追加することで発現を誘導します。
- 7 時間を表現する式のフラスコで大腸菌を許可します。
- 式の終わりの前に 20 分前クール 4 ° C に大床遠心
- 個々 の遠心分離機コンテナーとバランス式メディアのすべての 12 L を収集します。
- 遠心式メディア > 床の遠心分離機を使用して 4 ° C で 15 分間 12,000 × g。
- 各遠心容器から上澄みを離れて注ぐ。ヘラを使用して、あらかじめ重量を量られた zip ロックの袋に細胞ペレットを収集します。
- 再滅菌フィルター 10 バッファー (100 mL のバッファー ペレットの 25 g あたり) にペレットを中断し、ペレットをマッサージすることで余分な空気の泡を削除します。10 のバッファーの 1 L の純水 900 mL に塩化ナトリウムの 5.8 g、基本、トリスの 1.21 g とエチレンジアミン四酸 (EDTA) 二ナトリウム塩二水和物の 0.37 g を追加します。8.0 pH を調整し、1 l をもたらすこのステップの pH ストリップで十分です。
- 二次容器に再懸濁細胞ペレットを含む zip ロックの袋を置き、一晩-80 ° C で凍結します。
- 4-6 日目: 凍結融解サイクルを介して細菌の細胞壁を破壊
- 冷凍庫から冷凍餌を外し、ゆっくりと軌道のシェーカーを使用して穏やかな攪拌と 4 ° C で融解すること。
- いくつかの液体が存在するまでの解凍がペレットを許可します。追加 30 〜 40 mg のデオキシリボヌクレアーゼ I (DNase) 解凍ライセート。また、細胞ライセートの 100 mL あたりのイソプロパノールの 100 mM phenylmethylsulphonyl フッ化物 (PMSF; プロテアーゼ阻害剤) の 1 つの mL を追加します。一晩を振るライセートを許可します。
注: が必要な最初の凍結融解サイクルだけ PMSF と DNase の追加です。
注意: PMSF は吸入した場合有害です。PMSF 粉体を処理するときに、顔のマスクを使わなければなりません。 - 細胞ライセートは完全に解凍、凍結しますライセート-80 ° C で一晩、またはになるまで完全に凍結します。
- 合計 3 つのサイクルの凍結融解手順を繰り返します。最後の凍結融解後、4 ° C で融解、ライセートを残します。生浄化の結論にナトリウム dodecyl 硫酸ポリアクリルアミド ゲルの電気泳動 (SDS-PAGE) 分析用溶解液 100 μ を格納します。
- 最後の解凍後、解凍の 9.0 1 M NaOH を使用して溶解液の pH を調整します。このステップの pH ストリップで十分です。4 ° C 少なくとも 1 時間インキュベート (一晩は適切な) 軌道シェーカーで。
- 7-9 日: 冷・温スピン熱サイクルを介して ELP 浄化
- 4 ° C 20 分遠心分離前に床の遠心分離機をクールします。
- 因数と遠心容器に lysate をバランス、解凍。
- 遠心分離機のサンプルで > 4 ° C で 1 時間 15,000 × g浄化の完了の後の SDS-PAGE 解析の上清 100 μ L を格納します。
注: 遠心分離後、その LCST 以下の温度で水の高溶解性の関係上清に残るべきである ELP タンパク質 (< 32 ° C)。 - 上清を新しい遠心容器に転送し、適切にバランスをとる。
- 最終濃度 1 M (5.84 g 塩化ナトリウムの上澄みのすべて 100 ml) に、3 つの部分に塩化ナトリウム (NaCl) を追加します。塩化ナトリウムが十分な分解を許可する 3 つの部分に追加されることを確認します。
- 揺れのインキュベーターで 250 rpm で 37 ° C で 3 時間を揺り動かしなさい。
- 撹拌の終わりの前に 1 時間事前暖かい床遠心分離機を 37 ° C
- 遠心分離機 > 37 ° C で 1 時間 15,000 × g浄化の完了の後の SDS-PAGE 解析の上清 100 μ L を格納し、残りの上澄みを廃棄します。
注: 遠心分離後、ELP タンパク質必要がありますされるペレットの LCST 以上の温度で水に難溶のため (> 32 ° C)。 - 再ペレットの 1 g あたりのオートクレーブ、純水の水 10 mL を追加することでペレットを中断します。金属ヘラを使用すると、タンパク質の分解を支援するのにペレットをマッシュ アップします。
- 1 M NaOH を使用して 9.0 ライセート、解凍の pH を調整します。このステップの pH ストリップで十分です。
- 軌道シェーカーで 4 ° C で一晩を揺り動かしなさい。
- 3 つのサイクルの合計で寒さとホット スピン熱サイクリング手順を繰り返します (すなわち。、手順 1.5.11 を通じて 1.5.1 3 総サイクル数)。
- 10-15 日: ELP 透析と凍結乾燥
- 遠心分離機で中古冷蔵遠心分離機の再懸濁のペレット > 4 ° C で 1 時間 15,000 × g浄化の完了の後の SDS-PAGE 解析の上清 100 μ L を格納します。
- 4 ° C であらかじめ冷やして超純水水 4 L に対して 3.5 kDa 透析膜の残りの上澄みをおこしによるタンパク質溶液を脱塩します。6 回以上 3 日間の合計の 1 日 2 回透析水を変更します。
注: 典型的な上澄みボリューム 5 と 30 mL の間です。 - 遠心分離機で予冷、遠心分離機で透析ソリューション > 4 ° C で 1 時間 15,000 × g浄化の終わりの SDS-PAGE 解析の上清の 100 μ L を格納します。
- 結果としてあらかじめ重量を量られた円錐管で-80 ° C で培養上清をフリーズします。
- 3 日間・物質蛋白質収量を決定する最終製品の凍結を凍結乾燥します。
- パラフィルム ELP 製品や店舗に最終を含む管が凍結乾燥 4 ° C で
- 蛋白質の純度を決定する SDS ページを実行します。
注: SDS-PAGE のプロトコルは特定の agarose のゲルの条件に基づいて異なります。我々 の実験のため最終的な凍結乾燥タンパク質濃度 0.5 mg/mL の脱イオン水に溶解し、12% (w/v) アクリルアミドゲル変性条件下で 70-100 分の 140 V で実行します。
2. 細胞 3 D エラスチン様蛋白質ゲルのカプセル化
- シリコンモールドの作製
- 希望の直径と生検パンチを使用して、0.5 mm 厚のシリコン シートで穴を作成し、各ホールを囲む四角形をカットします。必要な金型の数に対して繰り返します。
注: 外径及び肉厚、金型の特定のアプリケーションと細胞培養条件を調整できます。50 の細胞培養のための実習では 10 の6セル/mL、4 mm と 5 mm の直径 0.5 mm 厚い金型はそれぞれ十分な DNA ・ RNA、タンパク質の抽出に推奨されます。免疫染色の 2 mm 生検パンチは、ウェルあたり 3 つ複製を汚すことができるように代わりに正方形金型ごとの 3 つの隣接する穴を作成する使用できます。 - ピンセットで個々 の金型の各側にプラスチック製のラップを削除します。
注: は、汚染は今後プラズマ接合効率を減らすことができます、さらされたシリコーン表面との接触を避けてください。 - ピンセットを使用して、48 ウェル プレートの逆蓋の行を交互に同じ数の裸のシリコンモールドとガラス coverslips (1 号, 直径 12 mm) を配置します。完了すると、汚染を避けるために 48 ウェル プレートの蓋をカバーします。
- 酸素プラズマ治療全体の 48 ウェル プレート蓋 (すなわち。、金型やスライド ガラス)。その後すぐ、隣接するガラス基板にシリコーン型を反転するのには鉗子を使用します。接着を確保するために金型にしっかりと押します。1 時間室温で孵化させなさい金型をしましょう。
注: 酸素プラズマ処理の期間は、使用機器によって異なります。計測器の典型的な条件は 0.3 4 間作動ガスの圧力の] ウィンドウ mbar、20 cm3最低で 10-20 s のプラズマ サンプル露出酸素ガスの流れ。 - 金型をオートクレーブで滅菌します。使用するまで無菌環境で室温で金型を格納します。
注: 金型がこの段階で不明確に保存されます。
- 希望の直径と生検パンチを使用して、0.5 mm 厚のシリコン シートで穴を作成し、各ホールを囲む四角形をカットします。必要な金型の数に対して繰り返します。
- エラスチンのような蛋白質の貯蔵液の準備
- 4 ° C のストレージから凍結乾燥 ELP を削除します。暖かい結露を防ぐために管を開く前に部屋の温度にタンパク質は、繰り返し使用に蛋白質に基づいています。
- ダルベッコ リン酸緩衝生理食塩水 (DPBS) 定数撹拌で 4 ° c に ELP を解散 (すなわち。、回転) 一晩。
注: ELP 原液濃度はさらにユーザー定義の体積比で架橋剤溶液の添加で希釈します。たとえば、3% (w/v) 最終的な ELP の濃度の ELP ソリューション: 架橋剤ソリューションの 4:1 の体積比で希釈が 3.75% (w/v) ELP の在庫ソリューションを準備します。目的のアプリケーションの必要に応じて濃度を調整します。 - 滅菌フィルター ELP 原液 0.22 μ m シリンジ フィルターを使用します。使用しないときに氷に ELP を格納します。
- キャビネットのバイオ セーフティ 24 ウェル培養プレートに滅菌ピンセットを使用して滅菌の金型を転送します。
- THPC ストック溶液の調製
- 使用する直前に DPBS で THPC を希釈します。最終的な ELP 濃度と必要な架橋比に従って THPC 溶液の濃度を調整します。
注: プロトコルの 3% (w/v) の最終的な ELP の集中になります 4:1 の体積比で THPC ソリューションと ELP の原液を混合することによって。必要に応じて調整します。 - DPBS 997.4 μ に THPC 溶液 (水の 80%) の 2.6 μ L を追加します。
注: ソリューションを最終的な 3% (w/v) ELP ハイドロゲルの説明 4:1 の体積比で混合した場合、THPC のこの集中は 1:1 の化学量論比 THPC 上ヒドロキシ メチル基と ELP 蛋白質アミンに対応します。THPC ソリューションは粘性、液滴ピペット チップの側面に固執する可能性があります。正確な濃度の DPBS に希釈するときこのような水滴を避けます。THPC 在庫コンテナー、ホスフィンの酸化と、架橋剤の不活性化を防ぐために窒素ガスでパージします。 - 渦をミックスし、氷の上を保つソリューション。
- 滅菌フィルター、THPC は 0.22 μ m シリンジ フィルターを使用して、ソリューションを在庫します。希薄 THPC ストック溶液さらに架橋の化学量論比を達成するために無菌の DPBS と (e.g。、脂肪または 0.75:1)。
注: THPC は酸素を区別する、および準備の後、数時間以内希釈液を使用する必要があります。
- 使用する直前に DPBS で THPC を希釈します。最終的な ELP 濃度と必要な架橋比に従って THPC 溶液の濃度を調整します。
- 単一細胞懸濁液にトリプシン-EDTA と孵化によって細胞を分離、細胞のペレット、再診断中中断セルをカウントします。
注: この手順の正確なプロトコルは、目的のセルの種類およびアプリケーションに大きく依存します。このプロトコルの全体で使用される神経前駆細胞、1.5 分間室温で 0.025% トリプシン-EDTA 培養を行った。セルは、2 分の 200 x g でペレットが。細胞生存率、細胞は通常の培地条件で保留されます。1-50 106セル/最終的なハイドロゲル ボリュームの mL からセル カプセル化範囲の典型的な細胞密度。必要に応じて調整します。 - 必要な滅菌 1.5 mL 遠心チューブに細胞数の約数。
- 慎重に ~ 200 x g で 3 分間で細胞を遠心、上清を吸引し、氷の上細胞ペレットを維持します。
注: 完全に ELP と THPC 架橋剤のそれ以上の希釈を軽減するためにすべての上清を吸引するが重要です。特定の遠心速度はセルの種類によって異なります。 - ボリュームが (ELP ソリューション: THPC ソリューションの比率は 4:1 と仮定) 最終巻の 80% になるよう再 ELP 原液で細胞ペレットを中断します。ピペットのミックス 20-25 回細胞と ELP の均質な混合物を生成します。
注: は、ELP の後続相転移と温度上昇を軽減するためにチューブの底部を把持を避けてください。3 複製それぞれ 2 mm の型が必要です最終巻の 7.5 μ L (すなわち。 6、ELP 原液と THPC 原液 1.5 μ μ l) 3 穴に均等に分割 (すなわち。、2.5 μ l 穴あたり最終巻)。4 と 5 mm 金型用 7.5 μ L と 15.5 μ L の最終巻はそれぞれ必要です。 - 残りの 20% の最終的なボリュームのセル/ELP サスペンションに THPC 原液を追加します。ピペットのミックス 20-25 回均質な混合物を生成します。
- すぐにセル/ELP/THPC 混合物の対応する最終的なボリュームの各型に円形の動きでピペットします。すべての金型を繰り返します。
- 37 ° C 15 分で追加のインキュベーション後、15 分間室温でサンプルをインキュベートします。
注: 最初の潜伏期間が ELP の LCST 上に温度が上昇し、その熱相分離を誘発する前に、ハイドロゲルの初期架橋を容易にするため。 - ゆっくりと暖かい培の 750 μ L をゲルを中断することを避けること、24 ウェル プレートの各ウェルに追加します。
- 7 日間の 37 ° C でゲルを孵化させなさい。
注: 完全な媒体の変化、細胞の種類に応じてすべての 1-2 日をお勧めします。ゲル上のストレスを制限するには、井戸から培地を吸引するときに 200 μ L ピペット チップをパスツール ピペット貼付ガラスを使用します。
3. 3D ELP ゲルの細胞の免疫細胞化学
- 30 ml DPBS 10 mL 16% (w/v) パラホルムアルデヒド (PFA) を混合することによって固定の解決を準備します。37 ° c. に解決を暖める
- 24 ウェル プレートから培地を吸引し、DPBS 1 mL で優しく洗ってください。
- 各ウェルに固定の解決の 750 μ L を追加し、37 ° C、30 分インキュベートします。PFA 蒸気と他の文化の汚染を避けるために組織文化のインキュベーターを使用しないでください。
- 慎重に適切な有害廃棄物コンテナーに PFA を破棄、各ウェルから固定の解決を吸い出しなさい。
注意: PFA への暴露は、皮膚や眼の炎症を引き起こす可能性が。手袋・安全メガネを着用し、化学の発煙のフードで働きます。 - 各サンプルに DPBS の 1 mL を追加します。すぐに、DPBS を吸引、PFA 廃棄物容器に廃棄します。
- サンプルは 2 回 10 分ずつの DPBS の 1 mL を洗浄します。
注: サンプルは、板パラフィルムで封止後の週まで 4 ° C で DPBS で格納することができます。 - 透過液 (100 mL DPBS とトリトン X-100; の 0.25 mL の 750 μ L で各サンプルを permeabilize します。Pbst; 15 rpm でロッカーに室温で 1 時間。
- PBST を吸引し、各サンプルにソリューション (95 mL の PBS、ウシ血清アルブミン (BSA) 5 g、血清、5 mL とトリトン X-100 の 0.5 mL) をブロックの 750 μ L を追加します。15 rpm でロッカーに 3 時間室温で孵化させなさい。
注: ブロックのソリューションは、二次抗体が提起された宿主動物種由来の血清を含める必要があります (e.g。、ヤギ、ロバ) と滅菌フィルターを通して、0.22 μ m フィルター使用する前に。 - 抗体希釈液 (DPBS 97 mL、BSA の 2.5 g、(同じホスト種からステップ 3.8 のように)、血清の 2.5 mL とトリトン X-100 の 0.5 mL) を準備します。抗体希釈液を使用して一次抗体の希釈、ソリューションの 500 μ L を各サンプルに追加します。板パラフィルムでシールし、ロッカーの 4 ° C で一晩インキュベートします。
注: ネスチン Sox2 一次抗体がメーカーの元の濃度から抗体希釈液で希釈 1: 400 と。 - 各サンプルから抗体溶液を吸引、15 rpm でロッカーに室温で 60 分 PBST とサンプルを洗ってください。洗浄ステップを 3 回繰り返します。
- DAPI (1:2, 000) 抗体希釈液を使用しての二次抗体と 5 mg/mL 株式を希釈し、各サンプルにソリューションの 500 μ L を追加します。カバーをアルミ箔 24 ウェル プレートとロッカーの 4 ° C で一晩インキュベートします。
注: 二次抗体は光に敏感で、サンプルはすべての後続のステップの退色から保護されます。ヤギ抗マウスとヤギ抗うさぎ二次抗体はメーカーの元の濃度から抗体希釈液で希釈 1: 500. - 各サンプルから抗体溶液を吸引し、常温ロッカーの pbst; 30 分のサンプルを洗ってください。洗浄ステップを 3 回繰り返します。
- スライド ガラスの表面上にメディアをゆるませたマウントのドロップを配置します。鉗子を使用して、ペーパー タオルにカビのエッジを軽くしみが付くことによって金型から余分なソリューションを削除します。慎重に逆さま取り付け中に金型を置き、気泡を導入することを避けるため。
- 室温で 48 時間を強化するメディアをマウントを許可します。部屋の温度や 4 ° C で試料を保存します。完全に媒体の屈折率、硬化の過程で変更するイメージング前に 48 h に設定するメディアをマウントを許可します。汚染またはサンプルの動きを軽減するために明確なマニキュアでカバー スライド ガラスへサンプルをシールします。
- 共焦点顕微鏡を用いたサンプルをイメージします。
結果
このプロトコルで使われる ELPs は 5 つの地域から成る: T7 タグ、His6 タグ、enterokinase (EK) 胸の谷間サイト、バイオ アクティブ領域およびエラスチンのような地域 (図 1)。T7 と His6 タグは、標準的な西部のしみの技術によって簡単に識別できます。EK の胸の谷間のサイトの紹介はタグ領域の酵素の除去のため必要な場合ことができます。バイオ アクティブ領域を拡張、フィブロネクチン由来の細胞接着 ('RGDS') または非接着剤 ('RDGS') シーケンスにエンコードします。最後に、エラスチンのような地域の中心部の繰り返しには THPC を介して架橋有効になり並ぶの繰り返しを含むイソロイシン31~ 32 ° C の LCST を達成するために、ゲストの残渣サイトでリジン グループが含まれています。
投稿式、SDS-PAGE または西部のしみは、分子量を視覚化し、T7 (MASMTGGQQMG) や His6 (HHHHHH) (図 2) などの抗体タグを含む ELPs の身元を確認する使用できます。制御条件の下で成功した式は両方の SDS ページ (図 2 a) を使用してこれらの蛋白質のおおよそ分子量 (~ 37 kDa) で 1 つの暗いバンドの存在によって表される高均質な製品を生成し、西部のしみ (図 2 b)。
制御不能の条件、西部のしみの低分子量のバンドの存在は、タンパク質の一部は完全に変換されませんでした/または式 (図 2) の後分解したを示唆しています。具体的には、ここで固まり、約 1 つの生体活性領域と 3 つのエラスチンのような地域 ('繰り返し')、重量またはターゲット蛋白質の約 4 分の 1 に相当する 〜 9 kDa で等間隔です。これらの小さい蛋白質のフラグメントがある通常より高い温度で式を行った場合 (> 32 ° C)図 2のように。これらの低分子量タンパク質の存在は予測不可能な機械的性質につながります。したがって、最終製品の品質を確保するため、定期的スクリーニング ポスト式はお勧めします。
ELP ベース ヒドロゲルの機械剛性は、ELP の濃度または THPC 反応グループ: ELP アミンの比率を操作することによって変更できます。同時に、任意の剛性体制内の非接着剤 (RDGS) シーケンスに、細胞接着 (RGDS) の ELP の変形の比率を変更することによって細胞接着リガンドの濃度を調整できます。これらの 2 つの変数を操作することによって機械的性質とリガンド濃度 (図 3) のスペクトルを持つゲルを生成できます。
3 D の ELP ヒドロゲル内のセルをカプセル化するには、必要な細胞数は媒体中に浮遊、細胞ペレット (図 4 a) を生成する遠心分離します。チューブから培地を吸引、セルは望ましい集中の ELP ソリューションで均一に再懸濁。次に、THPC ソリューションはセル/ELP の懸濁液に追加され、均質な混合物を形成するため徹底的に戻します。このソリューションは、迅速にピペットを使用して 24 ウェル プレート内滅菌シリコンモールドに転送され、各 (図 4 b) 常温、37 ° C 15 分で架橋を許可しました。最後に、媒体はウェル プレートに追加され、実験では 37 ° C で培養しました。
ライブ/デッド染色は細胞生存率と ELP ヒドロゲル内成功した細胞のカプセル化を評価するために使用できます。図 5に示すように、大人のマウスの神経前駆細胞 (Npc) の表示高細胞生存率 3% (w/v) ELP ハイドロゲル内 7 日間
3 D の ELP ヒドロゲルは以前正規 NPC タンパク質マーカー SRY (地域 Y を決定性) の発現を介して測定 NPC 幹メンテナンスをサポートする示されている-ボックス 2 (Sox2) と特異9。Npc は 3% (w/v) 低 THPC 架橋 Sox2 の核局在の免疫染色と顕微鏡を用いたイメージング (図 6) を介して細胞質の特異フィラメントのショー高発現 ELP ヒドロゲル カプセル化されます。

図 1: 対応するアミノ酸配列と ELP の略図。本研究で使用される ELP には、抗体ベースのイメージング、細胞接着ドメイン導入のため生理活性領域弾性力学特性を付与でき、化学架橋エラスチンのような地域に T7 および His6 タグが含まれています。この図の拡大版を表示するのにはここをクリックしてください。
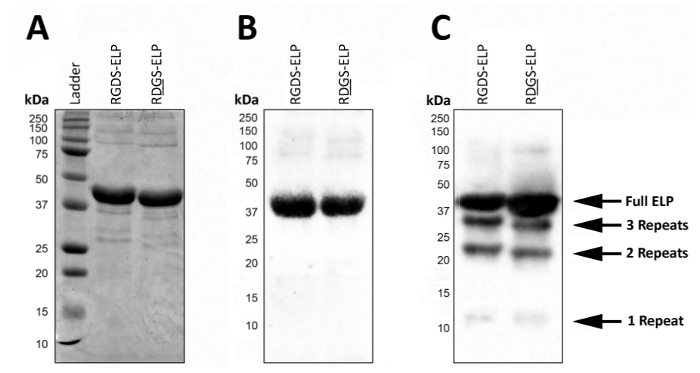
図 2: 分子量そして最終的な凍結乾燥製品の識別を確認する SDS のページおよび西部のしみのターゲット蛋白質の表現を検証できます。6 (HHHHHH) タグ SDS ページ(A)と T7 (MASMTGGQQMG) またはヒスチジンを使用して西部のしみの両方によって報告された 37 kDa の分子量で純粋なフルレングス ELP を実行(B) です。(C)。 ELP 表現のプロトコルで偏差による ELP の不純なバッチは、低分子量の ELPs の発現につながることができます。この図の拡大版を表示するのにはここをクリックしてください。
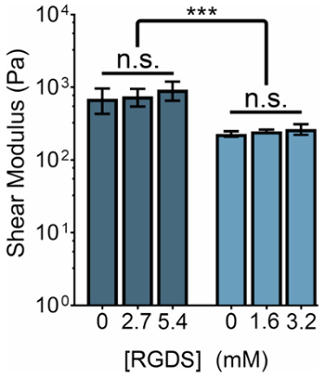
図 3:RGDS リガンド コンテンツ個別に調整できる ELP ヒドロゲル内機械的性質から。5% (w/v)、3% (w/v) ELP ヒドロゲル ~ 800 の横せん断係数がある Pa と 〜 400 Pa、それぞれ。THPC 反応グループ: ELP アミンの 1:1 の比率でゲルは 37 ° C に加熱、15 分間室温でクロスリンクしていましたおよび平衡測定前に 5 分のために。データは、平均 ± 標準偏差、 *p < 0.001。この図の拡大版を表示するのにはここをクリックしてください。

図 4:ELP ヒドロゲルの電池を封止材のスケマティック。(A).細胞中規模および小球形にされた遠心分離機を使用して単一細胞懸濁液に解離最初。チューブから培地を吸引とセルを再希望 ELP 溶液中に浮遊してよく混合します。最後に、THPC 架橋ソリューションを添加し、よく混合します。(B). THPC 添加の直後、ソリューションは、ピペットをシリコーン型にキャストされます。37 ° C で 2 番目 15 分インキュベーション続いて 15 分常温架橋へソリューションが許可します。媒体は、実験の期間のためによくカルチャに追加されます。この図の拡大版を表示するのにはここをクリックしてください。

図 5:神経前駆細胞は、ELP ヒドロゲルの高い生存率を維持します。神経前駆細胞の代表的なイメージは、3% (w/v) ELP で 7 日間培養後 1:1 架橋 (THPC 反応グループ: ELP アミン) とゲルをカプセル化します。緑: ライブ染色 (カルセイン AM);赤: 死んだ (エチジウム ホモ) を染色します。スケールバー = 100 μ m。
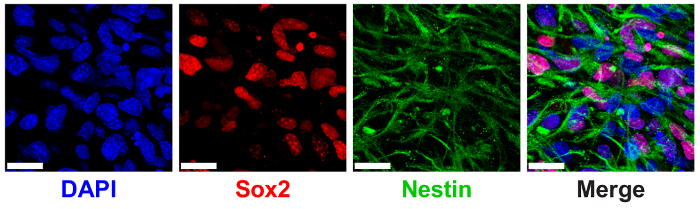
図 6: 3 D の ELP ヒドロゲルは神経前駆細胞幹メーカー表現をサポートします。Sox2 を表現し、ELP ヒドロゲルの文化の 7 日後の蛋白質のネスチンの神経前駆細胞の蛍光イメージ。画像は、セル脂肪架橋 (THPC 反応グループ: ELP アミン) と 3% (w/v) ELP ゲルのカプセル化を示しています。青: DAPI (核);赤: Sox2;緑: ネスチンします。スケール バー = 25 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
組換え蛋白質の表現および浄化は、再現性の高い生体材料を合成する強力なツールです。商品化された分子クローニングの出現を主因カスタム プラスミド購入できますいくつかのサプライヤーから ELPs のような材料で作業時間を大幅に削減します。同様に、元の仕事は、連邦契約によって支えられた非営利使用するため今後の作業になりますとプラスミドを元の研究室から直接要求できます。ELP の完全なアミノ酸シーケンスは、いくつかの ELP の亜種31以前公開されています。しかし、式から組換え蛋白質の最終的な浄化のプロセスは一般的に還元利回りや低品質の製品につながることができます重要な手順の数を含みます。ELP の準備のための最も一般的な問題のいくつかは、次のいずれかで発生する: 細菌の膜と熱サイクルを通じて (3) 蛋白質の浄化を妨害する、ストアドの細菌の在庫の品質 (1) (2) の最初の凍結融解サイクルします。
蛋白質の表現および他非生物材料の生産の手段の主な違いは我々 がポリマーを合成する遺伝子組換えホストの生物学的機械を活用しています。その後、このテクニックは、独自の制限がある: 細胞死または損傷。細胞死は最も一般的プレートまたは比較的ゆっくりと成長異常に小さいコロニーをストリー キング後細菌コロニー数の減少としてそれ自身を明示します。細菌株は場合は、慎重に維持安定したまま年;ただし、繰り返し使用や冷凍庫の故障による連続凍結融解サイクルは、細胞生存率を削減したり、DNA の損傷につながることができます。典型的な BL21 細菌株は浮遊細胞と混合量 10% と 40% のグリセロールの間使用します。グリセロールの目的は、凍結中の氷の結晶を核から膜の損傷を減らすことです。そのため、低濃度の使用 (< 10%) 高濃度ながら、侵害された膜につながることができます (> 40%) 在庫が細胞死につながるをフリーズすることがないために十分に凝固点を抑制することができます。ただし、最適なグリセロール濃度の中でも細菌の在庫する必要がありますできません完全に雪解けするグリセロールからの再凍結および細胞毒性から膜損傷の組み合わせになるために削減在庫生存率および DNA 損傷。したがって、それは細菌の在庫が低いコロニー カウントの結果をまたは (式中に低速 OD600ランプに入る率として現れる) 一貫して遅い速度で細胞を分裂していることが観察されてプラスミッドを再変換し、新しい在庫が単純なこの問題を解決する最初のアプローチ。これを念頭においては細菌の在庫の長期的な維持および DNA の完全性を確保するため冷凍水で、細胞内ではなく精製 DNA としてあなたのプラスミッドのコピーを格納するが最善です。この方法で DNA を保存すると、失敗した株式や冷凍庫の故障など予期しないイベントは、元の DNA の信頼性の高いソースを変換に使用することができますになります。
ELP 作製のもう一つの重要なステップは、式のホストからターゲット蛋白質の浄化です。エシェリヒア属大腸菌からの蛋白質の抽出は、連続凍結融解サイクルをさらに配合の懸濁細胞ライセート、凍結時に全体を形成する核の氷の結晶を使用して細胞壁を壊すことによって達成されます。細胞壁を破壊するための代替方法は、超音波やプレスなど利用できます。特に、ライセートの連続凍結融解は、有利なだけ冷凍庫とない他の専門機器が必要です。ただし、この手順は、DNA、RNA および蛋白質の汚染物、ターゲット蛋白質を低下させる可能性があるプロテアーゼに加えて特異的解放します。したがって、汚染を避けるため、収量、デオキシリボヌクレアーゼ (DNase) 私と phenylmethanesulfonyl フッ化物 (PMSF) 細胞、DNA を低下させるし、それぞれプロテアーゼを阻害するライセートに追加されますを削減します。DNase 添加する前に DNA の存在を観察できます視覚的に再懸濁細胞全体 '糸' 外観として次の雪どけライセート。DNase は積極的にこの DNA を低下し、細胞ライセート遠心分離によって浄化しやすく粘度を削減します。細胞ライセートが完全に液体に表示されることと、糸の外観は表示されなくなりますを確保することによって、最適な DNA の分解を視覚的に確認できます。我々 は mL 細胞ライセートあたり DNase の ~0.1 mg 添加が必要な分解を達成するために十分であることを実際に観察しました。しかし、DNA の存在は、まだ観察される場合より DNase 追加できます続いて撹拌の追加の 2、3 時間。ライセートの十分に融解する可能性が前に DNase が途中で追加した場合、同様の問題が発生する可能性も。この場合より冷たい温度は、DNase の早期不活性化による DNA 分解の効率を制限できます。この問題を避けるためには、それはしばしば治療の前に約 8 時間解凍し再懸濁のペレットを許可することをお勧めです。さらに、低蛋白質収量が報告される、DNA の破壊が十分なされている場合プロテアーゼから潜在的なタンパク質分解をさらに軽減する多く PMSF 添加が必要。
ELPs の最適な表現を確保するための追加の考慮事項は、利点について十分に理解と選択した抗生物質の限界もあります。ここでは、アンピシリン耐性遺伝子を含んでいる pET15b ベクトルは蛋白質の表現を使用しました。機能的には、ペットのベクター シリーズ専用の次の成功誘導32,33ターゲット蛋白質に細菌の蛋白質の表現の 50% の重要な蛋白質の表現を可能にします。ただし、アンピシリン選択抗生物質として最適な表現を妨げる可能性のあるいくつかの制限があります。まず、大腸菌の存在下でアンピシリンの劣化、β-ラクタマーゼのリリースのため急速に発生します。アンピシリンの十分な量が低下した場合プラスミドのアンピシリン エンコーディング (すなわちELP エンコーディング プラスミッド) が全く失われます。その結果、ELPs 期間が長くなる場合は、好ましい表現を許可する ELP エンコーディング遺伝子の十分な量を確保する連続した時点で、バイオマーカ発現量を慎重に監視する必要があります。Β-ラクタマーゼの蓄積のトラブルシューティングのための可能な方法はスターター文化をスピンダウンさせなど表現媒体を接種する前に抗生物質フリー培地で細胞を再懸濁します。このプロセスは効果的に抗生物質分解酵素の転送を制限し、確実に大部分のセルのターゲット蛋白質符号化ベクトル。また、アンピシリンは約 2 〜 3 週間の限られた寿命であります。したがって、使用する前に 2 週間の最大 4 ° C で蛋白質の表現のための培養皿を保存する必要があります。最後に、スターターと表現メディア、アンピシリン原液でアンピシリンの有効性を確保するため使用べきである作り出された新鮮なすぐに前に、長期的なストレージが少ない効果的な抗生物質につながる可能性がありますので。
LCST の存在は熱サイクルを通じて ELPs の簡単な浄化のためことができます。具体的には、高温、塩の存在下では、エントロピーの力は難溶となりその後ポリマー豊富なコアセルベート相を形成する非を引き起こします。その一方で、低温非水溶性のままかつ溶液に容易に溶解します。遠心分離手順を収集し、引き続いて非 ELP を含む段階を破棄すると相まってこれら 2 つの温度の政体間で循環蛋白質を集中し、同時に ELP 以外の汚染物質の存在を低減します。
ただし、どこ ELPs は、この精製過程で失われることがいくつかの段階があります。まず、すべての冷たいスピンの前に蛋白質含有溶液は 9.0 の pH に強アルカリします。このより高い pH で脱プロトン化は、効果的に帯電状態のまま、さらに溶解性を高める蛋白質のバックボーンにあるアミノ酸。したがって、この手順を上記またはタンパク質分解の十分な時間を許可しないは、非可溶性タンパク質を遠心分離中にペレットし、破棄するように収量の削減につながることができます。
同様に、ターゲット蛋白質は、ELP のペレットとの熱スピン処理中に失われることができます。当初は、塩化ナトリウムは、ELP の容解性を減らすためにタンパク質が豊富な上清に追加されます。塩は、水相から分離する蛋白質の原因のタンパク質と水の分子間静電相互作用を保護する仕事します。この効果はエントロピー効果により、さらに周囲の非含水「cage」を分解し、、蛋白質の集合を強制するソリューションを加熱することによって増幅されます。タンパク質濃度 (すなわち。 最初の熱サイクル)、塩だけで添加はしばしばこの相分離を引き起こすに十分な。ただし、タンパク質の濃度を増加させる (すなわち。、熱サイクル後)、と塩との対話を以下の二次汚染物質は、ELP をより容易に沈殿させます。結果として、塩を余りにすぐに追加する場合可能性がありますになる物理的に陥れ蛋白質を集計することによって効果的に、溶液の塩濃度が低下したとさらに蛋白質の沈殿物を制限します。したがって、塩はゆくソリューションを通じて配布する十分な時間を確保して 3 つの小型バッチで追加する必要があります。最後の注意点としてのいずれかを介して ELP バックボーンにバリエーションさらにエラスチンのような地域のゲスト残渣を変更またはバイオ アクティブ領域に変更することができます LCST 挙動に大きく影響します。したがって、タンパク質の亜種間で最適なタンパク質の収量を確保するため、pH、塩濃度、塩の種類を最適化するために重要な (e.g。、一価または二価) 冷・温のスピンのため。
低下は、ELP が浄化手順のいずれかの中に発生したかどうかを容易に判断に使用できるので、完了するプロトコル SDS ページを実行することをお勧めします。簡単に言えば、ELP は清熱スピンの後に検出された場合、タンパク質はされて効果的に沈殿しません。同様に、ELPs は、可溶化されたペレット寒いスピンを次のサンプルで指定されている場合、タンパク質はされている効果的に解散しません。
ELP ヒドロゲルは、合成または天然由来材料に比べて多くの利点を提供しています。具体的には、アミン反応性架橋剤 THPC の使用は、タンパク質架橋の低コスト、シンプルで、可変機構を与えます。ただし、注意すべき架橋プロトコル内で異なる制限があります。THPC は酸素に敏感で、それがすばやく反応効率の低下不適切な条件下で保存されている場合。さらに、第一級アミンとの反応性、原因 THPC は周囲のアミン類が豊富なメディアまたはそれらの細胞の表面の蛋白質と反応するかもしれません。したがって、ELP ヒドロゲルを形成する架橋効率で可能な外因性タンパク質交差反応性、したがって、減少を抑える細胞ペレットとメディア汚染を避けるため勧めします。最後に、この架橋メカニズム リジン残基を含まない生体活性領域シーケンスを排除し、したがって、いくつかの細胞接着モチーフの潜在的な統合を制限 (例えば.、IKVAV34)。これらの制限の変更に対処するためアジ化と bicyclononyne (BCN) ELP バックボーンに反作用パートナーは、前述した27としてのバイオ直交架橋。
ELP LCST 挙動がハイドロゲル微細構造の決定に重要な役割を果たしていることに注意してください。温度、LCST 上記体制で ELPs は、マトリックスの気孔率に影響を与えることができる蛋白質が豊富で、タンパク質欠乏相の形成とマトリックス9の架橋効率につながる解決から沈殿させます。ELP LCST 上関連する生理学的温度 (〜 37 ° C) でほとんどの細胞培養実験を行うために、これらの効果が考慮されなければなりません。効果的に架橋し、フォーム ヒドロゲル相互接続されたタンパク質ネットワーク、リジンから第一級アミン必要があります THPC 架橋剤が物理的にアクセス。ELP 集計が十分な架橋に達する前に発生した場合、アクセスできないとこうして架橋に参加することはできません ELPs タンパク質豊富なフェーズ内に閉じ込められた可能性があります。この制限に対処するためのプロトコル、ヒドロゲルへの予備的な架橋は、ELP の熱相転移を経る前に室温で初期 15 分架橋期間が必要です。この室温培養にはゲルの架橋を完成させるための 37 ° C でさらに 15 分インキュベーションが続きます。この手順は、十分な架橋と ELP 素材の堅牢な再現性のあるゲル化にとって重要です。
結論としては、ELP を用いて作製した組換え蛋白質ゲルは、タンパク質配列およびしたがって 3 D の細胞の微小環境の例外的な可変性を提供しています。ELP のポリマーは、生体内および生体外でシステムの様々 な LCST 言動により簡単に精製、高収率で表現できることが示さと生体適合性をされています。エシェリヒア属大腸菌の組換えのホストとしての使用は、ポリマーの分子量と機能の完全な制御の近くに上昇を与えるシンプルで安価な手順を提供します。併せて、この技法は、堅牢な可変特性と 3 D の細胞の種類の広い範囲の文化を可能にするハイドロゲル プラットフォームの再現性にできます。最後に、この ELP ハイドロゲル プラットフォームは qRT PCR、西部のしみ、DNA 抽出、細胞免疫染色9など多くの下流の生化学的アッセイを受けやすい。
開示事項
著者が明らかに何もありません。
謝辞
著者に感謝 t. パーマーと H. バブー (スタンフォード大学脳神経外科)図4 マウスの Npc。 ベクター アートを提供するために使用され、クリエイティブ ・ コモンズ表示 3.0 Unported ライセンス (https://creativecommons.org/ の下で仏医術から適応licenses/by/3.0/legalcode)。この作業の一環で、スタンフォード大学ナノ共有施設 (SNSF)、賞 ECCS 1542152 下の国立科学財団によってサポートを行った。N.A.S. は、サポートから国立科学研究所の一般医療の健康の国民の協会 (32 GM 008412) を認めています。C.M.M. は、博士フェローシップ (F31 EB020502) と Siebel 学者プログラムの NIH NRSA からサポートを認めています。S.C.H. では、再生医療 (RT3-07948)、国立衛生研究所 (U19 AI116484 と R21 EB018407)、全米科学財団 (DMR 1508006)、およびカリフォルニア工科大学からサポートを認めています。この研究は、ユーニス · ケネディ · シュライバー国立衛生研究所の子と人間の開発 (NICHD)、国立研究所によってサポートされている再生のリハビリテーション研究・ トレーニング (AR3T)、連合から資金を受けてください。神経疾患と脳卒中 (NINDS)、医用イメージング、生体 (NIBIB) 賞を受賞番号 P2CHD086843 の下で健康の国立研究所の国立研究所。内容は著者の責任と健康の国民の協会の見解を必ずしも表さない。
資料
| Name | Company | Catalog Number | Comments |
| Elastin-Like Protein Expression and Purification | |||
| 10 cm Petri Dishes | Thermo Fisher Scientific | FB0875713 | |
| 70% Ethanol | RICCA Chemical | 2546.70-1 | |
| Ammonium Sulfate | Sigma-Aldrich | A3920-500G | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25G | |
| Bacto Agar | Thermo Fisher Scientific | 9002-18-0 | |
| BL21(DE3)pLysS Competent Cells | Invitrogen | C606003 | |
| Chloramphenicol | Amresco | 0230-100G | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| EDTA disodium salt, dihydrate | Thermo Fisher Scientific | O2793-500 | |
| Glycerol | Thermo Fisher Scientific | BP229-4 | |
| Isopropanol | Thermo Fisher Scientific | A451-4 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | BP1755-10G | |
| Luria Broth | EMD Millipore | 1.10285.5007 | |
| Parafilm | VWR | 52858-000 | |
| Phenylmethanesulfonyl fluoride (PMSF) | MP Biomedicals | 195381 | |
| Sodium Chloride | Thermo Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Sigma-Aldrich | S 8045-1KG | |
| Syringe Filter Unit (0.22 μm) | Millipore | SLGP033RB | |
| Terrific Broth | Millipore | 71754-4 | |
| Tris Base | Thermo Fisher Scientific | BP152-1 | |
| Cell Encapsulation in 3D ELP Hydrogels | |||
| 0.22 μm syringe filters | Millipore | SLGV004SL | |
| 0.5 mm thick silicone sheet | Electron Microscopy Science | 70338-05 | |
| 24-well tissue culture plates | Corning | 353047 | |
| Disposable Biopsy Punch (2 mm) | Integra Miltex | 33-31 | |
| Disposable Biopsy Punch (4 mm) | Integra Miltex | 33-34 | |
| Disposable Biopsy Punch (5 mm) | Integra Miltex | 33-35 | |
| Dulbecco’s phosphate buffered saline (DPBS) | Corning | 21-031-CM | |
| No. 1 12 mm glass coverslips | Thermo Fisher Scientific | 12-545-80 | |
| Tetrakis(hydroxymethyl)phosphonium chloride (THPC) | Sigma-Aldrich | 404861-100ML | |
| 0.5% Tryspin/EDTA | Thermo Fisher | 15400054 | |
| Immunocytochemistry of Cells in 3D ELP Hydrogels | |||
| 16% (w/v) Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15701 | |
| Bovine Serum Albumin (BSA) | Roche | 3116956001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Donkey Serum | Lampire Biological Labs | 7332100 | |
| Goat anti-mouse Secondary Antibody (AF488) | Molecular Probes | A-11017 | |
| Goat anti-rabbit Secondary Antibody (AF546) | Molecular Probes | A-11071 | |
| Goat Serum | Gibco | 16210-072 | |
| Mouse Nestin Primary Antibody | BD Pharmingen | 556309 | |
| Mouse Sox2 Primary Antibody | Cell Signaling Technology | 23064S | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Vectashield Hardset Mounting Medium | Vector Labs | H-1400 |
参考文献
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294 (5547), 1708-1712 (2001).
- Birgersdotter, A., Sandberg, R., Ernberg, I. Gene expression perturbation in vitro-A growing case for three-dimensional (3D) culture systems. Seminars in Cancer Biology. 15 (5), 405-412 (2005).
- Gómez-Lechón, M. J., et al. Long-term expression of differentiated functions in hepatocytes cultured in three-dimensional collagen matrix. Journal of Cellular Physiology. 177 (4), 553-562 (1998).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Justice, B. A., Badr, N. A., Felder, R. A. 3D cell culture opens new dimensions in cell-based assays. Drug Discovery Today. 14 (1-2), 102-107 (2009).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Madl, C. M., et al. Maintenance of neural progenitor cell stemness in 3D hydrogels requires matrix remodelling. Nature Materials. 16 (12), 1233-1242 (2017).
- Discher, D. E., Janmey, P., Wang, Y. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Sun, Y., Villa-Diaz, L. G., Lam, R. H. W., Chen, W., Krebsbach, P. H., Fu, J. Mechanics Regulates Fate Decisions of Human Embryonic Stem Cells. PLoS ONE. 7 (5), e37178 (2012).
- Ehrbar, M., et al. Elucidating the Role of Matrix Stiffness in 3D Cell Migration and Remodeling. Biophysical Journal. 100 (2), 284-293 (2011).
- Rowlands, A. S., George, P. A., Cooper-White, J. J. Directing osteogenic and myogenic differentiation of MSCs: interplay of stiffness and adhesive ligand presentation. American Journal of Physiology - Cell Physiology. 295 (4), 1037-1044 (2008).
- Lampe, K. J., Antaris, A. L., Heilshorn, S. C. Design of three-dimensional engineered protein hydrogels for tailored control of neurite growth. Acta Biomaterialia. 9 (3), 5590-5599 (2013).
- Kilian, K. A., Mrksich, M. Directing Stem Cell Fate by Controlling the Affinity and Density of Ligand-Receptor Interactions at the Biomaterials Interface. Angewandte Chemie International Edition. 51 (20), 4891-4895 (2012).
- Tse, J. R., Engler, A. J. Preparation of Hydrogel Substrates with Tunable Mechanical Properties. Current Protocols in Cell Biology. , 10.16.1-10.16.16 (2010).
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: A complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- DiMarco, R. L., Heilshorn, S. C. Multifunctional Materials through Modular Protein Engineering. Advanced Materials. 24 (29), 3923-3940 (2012).
- Meyer, D. E., Chilkoti, A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nature Biotechnology. 17 (11), 1112-1115 (1999).
- Aladini, F., Araman, C., Becker, C. F. W. Chemical synthesis and characterization of elastin-like polypeptides (ELPs) with variable guest residues. Journal of Peptide Science. 22 (5), 334-342 (2016).
- McMillan, R. A., Caran, K. L., Apkarian, R. P., Conticello, V. P. High-Resolution Topographic Imaging of Environmentally Responsive, Elastin-Mimetic Hydrogels. Macromolecules. 32 (26), 9067-9070 (1999).
- McMillan, R. A., Conticello, V. P. Synthesis and Characterization of Elastin-Mimetic Protein Gels Derived from a Well-Defined Polypeptide Precursor. Macromolecules. 33 (13), 4809-4821 (2000).
- Chung, C., Lampe, K. J., Heilshorn, S. C. Tetrakis(hydroxymethyl) Phosphonium Chloride as a Covalent Cross-Linking Agent for Cell Encapsulation within Protein-Based Hydrogels. Biomacromolecules. 13 (12), 3912-3916 (2012).
- Romano, N. H., Madl, C. M., Heilshorn, S. C. Matrix RGD ligand density and L1CAM-mediated Schwann cell interactions synergistically enhance neurite outgrowth. Acta Biomaterialia. 11, 48-57 (2015).
- Shah, M., Hsueh, P. Y., Sun, G., Chang, H. Y., Janib, S. M., MacKay, J. A. Biodegradation of elastin-like polypeptide nanoparticles. Protein Science. 21 (6), 743-750 (2012).
- Nettles, D. L., Chilkoti, A., Setton, L. A. Applications of elastin-like polypeptides in tissue engineering. Advanced Drug Delivery Reviews. 62 (15), 1479-1485 (2010).
- Madl, C. M., Heilshorn, S. C. Tyrosine-Selective Functionalization for Bio-Orthogonal Cross-Linking of Engineered Protein Hydrogels. Bioconjugate Chemistry. 28 (3), 724-730 (2017).
- Zhu, D., Wang, H., Trinh, P., Heilshorn, S. C., Yang, F. Elastin-like protein-hyaluronic acid (ELP-HA) hydrogels with decoupled mechanical and biochemical cues for cartilage regeneration. Biomaterials. , 132-140 (2017).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Bio-Orthogonally Crosslinked, Engineered Protein Hydrogels with Tunable Mechanics and Biochemistry for Cell Encapsulation. Advanced Functional Materials. 26 (21), 3612-3620 (2016).
- Cai, L., Dinh, C. B., Heilshorn, S. C. One-pot synthesis of elastin-like polypeptide hydrogels with grafted VEGF-mimetic peptides. Biomater Sci. 2 (5), 757-765 (2014).
- Straley, K. S., Heilshorn, S. C. Independent tuning of multiple biomaterial properties using protein engineering. Soft Matter. 5 (1), 114-124 (2009).
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current Opinion in Biotechnology. 10 (5), 411-421 (1999).
- Graumann, K., Premstaller, A. Manufacturing of recombinant therapeutic proteins in microbial systems. Biotechnology Journal. 1 (2), 164-186 (2006).
- Tashiro, K., et al. A Synthetic Peptide Containing the IKVAV Sequence from the A Chain of Laminin Mediates Cell Attachment, Migration, and Neurite Outgrowth. Journal of Biological Chemistry. 264 (27), 16174-16182 (1989).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved