Method Article
Production de protéine élastine Hydrogels pour Encapsulation et immunomarquage des cellules en 3D
Dans cet article
Résumé
Hydrogels d’ingénierie de protéines recombinantes sont avantageuses pour la culture cellulaire 3D car ils permettent accordabilité complète de l’épine dorsale de polymère et par conséquent, le microenvironnement cellulaire. Nous décrivons ici le processus de purification de protéine recombinante élastine et son application dans l’encapsulation de cellules 3D hydrogel.
Résumé
Deux dimensions (2D) culture de tissus techniques ont été essentiels pour notre compréhension de la biologie cellulaire fondamentale. Toutefois, le manque de systèmes de culture de tissu 2D traditionnelle une matrice tridimensionnelle (3D), ce qui entraîne un important manque de concordance entre les résultats recueillis in vitro et in vivo. Pour combler cette lacune, les chercheurs ont conçu plates-formes de vitroplants hydrogel 3D qui peuvent imiter les propriétés biochimiques et biophysiques du microenvironnement cellulaire in vivo . Cette recherche a motivé la nécessité de développer des plates-formes matérielles qui prennent en charge l’encapsulation de cellules 3D et des épreuves biochimiques en aval. Ingénierie des protéines recombinantes propose un ensemble d’outils unique pour hydrogel 3D conception matérielle et le développement en permettant le contrôle spécifique de la séquence des protéines et donc, par extension, les propriétés mécaniques et biochimiques potentielles de la résultante matrice. Nous présentons ici un protocole pour l’expression des protéines sont elastin-like dérivées d’inoculation (PEL), qui peut être utilisé pour les hydrogels de formulaire avec les propriétés mécaniques réglables indépendamment et de la concentration de ligand cellule-adhésif. Plus loin, nous présentons une méthodologie pour l’encapsulation de cellules au sein de l’ELP hydrogels et immunofluorescence ultérieures d’intégrés pour analyse en aval et la quantification des cellules.
Introduction
Depuis un siècle, culture de tissus à deux dimensions (2D) est devenue un ensemble d’outils intégré pour l’étude de biologie cellulaire fondamentale in vitro. En outre, les protocoles relativement simples et peu coûteuse pour la culture cellulaire 2D ont conduit à son adoption à travers de nombreuses disciplines biologiques et médicales. Cependant, recherches antérieures ont montré que des plates-formes 2D traditionnelles peuvent conduire à des résultats que s’écarter sensiblement de ceux collectés in vivo, causant un temps précieux et financement gaspillé pour recherche clinique orientée vers1,2, 3. Nous et autres émis l’hypothèse que cette différence peut être attribuée à l’absence de natives indices biochimiques et biophysiques fournis aux cellules cultivées sur une surface 2D, qui peut s’avérer nécessaire de prolifération optimale et de maturation des différents types de cellules.
Pour remédier à ces limites et aide le pont l’écart entre 2D études in vitro et in vivo , les chercheurs ont développé en trois dimensions hydrogel (3D) plates-formes pour cellule-encapsulation1,4,5 ,6. Les hydrogels sont des matériaux idéaux pour récapituler le microenvironnement endogène de la matrice extracellulaire (ECM) en vivo grâce à leur tissu-comme des propriétés mécaniques et une structure gonflés par l’eau qui permet le transport rapid des éléments nutritifs et signalisation des facteurs7,8. En outre, hydrogels 3D peuvent être conçus pour avoir un contrôle indépendant sur les propriétés mécaniques et biochimiques de l’échafaudage. Tant matrice mécanique9,10,11,12 et des ligands cellulaires-adhésif13,14,15 sont bien connus pour influencer la cellule comportement en vitro et in vivo. Ainsi, les hydrogels 3D avec propriétés accordables offrent une plate-forme afin d’étudier les relations causales entre les cellules et leur microenvironnement. Critères pour une matrice hydrogel 3D idéal comprennent simple, non cytotoxiques cellulaires-encapsulation ainsi accordabilité indépendante des propriétés mécaniques physiologiquement pertinentes et imite de natives cell-adhésif motifs.
Les deux synthétiques (e.g., polyéthylène glycol, acide polylactique, poly (acide glycolique)) et dérivés naturels (p. ex.., alginate, collagène, Matrigel) hydrogels ont des avantages par rapport aux plates-formes de 2D in vitro culture ; Cependant, ils ont aussi des lacunes importantes qui limitent leur applicabilité. Tout d’abord, nombreuses plates-formes dérivés naturels et synthétiques nécessitent des conditions de réticulation sévères qui peuvent être potentiellement toxiques pour les cellules mammifères, conduisant à une diminution de viabilité cellulaire7. En outre, nombreuses plates-formes synthétiques manquent de bioactivité native et doivent être fonctionnalisée par le biais de réactions chimiques secondaires, ce qui peuvent représenter une augmentation des coûts et la complexité16. Enfin, alors que les matériaux dérivés naturels contiennent généralement des domaines de bio-actifs intrinsèques, ils sont souvent en proie à une variabilité élevée à lot et se limitent souvent à former des gels relativement faible7,17.
Ingénierie des protéines recombinantes présente un ensemble unique d’outils pour la conception de matériaux en permettant le contrôle explicite sur la séquence des protéines et, par extension, les propriétés mécaniques et biochimiques potentielles de l’hydrogel final échafaudage18. En outre, en s’appuyant sur les mécanismes biologiques connus d' Escherichia coli (e. coli) pour exprimer les protéines, matériaux peuvent être produits rentable et cohérente avec la variabilité limitée inter - et intra-lot. La protéine élastine-like (PEL) présentée ici a machiné de trois domaines : (1) une balise T7 et His6 qui permet de marquage fluorescent le tag anticorps, (2) une région « elastin-like » qui confère des propriétés mécaniques élastiques et permet pour produit chimique réticulation et (3) une région de « bio-active » qui code pour des motifs de cellule-adhésif.
Notre région elastin-like est basée sur la séquence canonique d’élastine5 de (Val-Pro-Gly-Xaa-Gly) où quatre de la « Xaa » sites acides aminés sont l’isoleucine (Ile), mais pourraient être conçu pour être n’importe quel acide aminé sauf proline. Cette séquence dote PEL recombinant avec un comportement de température (LCST) critique de la solution plus bas qui peuvent être exploitées pour l’expression après purification simple via thermique vélo19,20. Cette propriété LCST peut être ajustée à thermiquement agrégées à des températures différentes en modifiant les commentaires « Xaa » résidu21,22.
Ici, la position de « Xaa » sur l’un des cinq séquences répétées elastin-like a été remplacée avec le présentatrices d’amine lysine (Lys) l’acide aminé, qui est utilisé pour la réticulation de l’hydrogel. Nos travaux antérieurs ont montré non cytotoxique et robuste de réticulation par réaction avec les réactifs amine RETICULATION tétrakis (hydroxyméthyl) phosphonium chlorure (THPC)23. Par différentes protéines contenu et RETICULATION concentration globale, nous sommes en mesure de produire hydrogels qui peuvent être réglés pour couvrir une rigidité physiologiquement pertinents rang (~0.5-50 kPa)9,23,24. En plus de la mise au point des propriétés mécaniques, adhésion cellulaire au sein de l’hydrogel résulte de l’intégration des domaines de cellule-adhésif canoniques au sein de l’épine dorsale de la protéine de PEL. Par exemple, l’incorporation de la séquence d’acides aminés « RGDS » étendue dérivé de la fibronectine permet adhésion cellulaire et flexibilité conformationnelle, tandis que le brouillés, variante « DGR » compromettante limite d’adhérence cellule-matrice24. En modulant le rapport entre la cellule-adhésif non-adhésifs protéines ainsi que la concentration de protéine totale, nous sommes en mesure de produire efficacement des hydrogels qui couvrent une large gamme de concentration de ligand. Comme résultat, nous avons développé une plateforme hydrogel avec des propriétés biochimiques et biophysiques découplées, qui peuvent être réglées indépendamment pour la culture 3D optimale de divers types de cellules.
En plus de la matrice raideur et accordabilité ligand adhésif, hydrogels recombinants offre la possibilité aux profils de conception de dégradation du matériel spécifique, qui est nécessaire pour la propagation de cellules, prolifération et la migration dans un contexte 3D4 , 9. cette dégradation est offerte par sécrétion cellulaire des protéases qui ciblent spécifiquement l’étendue « RGDS »9 ou élastine comme séquence25. Les hydrogels PEL ont également montrés pour soutenir les épreuves biochimiques suivantes qui sont nécessaires pour étudier la viabilité cellulaire et fonction y compris immunocytochimie comme extraction d’ADN/ARN/protéines pour reverse quantitative transcription-polymérase (qRT-PCR) et Western blot9. Variantes de PEL ont également été utilisés dans un certain nombre de modèles de in vivo et sont connus pour être bien toléré par le système immunitaire26.
Pris ensemble, PEL comme une plate-forme matérielle pour les études de la cellule-encapsulation dispose d’une grande variété d’avantages par rapport aux plates-formes matérielles synthétiques ou d’origine naturelle, qui n’ont souvent pas le même degré d’accordabilité biochimique et biophysique et reproductibilité. En outre, de l’ELP utilisation simple et non cytotoxiques avec une grande variété de types de cellules (par exemple., poussin racine dorsale ganglions14,24, murin progénitrices neurales cellules9,27, bovine des cellules souches mésenchymateuses humaines chondrocytes néonatale28, homme endothélial cellules29,30) permet pour un modèle plus physiologiquement pertinent de l’ECM 3D endogène par rapport à la culture cellulaire 2D. Ici, nous présentons un protocole pour l’expression de la dérivée d’inoculation, encapsulation de cellules de Portfolios pour l’utilisation comme plate-forme hydrogel accordable pour la 3D. Nous présentons également la méthode de marquage fluorescent en aval et microscopie confocale des cellules encapsulées.
Protocole
1. protocole d’Expression PEL
- Jour 1 : Croissance de la colonie de démarreur
- Préparer des boîtes de gélose ampicilline et au chloramphénicol par autoclavage 25 g de Luria bouillon et 15 g d’agar pour 1 L d’eau ultrapure. Une fois que la solution est refroidie à ~ 60 ° C, ajouter 1 mL de stock de l’ampicilline (100 mg/mL dans de l’eau ultrapure) et 1 mL de stock de chloramphénicol (34 mg/mL dans l’éthanol à 70 %) dans 1 L de solution d’agar pour la concentration finale de 100 µg/mL et de 34 µg/mL , respectivement. Transférer 20 mL de solution finale à 10 cm de Pétri avec une pipette sérologique et permettre l’agar à se solidifier. Envelopper les boîtes de Pétri avec parafilm et conserver à 4 ° C.
Remarque : les boîtes de Pétri peuvent être stockés à 4 ° C pendant deux semaines. - Ensemencer un petit échantillon de BL21 (DE3) pLysS e. coli provenant d’un stock bactérien pré-faites contenant un vecteur pET15b codant le PEL d’intérêt sur une gélose au ampicilline et au chloramphénicol.
Remarque : L’ampicilline et au chloramphénicol sélectionner des bactéries contenant des vecteurs pLysS tant pET15b, respectivement. - Placer la plaque striée à l’envers dans un incubateur à 37 ° C. Laisser les colonies bactériennes à croître pendant la nuit.
NOTE : Ne pas Incuber les boîtes pendant plus de 16 h, comme l’ampicilline va se dégrader et peuvent former des colonies qui ne portent pas de résistance à l’ampicilline.
- Préparer des boîtes de gélose ampicilline et au chloramphénicol par autoclavage 25 g de Luria bouillon et 15 g d’agar pour 1 L d’eau ultrapure. Une fois que la solution est refroidie à ~ 60 ° C, ajouter 1 mL de stock de l’ampicilline (100 mg/mL dans de l’eau ultrapure) et 1 mL de stock de chloramphénicol (34 mg/mL dans l’éthanol à 70 %) dans 1 L de solution d’agar pour la concentration finale de 100 µg/mL et de 34 µg/mL , respectivement. Transférer 20 mL de solution finale à 10 cm de Pétri avec une pipette sérologique et permettre l’agar à se solidifier. Envelopper les boîtes de Pétri avec parafilm et conserver à 4 ° C.
- Jour 2 : Préparation des médias starter culture et expression
- Sortir la culture d’e. coli de l’incubateur. Parafilm la plaque et le magasin pour un maximum de 4 jours à 4 ° C.
- Préparer un flacon de culture starter (250 mL) et les flacons de culture expression (12 x 1 L) et les stériliser. Pour 1 L d’expression media, ajouter 47,6 g de bouillon formidable et 4 mL de glycérol à 1 L d’eau ultrapure dans un flacon de culture dérouté de 2 L et couvrez-les avec le papier d’aluminium.
Remarque : Les rendements typiques sont protéine de 60 à 100 mg/L d’expression media. - Charger le démarreur autoclavé dans préchauffé, incubateur de secousse de 37 ° C et laisser incuber sans agitation.
- Ajouter 250 µL de stérile filtrée de stock d’ampicilline (filtre de 0,22 µm) (100 mg/mL dans de l’eau ultrapure) dans la culture de départ pour une concentration finale de 100 µg/mL. Immédiatement commencer l’agitation de la culture starter à 250 tr/min.
Remarque : Le chloramphénicol est utilisé uniquement pour la sélection de colonies sur milieu gélosé et n’est pas inclus pour les cultures en milieu liquide. - Ensemencer la culture starter en ajoutant une seule colonie d’e. coli de plasmide PEL de la plaque striée et permettent la culture starter à trembler à 37 ° C pendant 16 h.
- Les milieux de culture expression flacons en préchauffée, 37 ° C, secouant les incubateurs et incuber pendant la nuit sans agitation, afin que les flacons sont prêts à ensemencer le lendemain matin.
- Jour 3 : Induisant expression de la protéine chez e. coli
- Faire le stock ampicilline frais et filtré stérile (100 mg/mL dans de l’eau ultrapure). Ajouter 1 mL de stock ampicilline dans chaque fiole d’expression media pour une concentration finale de 100 µg/mL.
- Commencer l’agitation des médias d’expression à 250 tr/min.
- Prendre un échantillon de 2 mL des médias tout flacon expression et ajouter à une cuvette comme un blanc pour une densité optique de lecture à 600 nm (OD600).
- À l’issue de l’incubation de la culture pour le démarreur 16 h, inoculer chaque fiole d’expression par le transfert de 20 mL de la culture de départ dans chaque fiole d’expression via une pipette sérologique.
- Après l’achèvement de l’agitation de 1 h, mesurer l' OD600 de l’un de ces flacons d’expression. Après cette étape, mesurer l’OD600 toutes les 20 min, vérifier une fiole différente chaque fois.
- Une OD600 de 0,6, réduire la température de la poivrière contenant les fioles d’expression à 32 ° C.
- Vérifier l’OD600 toutes les 10 min. Une OD600 de 0,8, induire l’expression en ajoutant 1 mL de 1 M, isopropyl β stérile filtré thiogalactoside (IPTG) dans de l’eau ultrapure dans chaque fiole d’expression.
- Permettre l' e. coli dans des flacons d’expression exprimer pendant 7 h.
- 20 min avant la fin de l’expression, refroidir préalablement une centrifugeuse de plancher grand à 4 ° C.
- Recueillir tous les 12 L d’expression media dans l’équilibre et des récipients individuels de centrifugation.
- Centrifuger les médias d’expression à > 12 000 x g pendant 15 min à 4 ° C à l’aide d’une centrifugeuse de plancher.
- Décanter le liquide surnageant dans chaque récipient de centrifugeuse. À l’aide d’une spatule, recueillir les granules cellulaires dans un sac à fermeture éclair préalablement pesé.
- Resuspendre le culot dans un tampon dix stérile filtré (100 mL de tampon par 25 g de granulés) et éliminez les bulles d’air en excès en massant le culot. Pour 1 litre de tampon de dix, ajouter 5,8 g de chlorure de sodium, 1,21 g de base tris et 0,37 g d’éthylènediamine tétraacétique (EDTA) acide dihydrate sel de disodium dans 900 mL d’eau ultrapure. Ajuster le pH à 8,0 et porter à 1 L. Pour cette étape, les bandes de pH sont suffisants.
- Placez le sac ziplock contenant le culot cellulaire remises en suspension dans un conteneur secondaire et congeler à-80 ° C durant la nuit.
- Jour 4-6 : rupture de la paroi cellulaire bactérienne par cycles de gel-dégel
- Enlever la pastille congelée du congélateur et laisser décongeler lentement à 4 ° C en agitant doucement à l’aide d’un agitateur orbital.
- Laisser le diabolo décongeler jusqu'à ce que le liquide est présent. Ajouter environ 30-40 mg de désoxyribonucléase I (DNase) décongelé lysat. En outre, ajouter 1 mL de fluorure de sulfonyle de 100 mM (PMSF ; un inhibiteur de protéase) dans l’alcool isopropylique 100 millilitres de lysat cellulaire. Permettre le lysat de secouer toute la nuit.
NOTE : Ajout de la DNase et PMSF n’est nécessaire pour le premier cycle de gel-dégel.
ATTENTION : PMSF est toxique par inhalation. Un masque doit être utilisé lors de la manipulation de poudre PMSF. - Une fois le lysat cellulaire est complètement décongelé, geler le lysat à-80 ° C durant la nuit, ou jusqu'à ce que complètement gelé.
- Répéter la procédure de gel-dégel pour un total de trois cycles. Laissez le lysat décongelés à 4 ° C après le dernier gel-dégel. Stocker 100 µL de lysat pour analyse sodium dodecyl sulfate polyacrylamide gel électrophorèse (SDS-PAGE) à l’issue de la purification de raw.
- Après le dernier dégel, ajuster le pH de la dégelée lysat de 9.0 à l’aide de 1 NaOH M. Pour cette étape, les bandes de pH sont suffisants. Incuber à 4 ° C pendant au moins 1 h (une nuit est approprié) dans un agitateur orbital.
- Jour 7-9 : purification PEL via cyclage thermique chaud et froid essorage
- Cool la centrifugeuse de plancher à 4 ° C 20 min avant la centrifugation.
- Aliquote et équilibre le décongelé lysat dans des contenants de centrifugeuse.
- Centrifuger les échantillons à > 15 000 x g pendant 1 h à 4 ° C. Conservez 100 µL du liquide surnageant pour analyse SDS-PAGE après l’achèvement de la purification.
Remarque : Après centrifugation, la protéine PEL doit rester dans le surnageant en raison de sa grande solubilité dans l’eau à des températures inférieures à sa LCST (< 32 ° C). - Transférer le surnageant de nouveaux conteneurs de centrifugeuse et équilibrer convenablement.
- Ajouter du chlorure de sodium (NaCl) en trois parties à une concentration finale de 1 M (5,84 g de NaCl pour chaque 100 mL du surnageant). Veiller à ce que le NaCl est ajouté en trois parties pour permettre la dissolution suffisante.
- Agiter pendant 3 h à 37 ° C à 250 tr/min dans un incubateur à agitation.
- 1 h avant la fin de l’agitation, préchauffer une centrifugeuse de plancher à 37 ° C.
- Centrifuger à > 15 000 x g pendant 1 h à 37 ° C. Stocker 100 µL du liquide surnageant pour analyse SDS-PAGE, après l’achèvement de la purification et éliminer le surnageant restant.
Remarque : Après centrifugation, la protéine PEL doit être granulée en raison de sa faible solubilité dans l’eau à des températures au-dessus de la LCST (> 32 ° C). - Resuspendre le culot en ajoutant 10 mL d’eau ultrapure autoclavé par 1 g de granulés. Utilisez une spatule métallique pour écraser les granulés pour faciliter la dissolution de la protéine.
- Ajuster le pH de la dégelée lysat de 9.0 à l’aide de 1 NaOH M. Pour cette étape, les bandes de pH sont suffisants.
- Agiter pendant une nuit à 4 ° C dans un agitateur orbital.
- Répétez la procédure de cyclisme thermique spin chauds et froids pour un total de trois cycles (i.e., répétez les étapes 1.5.1 par 1.5.11 pour trois cycles de totales).
- Jour 10-15 : PEL dialyse et lyophilisation
- Centrifuger le culot remises en suspension dans une centrifugeuse préalablement réfrigérée à > 15 000 x g pendant 1 h à 4 ° C. Conservez 100 µL du liquide surnageant pour analyse SDS-PAGE après l’achèvement de la purification.
- Dessalement de la solution de protéines par dialyse le surnageant restant dans une membrane de dialyse 3,5 kDa contre 4 L d’eau ultrapure préalablement refroidie à 4 ° C. Changer l’eau de dialyse deux fois par jour pour un total de 6 fois plus de 3 jours.
Remarque : Les volumes de surnageants typiques sont entre 5 et 30 mL. - Centrifuger la solution dialysée dans une centrifugeuse refroidie à > 15 000 x g pendant 1 h à 4 ° C. Stocker 100 µL du liquide surnageant pour analyse SDS-PAGE à la fin de la purification.
- Congeler le résultant surnageante à-80 ° C dans des tubes coniques préalablement pesés.
- Lyophiliser la solution congelée pendant 3 jours et la masse du produit final pour déterminer le rendement de protéine.
- Parafilm les tubes contenant la finale lyophilisé produit PEL et magasin à 4 ° C.
- Exécutez le SDS-PAGE pour déterminer la pureté de la protéine.
NOTE : Les protocoles pour SDS-PAGE variera selon des conditions de gel d’agarose spécifiques. Pour nos expériences, protéines lyophilisées final a été dissous à une concentration de 0,5 mg/mL dans l’eau désionisée et exécutez-le 140 V pour 70-100 min dans un gel d’acrylamide de 12 % (p/v) dans des conditions dénaturantes.
2. cell Encapsulation en 3D Elastin-like Protein Hydrogels
- Préparation de moules silicone
- Utilisez un punch biopsie avec le diamètre désiré pour créer des trous dans une feuille de silicone épaisseur 0,5 mm et découpez un carré autour de chaque trou. Répétez la procédure pour le nombre de moules désiré.
NOTE : Le diamètre et l’épaisseur des moules peuvent être ajustées pour l’application particulière et les conditions de culture cellulaire. En pratique, pour les cultures de cellules de 50 10 moules épaisseur 0,5 mm à 4 mm et 5 mm de diamètre,6 cellules/mL sont recommandés pour les DNA/RNA suffisante et extraction de protéine, respectivement. Pour immunostaining, un coup de poing 2 mm biopsie peut servir au lieu de cela créer trois trous adjacents par moule carré afin que trois répétitions peuvent être colorées par puits. - Retirer la pellicule de plastique de chaque côté du moule individuel avec des pincettes.
NOTE : Éviter tout contact avec la surface exposée de silicone que la contamination peut réduire plasma future liaison efficacité. - À l’aide de pinces à épiler, d’organiser le même nombre de moules silicone nu et lamelles de verre (n ° 1, 12 mm de diamètre) en alternant les lignes sur le couvercle inversé d’une plaque de 48 puits. Une fois terminé, couvrir le couvercle de la plaque de 48 puits pour éviter la contamination.
- Plasma oxygène traiter le couvercle ensemble plaque 48 puits (i.e., moules et plaques en verre). Immédiatement après, utilisez pince pour inverser le moule en silicone sur la lamelle de verre adjacentes. Appuyez fermement sur le moule afin d’assurer la liaison. Laissez les moules incuber à température ambiante pendant 1 h.
Remarque : La durée du traitement plasma oxygène varie selon l’instrument utilisé. Les conditions typiques pour notre instrument sont une fenêtre de pression gaz fonctionnement entre 0,3-4 mbar, gaz en oxygène à 20 cm3/min et l’exposition d’échantillon au plasma pour 10-20 s. - Stériliser les moules à l’autoclave. Placez les moules à la température ambiante dans un environnement stérile jusqu'à l’utilisation.
Remarque : Les moules peuvent être stockés indéfiniment à ce stade.
- Utilisez un punch biopsie avec le diamètre désiré pour créer des trous dans une feuille de silicone épaisseur 0,5 mm et découpez un carré autour de chaque trou. Répétez la procédure pour le nombre de moules désiré.
- Préparation de la solution mère de protéine élastine
- Retirez PEL lyophilisé de stockage de 4 ° C. Réchauffer la protéine à température ambiante avant d’ouvrir le tube pour assurer que sans condensation s’appuie sur la protéine sur une utilisation répétée.
- Dissoudre le PEL dans tampon phosphate salin de Dulbecco (SPD) à 4 ° C sous agitation constante (i.e., filature) pendant la nuit.
Remarque : La concentration de la solution stock PEL va être plus diluée avec l’ajout d’une solution de reticulation à un rapport volumétrique défini par l’utilisateur. Par exemple, pour une concentration finale de PEL 3 % (p/v), préparer une solution mère de PEL 3,75 % (p/v) qui sera diluée dans un rapport volumétrique de 4:1 de solution solution : RETICULATION PEL. Ajuster la concentration nécessaire pour l’application désirée. - Filtre stérile à l’aide d’une seringue-filtre de 0,22 µm de solution mère de PEL. Stocker le PEL sur la glace quand pas en service.
- Dans la prévention des risques biotechnologiques armoire, transférer les moules stériles à l’aide de la pince à épiler stériles pour une plaque de culture tissulaire 24 puits.
- Préparation de la solution mère THPC
- Diluer THPC au SPD juste avant l’utilisation. Ajuster la concentration de solution THPC selon la concentration finale de PEL et le ratio de réticulation désirée.
Remarque : Pour le protocole, une concentration finale de PEL de 3 % (p/v) se fera en mélangeant la solution avec la solution THPC à un rapport volumétrique de 4:1 PEL. Ajuster au besoin. - Ajouter 2.6 µL de solution THPC (80 % dans l’eau) dans 997.4 µL de SPD.
NOTE : Cette concentration de THPC correspond à un ratio de 1:1 stoechiométrique de groupes hydroxy méthyl sur THPC et des amines primaires sur la protéine PEL lors du mélange des solutions au rapport volumétrique décrit 4:1 pour un final hydrogel de PEL de 3 % (p/v). La solution THPC est visqueuse et gouttelettes de solution peuvent coller à côté de l’embout de la pipette. Pour les concentrations exactes, éviter ces gouttelettes en diluant dans le SPD. Vider le conteneur stock THPC à l’azote pour éviter l’oxydation de la phosphine et l’inactivation de la RETICULATION. - Vortex la solution pour mélanger et garder sur la glace.
- Filtre stérile la THPC stock solution à l’aide d’une seringue-filtre de 0,22 µm. Diluer la THPC stock solution davantage avec SPD stérile pour atteindre des taux de réticulation stoechiométrique inférieur (par exemple., 0.5:1 ou 0.75:1).
Remarque : THPC est sensible à l’oxygène, et la solution diluée doit être utilisée dans quelques heures après leur préparation.
- Diluer THPC au SPD juste avant l’utilisation. Ajuster la concentration de solution THPC selon la concentration finale de PEL et le ratio de réticulation désirée.
- Dissocier les cellules par incubation avec la trypsine-EDTA dans une suspension de cellules individuelles, les cellules de granule et compter les cellules remis en suspension dans un milieu à l’aide d’un hémocytomètre.
Remarque : Des protocoles précis pour cette étape dépendra fortement type de cellule souhaité et l’application. Pour les cellules progénitrices neurales utilisés tout au long de ce protocole, une période d’incubation de la trypsine-EDTA de 0,025 % à température ambiante pendant 1,5 min a été réalisée. Les cellules sont granulées à 200 x g pendant 2 min. Pour la viabilité accrue des cellules, cellules devraient être suspendus dans les conditions normales de moyenne. Densité des cellules typiques utilisée pour plage d’encapsulation de cellules de 1 à 50 106 cellules/mL de volume final hydrogel. Ajuster au besoin. - Aliquoter le nombre désiré de cellules dans un tube à centrifuger stérile de 1,5 mL.
- Centrifuger les cellules à ~ 200 g pendant 3 min. avec précaution, aspirer le surnageant et garder le culot cellulaire sur la glace.
Remarque : Il est essentiel d’aspirer complètement tout le surnageant pour atténuer la dilution supplémentaire de la RETICULATION PEL et THPC. Les vitesses centrifugation spécifiques varient avec le type de cellule. - Resuspendre le culot dans la solution mère de PEL telle que le volume soit 80 % du volume final (en supposant un ratio de 4:1 de solution solution : THPC PEL). Pipetter mix 20 à 25 fois pour produire un mélange homogène des cellules et des PEL.
Remarque : Évitez de saisir le fond du tube pour atténuer l’augmentation de la température et de la transition de la phase ultérieure du PEL. Chaque moule de 2 mm avec trois répétitions requiert 7,5 µL de volume final (i.e., 6 µL de la solution mère de PEL et 1,5 µL de solution mère THPC) répartis dans les 3 trous (i.e., 2,5 volume final µL par trou). Pour les moules de 4 à 5 mm, un volume final de 7,5 µL et 15,5 µL est requis, respectivement. - Solution mère THPC s’ajoute la suspension cellulaire/PEL pour le volume final de 20 % restant. Pipetter mix 20 à 25 fois pour produire un mélange homogène.
- Immédiatement Pipetter les volumes correspondants finales de cellule/PEL/THPC mélange dans chaque moule avec un mouvement circulaire. Répétez pour tous les moules.
- Incuber les échantillons à la température ambiante pendant 15 minutes, suivie d’une incubation supplémentaire à 37 ° C pendant 15 min.
Remarque : La première période d’incubation contribuera à faciliter une réticulation initiale de l’hydrogel avant l’augmentation de la température à celle ci-dessus LCST de l’ELP et induire sa séparation de phase thermique. - Ajouter lentement 750 µL de milieu de culture cellulaire chaude dans chaque puits de la plaque 24 puits, en évitant de perturber les gels.
- Incuber les hydrogels à 37 ° C pendant 7 jours.
NOTE : Plein milieu changements sont recommandés chaque 1 ou 2 jours selon le type de cellule. Pour limiter le stress sur le gel, utiliser un verre pipette Pasteur apposée avec une pointe de pipette 200 µL pour aspiration moyenne du puits.
3. immunocytochimique des cellules en 3D PEL Hydrogels
- Préparer la solution de fixation en mélangeant 10 mL de paraformaldéhyde à 16 % (p/v) (IFP) dans 30 ml SPD. Chauffer la solution à 37 ° C.
- Aspirer le milieu de la plaque 24 puits et laver délicatement avec 1 mL de SPD.
- Ajouter 750 µL de la solution de fixation à chaque puits et incuber à 37 ° C pendant 30 min. N’utilisez pas l’incubateur de culture de tissus pour éviter la contamination des autres cultures à vapeur de la PFA.
- Soigneusement aspirer la solution de fixation de chaque puits, jeter l’IFP à un conteneur de déchets appropriés.
ATTENTION : Exposition à l’IFP peut causer des irritations de peau et des yeux. Porter des gants/lunettes et travailler sous une hotte chimique. - Ajouter 1 mL de SPD dans chaque échantillon. Immédiatement aspirer le SPD et les jeter dans la poubelle de la PFA.
- Laver les échantillons deux fois avec 1 mL de SPD pendant 10 min chaque.
Remarque : Les échantillons peuvent être conservés dans le SPD à 4 ° C pendant plus d’une semaine après avoir scellé la plaque avec du Parafilm. - Permeabilize chaque échantillon avec 750 µL de solution de perméabilisation (100 mL de SPD et 0,25 mL de Triton X-100 ; PBST) pendant 1 h à température ambiante sur un rocker à 15 tours/minute.
- Aspirer le PBST et ajouter 750 µL de solution (95 mL de PBS, 5 g d’albumine sérique bovine (BSA), 5 mL de sérum et 0,5 mL de Triton X-100) de blocage à chaque échantillon. Incuber à température ambiante pendant 3 h sur un rocker à 15 tours/minute.
Remarque : La solution de saturation doit contenir de sérum de l’espèce hôte dans lequel les anticorps secondaires ont été soulevées (par ex.., chèvre, âne) et stérile filtré à travers un 0,22 µm filtrer avant utilisation. - Préparer la solution de dilution d’anticorps (97 mL de SPD, 2,5 g de BSA, 2,5 mL de sérum (de la même espèce hôte comme au point 3.8) et 0,5 mL de Triton X-100). Diluer l’anticorps primaire à l’aide de la solution de dilution des anticorps et ajouter 500 µL de la solution à chaque échantillon. Sceller la plaque avec du Parafilm et incuber une nuit à 4 ° C sur une bascule.
NOTE : Nestin et Sox2 anticorps primaires ont été dilués 1 : 400 dans la solution de dilution des anticorps de concentration originale du fabricant. - Aspirer la solution d’anticorps de chaque échantillon et laver les échantillons avec PBST pendant 60 min à température ambiante sur un rocker à 15 tours/minute. Répétez l’étape de lavage 3 fois.
- Diluer l’étalon secondaire de l’anticorps et de 5 mg/mL DAPI (1:2, 000) à l’aide de la solution de dilution des anticorps et ajouter 500 µL de la solution à chaque échantillon. Couvrir la plaque 24 puits avec du papier aluminium et incuber une nuit à 4 ° C sur une bascule.
Remarque : Comme les anticorps secondaires sont sensibles à la lumière, les échantillons doivent être protégés de photoblanchiment pour toutes les étapes subséquentes. Chèvre anti-souris et chèvre anti-lapin Anticorps secondaires ont été dilués 1/500 dans la solution de dilution des anticorps de concentration originale du fabricant. - Aspirer la solution d’anticorps de chaque échantillon et laver les échantillons avec PBST pendant 30 min à température ambiante sur la bascule. Répétez l’étape de lavage 3 fois.
- Placez une goutte de milieu de montage fixe sur la surface d’une lame de verre. Avec une pincette, enlever l’excédent de solution du moule en tamponnant légèrement le bord du moule sur du papier absorbant. Placez le moule à l’envers sur le support de montage soigneusement et éviter d’introduire des bulles.
- Permettre le support de montage durcir pendant 48 h à température ambiante. Stocker les échantillons à température ambiante ou 4 ° C. Permettre le support de montage définir pleinement pendant 48 h avant d’imagerie comme l’indice de réfraction du milieu va changer au cours du durcissement. Sceller les échantillons à la lame de verre couvercle avec vernis à ongles transparent pour atténuer la contamination ou l’échantillon de mouvement.
- Image des échantillons à l’aide d’un microscope confocal.
Résultats
Le PEL utilisés dans le présent protocole est composées de cinq régions : une balise T7, His6 tag, site de clivage entérokinase (EK), une région bio-actifs et une région elastin-like (Figure 1). Les balises T7 et His6 permettent une identification aisée grâce à des techniques standard de Western blot. Introduction du site de clivage EK permet l’élimination enzymatique de la région de tag, si nécessaire. La région de bio-active code l’étendu, dérivé de la fibronectine cellule-adhésif (« RGDS ») ou des séquences non adhésif (« DGR »). Enfin, le motif central de la région d’elastin-like contient un groupe de lysine sur le site de résidu de commentaires qui permet la réticulation par THPC tandis que les séquences flanquantes contiennent isoleucine pour atteindre une LCST de ~ 32 ° C31.
Expression de post, SDS-PAGE ou Western blot permet de visualiser le poids moléculaire et de confirmer l’identité des PEL qui contiennent des balises d’anticorps, comme T7 (MASMTGGQQMG) ou His6 (HHHHHH) (Figure 2). Une expression réussie dans des conditions contrôlées donne un produit très homogène, représenté par la présence d’une seule bande sombre au poids moléculaire approximatif (~ 37 kDa) de ces protéines à l’aide de deux SDS-PAGE (Figure 2 a) et Western blot) Figure 2 b).
Dans des conditions non contrôlées, la présence de bandes de poids moléculaire plus faibles sur une tache occidentale suggère qu’une fraction des protéines n’est pas complètement traduite et/ou ont été dégradées après expression (Figure 2). Plus précisément, les masses ici sont équidistants de ~ 9 kDa qui correspond à peu près le poids d’une région bio-actifs et trois régions elastin-like (une « répétition »), ou environ un quart de la protéine cible. Ces fragments de protéines plus petites sont généralement présents lorsque l’expression est effectuée à une température plus élevée (> 32 ° C) comme dans la Figure 2. La présence de ces protéines de poids moléculaire plus faibles peut conduire à des propriétés mécaniques imprévisibles. Ainsi, regular expression post de dépistage est recommandé pour assurer un produit final de haute qualité.
La rigidité mécanique des hydrogels axée sur le PEL peut être modifiée en manipulant la concentration du PEL ou le rapport d’amines primaires de groupes réactifs : PEL THPC. Parallèlement, la concentration des ligands cellulaires-adhésif peut être ajustée en changeant le ratio des variantes de PEL de la cellule-colle (RGDS) aux séquences non adhésif (DGR) tout régime de rigidité. En manipulant ces deux variables, nous pouvons produire des gels qui disposent d’une gamme de propriétés mécaniques et de la concentration de ligand (Figure 3).
Pour encapsuler les cellules à l’intérieur 3D PEL hydrogels, le nombre de cellules est en suspension dans le milieu et centrifugé pour produire un culot cellulaire (Figure 4 a). Le milieu est aspiré dans le tube, et les cellules sont remises en suspension uniformément dans la solution de PEL de la concentration désirée. Ensuite, solution THPC est ajoutée à la suspension cellulaire/PEL et éjectant complètement pour former un mélange homogène. Cette solution est rapidement transférée à moules silicone stérile dans une plaque de 24 puits à l’aide d’une pipette et autorisée à relier à température ambiante et 37 ° C pendant 15 min chaque (Figure 4 b). Enfin, le support est ajouté à la plaque bien et incubé à 37 ° C dans l’expérience.
Live/dead coloration peut être utilisée pour évaluer la viabilité cellulaire et l’encapsulation de cellules réussie dans PEL hydrogels. Tel qu’illustré à la Figure 5, cellules progénitrices neurales murine adultes (PNJ) montrent la viabilité cellulaire élevé pendant 7 jours dans un hydrogel de PEL de 3 % (p/v).
3D PEL hydrogels ont démontré antérieurement pour soutenir le maintien de souches NPC mesurée par le biais de l’expression des marqueurs de protéines canoniques NPC SRY (sex déterminant région Y)-boîte de 2 (Sox2) et nestin9. PNJ encapsulé dans 3 % (p/v) PEL hydrogels avec faible THPC réticulant Voir la forte expression de Sox2 nucléaire localisée et de filaments de nestin cytoplasmiques par immunomarquage et imagerie confocale (Figure 6).

Figure 1 : Une représentation schématique des PEL et des séquences d’acides aminés correspondante. Le PEL utilisé dans cette étude contient une balise T7 et His6 d’imagerie à base d’anticorps, une région bioactif pour l’introduction des domaines de la cellule-adhésif et une région elastin-like qui confère des propriétés mécaniques élastiques et permet de réticulation chimique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
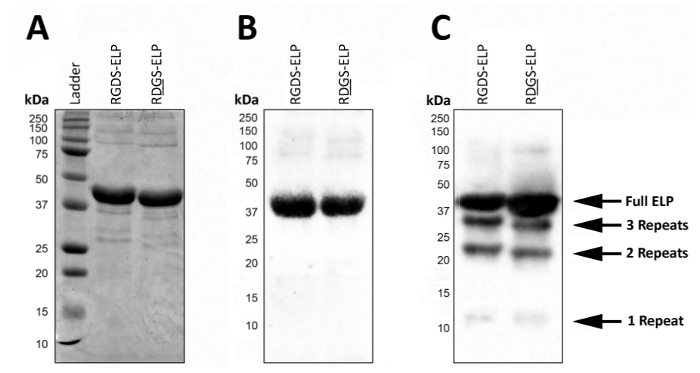
Figure 2 : Expression de la protéine cible peut être validée avec SDS-PAGE et Western blot pour confirmer le poids moléculaire et l’identité du produit lyophilisé final. ELP pleine longueur pure tourne à un poids moléculaire de 37 kDa tel que rapporté par SDS-PAGE (A) et Western blot, en utilisant le T7 (MASMTGGQQMG) ou l’histidine 6 tag (HHHHHH) b. C. lots impurs de PEL en raison de dérogations dans le protocole d’expression PEL peuvent conduire à l’expression des PEL de plus faibles poids moléculaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
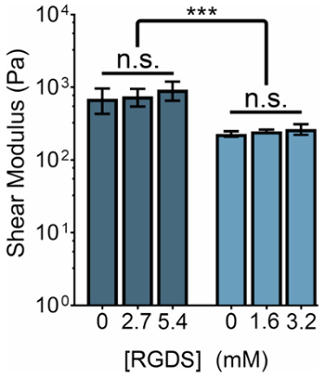
Figure 3 : Contenu de ligand RGDS peut être réglée indépendamment des propriétés mécaniques au sein de l’ELP hydrogels. 5 % (p/v) et 3 % (p/v) PEL hydrogels ont des modules de cisaillement de ~ 800 Pa et ~ 400 Pa, respectivement. Hydrogels avec un ratio de 1:1 d’amines primaires de groupes réactifs : PEL THPC ont été réticulé à température ambiante pendant 15 min, chauffé à 37 ° C et a permis de s’équilibrer pendant 5 minutes avant la mesure. Les données sont moyenne ± s.d., *p < 0,001. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Schématique d’encapsulation de cellules en PEL hydrogels. (A). les cellules sont initialement dissociées en une suspension de cellules individuelles dans le milieu et pressés à l’aide d’une centrifugeuse. Le milieu est aspiré dans le tube, et les cellules sont remis en suspension dans une solution de PEL à la concentration désirée et bien mélanger. Enfin, la solution de réticulation THPC est ajoutée et bien mélanger. B. immédiatement après l’ajout de THPC, la solution est coulée dans un moule de silicone avec une pipette. La solution est autorisée à relier à la température ambiante pendant 15 minutes, suivie d’une deuxième période d’incubation de 15 min à 37 ° C. Le médium est alors ajouté à la culture bien pendant la durée de l’expérience. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Des cellules progénitrices neurales maintiennent la viabilité haute en PEL hydrogels. Une image représentative des cellules progénitrices neurales encapsulé dans 3 % (p/v) PEL hydrogels avec 1:1 de réticulation (THPC groupes réactifs : PEL des amines primaires) après 7 jours de culture. Vert : vivre la coloration (calcéine-AM) ; Rouge : morts de coloration (homodimère d’éthidium). Echelle = 100 µm.
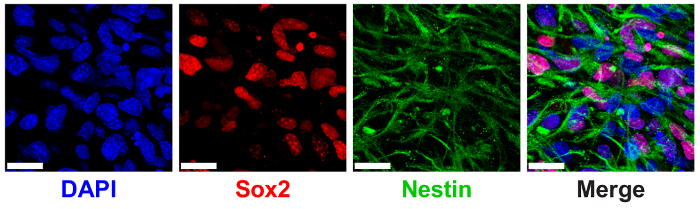
Figure 6 : 3D PEL hydrogels soutenir expression de progénitrices neurales cellules souches machine à. Image d’immunofluorescence des cellules progénitrices neurales exprimant Sox2 et nestin protéines après 7 jours de culture en PEL hydrogels. Les images montrent des cellules encapsulées dans des gels de PEL de 3 % (p/v) avec 0.5:1 de réticulation (THPC groupes réactifs : PEL des amines primaires). Bleu : DAPI (noyaux) ; Rouge : Sox2 ; Vert : nestin. Echelle = 25 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Purification et expression de protéine recombinante est un outil puissant pour synthétiser des biomatériaux avec une reproductibilité élevée. Dus en grande partie à l’avènement de clonage moléculaire commercialisé, plasmides recombinants personnalisés peuvent être achetés auprès de plusieurs fournisseurs, qui réduit considérablement le temps de travailler avec des matériaux tels que portfolios. De même, plasmides peuvent être demandés directement auprès du laboratoire d’origine lorsque le œuvre originale a été pris en charge par un contrat fédéral et les travaux futurs seront pour une utilisation à but non lucratif. La séquence d’acides aminés PEL complet a été publiée précédemment pour plusieurs PEL variantes31. Cependant, le processus d’expression éventuelle purification de protéines recombinantes implique un certain nombre d’étapes critiques qui entraînent généralement des rendements réduits ou un produit de qualité inférieur. Certaines des questions plus courantes pour la préparation du PEL se posent dans l’une des opérations suivantes : (1) qualité des stocks bactériennes stockées, (2) le premier gel-dégel cycle visant à désorganiser la membrane bactérienne et la purification des protéines (3) par le biais de cycles thermiques.
Une différence majeure entre l’expression des protéines et d’autres moyens non biologiques de production de matériaux, c’est que nous sommes s’appuyant sur les mécanismes biologiques d’hôtes recombinants pour synthétiser les polymères. Par la suite, cette technique est livré avec une limitation unique : mort cellulaire ou des dommages. La mort cellulaire plus souvent se manifeste comme un réduction du nombre de colonies bactériennes après étalement d’une plaque ou anormalement petites colonies qui se développent relativement lentement. Les stocks bactériennes, si entretenu avec soin, peuvent demeurer stables pour années ; Cependant, cycles gel-dégel successifs en raison d’échecs répétés d’utilisation ou au congélateur peuvent réduire la viabilité des cellules ou causer des dommages de l’ADN. Stocks de bactéries typiques BL21 utilisent entre 10 % et 40 % de glycérol en volume mélangé avec cellules suspendues. Le glycérol vise à réduire les dommages de la membrane de la nucléation des cristaux de glace au cours du gel. Par conséquent, à l’aide de faibles concentrations (< 10 %) peut conduire à une membrane compromise, tandis que des concentrations plus élevées (> 40 %) pour supprimer le point de congélation au point où le stock gèle jamais conduisant à la mort cellulaire. Cependant, même à l’intérieur des niveaux optimaux de glycérol, stocks bactériennes devraient pas pleinement dégel comme une combinaison de dommages de la membrane de regel et cytotoxiques des effets de la glycérol peut conduire à réduit la viabilité stock et dommages à l’ADN. Par conséquent, s’il est constaté qu’un stock bactérien entraîne une numération des colonies faibles ou que les cellules se divisent constamment lentement (se manifestant par un rythme lent de la rampe du600 OD au cours de l’expression), re-transformant le plasmide et faire un nouveau stock sont un simple première approche pour résoudre ce problème. Dans cette perspective, afin d’assurer l’entretien à long terme des stocks bactériennes et l’intégrité de l’ADN, il est préférable de stocker les copies de votre plasmide comme l’ADN purifié congelé dans de l’eau et pas dans les cellules. Entreposage de l’ADN de cette façon veillera à ce que, dans les événements imprévus comme un stock défaillant ou une panne de congélateur, une source fiable de l’ADN original peut être utilisée pour la transformation.
Une autre étape critique dans la fabrication de PEL est la purification de la protéine cible de l’hôte de l’expression. Extraction de la protéine d’e. coli est obtenue par la rupture de la paroi cellulaire à l’aide de nucléation des cristaux de glace qui se forment tout au long de la cellule suspension lysate sur gel, qui est encore aggravée avec les cycles de gel-dégel successifs. Méthodes alternatives pour une rupture de la paroi cellulaire peuvent être utilisés comme sonication ou une presse. En particulier, gel-dégel consécutive du lysat est avantageuse car elle nécessite seulement un congélateur et aucune autres équipements spécialisés. Toutefois, cette procédure libère façon non-spécifique ADN, d’ARN et contaminants de protéines, en plus des protéases qui sont susceptibles de dégrader les protéines cibles. Par conséquent, pour éviter toute contamination et réduit le rendement, désoxyribonucléase I (DNase) et le fluorure de phénylméthanesulfonyle (PMSF) sommes ajoutés à la cellule de lysate pour dégrader l’ADN et inhibe les protéases, respectivement. La présence de l’ADN avant l’ajout de DNase peut être observée visuellement comme un aspect « filant » dans toute la cellule remises en suspension lysate suite à la première coulée. DNase activement dégrade l’ADN et donc réduit la viscosité de la cellule lysate rend plus facile à purifier par centrifugation. Répartition optimale de l’ADN peut être confirmée visuellement en veillant à ce que le lysat cellulaire semble être entièrement liquide et que l’aspect filandreux n’est plus visible. Dans la pratique, nous avons observé que l’ajout de mg de ~0.1 de DNase / lysat cellulaire de mL est suffisante pour atteindre la dégradation nécessaire. Toutefois, si la présence d’ADN est encore observée, DNase plus peut être ajouté suivi par deux ou trois heures supplémentaires d’agitation. Un problème similaire peut également survenir si DNase est ajouté prématurément avant du lysat ait eu le potentiel suffisamment décongeler. Dans ce cas, les températures plus froides peuvent limiter l’efficacité de la dégradation de l’ADN due à l’inactivation prématurée de DNase. Pour éviter ce problème, il est souvent conseillé pour permettre le culot remises en suspension décongeler pendant environ 8 heures avant le traitement à la DNase. En outre, si hypoprotidique rendements sont signalées et la dégradation de l’ADN a été suffisante, l’ajout de PMSF plus pour aider à réduire davantage la dégradation potentielle des protéines des protéases peut être requis.
Considérations supplémentaires pour assurer une expression optimale de Portfolios comprennent une compréhension minutieuse des avantages et des limites d’un antibiotique choisi. Ici, pET15b vecteurs contenant un gène de résistance ampicilline ont été utilisées pour l’expression de la protéine. D’un point de vue fonctionnel, la série vector pour animaux de compagnie permettre pour l’expression de la protéine importante autant que 50 % de l’expression des protéines de la bactérie dédiée à la protéine cible après un succès induction32,33. Cependant, ampicilline, un antibiotique de choix est livré avec quelques limitations qui peuvent interférer avec l’expression optimale. Tout d’abord, la dégradation de l’ampicilline en présence d’e. coli peut se produire rapidement en raison de la sortie de la bêta-lactamase. Si une quantité suffisante de l’ampicilline est dégradée, le plasmide codant ampicilline (c.-à-d. le plasmide codant PEL) peut être perdu entièrement. Ainsi, lorsqu’elles expriment PEL pour des durées plus longues, niveaux d’expression de protéines doivent être surveillés attentivement en moments successifs afin d’assurer une quantité suffisante de la gène codant PEL pour permettre une expression souhaitable. Méthodes possibles pour le dépannage de l’accumulation de bêta-lactamases sont filer vers le bas la culture starter et re-suspension des cellules dans un milieu sans antibiotique avant d’ensemencer le milieu de l’expression. Ce processus effectivement limite le transfert des enzymes dégradant les antibiotique et assure une plus grande proportion de cellules contient le vecteur d’encodage de protéine-cible. En outre, l’ampicilline a une durée de vie limitée d’environ deux à trois semaines. Par conséquent, les plaques de culture pour l’expression de la protéine doivent être conservés à 4 ° C pendant un maximum de deux semaines avant d’utiliser. Enfin, pour garantir l’efficacité de l’ampicilline, au sein des médias de démarreur et d’expression, la solution mère d’ampicilline devrait être fraîche produite immédiatement avant utilisation, comme le stockage à long terme peut conduire à un antibiotique moins efficace.
La présence d’une LCST permet la purification simple des PEL par le biais de cycles thermiques. Plus précisément, à une température plus élevée et en présence de sels, forces entropiques causent portfolios à devenir moins solubles et former ensuite une phase COACERVATS riche en polymère. En revanche, aux basses températures, PEL reste solubles et se dissoudre rapidement dans la solution. Vélo entre ces régimes de deux température couplés avec les étapes de centrifugation pour recueillir et jeter la phase ne contenant pas d’ELP successivement concentre la protéine et réduit en même temps l’existence de contaminants non-PEL.
Cependant, il existe un certain nombre d’étapes où PEL peut être perdu dans ce processus de purification. Tout d’abord, avant chaque tour de froid, la solution contenant des protéines est solubilisée à un pH de 9,0. Ce pH plus élevé sert à déprotoner certains acides aminés sur l’épine dorsale de protéine, laissant efficacement dans un État chargé et continuent à améliorer leur solubilité. En conséquence, ce qui précède cette étape ou ne pas accordé un délai suffisant pour la dissolution de protéines peut conduire à une diminution du rendement car les protéines non solubilisées seront granulées lors de la centrifugation et mis au rebut.
De même, protéines cibles peuvent être perdus lors de la procédure de rotation chaud lorsque le PEL est granulée. Au départ, NaCl est ajouté au surnageant riche en protéines afin de réduire la solubilité du PEL. Les sels de travaillent pour éviter que les interactions électrostatiques entre les molécules de protéines et d’eau, provoquant la protéine séparer la phase aqueuse. Cet effet est amplifié par le chauffage de la solution, qui, en raison des effets entropiques, décompose la hydraté « cage » entourant les portfolios et oblige l’agrégation des protéines. À des concentrations plus faibles de protéine (i.e., le premier cycle thermique), l’ajout de sels seuls est souvent insuffisante pour causer cette séparation de phase. Toutefois, comme la concentration de protéines augmente (i.e., plus tard des cycles thermiques) et il y a moins contaminants secondaires d’interagir avec les sels, le PEL précipitera plus facilement. Ainsi, si les sels sont ajoutés trop rapidement, ils peuvent devenir physiquement pris au piège par l’agrégation des protéines, qui diminue la concentration de la solution de sel et limite autre précipitation de protéines. Ainsi, le sel doit être ajouté dans trois petits lots afin qu’ils disposent de suffisamment de temps pour distribuer homogène par le biais de la solution. Comme note finale, les variations de l’épine dorsale du PEL, soit par le biais d’autres modifications pour le résidu de commentaires de la région d’elastin-like ou changements dans la région de bio-actifs peuvent avoir un impact significativement le comportement de la LCST. Par conséquent, pour garantir des rendements de protéines optimal variants protéiques, il est essentiel d’optimiser le pH, concentration en sel et sel type (p. ex.., monovalents ou divalents) pour les spins chauds et froids.
SDS-PAGE en cours d’exécution à la fin du protocole est recommandé car il peut être utilisé pour déterminer facilement si la perte significative de PEL se produit au cours des étapes de la purification. En bref, si le PEL est détectée dans le surnageant après un spin chaud, puis la protéine n'est pas efficacement précipitée. De même, si le PEL est identifiés dans un échantillon de pellet solubilisée après un spin froid, puis la protéine n’est pas étant effectivement dissoute.
ELP hydrogels offrent plusieurs avantages par rapport aux matériaux d’origine naturelle ou synthétiques. Plus précisément, l’utilisation de la RETICULATION amine-réactive THPC offre un mécanisme simple, peu coûteux et accordable de protéines de réticulation. Cependant, il y a des limites distinctes au sein du protocole de réticulation qui est à noter. THPC est sensibles à l’oxygène, et stocké dans des conditions de mauvaise, il peut se détériorer rapidement en efficacité de réaction. En outre, en raison de sa réactivité avec des amines primaires, THPC peut réagir avec entourant les protéines dans les médias ou celles sur la surface des cellules qui sont riches en amines. Par conséquent, lors de la formation des hydrogels PEL, il est recommandé pour éviter la contamination des médias avec le culot cellulaire afin de réduire la réactivité croisée possible protéine exogène et donc, une réduction dans l’efficacité de la réticulation. Enfin, ce mécanisme de réticulation s’oppose à la séquence de la région bio-active à ceux ne contenant aucun résidus de lysine et limite donc l’intégration potentielle de certains motifs de cellule-adhésif (e.g., IKVAV34). Pour pallier ces lacunes, modifications à la colonne vertébrale du PEL avec azide et bicyclononyne (BCN) partenaires de réaction permet de réticulation bio-orthogonal, comme décrit précédemment27.
Il est à noter que le comportement de l’ELP LCST joue un rôle important dans la microstructure hydrogel à dicter. Aux régimes de température au-dessus de la LCST, portfolios précipitent hors de la solution conduisant à la formation de phases riches en protéines et déficients en protéines qui peuvent influencer la porosité de la matrice et l’efficacité de la réticulation de la matrice9. Parce que les expériences de culture cellulaire plus sont effectués à des températures physiologiquement pertinents (~ 37 ° C) au-dessus de la LCST ELP, ces effets doivent être jugés. Pour les hydrogels efficacement crosslink et forme un réseau interconnecté de protéine, l’amine primaire de la lysine doit être physiquement accessible à la RETICULATION THPC. En cas de l’agrégation de PEL avant d’arriver à réticulation suffisante, portfolios, pris au piège dans la phase riche en protéine peuvent être inaccessible et donc pas en mesure de participer à la réticulation. Pour combler cette lacune, notre protocole exige une période de réticulation initiale de 15 min à température ambiante, ce qui permet une réticulation préliminaire de l’hydrogel avant que le PEL subit sa transition de phase thermique. Cette incubation à température ambiante est suivie d’une incubation supplémentaire de 15 min à 37 ° C, afin de finaliser la réticulation de l’hydrogel. Cette procédure est critique pour la réticulation suffisante et gélification robuste et reproductible de la matière de PEL.
En conclusion, hydrogels de protéine recombinante fabriquées à l’aide de PEL offre exceptionnelle accordabilité de la séquence protéique et, par conséquent, le microenvironnement cellulaire 3D. Polymères PEL ont été montré pour être exprimable avec des rendements élevés, purifié facilement en raison de leur comportement LCST et biocompatibles dans une grande variété de systèmes in vitro et in vivo . L’utilisation d’e. coli comme un hôte recombinant fournit une procédure simple et peu coûteuse qui donne lieu à près d’un contrôle parfait de poids moléculaire de polymères et de fonctionnalité. En même temps, cette technique permet d’accordabilité robuste et de la reproductibilité de la plate-forme d’hydrogel permettant la culture d’un large éventail de types de cellules en 3D. Enfin, cette plate-forme d’hydrogel PEL se prête à plusieurs épreuves biochimiques en aval y compris qRT-PCR, Western blot, extraction d’ADN et cellule immunostaining9.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient T. Palmer et H. Babu (Stanford neurochirurgie) pour la fourniture de murin PNJs. vecteur de l’art à la Figure 4 a été utilisé et adapté de Servier Medical Art sous Creative Commons Attribution 3.0 Unported License (https://creativecommons.org/ licenses/by/3.0/legalcode). Partie de ce travail a été effectué à la Stanford Nano partagé des installations (FNS), soutenu par la National Science Foundation sous prix ECCS-1542152. N.A.S. reconnaît le soutien de la National Institute of General Medical Sciences, de la National Institutes of Health (32GM 008412). C.M.M. reconnaît le soutien d’un NRSA NIH bourse pré-doctorale (F31 EB020502) et le programme des boursiers Siebel. S.C.H. reconnaît le soutien de la National Institutes of Health (U19 AI116484 et R21 EB018407), National Science Foundation (DMR 1508006) et le California Institute for Regenerative Medicine (RT3-07948). Cette recherche a reçu un financement de l’Alliance for Regenerative Rehabilitation Research & Training (AR3T), qui est soutenu par le Eunice Kennedy Shriver National Institute of Child Health et Human Development (NICHD), Institut National de la Troubles neurologiques et course (NINDS) et National Institute of Biomedical Imaging and Bioengineering (NIBIB) des instituts nationaux de la santé en vertu de la sentence P2CHD086843 numéro. Le contenu est la seule responsabilité des auteurs et ne représente pas nécessairement les vues de la National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| Elastin-Like Protein Expression and Purification | |||
| 10 cm Petri Dishes | Thermo Fisher Scientific | FB0875713 | |
| 70% Ethanol | RICCA Chemical | 2546.70-1 | |
| Ammonium Sulfate | Sigma-Aldrich | A3920-500G | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25G | |
| Bacto Agar | Thermo Fisher Scientific | 9002-18-0 | |
| BL21(DE3)pLysS Competent Cells | Invitrogen | C606003 | |
| Chloramphenicol | Amresco | 0230-100G | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| EDTA disodium salt, dihydrate | Thermo Fisher Scientific | O2793-500 | |
| Glycerol | Thermo Fisher Scientific | BP229-4 | |
| Isopropanol | Thermo Fisher Scientific | A451-4 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | BP1755-10G | |
| Luria Broth | EMD Millipore | 1.10285.5007 | |
| Parafilm | VWR | 52858-000 | |
| Phenylmethanesulfonyl fluoride (PMSF) | MP Biomedicals | 195381 | |
| Sodium Chloride | Thermo Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Sigma-Aldrich | S 8045-1KG | |
| Syringe Filter Unit (0.22 μm) | Millipore | SLGP033RB | |
| Terrific Broth | Millipore | 71754-4 | |
| Tris Base | Thermo Fisher Scientific | BP152-1 | |
| Cell Encapsulation in 3D ELP Hydrogels | |||
| 0.22 μm syringe filters | Millipore | SLGV004SL | |
| 0.5 mm thick silicone sheet | Electron Microscopy Science | 70338-05 | |
| 24-well tissue culture plates | Corning | 353047 | |
| Disposable Biopsy Punch (2 mm) | Integra Miltex | 33-31 | |
| Disposable Biopsy Punch (4 mm) | Integra Miltex | 33-34 | |
| Disposable Biopsy Punch (5 mm) | Integra Miltex | 33-35 | |
| Dulbecco’s phosphate buffered saline (DPBS) | Corning | 21-031-CM | |
| No. 1 12 mm glass coverslips | Thermo Fisher Scientific | 12-545-80 | |
| Tetrakis(hydroxymethyl)phosphonium chloride (THPC) | Sigma-Aldrich | 404861-100ML | |
| 0.5% Tryspin/EDTA | Thermo Fisher | 15400054 | |
| Immunocytochemistry of Cells in 3D ELP Hydrogels | |||
| 16% (w/v) Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15701 | |
| Bovine Serum Albumin (BSA) | Roche | 3116956001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Donkey Serum | Lampire Biological Labs | 7332100 | |
| Goat anti-mouse Secondary Antibody (AF488) | Molecular Probes | A-11017 | |
| Goat anti-rabbit Secondary Antibody (AF546) | Molecular Probes | A-11071 | |
| Goat Serum | Gibco | 16210-072 | |
| Mouse Nestin Primary Antibody | BD Pharmingen | 556309 | |
| Mouse Sox2 Primary Antibody | Cell Signaling Technology | 23064S | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Vectashield Hardset Mounting Medium | Vector Labs | H-1400 |
Références
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294 (5547), 1708-1712 (2001).
- Birgersdotter, A., Sandberg, R., Ernberg, I. Gene expression perturbation in vitro-A growing case for three-dimensional (3D) culture systems. Seminars in Cancer Biology. 15 (5), 405-412 (2005).
- Gómez-Lechón, M. J., et al. Long-term expression of differentiated functions in hepatocytes cultured in three-dimensional collagen matrix. Journal of Cellular Physiology. 177 (4), 553-562 (1998).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Justice, B. A., Badr, N. A., Felder, R. A. 3D cell culture opens new dimensions in cell-based assays. Drug Discovery Today. 14 (1-2), 102-107 (2009).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Madl, C. M., et al. Maintenance of neural progenitor cell stemness in 3D hydrogels requires matrix remodelling. Nature Materials. 16 (12), 1233-1242 (2017).
- Discher, D. E., Janmey, P., Wang, Y. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Sun, Y., Villa-Diaz, L. G., Lam, R. H. W., Chen, W., Krebsbach, P. H., Fu, J. Mechanics Regulates Fate Decisions of Human Embryonic Stem Cells. PLoS ONE. 7 (5), e37178(2012).
- Ehrbar, M., et al. Elucidating the Role of Matrix Stiffness in 3D Cell Migration and Remodeling. Biophysical Journal. 100 (2), 284-293 (2011).
- Rowlands, A. S., George, P. A., Cooper-White, J. J. Directing osteogenic and myogenic differentiation of MSCs: interplay of stiffness and adhesive ligand presentation. American Journal of Physiology - Cell Physiology. 295 (4), 1037-1044 (2008).
- Lampe, K. J., Antaris, A. L., Heilshorn, S. C. Design of three-dimensional engineered protein hydrogels for tailored control of neurite growth. Acta Biomaterialia. 9 (3), 5590-5599 (2013).
- Kilian, K. A., Mrksich, M. Directing Stem Cell Fate by Controlling the Affinity and Density of Ligand-Receptor Interactions at the Biomaterials Interface. Angewandte Chemie International Edition. 51 (20), 4891-4895 (2012).
- Tse, J. R., Engler, A. J. Preparation of Hydrogel Substrates with Tunable Mechanical Properties. Current Protocols in Cell Biology. , 10.16.1-10.16.16 (2010).
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: A complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- DiMarco, R. L., Heilshorn, S. C. Multifunctional Materials through Modular Protein Engineering. Advanced Materials. 24 (29), 3923-3940 (2012).
- Meyer, D. E., Chilkoti, A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nature Biotechnology. 17 (11), 1112-1115 (1999).
- Aladini, F., Araman, C., Becker, C. F. W. Chemical synthesis and characterization of elastin-like polypeptides (ELPs) with variable guest residues. Journal of Peptide Science. 22 (5), 334-342 (2016).
- McMillan, R. A., Caran, K. L., Apkarian, R. P., Conticello, V. P. High-Resolution Topographic Imaging of Environmentally Responsive, Elastin-Mimetic Hydrogels. Macromolecules. 32 (26), 9067-9070 (1999).
- McMillan, R. A., Conticello, V. P. Synthesis and Characterization of Elastin-Mimetic Protein Gels Derived from a Well-Defined Polypeptide Precursor. Macromolecules. 33 (13), 4809-4821 (2000).
- Chung, C., Lampe, K. J., Heilshorn, S. C. Tetrakis(hydroxymethyl) Phosphonium Chloride as a Covalent Cross-Linking Agent for Cell Encapsulation within Protein-Based Hydrogels. Biomacromolecules. 13 (12), 3912-3916 (2012).
- Romano, N. H., Madl, C. M., Heilshorn, S. C. Matrix RGD ligand density and L1CAM-mediated Schwann cell interactions synergistically enhance neurite outgrowth. Acta Biomaterialia. 11, 48-57 (2015).
- Shah, M., Hsueh, P. Y., Sun, G., Chang, H. Y., Janib, S. M., MacKay, J. A. Biodegradation of elastin-like polypeptide nanoparticles. Protein Science. 21 (6), 743-750 (2012).
- Nettles, D. L., Chilkoti, A., Setton, L. A. Applications of elastin-like polypeptides in tissue engineering. Advanced Drug Delivery Reviews. 62 (15), 1479-1485 (2010).
- Madl, C. M., Heilshorn, S. C. Tyrosine-Selective Functionalization for Bio-Orthogonal Cross-Linking of Engineered Protein Hydrogels. Bioconjugate Chemistry. 28 (3), 724-730 (2017).
- Zhu, D., Wang, H., Trinh, P., Heilshorn, S. C., Yang, F. Elastin-like protein-hyaluronic acid (ELP-HA) hydrogels with decoupled mechanical and biochemical cues for cartilage regeneration. Biomaterials. , 132-140 (2017).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Bio-Orthogonally Crosslinked, Engineered Protein Hydrogels with Tunable Mechanics and Biochemistry for Cell Encapsulation. Advanced Functional Materials. 26 (21), 3612-3620 (2016).
- Cai, L., Dinh, C. B., Heilshorn, S. C. One-pot synthesis of elastin-like polypeptide hydrogels with grafted VEGF-mimetic peptides. Biomater Sci. 2 (5), 757-765 (2014).
- Straley, K. S., Heilshorn, S. C. Independent tuning of multiple biomaterial properties using protein engineering. Soft Matter. 5 (1), 114-124 (2009).
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current Opinion in Biotechnology. 10 (5), 411-421 (1999).
- Graumann, K., Premstaller, A. Manufacturing of recombinant therapeutic proteins in microbial systems. Biotechnology Journal. 1 (2), 164-186 (2006).
- Tashiro, K., et al. A Synthetic Peptide Containing the IKVAV Sequence from the A Chain of Laminin Mediates Cell Attachment, Migration, and Neurite Outgrowth. Journal of Biological Chemistry. 264 (27), 16174-16182 (1989).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon