Method Article
Producción de la proteína elastina como hidrogeles para encapsulación y el Immunostaining de células en 3D
En este artículo
Resumen
Hidrogeles de ingeniería de la proteína recombinantes son ventajosos para el cultivo celular 3D ya que permiten completa afinabilidad de la espina dorsal del polímero y por lo tanto, el microambiente de la célula. Aquí, describimos el proceso de purificación de proteína recombinante como elastina y su aplicación en la encapsulación de la célula de hidrogel 3D.
Resumen
Técnicas bidimensionales (2D) cultivo de tejidos han sido esenciales para nuestra comprensión de la biología de la célula fundamental. Sin embargo, la falta de sistemas de cultura de tejido tradicional 2D una matriz (3D) tridimensional, dando como resultado una importante desconexión entre resultados obtenida in vitro e in vivo. Para solucionar esta limitación, los investigadores han diseñado plataformas de cultivo de tejidos de hidrogel 3D que pueden imitar las propiedades bioquímicas y biofísicas del microambiente de la célula en vivo . Esta investigación ha motivado la necesidad de desarrollar plataformas de material que soportan encapsulación celular 3D y posteriores ensayos bioquímicos. Ingeniería de proteínas recombinantes ofrece un único conjunto de herramientas para desarrollo y diseño de material de hidrogel 3D por lo que permite el control específico de la secuencia de la proteína y por lo tanto, por extensión, las propiedades mecánicas y bioquímicas potenciales de la resultante matriz. Aquí, presentamos un protocolo para la expresión de derivados por vía recombinante como elastina proteína (ELP), que puede utilizarse para forma hidrogeles con propiedades mecánicas independientemente ajustables y la concentración de ligando adhesivo celular. Además presentamos una metodología para la encapsulación de la célula en hidrogeles ELP y posterior tinción inmunofluorescente de encajado las células para posteriores análisis y cuantificación.
Introducción
Durante el siglo pasado, cultivo de tejidos de dos dimensiones (2D) se ha convertido en un conjunto de herramientas integral para el estudio de biología fundamental de la célula en vitro. Además, los protocolos relativamente barato y simple para el cultivo celular 2D han conducido a su adopción a través de muchas disciplinas biológicas y médicas. Sin embargo, más allá de la investigación ha demostrado que las plataformas 2D tradicionales pueden conducir a resultados que se desvían marcadamente de los recogidos en vivo, causando tiempo precioso y financiación en vano para la investigación clínico1,2, 3. Nosotros y otros presumen que esta discrepancia puede ser atribuida a la falta de nativos señales bioquímicas y biofísicas a las células cultivadas en las superficies de la 2D, que pueden ser necesarias para la óptima proliferación y maduración de diversos tipos celulares.
Para hacer frente a estas limitaciones y ayuda el puente de la brecha entre 2D estudios in vitro e in vivo , los investigadores tienen plataformas de hidrogel (3D) tridimensional desarrollado para la encapsulación de la célula1,4,5 ,6. Los hidrogeles son materiales ideales para recapitular el microambiente endógeno de la matriz extracelular (ECM) en vivo debido a sus propiedades mecánicas como de tejido y estructura hinchada de agua que permite el rápido transporte de nutrientes y señalización de factores de7,8. Además, 3D hidrogeles pueden diseñarse para tener control independiente sobre las propiedades mecánicas y bioquímicas del andamio. Matriz mecánica9,10,11,12 y ligandos de células adhesivas13,14,15 son bien sabido para influir en la célula comportamiento en vitro y en vivo. Así, los hidrogeles 3D con propiedades ajustables ofrecen una plataforma para estudiar las relaciones de causalidad entre las células y su microambiente. Criterios para una matriz hidrogel 3D ideal incluyen encapsulación de células simple, no citotóxica como independiente afinabilidad de fisiológicamente relevantes propiedades mecánicas e imitadores de motivos adhesivo celular nativos.
Tanto sintético (e.g., polietilenglicol, ácido poliláctico, poli (ácido glicólico)) y origen natural (por ej., alginato, colágeno, Matrigel) hidrogeles tienen ventajas sobre las plataformas de cultura 2D en vitro ; sin embargo, también tienen importantes deficiencias que limitan su aplicabilidad. Primero, muchas plataformas sintéticas y de origen natural requieren condiciones de reticulación áspero que pueden ser potencialmente tóxicas para las células mamíferas, conduce a disminución de la viabilidad de la célula7. Además, muchas plataformas sintéticas carecen de actividad biológica nativa y deban ser funcionalizados mediante reacciones químicas secundarias, que pueden agregar mayor complejidad y costo16. Finalmente, mientras que los materiales de origen natural contienen típicamente intrínsecos dominios bio-activo, a menudo se ven afectadas por la alta variabilidad de lote a lote y a menudo se limitan a formar geles relativamente débil7,17.
Ingeniería de proteínas recombinantes presenta un conjunto único de herramientas para el diseño de materiales por lo que permite el control explícito de secuencia de la proteína y, por extensión, las propiedades mecánicas y bioquímicas potenciales de hidrogel final andamio18. Además, aprovechando la maquinaria biológica conocida de Escherichia coli (e. coli) para expresar proteínas materiales pueden producir rentable y consistente con variabilidad limitada inter y intra-lote. La proteína elastina-como (ELP) presentada aquí tiene tres dominios modificados: (1) una etiqueta T7 y His6 que permite mediante fluorescencia de etiquetado etiquetado anticuerpos, (2) una región de 'elastina-como' que le confiere propiedades mecánicas elásticas y permite para química reticulación y (3) una región de 'bio-activo' que codifica para celular-adhesivo motivos.
Nuestra región de elastina-como se basa en la canónica (Val-Pro-Gly-Xaa-Gly) secuencia de elastina5 donde cuatro de lo Xaa sitios del aminoácido isoleucina (Ile), pero podrían ser diseñado para ser cualquier aminoácido, excepto prolina. Esta secuencia dota ELPs recombinantes con bajo comportamiento de temperatura (LCST) de solución crítica que pueden ser aprovechados para la expresión posterior purificación simple vía termal ciclismo19,20. Esta propiedad LCST puede ajustarse al agregado térmicamente a diferentes temperaturas modificando el huésped 'Xaa' residuo21,22.
Aquí, la posición de 'Xaa' en una de las cinco repeticiones de elastina-como ha sido reemplazada con el presentación de Amina lisina (Lys) aminoácido, que se utiliza para la reticulación de hidrogel. Nuestro trabajo previo ha demostrado no citotóxico y robusto reticulación vía la reacción con los reactivos amina crosslinker tetrakis (hidroximetil) fosfonio cloruro (THPC)23. Variables proteína contenido y crosslinker concentración total, somos capaces de producir hidrogeles que pueden ajustarse para abarcar un rigidez fisiológicamente relevante gama (~0.5-50 kPa)9,23,24. Además de afinar características mecánicas, adhesión celular dentro del hidrogel resulta de la integración de dominios de células adhesivas canónicos dentro de la columna vertebral de la proteína de la ELP. Por ejemplo, la incorporación de la secuencia de aminoácidos derivados de fibronectina extendida 'RGDS' permite la adhesión celular y flexibilidad conformacional, mientras los revueltos, variante de 'RDGS' no vinculante restringe de adhesión célula-matriz24. Modulando la relación de la célula-adhesivo para proteínas no-adhesiva, así como la concentración de proteína total, somos capaces de producir efectivamente hidrogeles que abarcan una amplia gama de la concentración de ligando. Consecuencia, hemos desarrollado una plataforma de hidrogel con propiedades bioquímicas y biofísicas desconectadas, que pueden ajustarse independientemente para una óptima cultura 3D de diversos tipos celulares.
Además de rigidez de la matriz y afinabilidad ligando adhesivo, hidrogeles recombinantes ofrecen la capacidad de diseño perfiles de degradación del material específico, que es necesaria para separarse de la célula, la proliferación y la migración dentro de un contexto 3D4 , 9. esta degradación es ofrecida por secreción celular de las proteasas que dirigidas específicamente prolongado 'RGDS'9 o elastina-como secuencia25. Hidrogeles ELP también han demostrado para los posteriores ensayos bioquímicos que son necesarios para el estudio de viabilidad celular y la función incluyendo immunocytochemistry, así como la extracción de ADN/ARN/proteína para reversa cuantitativa reacción en cadena de la transcripción-polimerasa (qRT-PCR) y Western blot9. ELP variantes también se han utilizado en un número de modelos en vivo y son conocidas por ser bien tolerado por el sistema inmune26.
Tomados en conjunto, ELP como una plataforma material para estudios de encapsulación celular cuenta con una amplia variedad de ventajas en comparación con plataformas de material sintético o de origen natural, que carecen a menudo el mismo grado de afinabilidad bioquímica y Biofísica y reproducibilidad. Además, no citotóxico un de ELP uso sencillo y con una gran variedad de tipos celulares (por ej., chick raíz dorsal ganglia14,24, progenitoras neurales murinos células9,27, bovina de las células troncales mesenquimales humanas condrocitos neonatal28, human endothelial células29,30) permite que un modelo más fisiológicamente relevante del endógeno ECM 3D en comparación con el cultivo celular 2D. Adjunto, presentamos un protocolo para la expresión de derivados por vía recombinante, TEKS para el uso como plataforma de hidrogel regulables para 3D encapsulación de la célula. Además presentamos la metodología para el down-stream fluorescente etiquetado y microscopia confocal de células encapsuladas.
Protocolo
1. ELP expresión protocolo
- Día 1: Crecimiento de la colonia de arranque
- Preparar placas de agar ampicilina y cloranfenicol en autoclave 25 g de Luria caldo y 15 g de agar por 1 L de agua ultrapura. Una vez que la solución se ha enfriado a ~ 60 ° C, añadir 1 mL de caldo de ampicilina (100 mg/mL en agua ultrapura) y 1 mL de stock de cloranfenicol (34 mg/mL en etanol al 70%) a 1 L de solución de concentración final de 100 μg/mL y 34 μg/mL de agar , respectivamente. Transferir 20 mL de solución final a cajas Petri de 10 cm con una pipeta serológica y permitir que el agar solidifique. Envolver las cajas Petri con parafilm y almacenar a 4 ° C.
Nota: placas de Petri pueden almacenarse a 4 ° C hasta por dos semanas. - Raya una pequeña muestra de BL21 (DE3) pLysS e. coli de una población bacteriana pre-hechos que contiene un vector de pET15b codificación del ELP de interés sobre una placa de agar ampicilina y cloranfenicol.
Nota: La ampicilina y cloranfenicol seleccionan las bacterias que contiene la pET15b y pLysS vectores, respectivamente. - Coloque la placa veteada boca abajo en una incubadora a 37 ° C. Permitir que las colonias bacterianas que crecen durante la noche.
Nota: No incubar las placas durante más de 16 h como ampicilina se degrada y pueden formar las colonias que no tienen resistencia a la ampicilina.
- Preparar placas de agar ampicilina y cloranfenicol en autoclave 25 g de Luria caldo y 15 g de agar por 1 L de agua ultrapura. Una vez que la solución se ha enfriado a ~ 60 ° C, añadir 1 mL de caldo de ampicilina (100 mg/mL en agua ultrapura) y 1 mL de stock de cloranfenicol (34 mg/mL en etanol al 70%) a 1 L de solución de concentración final de 100 μg/mL y 34 μg/mL de agar , respectivamente. Transferir 20 mL de solución final a cajas Petri de 10 cm con una pipeta serológica y permitir que el agar solidifique. Envolver las cajas Petri con parafilm y almacenar a 4 ° C.
- Día 2: Preparación de los medios de expresión y cultura de arrancador
- Eliminar la cultura de e. coli de la incubadora. Parafilm la placa y almacenar por un máximo de 4 días a 4 ° C.
- Preparar un frasco de cultura de arrancador (250 mL) y frascos de cultivo de la expresión (12 x 1 L) y autoclave. Para 1 L de medio de expresión, agrega 47,6 g de caldo buenísimo y 4 mL de glicerol a 1 L de agua ultrapura en un matraz de 2 L cultura desconcertado y la tapa con papel de aluminio.
Nota: Rendimientos típicos son proteína de 60-100 mg/L de medio de expresión. - Cargar el motor de arranque tratado en autoclave en precalentado, incubador de agitación de 37 ° C e incubar sin agitación.
- Añadir 250 μl del filtrado estéril stock de ampicilina (0.22 μm filtro) (100 mg/mL en agua ultrapura) a la cultura de arrancador para una concentración final de 100 μg/mL. Inmediatamente comience a agitar la cultura de arrancador en 250 rpm.
Nota: El cloranfenicol es utilizado para la selección de colonias en placas de agar y no está incluido para los cultivos de líquido. - Inocular el cultivo de arranque añadiendo una sola PEL plásmido que contiene e. coli Colonia de la placa veteada y permita que la cultura de arrancador sacudir a 37 ° C por 16 h.
- Coloque el expresión medios de cultivo frascos en pre-calentados a 37 º C agitando incubadoras e incubar durante una noche sin de la agitación para que los frascos estén listos para inocular a la mañana siguiente.
- Día 3: Inducir la expresión de proteínas en e. coli
- Hacer el caldo fresco, filtrado estéril ampicilina (100 mg/mL en agua ultrapura). Añadir 1 mL de caldo de ampicilina a cada frasco de medio de expresión para una concentración final de 100 μg/mL.
- Comience a agitar los medios de expresión a 250 rpm.
- Toma una muestra de 2 mL de los medios de comunicación de cualquier frasco de expresión y añadir a una cubeta como blanco para una densidad óptica de la lectura a 600 nm (OD600).
- Después de la terminación de 16 h arranque cultura de incubación, inocular cada frasco de expresión mediante la transferencia de 20 mL de la cultura de arrancador en cada matraz de expresión a través de una pipeta serológica.
- Después de la terminación de agitación de 1 h, mida OD600 de uno de los frascos de expresión. Tras este paso, mida el OD600 cada 20 min., comprobar un frasco diferente cada vez.
- A un OD600 de 0,6, reducir la temperatura de la coctelera que contienen los frascos de expresión a 32 ° C.
- Compruebe el OD600 cada 10 minutos. A un OD600 de 0,8, inducen la expresión añadiendo 1 mL de 1 M, filtrado estéril β-isopropyl thiogalactoside (IPTG) en agua ultrapura a cada matraz de la expresión.
- Permita que la e. coli en frascos de expresión expresar h 7.
- 20 min antes del final de la expresión, pre-enfriar una centrífuga de piso grande a 4 ° C.
- Recoger los 12 L de medios de expresión en equilibrio y envases individuales de la centrifugadora.
- Centrifugue los medios de expresión en > 12.000 x g durante 15 min a 4 ° C utilizando una centrífuga de piso.
- Retirar el sobrenadante de cada recipiente de la centrífuga. Con una espátula, recoger los pellets de células en una bolsa zip previamente pesado.
- Volver a suspender el sedimento en buffer 10 filtrado estéril (100 mL de buffer por cada 25 g de pellets) y eliminar las posibles burbujas de aire exceso por masaje de la pelotilla. Para 1 L de tampón de diez, agregue 5,8 g de cloruro de sodio, 1,21 g de tris base y 0,37 g de etilendiamina tetraacético ácido (EDTA) sal disódica, dihidrato en 900 mL de agua ultrapura. Ajustar el pH a 8.0 y llevar a 1 L. Para este paso, las tiras de pH son suficientes.
- Coloque la bolsa zip-lock que contiene el precipitado de células suspende de nuevo en un contenedor secundario y congelar a-80 ° C durante la noche.
- Día 4-6: ruptura de la pared celular bacteriana a través de ciclos de congelación-descongelación
- Eliminar el sedimento congelado del congelador y deje que se descongele lentamente a 4 ° C con agitación suave con un agitador orbital.
- Permitir que el sedimento se descongele hasta que algún líquido está presente. Añadir ~ 30-40 mg de desoxirribonucleasa I (DNasa) de descongelado lisado. Además, agregar 1 mL de fluoruro de fenilmetilsulfonilo 100 mM (PMSF, un inhibidor de proteasa) de isopropanol por 100 mL de lisado de célula. Permita que el lisado a temblar durante la noche.
Nota: Agregar ADNasa y PMSF es sólo necesario para el primer ciclo de congelación y descongelación.
PRECAUCIÓN: PMSF es tóxico si se inhala. Debe utilizarse una mascarilla al manipular polvo PMSF. - Una vez que el lisado celular está completamente descongelada, congelar lisado a-80 ° C durante la noche, o hasta que esté completamente congelado.
- Repita el procedimiento de congelación y descongelación para un total de tres ciclos. Deje el lisado descongeladas a 4 ° C después de la última una congelación y descongelación. Almacenar 100 μl de raw lisado para análisis sodio dodecil sulfato-poliacrilamida gel electroforesis (SDS-PAGE) la conclusión de la purificación.
- Después del último deshielo, ajustar el pH de la descongelado lisado a 9.0 utilizando 1 M NaOH. Para este paso, las tiras de pH son suficientes. Incubar a 4 ° C durante al menos 1 h (la noche es apropiado) en un agitador orbital.
- Día 7-9: purificación de ELP mediante ciclos térmicos fría y caliente de la vuelta
- Enfriar la centrífuga de piso a 4 º C 20 min antes de centrifugar.
- Alícuota y el equilibrio la descongelado lisado en contenedores de centrífuga.
- Centrifugar las muestras a > 15.000 x g durante 1 h a 4 ° C. Almacenar 100 μl del sobrenadante para el análisis de SDS-PAGE después de la terminación de la purificación.
Nota: Después de centrifugar, la proteína ELP debe permanecer en el sobrenadante debido a su alta solubilidad en agua a temperaturas por debajo de su LCST (< 32 ° C). - Transferir el sobrenadante a recipientes nuevos de la centrifugadora y equilibrar adecuadamente.
- Añadir cloruro de sodio (NaCl) en tres partes a una concentración final de 1 M (5,84 g de NaCl por cada 100 mL del sobrenadante). Asegúrese de que el NaCl se añade en tres partes para permitir la disolución suficiente.
- Agitar durante 3 h a 37 ° C en un incubador de agitación de 250 rpm.
- 1 h antes del final de la agitación, precaliente una centrífuga de piso a 37 ° C.
- Centrifugue a > 15.000 x g durante 1 h a 37 ° C. Almacenar 100 μl del sobrenadante para el análisis de SDS-PAGE después de la terminación de depuración y descarte el sobrenadante restante.
Nota: Después de centrifugar, la proteína ELP debe ser peleteada debido a su baja solubilidad en agua a temperaturas por encima de su LCST (> 32 ° C). - Resuspenda el precipitado agregando 10 mL de agua ultrapura, autoclave por 1 g de pellets. Use una espátula de metal para hacer puré de la pelotilla para ayudar en la disolución de la proteína.
- Ajustar el pH de la descongelado lisado a 9.0 utilizando 1 M NaOH. Para este paso, las tiras de pH son suficientes.
- Agitar durante la noche a 4 ° C en un agitador orbital.
- Repita el procedimiento de ciclismo térmico exprimido fría y caliente para un total de tres ciclos (es decir., repita los pasos 1.5.1 a través 1.5.11 durante tres ciclos total).
- Día 10-15: ELP diálisis y liofilización
- Centrifugue el sedimento resuspendido en una centrífuga refrigerada previamente en > 15.000 x g durante 1 h a 4 ° C. Almacenar 100 μl del sobrenadante para el análisis de SDS-PAGE después de la terminación de la purificación.
- La solución de la proteína del desalt de diálisis el sobrenadante restante en una membrana de diálisis de 3.5 kDa contra 4 L de agua ultrapura previamente enfriada a 4 ° C. Cambie el agua de diálisis dos veces al día para un total de 6 veces en 3 días.
Nota: Los volúmenes sobrenadante típicos están entre 5 y 30 mL. - Centrifugue la solución de dializado en una centrífuga previamente enfriada en > 15.000 x g durante 1 h a 4 ° C. Almacenar 100 μl del sobrenadante para el análisis de SDS-PAGE al final de la purificación.
- Congelar el resultado sobrenadante a-80 ° C en tubos cónicos previamente pesados.
- Liofilizar la solución congelada durante 3 días y la masa del producto final para determinar el rendimiento de proteína.
- Parafilm los tubos que contienen el final liofilizado producto ELP y almacenar a 4 ° C.
- Correr de SDS-PAGE para determinar la pureza de la proteína.
Nota: Protocolos para SDS-PAGE variará según las condiciones de gel de agarosa específica. Para nuestros experimentos, proteína liofilizada final fue disuelta a una concentración de 0,5 mg/mL en agua desionizada y correr a 140 V 70-100 min en un gel de acrilamida de 12% (w/v) bajo condiciones de desnaturalización.
2. encapsulación en hidrogeles 3D elastina-como la proteína de la célula
- Preparación de moldes de silicona
- Use un punzón de biopsia con el diámetro deseado para crear agujeros en una hoja de silicona espesor 0,5 mm y recortar un cuadrado alrededor de cada agujero. Repita para el número de moldes que desea.
Nota: El diámetro y el grosor de los moldes pueden ajustarse para la aplicación particular y las condiciones de cultivo celular. En la práctica, para cultivos celulares de 50 106 células/mL, moldes espesor 0,5 mm con 4 mm y 5 mm de diámetro se recomienda suficiente ADN/ARN y extracción de proteínas, respectivamente. Para immunostaining, un punch de biopsia de 2 mm puede utilizarse para crear en su lugar tres agujeros adyacentes molde cuadrado para que tres repeticiones pueden ser manchados por pozo. - Retire el envoltorio plástico a cada lado del molde individual con las pinzas.
Nota: Evite el contacto con la superficie expuesta de la silicona como contaminación puede disminuir el plasma futura eficacia de la vinculación. - Utilizando pinzas, coloque el mismo número de moldes de silicona desnudo y cubreobjetos de vidrio (no. 1, 12 mm de diámetro) alternando filas sobre la tapa invertida de una placa de 48 pozos. Una vez completado, cubre la tapa de la placa de 48 pozos para evitar la contaminación.
- Plasma de oxígeno tratar la tapa toda placa de 48 pocillos (es decir., moldes y laminas de vidrio). Inmediatamente después, utilice pinzas para invertir el molde de silicona sobre el cubreobjetos de vidrio adyacente. Presione firmemente el molde para la vinculación. Dejar los moldes incubar a temperatura ambiente durante 1 h.
Nota: La duración del tratamiento plasma de oxígeno varía dependiendo del instrumento utilizado. Condiciones típicas para nuestro instrumento son una ventana a presión gas funcionamiento entre 0.3-4 mbar, flujo de gas oxígeno a 20 cm3/min. y la exposición de la muestra al plasma de 10-20 s. - Esterilice en autoclave los los moldes. Guarde los moldes a temperatura ambiente en un ambiente estéril hasta su utilización.
Nota: Los moldes pueden almacenarse en esta fase por tiempo indefinido.
- Use un punzón de biopsia con el diámetro deseado para crear agujeros en una hoja de silicona espesor 0,5 mm y recortar un cuadrado alrededor de cada agujero. Repita para el número de moldes que desea.
- Preparación de solución madre de elastina-como la proteína
- Quitar ELP liofilizado de almacenamiento de 4 ° C. Caliente la proteína a temperatura ambiente antes de abrir el tubo para asegurarse de que no condensación se basa en la proteína por uso repetido.
- Disolver ELP en tamponada con fosfato solución salina de Dulbecco (DPBS) a 4 ° C con agitación constante (es decir., spinning) durante la noche.
Nota: Concentración de la solución stock de ELP a diluirse con la adición de solución crosslinker en una proporción volumétrica de definido por el usuario. Por ejemplo, para una concentración de ELP final 3% (p/v), preparar una solución stock de ELP 3,75% (w/v) que se diluirá en una relación volumétrica 4:1 de solución de solución: crosslinker ELP. Ajustar la concentración necesaria para la aplicación deseada. - Filtro estéril solución ELP usando un filtro de jeringa de 0,22 μm. Tienda de ELP en el hielo cuando no esté en uso.
- En el gabinete de bioseguridad, transferir los moldes estériles con pinzas estériles sobre una placa de 24 pocillos de cultivo de tejidos.
- Preparación de solución madre THPC
- Diluir THPC en DPBS justo antes de usar. Ajustar la concentración de solución THPC según la concentración final de ELP y el cociente de reticulación deseada.
Nota: Para el protocolo, una concentración final de ELP del 3% (w/v) se realizará mediante la mezcla de la solución madre de ELP con la solución THPC en una relación volumétrica 4:1. Ajuste según sea necesario. - Añadir 2,6 μl de solución de THPC (80% en agua) a 997.4 μL de DPBS.
Nota: Esta concentración de THPC corresponde a una relación estequiométrica 1:1 de grupos hidroxi metil THPC y aminas primarias de la proteína ELP cuando se mezclan soluciones en la descrita relación volumétrica 4:1 para un hidrogel final de ELP 3% (p/v). La solución THPC es viscosa y gotas de solución pueden pegarse al lado de la punta de la pipeta. Para concentraciones precisas, evite tales gotitas al diluir en DPBS. Purgar el recipiente stock THPC con gas nitrógeno para evitar oxidación de la fosfina y la inactivación de la crosslinker. - Vórtice de la solución para mezclar y mantener en hielo.
- Filtro estéril la THPC stock solución usando un filtro de jeringa de 0,22 μm. Diluir la solución stock de THPC más con DPBS estéril para lograr relaciones estequiométricas reticulación más bajas (por ej., 0.5:1 o 0.75:1).
Nota: THPC es sensible al oxígeno, y la solución diluida debe utilizarse en unas pocas horas después de la preparación.
- Diluir THPC en DPBS justo antes de usar. Ajustar la concentración de solución THPC según la concentración final de ELP y el cociente de reticulación deseada.
- Disociar las células por la incubación con tripsina-EDTA en una suspensión unicelular de la pelotilla de las células y contar las células resuspendidas en medio usando un hemocitómetro.
Nota: Los protocolos exactos para este paso dependerá en gran medida tipo celular deseado y aplicación. Para las células progenitoras neurales a través de este protocolo, se realizó una incubación de tripsina-EDTA 0.025% a temperatura ambiente durante 1,5 minutos. Las células fueron peleteadas a 200 x g durante 2 minutos. Para la viabilidad creciente de la célula, las células deben suspenderse en condiciones normales del medio. Densidades de célula típica utilizadas para rango de encapsulado de celdas de 1-50 106 células/mL del volumen final del hidrogel. Ajuste según sea necesario. - El número de células en un tubo de centrífuga estériles de 1.5 mL de alícuota.
- Centrifugar las células a ~ 200 x g durante 3 min con cuidado, aspirar el sobrenadante y mantener el pellet celular en hielo.
Nota: Es fundamental para aspirar completamente el sobrenadante para mitigar la dilución adicional de la ELP y THPC crosslinker. Velocidades de centrifugación específico dependerá del tipo de la célula. - Resuspenda el precipitado de células en la solución madre de ELP que el volumen es el 80% del volumen final (suponiendo una relación de 4:1 de solución de solución: THPC ELP). Pipeta de mezcla 20 - 25 veces para producir una mezcla homogénea de las células y ELP.
Nota: Evite agarre la parte inferior del tubo para mitigar el aumento de la temperatura y la transición de la fase posterior de ELP. Cada molde 2 mm con tres repeticiones requiere 7.5 μl de volumen final (es decir., 6 μl de solución stock de ELP y 1,5 μl de solución stock de THPC) dividido igualmente en los 3 agujeros (es decir., 2,5 volumen final μl por agujero). Para los moldes de 4 y 5 mm, un volumen final de 7.5 μl y 15.5 μl se requiere, respectivamente. - Añadir solución THPC a la suspensión de la célula/ELP para el volumen final de 20% restante. Pipeta de mezcla 20 - 25 veces para producir una mezcla homogénea.
- Pipetear inmediatamente los correspondientes volúmenes finales de ELP/celular/THPC mezcla en cada molde con un movimiento circular. Repita para todos los moldes.
- Incubar las muestras a temperatura ambiente durante 15 min, seguido de una incubación adicional a 37 ° C durante 15 minutos.
Nota: El primer período de incubación ayudará a facilitar reticulación inicial del hidrogel antes de aumentar la temperatura a la por encima LCST de la ELP e induciendo su segregación de fase térmico. - Lentamente añadir 750 μl de medio de cultivo celular caliente a cada pocillo de la placa de 24 pocillos, evitando interrumpir los geles.
- Incubar los hidrogeles a 37 ° C durante 7 días.
Nota: Todo medio de cambios se recomiendan cada 1-2 días dependiendo del tipo de la célula. Para limitar la tensión en el gel, use un vidrio pipeta Pasteur fijada con una punta de pipeta de 200 μL al medio del pozo de aspiración.
3. inmunocitoquímica de células en 3D ELP hidrogeles
- Preparar la solución de fijación mezclando paraformaldehido de 16% (p/v) de 10 mL (PFA) en 30 ml de DPBS. Calentar la solución a 37 ° C.
- Aspirar el medio de la placa de 24 pocillos y lavar suavemente con 1 mL de DPBS.
- Adicionar 750 μl de la solución de fijación a cada pocillo e incubar a 37 ° C durante 30 minutos. No use la incubadora de cultivo de tejidos para evitar la contaminación de otras culturas con el vapor de la PFA.
- Aspirar cuidadosamente la solución de fijación de cada bien, descartando la PFA a un contenedor de residuos peligrosos correspondiente.
PRECAUCIÓN: Exposición a PFA puede causar irritación de la piel y los ojos. Gafas de seguridad guantes y trabajar en una campana de humos químicos. - Añadir 1 mL de DPBS a cada muestra. Inmediatamente aspirar la DPBS y deseche en recipiente de PFA.
- Lavar las muestras dos veces con 1 mL de DPBS durante 10 minutos.
Nota: Las muestras pueden almacenarse en DPBS a 4 ° C por hasta una semana después de sellar la placa con Parafilm. - Permeabilizar cada muestra con 750 μl de solución de permeabilización (100 mL de DPBS y 0,25 mL de Triton X-100; SAFT) por 1 h a temperatura ambiente en un eje de balancín a 15 rpm.
- Aspire el Saft y añadir 750 μl de solución (95 mL de PBS, 5 g de albúmina de suero bovino (BSA), 5 mL de suero y 0,5 mL de Triton X-100) de bloqueo para cada muestra. Incubar a temperatura ambiente durante 3 h en un eje de balancín a 15 rpm.
Nota: La solución de bloqueo debe contener suero de la especie en la que se plantearon los anticuerpos secundarios (por ej., cabra, burro) y estéril filtrada a través de un 0.22 μm filtro antes de usar. - Preparar la solución de dilución del anticuerpo (97 mL de DPBS, 2,5 g de BSA, 2,5 mL de suero (de la misma especie como en el paso 3.8) y 0,5 mL de Triton X-100). Diluir el anticuerpo primario usando la solución de dilución del anticuerpo y agregar 500 μl de la solución a cada muestra. Selle la placa con Parafilm e incubar durante una noche a 4 ° C en un eje de balancín.
Nota: Nestin y Sox2 anticuerpos primarios fueron diluidas 1: 400 en la solución de dilución del anticuerpo de la concentración original de los fabricantes. - Aspire la solución de anticuerpo de cada muestra y lavar las muestras con SAFT durante 60 min a temperatura ambiente en un eje de balancín a 15 rpm. Repetir el lavado 3 veces.
- Diluir la acción secundaria de anticuerpos y 5 mg/mL DAPI (1:2, 000) con la solución de dilución del anticuerpo y agregar 500 μl de la solución a cada muestra. Cubra la placa de 24 pocillos con papel de aluminio e incubar durante una noche a 4 ° C en un eje de balancín.
Nota: Como los anticuerpos secundarios son sensibles a la luz, las muestras deben protegerse de fotoblanqueo para todos los pasos posteriores. Cabra anti-ratón y cabra anti-conejo secundaria los anticuerpos fueron diluidas 1: 500 en la solución de dilución del anticuerpo de la concentración original de los fabricantes. - Aspire la solución de anticuerpo de cada muestra y lavar las muestras con SAFT durante 30 min a temperatura ambiente en el eje de balancín. Repetir el lavado 3 veces.
- Coloque una gota de medio de montaje observó sobre la superficie de un portaobjetos de vidrio. Con unas pinzas, quitar exceso de solución del molde frotando ligeramente el borde del molde sobre una toalla de papel. Cuidadosamente coloque el molde boca abajo sobre el medio de montaje y evitar la introducción de burbujas.
- Permitir que el medio de montaje endurecer durante 48 h a temperatura ambiente. Almacenar las muestras a temperatura ambiente o 4 ° C. Permitir que el medio de montaje fijar completamente durante 48 h antes de la proyección de imagen como índice de refracción del medio va a cambiar en el curso de endurecimiento. Sellar las muestras a la diapositiva de cubierta de vidrio con esmalte claro para mitigar contaminación o muestra movimiento.
- Imagen de las muestras con un microscopio confocal.
Resultados
El ELPs utilizados en este protocolo se componen de cinco regiones: una etiqueta de T7, etiqueta His6, sitio de la hendidura del enterokinase (EK), una región de bio-activos y una región de elastina-como (figura 1). Las etiquetas T7 y His6 permiten la fácil identificación mediante técnicas de Western blot estándar. Introducción del sitio de clivaje EK permite la eliminación enzimática de la región de la etiqueta, si es necesario. La región de bio-activos codifica para el extendido, derivado de fibronectina celular-adhesivo ('RGDS') o las secuencias no-adhesiva ('RDGS'). Por último, la repetición de la central de la región como elastina contiene un grupo de lisina en el sitio de residuo de huésped que permite la reticulación via THPC mientras que las repeticiones que flanquean contienen isoleucina para lograr un LCST de ~ 32 ° C31.
Expresión de post, SDS-PAGE y Western blot puede utilizarse para visualizar el peso molecular y confirmar la identidad del ELPs que contienen etiquetas de anticuerpos, como T7 (MASMTGGQQMG) o His6 (HHHHHH) (figura 2). Expresión acertada bajo condiciones controladas rinde un producto muy homogéneo representado por la presencia de una sola banda oscura en el peso molecular aproximado (~ 37 kDa) de estas proteínas usando ambos SDS-PAGE (figura 2A) y Western blot) Figura 2B).
En condiciones incontroladas, la presencia de bandas de peso molecular más bajos en un Western blot sugiere que una fracción de las proteínas no fue completamente traducido o fueron degradados después de la expresión (figura 2). Específicamente, las masas aquí están espaciadas uniformemente por ~ 9 kDa, que se corresponde aproximadamente con el peso de una región de bio-activos y tres regiones de elastina-como (una repetición), o aproximadamente una cuarta parte de la proteína diana. Estos pequeños fragmentos de proteínas están generalmente presentes cuando la expresión se realiza a una temperatura más alta (> 32 ° C) como en la figura 2. La presencia de estas proteínas de peso molecular más bajas puede llevar a propiedades mecánicas impredecibles. Así, se recomienda screening regular expresión post para garantizar un producto final de alta calidad.
La rigidez mecánica de Hidrogeles basados en ELP puede modificarse mediante la manipulación de la concentración de ELP o la relación de aminas primarias de THPC grupos reactivos: ELP. Al mismo tiempo, la concentración de ligandos de células adhesivas puede ajustarse cambiando la proporción de variantes ELP con el adhesivo de la célula (RGDS) a las secuencias de (RDGS) no adhesiva dentro de cualquier régimen de rigidez. Mediante la manipulación de estas dos variables, podemos producir geles que poseen un espectro de propiedades mecánicas y las concentraciones de ligando (figura 3).
Para encapsular células en 3D hidrogeles ELP, el número deseado de células suspendido en el medio y se centrifugó para producir un precipitado de células (Figura 4A). El medio se aspira del tubo, y las células se resuspendió uniformemente en la solución de la ELP de la concentración deseada. A continuación, THPC solución es añadido a la suspensión de la célula/ELP y pipetea cuidadosamente para formar una mezcla homogénea. Esta solución es rápidamente transferida a los moldes de silicona estéril dentro de una placa de 24 pocillos con una pipeta y permitió a reticulación a temperatura ambiente y 37 ° C durante 15 min cada uno (Figura 4B). Por último, el medio es añadido a la placa de la pozo y se incubaron a 37 ° C en el experimento.
Live/dead tinción puede utilizarse para evaluar viabilidad celular y la encapsulación de acertado de la célula en hidrogeles ELP. Como se ilustra en la figura 5, las células progenitoras neurales murinos adultos (PNJ) Mostrar viabilidad celular alta durante 7 días dentro de un hidrogel ELP 3% (p/v).
Hidrogeles ELP 3D han demostrado previamente para apoyar el mantenimiento de la madre NPC medido a través de la expresión de marcadores de proteínas NPC canónicos SRY (sexo que determina la región Y)-caja 2 (Sox2) y nestina9. NPCs encapsuladas hidrogeles ELP 3% (p/v) con baja THPC reticulación Mostrar alta expresión de Sox2 nuclear localizada y filamentos citoplásmicos nestina mediante inmunotinción y proyección de imagen confocal (figura 6).

Figura 1 : Una representación esquemática de la ELP y de secuencias de aminoácidos correspondientes. El ELP utilizado en este estudio contiene una etiqueta T7 y His6 para la proyección de imagen basados en anticuerpos, una región bioactiva para la introducción de dominios adhesivo celular y una región como elastina que le confiere propiedades mecánicas elásticas y permite para la reticulación química. Haga clic aquí para ver una versión más grande de esta figura.
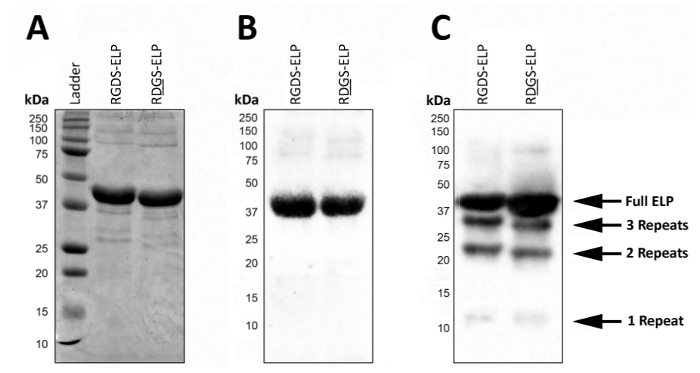
Figura 2 : Expresión de la proteína objetivo puede validarse con SDS-PAGE y Western blot para confirmar el peso molecular y la identidad del producto liofilizado final. Puro ELP cuerpo entero funciona con un peso molecular de 37 kDa reportado por (A) de SDS-PAGE y Western blot utilizando el T7 (MASMTGGQQMG) o histidina 6 etiqueta (HHHHHH) (B). (C). lotes impuros de ELP debido a las desviaciones en el protocolo de expresión ELP pueden conducir a la expresión de ELPs con pesos moleculares más bajos. Haga clic aquí para ver una versión más grande de esta figura.
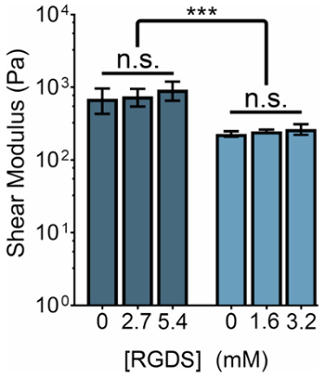
Figura 3: Contenido de ligando RGDS puede ajustarse independientemente de características mecánicas en hidrogeles ELP. 5% (p/v) y 3% (p/v) ELP hidrogeles tienen esquileo moduli de ~ 800 Pa y ~ 400 Pa, respectivamente. Hidrogeles con una relación 1:1 de aminas primarias de THPC grupos reactivos: ELP fueron reticulado a temperatura ambiente durante 15 minutos, calentada a 37 ° C y permitieron para equilibrar durante 5 minutos antes de la medición. Datos son medias ± d.e., *p < 0.001. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Esquema de encapsulación de la célula en hidrogeles ELP. (A). las células inicialmente son disociadas en una suspensión unicelular en el medio y la granulada utilizando una centrífuga. El medio se aspira del tubo, y las células se resuspendió en solución ELP en la concentración deseada y mezclar bien. Finalmente, la solución de reticulación THPC se añade y mezcla bien. (B). inmediatamente después de la adición de THPC, la solución se echa en un molde de silicona con una pipeta. La solución es permitida reticulación a temperatura ambiente durante 15 min, seguido de una segunda incubación de 15 minutos a 37 ° C. El medio se agrega entonces a la cultura para la duración del experimento. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Células progenitoras neurales mantienen alta viabilidad en hidrogeles ELP. Imagen representativa de las células progenitoras neurales había encapsulado en el 3% (p/v) ELP hidrogeles con reticulación de 1:1 (aminas primarias de grupos reactivos: ELP de THPC) después de 7 días en la cultura. Verde: viva coloración (calceína-AM); Rojo: muertos tinción (homodímero de etidio). Barra de escala = 100 μm.
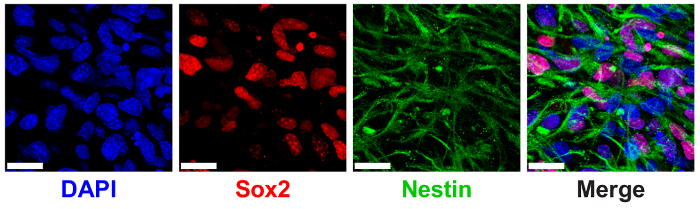
Figura 6 : 3D ELP hidrogeles apoyan la expresión progenitoras neurales célula madre fabricante. Imagen de inmunofluorescencia de células progenitoras neurales expresando Sox2 y nestina proteínas después de 7 días de la cultura en hidrogeles ELP. Las imágenes muestran las células encapsuladas en geles de ELP 3% (w/v) con 0.5:1 de reticulación (aminas primarias de grupos reactivos: ELP de THPC). Azul: DAPI (núcleos); Rojo: Sox2; Verde: nestin. Barra de escala = 25 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Purificación y expresión de la proteína recombinante es una herramienta poderosa para sintetizar biomateriales con alta reproducibilidad. Debido en gran parte a la llegada de la clonación molecular comercializada, plásmidos recombinantes personalizados pueden adquirirse de varios proveedores, que reduce significativamente el tiempo para trabajar con materiales como el ELPs. Del mismo modo, plásmidos pueden solicitarse directamente en el laboratorio de origen, cuando la obra original fue respaldada por un contrato federal y la labor futura serán para uso sin fines de lucro. La secuencia de aminoácidos completa de ELP ha sido publicada previamente por varias variantes ELP31. Sin embargo, el proceso de expresión a la eventual purificación de proteínas recombinantes implica a una serie de pasos críticos que comúnmente pueden conducir a la reducción de rendimientos o un producto de calidad inferior. Algunos de los problemas más comunes para la preparación de ELP se presentan en uno de los siguientes: (1) calidad de las poblaciones bacterianas almacenadas, (2) la congelación y descongelación de primer ciclo para alterar la membrana bacteriana y (3) proteína purificación a través de ciclos térmicos.
Una diferencia importante entre la expresión de la proteína y otros medios no biológicos de producción de materiales es que estamos aprovechando la maquinaria biológica de anfitriones recombinantes para sintetizar los polímeros. Posteriormente, esta técnica viene con una única limitación: muerte celular o daño. Muerte de las células más comúnmente se manifiesta como un reducido número de colonias bacterianas después de rayar una placa o anormalmente pequeñas colonias que crecen relativamente despacio. Las poblaciones bacterianas, si mantiene cuidadosamente, pueden permanecer estables durante años; sin embargo, ciclos de congelación y descongelación sucesivas debido a la falta repetida de uso o en el congelador pueden reducir la viabilidad de las células o conducir a daños en el ADN. Típica acción de las bacterias BL21 usa entre 10% y glicerol al 40% por volumen mezclado con células suspendidas. El propósito de la glicerina es reducir el daño de la membrana de la nucleación de cristales de hielo durante la congelación. Por lo tanto, usando una concentración baja (< 10%) puede conducir a una membrana comprometida, mientras que concentraciones más altas (> 40%) puede suprimir el punto de congelación suficientemente a donde la acción nunca congela que conduce a la muerte celular. Sin embargo, incluso dentro de los niveles de glicerol óptima, las poblaciones bacterianas no se debe a totalmente deshielo como una combinación de daño de la membrana de re-congelación y citotóxicos efectos desde el glicerol puede llevar a la reducida viabilidad de población y daño de la DNA. Por lo tanto, si se observa que una población bacteriana resulta en un recuento de colonias bajo o que están dividiendo las células a un ritmo constante lento (se manifiesta como una velocidad de rampa lenta de OD600 durante la expresión), volver a transformar el plásmido y haciendo una nueva acción es un simple primera aproximación para solucionar este problema. Con esto en mente, para asegurar el mantenimiento a largo plazo de las poblaciones bacterianas y la integridad del ADN, es mejor almacenar las copias de su plásmido DNA purificado en agua y no dentro de las células congelada. Almacenamiento de DNA de esta manera se asegurará de que en acontecimientos imprevistos como un acción fallida o congelador, una fuente confiable de la DNA original puede utilizarse para la transformación.
Otro paso crítico en la fabricación de ELP es la purificación de la proteína diana desde el host de expresión. Extracción de proteínas de e. coli se logra mediante la ruptura de la pared celular mediante nucleating cristales de hielo que se forman a lo largo de la celda suspendida lisada a congelación, que se agrava aún más con la congelación y descongelación sucesivas. Métodos alternativos para la ruptura de la pared celular pueden ser utilizados como sonicación o una prensa. En particular, consecutivo hielo-deshielo del lisado es ventajoso ya que sólo requiere un congelador y ningún otro equipo de la especialidad. Sin embargo, este procedimiento libera un ADN, RNA y proteínas contaminantes, además de proteasas que tienen el potencial para degradar la proteína diana. Por lo tanto, para evitar la contaminación y reduce el rendimiento, desoxirribonucleasa (DNasa) iy phenylmethanesulfonyl fluoruro (PMSF) estamos añadidos a la celda lisada a degradar el DNA e inhiben las proteasas, respectivamente. La presencia de ADN antes de la adición de la ADNsa se observa visualmente como un aspecto 'fibroso' a lo largo de la celda suspende de nuevo lisada tras el primer deshielo. DNAsas degradan activamente este ADN y así reducen la viscosidad de la célula lisada haciéndolo más fácil de purificar mediante centrifugación. Descomponen el óptimo de la DNA se puede confirmar visualmente garantizando que el lisado celular parece ser totalmente líquido y que ya no es visible el aspecto fibroso. En la práctica hemos observado que la adición de mg ~0.1 de DNasa por lisado de célula de mL es suficiente para lograr la degradación es necesaria. Sin embargo, si aún se observa la presencia de ADN, DNasa más puede añadirse seguido por un adicional de dos a tres horas de agitación. Un problema similar también puede surgir si DNasa se agrega prematuramente antes de lisado ha tenido la posibilidad de descongelar suficientemente. En este caso, las temperaturas más frías pueden limitar la eficiencia de degradación del ADN debido a la inactivación prematura de DNasa. Para evitar este problema, es a menudo mejor práctica para permitir que el sedimento suspende de nuevo descongelar durante aproximadamente 8 horas antes del tratamiento con DNasa. Además, si se reportan rendimientos de baja proteína y la ruptura del ADN ha sido suficiente, la adición de más PMSF para ayudar a reducir aún más el potencial degradación de las proteínas de las proteasas puede ser requerida.
Consideraciones adicionales para asegurar la óptima expresión de ELPs incluyen una comprensión cuidadosa de los beneficios y limitaciones de un antibiótico elegido. Aquí, pET15b vectores que contienen un gen de resistencia a la ampicilina fueron utilizados para la expresión de la proteína. Funcionalmente, la serie vector pET permite la expresión de la proteína significativa con 50% de expresión de la proteína de la bacteria dedicada a la proteína diana tras una inducción exitosa32,33. Sin embargo, la ampicilina como un antibiótico de selección viene con algunas limitaciones que pueden interferir con la expresión óptima. En primer lugar, la degradación de la ampicilina en la presencia de e. coli puede ocurrir rápidamente debido a la liberación de beta-lactamasa. Si una cantidad suficiente de la ampicilina se degrada, el plásmido ampicilina-codificación (es decir, el plásmido de codificación de ELP) puede perderse totalmente. Como resultado, al expresar el ELPs durante períodos más largos, los niveles de expresión de la proteína deben ser supervisados cuidadosamente en momentos sucesivos para garantizar una cantidad suficiente del gene codificación de ELP permitir la expresión conveniente. Posibles métodos de solución de problemas de la acumulación de beta-lactamasas incluyen girar hacia abajo la cultura de arrancador y volver a suspender las células en medio libre de antibiótico antes de inocular el medio de expresión. Este proceso limita la transferencia de las enzimas degradantes de antibiótico eficaz y asegura una mayor parte de las células contienen el vector de codificación de la proteína objetivo. Además, la ampicilina tiene una vida útil limitada de aproximadamente dos a tres semanas. Por lo tanto, las placas de cultivo para la expresión de la proteína deben almacenarse a 4 ° C por un máximo de dos semanas previas a utilizar. Finalmente, para asegurar la eficacia de la ampicilina en el arranque y la expresión medios de comunicación, la solución ampicilina debe ser fresco producido inmediatamente antes de usar, como almacenamiento a largo plazo puede conducir a un antibiótico menos eficaz.
La presencia de un LCST permite la simple purificación de TEKS por ciclos térmicos. En concreto, en una temperatura más alta y en presencia de sales, las fuerzas entrópicas causan ELPs menos solubles y forman posteriormente una fase de polímero rico coacervate. Por el contrario, a temperaturas más bajas, TEKS permanecen solubles y fácilmente se disuelven en la solución. Ciclismo entre estos regímenes de dos temperatura juntados con pasos de centrifugación para recoger y eliminar la fase contiene de ELP no sucesivamente concentra la proteína y reduce simultáneamente la existencia de contaminantes no ELP.
Sin embargo, hay una serie de etapas donde el ELPs se pueden perder en este proceso de purificación. En primer lugar, antes de cada giro frío es alcalizada la solución que contiene la proteína a un pH de 9.0. Este pH más alto sirve para deprotonate ciertos aminoácidos en la espina dorsal de la proteína, con eficacia, dejándolos en un estado cargado y seguir mejorando su solubilidad. En consecuencia, lo anterior este paso o no, lo que permite tiempo suficiente para la disolución de proteína puede conducir a una reducción en la producción como proteínas no solubilizado se peleteado durante la centrifugación y se descarta.
Del mismo modo, las proteínas blanco puede perder durante el procedimiento de giro caliente cuando el ELP es peleteado. Inicialmente, se agrega NaCl al sobrenadante rico en proteínas para reducir la solubilidad de la ELP. Las sales de trabajan para proteger a interacciones electrostáticas entre las moléculas de proteína y agua, haciendo que la proteína de la fase acuosa. Este efecto se amplifica mediante el calentamiento de la solución, que, debido a los efectos antrópicos, además rompe la 'jaula' hidratada que rodean ELPs y obliga a la agregación de las proteínas. En concentraciones más bajas de la proteína (es decir., el primer ciclo térmico), la adición de sales solo a menudo es insuficiente para causar esta separación de fases. Sin embargo, como la concentración de proteína aumenta (es decir., después de ciclos térmicos) y hay menos contaminantes secundarios para interactuar con las sales, el ELP precipitará más fácilmente. Como resultado, si sales se añaden demasiado rápido, puede físicamente atrapadas por agregación de las proteínas, que reduce la concentración de la solución con eficacia y límites más precipitación de la proteína. Así, la sal debe agregarse en tres pequeñas cantidades para que tengan tiempo suficiente para distribuir homogéneamente a través de la solución. Como nota final, variaciones a la columna vertebral de la ELP, ya sea a través de más modificaciones en el resto de huéspedes de la región como elastina o cambios en la región de bio-activo pueden afectar significativamente el comportamiento LCST. En consecuencia, para asegurar rendimientos óptimos de la proteína a través de variantes de la proteína, es crucial optimizar el pH, concentración de sal y sal tipo (e.g., monovalentes o divalentes) de las vueltas frías y calientes.
Correr de SDS-PAGE sobre la terminación de protocolo se recomienda ya que puede ser utilizado para determinar fácilmente si pérdida significativa de ELP se produce durante alguno de los pasos de purificación. Brevemente, si ELP se detecta en el sobrenadante después de un giro caliente, entonces la proteína no es ser efectivamente precipitada. Del mismo modo, si ELPs se identifican en una muestra de pellet solubilizado tras un centrifugado en frío, entonces la proteína no es ser efectivamente disuelto.
Hidrogeles ELP ofrecen muchas ventajas sobre materiales sintéticos o de origen natural. Específicamente, el uso de la amina reactiva crosslinker THPC ofrece un mecanismo de bajo costo, simple y armonioso de la reticulación de proteínas. Sin embargo, hay diferentes limitaciones dentro del Protocolo de reticulación que debe señalarse. THPC es oxígeno sensible, y si se almacena bajo condiciones indebidas, rápidamente pueden deteriorarse en la eficiencia de la reacción. Además, debido a su reactividad con aminas primarias, THPC puede reaccionar con alrededor de proteínas en los medios de comunicación o en la superficie celular que son ricas en aminas. Por lo tanto, al formar hidrogeles ELP, se recomienda para evitar la contaminación de los medios de comunicación con el precipitado de células para reducir la reactividad cruzada posible proteína exógena y por ende, una reducción en la eficiencia de la reticulación. Por último, este mecanismo de reticulación excluye la secuencia de la región de bio-activos para los que no hay residuos de lisina y por lo tanto, limita la potencial integración de algunos motivos de células adhesivas (por ej., IKVAV34). Para enfrentar estas limitaciones, modificaciones a la red troncal ELP con azida y bicyclononyne (BCN) socios de la reacción permite el entrecruzamiento bio-ortogonales, como se describió anteriormente27.
Cabe señalar que el comportamiento LCST ELP juega un papel importante en dictar microestructura de hidrogel. A regímenes de temperatura por encima de la LCST, ELPs precipitan fuera de solución lleva a la formación de fases de proteínas y deficiencia de proteína que puede influir en la porosidad de la matriz y la eficiencia de la reticulación de la matriz9. Porque se llevan a cabo más experimentos de cultivo celular a temperaturas fisiológicamente relevantes (~ 37 ° C) por encima de la ELP LCST, estos efectos se deben considerar. Para los hidrogeles con eficacia la reticulación y forma una red interconectada de la proteína, la amina primaria de la lisina debe ser físicamente accesible para el crosslinker THPC. Si la agregación de ELP se produce antes de llegar a reticulación suficiente, TEKS atrapados dentro de la fase rica en proteínas pueden ser inaccesible y por lo tanto no puede participar en la reticulación. Para solucionar esta limitación, nuestro protocolo requiere un período de cura inicial 15 min a temperatura ambiente, que permite para la reticulación preliminar del hidrogel antes de que el ELP experimenta su transición térmica. La temperatura de incubación es seguida por una incubación adicional de 15 min a 37 ° C para finalizar reticulación de hidrogel. Este procedimiento es crítico para la reticulación suficiente y robusta y reproducible gelación del material ELP.
En conclusión, la proteína recombinante hidrogeles fabricados con ELP ofrecen excepcional afinabilidad de la secuencia de la proteína y por lo tanto el microambiente celular 3D. Polímeros ELP han demostrado ser expresable en altos rendimientos, purificados fácilmente debido a su comportamiento LCST y biocompatible en una amplia variedad de sistemas in vitro e in vivo . El uso de e. coli como huésped recombinante proporciona un procedimiento sencillo y económico que da lugar a cerca de control ideal de peso molecular de polímero y la funcionalidad. En conjunto, esta técnica permite afinabilidad robusto y reproducibilidad de la plataforma de hidrogel que permite el cultivo de una amplia gama de tipos de células en 3D. Finalmente, esta plataforma de hidrogel ELP es susceptible a muchos análisis bioquímicos posteriores incluyendo qRT-PCR, Western blot, la extracción de ADN y células immunostaining9.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen T. Palmer y H. Babu (Neurocirugía de Stanford) para proporcionar murino NPCs. Vector art en la figura 4 fue utilizado y adaptado de Servier arte médico bajo licencia Creative Commons Atribución 3.0 Unported (https://creativecommons.org/ licenses/by/3.0/legalcode). Parte de este trabajo fue realizado en la Stanford Nano comparte instalaciones (FNS), apoyado por la National Science Foundation bajo premio ECCS-1542152. N.A.S. agradece apoyo del Instituto Nacional de General médica Ciencias de los institutos nacionales de salud (32GM 008412). C.M.M. reconoce apoyo de un NIH NRSA becas predoctorales (F31 EB020502) y el programa Siebel. S.C.H. reconoce apoyo de los institutos nacionales de salud (U19 AI116484 y R21 EB018407), National Science Foundation (DMR 1508006) y el Instituto de California de medicina regenerativa (RT3-07948). Esta investigación recibió financiamiento de la Alianza para la investigación Regenerativa de rehabilitación y capacitación (AR3T), que es apoyada por la Eunice Kennedy Shriver Instituto Nacional de salud infantil y desarrollo humano (NICHD), Instituto Nacional de Desórdenes neurológicos y movimiento (NINDS) e Instituto Nacional de imágenes biomédicas y bioingeniería (NIBIB) de los institutos nacionales de salud bajo la concesión número P2CHD086843. El contenido es responsabilidad exclusiva de los autores y no representan necesariamente las opiniones de los institutos nacionales de salud.
Materiales
| Name | Company | Catalog Number | Comments |
| Elastin-Like Protein Expression and Purification | |||
| 10 cm Petri Dishes | Thermo Fisher Scientific | FB0875713 | |
| 70% Ethanol | RICCA Chemical | 2546.70-1 | |
| Ammonium Sulfate | Sigma-Aldrich | A3920-500G | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25G | |
| Bacto Agar | Thermo Fisher Scientific | 9002-18-0 | |
| BL21(DE3)pLysS Competent Cells | Invitrogen | C606003 | |
| Chloramphenicol | Amresco | 0230-100G | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| EDTA disodium salt, dihydrate | Thermo Fisher Scientific | O2793-500 | |
| Glycerol | Thermo Fisher Scientific | BP229-4 | |
| Isopropanol | Thermo Fisher Scientific | A451-4 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | BP1755-10G | |
| Luria Broth | EMD Millipore | 1.10285.5007 | |
| Parafilm | VWR | 52858-000 | |
| Phenylmethanesulfonyl fluoride (PMSF) | MP Biomedicals | 195381 | |
| Sodium Chloride | Thermo Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Sigma-Aldrich | S 8045-1KG | |
| Syringe Filter Unit (0.22 μm) | Millipore | SLGP033RB | |
| Terrific Broth | Millipore | 71754-4 | |
| Tris Base | Thermo Fisher Scientific | BP152-1 | |
| Cell Encapsulation in 3D ELP Hydrogels | |||
| 0.22 μm syringe filters | Millipore | SLGV004SL | |
| 0.5 mm thick silicone sheet | Electron Microscopy Science | 70338-05 | |
| 24-well tissue culture plates | Corning | 353047 | |
| Disposable Biopsy Punch (2 mm) | Integra Miltex | 33-31 | |
| Disposable Biopsy Punch (4 mm) | Integra Miltex | 33-34 | |
| Disposable Biopsy Punch (5 mm) | Integra Miltex | 33-35 | |
| Dulbecco’s phosphate buffered saline (DPBS) | Corning | 21-031-CM | |
| No. 1 12 mm glass coverslips | Thermo Fisher Scientific | 12-545-80 | |
| Tetrakis(hydroxymethyl)phosphonium chloride (THPC) | Sigma-Aldrich | 404861-100ML | |
| 0.5% Tryspin/EDTA | Thermo Fisher | 15400054 | |
| Immunocytochemistry of Cells in 3D ELP Hydrogels | |||
| 16% (w/v) Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15701 | |
| Bovine Serum Albumin (BSA) | Roche | 3116956001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Donkey Serum | Lampire Biological Labs | 7332100 | |
| Goat anti-mouse Secondary Antibody (AF488) | Molecular Probes | A-11017 | |
| Goat anti-rabbit Secondary Antibody (AF546) | Molecular Probes | A-11071 | |
| Goat Serum | Gibco | 16210-072 | |
| Mouse Nestin Primary Antibody | BD Pharmingen | 556309 | |
| Mouse Sox2 Primary Antibody | Cell Signaling Technology | 23064S | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Vectashield Hardset Mounting Medium | Vector Labs | H-1400 |
Referencias
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294 (5547), 1708-1712 (2001).
- Birgersdotter, A., Sandberg, R., Ernberg, I. Gene expression perturbation in vitro-A growing case for three-dimensional (3D) culture systems. Seminars in Cancer Biology. 15 (5), 405-412 (2005).
- Gómez-Lechón, M. J., et al. Long-term expression of differentiated functions in hepatocytes cultured in three-dimensional collagen matrix. Journal of Cellular Physiology. 177 (4), 553-562 (1998).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Justice, B. A., Badr, N. A., Felder, R. A. 3D cell culture opens new dimensions in cell-based assays. Drug Discovery Today. 14 (1-2), 102-107 (2009).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Madl, C. M., et al. Maintenance of neural progenitor cell stemness in 3D hydrogels requires matrix remodelling. Nature Materials. 16 (12), 1233-1242 (2017).
- Discher, D. E., Janmey, P., Wang, Y. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Sun, Y., Villa-Diaz, L. G., Lam, R. H. W., Chen, W., Krebsbach, P. H., Fu, J. Mechanics Regulates Fate Decisions of Human Embryonic Stem Cells. PLoS ONE. 7 (5), e37178(2012).
- Ehrbar, M., et al. Elucidating the Role of Matrix Stiffness in 3D Cell Migration and Remodeling. Biophysical Journal. 100 (2), 284-293 (2011).
- Rowlands, A. S., George, P. A., Cooper-White, J. J. Directing osteogenic and myogenic differentiation of MSCs: interplay of stiffness and adhesive ligand presentation. American Journal of Physiology - Cell Physiology. 295 (4), 1037-1044 (2008).
- Lampe, K. J., Antaris, A. L., Heilshorn, S. C. Design of three-dimensional engineered protein hydrogels for tailored control of neurite growth. Acta Biomaterialia. 9 (3), 5590-5599 (2013).
- Kilian, K. A., Mrksich, M. Directing Stem Cell Fate by Controlling the Affinity and Density of Ligand-Receptor Interactions at the Biomaterials Interface. Angewandte Chemie International Edition. 51 (20), 4891-4895 (2012).
- Tse, J. R., Engler, A. J. Preparation of Hydrogel Substrates with Tunable Mechanical Properties. Current Protocols in Cell Biology. , 10.16.1-10.16.16 (2010).
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: A complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- DiMarco, R. L., Heilshorn, S. C. Multifunctional Materials through Modular Protein Engineering. Advanced Materials. 24 (29), 3923-3940 (2012).
- Meyer, D. E., Chilkoti, A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nature Biotechnology. 17 (11), 1112-1115 (1999).
- Aladini, F., Araman, C., Becker, C. F. W. Chemical synthesis and characterization of elastin-like polypeptides (ELPs) with variable guest residues. Journal of Peptide Science. 22 (5), 334-342 (2016).
- McMillan, R. A., Caran, K. L., Apkarian, R. P., Conticello, V. P. High-Resolution Topographic Imaging of Environmentally Responsive, Elastin-Mimetic Hydrogels. Macromolecules. 32 (26), 9067-9070 (1999).
- McMillan, R. A., Conticello, V. P. Synthesis and Characterization of Elastin-Mimetic Protein Gels Derived from a Well-Defined Polypeptide Precursor. Macromolecules. 33 (13), 4809-4821 (2000).
- Chung, C., Lampe, K. J., Heilshorn, S. C. Tetrakis(hydroxymethyl) Phosphonium Chloride as a Covalent Cross-Linking Agent for Cell Encapsulation within Protein-Based Hydrogels. Biomacromolecules. 13 (12), 3912-3916 (2012).
- Romano, N. H., Madl, C. M., Heilshorn, S. C. Matrix RGD ligand density and L1CAM-mediated Schwann cell interactions synergistically enhance neurite outgrowth. Acta Biomaterialia. 11, 48-57 (2015).
- Shah, M., Hsueh, P. Y., Sun, G., Chang, H. Y., Janib, S. M., MacKay, J. A. Biodegradation of elastin-like polypeptide nanoparticles. Protein Science. 21 (6), 743-750 (2012).
- Nettles, D. L., Chilkoti, A., Setton, L. A. Applications of elastin-like polypeptides in tissue engineering. Advanced Drug Delivery Reviews. 62 (15), 1479-1485 (2010).
- Madl, C. M., Heilshorn, S. C. Tyrosine-Selective Functionalization for Bio-Orthogonal Cross-Linking of Engineered Protein Hydrogels. Bioconjugate Chemistry. 28 (3), 724-730 (2017).
- Zhu, D., Wang, H., Trinh, P., Heilshorn, S. C., Yang, F. Elastin-like protein-hyaluronic acid (ELP-HA) hydrogels with decoupled mechanical and biochemical cues for cartilage regeneration. Biomaterials. , 132-140 (2017).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Bio-Orthogonally Crosslinked, Engineered Protein Hydrogels with Tunable Mechanics and Biochemistry for Cell Encapsulation. Advanced Functional Materials. 26 (21), 3612-3620 (2016).
- Cai, L., Dinh, C. B., Heilshorn, S. C. One-pot synthesis of elastin-like polypeptide hydrogels with grafted VEGF-mimetic peptides. Biomater Sci. 2 (5), 757-765 (2014).
- Straley, K. S., Heilshorn, S. C. Independent tuning of multiple biomaterial properties using protein engineering. Soft Matter. 5 (1), 114-124 (2009).
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current Opinion in Biotechnology. 10 (5), 411-421 (1999).
- Graumann, K., Premstaller, A. Manufacturing of recombinant therapeutic proteins in microbial systems. Biotechnology Journal. 1 (2), 164-186 (2006).
- Tashiro, K., et al. A Synthetic Peptide Containing the IKVAV Sequence from the A Chain of Laminin Mediates Cell Attachment, Migration, and Neurite Outgrowth. Journal of Biological Chemistry. 264 (27), 16174-16182 (1989).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados