Method Article
캡슐화 및 3d에서 셀의 Immunostaining에 대 한 엘라 스 틴 같은 단백질 Hydrogels의 생산
요약
그들은 완전 한 tunability 폴리머 백본 및 따라서 셀 microenvironment의 허용으로 재조합 단백질 엔지니어링 hydrogels는 3D 세포 배양에 대 한 유리한 있습니다. 여기, 우리 재조합 엘라 스 틴 같은 단백질 정화의 과정 및 3 차원 하이드로 겔 셀 캡슐화에의 응용을 설명합니다.
초록
2 차원 (2D) 조직 문화 기술 근본적인 세포 생물학의 우리의 이해에 필수적인 되었습니다. 그러나, 전통적인 2D 조직 문화 시스템 부족 결과 사이의 중요 한 결과 3 차원 (3D) 매트릭스 분리 수집 생체 외에서 그리고 vivo에서. 이 한계를 해결 하기 위해 연구자는 vivo에서 세포 microenvironment의 생 화 확 및 생물 속성을 흉내낼 수 있는 3 차원 하이드로 겔 조직 문화 플랫폼 설계 있다. 이 연구는 3D 셀 캡슐화 및 다운스트림 생 화 확 적인 분석 실험을 지 원하는 소재 플랫폼을 개발할 필요가 동기가 있다. 재조합 단백질 공학 단백질 시퀀스의 특정 컨트롤에 대 한 허용 및 따라서, 확장, 결과의 잠재적인 기계 및 생 화 확 적인 속성 3D 하이드로 겔 소재 설계 및 개발에 대 한 고유한 도구 제공 매트릭스입니다. 여기, 우리는 recombinantly 파생 된 엘라 스 틴 같은 단백질 (ELP), 양식 hydrogels 독립적으로 조정할 수 있는 기계적 특성 및 세포 접착 ligand 농도에 사용 될 수 있는 표현에 대 한 프로토콜을 제시. 우리 더 ELP hydrogels 내 셀 캡슐화에 대 한 방법론을 제시 하 고 다운스트림 분석 및 정량화에 대 한 셀을 포함의 후속 immunofluorescent 얼룩.
서문
지난 세기 동안 2 차원 (2D) 조직 문화는 근본적인 세포 생물학에서 공부 시험관에대 한 통합 도구 집합으로 개발 했다. 또한, 2 차원 세포 배양에 대 한 상대적으로 저렴 하 고 간단한 프로토콜은 많은 생물학과 의학 분야에 걸쳐 그것의 채용에 이르렀다. 그러나, 과거의 연구 표시 했다 전통적인 2D 플랫폼 이어질 수 있는 결과 그 수집 된 vivo에서에서 현저 하 게 이탈, 귀중 한 시간을 일으키는 원인이 되 고 자금 낭비 임상 지향적인된 연구1,2, 3. 우리와 다른 가설 것이 불일치 최적의 확산 및 다양 한 종류의 세포 성숙에 필요한 수 있는 2D 표면에 경작 하는 셀에 제공 하는 네이티브 생화학 및 생물 단서의 부족에 표시 될 수 있습니다.
이러한 제한 및 도움 다리 2D 간의 격차를 해결 하기 위해 생체 외에서 그리고 vivo에서 학문, 연구원은 세포 캡슐화1,4,5 개발된 3 차원 (3D) 히드로 플랫폼을가지고 ,6. Hydrogels는 이상적인 재료는 세포 외 기질 (ECM) 생체 내에서 그들의 조직 같은 기계적 성질 및 영양분의 빠른 수송을 가능 하 게 물을 부 어 구조의 내 인 성 microenvironment을 정리 하 고 신호7,8요인. 또한, 3D hydrogels 독립 제어할 발판의 기계 및 생 화 확 적인 속성을 설계할 수 있습니다. 매트릭스 역학9,10,,1112 와 셀 접착제 ligands13,,1415 셀에 영향을 잘 알려져 있습니다. 생체 외에서 행동 하 고 vivo에서. 따라서, 가변 속성 3D hydrogels 셀과 그들의 microenvironment 간의 인과 관계를 연구 하는 플랫폼을 제공 합니다. 이상적인 3D 하이드로 겔 매트릭스에 대 한 기준 간단 하 고, 비 세포 독성 세포 캡슐화로 생리 적으로 관련 된 기계적 특성의 독립적인 tunability 및 기본 세포 접착 모티프의 모방을 포함.
모두 합성 (예., 폴 리 에틸렌 글리콜, polylactic 산, 폴 리 (glycolic acid)) 자연스럽 게 파생 (예., alginate, 콜라겐, Matrigel) hydrogels 있다 이점이 문화 플랫폼 2D 생체 외에서 ; 그러나, 그들은 또한 그들의 적용을 제한 하는 중요 한 단점이 있다. 첫 번째, 포유류 세포에 잠재적으로 독성이 될 수 있는 가혹한 가교 조건을 요구 하는 많은 합성 하 고 자연스럽 게 파생 된 플랫폼, 선도적인 세포 생존7감소. 또한, 많은 합성 플랫폼 네이티브 bioactivity 부족 그리고 증가 비용 및 복잡성16을 추가할 수 있는 보조 화학 반응을 통해 공업화 될 해야 합니다. 마지막으로, 자연스럽 게 파생 된 자료는 일반적으로 내장 바이오 액티브 도메인을 포함, 그들은 종종 높은 일괄 배치 변화를 시달려 고 종종 상대적으로 약한 젤7,17형성에 제한 됩니다.
재조합 단백질 공학 단백질 시퀀스를 명시적으로 제어 함으로써 재료 설계에 대 한 고유한 도구 집합을 제공 하 고, 확장 하 여, 최종 하이드로 겔의 잠재적인 기계 및 생 화 확 적인 재산18발판. 또한, 대장균 (대장균) 단백질을 표현 하의 잘 알려진 생물 학적 기계를 활용 하 여 재료 생산 수 있습니다 효율적이 고 일관 되 게 제한 남북 및 내부-일괄 가변성. 여기에 제시 된 엘라 스 틴 같은 단백질 (ELP)는 3 개의 조작된 도메인: 항 체를 태그를 통해 붙일 라벨을 허용 (1) T7, His6 태그, 수 여 탄성 기계적 성질 및 화학에 대 한 (2)는 ' 엘라 스 틴 같은 ' 지역 가교, (3) 세포 접착 모티프에 대 한 인코딩 ' 바이오-액티브 ' 지역.
엘라 스 틴 같은 지역 4 'Xaa' 아미노산 사이트 이소류신 (Ile), 하지만 될 수 있는 어떤 아미노산 프롤린 제외 될 하도록 정식 (발-프로-Gly-Xaa-Gly)5 엘라 스 틴 시퀀스를 기반으로 합니다. 이 시퀀스는 간단한 정화 후 식 열 사이클링19,20를 통해 악용 될 수 있는 낮은 중요 한 솔루션 온도 (LCST) 동작으로 재조합 ELPs endows. 이 LCST 속성 열 집계에 다른 온도에 게스트 'Xaa' 찌 꺼 기21,22를 수정 하 여 조정 될 수 있습니다.
여기, 5 엘라 스 틴 같은 반복 중 하나에 'Xaa' 위치는 아민 제시 리 (리스) 아미노산, 히드로 가교에 이용 되는 대체 되었습니다. 우리의 이전 작품 비 세포 독성과 강력한 아민 반응 crosslinker tetrakis (hydroxymethyl) phosphonium 염화 (THPC)23반응을 통해 가교를 보이고 있다. 다양 한 전체 단백질 콘텐츠 및 crosslinker 농도, 우리 hydrogels 순수 관련 강성 범위 (~0.5-50 kPa)9,,2324스팬 조정 될 수 있습니다 생산 수 있습니다. 기계적 성질, 튜닝 외에 히드로 내 세포 접착 ELP 단백질의 백본 내의 정식 셀 접착제 도메인의 통합에서 유래한 다. 예를 들어 비 바인딩 'RDGS' 변종 세포-매트릭스 접착24을 제한 확장된 fibronectin 파생 'RGDS' 아미노산 시퀀스의 세포 접착 및 스크램블, 동안 구조적 유연성을 허용 합니다. 세포 접착 비 접착 단백질 뿐만 아니라 총 단백질 농도의 비율을 변조, 우리가 효과적으로 리간드 농도의 넓은 범위에 걸쳐 hydrogels 생산 수 있습니다. 릴리스할, 히드로 플랫폼 독립적으로 튜닝할 수 없는 다양 한 종류의 세포 최적의 3D 문화에 대 한 분리 된 생 화 확 및 생물 속성을 개발 했습니다.
매트릭스 강성 및 접착제 ligand tunability, 재조합 hydrogels 셀 확산, 확산, 및4 3D 컨텍스트 내에서 마이그레이션에 필요한 디자인 특정 소재 저하 프로필 기능 제공 , 9.이 저하 특히 대상으로 확장된 'RGDS'9 또는 엘라 스 틴 같은 시퀀스25프로 테아의 분 비 세포에서 제공. ELP hydrogels 세포 생존 능력 및 기능 immunocytochemistry 양적 역에 대 한 DNA/RNA/단백질 추출 등 공부에 필요한 후속 생 화 확 적인 분석 실험을 지원 하기 위해 표시 되었습니다 또한 전사-연쇄 반응 (qRT-PCR)와 서 부 오9점. ELP 변종 vivo에서 모델의 수에도 사용 되었습니다 그리고26면역 시스템 의해 잘 용납 될 것으로 알려져 있습니다.
합쳐, ELP 다양 한 합성 또는 자연스럽 게 파생 된 소재 플랫폼, 생화학 및 생물 tunability의 동일한 정도 부족에 비해 혜택을 자랑 하는 셀 캡슐화 연구 소재 플랫폼으로 고 재현성입니다. 또한, ELP의 간단 하 고 세포 독성 비 사용 다양 한 세포 유형 (예., 병아리 지 루트 중추14,24, murine 신경 조상 세포9, 인간 간 엽 줄기 세포27, 소 신생아 chondrocytes28, 인간 내 피 세포29,30) 2 차원 세포 배양에 비해 생 3D ECM의 더 순수 관련 모델에 대 한 수 있습니다. 여기, 우리 recombinantly 파생의 표현에 대 한 프로토콜을 제시, 3D에 대 한 가변 히드로 플랫폼으로 사용 하기 위해 ELPs 세포 캡슐화. 우리는 더 다운 스트림 형광 라벨 및 캡슐화 된 세포의 confocal 현미경 검사 법에 대 한 방법론을 제시.
프로토콜
1. 엘 프 식 프로토콜
- 제 1 일: 초보 식민지 성장
- 국물과 한 천의 초순 물 1 L 당 15 g 압력가 마로 소독 Luria의 25 g에 의해 암 피 실린, 페니 한 접시를 준비 합니다. 일단 솔루션 ~ 60 ° C에 냉각은, 100 µ g/mL와 34 µ g/mL의 최종 농도 대 한 솔루션의 1 리터를 1 mL 암 피 실린 재고 (초순에 100 mg/mL)와 페니 주식 (70% 에탄올에 34 mg/mL) 1 mL를 추가 각각. 최종 솔루션의 20 mL 혈 청 학적인 피 펫으로 10 cm 배양 접시에 전송 하 고 공고히 agar를 허용 합니다. 랩 parafilm와 4 ° c.에 게 페 트리 요리
참고: 접시 저장할 수 있습니다 4 ° C에서 최대 2 주 동안. - 줄무늬가 BL21의 작은 샘플 (DE3) pLysS 대장균 암 피 실린 및 페니 한 천 격판덮개에 관심의 ELP 인코딩 pET15b 벡터를 포함 하는 미리 만든된 세균 주식에서.
참고: 암 피 실린과 페니 각각 pET15b 및 pLysS 벡터를 포함 하는 박테리아에 대 한 선택. - 37 ° c.에 인큐베이터에 거꾸로 질주 된 플레이트를 배치 밤새 껏 성장 세균성 식민지를 허용 합니다.
암 피 실린 저하 됩니다 하 고 수행 하지 암 피 실린 저항 하는 식민지를 형성할 수 있다 참고: 16 h 이상 판 품 어 하지 마십시오.
- 국물과 한 천의 초순 물 1 L 당 15 g 압력가 마로 소독 Luria의 25 g에 의해 암 피 실린, 페니 한 접시를 준비 합니다. 일단 솔루션 ~ 60 ° C에 냉각은, 100 µ g/mL와 34 µ g/mL의 최종 농도 대 한 솔루션의 1 리터를 1 mL 암 피 실린 재고 (초순에 100 mg/mL)와 페니 주식 (70% 에탄올에 34 mg/mL) 1 mL를 추가 각각. 최종 솔루션의 20 mL 혈 청 학적인 피 펫으로 10 cm 배양 접시에 전송 하 고 공고히 agar를 허용 합니다. 랩 parafilm와 4 ° c.에 게 페 트리 요리
- 주 2: 준비 시작 문화와 식 미디어의
- 인큐베이터에서 대장균 문화를 제거 합니다. Parafilm 접시와 최대 4 ° c.에 4 일에 대 한 저장소
- 스타터 문화 플라스 크 (250 mL)와 식 문화 플라스 크 (12 x 1 L) 및 오토 클레이 브를 준비 합니다. 식 미디어의 1 l 1 l 2 L 당황된 문화 플라스 크에 초순의 훌륭한 국물의 47.6 g, 글리세롤의 4 mL를 추가 하 고 알루미늄 호 일 모자.
참고: 전형적인 수확량은 식 미디어의 60-100mg/L 단백질. - 미리 데워 진된, 37 ° C 떨고 인큐베이터에 압력가 스타터를 로드 하 고 동요 하지 않고 품 어.
- 100 µ g/mL의 최종 농도 대 한 스타터 문화 (0.22 μ m 필터) 암 피 실린 주식 살 균 필터 (초순에 100 mg/mL)의 250 µ L를 추가 합니다. 즉시 250 rpm에서 시작 문화 교 반 시작.
참고: 페니는 한 천 배지에서 식민지 선택에만 사용 하 고 액체 문화에 대 한 포함 되지 않습니다. - 초보 문화 질주 된 접시에서 단일 ELP 플라스 미드 포함 된 대장균 식민지를 추가 하 여 접종 하 고 16 h 37 ° C에서 흔들어 스타터 문화 허용.
- 식 배양 플라스 크로 미리 예 열, 37 ° C incubators 떨고 놓고는 플라스 크는 다음 날 아침 접종 준비가 동요 없이 밤새 품 어.
- 대장균 에서 단백질 발현을 유도 하는 제 3 일:
- 신선 하 고, 살 균 필터링 암 피 실린 주식 (초순에 100 mg/mL)을 확인 합니다. 100 µ g/mL의 최종 농도 대 한 표현 미디어의 각 플라스 크에 암 피 실린 재고의 1 mL를 추가 합니다.
- 교 반 식 미디어 250 rpm에서 시작 합니다.
- 어떤 식 플라스 크에서 미디어의 2 mL 샘플 하 고는 베트에 600에서 읽고 광학 밀도 대 한 빈으로 추가 nm (OD600).
- 16 h 초보 문화 부 화 완료 후 혈 청 학적인 피 펫을 통해 각 식 플라스 크를 선발 문화 20 mL를 전송 하 여 각 식 플라스 크를 예방.
- 1 h 교 반 완료 후 식 플라스 크 중의 OD600 을 측정 합니다. 이 단계에 따라 OD600 검사 다른 플라스 크 각 시간 마다 20 분을 측정 합니다.
- 세600 0.6, 32 ° c 식 플라스 크를 포함 하는 동영상의 온도 감소 시키십시오
- OD600 10 분 마다 확인 합니다. 마약600 의 0.8, 1 m, 각 식 플라스 크를 초순에 β-이소프로필 메 마른 필터링 thiogalactoside (IPTG) 1 mL를 추가 하 여 식을 유도.
- 7 h 표현 하 식 플라스 크에서 대장균 을 허용 합니다.
- 식의 끝 전에 20 분 사전 냉각 4 ° c 대형 바닥 원심 분리기
- 식 미디어의 모든 12 L 개별 원심 분리기 용기와 균형으로 수집 합니다.
- 원심에서 식 미디어 > 12000 x g 층 원심 분리기를 사용 하 여 4 ° C에서 15 분.
- 각 원심 분리기 컨테이너에서 상쾌한을 붓는 다. 주걱을 사용 하 여 미리 무게 지퍼 잠금 가방에 셀 알 약을 수집 합니다.
- 다시 살 균 필터링 10 버퍼 (버퍼 펠 릿의 25 g 당 100 mL)에 펠 릿을 일시 중단 하 고 펠 릿을 마사지 하 여 모든 초과 공기 방울을 제거 합니다. 10 버퍼의 1 l, 초순 물 900 mL에 염화 나트륨의 5.8 g, 트라이앵글, 1.21 g 및 ethylenediamine tetraacetic 산 (EDTA) disodium 소금이 수화물의 0.37 g을 추가 합니다. PH 8.0에 조정 하 고 1 나를 이 단계에 대 한 pH 지구는 충분 하다.
- 보조 용기에 다시 중단된 셀 펠 릿을 포함 하는 지퍼 잠금 가방 놓고 밤새-80 ℃에서 동결 합니다.
- 제 4-6 일: freeze-thaw 주기를 통해 세균성 세포 벽을 파열
- 냉장고에서 냉동된 펠 릿을 제거 하 고 궤도 셰이 커를 사용 하 여 부드러운 동요와 4 ° C에서 천천히 해 동을.
- 어떤 액체는 현재까지 해빙 하는 것 펠 릿을 허용 합니다. 추가 30 ~ 40 mg의 deoxyribonuclease I (DNase)를 lysate 해 동. 또한, 세포 lysate의 100 mL 당 소 프로 파 놀 있는 100mm phenylmethylsulphonyl 불 소 (PMSF, protease 억제제)의 1 mL를 추가 합니다. 밤새 흔들 lysate 허용.
참고: 첫 번째 동결-해 동 주기 위한 필요만 PMSF DNase를 추가.
주의: PMSF 흡입 독성이 있다. PMSF 분말을 처리할 때 얼굴에 마스크를 사용 해야 합니다. - 일단 세포 lysate 완전히 해 동, 동결 lysate-80 ° C에서 하룻밤, 또는 때까지 완전히 동결.
- 3 주기 총 동결-해 동 절차를 반복 합니다. 두고는 lysate 마지막 동결-해 동 후 4 ° C에서 해 동. 100 µ L 원시의 정화의 결론에 나트륨 라우릴 황산 polyacrylamide 젤 전기 이동 법 (SDS 페이지) 분석에 대 한 lysate를 저장 합니다.
- 지난 해 동 후의 산도 해 동된 1 M NaOH를 사용 하 여 9.0 lysate를 조정 합니다. 이 단계에 대 한 pH 지구는 충분 하다. 적어도 1 시간에 4 ° C에서 품 어 (하룻밤은 적절 한) 궤도 통에.
- 7-9 일: ELP 정화 춥고 뜨거운 회전 열 사이클링을 통해
- 멋진 바닥 원심 분리기 4 ° c 원심 분리 전에 20 분.
- 약 수 고는 해 동된 균형 원심 분리기 컨테이너로 lysate.
- 원심에서 샘플 > 15000 x g 1 h 4 ° c.에 대 한 정화의 완료 후에 SDS 페이지 분석을 위한 상쾌한의 100 µ L를 저장 합니다.
참고: centrifuging, 후 ELP 단백질 있어야 상쾌한의 LCST 아래의 온도에서 물에 있는 그것의 높은 가용성 때문에 (< 32 ° C). - 새로운 분리기 컨테이너에는 상쾌한을 전송 하 고 적절 하 게 균형.
- 1 M (5.84 g의 NaCl는 상쾌한의 모든 100 ml)의 최종 농도에 3 개 부품에서 염화 나트륨 (NaCl)를 추가 합니다. 충분 한 해산 수 있도록 3 개 부품에서 NaCl이 추가 되었는지 확인 합니다.
- 떨고 인큐베이터에서 250 rpm에서 37 ° C에서 3 h 교 반 하십시오.
- 동요, 끝나기 전에 1 시간 전 따뜻한 바닥 분리기 37 ° c
- 원심 > 15000 x g 1 h 37 ° c.에 대 한 정화의 완료 후에 SDS 페이지 분석을 위한 상쾌한의 100 µ L를 저장 하 고 나머지 상쾌한 삭제.
참고: centrifuging, 후 ELP 단백질 해야 될 pelleted는 LCST 이상의 온도에서 물에 그것의 낮은 용 해도 때문 (> 32 ° C). - 다시, 펠 릿의 1 g 당 압력가 마로 소독, 초순 물 10 mL를 추가 하 여 펠 릿을 일시 중단 합니다. 금속 주걱을 사용 하 여 단백질의 해산에 도움이 펠 릿을 매쉬.
- 1 M NaOH를 사용 하 여 9.0 lysate는 해 동의 pH를 조정 합니다. 이 단계에 대 한 pH 지구는 충분 하다.
- 궤도 통에 4 ° C에서 하룻밤 교 반 하십시오.
- 3 주기 총 추위와 뜨거운 회전 열 사이클링 절차를 반복 (즉., 단계 1.5.11 통해 1.5.1 3 총 주기를 반복).
- 하루 10-15: ELP 투 석 및 동결은
- 다시 일시 중단 된 펠 릿에 미리 냉장된 원심 분리기에 원심 > 15000 x g 1 h 4 ° c.에 대 한 정화의 완료 후에 SDS 페이지 분석을 위한 상쾌한의 100 µ L를 저장 합니다.
- 4 ° c.에 미리 냉장된 초순의 4 L에 대 한 3.5 kDa 투 석 막에 나머지 상쾌한 dialyzing에 의해 단백질 해결책 desalt 투 석 물 하루에 두 번 6 번 3 일 총에 대 한 변경.
참고: 일반적인 표면에 뜨는 볼륨 5와 30 mL 사이 있습니다. - 원심에서 미리 냉각된 원심 분리기에서 dialyzed 솔루션 > 15000 x g 1 h 4 ° c.에 대 한 정화의 끝에 SDS 페이지 분석을 위한 상쾌한의 100 µ L를 저장 합니다.
- 그 결과 고정 미리 무게 원뿔 관에-80 ° C에 표면에 뜨는.
- 3 일 및 질량 단백질 수율을 결정 하는 최종 제품에 대 한 냉동된 솔루션을 lyophilize.
- Parafilm 최종 포함 된 튜브 동결 건조 된 ELP 제품 및 상점 4 ° c.에
- SDS-단백질의 순도 확인 하려면 페이지를 실행 합니다.
참고: SDS-페이지에 대 한 프로토콜 특정 agarose 젤 조건에 따라 달라 집니다. 우리의 실험에 대 한 최종 동결 건조 된 단백질은 이온된 수에 0.5 mg/mL의 농도에 해산 하 고 140 V 12% (w/v) 아크릴 아 미드 젤 조건을 변성 시키기의 밑에 70-100 분 실행 합니다.
2. 셀 3D 엘라 스 틴 같은 단백질 Hydrogels에서 캡슐화
- 실리콘 금형의 준비
- 원하는 직경 생 검 펀치를 사용 하 여 0.5 m m 두꺼운 실리콘 시트에 구멍을 만들고 각 구멍 주위 정사각형을 잘라. 원하는 금형의 번호를 반복 합니다.
참고: 직경 및 금형의 두께 특정 응용 프로그램 및 세포 배양 조건에 대 한 조정할 수 있습니다. 실제로, 50의 세포 배양에 대 한 106 셀/mL, 5 mm 직경 4 m m와 0.5 m m 두꺼운 금형 각각 충분 한 DNA/RNA 및 단백질 추출에 대 한 권장 됩니다. Immunostaining에 대 한 2 m m 생 검 펀치를 잘 당 3 개의 복제를 얼룩이 질 수 있다 그래야 평방 형 당 3 개의 인접 한 구멍을 만드는 대신 사용할 수 있습니다. - 핀셋으로 개별 형의 양쪽에 플라스틱 포장을 제거 합니다.
참고: 피하십시오 노출된 실리콘 표면과 접촉을 오염 미래 플라즈마 결합 효율을 줄일 수 있습니다. - 핀셋을 사용 하 여 교대로 48-잘 접시의 거꾸로 뚜껑에 행에 같은 수의 벌 거 벗은 실리콘 금형와 유리 coverslips (1, 12 m m 직경) 정렬. 완료 되 면, 오염을 피하기 위하여 48-잘 접시의 뚜껑을 커버.
- 산소 플라즈마 처리 전체 48-잘 접시 뚜껑 (즉., 금형과 유리 슬라이드). 직후, 집게를 사용 하 여 인접 한 유리 coverslip에 실리콘 금형 반전. 결합 되도록 금형에 단단히 누릅니다. 금형 1 시간 실 온에서 품 어 보자.
참고: 산소 플라즈마 처리의 기간 사용 하는 악기에 따라 달라 집니다. 우리의 악기에 대 한 일반적인 조건이 0.3-4 사이 작동 가스 압력 창 mbar, 20 cm3/min, 및 10-20 s 플라즈마 샘플 노출에서 산소 가스 흐름. - 압력가 마로 소독 하 여 금형을 소독. 메 마른 환경 사용까지 실 온에서 금형을 저장 합니다.
참고: 금형 저장할 수 있습니다이 단계에서 무기한.
- 원하는 직경 생 검 펀치를 사용 하 여 0.5 m m 두꺼운 실리콘 시트에 구멍을 만들고 각 구멍 주위 정사각형을 잘라. 원하는 금형의 번호를 반복 합니다.
- 엘라 스 틴 같은 단백질 재고 솔루션의 준비
- 동결 건조 된 ELP 4 ° C 저장소에서 제거 합니다. 따뜻한 비응결 되도록 튜브를 열기 전에 실내 온도에 단백질 빌드 단백질에 반복된 사용을 통해.
- ELP Dulbecco의 인산 염 버퍼 식 염 수 (DPBS) 일정 한 동요와 4 ° C에서 분해 (즉., 회전) 하룻밤.
참고: ELP 재고 솔루션 농도 것입니다 더 희석 수 부피 비율을 사용자 정의에서 crosslinker 솔루션의 추가 함께. 예를 들어 3% (w/v) 최종 ELP 농도, ELP 솔루션: crosslinker 솔루션의 4:1 체적 비율로 희석 3.75% (w/v) ELP 재고 솔루션을 준비 합니다. 원하는 응용 프로그램에 필요한 농도 조정 합니다. - 살 균 필터 ELP 재고 솔루션 0.22 μ m 주사기 필터를 사용 하 여. ELP 사용 중 경우의 얼음에 저장.
- 캐비닛 biosafety 살 균 형 24-잘 조직 문화 접시에 멸 균 핀셋을 사용 하 여 전송.
- THPC 재고 솔루션의 준비
- 희석 DPBS 그냥 사전 사용에 THPC. 최종 ELP 농도 및 원하는 가교 비율 THPC 용액의 농도 조정 합니다.
참고: 프로토콜, 3% (w/v)의 최종 ELP 농도 ELP 재고 솔루션 THPC 솔루션 4: 1의 부피 비율로 혼합 하 여 만들 것 이다. 필요에 따라 조정 합니다. - THPC 솔루션 물 (80%)의 2.6 µ L DPBS의 997.4 µ L를 추가 합니다.
참고: 때 최종 3% (w/v) ELP 하이드로 겔에 대 한 설명 4:1 체적 비율로 솔루션 THPC의이 농도에 THPC hydroxy 메 틸 그룹과 ELP 단백질에 1 차 아민의 1:1 화학 량 론 비율에 해당 합니다. THPC 솔루션은 점성 그리고 솔루션의 방울 피 펫 팁의 측에 충실 수 있습니다. 정확한 농도 대 한 이러한 방울을 때 DPBS에 diluting 하지 마십시오. THPC 재고 컨테이너는 phosphine의 산화와는 crosslinker의 비활성화를 방지 하기 위해 질소 가스를 제거. - 소용돌이 혼합 하 여 얼음에 계속 솔루션.
- 살 균 필터는 THPC 주식 0.22 μ m 주사기 필터를 사용 하 여 솔루션. THPC 재고 솔루션 더 낮은 가교 화학 량 론 비율을 달성 하기 위해 살 균 DPBS 희석 (예., 0.5:1 또는 0.75:1).
참고: THPC는 산소에 민감한 고 희석된 솔루션 준비 후 몇 시간 이내에 사용 해야 합니다.
- 희석 DPBS 그냥 사전 사용에 THPC. 최종 ELP 농도 및 원하는 가교 비율 THPC 용액의 농도 조정 합니다.
- 단일 세포 현 탁 액에 트립 신-EDTA를 가진 외피에 의해 세포 분열, 세포, 작은 하 고 다시는 hemocytometer를 사용 하 여 중간에 중단 하는 셀.
참고:이 단계에 대 한 정확한 프로토콜 원하는 세포 유형 및 응용 프로그램에 무 겁 게 달라 집니다. 이 프로토콜 사용 신경 조상 세포에 대 일 분 동안 실 온에서 0.025% 트립 신-EDTA 보육 실시 했다. 셀은 수송과 200 x g 2 분 동안에. 증가 세포 생존 능력에 대 한 셀 표준 중간 상태에서 정지 한다. 1-50 106 셀/mL의 최종 히드로 볼륨에서 셀 캡슐화 범위 사용 한 전형적인 세포 밀도 필요에 따라 조정 합니다. - 약 수 살 균 1.5 mL 원심 분리기 튜브로 셀의 원하는 수.
- 신중 하 게 3 분 ~ 200 x g에서 세포를 원심는 상쾌한 발음 하 고 얼음에 셀 펠 릿을 유지.
참고: 그것은 완전히 발음 ELP와 THPC crosslinker의 더 희석을 완화 하기 위해 모든 상쾌한 중요입니다. 특정 원심 분리 속도 셀 유형으로 달라질 수 있습니다. - 다시 일시 중단 셀 펠 릿 ELP 재고 솔루션에서 볼륨은 마지막 볼륨 (가정 ELP 솔루션: THPC 솔루션의 4:1 비율)의 80%는. 플라스틱 믹스 20-25 시간 셀과 ELP의 동질적인 혼합물을 생산 하기 위해.
참고: 온도 증가 및 ELP의 후속 상전이를 튜브의 바닥 창과 하지 마십시오. 3 복제와 각 2 mm 형 필요 최종 볼륨의 7.5 µ L (즉., 6 ELP 재고 솔루션 및 THPC 재고 솔루션의 1.5 µ L의 µ L) 3 구멍으로 동등 하 게 분할 (즉., 2.5 µ L 최종 볼륨 구멍 당). 4와 5 m m 금형 7.5 µ L와 15.5 µ L의 최종 볼륨 필요 하다, 각각. - 나머지 20% 최종 볼륨에 대 한 셀/ELP 정지에 THPC 재고 솔루션을 추가 합니다. 플라스틱 믹스 20-25 시간 동질적인 혼합물을 생산 하기 위해.
- 즉시 원형 모션으로 각 금형에 셀/엘 프/THPC 혼합물의 해당 최종 볼륨 플라스틱. 모든 금형에 대 한 반복 합니다.
- 15 분, 15 분 동안 37 ° C에 추가 부 화 뒤 실 온에서 샘플을 품 어.
참고: 첫 번째 잠복기 ELP의 LCST 이상의 그 온도 증가 하 고 유도 하는 그것의 열 단계 분리 하기 전에 히드로의 초기 가교를 촉진에 도움이 됩니다. - 천천히 피하는 젤 방해 24-잘 접시의 각 음에 따뜻한 세포 배양 매체의 750 µ L를 추가 합니다.
- 7 일 동안 37 ° C에서 hydrogels를 품 어.
참고: 전체 변경 셀 유형에 따라 1-2 일 마다 권장 하는 매체. 우물에서 매체를 발음 할 때 젤에 스트레스를 제한 하려면 200 µ L 피 펫 팁 파스퇴르 피 펫 부착 되어 유리를 사용 합니다.
3. 3D ELP Hydrogels 셀의 Immunocytochemistry
- 10 mL 30 mL DPBS의 16% (w/v) paraformaldehyde (PFA)를 혼합 하 여 고정 솔루션을 준비 합니다. 37 ° c 솔루션 따뜻한
- 24-잘 접시에서 매체를 발음 하 고 부드럽게 DPBS의 1 mL로 씻어.
- 각 우물에 고정 솔루션의 750 µ L을 추가 하 고 30 분 동안 37 ° C에서 품 어. PFA 증기와 다른 문화의 오염을 피하기 위하여 조직 문화 인큐베이터를 사용 하지 마십시오.
- 신중 하 게 적절 한 유해 폐기물 컨테이너 PFA 삭제 각 우물에서 고정 솔루션 발음.
주의: PFA에 노출은 피부와 눈 자극을 발생할 수 있습니다. 장갑/안전 안경을 착용 하 고 화학 증기 두건에서 작동. - 각 샘플에 DPBS의 1 mL를 추가 합니다. 즉시는 DPBS 발음 하 고 PFA 폐기물 용기에 폐기.
- 10 분 동안 DPBS의 1 mL로 두 번 샘플을 씻으십시오.
참고: 샘플 수에 저장 DPBS 접시 Parafilm으로 밀봉 후 1 주까지 4 ° C에서. - 각 샘플 permeabilization 솔루션 (DPBS의 100 mL 및 트라이 톤 X-100;의 0.25 mL의 750 µ L permeabilize PBST) 15 rpm에서 로커에 실 온에서 1 h.
- 발음은 PBST 고 각 샘플 솔루션 (95 mL PBS의, 소 혈 청 알 부 민 (BSA)의 5 g, 혈 청의 5 mL 및 트라이 톤 X-100의 0.5 mL) 차단의 750 µ L를 추가 합니다. 3 h 15 rpm에서 로커에 대 한 실 온에서 품 어.
참고: 차단 솔루션 2 차 항 체 발생 했다 호스트 종에서 혈 청을 포함 해야 합니다 (예., 염소, 당나귀)는 0.22를 통해 살 균 필터링 µ m 필터 사용 하기 전에. - 항 체 희석 솔루션 (DPBS의 97 mL, BSA의 2.5 g, (동일한 호스트 종에서 단계 3.8에서와 같이), 혈 청의 2.5 mL 및 트라이 톤 X-100의 0.5 mL)을 준비 합니다. 항 체 희석 솔루션을 사용 하 여 1 차적인 항 체를 희석 하 고 각 샘플 솔루션의 500 µ L를 추가 합니다. 플레이트 Parafilm으로 밀봉 하 고 로커에 4 ° C에서 밤새 품 어.
참고: Nestin Sox2 기본 항 체 항 체 희석 솔루션 제조 업체의 원래 농도에서 희석된 1:400 했다. - 각 샘플에서 항 체 솔루션을 발음 하 고 15 rpm에서 로커에 실 온에서 60 분에 대 한 PBST와 샘플을 씻어. 3 번 세척 단계를 반복 합니다.
- 2 차 항 체 및 5 mg/mL 주식 DAPI (1:2, 000) 항 체 희석 솔루션을 사용 하 여 묽 게 하십시오 고 각 샘플 솔루션의 500 µ L를 추가 합니다. 커버 알루미늄 호 일로 24-잘 접시와 로커에 4 ° C에서 밤새 품 어.
참고: 2 차 항 체는 빛에 민감한, 샘플에 대 한 모든 후속 단계 photobleaching에서 보호 합니다. 염소 반대로 마우스와 염소 안티 토끼 2 차 항 체 항 체 희석 솔루션 제조 업체의 원래 농도에서 희석된 1: 500 이었다. - 각 샘플에서 항 체 솔루션을 발음 하 고 로커에 실 온에서 30 분 동안 PBST와 함께 샘플을 세척. 3 번 세척 단계를 반복 합니다.
- 유리 슬라이드 표면에 hard-set 설치 매체의 한 방울을 배치 합니다. 집게를 사용 하 여 종이 타월에 금형의 가장자리를 가볍게 blotting에 의해 금형에서 초과 솔루션을 제거 합니다. 신중 하 게 장착 매체에 거꾸로 형 놓고 거품을 소개 하지 않도록 합니다.
- 실 온에서 48 h에 대 한 강화를 장착 중간을 수 있습니다. 실내 온도 또는 4 ° C에서 샘플 저장 완전히 경화의 과정을 통해 매체의 굴절률 변경 됩니다 이미징 하기 전에 48 h에 대 한 설정에 설치 매체를 허용 합니다. 오염 또는 샘플 움직임을 완화 하기 위해 투명 매니큐어와 유리 커버 슬라이드에 샘플을 봉인.
- Confocal 현미경을 사용 하 여 샘플 이미지.
결과
ELPs이이 프로토콜에 사용 되는 5 개 영역으로 구성: T7 태그, His6 태그, enterokinase (EK) 분열 사이트, 생체 활성 영역 및 엘라 스 틴 같은 지역 (그림 1). T7 His6 태그 표준 서쪽 오 점 기술을 통해 쉽게 식별할 수 있습니다. EK 분열 사이트의 소개 태그 영역의 효소 제거 필요한 경우 수 있습니다. 바이오 액티브 지역 확장, fibronectin 파생 셀-접착제 ('RGDS') 또는 비-접착제 ('RDGS') 시퀀스를 인코딩합니다. 마지막으로, 엘라 스 틴 같은 영역의 중앙 반복 이용 잔류물 사이트 측면에 서 반복 포함 ~ 32 ° C31의 LCST를 달성 하기 위해 이소류신 THPC 통해 가교를 가능 하 게에서 lysine 그룹을 포함 합니다.
게시물 식, SDS 페이지 또는 서쪽 오 점 시각화 하는 분자량 고 ELPs T7 (MASMTGGQQMG) 또는 His6 (HHHHHH) (그림 2)와 같은 항 체 태그를 포함 하는 신원 확인 사용할 수 있습니다. 제어 조건 하에서 성공적인 식 대략적인 분자량 (~ 37 kDa)에서 단일 어두운 밴드의 존재에 의해 표현 매우 균질 제품 모두 SDS 페이지 (그림 2A)를 사용 하 여 이러한 단백질의 및 서쪽 오 점 ( 그림 2B)입니다.
통제 조건에서 서쪽 오 점에 낮은 분자량 밴드의 존재는 단백질의 어떤 일부분은 완전히 번역 및 후 식 (그림 2C) 저하 했다 나왔다. 특히, 여기 대 중 약 또는 해당 하는 한 생물 활동 영역과 3 엘라 스 틴 같은 지역 ('반복'), 무게 약 대상 단백질의 4 ~ 9 kDa에 의해 균등 하 게 분포 됩니다. 이 작은 단백질 조각은 일반적으로 식이 더 높은 온도에서 실시 하는 때 (> 32 ° C) 그림 2C처럼. 이러한 낮은 분자량 단백질의 존재는 예측할 수 없는 기계적 특성으로 이어질 수 있습니다. 따라서, 일반 게시물 식 검사 것이 좋습니다 높은 품질의 최종 제품을 보장 하기 위해.
ELP 기반 hydrogels의 기계적 강성 ELP의 농도 또는 THPC 반응 그룹: ELP 1 차 아민의 비율을 조작 하 여 수정할 수 있습니다. 동시에, 농도 세포 접착 ligands의 어떤 강성 정권 내 비 접착제 (RDGS) 시퀀스에 ELP 변종 세포 접착제 (RGDS)의 비율을 변경 하 여 조정 될 수 있습니다. 이 두 개의 변수를 조작 하 여 우리는 기계적 특성 및 리간드 농도 (그림 3)의 스펙트럼을 젤을 생성할 수 있습니다.
3D ELP hydrogels 내의 셀을 캡슐화 하기 위해 셀의 원하는 수 매체에 일시 중단 하 고 centrifuged 셀 펠 릿 (그림 4A)을 생성 하는. 매체는 튜브에서 발음 되며 셀 다시 원하는 농도의 ELP 솔루션 균일 하 게 정지. 다음, THPC 솔루션 셀/ELP 현 탁 액에 추가 하 고 동질적인 혼합물을 형성 하기 위하여 철저 하 게 pipetted 이다. 이 솔루션은 신속 하 게 24-잘 접시는 피 펫을 사용 하 여 내 살 균 실리콘 금형을 전송 하며 각 (그림 4B) 실내 온도 15 분 동안 37 ° C에서 crosslink 허용. 마지막으로, 매체 잘 접시에 추가 하 고 실험에서 37 ° C에서 incubated입니다.
라이브/죽은 얼룩이 지는 세포 생존 능력 및 ELP hydrogels 내 성공적인 세포 캡슐화를 평가 하기 위해 사용할 수 있습니다. 그림 5에서 볼 수 있듯이 성인 murine 신경 조상 세포 (Npc) 표시 높은 세포 생존 능력 3% (w/v) ELP 히드로 내에서 7 일 동안.
3D ELP hydrogels 이전 정식 NPC 단백질 마커 SRY (섹스 지역 Y 결정)의 표현을 통해 측정 NPC 줄기 유지 보수를 지원 하기 위해 표시 되었습니다-상자 2 (Sox2) 및 nestin9. NPCs는 ELP hydrogels Sox2 핵 지역화 및 immunostaining 및 confocal 영상 (그림 6)를 통해 세포질 nestin 필 라 멘 트의 낮은 THPC 가교 쇼 높은 식이 3% (w/v)에 캡슐화.

그림 1 : ELP와 해당 아미노산 시퀀스의 도식 대표. 이 연구에 사용 된 엘 프 항 체 기반 이미징, 세포 접착 도메인의 도입에 대 한 생리 활성 영역 및 수 여 탄성 기계적 특성 및 화학적 가교에 대 한 엘라 스 틴 같은 지역에 대 한 t 7과 His6 태그를 포함 되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
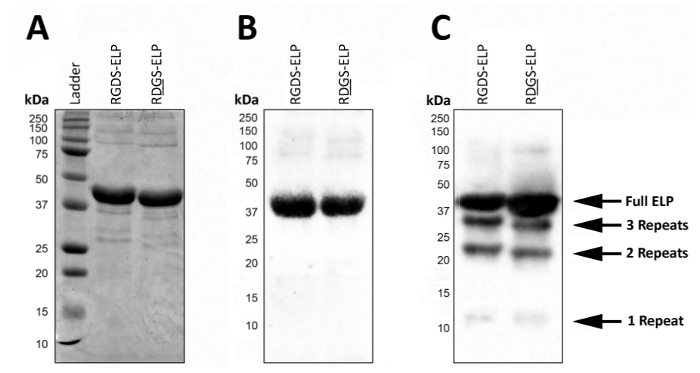
그림 2 : 대상 단백질 발현 SDS 페이지 및 서쪽 오 점 분자량 및 동결 건조 된 완성품의 정체성 확인 유효성을 검사할 수. 순수한 전체 길이 ELP 6 (HHHHHH) 태그 SDS 페이지 (A) 와 서쪽 오 점 T7 (MASMTGGQQMG) 또는 히스티딘을 사용 하 여 보고 37 kDa의 분자량에서 실행 (B). (C). ELP 식 프로토콜에 편차 때문에 ELP의 불순 한 일괄 낮은 분자 무게를 가진 ELPs 표현 될 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
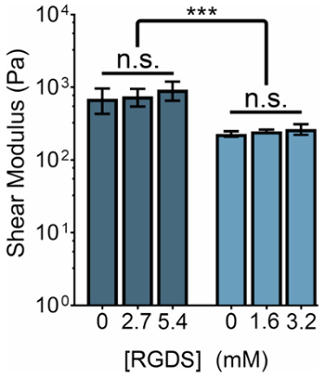
그림 3: RGDS ligand 콘텐츠 조정 될 수 있다 독립적으로 하지 ELP hydrogels 내 기계적 성질에서. 5% (w/v) 및 3% (w/v) ELP hydrogels ~ 800의 전단 계수는 Pa와 ~ 400 Pa, 각각. THPC 반응 그룹: ELP 1 차 아민의 1:1 비율로 Hydrogels 37 ° C에가 열 하는 15 분 동안 실내 온도에서 가교 화 그리고 측정 전에 5 분 동안 equilibrate 수 있습니다. 데이터는 평균 ± 사 우 스 다코타, *p < 0.001. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: ELP hydrogels에 셀 캡슐화의 도식. (A). 셀 처음 매체 및 수송과 원심 분리기를 사용 하 여 단일 세포 현 탁 액에 해리 했다. 매체는 튜브에서 발음 그리고 셀은 다시 원하는 농도에 ELP 솔루션에 정지 잘 혼합. 마지막으로, THPC 가교 솔루션은 추가 하 고 잘 혼합. (B). THPC의 추가 직후, 솔루션 한 피 펫을 가진 실리콘 형으로 캐스팅 됩니다. 솔루션 수 crosslink 실 온에서 15 분 뒤에 두 번째 15 분 부 화 37 ° c.에 대 한 매체는 잘 실험의 기간에 대 한 다음 문화에 추가 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5: 신경 조상 세포 유지 ELP hydrogels 높은 생존. 신경 조상 세포의 대표 이미지 캡슐화 3% (w/v) ELP hydrogels 1:1 가교 (THPC 반응 그룹: ELP 주 아민)와 7 일 후에 문화. 녹색: 라이브 얼룩 (calcein-오전); 레드: 죽은 (브로민 homodimer) 얼룩입니다. 눈금 막대 = 100 µ m.
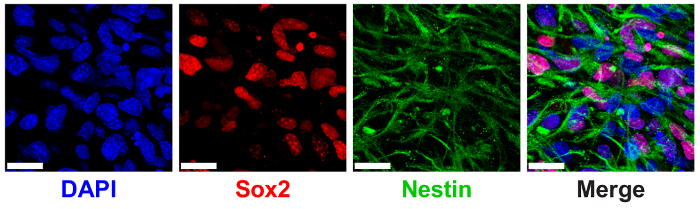
그림 6 : 3D ELP hydrogels 지원 신경 조상 세포 줄기 메이커 식. Sox2 표현 및 ELP hydrogels 문화의 7 일 후 단백질 nestin 신경 조상 세포의 면역 형광 이미지. 이미지는 3% (w/v) 0.5:1 가교 (THPC 반응 그룹: ELP 주 아민)와 ELP 젤에 셀을 표시 합니다. 블루: DAPI (핵); 레드: Sox2; 녹색: nestin. 눈금 막대 = 25 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
재조합 형 단백질 표정과 정화 높은 재현성 바이오 소재를 합성 하는 강력한 도구입니다. 때문에 크게 상용화 분자 클로닝의 출현, 사용자 정의 재조합 형 플라스 미드 구입하실 수 있습니다 여러 공급 업체에서 크게 ELPs 같은 재료와 함께 일 하는 시간을 감소 시키는. 마찬가지로, plasmids 원래 작품 연방 계약에 의해 지원 되었다 미래 일 비영리 사용 될 것입니다 때 원래 실험실에서 직접 요청할 수 있습니다. 전체 ELP 아미노산 시퀀스 여러 ELP 변종31이전 게시 되었습니다. 그러나, 재조합 단백질의 최종 정화에 식에서 프로세스는 일반적으로 감소 수익률 또는 낮은 품질의 제품으로 이어질 수 있는 중요 한 단계의 숫자 포함 됩니다. ELP 준비에 대 한 가장 일반적인 문제 중 일부는 다음 중 하나에 발생: (1) 저장된 세균성 주식의 품질, 세균 막, 그리고 (3) 단백질 정화 열 사이클링을 통해 방해 (2) 첫 번째 동결-해 동 주기.
단백질 식 및 다른 비 생물 재료 생산 수단의 사이의 주요 차이점은 우리는 고분자를 합성 하는 재조합 호스트의 생물 학적 기계를 활용 하. 그 후,이 기술은 고유 제한 함께 제공: 세포 죽음 또는 손상. 세포 죽음 가장 일반적으로 접시 또는 상대적으로 천천히 성장 하는 비정상적으로 작은 식민지를 질주 후 세균성 식민지의 감소 된 수로 자체 명단. 세균성 주식, 신중 하 게, 유지 하는 경우 남아 있을 수 있는 안정적인 년; 그러나, 반복 사용 또는 냉장고 실패 연속 동결-해 동 주기 세포 생존 능력을 감소 하거나 DNA 손상으로 이어질 수 있습니다. 전형적인 BL21 박테리아 주식 10%와 40% 글리세롤 간의 볼륨 정지 세포와 혼합 하 여 사용 합니다. 글리세롤의 목적은 동결 시 얼음 결정을 nucleating에서 막 피해를 줄이는 것입니다. 따라서, 낮은 농도 사용 하 여 (< 10%), 높은 농도 동안 손상 된 막으로 이어질 수 있습니다 (> 40%) 충분히 재고는 결코 세포 죽음에 주요한 정지에 어 포인트를 억제 수 있습니다. 그러나, 최적의 글리세롤 수준 내 에서도 세균성 주식 해야 수 없습니다를 완전히 해 동으로 다시 고정 및 세포 독성 효과 글리세롤에서에서 막 손상의 조합으로 이어질 수 있습니다 감소 주식 생존 및 DNA 손상. 그러므로 그것은 세균성 주식 낮은 식민지 수에 결과 또는 셀 (식 동안 느린 OD600 램프 속도으로 각 성) 지속적으로 느린 속도로 나누어는 관찰, 플라스 미드를 다시 변환 하 고 새로운 주식은 간단한 이 문제를 해결 하려면 첫 번째 접근입니다. 이 염두에서에 두고, 세균성 주식의 장기 유지와 DNA의 무결성을 보장 하기 위해 그것이 가장 순화 된 DNA를 세포 내 물에 냉동으로 당신의 플라스 미드의 복사본을 저장 하. 이 방법으로 DNA를 저장 실패 한 주식 또는 냉장고 실패 등 예기치 않은 이벤트, 원래 DNA의 신뢰할 수 있는 소스 사용할 수 있는 변환에 대 한 보장 합니다.
엘 프 제작에 있는 또 다른 중요 한 단계는 식 호스트에서 대상 단백질의 정화 이다. 대장균 에서 단백질 추출 nucleating 얼음 결정을 형성 하는 일시 중단 된 세포 lysate 동결, 시 연속 동결-해 동 주기와 혼합 추가 통해 사용 하 여 세포 벽을 파괴 함으로써 이루어집니다. 세포 벽을 파열에 대 한 대체 방법은 쥡니다 또는 언론 등 활용할 수 있습니다. 그것만 냉동 및 기타 특수 장비를 필요로 특히, 연속 동결-녹고는 lysate의 유리 하다. 그러나,이 절차는 nonspecifically DNA, RNA 및 단백질 오염 물질, 프로 테아 제 대상 단백질을 저하 가능성이 있는 이외에 출시 하였습니다. 따라서,를 오염을 방지 하 고 감소 하는 수확량, deoxyribonuclease 나 (DNase)와 phenylmethanesulfonyl 불 (PMSF) DNA 저하를 억제 하는 프로 테아 제, 각각 lysate 셀에 추가 됩니다. DNase 추가 하기 전에 DNA의 존재 관찰할 수 있습니다 시각적으로 다시 중단된 셀 통해 '힘 줄' 모양으로 첫 번째 재개 다음 lysate. DNase는 적극적으로이 DNA를 저하 하 고 따라서 세포 lysate 쉽게 원심 분리를 통해 정화의 점성을 감소 시킨다. DNA의 최적의 고장 세포 lysate 완전히 액체 것 같다 고 힘 줄 모양을 볼 수 이상 함으로써 시각적으로 확인할 수 없습니다. 우리 당 mL 세포 lysate DNase의 ~0.1 mg의 추가 필요한 저하를 달성 하기 위해 충분 한 연습에서 관찰 했습니다. 그러나, DNA의 존재, 여전히 관찰 하는 경우 더 많은 DNase 추가할 수 있습니다 다음 동요의 추가 2 ~ 3 시간. 전에 lysate의 잠재력을 충분히 녹여 DNase 성급 하 게 추가 되는 경우에 비슷한 문제가 발생할 수 있습니다. 이 경우에, 추운 온도 DNase의 조기 비활성화로 인해 DNA 저하의 효율성을 제한할 수 있습니다. 이 문제를 피하기 위해, 그것은 종종 DNase 치료 전에 약 8 시간에 대 한 해 동 다시 일시 중단 된 펠 릿을 허용 하는 것이 좋습니다. 또한, 낮은 단백질 수익률 보고 DNA의 붕괴는 충분 한 되었습니다 경우 더 프로 테아 제에서 잠재적인 단백질 저하를 줄일 수 있도록 더 많은 PMSF 추가 필요할 수 있습니다.
최적의 표현의 ELPs 보장에 대 한 추가 고려 사항 이득의 주의 깊은 이해 등 선택한 항생제의 한계. 여기, pET15b 벡터는 암 피 실린 저항 유전자를 포함 하는 단백질 식에 사용 되었다. 기능적으로, 애완 동물 벡터 시리즈 성공적인 유도32,33다음 대상 단백질에 전념 하는 박테리아의 단백질 식의 50%와 함께 중요 한 단백질 표정 허용. 그러나, 암 피 실린 선택 항생제로 최적의 식을 방해할 수 있는 몇 가지 제한이 함께 제공 됩니다. 첫째, 암 피 실린 대장균 의 존재의 beta lactamase의 출시로 인해 빠르게 발생할 수 있습니다. 경우에 암 피 실린의 충분 한 수량 저하 암 피 실린 인코딩 플라스 미드 (즉 ELP 인코딩 플라스 미드) 완전히 손실 될 수 있습니다. 결과적으로 때 더 긴 기간을 위한 ELPs 표현, 단백질 표정 수준 해야 신중 하 게 모니터링 ELP 인코딩 유전자의 충분 한 양의 바람직한 식 수 있도록 유지 하려면 연속 시간 시점. Beta lactamases의 형성 문제 해결 가능한 방법 초보 문화 아래로 회전 하 고 다시 항생제 무료 매체 표현 매체를 접종 이전에 셀 중단 포함 됩니다. 이 프로세스 효과적으로 항생제 타락 하는 효소의 양도 제한 하 고의 큰 부분을 보장 대상 단백질 인코딩 벡터를 포함 하는 셀. 또한, 암 피 실린의 약 2-3 주 제한 된 수명 있다. 따라서, 단백질 식 문화 접시 사용 하기 2 주 전에 최대 4 ° C에서 저장 되어야 한다. 마지막으로, 시작 및 식 미디어, 암 피 실린 재고 솔루션 내 암 피 실린의 효 험 사용 해야 합니다 수 생산된 신선한 즉시 전에, 장기 저장 덜 효과적인 항생제를 끌 수 있습니다.
열 순환 통해 ELPs의 간단한 정화는 LCST의 존재 수 있습니다. 특히, 높은 온도 소금의 존재, 엔트로피 세력 덜 용 해 되 고 이후 형성 폴리머 풍부한 coacervate 단계 ELPs 발생할. 다른 한편으로, 낮은 온도에서 ELPs 수용 성 유지 하 고 쉽게 솔루션으로 해산. 원심 분리 단계를 수집 하 고 엘 프 포함 된 단계를 연속적으로 삭제와 결합이 두 온도 정권 사이 자전거 단백질을 집중 하 고 동시에 비 ELP 오염 물질의 존재를 감소 시킨다.
그러나, 있다 단계의 수 어디 ELPs이 정화 과정에서 손실 될 수 있습니다. 첫째, 모든 감기 스핀 이전 솔루션을 포함 하는 단백질은 알칼리 화 된 9.0의 pH에. 이 높은 산도 제공 deprotonate 특정 아미노산은 단백질 중추, 효과적으로 충전된 상태에서 그들을 떠나 그들의 가용성을 더욱 향상에. 따라서,이 단계를 전술한 또는 단백질 해산에 대 한 충분 한 시간을 허용 하지 발생할 수 있습니다 수확량에서 감소 비 solubilized 단백질 원심 분리 동안 수송과 되며 삭제로.
마찬가지로, 대상 단백질 수 손실 뜨거운 회전 절차는 ELP는 일지도. 처음에, NaCl는 ELP의 용 해도 줄이기 위해 단백질이 풍부한 상쾌한에 추가 됩니다. 소금 수성 단계에서 분리 하기 위하여 단백질을 일으키는 단백질와 물 분자 간의 정전기 상호 작용을 보호 하는 작업. 이 효과 있는 게 엔트로피 효과 인해 더 ELPs 주변 함수의 '케이지' 분해 하 고 단백질의 집계 강제로 솔루션을가 열 하 여 증폭 됩니다. 낮은 단백질 농도에서 (즉., 첫 번째 열 사이클), 혼자 소금의 추가 종종이 단계 분리를 일으킬 충분 하지 않습니다. 그러나, 단백질의 농도 증가 (즉., 나중 열 사이클), 적은 보조 오염 물질 소금 상호 작용할 수 있다는 ELP 침전 더 쉽게 것입니다. 그 결과, 염 분을 너무 빨리 추가 하는 경우 그들은 갇혀 수 있습니다 될 물리적으로 단백질, 집계 하 여는 효과적으로 솔루션의 소금 농도 감소 하 고 더 단백질 강 수를 제한. 따라서, 소금 그들이 homogenously 솔루션 통해 배포할 충분 한 시간을 가질 수 있도록 3 개의 작은 일괄 처리에 추가 되어야 합니다. 최종 메모로 서, ELP 백본 통해 유사 더 엘라 스 틴 같은 지역의 게스트 잔류물에 대 한 수정 또는 바이오 액티브 지역 변경 LCST 동작 영향 크게 수 있습니다. 따라서, 단백질 이체에 걸쳐 최적의 단백질 수율을 보장 하기 위해, 그것은 pH, 염 농도, 및 소금 종류를 최적화 하는 중요 한 (예., 여러차례 또는 divalent) 추위와 뜨거운 회전에 대 한.
SDS 페이지 프로토콜 완료 되 면 실행 것이 좋습니다 쉽게 중요 한 ELP 손실 정화 단계 동안 발생 하는지 확인 하는 데 사용할 수 있습니다. 짧게, ELP 상쾌한 뜨거운 스핀 다음에 감지 되 면 다음 단백질은 안 되 고 효과적으로 시 켰 던. 마찬가지로, ELPs solubilized 펠 릿 감기 스핀 다음의 샘플에서 식별 하는 경우 다음 단백질은 안 되 고 효과적으로 해산.
ELP hydrogels 합성 또는 자연스럽 게 파생 된 자료를 통해 많은 이점을 제공합니다. 특히, 아민 반응 crosslinker THPC 사용 하 여 단백질 가교의 저비용, 단순 하 고 조정할 수 있는 메커니즘을 제공합니다. 그러나, 주목 해야 한다 가교 프로토콜 내에서 뚜렷한 한계가 있다. THPC 산소 민감한, 그리고 부적 절 한 조건 하에서 저장 하는 경우 그것은 신속 하 게 반응 효율에서 저하 수 있습니다. 또한, 주 아민과의 반응으로 인해 THPC 아민에서 부유한 미디어 또는 세포 표면에 있는 단백질을 주변으로 반응할 수 있습니다. 따라서, ELP hydrogels 형성 때 그것 가교 효율성에서 가능한 exogenous 단백질 분 및 따라서 감소를 셀 펠 릿으로 미디어 오염을 방지 하 고 좋습니다. 마지막으로,이 가교 메커니즘 바이오 액티브 지역 순서 없는 리 진 잔류물을 포함 하는 걸로 하 고 일부 셀 접착제 모티프의 잠재적인 통합을 따라서, 제한 (예., IKVAV34). 이러한 제한, 수정 해결 하기 위해 아 지 드와 bicyclononyne (BCN) ELP 백본 반응 파트너 앞에서 설명한27바이오 직교 가교에 대 한 수 있습니다.
그것은 ELP LCST 동작 히드로 미세 지시에 중요 한 역할을 지적 한다. LCST 이상의 온도 정권에서 ELPs 매트릭스 다공성에 영향을 줄 수 있는 단백질이 풍부한 고 단백질 결핍 단계의 형성 및 매트릭스9의 가교 효율 솔루션에서 침전. 대부분 세포 배양 실험 ELP LCST 이상의 순수 관련 온도 (~ 37 ° C)에서 실시 하는, 때문에 이러한 효과 고려 한다. 효과적으로 crosslink 및 양식 hydrogels 상호 단백질 네트워크 주 아민은 리에서 수 있어야 합니다 THPC crosslinker에 물리적으로 액세스할 수 있습니다. 있습니다 ELP 집계 충분 한 가교에 도달 하기 전에 발생 하는 경우 액세스할 수 없는 및 따라서 가교에 참여할 수 없습니다 ELPs 단백질이 풍부한 단계 안에 갇혀 있을 수 있습니다. 이 한계를 해결 하기 위해 우리의 프로토콜에는 실내 온도에, 예비 가교는 히드로의 전에 ELP의 열 단계 변화를 겪 습 수 있는 초기 15 분 가교 기간을 필요 합니다. 이 실내 온도 인큐베이션 히드로 가교 마무리를 37 ° C에서 추가로 15 분 인큐베이션 옵니다. 이 절차는 충분 한 가교와 ELP 물자의 강력 하 고 재현 가능한 겔 화에 대 한 중요 한.
결론적으로, 엘 프를 사용 하 여 조작 하는 재조합 형 단백질 hydrogels 단백질 시퀀스 및 따라서 3D 셀 microenvironment의 뛰어난 tunability를 제공 합니다. ELP 고분자 생체 외에서 그리고 vivo에서 시스템의 다양 한 쉽게 때문에 LCST 동작, 정화, 높은 수율에 표현할 수 표시 및 생체 되었습니다. 재조합 호스트 대장균 의 사용 상승 근처의 고분자 분자량과 기능의 완벽 한 제어를 제공 하는 간단 하 고 저렴 한 절차를 제공 합니다. 함께,이 기술은 강력한 tunability와 히드로 플랫폼 차원에서 세포 유형의 다양 한 문화에 대 한 수의 재현성에 대 한 수 있습니다. 마지막으로,이 ELP 히드로 플랫폼은 의무가 qRT-PCR, 서쪽 오 점, DNA 추출 및 셀 immunostaining9를 포함 하 여 많은 다운스트림 생 화 확 적인 분석 실험.
공개
저자는 공개 없다.
감사의 말
저자 감사 토니 파머와 H. 간디 (스탠포드 신경외과) 그림 4에서 murine NPCs 벡터 아트를 제공 하는 사용 하 고 크리에이 티브 커먼즈 저작자 표시 3.0 Unported 라이센스 (https://creativecommons.org/ 아래 Servier 의료 예술에서 적용 licenses/by/3.0/legalcode)입니다. 이 작품의 일부에는 스탠포드 나노 공유 시설 (SNSF), 수상 ECCS-1542152에서 국립 과학 재단에 의해 지원 되는 수행 되었다. N.A.S. 지원 국립 과학 연구소에서의 일반 의료 건강의 국가 학회 (32 GM 008412)의 인정합니다. C.M.M. 사전 박사 친목 (F31 EB020502) 그리고 Siebel 학자 프로그램 NIH NRSA에서 지원을 인정 한다. S.C.H. 재생 의학 (RT3-07948)는 건강의 국가 학회 (U19 AI116484 및 R21 EB018407), 국립 과학 재단 (DMR 1508006), 및 캘리포니아 연구소에서 지원을 인정합니다. 이 연구는 유 니스 케네디 슈 라이버 국립 연구소의 아동 건강 및 인간 발달 (NICHD), 국립 연구소에 의해 지원 되는 재생 재활 연구 및 교육 (AR3T), 얼라이언스에서 자금 지원을 받은 신경 성 질환 및 치기 (NINDS), 국립 생물 의학 이미징 및 생명 공학 (NIBIB)의 수상 번호 P2CHD086843에서 건강의 국가 학회. 내용은 전적으로 저자의 책임 이며 반드시 국립 보건원의 의견을 대표 하지 않는다.
자료
| Name | Company | Catalog Number | Comments |
| Elastin-Like Protein Expression and Purification | |||
| 10 cm Petri Dishes | Thermo Fisher Scientific | FB0875713 | |
| 70% Ethanol | RICCA Chemical | 2546.70-1 | |
| Ammonium Sulfate | Sigma-Aldrich | A3920-500G | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25G | |
| Bacto Agar | Thermo Fisher Scientific | 9002-18-0 | |
| BL21(DE3)pLysS Competent Cells | Invitrogen | C606003 | |
| Chloramphenicol | Amresco | 0230-100G | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| EDTA disodium salt, dihydrate | Thermo Fisher Scientific | O2793-500 | |
| Glycerol | Thermo Fisher Scientific | BP229-4 | |
| Isopropanol | Thermo Fisher Scientific | A451-4 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | BP1755-10G | |
| Luria Broth | EMD Millipore | 1.10285.5007 | |
| Parafilm | VWR | 52858-000 | |
| Phenylmethanesulfonyl fluoride (PMSF) | MP Biomedicals | 195381 | |
| Sodium Chloride | Thermo Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Sigma-Aldrich | S 8045-1KG | |
| Syringe Filter Unit (0.22 μm) | Millipore | SLGP033RB | |
| Terrific Broth | Millipore | 71754-4 | |
| Tris Base | Thermo Fisher Scientific | BP152-1 | |
| Cell Encapsulation in 3D ELP Hydrogels | |||
| 0.22 μm syringe filters | Millipore | SLGV004SL | |
| 0.5 mm thick silicone sheet | Electron Microscopy Science | 70338-05 | |
| 24-well tissue culture plates | Corning | 353047 | |
| Disposable Biopsy Punch (2 mm) | Integra Miltex | 33-31 | |
| Disposable Biopsy Punch (4 mm) | Integra Miltex | 33-34 | |
| Disposable Biopsy Punch (5 mm) | Integra Miltex | 33-35 | |
| Dulbecco’s phosphate buffered saline (DPBS) | Corning | 21-031-CM | |
| No. 1 12 mm glass coverslips | Thermo Fisher Scientific | 12-545-80 | |
| Tetrakis(hydroxymethyl)phosphonium chloride (THPC) | Sigma-Aldrich | 404861-100ML | |
| 0.5% Tryspin/EDTA | Thermo Fisher | 15400054 | |
| Immunocytochemistry of Cells in 3D ELP Hydrogels | |||
| 16% (w/v) Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15701 | |
| Bovine Serum Albumin (BSA) | Roche | 3116956001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Donkey Serum | Lampire Biological Labs | 7332100 | |
| Goat anti-mouse Secondary Antibody (AF488) | Molecular Probes | A-11017 | |
| Goat anti-rabbit Secondary Antibody (AF546) | Molecular Probes | A-11071 | |
| Goat Serum | Gibco | 16210-072 | |
| Mouse Nestin Primary Antibody | BD Pharmingen | 556309 | |
| Mouse Sox2 Primary Antibody | Cell Signaling Technology | 23064S | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Vectashield Hardset Mounting Medium | Vector Labs | H-1400 |
참고문헌
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294 (5547), 1708-1712 (2001).
- Birgersdotter, A., Sandberg, R., Ernberg, I. Gene expression perturbation in vitro-A growing case for three-dimensional (3D) culture systems. Seminars in Cancer Biology. 15 (5), 405-412 (2005).
- Gómez-Lechón, M. J., et al. Long-term expression of differentiated functions in hepatocytes cultured in three-dimensional collagen matrix. Journal of Cellular Physiology. 177 (4), 553-562 (1998).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Justice, B. A., Badr, N. A., Felder, R. A. 3D cell culture opens new dimensions in cell-based assays. Drug Discovery Today. 14 (1-2), 102-107 (2009).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Madl, C. M., et al. Maintenance of neural progenitor cell stemness in 3D hydrogels requires matrix remodelling. Nature Materials. 16 (12), 1233-1242 (2017).
- Discher, D. E., Janmey, P., Wang, Y. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Sun, Y., Villa-Diaz, L. G., Lam, R. H. W., Chen, W., Krebsbach, P. H., Fu, J. Mechanics Regulates Fate Decisions of Human Embryonic Stem Cells. PLoS ONE. 7 (5), e37178(2012).
- Ehrbar, M., et al. Elucidating the Role of Matrix Stiffness in 3D Cell Migration and Remodeling. Biophysical Journal. 100 (2), 284-293 (2011).
- Rowlands, A. S., George, P. A., Cooper-White, J. J. Directing osteogenic and myogenic differentiation of MSCs: interplay of stiffness and adhesive ligand presentation. American Journal of Physiology - Cell Physiology. 295 (4), 1037-1044 (2008).
- Lampe, K. J., Antaris, A. L., Heilshorn, S. C. Design of three-dimensional engineered protein hydrogels for tailored control of neurite growth. Acta Biomaterialia. 9 (3), 5590-5599 (2013).
- Kilian, K. A., Mrksich, M. Directing Stem Cell Fate by Controlling the Affinity and Density of Ligand-Receptor Interactions at the Biomaterials Interface. Angewandte Chemie International Edition. 51 (20), 4891-4895 (2012).
- Tse, J. R., Engler, A. J. Preparation of Hydrogel Substrates with Tunable Mechanical Properties. Current Protocols in Cell Biology. , 10.16.1-10.16.16 (2010).
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: A complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- DiMarco, R. L., Heilshorn, S. C. Multifunctional Materials through Modular Protein Engineering. Advanced Materials. 24 (29), 3923-3940 (2012).
- Meyer, D. E., Chilkoti, A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nature Biotechnology. 17 (11), 1112-1115 (1999).
- Aladini, F., Araman, C., Becker, C. F. W. Chemical synthesis and characterization of elastin-like polypeptides (ELPs) with variable guest residues. Journal of Peptide Science. 22 (5), 334-342 (2016).
- McMillan, R. A., Caran, K. L., Apkarian, R. P., Conticello, V. P. High-Resolution Topographic Imaging of Environmentally Responsive, Elastin-Mimetic Hydrogels. Macromolecules. 32 (26), 9067-9070 (1999).
- McMillan, R. A., Conticello, V. P. Synthesis and Characterization of Elastin-Mimetic Protein Gels Derived from a Well-Defined Polypeptide Precursor. Macromolecules. 33 (13), 4809-4821 (2000).
- Chung, C., Lampe, K. J., Heilshorn, S. C. Tetrakis(hydroxymethyl) Phosphonium Chloride as a Covalent Cross-Linking Agent for Cell Encapsulation within Protein-Based Hydrogels. Biomacromolecules. 13 (12), 3912-3916 (2012).
- Romano, N. H., Madl, C. M., Heilshorn, S. C. Matrix RGD ligand density and L1CAM-mediated Schwann cell interactions synergistically enhance neurite outgrowth. Acta Biomaterialia. 11, 48-57 (2015).
- Shah, M., Hsueh, P. Y., Sun, G., Chang, H. Y., Janib, S. M., MacKay, J. A. Biodegradation of elastin-like polypeptide nanoparticles. Protein Science. 21 (6), 743-750 (2012).
- Nettles, D. L., Chilkoti, A., Setton, L. A. Applications of elastin-like polypeptides in tissue engineering. Advanced Drug Delivery Reviews. 62 (15), 1479-1485 (2010).
- Madl, C. M., Heilshorn, S. C. Tyrosine-Selective Functionalization for Bio-Orthogonal Cross-Linking of Engineered Protein Hydrogels. Bioconjugate Chemistry. 28 (3), 724-730 (2017).
- Zhu, D., Wang, H., Trinh, P., Heilshorn, S. C., Yang, F. Elastin-like protein-hyaluronic acid (ELP-HA) hydrogels with decoupled mechanical and biochemical cues for cartilage regeneration. Biomaterials. , 132-140 (2017).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Bio-Orthogonally Crosslinked, Engineered Protein Hydrogels with Tunable Mechanics and Biochemistry for Cell Encapsulation. Advanced Functional Materials. 26 (21), 3612-3620 (2016).
- Cai, L., Dinh, C. B., Heilshorn, S. C. One-pot synthesis of elastin-like polypeptide hydrogels with grafted VEGF-mimetic peptides. Biomater Sci. 2 (5), 757-765 (2014).
- Straley, K. S., Heilshorn, S. C. Independent tuning of multiple biomaterial properties using protein engineering. Soft Matter. 5 (1), 114-124 (2009).
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current Opinion in Biotechnology. 10 (5), 411-421 (1999).
- Graumann, K., Premstaller, A. Manufacturing of recombinant therapeutic proteins in microbial systems. Biotechnology Journal. 1 (2), 164-186 (2006).
- Tashiro, K., et al. A Synthetic Peptide Containing the IKVAV Sequence from the A Chain of Laminin Mediates Cell Attachment, Migration, and Neurite Outgrowth. Journal of Biological Chemistry. 264 (27), 16174-16182 (1989).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유