Method Article
Produção de elastina, como proteína hidrogel para encapsulamento e imunocoloração de células em 3D
Neste Artigo
Resumo
Hidrogel engenharia de proteínas recombinantes é vantajosos para cultura celular 3D, já que permitem completo pré-definido a espinha dorsal do polímero e, portanto, o microambiente celular. Aqui, descrevemos o processo de purificação de proteínas recombinantes de elastina, como e sua aplicação no encapsulamento de célula de hidrogel 3D.
Resumo
Bidimensional (2D) cultura do tecido técnicas têm sido essenciais para o nosso entendimento da biologia das células fundamentais. No entanto, a falta de sistemas de cultura de tecido tradicional 2D uma matriz tridimensional de (3D), resultando em um significativo desconexão entre resultados coletados in vitro e in vivo. Para resolver essa limitação, os pesquisadores têm engenharia plataformas de cultura de tecidos de hidrogel 3D que podem imitar as propriedades bioquímicas e biofísicas do microambiente celular na vivo . Esta pesquisa tem motivado a necessidade de desenvolver materiais plataformas que oferecem suporte a 3D celular encapsulamento e ensaios bioquímicos a jusante. Engenharia de proteínas recombinantes oferece um único conjunto de ferramentas para design material de hidrogel 3D e desenvolvimento, permitindo o controle específico da sequência da proteína e, portanto, por extensão, as propriedades mecânicas e bioquímicas potenciais a resultante matriz. Aqui, apresentamos um protocolo para a expressão de recombinantes derivados como elastina proteína (ELP), que pode ser usado de forma hidrogel com propriedades mecânicas independentemente ajustáveis e concentração de ligante de célula-adesivo. Ainda mais, apresentamos uma metodologia para encapsulamento de célula dentro de hidrogel ELP e coloração imunofluorescente subsequentes de embutidos células para análise a jusante e quantificação.
Introdução
Durante o século passado, cultura de tecidos bidimensional (2D) desenvolveu-se em um conjunto de ferramentas integral para estudar a célula fundamental biologia em vitro. Além disso, os protocolos relativamente barata e simples para cultura de células 2D conduziram a sua adopção em muitas disciplinas biológicas e médicas. No entanto, passado pesquisa tem mostrado que as plataformas 2D tradicionais podem levar a resultados que desviam acentuadamente aqueles recolhidos na vivo, causando o tempo precioso e financiamento desperdiçaram para pesquisa clinicamente orientada1,2, 3. Nós e os outros a hipótese que esta discrepância pode ser atribuída à falta de pistas de bioquímicas e biofísicas nativas fornecido para as células cultivadas em superfícies 2D, que podem ser necessárias para ideal proliferação e maturação dos vários tipos de células.
Para resolver essas limitações e ajuda ponte a lacuna entre 2D estudos in vitro e in vivo , os pesquisadores têm desenvolvido tridimensional (3D) hidrogel plataformas para celular-encapsulamento1,4,5 ,6. Hidrogel é materiais ideais para recapitular o microambiente endógeno da matriz extracelular (ECM) na vivo devido a suas propriedades mecânicas, como tecido e água-inchada estrutura que permite o transporte rápido de nutrientes e sinalização de fatores7,8. Além disso, 3D hidrogel pode ser projetado para ter controle independente sobre as propriedades mecânicas e bioquímicas do cadafalso. Tanto matriz mecânica9,10,11,12 e célula-adesivo ligantes13,14,15 são bem conhecidos para influenciar a célula comportamento em vitro e in vivo. Assim, 3D hidrogel com propriedades ajustáveis oferece uma plataforma para estudar as relações causais entre as células e seu microambiente. Critérios para uma matriz de hidrogel 3D ideal incluem simples, não citotóxicas célula-encapsulamento bem como pré-definido independente das propriedades mecânicas fisiologicamente relevantes e imita de motivos de célula-adesivo nativos.
Ambos sintético (EG., polietilenoglicol, ácido polilático, poli (ácido glicólico)) e naturalmente derivados (ex., alginato, colágeno, Matrigel) hidrogel têm vantagens sobre 2D em vitro plataformas de cultura; no entanto, eles também têm deficiências significativas que limitam a sua aplicabilidade. Primeiro, muitas plataformas sintéticas e naturalmente derivados exigem reticulação duras condições que podem ser potencialmente tóxicas para as células dos mamíferos, levando à diminuição de viabilidade celular7. Além disso, muitas plataformas sintéticas faltam Bioatividade nativa e precisam ser acrescida através de reações químicas secundárias, que podem adicionar o aumento de custo e complexidade16. Finalmente, enquanto materiais naturalmente derivados normalmente contêm domínios de bio-ativos intrínsecos, eles muitas vezes são atormentados pela alta variabilidade para lotes e muitas vezes limitam-se à formação de géis relativamente fraco7,17.
Engenharia de proteína recombinante apresenta um único conjunto de ferramentas para design de materiais, permitindo o controle explícito sobre a sequência da proteína e, por extensão, as propriedades mecânicas e bioquímicas potenciais de hidrogel o final do andaime18. Além disso, aproveitando as máquinas biológicas conhecidas de Escherichia coli (e. coli) que expressam proteínas, materiais podem ser produzidos a custos reduzidos e consistentemente com variabilidade limitada intere intralote. A elastina, como proteína (ELP) apresentada aqui tem três domínios de engenharia: (1) uma tag T7 e His6 que permite através de rotulagem fluorescente etiquetado anticorpos, (2) uma região 'elastina-like' que confere propriedades mecânicas elásticas e permite a química reticulação e (3) uma região 'bio-ativos' que codifica para celular-adesivo motivos.
Nossa região de elastina, como se baseia a sequência canônica de elastina5 (Val-Pro-Gly-Xaa-Gly) onde quatro do 'Xaa' sites de aminoácidos são isoleucina (Ile), mas podem ser projetado para ser qualquer aminoácido excepto prolina. Esta sequência dota ELPs recombinantes com comportamento de temperatura (LCST) solução crítica inferior que pode ser explorada para pós-expressão de purificação simples via térmica ciclismo19,20. Esta propriedade LCST pode ser ajustada para termicamente agregadas em diferentes temperaturas, modificando os comentários 'Xaa' resíduo21,22.
Aqui, a posição de 'Xaa' em uma das cinco repetições elastina-como foi substituída com o amina-apresentando lisina (Lys) aminoácido, que é utilizado para reticulação de hidrogel. Nosso trabalho anterior demonstrou não citotóxicas e robusto ligando via reação com a amina reativos crosslinker tetrakis (hidroximetil) do phosphonium cloreto (THPC)23. Pela variação total concentração da proteína conteúdo e agente reticulante, somos capazes de produzir hidrogel que pode ser ajustados para abranger uma rigidez fisiologicamente relevantes gama (~0.5-50 kPa)9,23,24. Além do ajuste de propriedades mecânicas, aderência de célula dentro o hidrogel resulta da integração dos domínios de célula-adesivo canônicas dentro a espinha dorsal da proteína ELP. Por exemplo, a incorporação da sequência de aminoácidos de 'RGDS' derivado de fibronectina estendida permite a aderência de célula e flexibilidade conformacional, enquanto os ovos mexidos, variante de 'RDGS' não-vinculativa restringe de adesão célula-matriz24. Modulando a proporção de células-adesivo para proteínas não adesivas, bem como a concentração de proteínas totais, somos capazes de produzir efetivamente hidrogel que abrangem uma vasta gama de concentração de ligante. Resultantly, desenvolvemos uma plataforma de hidrogel com propriedades bioquímicas e biofísicas dissociadas, que pode ser ajustado independentemente para cultura 3D ideal de vários tipos de células.
Além de matriz de rigidez e pré-definido de ligante adesivo, hidrogel recombinante oferece a capacidade de perfis de degradação material específico do projeto, que é necessária para a célula se espalhando, proliferação e migração dentro de um contexto 3D4 , 9. esta degradação é conferida pela secreção da célula de proteases que visam especificamente o estendido 'RGDS'9 ou sequência elastina25. Hidrogel ELP também foram mostrados para suportar os ensaios bioquímicos subsequentes que são necessários para o estudo de viabilidade celular e função incluindo imunocitoquímica, bem como a extração de DNA/RNA/proteína para reversa quantitativa reação em cadeia da polimerase-transcrição (qRT-PCR) e Western blot-9. Variantes do ELP também têm sido usadas em um número de modelos na vivo e são conhecidas por ser bem tolerada pelo sistema imunológico26.
Tomados em conjunto, ELP como uma plataforma de material para estudos de célula-encapsulamento possui uma ampla variedade de benefícios em comparação com plataformas materiais sintéticas ou natural-derivado, que muitas vezes não têm o mesmo grau de bioquímico e biofísico pré-definido e reprodutibilidade. Além disso, não citotóxicas uma do ELP utilização simples e com uma grande variedade de tipos de células (por exemplo., garota raiz dorsal gânglio14,24, murino progenitoras neurais células9, tronco mesenquimal humano células27, bovinos condrócitos neonatal28, humanos endoteliais células29,30) permite a um modelo mais fisiologicamente relevante de ECM 3D endógena em comparação com a cultura de pilha 2D. Neste documento, apresentamos um protocolo para a expressão de recombinantes derivados, encapsulamento de células ELPs para o uso como uma plataforma de hidrogel ajustáveis para 3D. Ainda mais, apresentamos a metodologia para a rotulagem fluorescente de jusante e microscopia confocal de células encapsuladas.
Protocolo
1. ELP expressão protocolo
- Dia 1: Crescimento da colônia de acionador de partida
- Prepare as placas de agar ampicilina e cloranfenicol por autoclavagem 25g de Luria caldo e 15 g de ágar-ágar por 1 L de água ultrapura. Uma vez que a solução tiver arrefecido até ~ 60 ° C, adicionar 1 mL de estoque ampicilina (100 mg/mL em água ultrapura) e 1 mL de caldo de cloranfenicol (34 mg/mL em etanol a 70%) para 1 L de solução de ágar para concentrações finais de 100 µ g/mL e 34 µ g/mL , respectivamente. Transferir 20 mL da solução final para pratos de Petri de 10 cm com uma pipeta sorológica e permitir que o agar para solidificar. Enrole os pratos de Petri com parafilm e em 4 ° C.
Nota: pratos de Petri podem ser armazenados a 4 ° C por até duas semanas. - Marcam uma pequena amostra do BL21 (DE3) pLysS Escherichia coli de um estoque de bactérias pre-feito que contém um vetor de pET15b codificação o ELP de juros sobre uma placa de ágar de ampicilina e cloranfenicol.
Nota: A ampicilina e o cloranfenicol selecionar para as bactérias que contêm vetores de ambos os pET15b e pLysS, respectivamente. - Coloque a placa de listras de cabeça para baixo em uma incubadora a 37 ° C. Permitir que as colônias bacterianas crescer durante a noite.
Nota: Não Incube as placas por mais de 16 h como ampicilina degradará e podem formar colônias que não sejam portadores de resistência à ampicilina.
- Prepare as placas de agar ampicilina e cloranfenicol por autoclavagem 25g de Luria caldo e 15 g de ágar-ágar por 1 L de água ultrapura. Uma vez que a solução tiver arrefecido até ~ 60 ° C, adicionar 1 mL de estoque ampicilina (100 mg/mL em água ultrapura) e 1 mL de caldo de cloranfenicol (34 mg/mL em etanol a 70%) para 1 L de solução de ágar para concentrações finais de 100 µ g/mL e 34 µ g/mL , respectivamente. Transferir 20 mL da solução final para pratos de Petri de 10 cm com uma pipeta sorológica e permitir que o agar para solidificar. Enrole os pratos de Petri com parafilm e em 4 ° C.
- Dia 2: Preparação dos meios de cultura e expressão do acionador de partida
- Remova a cultura de Escherichia coli da incubadora. Parafilm a placa e armazenamento para um máximo de 4 dias a 4 ° C.
- Prepare um frasco de cultura starter (250 mL) e frascos de cultura de expressão (12 x 1 L) e autoclave. Para 1 L de meios de expressão, adicionar 47,6 g de caldo fantástico e 4 mL de glicerol para 1 L de água ultrapura em um frasco de cultura perplexo 2L e tampa com folha de alumínio.
Nota: Rendimentos típicos são proteínas de 60-100 mg/L de meios de expressão. - Carregar o acionador de partida autoclavado em pré-aquecido, 37 ° C e agitação incubadora e incubar sem agitação.
- Adicione 250 µ l de filtrado estéril estoque de ampicilina (filtro de 0,22 µm) (100 mg/mL em água ultrapura) para a cultura do acionador de partida para uma concentração final de 100 µ g/mL. Começa imediatamente agitando a cultura starter a 250 rpm.
Nota: Cloranfenicol é usado somente para a seleção de colônia em placas de ágar e não está incluído para culturas líquidas. - Inocular a cultura starter adicionando uma única ELP plasmídeo contendo Escherichia coli colônia da placa de listras e permitir que a cultura do acionador de partida agitar a 37 ° C durante 16 h.
- Coloque o meio de cultura de expressão frascos em pré aquecidos, 37 ° C, agitando incubadoras e incubar durante uma noite sem a agitação para que os balões estão prontos para inocular na manhã seguinte.
- Dia 3: Indução de expressão da proteína em e. coli
- Fazer estoque fresco, estéril-filtrado ampicilina (100 mg/mL em água ultrapura). Adicione 1 mL de caldo de ampicilina para cada balão de mídia de expressão para uma concentração final de 100 µ g/mL.
- Começa a agitar os meios de expressão a 250 rpm.
- Colher uma amostra de 2 mL dos meios de comunicação de qualquer frasco de expressão e adicionar a uma cubeta como um espaço em branco para uma densidade óptica de leitura em 600 nm (OD600).
- Após a conclusão de incubação de cultura starter 16 h, inocule cada frasco de expressão através da transferência de 20 mL da cultura starter para cada balão de expressão através de uma pipeta sorológica.
- Após a conclusão da agitação de 1h, medir o OD600 de um dos frascos a expressão. Após esta etapa, medir o OD600 cada 20 min, verificando um balão diferente cada vez.
- Em um OD de600 de 0,6, reduzir a temperatura dos shakers contendo os frascos de expressão a 32 ° C.
- Verifique o OD600 cada 10 min. Em um OD de600 de 0,8, induzi a expressão, adicionando 1 mL de 1 M, β-isopropílico filtrado estéril thiogalactoside (IPTG) em água ultrapura para cada balão de expressão.
- Permitir que a e. coli em frascos de expressão expressar para 7 h.
- 20 min antes do final da expressão, pre-cool uma centrífuga grande andar a 4 ° C.
- Colete todos os 12 L dos meios de expressão em equilíbrio e recipientes individuais centrífuga.
- Centrifugue os meios de expressão em > 12.000 x g por 15 min a 4 ° C, utilizando uma centrífuga de chão.
- Decantar o sobrenadante de cada recipiente de centrífuga. Usando uma espátula, colete as pelotas de célula em um saco de fechamento do fecho de correr pré-pesados.
- Ressuspender o pellet em buffer dez estéril filtrada (100 mL de tampão por 25 g de pelota) e remover quaisquer bolhas de ar em excesso massageando a pelota. Para 1 L de tampão de dez, adicione 5,8 g de cloreto de sódio, 1,21 g de tris base e 0,37 g de etilenodiamina tetraacetic acid (EDTA) dissódico sal di-hidratado a 900 mL de água ultrapura. Ajustar o pH para 8,0 e trazer para 1 L. Para esta etapa, as tiras de pH são suficientes.
- Coloque o saco zip-lock, contendo o centrifugado re-suspenso em um recipiente secundário e congelar a-80 ° C durante a noite.
- Dia 4-6: romper a parede celular bacteriana através de ciclos de gelo-degelo
- Retire a pelota congelada do freezer e deixe descongelar lentamente a 4 ° C com agitação suave, utilizando um agitador orbital.
- Permita a pelota descongelar até algum líquido está presente. Adicionar ~ 30-40 mg de desoxirribonuclease I (DNase) descongelados lisado. Além disso, adicione 1 mL de fluoreto de fenilmetilsulfonil 100mm (PMSF; um inibidor de protease) em isopropanol por 100 mL de lisado celular. Permita o lisado agitar a noite.
Nota: Adicionar o DNase e PMSF só é necessário para o primeiro ciclo de congelamento e descongelamento.
Cuidado: PMSF é tóxico se inalado. Uma máscara de rosto deve ser usada quando estiver manipulando o pó PMSF. - Uma vez que o lisado celular é completamente derretido, congele o lisado a-80 ° C durante a noite, ou até completamente congelado.
- Repita o procedimento de congelamento-descongelamento para um total de três ciclos. Deixe o lisado descongelado a 4 ° C, após o último congelamento e descongelamento. Armazene 100 µ l de matérias-primas lisado para análise de eletroforese (SDS-PAGE) de gel de sódio Dodecil sulfato de sódio-poliacrilamida na conclusão da purificação.
- Após o último degelo, ajuste o pH do descongeladas lisado a 9.0 usando 1 M de NaOH. Para esta etapa, as tiras de pH são suficientes. Incubar a 4 ° C, durante pelo menos 1 h (durante a noite é apropriado) em um agitador orbital.
- Dia 7-9: purificação do ELP através de rotação de quente e fria de ciclagem térmica
- Legal o centrifugador de andar a 4 ° C 20 min antes da centrifugação.
- Alíquota e equilíbrio o descongeladas lisado em recipientes de centrífuga.
- Centrifugar as amostras em > 15.000 x g durante 1 h a 4 ° C. Armazene 100 µ l do sobrenadante para análise de SDS-PAGE após a conclusão da purificação.
Nota: Após a centrifugação, a proteína do ELP deve permanecer no sobrenadante devido a sua alta solubilidade em água em temperaturas abaixo de sua LCST (< 32 ° C). - Transferir o sobrenadante para novos recipientes de centrífuga e equilibrar adequadamente.
- Adicione cloreto de sódio (NaCl) em três partes para uma concentração final de 1 M (5,84 g de NaCl para cada 100 mL do sobrenadante). Certifique-se de que o NaCl é adicionada em três partes para permitir a dissolução suficiente.
- Agite durante 3 h a 37 ° C a 250 rpm numa incubadora de agitação.
- 1 h antes do fim da agitação, pré-aquecer uma centrífuga de andar a 37 ° C.
- Centrifugar a > 15.000 x g durante 1 h a 37 ° C. Armazenar 100 µ l do sobrenadante para análise de SDS-PAGE após a conclusão da purificação e descartar o sobrenadante restante.
Nota: Após a centrifugação, a proteína do ELP deve ser peletizada devido a sua baixa solubilidade em água a temperaturas acima de sua LCST (> 32 ° C). - Ressuspender o sedimento, adicionando 10 mL de água ultrapura, autoclavada por 1 g de pelota. Use uma espátula de metal para esmagar a pelota para auxiliar na dissolução da proteína.
- Ajuste o pH do descongeladas lisado a 9.0 usando 1 M de NaOH. Para esta etapa, as tiras de pH são suficientes.
- Agite durante a noite a 4 ° C em um agitador orbital.
- Repita o procedimento de ciclagem térmica rotação fria e quente para um total de três ciclos (i. e., repita as etapas 1.5.1 através de 1.5.11 para três ciclos totais).
- Dia 10-15: ELP diálise e liofilização
- Centrifugue a pelota re-suspensa em uma centrífuga previamente refrigerada em > 15.000 x g durante 1 h a 4 ° C. Armazene 100 µ l do sobrenadante para análise de SDS-PAGE após a conclusão da purificação.
- Do desalt solução da proteína por dializando o sobrenadante restante em uma membrana de diálise 3.5 kDa contra 4 L de água ultrapura pre-refrigerada a 4 ° C. Mude a água de diálise duas vezes por dia para um total de 6 vezes por 3 dias.
Nota: Os volumes de sobrenadante típicos são entre 5 e 30 mL. - Centrifugue a solução dializada em um pre-cooled centrifugar > 15.000 x g durante 1 h a 4 ° C. Armazene 100 µ l do sobrenadante para análise de SDS-PAGE no final da purificação.
- Congele o resultante sobrenadante a-80 ° C em tubos cónicos pré-pesados.
- Lyophilize a solução congelada por 3 dias e a massa do produto final para determinar o rendimento de proteína.
- Parafilm os tubos contendo o final liofilizado produto ELP e loja a 4 ° C.
- Execute SDS-PAGE para determinar a pureza da proteína.
Nota: Os protocolos para SDS-PAGE irão variar com base nas condições de gel de agarose específicos. Para nossas experiências, proteína liofilizada final foi dissolvida a uma concentração de 0,5 mg/mL em água desionizada e executar a 140 V para 70-100 min em um gel do acrilamido de 12% (p/v) sob condições de desnaturação.
2. célula encapsulamento em 3D como elastina proteína hidrogel
- Preparação de moldes de silicone
- Use um soco de biópsia com o diâmetro desejado para criar furos em uma folha de silicone espessura de 0.5 mm e cortar um quadrado ao redor de cada buraco. Repita para o número de moldes desejado.
Nota: O diâmetro e a espessura dos moldes podem ser ajustados para o aplicativo específico e condições de cultura celular. Na prática, para culturas de células de 50 106 células/mL, 0,5 mm espessura moldes com diâmetros de 5 mm e 4 mm são recomendados para DNA/RNA suficiente e extração da proteína, respectivamente. Para imunocoloração, um soco de biópsia de 2 mm pode ser usado em vez disso, criar três furos adjacentes por molde quadrado para que três repetições podem ser manchadas por bem. - Remova o envoltório de plástico em cada lado do molde individual com uma pinça.
Nota: Evite o contacto com a superfície exposta do silicone como plasma futura ligação eficiência pode diminuir a contaminação. - Usando uma pinça, organize o mesmo número de moldes de silicone nua e lamelas de vidro (n º 1, 12 mm de diâmetro) em linhas na pálpebra invertida de uma placa de 48 alternadas. Depois de concluído, cobrir a tampa da placa de 48-bem para evitar a contaminação.
- Plasma de oxigênio tratar a tampa toda placa 48 (i. e., moldes e lâminas de vidro). Imediatamente após, use fórceps para inverter o molde de silicone no sentido do lamela de vidro adjacente. Pressione firmemente sobre o molde para garantir a ligação. Deixe os moldes incubar a temperatura ambiente durante 1 h.
Nota: A duração do tratamento de plasma de oxigênio irá variar dependendo do instrumento utilizado. As condições típicas para o nosso instrumento são uma janela operacionais de pressão de gás entre 0,3-4 mbar, fluxo de gás oxigênio em 20 cm3/min e exposição da amostra de plasma para 10-20 s. - Esterilize os moldes em autoclave. Armazene os moldes à temperatura ambiente em um ambiente estéril até o uso.
Nota: Os moldes podem ser armazenados nesta fase indefinidamente.
- Use um soco de biópsia com o diâmetro desejado para criar furos em uma folha de silicone espessura de 0.5 mm e cortar um quadrado ao redor de cada buraco. Repita para o número de moldes desejado.
- Preparação da solução estoque de elastina, como proteína
- Remova o ELP liofilizado de armazenamento de 4 ° C. Aquecer a proteína à temperatura ambiente antes de abrir o tubo para garantir que nenhuma condensação baseia-se na proteína sobre uso repetido.
- Dissolver o ELP em fosfato salino de Dulbecco (DPBS) a 4 ° C, com agitação constante (i. e., girando) durante a noite.
Nota: A concentração da solução estoque ELP será diluída ainda mais com a adição da solução de agente reticulante na proporção volumétrica de definido pelo usuário. Por exemplo, para uma concentração final de ELP 3% (p/v), prepare uma solução de stock de ELP de 3,75% (p/v) que será diluída na proporção volumétrica de 4:1 de solução de solução: crosslinker ELP. Ajuste a concentração como necessárias para a aplicação desejada. - Filtro estéril solução estoque ELP, usando um filtro de seringa 0,22 µm. Armazenar o ELP no gelo quando não estiver em uso.
- A gabinete de segurança biológica, transferi os moldes estéreis, usando uma pinça estéril para uma placa de cultura de tecidos de 24-bem.
- Preparação da solução-mãe THPC
- Dilua THPC em DPBS antes de usar. Ajuste a concentração da solução THPC de acordo com a concentração final de ELP e relação de reticulação desejado.
Nota: Para o protocolo, uma concentração final de ELP de 3% (p/v) será feita através da mistura de solução-mãe ELP com a solução THPC na proporção volumétrica de 1:4. Ajuste conforme necessário. - Adicionem 997.4 µ l de DPBS 2,6 µ l de solução THPC (80% em água).
Nota: Esta concentração de THPC corresponde a uma relação estequiométrica 1:1 de grupos metil hidroxi na THPC e aminas primárias na proteína ELP quando a combinação de soluções para a relação volumétrica de 4:1 descrita para um hidrogel ELP final 3% (p/v). A solução THPC é viscosa e gotas de solução podem ficar ao lado da ponta da pipeta. Para concentrações exatas, evite tais gotículas quando diluir em DPBS. Limpe o recipiente de estoque THPC com gás de nitrogênio para evitar a oxidação da fosfina e inactivação do agente reticulante. - A solução para misturar e manter-se no gelo de vórtice.
- Filtro estéril o THPC estoque solução usando um filtro de seringa 0,22 µm. Diluir a THPC solução estoque ainda mais com DPBS estéril para atingir proporções de reticulação estequiométrica inferiores (ex., 0.5:1 ou 0.75:1).
Nota: THPC é sensíveis ao oxigênio, e a solução diluída deve ser usada dentro de algumas horas após o preparo.
- Dilua THPC em DPBS antes de usar. Ajuste a concentração da solução THPC de acordo com a concentração final de ELP e relação de reticulação desejado.
- Dissociar as células de incubação com Trypsin-EDTA em uma suspensão de célula única, as células de pelotas e contar as células re-suspendidas em meio usando um hemocytometer.
Nota: Protocolos exatos para esta etapa dependerá fortemente tipo celular desejado e aplicação. Para as células progenitoras neurais utilizadas ao longo do presente protocolo, realizou-se uma incubação de Trypsin-EDTA de 0.025% à temperatura ambiente por 1,5 min. As células foram peletizadas a 200 x g por 2 min. A viabilidade celular aumentada, as células devem ser suspensas em condições normais de médio. Densidades de célula típica usadas para intervalo de encapsulamento de células de 1-50 de 106 células/mL de volume final de hidrogel. Ajuste conforme necessário. - O número desejado de células para um tubo de centrifugação estéril 1,5 mL de alíquota.
- Centrifugar as células a ~ 200 x g durante 3 min. com cuidado, aspirar o sobrenadante e manter o centrifugado no gelo.
Nota: É fundamental para aspirar completamente todo o sobrenadante para atenuar a diluição mais do agente reticulante ELP e THPC. Velocidades de centrifugação específico variará com o tipo de célula. - Ressuspender o centrifugado na solução estoque ELP, tal que o volume é de 80% do volume final (supondo uma proporção de 4:1 de solução de solução: THPC ELP). Pipetar mistura 20 - 25 vezes para produzir uma mistura homogênea das pilhas e do ELP.
Nota: Evite segurando a parte inferior do tubo para atenuar o aumento da temperatura e transição de fase posterior do ELP. Cada molde de 2 mm, com três repetições requer 7,5 µ l de volume final (IE., 6 µ l de solução-mãe de ELP e 1,5 µ l de solução-mãe THPC) dividido igualmente os 3 furos (IE., 2,5 volume final µ l por furo). Para os moldes de mm 4 e 5, um volume final de 7,5 µ l e 15,5 µ l é necessário, respectivamente. - Adicione THPC de solução para a suspensão de célula/ELP para o volume final de 20% restantes. Pipetar mistura 20 - 25 vezes para produzir uma mistura homogênea.
- Imediatamente, pipete os volumes correspondentes de finais de célula/ELP/THPC mistura para cada molde por um movimento circular. Repita para todos os moldes.
- Incube as amostras à temperatura ambiente por 15 min, seguido por uma adicional incubação a 37 ° C por 15 min.
Nota: O primeiro período de incubação vai ajudar a facilitar a reticulação inicial do hidrogel antes de aumento da temperatura a que acima LCST do ELP e induzindo sua segregação térmica fase. - Adicione lentamente 750 µ l de meio de cultura celular quente a cada poço da placa de 24 poços, evitando perturbar os géis.
- Incube o hidrogel a 37 ° C por 7 dias.
Nota: Total médio alterações são recomendadas a cada 1-2 dias dependendo do tipo de célula. Para limitar a pressão sobre o gel, use um copo pipeta Pasteur afixada com uma ponta de pipeta 200 µ l quando aspirar médio do poço.
3. imunocitoquímica de células em 3D ELP hidrogel
- Prepare a solução de fixação misturando paraformaldeído de 16% (p/v) de 10 mL (PFA) em 30 ml de DPBS. Aquecer a solução a 37 ° C.
- Aspire o meio da placa de 24 poços e lave delicadamente com 1 mL de DPBS.
- Adicione 750 µ l da solução de fixação a cada poço e incubar a 37 ° C por 30 min. Não use a incubadora de cultura de tecidos para evitar a contaminação de outras culturas com vapor de PFA.
- Aspire cuidadosamente com a solução de fixação de cada poço, descartando o PFA para um recipiente adequado de resíduos perigosos.
Atenção: A exposição a PFA pode causar irritação cutânea e ocular. Use óculos de segurança/luvas e trabalhar em uma coifa de química. - Adicione 1 mL de DPBS para cada amostra. Imediatamente, Aspire o DPBS e descartar em recipiente de resíduos de PFA.
- Lave as amostras duas vezes com 1 mL de DPBS por 10 min cada.
Nota: As amostras podem ser armazenadas em DPBS a 4 ° C por até uma semana após a selagem da placa com parafilme. - Permeabilize cada amostra com 750 µ l de solução de permeabilização (100 mL de DPBS e 0,25 mL de Triton X-100; PBST) por 1h à temperatura ambiente em um roqueiro a 15 rpm.
- Aspirar o PBST e adicione 750 µ l de solução (95 mL de PBS, 5 g de albumina de soro bovino (BSA), 5 mL de soro e 0,5 mL de Triton X-100) de bloqueio para cada amostra. Incube a temperatura ambiente por 3 h sobre um roqueiro a 15 rpm.
Nota: A solução de bloqueio deve conter soro provenientes das espécies de acolhimento em que os anticorpos secundários foram levantados (EG., cabra, burro) e estéril-filtrada através de um 0,22 µm filtro antes da utilização. - Prepare a solução de diluição de anticorpo (97 mL de DPBS, 2,5 g de BSA, 2,5 mL de soro (da mesma espécie de hospedeiro como na etapa 3.8) e 0,5 mL de Triton X-100). Diluir o anticorpo primário usando a solução de diluição de anticorpo e adicionar 500 µ l da solução para cada amostra. Selar a placa com Parafilm e incubar durante uma noite a 4 ° C em uma cadeira de balanço.
Nota: Nestin e Sox2 anticorpos primários foram diluídos 1: 400 em solução de diluição de anticorpo da concentração original dos fabricantes. - Aspirar a solução de anticorpo de cada amostra e lavar as amostras com PBST por 60 min à temperatura ambiente em um roqueiro a 15 rpm. Repita a etapa de lavagem 3 vezes.
- Diluir o estoque secundário de anticorpos e 5 mg/mL DAPI (1:2, 000) usando a solução de diluição de anticorpo e adicionar 500 µ l da solução para cada amostra. Cobrir a placa de 24 com folha de alumínio e incubar durante uma noite a 4 ° C em uma cadeira de balanço.
Nota: Como os anticorpos secundários são sensíveis à luz, as amostras devem ser protegidas de fotobranqueamento para todas as etapas subsequentes. Cabra do anti-rato e cabra anticoelho anticorpos secundários foram diluídos 1: 500 em solução de diluição de anticorpo da concentração original dos fabricantes. - Aspirar a solução de anticorpo de cada amostra e lavar as amostras com PBST por 30 min à temperatura ambiente o basculante. Repita a etapa de lavagem 3 vezes.
- Coloque uma gota de meio de montagem de hard-set sobre a superfície de uma lâmina de vidro. Usando fórceps, remova excesso solução do molde, borrando levemente a borda do molde em um papel toalha. Cuidadosamente coloque o molde de cabeça para baixo para o meio de montagem e evitar a introdução de bolhas.
- Permitir que o meio de montagem endurecer por 48 h à temperatura ambiente. Armazenar as amostras em temperatura ambiente ou 4 ° C. Permitir que o meio de montagem definir totalmente por 48 h antes da imagem latente como índice de refração do meio vai mudar ao longo do endurecimento. Sele as amostras para o slide de tampa de vidro com esmaltes claros para atenuar a contaminação ou amostra de movimento.
- Imagem das amostras usando um microscópio confocal.
Resultados
Os ELPs usados no presente protocolo são compostas por cinco regiões: uma marca de T7, marca His6, local de clivagem enterokinase (EK), uma região de bio-ativo e uma região elastina (Figura 1). As tags T7 e His6 permitem fácil identificação através de técnicas de padrão ocidental do borrão. Introdução do site EK clivagem permite a remoção enzimática da região de marca, se necessário. A região de bio-ativos codifica para a estendida, derivado de fibronectina celular-adesivo ('RGDS') ou sequências não-adesivas ('RDGS'). Por último, a repetição central da região de elastina, como contém um grupo de lisina no local de resíduo de comentários que permite reticulação através de THPC enquanto as repetições flanqueando contêm isoleucina para alcançar um LCST de ~ 32 ° C31.
Expressão de post, SDS-PAGE ou borrão ocidental pode ser usado para visualizar o peso molecular e confirmar a identidade do ELPs que contêm marcas de anticorpo, como T7 (MASMTGGQQMG) ou His6 (HHHHHH) (Figura 2). Expressão bem sucedido sob condições controladas produz um produto altamente homogêneo representado pela presença de uma única banda escura com o peso molecular aproximado (~ 37 kDa) destas proteínas usando ambos os SDS-PAGE (Figura 2A) e Western blot ( Figura 2B).
Em condições não controladas, a presença de bandas de peso molecular inferiores em um Western blot sugere que alguma fração das proteínas não foi completamente traduzido e/ou foram degradadas depois da expressão (Figura 2). Especificamente, as massas aqui são espaçadas por kDa ~ 9 que corresponde, aproximadamente o peso de uma região de bio-ativo e três regiões semelhantes a elastina (uma ' Repetir'), ou aproximadamente um quarto da proteína alvo. Estes pequenos fragmentos de proteína estão geralmente presentes quando a expressão é realizada a uma temperatura mais elevada (> 32 ° C) como na Figura 2. A presença destas proteínas de peso molecular inferior pode conduzir a imprevisíveis propriedades mecânicas. Assim, rastreio regular expressão do post é recomendado para garantir um produto final de alta qualidade.
A rigidez mecânica do ELP-baseado de hidrogel pode ser modificada manipulando-se a concentração de ELP ou a relação de aminas primárias de THPC grupos reativos: ELP. Simultaneamente, a concentração de ligantes de célula-adesivo pode ser ajustada alterando-se a proporção de variantes ELP com a célula-adesivo (RGDS) para sequências de (RDGS) não-adesivas em qualquer regime de rigidez. Manipulando essas duas variáveis, nós podemos produzir géis que têm um espectro de propriedades mecânicas e concentrações de ligante (Figura 3).
Para encapsular células dentro 3D hidrogel ELP, o número desejado de células é suspensos no meio e centrifugado para produzir uma pelota de célula (Figura 4A). O meio é aspirado do tubo, e as células são re-suspensas uniformemente na solução ELP da concentração desejada. Em seguida, solução THPC é adicionada à suspensão celular/ELP e pipetada cuidadosamente para formar uma mistura homogênea. Esta solução é rapidamente transferida para moldes de silicone estéril dentro de uma placa de 24 usando uma pipeta e permitida crosslink em temperatura ambiente e 37 ° C por 15 min cada (Figura 4B). Finalmente, o meio é adicionado ao prato bem e incubado a 37 ° C no experimento.
Ao vivo/morto coloração pode ser usado para avaliar a viabilidade celular e encapsulamento de célula bem sucedido dentro ELP hidrogel. Conforme ilustrado na Figura 5, células progenitoras neurais murino adulto (NPCs) mostram a viabilidade celular alta durante 7 dias dentro de um hidrogel ELP de 3% (p/v).
Hidrogel 3D do ELP foram mostrados anteriormente para apoiar a manutenção NPC haste medida através da expressão de marcadores de proteína canônicos NPC SRY (sex-determinando a região Y)-caixa 2 (Sox2) e nestin9. NPCs encapsulados em 3% (p/v) ELP hidrogel com baixa THPC reticulação mostrar alta expressão nuclear-localizada Sox2 e filamentos citoplasmáticos de nestin via imunocoloração e imagem latente confocal (Figura 6).

Figura 1 : Uma representação esquemática do ELP e sequências de aminoácido correspondente. O ELP utilizado neste estudo contém uma tag T7 e His6 para geração de imagens baseada em anticorpos, uma região Bioativo para introdução de célula-adesivo domínios e uma região de elastina, como que confere propriedades mecânicas elásticas e permite a reticulação química. Clique aqui para ver uma versão maior desta figura.
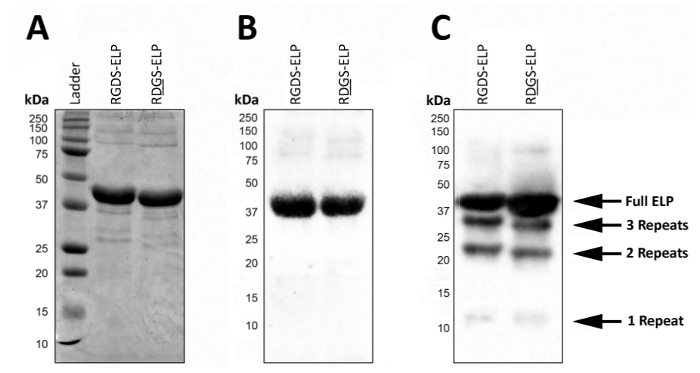
Figura 2 : Expressão da proteína-alvo pode ser validado com SDS-PAGE e Western blot, para confirmar o peso molecular e a identidade do produto liofilizado final. ELP completo puro é executado em um peso molecular de 37 kDa, conforme relatado por SDS-PAGE (A) e Western blot utilizando o T7 (MASMTGGQQMG) ou histidina 6 marca (HHHHHH) b. (C). impuros lotes de ELP devido os desvios no protocolo expressão ELP podem levar à expressão de ELPs com menor peso molecular. Clique aqui para ver uma versão maior desta figura.
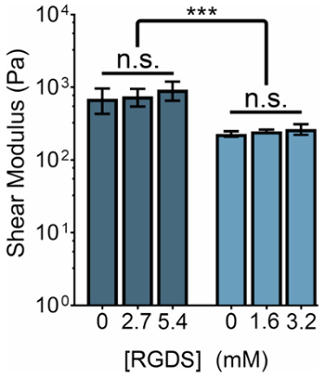
Figura 3: Teor de ligante RGDS pode ser ajustado independentemente de propriedades mecânicas dentro ELP hidrogel. 5% (p/v) e 3% (p/v) ELP hidrogel tem módulo de cisalhamento de ~ 800 Pa e 400 ~ Pa, respectivamente. Hidrogel com uma proporção de 1:1 de aminas primárias de THPC grupos reativos: ELP foram quitosana em temperatura ambiente por 15 min, aquecido a 37 ° C e permitido equilibrar por 5 min antes da medição. Dados são média ± d.p., *p < 0,001. Clique aqui para ver uma versão maior desta figura.

Figura 4: Esquemático de encapsulamento de célula em hidrogel ELP. (A). as células são inicialmente dissociadas em uma suspensão de célula única a médio e peletizadas utilizando uma centrífuga. O meio é aspirado do tubo, e as células são re-suspensas na solução do ELP na concentração desejada e bem misturadas. Finalmente, a solução de reticulação THPC é adicionada e misturada bem. (B). imediatamente após a adição de THPC, a solução é convertida em um molde de silicone com uma pipeta. A solução é permitida crosslink em temperatura ambiente por 15 min, seguido por uma segunda incubação de 15 min a 37 ° C. O meio é então adicionado à cultura bem para a duração do experimento. Clique aqui para ver uma versão maior desta figura.

Figura 5: Células progenitoras neurais mantêm alta viabilidade em hidrogel ELP. Imagem representativa de células progenitoras neurais encapsulado em 3% (p/v) ELP hidrogel com reticulação de 1:1 (aminas primárias de THPC grupos reativos: ELP) após 7 dias em cultura. Verde: viver coloração (calceína-AM); Vermelho: mortos coloração (homodímero de etídio). Barra de escala = 100 µm.
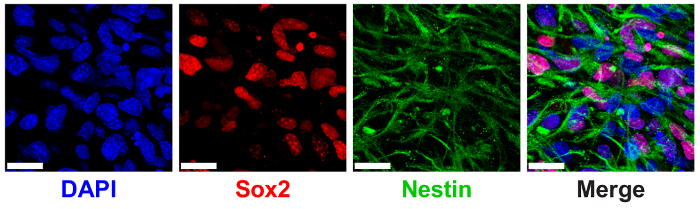
Figura 6 : Suporte a 3D ELP hidrogel expressão de fabricante progenitoras neurais célula tronco. Imagem de imunofluorescência de células progenitoras neurais expressando Sox2 e nestin proteínas após 7 dias de cultura em hidrogel ELP. Imagens mostram células encapsuladas em géis de 3% (p/v) ELP com 0.5:1 reticulação (aminas primárias de THPC grupos reativos: ELP). Azul: DAPI (núcleos); Vermelho: Sox2; Verde: nestin. Barra de escala = 25 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Purificação e expressão da proteína recombinante é uma ferramenta poderosa para sintetizar biomateriais com alta reprodutibilidade. Devido em grande parte para o advento da clonagem molecular comercializado, plasmídeo recombinante personalizado pode ser adquirido de vários fornecedores, que reduz significativamente o tempo para trabalhar com materiais como o ELPs. Da mesma forma, plasmídeos podem ser solicitados diretamente do laboratório de origem, quando o trabalho original foi apoiado por um contrato federal e trabalho futuro será para uso sem fins lucrativos. A sequência completa de aminoácidos ELP foi anteriormente publicada por várias variantes ELP31. No entanto, o processo de expressão para eventual purificação de proteínas recombinantes envolve uma série de passos críticos que comumente podem levar a rendimentos reduzidos ou um produto de qualidade inferior. Algumas das questões mais comuns para a preparação de ELP surgirem em um dos seguintes: (1) qualidade de populações bacterianas armazenadas, (2) o congelamento-descongelamento primeiro ciclo para romper a membrana bacteriana e purificação de proteínas (3) através de ciclagem térmica.
Uma diferença importante entre a expressão da proteína e outros meios não-biológicos de produção de materiais é que nós estão aproveitando a maquinaria biológica de hosts recombinantes para sintetizar os polímeros. Posteriormente, essa técnica vem com uma única limitação: morte celular ou danos. Morte celular mais comumente manifesta-se como um reduzido número de colônias bacterianas após estrias uma placa ou anormalmente pequenas colônias que crescem relativamente lentamente. Populações bacterianas, se mantido cuidadosamente, podem permanecer estáveis durante anos; no entanto, ciclos de congelamento-descongelamento sucessivos devido a falha repetida de uso ou congelador podem reduzir a viabilidade celular ou levar a danos no DNA. Estoques de bactéria BL21 típicos usam entre 10% e 40% de glicerol em volume misturado com células suspensas. O objetivo do glicerol é reduzir danos de membrana de nucleação de cristais de gelo durante o congelamento. Portanto, usando baixas concentrações (< % de 10) pode levar a uma membrana comprometida, enquanto altas concentrações (> 40%) pode suprimir o ponto de congelamento suficientemente para onde o estoque nunca congela levando à morte celular. No entanto, mesmo dentro dos níveis de glicerol ideal, populações bacterianas não poderão totalmente degelo como uma combinação de membrana danos causados por efeitos citotóxicos e re-congelamento do glicerol pode levar a reduzida viabilidade das ações e danos no DNA. Portanto, se observa-se que uma ação bacteriana resulta em uma contagem baixa de colônia ou que as células se dividem a uma taxa lenta consistentemente (manifestada como uma taxa de rampa de600 OD lenta durante a expressão), re-transformar o plasmídeo e fazer um novo stock são um simples primeira abordagem para solucionar este problema. Com isto em mente, para garantir a manutenção a longo prazo das populações bacterianas e integridade do DNA, é melhor armazenar as cópias de seu plasmídeo como DNA purificado congelado em água e não dentro das células. Armazenar o DNA desta forma irá garantir que imprevistos como uma falha de estoque ou falha do congelador, uma fonte confiável do DNA original pode ser usada para transformação.
Outro passo fundamental na fabricação do ELP é a purificação da proteína alvo do host de expressão. Extração de proteínas de e. coli é conseguida quebrando a parede de pilha usando nucleação cristais de gelo que se formam em toda o suspensão lisado celular total sobre congelamento, que é ainda mais agravado com ciclos de congelamento e descongelamento sucessivos. Métodos alternativos para romper a parede celular podem ser utilizados como sonication ou uma prensa. Em particular, consecutivo congelamento-descongelamento do lisado é vantajoso, pois requer apenas um freezer e nenhum outro equipamento de especialidade. No entanto, este procedimento libera nonspecifically o DNA, RNA e proteínas contaminantes, além de proteases que têm o potencial de degradar a proteína do alvo. Portanto, para evitar contaminação e redução de rendimento, desoxirribonuclease I (DNase) e fluoreto de phenylmethanesulfonyl (PMSF) são adicionados à célula lisada para degradar o DNA e inibir proteases, respectivamente. A presença de DNA antes da adição de DNase pode ser observada visualmente como uma aparência 'pegajoso' em toda a célula re-suspensa lisada seguindo o primeiro degelo. DNase ativamente degrada o DNA e, portanto, reduz a viscosidade da célula lisada facilitando a purificar através de centrifugação. Optimal quebra de DNA pode ser confirmada visualmente, garantindo que o lisado celular parece ser inteiramente líquido e que a aparência fibrosa não é mais visível. Temos observado na prática que a adição de ~0.1 mg de DNase por lisado celular de mL é suficiente para alcançar a necessária degradação. No entanto, se a presença de DNA ainda é observada, DNase mais pode ser adicionado seguido por um adicional de duas a três horas de agitação. Um problema semelhante também pode surgir se DNase é adicionado prematuramente, antes de qualquer um do lisado teve o potencial para descongelar suficientemente. Neste caso, as temperaturas mais frias podem limitar a eficiência da degradação do DNA devido à inactivação prematura de DNase. Para evitar esse problema, muitas vezes é prática recomendada para permitir a re-suspensa pelota descongelar por aproximadamente 8 horas antes do tratamento com DNase. Além disso, se são relatados rendimentos de baixa proteína e degradação do DNA tem sido suficiente, a adição de mais PMSF para ajudar a reduzir ainda mais o potencial degradação proteica de proteases pode ser necessária.
Considerações adicionais para garantir a expressão ideal da ELPs incluem uma compreensão cuidadosa dos benefícios e limitações de um antibiótico escolhido. Aqui, vetores de pET15b contendo um gene de resistência de ampicilina foram usados para a expressão da proteína. Funcionalmente, a série de vetor de animais permite significativa na expressão de proteínas com tanto quanto 50% de expressão de proteínas de uma bactéria dedicado à proteína alvo após uma bem sucedida indução32,33. No entanto, ampicilina como um antibiótico seleção vem com algumas limitações que podem interferir com a expressão ideal. Primeiro, degradação de ampicilina na presença de Escherichia coli pode ocorrer rapidamente devido à liberação de beta-lactamase. Se uma quantidade suficiente da ampicilina é degradada, o plasmídeo codificação de ampicilina (ou seja, o plasmídeo ELP-codificação) pode ser perdido inteiramente. Como resultado, quando expressar ELPs para durações mais longas, os níveis de expressão da proteína devem ser monitorados cuidadosamente em pontos sucessivos de tempo para garantir que uma quantidade suficiente do gene ELP-codificação permitir a expressão desejável. Métodos possíveis para solução de problemas o acúmulo de beta-lactamases incluem girando para baixo a cultura starter e re-suspender as células em meio sem antibióticos antes de inocular o meio de expressão. Este processo efetivamente limita a transferência de enzimas degradantes de antibiótico e garante uma maior parcela de células contêm o vetor alvo-proteína-codificação. Além disso, a ampicilina tem uma vida útil limitada de cerca de duas a três semanas. Portanto, placas de cultura para a expressão da proteína devem ser armazenadas a 4 ° C por um período máximo de duas semanas antes de usar. Finalmente, para garantir a eficácia da ampicilina dentro do starter e expressão de mídia, a solução estoque de ampicilina deve ser fresco produzido imediatamente antes da utilização, como o armazenamento a longo prazo pode levar a um antibiótico menos eficaz.
A presença de um LCST permite a purificação simples de ELPs através de ciclagem térmica. Especificamente, a uma temperatura mais elevada e na presença de sais, forças entrópica causam ELPs tornar-se menos solúvel e posteriormente formam uma fase coacervate ricos em polímero. Por outro lado, a baixas temperaturas, ELPs permanecem solúveis e facilmente dissolvem na solução. Andar de bicicleta entre esses regimes de dois temperatura juntamente com etapas de centrifugação para recolher e descartar a fase não-ELP-contendo sucessivamente concentra-se a proteína e simultaneamente reduz a existência de contaminantes não-ELP.
No entanto, há um número de estágios onde ELPs podem ser perdidos neste processo de purificação. Primeiro, antes de cada rodada de fria, a solução contendo proteína é alcalinizada a um pH de 9.0. Este pH superior serve para deprotonar certos aminoácidos sobre a espinha dorsal da proteína, efetivamente, deixando-os em um estado de carga e aumentando ainda mais a sua solubilidade. Consequentemente, esta etapa que precede ou não, deixando tempo suficiente para dissolução de proteína pode levar a uma redução no rendimento como proteínas não-solubilizado serão peletizadas durante a centrifugação e descartadas.
Da mesma forma, as proteínas alvo podem ser perdidas durante o procedimento de centrifugação quente quando o ELP é peletizado. Inicialmente, NaCl é adicionado para o sobrenadante rico em proteínas para reduzir a solubilidade do ELP. Os sais trabalham para proteger interações eletrostáticas entre as moléculas de proteína e água, fazendo com que a proteína separar a fase aquosa. Este efeito é amplificado por aquecimento a solução, que, devido aos efeitos Entrópico, ainda mais se decompõe hidratada 'gaiola' em torno ELPs e obriga a agregação das proteínas. Em concentrações menores de proteína (i. e., o primeiro ciclo térmico), a adição de sais sozinhos muitas vezes é insuficiente para causar essa separação de fases. No entanto, como a concentração de proteína aumenta (i. e., depois os ciclos térmicos) e há menos contaminantes secundários para interagir com os sais, o ELP mais prontamente irá precipitar. Como resultado, se sais são adicionados também rapidamente, eles podem tornar-se fisicamente presos da agregação de proteínas, que efetivamente reduz a concentração de sal da solução e limita mais precipitação de proteínas. Assim, o sal deve ser adicionado em três pequenos lotes para garantir que eles tenham tempo suficiente para distribuir homogênea através da solução. Como uma nota final, ou variações para a espinha dorsal do ELP, por meio de adicional modificações para o resíduo de comentários da região de elastina, como alterações na região de bio-ativo significativamente podem afetar o comportamento LCST. Consequentemente, para garantir o rendimento de proteína ideal em variantes de proteína, é fundamental otimizar o pH, concentração de sal e sal tipo (ex., monovalente ou divalentes) para as rotações de frias e quentes.
SDS-PAGE em execução após a conclusão do protocolo é recomendada, pois pode ser usada para determinar facilmente se perda significativa do ELP ocorre durante qualquer uma das etapas da purificação. Brevemente, se ELP é detectado no sobrenadante após uma rodada quente, então a proteína não é ser efetivamente precipitada. Da mesma forma, se ELPs são identificados em uma amostra de sedimento solubilizado após uma rotação de fria, então a proteína não é ser efetivamente dissolvida.
ELP hidrogel oferece muitas vantagens sobre materiais sintéticos ou derivados naturalmente. Especificamente, o uso da amina reativos crosslinker THPC proporciona um mecanismo de baixo custo, simples e ajustável de reticulação de proteína. No entanto, existem limitações distintas dentro do protocolo de reticulação que deve-se notar. THPC é sensível de oxigênio, e se armazenados em condições impróprias, isso pode rapidamente se deteriorar na eficiência da reação. Além disso, devido a sua reatividade com aminas primárias, THPC pode reagir com em torno de proteínas em mídia ou aqueles na superfície das células que são ricas em aminas. Portanto, quando o formando hidrogel ELP, é recomendável para evitar a contaminação de mídia com o centrifugado para reduzir a reatividade cruzada de proteína exógena possível e, portanto, uma redução na eficiência de reticulação. Finalmente, este mecanismo de reticulação opõe-se a sequência de região de bio-ativo para aqueles que contêm sem resíduos de lisina e assim, limita o potencial integração de alguns motivos de célula-adesivo (EG., IKVAV,34). Para resolver essas limitações, modificações ao backbone ELP com azida sódica e bicyclononyne (BCN) parceiros de reação permite a reticulação bio-ortogonais, como descrito anteriormente,27.
Note-se que o comportamento do ELP LCST desempenha um papel importante em ditar a microestrutura de hidrogel. Em regimes de temperatura acima da LCST, ELPs precipitam fora da solução, levando a formação de fases ricas em proteínas e deficiência de proteína que pode influenciar a porosidade da matriz e eficiência de reticulação da matriz9. Porque a maioria das experiências de cultura de pilha são realizadas em temperaturas fisiologicamente relevantes (~ 37 ° C) acima do ELP LCST, esses efeitos devem ser considerados. Para o hidrogel para efetivamente crosslink e forma uma rede interconectada de proteína, a amina primária da lisina deve ser fisicamente acessível para o agente reticulante THPC. Se a agregação de ELP ocorre antes de chegar a reticulação suficiente, ELPs presos no âmbito da fase rica em proteínas podem ser inacessível e, portanto, incapaz de participar de reticulação. Para resolver essa limitação, o nosso protocolo requer um período de reticulação inicial 15 min à temperatura ambiente, que permite a reticulação preliminar do hidrogel antes o ELP sofre sua transição de fase térmica. Esta temperatura de incubação é seguida por uma incubação adicional 15 min a 37 ° C para finalizar reticulação de hidrogel. Este procedimento é fundamental para reticulação suficiente e robusta, reprodutível gelificação do material ELP.
Em conclusão, proteína recombinante hidrogel fabricado usando ELP oferece excepcional pré-definido da sequência da proteína e, portanto, o microambiente celular 3D. Polímeros ELP tem sido mostrado ser expressáveis em rendimentos elevados, facilmente purificados devido a seu comportamento LCST e biocompatível em uma ampla variedade de sistemas in vitro e in vivo . O uso de e. coli como um host recombinante fornece um procedimento simples e barato que dá origem a quase perfeito controle de peso molecular de polímeros e funcionalidade. Em conjunto, esta técnica permite robusto pré-definido e reprodutibilidade da plataforma de hidrogel, permitindo para a cultura de uma vasta gama de tipos de células em 3D. Finalmente, esta plataforma de hidrogel ELP é passível de muitos ensaios bioquímicos a jusante, incluindo qRT-PCR, Western blot, extração de DNA e célula immunostaining9.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores agradecer T. Palmer e H. Barbosa (Stanford neurocirurgia) para fornecer murino NPCs. vetoriais na Figura 4 foi utilizada e adaptada da arte médica Servier sob licença Creative Commons Attribution 3.0 Unported (https://creativecommons.org/ licenses/by/3.0/legalcode). Parte deste trabalho foi realizada no Stanford Nano compartilhado instalações (SNSF), apoiado pela Fundação Nacional de ciência sob prémio ECCS-1542152. N.A.S. reconhece o apoio do Instituto Nacional de General Medical Ciências, do National Institutes of Health (32GM 008412). C.M.M. reconhece apoio de um NRSA NIH doutorandos fellowship (F31 EB020502) e o programa de estudiosos do Siebel. S.C.H. reconhece apoio do National Institutes of Health (AI116484 de Sub-19 e R21 EB018407), National Science Foundation (DMR-1508006) e o Instituto de Califórnia para a medicina regenerativa (RT3-07948). Esta pesquisa recebeu financiamento da Aliança para pesquisa de reabilitação regenerativa & treinamento (AR3T), que é apoiada pela Eunice Kennedy Shriver National Institute de saúde infantil e desenvolvimento humano (FORMULADORES), Instituto Nacional de Distúrbios neurológicos e Stroke (NINDS) e do Instituto Nacional de imagem biomédica e bioengenharia (NIBIB) dos institutos nacionais de saúde, sob número P2CHD086843 Award. O conteúdo é exclusivamente da responsabilidade dos autores e não representam necessariamente as opiniões do institutos nacionais da saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| Elastin-Like Protein Expression and Purification | |||
| 10 cm Petri Dishes | Thermo Fisher Scientific | FB0875713 | |
| 70% Ethanol | RICCA Chemical | 2546.70-1 | |
| Ammonium Sulfate | Sigma-Aldrich | A3920-500G | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25G | |
| Bacto Agar | Thermo Fisher Scientific | 9002-18-0 | |
| BL21(DE3)pLysS Competent Cells | Invitrogen | C606003 | |
| Chloramphenicol | Amresco | 0230-100G | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | DN25 | |
| EDTA disodium salt, dihydrate | Thermo Fisher Scientific | O2793-500 | |
| Glycerol | Thermo Fisher Scientific | BP229-4 | |
| Isopropanol | Thermo Fisher Scientific | A451-4 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | BP1755-10G | |
| Luria Broth | EMD Millipore | 1.10285.5007 | |
| Parafilm | VWR | 52858-000 | |
| Phenylmethanesulfonyl fluoride (PMSF) | MP Biomedicals | 195381 | |
| Sodium Chloride | Thermo Fisher Scientific | BP358-212 | |
| Sodium Hydroxide | Sigma-Aldrich | S 8045-1KG | |
| Syringe Filter Unit (0.22 μm) | Millipore | SLGP033RB | |
| Terrific Broth | Millipore | 71754-4 | |
| Tris Base | Thermo Fisher Scientific | BP152-1 | |
| Cell Encapsulation in 3D ELP Hydrogels | |||
| 0.22 μm syringe filters | Millipore | SLGV004SL | |
| 0.5 mm thick silicone sheet | Electron Microscopy Science | 70338-05 | |
| 24-well tissue culture plates | Corning | 353047 | |
| Disposable Biopsy Punch (2 mm) | Integra Miltex | 33-31 | |
| Disposable Biopsy Punch (4 mm) | Integra Miltex | 33-34 | |
| Disposable Biopsy Punch (5 mm) | Integra Miltex | 33-35 | |
| Dulbecco’s phosphate buffered saline (DPBS) | Corning | 21-031-CM | |
| No. 1 12 mm glass coverslips | Thermo Fisher Scientific | 12-545-80 | |
| Tetrakis(hydroxymethyl)phosphonium chloride (THPC) | Sigma-Aldrich | 404861-100ML | |
| 0.5% Tryspin/EDTA | Thermo Fisher | 15400054 | |
| Immunocytochemistry of Cells in 3D ELP Hydrogels | |||
| 16% (w/v) Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15701 | |
| Bovine Serum Albumin (BSA) | Roche | 3116956001 | |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Molecular Probes | D1306 | |
| Donkey Serum | Lampire Biological Labs | 7332100 | |
| Goat anti-mouse Secondary Antibody (AF488) | Molecular Probes | A-11017 | |
| Goat anti-rabbit Secondary Antibody (AF546) | Molecular Probes | A-11071 | |
| Goat Serum | Gibco | 16210-072 | |
| Mouse Nestin Primary Antibody | BD Pharmingen | 556309 | |
| Mouse Sox2 Primary Antibody | Cell Signaling Technology | 23064S | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Vectashield Hardset Mounting Medium | Vector Labs | H-1400 |
Referências
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294 (5547), 1708-1712 (2001).
- Birgersdotter, A., Sandberg, R., Ernberg, I. Gene expression perturbation in vitro-A growing case for three-dimensional (3D) culture systems. Seminars in Cancer Biology. 15 (5), 405-412 (2005).
- Gómez-Lechón, M. J., et al. Long-term expression of differentiated functions in hepatocytes cultured in three-dimensional collagen matrix. Journal of Cellular Physiology. 177 (4), 553-562 (1998).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension - how 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nature Reviews Molecular Cell Biology. 8 (10), 839-845 (2007).
- Justice, B. A., Badr, N. A., Felder, R. A. 3D cell culture opens new dimensions in cell-based assays. Drug Discovery Today. 14 (1-2), 102-107 (2009).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and Bioengineering. 103 (4), 655-663 (2009).
- Madl, C. M., et al. Maintenance of neural progenitor cell stemness in 3D hydrogels requires matrix remodelling. Nature Materials. 16 (12), 1233-1242 (2017).
- Discher, D. E., Janmey, P., Wang, Y. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science. 310 (5751), 1139-1143 (2005).
- Sun, Y., Villa-Diaz, L. G., Lam, R. H. W., Chen, W., Krebsbach, P. H., Fu, J. Mechanics Regulates Fate Decisions of Human Embryonic Stem Cells. PLoS ONE. 7 (5), e37178 (2012).
- Ehrbar, M., et al. Elucidating the Role of Matrix Stiffness in 3D Cell Migration and Remodeling. Biophysical Journal. 100 (2), 284-293 (2011).
- Rowlands, A. S., George, P. A., Cooper-White, J. J. Directing osteogenic and myogenic differentiation of MSCs: interplay of stiffness and adhesive ligand presentation. American Journal of Physiology - Cell Physiology. 295 (4), 1037-1044 (2008).
- Lampe, K. J., Antaris, A. L., Heilshorn, S. C. Design of three-dimensional engineered protein hydrogels for tailored control of neurite growth. Acta Biomaterialia. 9 (3), 5590-5599 (2013).
- Kilian, K. A., Mrksich, M. Directing Stem Cell Fate by Controlling the Affinity and Density of Ligand-Receptor Interactions at the Biomaterials Interface. Angewandte Chemie International Edition. 51 (20), 4891-4895 (2012).
- Tse, J. R., Engler, A. J. Preparation of Hydrogel Substrates with Tunable Mechanical Properties. Current Protocols in Cell Biology. , 10.16.1-10.16.16 (2010).
- Hughes, C. S., Postovit, L. M., Lajoie, G. A. Matrigel: A complex protein mixture required for optimal growth of cell culture. Proteomics. 10 (9), 1886-1890 (2010).
- DiMarco, R. L., Heilshorn, S. C. Multifunctional Materials through Modular Protein Engineering. Advanced Materials. 24 (29), 3923-3940 (2012).
- Meyer, D. E., Chilkoti, A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nature Biotechnology. 17 (11), 1112-1115 (1999).
- Aladini, F., Araman, C., Becker, C. F. W. Chemical synthesis and characterization of elastin-like polypeptides (ELPs) with variable guest residues. Journal of Peptide Science. 22 (5), 334-342 (2016).
- McMillan, R. A., Caran, K. L., Apkarian, R. P., Conticello, V. P. High-Resolution Topographic Imaging of Environmentally Responsive, Elastin-Mimetic Hydrogels. Macromolecules. 32 (26), 9067-9070 (1999).
- McMillan, R. A., Conticello, V. P. Synthesis and Characterization of Elastin-Mimetic Protein Gels Derived from a Well-Defined Polypeptide Precursor. Macromolecules. 33 (13), 4809-4821 (2000).
- Chung, C., Lampe, K. J., Heilshorn, S. C. Tetrakis(hydroxymethyl) Phosphonium Chloride as a Covalent Cross-Linking Agent for Cell Encapsulation within Protein-Based Hydrogels. Biomacromolecules. 13 (12), 3912-3916 (2012).
- Romano, N. H., Madl, C. M., Heilshorn, S. C. Matrix RGD ligand density and L1CAM-mediated Schwann cell interactions synergistically enhance neurite outgrowth. Acta Biomaterialia. 11, 48-57 (2015).
- Shah, M., Hsueh, P. Y., Sun, G., Chang, H. Y., Janib, S. M., MacKay, J. A. Biodegradation of elastin-like polypeptide nanoparticles. Protein Science. 21 (6), 743-750 (2012).
- Nettles, D. L., Chilkoti, A., Setton, L. A. Applications of elastin-like polypeptides in tissue engineering. Advanced Drug Delivery Reviews. 62 (15), 1479-1485 (2010).
- Madl, C. M., Heilshorn, S. C. Tyrosine-Selective Functionalization for Bio-Orthogonal Cross-Linking of Engineered Protein Hydrogels. Bioconjugate Chemistry. 28 (3), 724-730 (2017).
- Zhu, D., Wang, H., Trinh, P., Heilshorn, S. C., Yang, F. Elastin-like protein-hyaluronic acid (ELP-HA) hydrogels with decoupled mechanical and biochemical cues for cartilage regeneration. Biomaterials. , 132-140 (2017).
- Madl, C. M., Katz, L. M., Heilshorn, S. C. Bio-Orthogonally Crosslinked, Engineered Protein Hydrogels with Tunable Mechanics and Biochemistry for Cell Encapsulation. Advanced Functional Materials. 26 (21), 3612-3620 (2016).
- Cai, L., Dinh, C. B., Heilshorn, S. C. One-pot synthesis of elastin-like polypeptide hydrogels with grafted VEGF-mimetic peptides. Biomater Sci. 2 (5), 757-765 (2014).
- Straley, K. S., Heilshorn, S. C. Independent tuning of multiple biomaterial properties using protein engineering. Soft Matter. 5 (1), 114-124 (2009).
- Baneyx, F. Recombinant protein expression in Escherichia coli. Current Opinion in Biotechnology. 10 (5), 411-421 (1999).
- Graumann, K., Premstaller, A. Manufacturing of recombinant therapeutic proteins in microbial systems. Biotechnology Journal. 1 (2), 164-186 (2006).
- Tashiro, K., et al. A Synthetic Peptide Containing the IKVAV Sequence from the A Chain of Laminin Mediates Cell Attachment, Migration, and Neurite Outgrowth. Journal of Biological Chemistry. 264 (27), 16174-16182 (1989).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados