Method Article
Два методы, чтобы создать Hypoparathyroid Мыши: паратиреоидэктомию Использование GFP железах и дифтерийно-Токсин-опосредованной паратиреоидного абляции
В этой статье
Резюме
Mice with acquired hypoparathyroidism would be useful for studying novel drug therapies for hypoparathyroidism. Two procedures to create such mice are demonstrated. The GFP-PTX mouse is generated by surgical parathyroidectomy guided by green fluorescing parathyroid glands. A second, non-surgical approach is based on parathyroid-specific expression of the diphtheria toxin receptor.
Аннотация
Hypoparathyroidism (HP) is a disorder characterized by low levels of PTH which lead to hypocalcemia, hyperphosphatemia, and low bone turnover. The most common cause of the disease is accidental removal of the parathyroid glands during thyroid surgery. Novel therapies for HP are needed, but testing them requires reliable animal models of acquired HP.
Here, we demonstrate the generation of two mouse models of acquired HP. In the GFP-PTX model, mice with green fluorescent protein (GFP) expressed specifically in the parathyroids (PTHcre-mTmG) were created by crossing PTHcre+ mice with Rosa-mTmGfl/fl mice. Green fluorescing parathyroid glands are easily identified under a fluorescence dissecting microscope and parathyroidectomy is performed in less than 20 min. After fluorescence-guided surgery, mice are profoundly hypocalcemic. Contrary to the traditional thyro-parathyroidectomy, this precise surgical approach leaves thyroid glands and thyroid function intact. The second model, which does not require surgery, is based on a diphtheria-toxin approach. PTHcre-iDTR mice, which express the diphtheria toxin (DT) receptor specifically in the parathyroids, were generated by crossing the inducible DTR mouse with the PTHcre mouse. Parathyroid cells are thus rendered sensitive to diphtheria toxin (DT) and can be selectively destroyed by systemically injecting mice with DT. The resulting hypocalcemic phenotype is stable.
Введение
С момента первого систематического описания паращитовидных желез у человека и в нескольких других видов Сандстрёма в 1880 году 1, понимая значение этого маленького эндокринного органа по физиологии человека и болезней постоянно совершенствуется. Паращитовидных желез секреции паратиреоидного гормона (РТН), главный регулятор метаболизма кальция. PTH также является важным гормоном для фосфатного гомеостаза и метаболизма костной ткани 1, 2. Случайное удаление или повреждение паращитовидных желез во время операции шеи является наиболее распространенной причиной гипопаратиреоз, болезнь характеризуется низким содержанием кальция в крови, низкий уровень ПТГ и повышенных фосфора 1.
Для лучшего изучения приобретенного гипопаратиреоз и тестирования новых методов лечения, надежные и легко доступные модели мыши обязательны к заполнению. Мыши широко используются в исследованиях, поскольку большое разнообразие генетических инструментов являютсяв этой модели шириной вида , разрешающих сложные механистические исследования в естественных условиях. Тем не менее, в то время как хирургическое паратиреоидэктомия (PTX) может быть использован у крыс 2, 3, 4, 5, и более крупных млекопитающих , 6, 7, 8, это технически очень сложно у мышей из - за небольшого размера желез и их переменной анатомического распределения 9. Таким образом, Thyro-паратиреоидэктомия (TPTX) обычно проводят на мышах, в которых щитовидная и паращитовидные железы удаляются вместе 10. Тем не менее, низкий уровень гормонов щитовидной железы являются потенциальным confounder в экспериментах, усложняя эту модель. Кроме того, C-клеток в щитовидной железе, которые производят кальцитонин, гормон важно в кальциевого гомеостаза у грызунов, также теряются при удалении из гоyroids 11.
Несколько генетические модели мыши гипопаратиреозом существуют, которые включают в себя РТН-нуль мышь 12, GCM2-нуль мышь 13 и мышь Нуф с мутацией активирующего в кальция зондирования рецептор (CASR) 14, 15. Тем не менее, эти генетические дефекты уже присутствуют во время эмбрионального развития, и функция паращитовидных желез, следовательно, уже нарушена в процессе эмбриогенеза. Это может повлиять на развитие органов, таких как скелет. Это контрастирует с пациентами с послеоперационным гипопаратиреоз, приобретающих болезнь позже в жизни. Кроме того, некоторые из этих моделей мыши обладают ранней летальности и снижение рождаемости, что еще больше затрудняет их использование 12, 13, 14.
Мы разработали две новые мыши мodels учтенные гипопаратиреоз. С помощью генной инженерии мышей, которые выражают GFP в частности паращитовидных желез позволяет паращитовидных желез быть легко идентифицированы для хирургического удаления без удаления щитовидной железы. Эта мышь была сгенерирована путем скрещивания мыши РТН-Cre, выражающий Cre рекомбиназу под контролем 5,5 т.п.н. РТН промотора 16 с помощью мыши РОСА mTmG. Полученные PTHcre; мышей mTmG выражают зеленый флуоресцентный белок специфически в клетках паращитовидной железы. Вторая модель мыши использует тот же РТН-Cre, на этот раз с требованием удалить СТОП кассету из индуцируемого DTR мыши, что приводит к экспрессии рецептора дифтерийного токсина специфически в паращитовидных желез. Системное введение DT разрушает клетки паращитовидной железы, что делает животных hypoparathyroid без хирургического вмешательства.
Две мышиные модели, представленные в данном исследовании, демонстрируют устойчивую hypocalcemic фенотип над пери наблюдения трехмесячныхобмундирование оливково-серого цвета Процедуры просты для выполнения, фенотип является воспроизводимым, а hypoparathyroid мыши обнаруживают высокую скорость 17 выживания.
протокол
Это исследование было одобрено животных по уходу и использованию комитета (Institutional IACUC) Генеральной больницы штата Массачусетс по. Получить соответствующую институциональную одобрение для этого животного перед началом исследования. Некоторые методы, возможно, придется быть скорректированы в соответствии с местными требованиями IACUC.
1. GFP-PTX Мыши
- Получить мышей PTHcre + и мышей Rosa-mTmG на 8 - 10 недель для дальнейшего спаривания.
- Бэккросс в PTHcre + мышей (смешанные 129; FVB фон) с 6 мышей C57BL / 6 поколений , чтобы получить мышей с C57BL / 6 фоне.
- ИНБРЕДНЫЕ PTHcre + мышей , чтобы получить PTHcre + / + мышей 17.
Примечание: Для выполнения генотипирование, извлечь ДНК из кончика хвоста и использовать его для проведения ПЦР. ПЦР-праймеров для проверки гетерозиготность и гомозиготность трансгена PTHcre заключаются в следующем: прямой праймер A, CCTGTCAAGGATGTGGAAGA, обратный праймер, A ', TCAGATCACACCACACAGCA, Forward праймера B, CAGTTGTCTTTAGTTTACTCAGCATCAG, обратный праймер B ', GATAATCGCGAACATCTTCAGGTT 17. - Крест PTHcre + / + мышей 16 с Rosa-mTmG мышей 18. Wean PTHcre; mTmG щенкам, когда 4 недели.
- Обезболить 8 - 10 недель PTHcre; мышей mTmG И.П. инъекции tribromoethanol (Avertin) при 0,6 мг / г веса тела, или другие агенты, такие как кетамин / ксилазином. Использование бупренорфина 0,1 мг / кг подкожно каждые 12 ч в качестве обезболивающего средства в течение 48 часов после операции в соответствии с утвержденным протоколом. Обеспечить надлежащую глубину анестезии мысочного абстинентного пинч рефлекса или других средств. Поместите животное в положении лежа на спине.
- Расширить и подготовить регион вентральной шеи после бритья кожу с помощью одного ребра лезвия. Лечить бритой кожи с йодповидон антисептическим колодки.
- Накройте животное с стерильных хирургических простыней, чтобы уменьшить загрязнение хирургического участка и использовать автоклавного микрофонrosurgical инструменты для хирургической процедуры.
- Вырезать 2 см продольный разрез в коже с хирургическим скальпелем. Рассеките фасции и толкать слюнных желез в сторону тупым рассечением с изогнутыми зубчатыми щипцами.
- Под микроскопом рассечение, используя галогенную лампу и 4 - увеличение 5X, вырезать и отделить паратрахеальных мышцы, используя острые щипцы советы и подвергать трахеи.
- Определить щитовидной железы с правой и левой доли, расположенной рядом с трахеи.
- Включите источник света для флуоресцентного света и визуализировать два зеленых-флуоресцирующий паращитовидных желез.
Примечание: Как правило, два паращитовидной железы расположены на или вблизи поверхности щитовидной железы, но иногда они расположены дальше. - Осторожно удалите зеленые паращитовидных желез с помощью хирургических щипцов и ножниц. Используйте стерильную марлю для гемостаза и тщательно проверьте вдоль трахеи, чтобы гарантировать, что все зеленые ткани были удалены.
- Закройте паратрахеальных мышцы, прерванного швом с использованием 6-0 полиглактином 910 наложения швов. Закройте разрез кожи по Холстед швом с использованием 6-0 полиглактином 910 наложения швов.
- Дополнительно: Inject 10 мкл / г массы тела стерильными нормальный 0,9% раствор хлорида натрия для мышей для замены жидкости.
- Поместите послеоперационные животных в отдельную клетку на теплом инкубаторе (37 ° C) для восстановления температуры тела. После того, как мыши просыпаются и в лежачем положении, положите гранулы чау и воду с небольшим количеством желатина пищи на полу клетки.
- После послеоперационного периода наблюдения, 2 ч, вернуть мышь в виварии и соблюдать местные требования к послеоперационной помощи.
- Через 3 дня после паратиреоидэктомии, получить 10 мкл хвост крови и измерения крови ионизированного Са ++ , с использованием анализатора , таких как система газового состава крови Са ++ анализатор / рН. Успешные результаты паратиреоидэктомию в крови ионизируется Са ++ равной или ниже -2SD из ложнооперированными конTROL мышей (1,20 ммоль / л в наших опытах п = 30).
2. РТН-CRE-IDTR Мыши
- Получить PTHcre + и DTR фл / фл мышей на 8 - 10 недель для вязки.
- Бэккросс мышей PTHcre (смешанные 129; FVB фон) с 6 мышей C57BL / 6 поколений, чтобы получить мышей с C57BL / 6 фоне.
- ИНБРЕДНЫЕ PTHcre + (C57BL / 6 фоне) мышей , чтобы получить PTHcre + / + мышей 17.
ПРИМЕЧАНИЕ: Для выполнения генотипирование, ДНК из мышей кончиков хвоста извлекали и использовали для проведения ПЦР. Генотипирования праймеры: прямой праймер A, CCTGTCAAGGATGTGGAAGA, обратный праймер A ', TCAGATCACACCACACAGCA, прямой праймер B, CAGTTGTCTTTAGTTTACTCAGCATCAG, обратный праймер B', GATAATCGCGAACATCTTCAGGTT 17. - Mate PTHcre + / + мышей 16 с DTR фл / фл мышей 19 , чтобы получить мышей PTHcre-IDTR.
- Приготовьте раствор DT путем разбавления diphtheriтоксин порошок со стерильным физиологическим раствором до концентрации 0,5 мкг / мл. Стерильный фильтр, и хранить аликвоты при -80 ° С.
- Выберите 8 - 10 недель старых мышей PTHcre-IDTR для инъекций эксперимента. Оттепели ДТ аликвоты до комнатной температуры, введение DT внутрибрюшинно в 5 мкг / кг (10 мкл / г) веса тела животного. Для достижения максимальной эффективности и наименьшей токсичности, введение DT повторяется в общей сложности на 2 инъекции в течение 3 дней с интервалом 17.
- Через 3 дня после второй инъекции, берут 10 мкл крови из хвоста каждого PTHcre-IDTR / PTHcre-IDTR-mTmG мыши и измерить Са ++ в крови с использованием газов крови Система Ca ++ анализатор / рН.
Примечание: Определим мышей с кровью ионизируется Ca ++ ниже 1,18 ммоль / л , как hypoparathyroid мышей, что составляет 2SD ниже среднего значения контрольных мышей вводили носителем (п = 22).
Результаты
Расположение паращитовидных железах
Во-первых, мы записали распределение паращитовидных желез 54 мышей PTHcre-mTmG как это наблюдалось под флуоресцентным микроскопом рассечение. 74% (40/54) мыши имели два зеленых паращитовидных желез (рис 1А, С, Е), 26% (14/54) мыши имели дополнительный третий паращитовидных желез (рис 1B, D, F). Не было отмечено ни одного мышь с одной железы или более трех желез. Как правило, паращитовидных желез были расположены вблизи верхней границы щитовидной железы (58%, 71/122; Рисунок 1А (1,2), В (1,2), С (2), D (1,2), E (2), Р (3)). 27% (33/122) железы были расположены вблизи нижней границы щитовидной железы (рис 1С (1), D (3), F (1)), и 13% (16/122) были расположены вдали от тhyroid железы (Фигура 1В (3), Е (1), Р (2)). Наши данные согласуются с результатами и расширить предыдущие выводы различной степени расположения паращитовидных желез 20.
GFP-PTX Мыши
Вся операция от наркоза, чтобы закрыть разрез кожи потребовалось приблизительно 20 мин на мышь. Коэффициент выживаемости мышей послеоперационный период наблюдения в течение 3-х месяцев была 96,3% (53/55). 92,4% (49/53) мышей GFP-PTX выставлены ионизированные уровни кальция, которые были 2 SD ниже среднего ложнооперированными контрольных мышей или ниже. Hypoparathyroid фенотип у мышей GFP-PTX (гипокальциемия, низкий уровень ПТГ и повышенный уровень фосфата) был стабилен в течение всего времени наблюдения 3-х месяцев. Важно отметить, что функция щитовидной железы не отличалась от ложнооперированными животных через 3 мес после операции (TSH = 42 ± 24 против 30 ± 15 мЕд / л, р = 0,171; Т4 = 30,0 ± 0,6 против 3,1 ± 0,9 мкг / дл, р = 0,707 (рисунок 2).
РТН-CRE-IDTR Мыши
DT вводили мышам РТН-Cre-IDTR развитую гипопаратиреоз (ионизированного кальция в крови низкое, повышенное фосфора в крови, и неадекватно низкого нормальные уровни РТН). Ранее мы уже сообщали о том , что несколько РТН положительных клеток избежать абляции токсина дифтерии, объясняя измеримое циркулирующего ПТГ и , следовательно, несколько более умеренный фенотип этих мышей 17.
Гипопаратиреоз в GFP-PTX Мыши и РТН-CRE-IDTR мышей
Наблюдалось значительное снижение Са ++ в крови и уровни ПТГ в сыворотке в GFP-PTX мышей через 3 дня после операции, по сравнению с уровнями , обнаруженными в ложнооперированными мышей (Ca ++ = 1,05 ± 0,40 vs. 1,30 ± 0,03 ммоль / л, р <0,05; РТН = 32 ± 22 против 580 ± 137 пг / мл, р <0,05). Гипопаратиреоз фенотип был стабильным в течение 3-месячного периода наблюдения (рис 3А, перепечатано с разрешения (ссылка # 17)). После 2-х инъекций 5 мкг / кг DT через 3 дня интервал, дозы и схемы оптимизированного использовать наименьшее количество ДТ, чтобы дать максимальную hypoparathyroid фенотип, ДТ вводили РТН-CRE-IDTR мышей показали значительное гипокальцемию и снижение ПТГ по сравнению с управления транспортным средством мышей, которые сохранялись в течение 90 - дневного периода наблюдения (Ca ++ = 1,10 ± 0,07 ммоль / л против 1,26 ± 0,05 ммоль / л, р <0,05; РТН = 218 ± 156 пг / мл против 572 ± 164 пг / мл, р <0,05) (рис 3B, перепечатано с разрешения (ссылка № 17)).
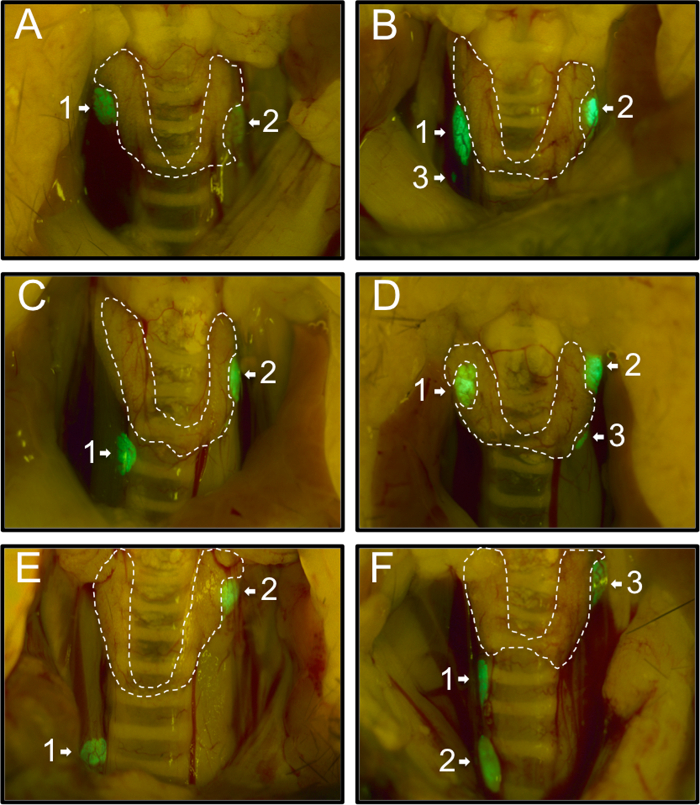
Рисунок 1: Представитель изображения различных местах паращитовидных железах в 54 PTHcre-mTmG мышей под люминесцентной микроскопом рассечение. Мыши были либо два (А, С, Е) или три (B, D, F) зеленый паращитовидных желез. Большинство паращитовидных желез были расположены вблизи верхней границы (A (1,2), В (1,2), С (2), D (1,2), Е (2), F (3) или вблизи нижняя граница щитовидной железы (с (1), D (3), F (1)). в редких случаях, некоторые из них были расположены эктопически (B (3), Е (1), F (2)). Пожалуйста , нажмите здесь , чтобы просмотреть большую версию этой фигуры.
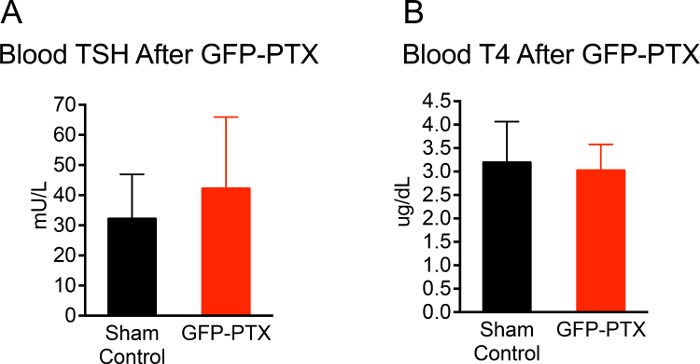
На рисунке 2: ТТГ и Т4 уровень GFP-PTX мышей. 3 месяца после того, как GFP-PTX, сыворотка была получена для ТТГ и Т4 measurem Энты. GFP-PTX мыши показали концентрации TSH (42 ± 24 мЕд / л) концентрации (А) и Т4 (3,0 ± 0,6 мкг / дл) (В) , которые не отличались от контрольных мышей (ТСГ = 30 ± 15 мЕд / л, р = 0,171, N = 11, Т4 = 3,1 ± 0,9, р = 0,707, n = 11). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
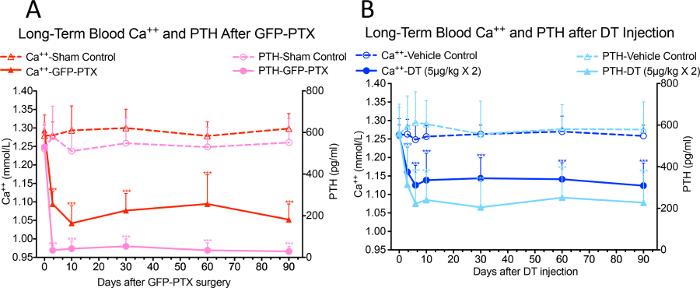
Рисунок 3: Кровь Са ++ и РТН Уровни в GFP-PTX Мыши и DT Введенный РТН-CRE-IDTR мышей. Обе мыши GFP-PTX (A) и DT вводили РТН-CRE-IDTR мышей (B) выставлены стабильные гипокальцемию и снижение уровня ПТГ в течение 3 - месячного периода наблюдения (N = 6 - 8, *** р <0,001) (перепечатывали с разрешения источника № 17).эс / ftp_upload / 55010 / 55010fig3large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Мы демонстрируем технику GFP наведением паратиреоидэктомии с использованием трансгенных мышей с экспрессией GFP избирательно в паращитовидных желез. В PTHcre, мышей mTmG, двойной флуоресценции (зеленая GFP в Cre-выраженных клеток и красный помидор в не-Cre выражены клетки) позволили нам четко определить и точно удалить все паращитовидных желез без удаления щитовидной железе. В то время как мы предпочитаем использовать двойной флуоресценции мышей mTmG для способности идентифицировать флуоресцентный красный без паращитовидной ткани, наша процедура должна также хорошо работать с использованием одиночных флуоресцентных животных, таких как томатный красный (B6.Cg-Ct (ROSA) 26Sortm14 ( CAG-tdTomato) Hze / J) мыши. Процедура относительно легко выполнить, требует около 20 минут на мышь, и приводит к тяжелым и устойчивым hypoparathyroid фенотипа.
Кроме того, еще одним преимуществом GFP-положительных паращитовидных желез является легкость обнаружения аберрантных паращитовидных желез. Наши исследования показывают,mislocalization из паращитовидных желез в около четверти мышей В6 (рис 1), которые легко обнаружить в нашей модели мыши с помощью зеленой флуоресценции. В отличие от Thyro-паратиреоидэктомии, наш метод позволяет избежать удаления щитовидной с последующей необходимости замены тиреоидных гормонов и неизвестному эффект удаления кальцитонина продуцирующих тиреоидных С-клеток. Флуоресцентно меченных паращитовидных желез могут быть также использованы для других исследований, которые требуют изоляции паращитовидных желез. Ограничением этой модели включает в себя требование к операции. Базовые навыки микрохирургии и рассечение микроскоп с флуоресцентным источником света требуется.
Второй метод генерирования hypoparathyroid мышей, что устраняет необходимость в операции демонстрируется. Дифтерия токсин обработанных мышей PTHcre-IDTR демонстрируют более мягкое гипопаратиреоз фенотип, но просто требуют инъекции DT внутрибрюшинно в мышь. Критическая часть FOг генерации этой модели была оптимизация дозы и режима дозирования. Высокие дозы DT привели к токсичности, но низкие дозы снижала эффективность подхода. Мы определили, что доза полк 2-х инъекций в 5 мкг / кг, при введении 3 дней друг от друга, привели к надежной и стабильной гипокальциемии, без / минимальной смертности.
В конечном счете, мы надеемся, что эти два подхода дают полезные модели мыши для приобретенной гипопаратиреоз. Используя новый пролонгированный РТН, мы уже сообщали первое использование обоих этих моделей при определении эффективности новых лекарств для гипопаратиреозом 17.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
Эта работа была поддержана NIH гранты R01-DK100584 и Китайская государственная лаборатория заболеваний полости рта Открытое финансирование SKLOD2015OF01 (РБ). Мы благодарим Wenping Чжао, Тадатоси Сато, и Келли Lauter за помощью.
Материалы
| Name | Company | Catalog Number | Comments |
| ROSAmT/mG mice | The Jackson Laboratory | 7676 | |
| PTH-Cre mice | The Jackson Laboratory | 5989 | |
| iDTRmice | The Jackson Laboratory | 7900 | |
| 6-0 polyglactin 910 suture with needle | Ethicon, Inc | J510G | |
| Safety Single Edge Razor Blades | American Safety Razor Company | 66-0089 | |
| Disposable Scalpel | Feather Safety Razor Co., LTD | 72042-11 | |
| Povidone-Iodine Prep Pads | Dynarex Corporation | 1108 | |
| Ply gauze | Busse. Inc | BHD707 | |
| 0.9% Sodium Chloride Solution | HOSPIRA Worldwide, Inc | 07983-09 | |
| 1 mL 29 G Insulin Syringe | BECTON DICKINSON | 329622 | |
| Surgical Incise Drapes | 3M | 6640EZ | |
| Dumstar Biology forceps | Roboz Surgical Instrument Co., Inc | RS-4984 | |
| Micro Dissecting Spring Scissors | Roboz Surgical Instrument Co., Inc | RS-5605 | |
| Needle Holder | MILTEX.,Inc | V98-42 | |
| 2,2,2-Tribromethanol | Sigma-Aldrich | T48402 | |
| 2-Methyl-2-Butanol | Sigma-Aldrich | 152463 | For dissolve the 2,2,2-Tribromethanol |
| Diphtheria Toxin Powder | Sigma-Aldrich | D0564 | Dissolve in 0.9% sodium chloride solution at 1 mg/mL as the stock solution in -80 °C |
| Multicap Blood Collection Capillary tubes | Siemens Healthcare Diagnostics Ltd | 855578 | For collecting blood in iCa2+ analysis using RapidLab 348 Ca2+/pH analyzer |
| RapidLab 348 Ca2+/pH analyzer | Siemens Healthcare | For iCa2+ analysis |
Ссылки
- Brandi, M. L., Brown, E. M. . Hypoparathyroidism. , (2015).
- van Abel, M. Coordinated control of renal Ca(2+) transport proteins by parathyroid hormone. Kidney Int. 68, 1708-1721 (2005).
- Sebastian, E. M., Suva, L. J., Friedman, P. A. Differential effects of intermittent PTH(1-34) and PTH(7-34) on bone microarchitecture and aortic calcification in experimental renal failure. Bone. 43, 1022-1030 (2008).
- Rodriguez-Ortiz, M. E. Calcium deficiency reduces circulating levels of FGF23. J Am Soc Nephrol. 23, 1190-1197 (2012).
- Liao, H. W. Relationship between Fibroblast Growth Factor 23 and Biochemical and Bone Histomorphometric Alterations in a Chronic Kidney Disease Rat Model Undergoing Parathyroidectomy. PloS one. 10, e0133278 (2015).
- Fox, J., Care, A. D. Effect of low calcium and low phosphorus diets on the intestinal absorption of water in intact and parathyroidectomized pigs. Calcif Tissue Int. 31, 253-255 (1980).
- Finco, D. R., Brown, S. A., Ferguson, D. C., Crowell, W. A. Selective parathyroidectomy of the dog. Can J Vet Res. 57, 288-292 (1993).
- Can, I. Parathyroid allotransplantation in rabbits without cultivation. Int J Clin Exp Med. 7, 280-284 (2014).
- Dunn, T. B. Melanoblasts in the stroma of the parathyroid glands of strain C58 mice. j Natl Cancer Inst. 10, 725-733 (1949).
- Sakai, A. Osteoclast development in immobilized bone is suppressed by parathyroidectomy in mice. J Bone Miner Metab. 23, 8-14 (2005).
- Miao, D. Skeletal abnormalities in Pth-null mice are influenced by dietary calcium. Endocrinology. 145, 2046-2053 (2004).
- Gunther, T. Genetic ablation of parathyroid glands reveals another source of parathyroid hormone. Nature. 406, 199-203 (2000).
- Hough, T. A. Activating calcium-sensing receptor mutation in the mouse is associated with cataracts and ectopic calcification. Proc Natl Acad Sci U S A. 101, 13566-13571 (2004).
- Hannan, F. M. The Calcilytic Agent NPS 2143 Rectifies Hypocalcemia in a Mouse Model With an Activating Calcium-Sensing Receptor (CaSR) Mutation: Relevance to Autosomal Dominant Hypocalcemia Type 1 (ADH1). Endocrinology. 156, 3114-3121 (2015).
- Libutti, S. K. Parathyroid gland-specific deletion of the mouse Men1 gene results in parathyroid neoplasia and hypercalcemic hyperparathyroidism. Cancer Res. 63, 8022-8028 (2003).
- Bi, R. Diphtheria Toxin- and GFP-Based Mouse Models of Acquired Hypoparathyroidism and Treatment with a Long-Acting Parathyroid Hormone Analog. J Bone Miner Res. , (2015).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45, 593-605 (2007).
- Buch, T. A Cre-inducible diphtheria toxin receptor mediates cell lineage ablation after toxin administration. Nat Methods. 2, 419-426 (2005).
- Dunn, T. B. Melanoblasts in the stroma of the parathyroid glands of strain C58 mice. J Natl Cancer Inst. 10, 725-733 (1949).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены