Method Article
Zwei Techniken zum Erstellen Hypoparathyroid Mäuse: Parathyreoidektomie Mit GFP Drüsen und Diphtherie-Toxin-Mediated Parat Ablationssystem
In diesem Artikel
Zusammenfassung
Mice with acquired hypoparathyroidism would be useful for studying novel drug therapies for hypoparathyroidism. Two procedures to create such mice are demonstrated. The GFP-PTX mouse is generated by surgical parathyroidectomy guided by green fluorescing parathyroid glands. A second, non-surgical approach is based on parathyroid-specific expression of the diphtheria toxin receptor.
Zusammenfassung
Hypoparathyroidism (HP) is a disorder characterized by low levels of PTH which lead to hypocalcemia, hyperphosphatemia, and low bone turnover. The most common cause of the disease is accidental removal of the parathyroid glands during thyroid surgery. Novel therapies for HP are needed, but testing them requires reliable animal models of acquired HP.
Here, we demonstrate the generation of two mouse models of acquired HP. In the GFP-PTX model, mice with green fluorescent protein (GFP) expressed specifically in the parathyroids (PTHcre-mTmG) were created by crossing PTHcre+ mice with Rosa-mTmGfl/fl mice. Green fluorescing parathyroid glands are easily identified under a fluorescence dissecting microscope and parathyroidectomy is performed in less than 20 min. After fluorescence-guided surgery, mice are profoundly hypocalcemic. Contrary to the traditional thyro-parathyroidectomy, this precise surgical approach leaves thyroid glands and thyroid function intact. The second model, which does not require surgery, is based on a diphtheria-toxin approach. PTHcre-iDTR mice, which express the diphtheria toxin (DT) receptor specifically in the parathyroids, were generated by crossing the inducible DTR mouse with the PTHcre mouse. Parathyroid cells are thus rendered sensitive to diphtheria toxin (DT) and can be selectively destroyed by systemically injecting mice with DT. The resulting hypocalcemic phenotype is stable.
Einleitung
Da die erste systematische Beschreibung der Nebenschilddrüsen in der Human- und in mehreren anderen Arten von Sandström im Jahr 1880 1, das Verständnis der Bedeutung dieser kleinen endokrine Organ für die menschliche Physiologie und Krankheit hat sich kontinuierlich verbessert. Nebenschilddrüsen sezerParatHormon (PTH), das wichtigste Regulator des Kalziumstoffwechsels. PTH ist auch ein wichtiges Hormon für Phosphat - Homöostase und Knochenumsatz 1, 2. Unbeabsichtigter Entfernung oder Beschädigung der Nebenschilddrüsen während Hals - Chirurgie ist die häufigste Ursache für Hypoparathyreoidismus, eine Krankheit , die durch einen niedrigen Blutkalzium, niedrige PTH gekennzeichnet und erhöhte Phosphor 1.
Um eine bessere Studie erworbenen Hypoparathyreoidismus und Test neuartige Therapien, zuverlässige und leicht zugängliche Mausmodelle erforderlich sind. Mäuse werden weit verbreitet in der Forschung verwendet werden, weil eine Vielzahl von genetischen Werkzeugen a sindvailable in dieser Spezies für mechanistische Studien in vivo ermöglicht. Während jedoch die chirurgische Parathyreoidektomie (PTX) bei Ratten verwendet werden können , 2, 3, 4, 5 und größeren Säugetieren 6, 7, 8, ist es technisch sehr anspruchsvoll in Mäusen wegen der geringen Größe der Drüsen und ihre variable anatomischen Verteilung 9. Daher wird in Mäusen thyreo-Parathyreoidektomie (TPTX) typischerweise durchgeführt, in denen die Schilddrüse und Nebenschilddrüsen zusammen 10 entfernt werden. Allerdings sind niedrige Schilddrüsenhormonspiegel ein potentieller Störfaktor in Experimenten, dieses Modell zu komplizieren. Zusätzlich C-Zellen in der Schilddrüse, die in Nagetieren wichtig in Calciumhomöostase Calcitonin, ein Hormon produzieren, werden auch beim Entfernen der th verlorenyroids 11.
Mehrere genetische Mausmodelle von Hypoparathyreoidismus existieren, die den PTH-null - Maus 12, die GCM2-null - Maus 13 und der Maus Nuf mit einem aktivierenden Mutation in der Calcium-sensitiven Rezeptor (CaSR) 14, 15 umfassen. Jedoch sind diese genetische Defekte bereits während der embryonalen Entwicklung und die Funktion der Nebenschilddrüsen ist daher bereits während der Embryonalentwicklung beeinträchtigt. Dies kann die Entwicklung von Organen, wie beispielsweise das Skelett beeinflussen. Dies steht im Gegensatz zu Patienten mit postoperativen Hypoparathyreoidismus, die die Krankheit im späteren Leben zu erwerben. Außerdem zeigen einige dieser Mausmodelle frühen Letalität und verminderte Fruchtbarkeit, die ihre Anwendung 12, 13 weiter erschwert, 14.
Wir entwickelten zwei neue Maus modelle für erworbene Hypoparathyreoidismus. Unter Verwendung genetisch Mäuse, die GFP speziell in den Nebenschilddrüsen ausdrücken lassen sich die Nebenschilddrüsen ohne Entfernung der Schilddrüse für die chirurgische Entfernung leicht identifiziert werden. Diese Maus wurde erzeugt , indem die PTH-Cre Maus kreuzt, die unter der Steuerung der 5,5 kb - Promotor PTH 16 mit dem ROSA mTmG Maus Cre - Rekombinase exprimiert. Die resultierenden PTHcre; mTmG Mäuse exprimieren das grün fluoreszierende Protein spezifisch in Nebenschilddrüsenzellen. Die zweite Maus-Modell verwendet die gleiche PTH-Cre, diesmal eine STOP-Kassette aus dem induzierbaren DTR Maus, was die Expression des Diphtherietoxin-Rezeptor spezifisch in den Nebenschilddrüsen zu entfernen. Eine systemische Verabreichung von DT zerstört Nebenschilddrüsenzellen, wodurch die Tiere ohne Operation hypoparathyroid.
Die beiden Mausmodelle in dieser Studie präsentierten zeigen einen stabilen hypocalcämische Phänotyp über den dreimonatigen Beobachtungs period. Die Verfahren sind leicht durchzuführen, ist der Phänotyp reproduzierbar und die hypoparathyroid Mäuse eine hohe Überlebensrate 17 aufweisen.
Protokoll
Diese Studie wurde von der Institutional Animal Care und Use Committee (IACUC) des Massachusetts General Hospital genehmigt. Erhalten Sie geeignete institutionelle Zulassung für diese Tierstudie vor Beginn. Einige Techniken haben könnten nach den örtlichen IACUC Anforderungen angepasst werden.
1. GFP-PTX Mäuse
- Erhalten PTHcre + Mäuse und Rosa-mTmG Mäuse bei 8 - 10 Wochen alt für eine weitere Paarung.
- Rückkreuzungs die PTHcre + Mäusen (mixed 129; FVB Hintergrund) mit C57BL / 6 - Mäuse für 6 Generationen Mäusen C57BL / 6 - Hintergrund zu erhalten.
- Inbreed PTHcre + Mäuse PTHcre + / + Mäuse 17 zu erhalten.
HINWEIS: Genotypisierung ausführen zu können, extrahieren die DNA aus der Spitze des Schwanzes und verwenden Sie es für die PCR. Die PCR-Primer für Heterozygotie und Homozygotie des PTHcre Transgen zu überprüfen, sind wie folgt: Vorwärts-Primer A, CCTGTCAAGGATGTGGAAGA, Primer A umkehren ', TCAGATCACACCACACAGCA, forward Primer B, CAGTTGTCTTTAGTTTACTCAGCATCAG, Reverse - Primer B ', GATAATCGCGAACATCTTCAGGTT 17. - Kreuz PTHcre + / + Mäuse 16 mit Rosa-mTmG Mäuse 18. Wean PTHcre; mTmG Welpen als 4 Wochen alt.
- Anästhesieren 8 - 10 Wochen alt PTHcre; mTmG Mäuse durch ip Injektion von Tribromethanol (Avertin) bei 0,6 mg / g Körpergewicht oder anderen Mitteln wie Ketamin / Xylazin. Verwenden Buprenorphin 0,1 mg / kg sc alle 12 h als Analgetikum für 48 h nach der Operation entsprechend einem zugelassenen Protokoll. Sicherstellung einer angemessenen Tiefe der Anästhesie durch den Zeh Prise Rückzugsreflex oder andere Mittel. Legen Sie das Tier in Rückenlage.
- Verlängern und bereiten den ventralen Halsbereich durch die Haut mit einzelnen Kanten Klingen rasieren. Desinfizieren Sie die rasierte Haut mit einem Povidonjodid antiseptisch Pad.
- Decken Sie das Tier mit einem sterilen OP-Tüchern Kontamination der Operationsstelle zu reduzieren und autoklaviert Mikrofon verwendenrosurgical Instrumente zum chirurgischen Eingriff.
- Schneiden Sie ein 2 cm Längsschnitt in der Haut mit einem chirurgischen Skalpell. Präparieren Faszie und drücken Sie die Speicheldrüsen an der Seite durch stumpfe Dissektion mit gekrümmten gezackten Pinzette.
- Unter dem Präpariermikroskop Halogenlicht und ein 4 - 5fache Vergrößerung, schneiden und trennen Sie die paratracheal Muskeln mit scharfen Zangenspitzen und die Luftröhre aus.
- Identifizieren Sie die Schilddrüse mit der rechten und linken Lappen neben der Luftröhre.
- Schalten Sie die Lichtquelle Fluoreszenzlicht und visualisieren die beiden grünen fluoreszierenden Nebenschilddrüsen.
HINWEIS: In der Regel werden die beiden Nebenschilddrüsen an oder nahe der Oberfläche der Schilddrüse befindet, aber gelegentlich werden sie weiter entfernt. - Entfernen Sie vorsichtig die grüne chirurgische Pinzette und Schere mit Nebenschilddrüsen. Verwenden steriler Gaze für Hämostase und sorgfältig zu prüfen, entlang der Luftröhre, um sicherzustellen, dass alle grünen Gewebe entfernt wurde.
- Schließen Sie die paratracheal Muskeln durch unterbrochene Naht mit 6-0 Polyglactin 910 Nähten. Schließen Sie den Hautschnitt von Halsted Naht mit 6-0 Polyglactin 910 Nähten.
- Optional: Injizieren Sie 10 ul / g Körpergewicht sterile normale 0,9% Natriumchloridlösung für die Mäuse für Flüssigkeitsersatz.
- Legen Sie Tiere zu postoperativen einem separaten Käfig an einem warmen Inkubator (37 ° C) für die Körpertemperatur Erholung. Sobald die Mäuse wach und in der liegenden Position sind, setzen Pelletfutter und Wasser mit etwas Gelatine Essen auf dem Käfigboden.
- Nach einer postoperativen Beobachtungszeit von 2 h, Maus an die Tierhaltung zurückkehren und lokale Anforderungen für die postoperative Pflege folgen.
- 3 Tage nach Parathyreoidektomie, 10 & mgr; l Schwanz Blut erhalten und zu messen Blut ionisiertem Ca ++ unter Verwendung eines Analysators wie dem Blutgassystem Ca ++ / pH - Analysator. Erfolgreiche Parathyreoidektomie Ergebnisse in Blut ionisiertem Ca ++ gleich oder niedriger als -2SD von scheinoperierten control Mäuse (1,20 mmol / L in unseren Experimenten von n = 30).
2. PTH-cre-IDTR Mäuse
- Erhalten PTHcre + und DTR fl / fl Mäusen bei 8 - 10 Wochen alt für die Paarung.
- Rückkreuzungs die PTHcre Mäuse (mixed 129; FVB Hintergrund) mit C57BL / 6-Mäuse für 6 Generationen Mäusen C57BL / 6-Hintergrund zu erhalten.
- Inbreed die PTHcre + (C57BL / 6 Hintergrund) Mäuse PTHcre + / + Mäuse 17 zu erhalten.
HINWEIS: Zur Durchführung der Genotypisierung, DNA von Mäusen Schwanzspitzen wurde extrahiert und verwendet für die PCR. Genotypisierung Grundierungen: Vorwärts - Primer A, CCTGTCAAGGATGTGGAAGA, Reverse - Primer A ', TCAGATCACACCACACAGCA, Vorwärts - Primer B, CAGTTGTCTTTAGTTTACTCAGCATCAG, Reverse - Primer B', GATAATCGCGAACATCTTCAGGTT 17. - Mate - PTHcre + / + Mäuse 16 mit DTR fl / fl Mäuse 19 PTHcre-IDTR Mäuse zu erhalten.
- Bereiten Sie DT-Lösung durch Verdünnen diphtheriein Toxin-Pulver mit steriler Kochsalzlösung auf eine Konzentration von 0,5 & mgr; g / mL. Sterilfilter und speichern Aliquots bei -80 ° C.
- Wählen Sie 8 - 10 Wochen alt PTHcre-IDTR Mäuse für die Injektion Experiment. Auftau DT Aliquot auf Raumtemperatur verabreichen DT intraperitoneal mit 5 ug / kg (10 & mgr; l / g) Körpergewicht des Tieres. Für maximale Effizienz und mindestens Toxizität wird DT Verabreichung in einem 3-tägigen Intervall 17 für insgesamt 2 Injektionen wiederholt.
- 3 Tage nach der zweiten Injektion nehmen 10 ul Schwanz Blut von jedem PTHcre-IDTR / PTHcre-IDTR-mTmG Maus und Blut Ca ++ messen mit Hilfe eines Blutgas - System Ca ++ / pH - Analysator.
HINWEIS: Wir definieren Mäuse mit Blut Ca ++ ionisiert niedriger als 1,18 mmol / L wie hypoparathyroid Mäuse, die 2SD gleich unter dem Mittelwert der Fahrzeug-injizierten Kontrollmäusen (n = 22).
Ergebnisse
Lage der Nebenschilddrüsen
Zunächst erfasst wir die Verteilung der Nebenschilddrüsen von 54 PTHcre-mTmG Mäusen wie unter dem Fluoreszenzmikroskop beobachtet Dissektion. 74% (40/54) Mäuse hatten zwei grüne Nebenschilddrüsen (1A, C, E), 26% (14/54) Mäuse hatten eine zusätzliche dritte Nebenschilddrüsen (Abbildung 1B, D, F). Keine Maus mit einer einzigen Drüse oder mehr als drei Drüsen beobachtet. Üblicherweise wurden Nebenschilddrüsen in der Nähe des oberen Rand der Schilddrüse (58%, 71/122; 1A (1,2), B (1,2), C (2), D (1,2), E (2), F (3)). 27% (33/122) Drüsen in der Nähe der unteren Grenze der Schilddrüse angeordnet waren (1C (1), D (3), F (1)) und 13% (16/122) aus der t entfernt angeordnethyroid Drüse (Abbildung 1B (3), E (1), F (2)). Unsere Ergebnisse stehen im Einklang mit und erweitern frühere Ergebnisse von 20 Standorten der Nebenschilddrüsen variiert.
GFP-PTX Mäuse
Die gesamte Operation aus der Narkose die Hautschnitt zur Schließung dauerte etwa 20 Minuten pro Maus. Die Überlebensrate von postoperativen Mäusen über einen 3-Monats-Beobachtungszeitraum betrug 96,3% (53/55). 92,4% (49/53) GFP-PTX Mäuse ionisierte Kalziumspiegel zeigten, dass 2 SD unter dem Mittelwert von scheinoperierten waren Kontrollmäuse oder niedriger. Der hypoparathyroid Phänotyp in den GFP-PTX-Mäuse (Hypokalzämie, niedriger PTH und erhöhte Serum-Phosphat) war stabil für die gesamte Beobachtungszeit von 3 Monaten. Wichtig ist, dass die Funktion der Schilddrüse nicht verschieden von scheinoperierten Tieren 3 Monate nach der Operation (TSH = 42 ± 24 vs. 30 ± 15 mU / l, p = 0,171; T4 = 30,0 ± 0,6 vs 3,1 ± 0,9 & mgr; g / dl, p = 0,707 (Abbildung 2).
PTH-cre-IDTR Mäuse
DT injiziert PTH-Cre-IDTR Mäuse entwickelten Hypoparathyreoidismus (niedriger Blut ionisiertem Kalzium, erhöhter Blut Phosphor und unangemessen niedrig-normalen PTH-Spiegel). Wir haben bereits berichtet , dass einige PTH - positiven Zellen die Ablation von Diphtherietoxin entkommen, erklärt die messbaren zirkulierenden PTH und die deshalb den etwas milderen Phänotyp dieser Mäuse 17.
Hypoparathyreoidismus in GFP-PTX Mäuse und PTH-cre-IDTR Mäuse
Signifikante Verringerungen des Blut Ca ++ und Serum - PTH - Spiegel wurden in GFP-PTX - Mäuse 3 Tage nach der Operation beobachtet, im Vergleich zu Ebenen in scheinoperierten Mäusen (Ca ++ gefunden = 1,05 ± 0,40 vs. 1,30 ± 0,03 mmol / l, p <0,05; PTH = 32 ± 22 vs. 580 ± 137 pg / ml, p <0,05). Der hypoparathyroidism Phänotyp war stabil über der 3-monatigen Beobachtungsperiode (3A, nachgedruckt mit freundlicher Genehmigung von (Referenz # 17)). Nach 2 Injektionen von 5 ug / kg DT in 3 Tage-Intervall, einer Dosis und Therapie optimiert, um die geringste Menge an DT verwenden, um den maximal hypoparathyroid Phänotyp zu verleihen, injiziert die DT PTH-cre-IDTR Mäuse signifikante Hypokalzämie und reduzierte PTH zeigten im Vergleich zu Fahrzeugkontrollmäuse, die über die 90 Tage Beobachtungszeit anhielt (Ca ++ = 1,10 ± 0,07 mmol / l vs. 1,26 ± 0,05 mmol / l, p <0,05; PTH = 218 ± 156 pg / ml vs. 572 ± 164 pg / ml, p <0,05) (3B, mit freundlicher Genehmigung von (Referenz # 17 abgedruckt)).
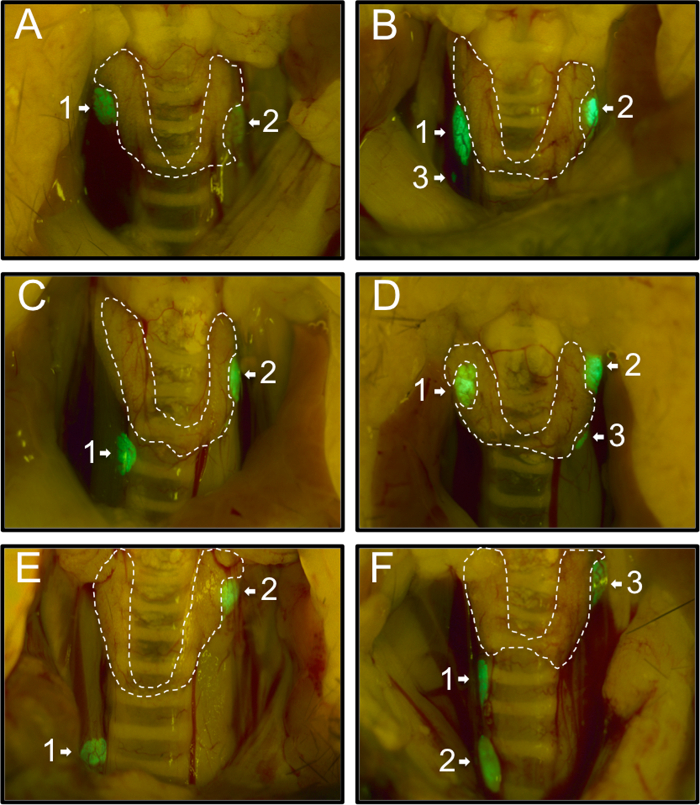
Abbildung 1: Repräsentative Bilder der verschiedenen Standorte der Nebenschilddrüsen in 54 PTHcre-mTmG Mäuse unter Fluorescent Dissection Mikroskop. Die Mäuse hatten entweder zwei (A, C, E) oder drei (B, D, F) grün Nebenschilddrüsen. Die meisten Nebenschilddrüsen in der Nähe der oberen Grenze wurden (A (1,2), B (1,2), C (2), D (1,2), E (2), F (3) oder nahe dem unteren Rand der Schilddrüse (C (1), D (3), F (1)). In seltenen Fällen wurden ektopisch einige gelegen (B (3), E (1), F (2)). Bitte klicken Sie hier , um die sehen eine größere Version dieser Figur.
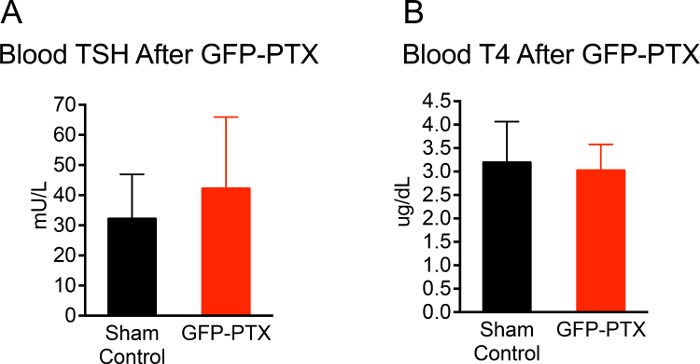
Abbildung 2: TSH und T4 Niveau der GFP-PTX Mäuse. 3 Monate nach der GFP-PTX, Serum wurde für TSH und T4 Measurem erhalten ents. GFP-PTX Mäuse zeigten TSH - Konzentrationen (42 ± 24 mU / L) (A) und T4 - Konzentrationen (3,0 ± 0,6 & mgr; g / dL) (B) , die aus Kontrollmäusen nicht unterschiedlich waren (TSH = 30 ± 15 mU / L, p = 0,171, n = 11, T4 = 3,1 ± 0,9, p = 0,707, n = 11). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
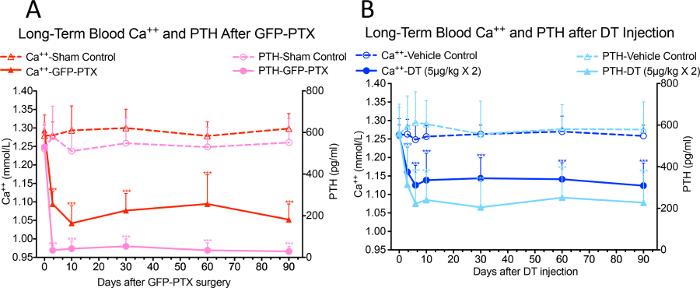
Abbildung 3: Blut Ca ++ und PTH - Spiegel in GFP-PTX Mäuse und DT injizierte PTH-cre-IDTR Mäuse. Beide GFP-PTX - Mäusen (A) und DT injiziert PTH-cre-IDTR Mäuse (B) zeigten stabile Hypokalzämie und reduziert die PTH - Spiegel über 3 Monate Beobachtungszeitraum (N = 6 - 8, *** p <0,001) (neu gedruckt mit Genehmigung aus Lit. # 17).es / ftp_upload / 55010 / 55010fig3large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Diskussion
Wir demonstrieren die Technik der GFP-geführten Parathyreoidektomie mit transgenen Mäusen, die mit GFP-Expression selektiv in den Nebenschilddrüsen. In den PTHcre; mTmG Mäuse, die doppelte Fluoreszenz (die grüne GFP in Cre-Zellen exprimiert und rote Tomaten in nicht-Cre ausgedrückt Zellen) konnten wir eindeutig zu identifizieren und genau alle Nebenschilddrüsen entfernen, ohne die Schilddrüsen zu entfernen. Während wir den Einsatz der Doppelfluoreszenz mTmG Mäuse für die Fähigkeit zu identifizieren leuchtrot nicht Parat Gewebe bevorzugt, sollte sich unser Verfahren auch gut einzelnen fluoreszierenden Tiere wie die Tomate rot (B6.Cg-Ct (ROSA) 26Sortm14 mit Arbeit ( CAG-tdTomato) hze / J) Maus. Das Verfahren ist relativ einfach durchzuführen, erfordert etwa 20 min pro Maus, und führt zu einer starken und anhalt hypoparathyroid Phänotyp.
Darüber hinaus ist ein weiterer Vorteil der GFP-positive Nebenschilddrüsen ist die einfache Detektion von aberrant Nebenschilddrüsen. Unsere Studien zeigen,Mislokalisation der Epithelkörperchen in etwa ein Viertel der B6 - Mäusen (Abbildung 1), die durch die grüne Fluoreszenz in unserem Mausmodell leicht erkannt werden. Im Gegensatz zu thyreo-Parathyreoidektomie vermeidet unserer Technik, um die Entfernung der Schilddrüse mit nachfolgender Bedarf für die Hormonersatz Schilddrüse und die unbekannte Wirkung der Entfernung von Calcitonin-produzierende C-Zellen der Schilddrüse. Fluoreszenzmarkierten Nebenschilddrüsen auch für andere Untersuchungen verwendet werden könnten, die die Isolierung der Nebenschilddrüsen erfordern. Die Begrenzung dieses Modells enthält die Forderung nach der Operation. Grund Mikrochirurgie Fähigkeiten und einem Präpariermikroskop mit einer fluoreszierenden Lichtquelle benötigt.
Eine zweite Technik zum Erzeugen hypoparathyroid Mäuse, die die Notwendigkeit einer Operation beseitigt wird demonstriert. Diphtherietoxin behandelten PTHcre-IDTR Mäuse eine mildere hypoparathyroidism Phänotyp aufweisen, sondern einfach erfordern DT intraperitoneal in die Maus injiziert wird. Der kritische Teil for Erzeugung dieses Modells wurde die Optimierung der Dosis und Dosierungsschema. Hohe Dosen von DT führte zu Toxizität, aber niedrige Dosen verringert die Wirksamkeit des Ansatzes. Wir stellten fest, dass die Dosis Regiment von 2 Injektionen bei 5 ug / kg, verabreicht 3 Tage auseinander, führte zu zuverlässigen und stabilen Hypokalzämie ohne / minimale Sterblichkeit.
Letztendlich hoffen wir, dass diese beiden Ansätze nützliche Mausmodelle für erworbene hypoparathyroidism bieten. Verwendung eines neuartigen langwirksamen PTH berichteten wir über die erste Verwendung beider dieser Modelle bei der Bestimmung der Wirksamkeit von neuen Arzneimitteln für Hypoparathyreoidismus 17.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Diese Arbeit wurde durch die NIH gewährt R01-DK100584 und China State Key Laboratory of Oral Diseases Offene Finanzierung SKLOD2015OF01 (RB). Wir danken Wenping Zhao, Tadatoshi Sato und Kelly Lauter um Hilfe.
Materialien
| Name | Company | Catalog Number | Comments |
| ROSAmT/mG mice | The Jackson Laboratory | 7676 | |
| PTH-Cre mice | The Jackson Laboratory | 5989 | |
| iDTRmice | The Jackson Laboratory | 7900 | |
| 6-0 polyglactin 910 suture with needle | Ethicon, Inc | J510G | |
| Safety Single Edge Razor Blades | American Safety Razor Company | 66-0089 | |
| Disposable Scalpel | Feather Safety Razor Co., LTD | 72042-11 | |
| Povidone-Iodine Prep Pads | Dynarex Corporation | 1108 | |
| Ply gauze | Busse. Inc | BHD707 | |
| 0.9% Sodium Chloride Solution | HOSPIRA Worldwide, Inc | 07983-09 | |
| 1 mL 29 G Insulin Syringe | BECTON DICKINSON | 329622 | |
| Surgical Incise Drapes | 3M | 6640EZ | |
| Dumstar Biology forceps | Roboz Surgical Instrument Co., Inc | RS-4984 | |
| Micro Dissecting Spring Scissors | Roboz Surgical Instrument Co., Inc | RS-5605 | |
| Needle Holder | MILTEX.,Inc | V98-42 | |
| 2,2,2-Tribromethanol | Sigma-Aldrich | T48402 | |
| 2-Methyl-2-Butanol | Sigma-Aldrich | 152463 | For dissolve the 2,2,2-Tribromethanol |
| Diphtheria Toxin Powder | Sigma-Aldrich | D0564 | Dissolve in 0.9% sodium chloride solution at 1 mg/mL as the stock solution in -80 °C |
| Multicap Blood Collection Capillary tubes | Siemens Healthcare Diagnostics Ltd | 855578 | For collecting blood in iCa2+ analysis using RapidLab 348 Ca2+/pH analyzer |
| RapidLab 348 Ca2+/pH analyzer | Siemens Healthcare | For iCa2+ analysis |
Referenzen
- Brandi, M. L., Brown, E. M. . Hypoparathyroidism. , (2015).
- van Abel, M. Coordinated control of renal Ca(2+) transport proteins by parathyroid hormone. Kidney Int. 68, 1708-1721 (2005).
- Sebastian, E. M., Suva, L. J., Friedman, P. A. Differential effects of intermittent PTH(1-34) and PTH(7-34) on bone microarchitecture and aortic calcification in experimental renal failure. Bone. 43, 1022-1030 (2008).
- Rodriguez-Ortiz, M. E. Calcium deficiency reduces circulating levels of FGF23. J Am Soc Nephrol. 23, 1190-1197 (2012).
- Liao, H. W. Relationship between Fibroblast Growth Factor 23 and Biochemical and Bone Histomorphometric Alterations in a Chronic Kidney Disease Rat Model Undergoing Parathyroidectomy. PloS one. 10, e0133278 (2015).
- Fox, J., Care, A. D. Effect of low calcium and low phosphorus diets on the intestinal absorption of water in intact and parathyroidectomized pigs. Calcif Tissue Int. 31, 253-255 (1980).
- Finco, D. R., Brown, S. A., Ferguson, D. C., Crowell, W. A. Selective parathyroidectomy of the dog. Can J Vet Res. 57, 288-292 (1993).
- Can, I. Parathyroid allotransplantation in rabbits without cultivation. Int J Clin Exp Med. 7, 280-284 (2014).
- Dunn, T. B. Melanoblasts in the stroma of the parathyroid glands of strain C58 mice. j Natl Cancer Inst. 10, 725-733 (1949).
- Sakai, A. Osteoclast development in immobilized bone is suppressed by parathyroidectomy in mice. J Bone Miner Metab. 23, 8-14 (2005).
- Miao, D. Skeletal abnormalities in Pth-null mice are influenced by dietary calcium. Endocrinology. 145, 2046-2053 (2004).
- Gunther, T. Genetic ablation of parathyroid glands reveals another source of parathyroid hormone. Nature. 406, 199-203 (2000).
- Hough, T. A. Activating calcium-sensing receptor mutation in the mouse is associated with cataracts and ectopic calcification. Proc Natl Acad Sci U S A. 101, 13566-13571 (2004).
- Hannan, F. M. The Calcilytic Agent NPS 2143 Rectifies Hypocalcemia in a Mouse Model With an Activating Calcium-Sensing Receptor (CaSR) Mutation: Relevance to Autosomal Dominant Hypocalcemia Type 1 (ADH1). Endocrinology. 156, 3114-3121 (2015).
- Libutti, S. K. Parathyroid gland-specific deletion of the mouse Men1 gene results in parathyroid neoplasia and hypercalcemic hyperparathyroidism. Cancer Res. 63, 8022-8028 (2003).
- Bi, R. Diphtheria Toxin- and GFP-Based Mouse Models of Acquired Hypoparathyroidism and Treatment with a Long-Acting Parathyroid Hormone Analog. J Bone Miner Res. , (2015).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45, 593-605 (2007).
- Buch, T. A Cre-inducible diphtheria toxin receptor mediates cell lineage ablation after toxin administration. Nat Methods. 2, 419-426 (2005).
- Dunn, T. B. Melanoblasts in the stroma of the parathyroid glands of strain C58 mice. J Natl Cancer Inst. 10, 725-733 (1949).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten