Method Article
Duas técnicas para criar Mice Hypoparathyroid: Paratireoidectomia Usando GFP Glândulas e Difteria-Toxin-Mediated paratireóide Ablação
Neste Artigo
Resumo
Mice with acquired hypoparathyroidism would be useful for studying novel drug therapies for hypoparathyroidism. Two procedures to create such mice are demonstrated. The GFP-PTX mouse is generated by surgical parathyroidectomy guided by green fluorescing parathyroid glands. A second, non-surgical approach is based on parathyroid-specific expression of the diphtheria toxin receptor.
Resumo
Hypoparathyroidism (HP) is a disorder characterized by low levels of PTH which lead to hypocalcemia, hyperphosphatemia, and low bone turnover. The most common cause of the disease is accidental removal of the parathyroid glands during thyroid surgery. Novel therapies for HP are needed, but testing them requires reliable animal models of acquired HP.
Here, we demonstrate the generation of two mouse models of acquired HP. In the GFP-PTX model, mice with green fluorescent protein (GFP) expressed specifically in the parathyroids (PTHcre-mTmG) were created by crossing PTHcre+ mice with Rosa-mTmGfl/fl mice. Green fluorescing parathyroid glands are easily identified under a fluorescence dissecting microscope and parathyroidectomy is performed in less than 20 min. After fluorescence-guided surgery, mice are profoundly hypocalcemic. Contrary to the traditional thyro-parathyroidectomy, this precise surgical approach leaves thyroid glands and thyroid function intact. The second model, which does not require surgery, is based on a diphtheria-toxin approach. PTHcre-iDTR mice, which express the diphtheria toxin (DT) receptor specifically in the parathyroids, were generated by crossing the inducible DTR mouse with the PTHcre mouse. Parathyroid cells are thus rendered sensitive to diphtheria toxin (DT) and can be selectively destroyed by systemically injecting mice with DT. The resulting hypocalcemic phenotype is stable.
Introdução
Desde a primeira descrição sistemática das glândulas paratireóides em humanos e em várias outras espécies por Sandström em 1880 1, a compreensão do significado deste pequeno órgão endócrino para a fisiologia humana e da doença tem melhorado continuamente. glândulas paratireóides secretam hormônio da paratireóide (PTH), o principal regulador do metabolismo do cálcio. PTH também é um hormônio importante para a homeostase de fosfato e remodelação óssea, 1, 2. Remoção acidental ou danos das paratireóides durante a cirurgia no pescoço é a causa mais comum de hipotireoidismo, uma doença caracterizada por níveis baixos de cálcio no sangue, baixa de PTH e fósforo elevados 1.
Para melhor estudo adquiriu hipoparatireoidismo e testar novas terapias, fiáveis e facilmente são necessários modelos de ratos acessíveis. Os ratos são amplamente utilizado em pesquisa, porque uma grande variedade de ferramentas genéticas são umvailable nesta espécie que permitem estudos sobre os mecanismos sofisticados in vivo. No entanto, enquanto paratireoidectomia cirúrgica (PTX) pode ser usado em ratos 2, 3, 4, 5 e mamíferos maiores 6, 7, 8, é tecnicamente muito desafiante em ratos por causa do pequeno tamanho das glândulas e sua distribuição anatômica variável 9. Portanto, thyro-paratireoidectomia (TPTX) é normalmente realizada em ratinhos, em que a tireóide e glândulas paratireóides são removidos em conjunto 10. No entanto, os baixos níveis de hormônio da tireóide são um fator de confusão em potencial em experimentos, o que complica este modelo. Além disso, células C da glândula tiróide, que produzem calcitonina, uma hormona importante na homeostase do cálcio em roedores, também são perdidas após a remoção dos thyroids 11.
Vários modelos genéticos do rato de hipoparatireoidismo existe, que incluem o mouse PTH-nula 12, o mouse GCM2 nulo 13, eo rato Nuf com uma mutação ativadora no receptor sensível ao cálcio (CaSR) 14, 15. No entanto, estes defeitos genéticos já estão presentes durante o desenvolvimento embrionário, e a função das paratiróides é, por conseguinte, já prejudicado durante a embriogénese. Isto pode afectar o desenvolvimento dos órgãos, tais como o esqueleto. Isto contrasta com pacientes com hipoparatireoidismo pós-cirúrgico que adquirem a doença mais tarde na vida. Além disso, alguns desses modelos de ratos apresentam letalidade precoce e fertilidade reduzida, o que complica ainda mais a sua utilização 12, 13, 14.
Nós desenvolvemos dois novos rato modelos para hypoparathyroidism adquiridos. Usando ratos geneticamente modificados que expressam GFP especificamente nas paratiróides permite que as glândulas paratiróides para ser facilmente identificados por remoção cirúrgica sem remover a glândula tiróide. Este ratinho foi gerado através do cruzamento do rato PTH-Cre, que expressa a recombinase Cre sob o controle do promotor de 5,5 kb de PTH 16 com o rato ROSA mTmG. Os PTHcre resultantes; ratos mTmG expressar a proteína verde fluorescente especificamente em células paratireóides. O segundo modelo de ratinho usa o mesmo PTH-Cre, desta vez para remover uma cassete STOP proveniente do rato DTR indutivel, resultando na expressão do receptor da toxina da difteria especificamente nas paratiróides. administração sistêmica de DT destrói as células paratireóides, tornando os animais hypoparathyroid sem cirurgia.
Os dois modelos de mouse apresentados neste estudo demonstram um fenótipo hypocalcemic estável ao longo dos peri de observação de três mesesOD. Os procedimentos são fáceis de executar, o fenótipo é reprodutível, e os ratos hypoparathyroid exibem uma alta taxa de sobrevivência 17.
Protocolo
Este estudo foi aprovado pelo Comitê Institucional de Animal Care and Use (IACUC) do Hospital Geral de Massachusetts. Obter a aprovação institucional adequado para este estudo em animais antes de começar. Algumas técnicas podem ter de ser ajustada de acordo com as exigências locais IACUC.
1. Os murganhos GFP-PTX
- Obter ratos PTHcre + e ratos Rosa-mTmG em 8 - 10 semanas de idade para mais de acasalamento.
- Backcross os ratos PTHcre + (mistos 129; FVB fundo) com camundongos C57BL / 6 para 6 gerações para obter camundongos com C57BL / 6 background.
- Camundongos inbreed PTHcre + obter PTHcre + / + ratos 17.
NOTA: Para efectuar genotipagem, extrair o ADN a partir da ponta da cauda e usá-lo para a PCR. Os iniciadores de PCR para verificar quanto a heterozigocidade e homozigotia do transgene PTHcre são as seguintes: iniciador A frente, CCTGTCAAGGATGTGGAAGA, inverter o iniciador A ', TCAGATCACACCACACAGCA, forward iniciador B, CAGTTGTCTTTAGTTTACTCAGCATCAG, o iniciador inverso B ', GATAATCGCGAACATCTTCAGGTT 17. - Cruz PTHcre + / + camundongos 16 com Rosa-mTmG ratos 18. Desmamar PTHcre; filhotes mTmG quando 4 semanas de idade.
- Anestesiar 8 - 10 semanas de idade PTHcre; mTmG ratinhos por injecção ip de tribromoetanol (Avertin) a 0,6 mg / g de peso corporal, ou outros agentes, tais como a cetamina / xilazina. Use buprenorfina 0,1 mg / kg sc a cada 12 h, como um analgésico durante 48 horas após a cirurgia, de acordo com um protocolo aprovado. Assegurar profundidade adequada da anestesia pelo reflexo do dedo retirada aperto ou outros meios. Colocar o animal em decúbito dorsal.
- Estender e preparar a região do pescoço ventral raspando a pele usando lâminas de aresta única. Desinfectar a pele raspada com uma almofada anti-séptica povidona iodo.
- Cobrir o animal com campos cirúrgicos estéreis para reduzir a contaminação do sítio cirúrgico e usar microfone autoclavadoinstrumentos rosurgical para o procedimento cirúrgico.
- Cortar uma incisão longitudinal de 2 cm de pele com um bisturi cirúrgico. Dissecar fascia e empurre as glândulas salivares para o lado por dissecção romba com uma pinça serrilhada curvas.
- Sob o microscópio de dissecção utilizando luz halógena e um 4 - ampliação de 5X, cortar e separar os músculos paratraqueais usando uma pinça afiada dicas e expor a traqueia.
- Identificar a glândula tireóide, com o lóbulo direito e esquerdo localizado ao lado da traquéia.
- Mudar a fonte de luz para luz fluorescente e visualizar as duas glândulas paratireóides verde-fluorescente.
NOTA: Tipicamente, as duas glândulas paratiróides estão localizados em ou perto da superfície das glândulas da tiróide, mas, ocasionalmente, que estão localizados mais longe. - Remova cuidadosamente as glândulas paratireóides verdes usando pinça cirúrgica e tesoura. Use gaze estéril para hemostasia e verifique cuidadosamente ao longo da traquéia para garantir que todo o tecido verde foi removido.
- Feche os músculos paratraqueais por sutura interrompida usando 6-0 poliglactina 910 suturas. Feche a incisão na pele por Halsted sutura usando 6-0 poliglactina 910 suturas.
- Opcional: Injectar 10 mL / g de peso corporal solução normal, estéril de cloreto de sódio a 0,9% para os ratos para a reposição de líquidos.
- Colocar os animais pós-cirúrgicas para uma gaiola separada em uma incubadora quente (37 ° C) para a recuperação da temperatura corporal. Uma vez que os ratos estão despertos e na posição de decúbito, colocar comida pellet e água com um pouco de comida de gelatina no chão da gaiola.
- Depois de um período de observação pós-cirúrgica de 2 h, o retorno do mouse para o biotério e siga os requisitos locais para o cuidado pós-cirúrgico.
- 3 dias após a paratireoidectomia, obter 10 mL de sangue da cauda e medir sangue ionizado Ca ++ utilizando um analisador, como o sistema de gás de sangue Ca ++ / analisador de pH. Paratireoidectomia bem sucedidos resultados no sangue ionizado Ca ++ igual ou inferior a -2SD de con operação simuladaratinhos trolo (1,20 mmol / L nas nossas experiências de n = 30).
2. PTH Cre-IDTR Ratos
- Obter PTHcre + e DTR fl / fl ratos em 8 - 10 semanas de idade para o acasalamento.
- Backcross os ratos PTHcre (mistos 129; FVB fundo) com camundongos C57BL / 6 para 6 gerações para obter camundongos com C57BL / 6 background.
- Inbreed o PTHcre + (C57BL / 6, fundo) para obter ratinhos PTHcre + / + 17 ratinhos.
NOTA: Para efectuar genotipagem, de ADN de ratinhos pontas da cauda foi extraído e usado para PCR. Primers de genotipagem: iniciador directo A, CCTGTCAAGGATGTGGAAGA, o iniciador inverso A ', TCAGATCACACCACACAGCA, frente iniciador B, CAGTTGTCTTTAGTTTACTCAGCATCAG, o iniciador inverso B', GATAATCGCGAACATCTTCAGGTT 17. - Companheiro PTHcre + / + camundongos 16 com DTR fl / fl ratos 19 para obter camundongos PTHcre-IDTR.
- Preparar a solução DT diluindo diphtherium pó toxina com solução salina estéril para uma concentração de 0,5 ug / mL. alíquotas de filtro estéril e armazenar a -80 ° C.
- Escolha 8 - ratos 10 semanas de idade PTHcre-IDTR para experimento de injeção. Descongelar DT aliquota à temperatura ambiente, DT administrar por via intraperitoneal no peso corporal do animal 5 ug / kg (10 mL / g). Para a eficiência máxima e menos toxicidade, a administração DT é repetido para um total de 2 injecções com um intervalo de 3 dias 17.
- 3 dias após a segunda injecção, levar de 10 mL de sangue da cauda de cada PTHcre-IDTR / PTHcre-IDTR-mTmG rato e medir Ca ++ sangue usando um sistema de gás de sangue Ca ++ / analisador de pH.
NOTA: Definimos ratinhos com ionizado no sangue de Ca ++ menor do que 1,18 mmol / L como ratinhos hypoparathyroid, que é igual a 2 DP abaixo da média de ratos de controlo injectados com o veículo (n = 22).
Resultados
Localização do Glândulas Paratireóides
Em primeiro lugar, que registaram a distribuição das glândulas paratiróides de 54 ratinhos PTHcre-mTmG como observadas ao microscópio de dissecção fluorescente. 74% (40/54) ratinhos tinham duas glândulas paratiróides verde (Figura 1A, C, E), 26% (14/54) ratinhos tinham um terceiro glândula paratiróide adicional (Figura 1B, D, F). Não foram observadas rato com um único glândula ou mais do que três glândulas. Normalmente, as glândulas paratireóides foram localizados perto da fronteira superior da glândula tireóide (58%, 71/122; Figura 1A (1,2), B (1,2), C (2), D (1,2), E (2), F (3)). 27% (33/122) glândulas foram localizados perto da borda inferior da glândula tireóide (Figura 1C (1), D (3), F (1)) e 13% (16/122) foram localizados longe do tglândula hyroid (Figura 1B (3), E (1), F (2)). Os nossos resultados são consistentes com e estender descobertas anteriores de diferentes localizações das glândulas paratireóides 20.
Os murganhos GFP-PTX
Toda a cirurgia da anestesia para fechar a incisão na pele levou cerca de 20 min por mouse. A taxa de sobrevivência de ratos pós-cirúrgicas ao longo de um período de observação de 3 meses foi de 96,3% (53/55). 92,4% (49/53) camundongos GFP-PTX apresentaram níveis de cálcio ionizado que eram 2 DP abaixo da média dos ratos de controle operados por simulação ou inferior. O fenótipo hypoparathyroid nos murganhos GFP-PTX (hipocalcemia, baixo de PTH e fosfato no soro elevado) permaneceu estável durante todo o tempo de observação de 3 meses. Importante, a função da tiróide não foi diferente de animais operados de forma simulada os 3 meses após a cirurgia (TSH = 42 ± 24 vs 30 ± 15 mU / L, P = 0,171; T4 = 30,0 ± 0,6 vs. 3,1 ± 0,9 ug / dl, p = 0,707 (Figura 2).
PTH-CRE-IDTR Ratos
DT injetaram em ratos PTH-Cre-IDTR hypoparathyroidism desenvolvido (cálcio no sangue baixo ionizado, fósforo no sangue elevados, e níveis de PTH inadequadamente baixa normais). Descrevemos previamente que as células positivas alguns PTH escapar da ablação por toxina da difteria, explicando o mensurável circulante PTH e, por conseguinte, o fenótipo pouco mais suave de 17 destes ratinhos.
Hipoparatireoidismo em camundongos GFP-PTX e PTH-cre-IDTR Mice
Reduções significativas de Ca ++ no sangue e os níveis de PTH no soro foram observadas em GFP-PTX ratos 3 dias após a cirurgia, em comparação aos níveis observados em ratos operados por simulação (Ca ++ = 1,05 ± 0,40 vs. 1,30 ± 0,03 mmol / L, p <0,05; PTH = 32 ± 22 vs 580 ± 137 pg / ml, p <0,05). O fenótipo hypoparathyroidism era estável ao longo do período de observação de 3 meses (Figura 3A, reimpresso com permissão de (referência # 17)). Após 2 injecções de 5 ug / kg de DT e 3 intervalo de dias, a dose e regime optimizado para usar a menor quantidade de DT para dar o fenótipo hypoparathyroid máxima, o DT ratinhos injectados-IDTR Cre-PTH mostrou hipocalcemia significativa e PTH reduzida em comparação com ratos de controlo do veículo, que persistiram durante o período de observação de 90 dias (Ca ++ = 1,10 ± 0,07 mmol / L vs 1,26 ± 0,05 mmol / L, p <0,05; PTH = 218 ± 156 pg / ml vs. 572 ± 164 pg / mL, p <0,05) (Figura 3B, reimpresso com permissão de (referência # 17)).
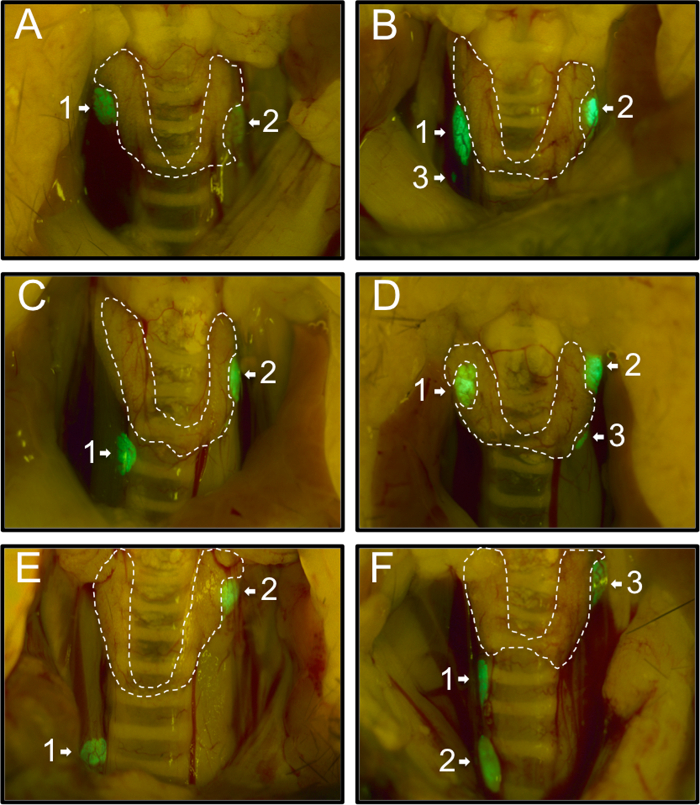
Figura 1: Imagens representativas dos diferentes locais da paratireóide glândulas em 54 Mice PTHcre-mTmG sob fluorescente dissecção microscópica. Os ratinhos tinham dois (A, C, E) ou três (B, D, F), as glândulas paratiróides verdes. Glândulas paratireóides maioria estavam localizados perto da borda superior (A (1,2), B (1,2), C (2), D (1,2), E (2), F (3) ou perto da borda inferior da glândula tiróide (C (1), D (3), F (1)). Em casos raros, alguns foram localizados ectopicamente (B (3), E (1), F (2)). por favor clique aqui para ver uma versão maior desta figura.
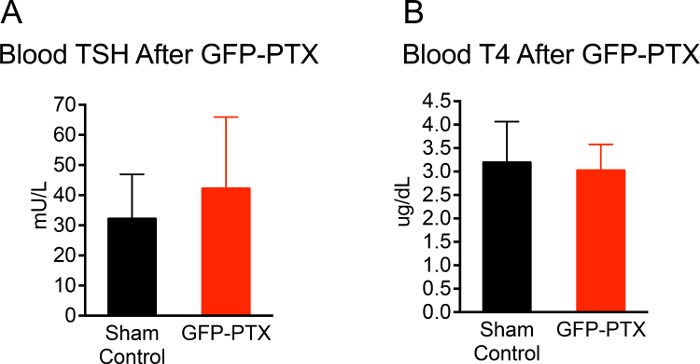
Figura 2: TSH e T4 Nível de Mice GFP-PTX. 3 meses depois de GFP-PTX, o soro foi obtido por TSH e T4 measurem entos. GFP-PTX ratinhos apresentaram concentrações de TSH concentrações (42 ± 24 mU / L) (A) e T4 (3,0 ± 0,6 mg / dL) (B) que não eram diferentes dos ratinhos de controlo (TSH = 30 ± 15 mU / L, P = 0,171, n = 11, T4 = 3,1 ± 0,9, p = 0,707, n = 11). Por favor clique aqui para ver uma versão maior desta figura.
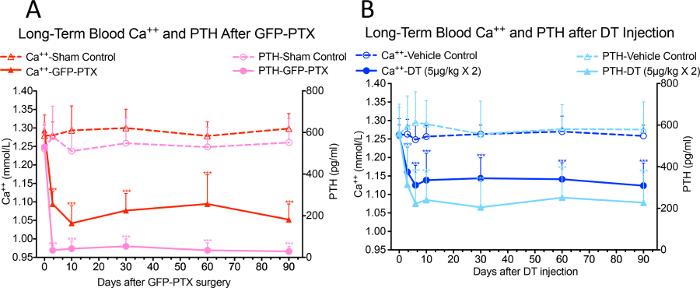
Figura 3: Blood Ca ++ e os níveis de PTH em camundongos GFP-PTX e DT injetaram em ratos-IDTR CRE-PTH. Ambos os camundongos GFP-PTX (A) e DT injetaram em ratos (B) exibiram hipocalcemia estável CRE-IDTR-PTH e reduziu os níveis de PTH acima de 3 período de observação mês (N = 6-8, *** p <0,001) (re-impressa com a permissão de referência # 17).es / ftp_upload / 55010 / 55010fig3large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
Discussão
Nós demonstramos a técnica de paratireoidectomia guiada-GFP utilizando camundongos transgênicos com expressão GFP seletivamente nas glândulas paratireóides. Nos PTHcre; ratos mTmG, a fluorescência de casal (a GFP verde em células Cre-expressas e tomate vermelho na não-Cre células expressaram) nos permitiu identificar claramente, e para remover precisamente todas as glândulas paratireóides sem remover os tireóide. Enquanto nós preferimos o uso dos ratinhos mTmG dupla fluorescência para identificar a capacidade de um tecido não-paratiróide vermelho fluorescente, o nosso procedimento também deve funcionar bem com animais individuais fluorescentes tais como vermelho do tomate (B6.Cg-Ct (Rosa) 26Sortm14 ( CAG-tdTomato) Hze / J) mouse. O procedimento é relativamente fácil de realizar, requer cerca de 20 minutos por rato, e resulta num fenótipo hypoparathyroid grave e prolongada.
Além disso, outra vantagem das glândulas paratiróides GFP-positiva é a facilidade de detecção das glândulas paratiróides aberrantes. Os nossos estudos demonstrammislocalization das paratiróides em cerca de um quarto de ratinhos B6 (Figura 1), que são facilmente detectadas no nosso modelo de ratinho pela fluorescência verde. Contrariamente ao tíreo-paratiroidectomia, a nossa técnica evita a remoção da tiróide com consequente necessidade de substituição da hormona da tiróide e o efeito desconhecido de remoção de células C da tiróide produtoras de calcitonina. glândulas paratiróides marcado por fluorescência pode também ser utilizado para outras investigações que requerem o isolamento das glândulas paratiróides. A limitação deste modelo inclui a exigência para a cirurgia. habilidades de microcirurgia básicas e um microscópio de dissecação com uma fonte de luz fluorescente são obrigatórios.
Uma segunda técnica para gerar ratinhos hypoparathyroid que elimina a necessidade de cirurgia é demonstrada. Difteria toxina-ratinhos tratados PTHcre-IDTR exibem um fenótipo hypoparathyroidism mais suave, mas simplesmente exigir injetar DT intraperitoneal no rato. A parte crítica for gerando este modelo foi a otimização da dose e regime de dosagem. Altas doses de DT, levou a toxicidade mas doses baixas diminuiu a eficácia da abordagem. Nós determinamos que o regimento dose de 2 injeções com 5 mg / kg, administrada 3 dias de intervalo, resultou em hipocalcemia confiável e estável sem mortalidade / mínima.
Em última análise, esperamos que estas duas abordagens fornecem modelos úteis de mouse para hypoparathyroidism adquirido. Usando um romance PTH de ação prolongada, que relataram o primeiro uso de ambos os modelos para determinar a eficácia de novas drogas para o hipoparatireoidismo 17.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Este trabalho foi financiado pelo NIH concede R01-DK100584 e China State chave do Laboratório de Doenças Orais Abrir SKLOD2015OF01 Financiamento (RB). Agradecemos Wenping Zhao, Tadatoshi Sato, e Kelly Lauter para obter ajuda.
Materiais
| Name | Company | Catalog Number | Comments |
| ROSAmT/mG mice | The Jackson Laboratory | 7676 | |
| PTH-Cre mice | The Jackson Laboratory | 5989 | |
| iDTRmice | The Jackson Laboratory | 7900 | |
| 6-0 polyglactin 910 suture with needle | Ethicon, Inc | J510G | |
| Safety Single Edge Razor Blades | American Safety Razor Company | 66-0089 | |
| Disposable Scalpel | Feather Safety Razor Co., LTD | 72042-11 | |
| Povidone-Iodine Prep Pads | Dynarex Corporation | 1108 | |
| Ply gauze | Busse. Inc | BHD707 | |
| 0.9% Sodium Chloride Solution | HOSPIRA Worldwide, Inc | 07983-09 | |
| 1 mL 29 G Insulin Syringe | BECTON DICKINSON | 329622 | |
| Surgical Incise Drapes | 3M | 6640EZ | |
| Dumstar Biology forceps | Roboz Surgical Instrument Co., Inc | RS-4984 | |
| Micro Dissecting Spring Scissors | Roboz Surgical Instrument Co., Inc | RS-5605 | |
| Needle Holder | MILTEX.,Inc | V98-42 | |
| 2,2,2-Tribromethanol | Sigma-Aldrich | T48402 | |
| 2-Methyl-2-Butanol | Sigma-Aldrich | 152463 | For dissolve the 2,2,2-Tribromethanol |
| Diphtheria Toxin Powder | Sigma-Aldrich | D0564 | Dissolve in 0.9% sodium chloride solution at 1 mg/mL as the stock solution in -80 °C |
| Multicap Blood Collection Capillary tubes | Siemens Healthcare Diagnostics Ltd | 855578 | For collecting blood in iCa2+ analysis using RapidLab 348 Ca2+/pH analyzer |
| RapidLab 348 Ca2+/pH analyzer | Siemens Healthcare | For iCa2+ analysis |
Referências
- Brandi, M. L., Brown, E. M. Hypoparathyroidism. , Springer. (2015).
- van Abel, M. Coordinated control of renal Ca(2+) transport proteins by parathyroid hormone. Kidney Int. 68, 1708-1721 (2005).
- Sebastian, E. M., Suva, L. J., Friedman, P. A. Differential effects of intermittent PTH(1-34) and PTH(7-34) on bone microarchitecture and aortic calcification in experimental renal failure. Bone. 43, 1022-1030 (2008).
- Rodriguez-Ortiz, M. E. Calcium deficiency reduces circulating levels of FGF23. J Am Soc Nephrol. 23, 1190-1197 (2012).
- Liao, H. W. Relationship between Fibroblast Growth Factor 23 and Biochemical and Bone Histomorphometric Alterations in a Chronic Kidney Disease Rat Model Undergoing Parathyroidectomy. PloS one. 10, e0133278(2015).
- Fox, J., Care, A. D. Effect of low calcium and low phosphorus diets on the intestinal absorption of water in intact and parathyroidectomized pigs. Calcif Tissue Int. 31, 253-255 (1980).
- Finco, D. R., Brown, S. A., Ferguson, D. C., Crowell, W. A. Selective parathyroidectomy of the dog. Can J Vet Res. 57, 288-292 (1993).
- Can, I. Parathyroid allotransplantation in rabbits without cultivation. Int J Clin Exp Med. 7, 280-284 (2014).
- Dunn, T. B. Melanoblasts in the stroma of the parathyroid glands of strain C58 mice. j Natl Cancer Inst. 10, 725-733 (1949).
- CRIVER. , Available from: http://www.criver.com/products-services/basic-research/rodent-surgery/soft-tissue-procedures (2010).
- Sakai, A. Osteoclast development in immobilized bone is suppressed by parathyroidectomy in mice. J Bone Miner Metab. 23, 8-14 (2005).
- Miao, D. Skeletal abnormalities in Pth-null mice are influenced by dietary calcium. Endocrinology. 145, 2046-2053 (2004).
- Gunther, T. Genetic ablation of parathyroid glands reveals another source of parathyroid hormone. Nature. 406, 199-203 (2000).
- Hough, T. A. Activating calcium-sensing receptor mutation in the mouse is associated with cataracts and ectopic calcification. Proc Natl Acad Sci U S A. 101, 13566-13571 (2004).
- Hannan, F. M. The Calcilytic Agent NPS 2143 Rectifies Hypocalcemia in a Mouse Model With an Activating Calcium-Sensing Receptor (CaSR) Mutation: Relevance to Autosomal Dominant Hypocalcemia Type 1 (ADH1). Endocrinology. 156, 3114-3121 (2015).
- Libutti, S. K. Parathyroid gland-specific deletion of the mouse Men1 gene results in parathyroid neoplasia and hypercalcemic hyperparathyroidism. Cancer Res. 63, 8022-8028 (2003).
- Bi, R. Diphtheria Toxin- and GFP-Based Mouse Models of Acquired Hypoparathyroidism and Treatment with a Long-Acting Parathyroid Hormone Analog. J Bone Miner Res. , (2015).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45, 593-605 (2007).
- Buch, T. A Cre-inducible diphtheria toxin receptor mediates cell lineage ablation after toxin administration. Nat Methods. 2, 419-426 (2005).
- Dunn, T. B. Melanoblasts in the stroma of the parathyroid glands of strain C58 mice. J Natl Cancer Inst. 10, 725-733 (1949).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados