Method Article
Due tecniche per creare Mice Hypoparathyroid: paratiroidectomia Uso GFP Ghiandole ed difterite-tossina-Mediated paratiroideo Ablazione
In questo articolo
Riepilogo
Mice with acquired hypoparathyroidism would be useful for studying novel drug therapies for hypoparathyroidism. Two procedures to create such mice are demonstrated. The GFP-PTX mouse is generated by surgical parathyroidectomy guided by green fluorescing parathyroid glands. A second, non-surgical approach is based on parathyroid-specific expression of the diphtheria toxin receptor.
Abstract
Hypoparathyroidism (HP) is a disorder characterized by low levels of PTH which lead to hypocalcemia, hyperphosphatemia, and low bone turnover. The most common cause of the disease is accidental removal of the parathyroid glands during thyroid surgery. Novel therapies for HP are needed, but testing them requires reliable animal models of acquired HP.
Here, we demonstrate the generation of two mouse models of acquired HP. In the GFP-PTX model, mice with green fluorescent protein (GFP) expressed specifically in the parathyroids (PTHcre-mTmG) were created by crossing PTHcre+ mice with Rosa-mTmGfl/fl mice. Green fluorescing parathyroid glands are easily identified under a fluorescence dissecting microscope and parathyroidectomy is performed in less than 20 min. After fluorescence-guided surgery, mice are profoundly hypocalcemic. Contrary to the traditional thyro-parathyroidectomy, this precise surgical approach leaves thyroid glands and thyroid function intact. The second model, which does not require surgery, is based on a diphtheria-toxin approach. PTHcre-iDTR mice, which express the diphtheria toxin (DT) receptor specifically in the parathyroids, were generated by crossing the inducible DTR mouse with the PTHcre mouse. Parathyroid cells are thus rendered sensitive to diphtheria toxin (DT) and can be selectively destroyed by systemically injecting mice with DT. The resulting hypocalcemic phenotype is stable.
Introduzione
Dal momento che la prima descrizione sistematica delle ghiandole paratiroidi in umano e in diverse altre specie di Sandström nel 1880 1, comprendere il significato di questo piccolo organo endocrino per la fisiologia umana e la malattia ha continuamente migliorato. ghiandole paratiroidee secernono l'ormone paratiroideo (PTH), il principale regolatore del metabolismo del calcio. PTH è anche un ormone importante per l'omeostasi fosfato e turnover osseo 1, 2. Rimozione accidentale o danneggiamento delle paratiroidi durante l'intervento chirurgico al collo è la causa più comune di ipoparatiroidismo, una malattia caratterizzata da bassi livelli di calcio nel sangue, bassi PTH, e fosforo elevati 1.
Per una migliore studio acquisito ipoparatiroidismo e nuove terapie di prova, affidabili e facilmente sono necessari modelli di mouse accessibili. I topi sono ampiamente utilizzati nella ricerca perché una grande varietà di strumenti genetici sono unvailable in questa specie che permettono sofisticati studi meccanicistici in vivo. Tuttavia, mentre paratiroidectomia chirurgica (PTX) può essere utilizzato in ratti 2, 3, 4, 5, e mammiferi superiore 6, 7, 8, è tecnicamente molto impegnativo in topi a causa delle piccole dimensioni delle ghiandole e la loro distribuzione anatomica variabile 9. Pertanto, tiro-paratiroidectomia (TPTX) viene in genere eseguita in topi, in cui la tiroide e paratiroidi vengono rimossi insieme 10. Tuttavia, i bassi livelli di ormone tiroideo sono un potenziale fattore confondente in esperimenti, complicando questo modello. Inoltre, cellule C all'interno della ghiandola tiroidea, che producono calcitonina, un ormone importante nella omeostasi del calcio nei roditori, sono anche perso dopo la rimozione dei thyroids 11.
Diversi modelli genetici murini di ipoparatiroidismo esistono, che includono il mouse PTH-null 12, il mouse GCM2-null 13, e il mouse Nuf con una mutazione attivante del recettore sensibile al calcio (CaSR) 14, 15. Tuttavia, questi difetti genetici sono già presenti durante lo sviluppo embrionale, e la funzione delle paratiroidi è quindi già alterata durante l'embriogenesi. Questo può influenzare lo sviluppo di organi, come lo scheletro. Questo contrasta con i pazienti con ipoparatiroidismo post-chirurgica che acquisiscono la malattia più tardi nella vita. Inoltre, alcuni di questi modelli di topo esibiscono mortalità precoce e riduzione della fertilità, il che complica ulteriormente il loro uso 12, 13, 14.
Abbiamo sviluppato due nuovo mouse modelli per ipoparatiroidismo acquisito. Utilizzando topi geneticamente ingegnerizzati che esprimono GFP in particolare nelle paratiroidi permette alle ghiandole paratiroidee per essere facilmente identificati per la rimozione chirurgica senza rimuovere la ghiandola tiroidea. Questo mouse è stato generato attraversando il mouse PTH-Cre, che esprime Cre ricombinasi sotto il controllo del promotore 5,5 kb PTH 16 con il mouse ROSA mTmG. I PTHcre risultanti; topi mTmG esprimono la proteina fluorescente verde specificamente in cellule paratiroidee. Il secondo modello di topo utilizza lo stesso PTH-Cre, questa volta per rimuovere una cassetta di STOP dal mouse inducibile DTR, con conseguente espressione del recettore tossina difterica specifico nelle paratiroidi. La somministrazione sistemica di DT distrugge le cellule paratiroidee, rendendo gli animali hypoparathyroid senza intervento chirurgico.
I due modelli di mouse presentati in questo studio dimostrano un fenotipo hypocalcemic stabile negli peri di osservazione a tre mesiod. Le procedure sono facili da eseguire, il fenotipo è riproducibile, ed i topi hypoparathyroid presentano un alto tasso di sopravvivenza 17.
Protocollo
Questo studio è stato approvato dal Comitato Istituzionale Animal Care e Usa (IACUC) del Massachusetts General Hospital. Ottenere l'approvazione istituzionale adeguato per questo studio sugli animali prima di iniziare. Alcune tecniche potrebbero dover essere regolata in base alle esigenze IACUC locali.
1. I topi GFP-PTX
- Ottenere topi PTHcre + e topi Rosa-mTmG a 8 - 10 settimane per un ulteriore accoppiamento.
- Backcross le PTHcre + topi (mixed 129; FVB sfondo) con C57BL 6 topi / da 6 generazioni di ottenere topi con C57BL / 6 sfondo.
- Topi Inbreed PTHcre + per ottenere PTHcre + / + 17 topi.
NOTA: Per eseguire la genotipizzazione, estrarre il DNA dalla punta della coda e usarlo per PCR. I primer PCR per verificare la presenza di eterozigosi e omozigosi del transgene PTHcre sono i seguenti: Forward Primer A, CCTGTCAAGGATGTGGAAGA, invertire innesco A ', TCAGATCACACCACACAGCA, fORIZZONTE Primer B, CAGTTGTCTTTAGTTTACTCAGCATCAG, invertire Primer B ', GATAATCGCGAACATCTTCAGGTT 17. - Croce PTHcre + / + topo 16 con Rosa-mTmG topi 18. Svezzare PTHcre; cuccioli mTmG quando 4 settimane di vita.
- Anestetizzare 8 - 10 settimane PTHcre; topi mTmG mediante iniezione ip di tribromoethanol (Avertin) a 0,6 mg / g di peso corporeo, o altri agenti come ketamina / xylazina. Utilizzare buprenorfina 0,1 mg / kg sc ogni 12 h come analgesico per 48 ore dopo l'intervento secondo un protocollo approvato. Garantire un'adeguata profondità dell'anestesia dal riflesso punta pizzico ritiro o altri mezzi. Posto l'animale in posizione supina.
- Estendere e preparare la regione ventrale del collo con la rasatura della pelle utilizzando lame singolo bordo. Disinfettare la pelle rasata con un tampone antisettico povidone iodio.
- Coprire l'animale con teli chirurgici sterili per ridurre la contaminazione del sito chirurgico e utilizzare il microfono autoclavatostrumenti rosurgical per la procedura chirurgica.
- Tagliare un'incisione di 2 cm longitudinale nella pelle con un bisturi chirurgico. Sezionare fascia e spingere le ghiandole salivari a lato per via smussa con pinze dentellate curve.
- Sotto il microscopio dissezione con luce alogena e un 4 - di ingrandimento 5X, tagliare e separare i muscoli paratracheali con pinze taglienti suggerimenti ed esporre la trachea.
- Identificare la ghiandola tiroidea con il destro e sinistro del lobo situato accanto alla trachea.
- Accendere la sorgente di luce a luce fluorescente e visualizzare le due ghiandole paratiroidi verdi fluorescenti.
NOTA: Tipicamente, i due ghiandole paratiroidee sono situati in corrispondenza o in prossimità della superficie delle ghiandole tiroidee, ma occasionalmente, si trovano più lontano. - Rimuovere con attenzione le ghiandole paratiroidi verdi con pinze chirurgiche e forbice. Utilizzare garza sterile per l'emostasi e controllare attentamente lungo la trachea per garantire che tutti i tessuti verde è stato rimosso.
- Chiudere i muscoli paratracheali da sutura interrotta utilizzando 6-0 Polyglactin 910 punti di sutura. Chiudere l'incisione cutanea da Halsted sutura utilizzando 6-0 Polyglactin 910 punti di sutura.
- Opzionale: Iniettare 10 ml / g di peso corporeo normale sterile 0,9% soluzione di cloruro di sodio per i topi per la sostituzione del fluido.
- Posizionare animali postchirurgici ad una gabbia separato su un incubatore calda (37 ° C) per il recupero della temperatura corporea. Una volta che i topi sono svegli e nella posizione reclinata, mettere pellet chow e acqua con cibo gelatina sul pavimento della gabbia.
- Dopo un periodo di osservazione post-chirurgica di 2 h, tornare mouse per l'impianto animale e seguire le disposizioni locali per la cura post-chirurgica.
- 3 giorni dopo paratiroidectomia, ottenere il sangue coda 10 ml e misurare ionizzato Ca ++ utilizzando un analizzatore di sangue, come il sistema di gas del sangue Ca ++ analizzatore / pH. Risultati paratiroidectomia successo nel sangue ionizzati Ca ++ uguale o inferiore a -2SD di sham-operated contopi trollo (1,20 mmol / L nei nostri esperimenti di n = 30).
2. PTH-Cre-IDTR Mice
- Ottenere PTHcre + e DTR fl / fl topi a 8 - 10 settimane di vita per l'accoppiamento.
- Backcross i topi PTHcre (misti 129; FVB sfondo) con C57BL 6 topi / da 6 generazioni di ottenere topi con C57BL / 6 sfondo.
- Inbreed il PTHcre + (C57BL / 6 sfondo) topi per ottenere PTHcre + / + 17 topi.
NOTA: Per eseguire la genotipizzazione, il DNA di topi punte di coda è stato estratto e utilizzato per la PCR. Primer di genotipizzazione: Forward Primer A, CCTGTCAAGGATGTGGAAGA, invertire innesco A ', TCAGATCACACCACACAGCA, Forward Primer B, CAGTTGTCTTTAGTTTACTCAGCATCAG, invertire Primer B', GATAATCGCGAACATCTTCAGGTT 17. - Mate PTHcre + / + topo 16 con DTR fl / fl topi 19 per ottenere topi PTHcre-IDTR.
- Preparare la soluzione DT diluendo diphtheriuna polvere tossina con soluzione salina sterile ad una concentrazione di 0,5 mg / mL. filtro sterile, e memorizzare aliquote a -80 ° C.
- Scegli 8 - 10 settimane i topi PTHcre-IDTR per esperimento iniezione. Scongelare DT un'aliquota a temperatura ambiente, amministrare DT intraperitoneale a 5 mg / kg (10 ml / g) di peso corporeo dell'animale. Per l'efficienza massima e almeno tossicità, amministrazione DT viene ripetuta per un totale di 2 iniezioni in un intervallo di 3 giorni 17.
- 3 giorni dopo la seconda iniezione, prendere 10 microlitri di sangue coda da ogni PTHcre-IDTR / PTHcre-IDTR-mTmG mouse e misurare Ca ++ sangue utilizzando un sistema Emogasanalisi Ca ++ analizzatore / pH.
NOTA: Definiamo topi con sangue ionizzati Ca ++ inferiore a 1,18 mmol / L come topi hypoparathyroid, che equivale 2SD al di sotto della media dei topi di controllo dei veicoli a iniezione (n = 22).
Risultati
Location della paratiroideo Ghiandole
In primo luogo, abbiamo registrato la distribuzione delle ghiandole paratiroidi di 54 topi PTHcre-mTmG come osservato al microscopio a fluorescenza dissezione. 74% (40/54) topi aveva due ghiandole paratiroidi verdi (Figura 1A, C, E), 26% (14/54) topi ha avuto un ulteriore terzo ghiandola paratiroidea (Figura 1B, D, F). Non sono state osservate mouse con una sola ghiandola o più di tre ghiandole. Di solito, ghiandole paratiroidi si trovavano vicino al confine superiore della ghiandola tiroidea (58%, 71/122, la figura 1A (1,2), B (1,2), C (2), D (1,2), E (2), F (3)). 27% (33/122) ghiandole erano situate vicino al bordo inferiore della ghiandola tiroidea (Figura 1C (1), D (3), F (1)), e il 13% (16/122) sono stati trova lontano dal tghiandola hyroid (Figura 1B (3), E (1), F (2)). I nostri risultati sono coerenti con precedenti ed estendere i risultati di varie posizioni delle ghiandole paratiroidi 20.
I topi GFP-PTX
L'intero intervento chirurgico da anestesia per chiudere l'incisione cutanea ha preso circa 20 minuti per ogni mouse. Il tasso di sopravvivenza dei topi post-chirurgiche nel corso di un periodo di osservazione di 3 mesi è stata del 96,3% (53/55). 92,4% (49/53) topi GFP-PTX esposti i livelli di calcio ionizzato che erano 2 DS al di sotto della media dei topi di controllo sham o inferiore. Il fenotipo hypoparathyroid nei topi GFP-PTX (ipocalcemia, basso PTH e di fosfato elevata) è rimasto stabile per tutto il periodo di osservazione di 3 mesi. È importante sottolineare che la funzione tiroidea non era diverso dagli animali sham-operati 3 mesi dopo l'intervento (TSH = 42 ± 24 vs 30 ± 15 mU / L, p = 0,171; T4 = 3.0 ± 0,6 contro 3,1 ± 0,9 mg / dL, p = 0,707 (Figura 2).
PTH-cre-IDTR Mice
DT iniettato topi PTH-Cre-IDTR ipoparatiroidismo sviluppato (calcio nel sangue basso ionizzato, elevata di fosforo nel sangue, e inappropriatamente basso normali livelli di PTH). Abbiamo precedentemente riportato che le cellule positive pochi PTH sfuggire l'ablazione con tossina difterica, spiegando il misurabile circolante PTH e quindi la un po 'più mite fenotipo di questi topi 17.
Ipoparatiroidismo nei topi GFP-PTX e PTH-cre-IDTR Mice
Sono state osservate significative riduzioni di Ca ++ nel sangue e livelli di PTH sierici di GFP-PTX topi 3 giorni dopo l'intervento chirurgico, rispetto ai livelli trovati in topi sham (Ca ++ = 1.05 ± 0.40 vs. 1.30 ± 0.03 mmol / L, p <0.05; PTH = 32 ± 22 vs 580 ± 137 pg / mL, p <0,05). Il fenotipo ipoparatiroidismo è rimasta stabile nel corso del periodo di osservazione a 3 mesi (Figura 3A, ristampato con il permesso (riferimento # 17)). Dopo 2 iniezioni di 5 mg / kg DT ad intervalli di 3 giorni, la dose e il regime ottimizzato per utilizzare la quantità minima di DT per dare il fenotipo hypoparathyroid massima, il DT iniettato topi-IDTR PTH-cre mostrato ipocalcemia significativa e ridotta PTH rispetto ai topi di controllo del veicolo, che persistevano nel corso del periodo di osservazione di 90 giorni (Ca ++ = 1.10 ± 0.07 mmol / L vs 1.26 ± 0.05 mmol / L, p <0.05; PTH = 218 ± 156 pg / mL vs 572 ± 164 pg / mL, p <0,05) (Figura 3B, ristampato con il permesso (riferimento # 17)).
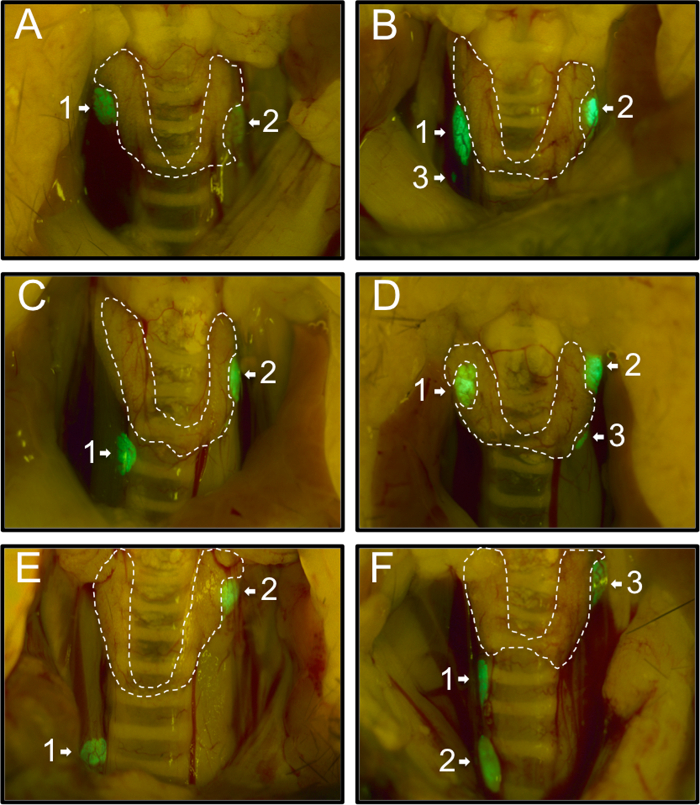
Figura 1: rappresentativi immagini delle varie località del paratiroidi in 54 topi PTHcre-mTmG sotto fluorescente dissezione microscopio. I topi aveva uno due (A, C, E) o tre (B, D, F) ghiandole paratiroidee verdi. La maggior parte delle ghiandole paratiroidi si trovavano vicino al confine superiore (A (1,2), B (1,2), (2) C, D (1,2), E (2), F (3) o in prossimità del bordo inferiore della ghiandola tiroidea (C (1), D (3), F (1)). In rari casi, alcuni sono stati trova ectopica (B (3), E (1), F (2)). clicca qui per visualizzare una versione più grande di questa figura.
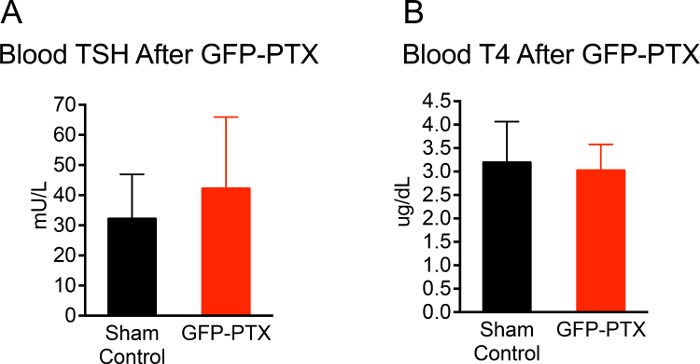
Figura 2: TSH e T4 Livello di topi GFP-PTX. 3 mesi dopo la GFP-PTX, il siero è stato ottenuto per il TSH e T4 measurem Ent. GFP-PTX topi hanno mostrato concentrazioni di TSH (42 ± 24 mU / L) concentrazioni di (A) e T4 (3,0 ± 0,6 mg / dL) (B) che non erano differenti da topi di controllo (TSH = 30 ± 15 mU / L, P = 0,171, n = 11, T4 = 3.1 ± 0.9, p = 0,707, n = 11). Clicca qui per vedere una versione più grande di questa figura.
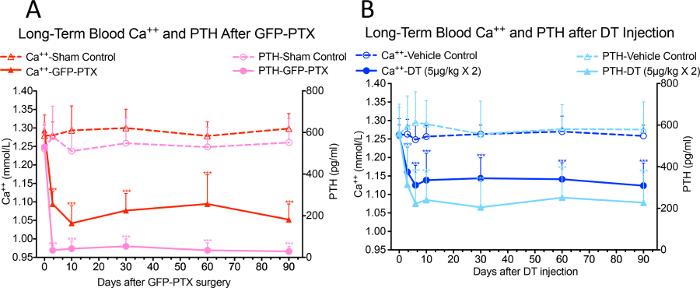
Figura 3: Blood Ca ++ e livelli di PTH nei topi GFP-PTX e DT per colata PTH-cre-IDTR topi. Entrambi i topi GFP-PTX (A) e DT iniettati PTH-cre-IDTR topi (B) esposto ipocalcemia stabile e ridotti livelli di PTH oltre 3 mesi periodo di osservazione (N = 6-8, *** p <0,001) (ristampato con il permesso di riferimento # 17).es / ftp_upload / 55010 / 55010fig3large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
Discussione
Dimostriamo la tecnica della paratiroidectomia GFP-guidato utilizzando topi transgenici con espressione GFP selettivamente nelle ghiandole paratiroidi. Nei PTHcre; topi mTmG, il doppio di fluorescenza (GFP verde nelle cellule Cre-espresse e rosso pomodoro in non-Cre espresso cellule) ci ha permesso di identificare con chiarezza, e di rimuovere con precisione tutte le ghiandole paratiroidee senza rimuovere le tiroide. Mentre noi preferiamo l'uso dei topi mTmG doppio fluorescenza per la capacità di identificare il tessuto non paratiroideo rosso fluorescente, la nostra procedura dovrebbe funzionare bene anche con gli animali fluorescenti singoli, come il rosso del pomodoro (B6.Cg-Ct (ROSA) 26Sortm14 ( CAG-tdTomato) HZE / J) del mouse. La procedura è relativamente facile da eseguire, richiede circa 20 minuti per topo, e si traduce in una grave e sostenuta fenotipo hypoparathyroid.
Inoltre, un altro vantaggio delle ghiandole paratiroidee GFP-positive è la facilità di rilevazione delle ghiandole paratiroidee aberranti. I nostri studi dimostranomislocalization delle paratiroidi in circa un quarto di topi B6 (Figura 1), che vengono facilmente rilevati nel nostro modello di topo dalla fluorescenza verde. Contrariamente a tiro-paratiroidectomia, la nostra tecnica evita la rimozione della tiroide con conseguente necessità di sostituzione dell'ormone tiroideo e l'effetto sconosciuta di rimozione della tiroide cellule C calcitonina produttrici. ghiandole paratiroidee fluorescente potrebbero essere utilizzati anche per altre indagini che richiedono l'isolamento delle ghiandole paratiroidee. La limitazione di questo modello include il requisito per la chirurgia. sono richieste competenze microchirurgia base e un microscopio dissezione con una sorgente luminosa fluorescente.
è dimostrata Una seconda tecnica per generare topi hypoparathyroid che elimina la necessità di un intervento chirurgico. Tossina difterica-topi trattati PTHcre-IDTR mostrano una lieve ipoparatiroidismo fenotipo, ma richiedono semplicemente l'iniezione di DT per via intraperitoneale nel mouse. La parte critica FOR generando questo modello è stato l'ottimizzazione della dose e regime di dosaggio. Alte dosi di DT ha portato alla tossicità ma basse dosi diminuito l'efficacia di questo approccio. Abbiamo determinato che il reggimento dose di 2 iniezioni a 5 mg / kg, somministrata 3 giorni di distanza, ha provocato ipocalcemia affidabile e stabile senza / minimo la mortalità.
In definitiva, ci auguriamo che questi due approcci forniscono modelli utili del mouse per ipoparatiroidismo acquisito. Utilizzando un romanzo PTH lunga durata d'azione, abbiamo riportato il primo uso di entrambi questi modelli nel determinare l'efficacia di nuovi farmaci per ipoparatiroidismo 17.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
Questo lavoro è stato supportato dal NIH concede R01-DK100584 e Cina Stato chiave Laboratorio di malattie orali aperta finanziamento SKLOD2015OF01 (RB). Ringraziamo Wenping Zhao, Tadatoshi Sato, e Kelly Lauter aiuto.
Materiali
| Name | Company | Catalog Number | Comments |
| ROSAmT/mG mice | The Jackson Laboratory | 7676 | |
| PTH-Cre mice | The Jackson Laboratory | 5989 | |
| iDTRmice | The Jackson Laboratory | 7900 | |
| 6-0 polyglactin 910 suture with needle | Ethicon, Inc | J510G | |
| Safety Single Edge Razor Blades | American Safety Razor Company | 66-0089 | |
| Disposable Scalpel | Feather Safety Razor Co., LTD | 72042-11 | |
| Povidone-Iodine Prep Pads | Dynarex Corporation | 1108 | |
| Ply gauze | Busse. Inc | BHD707 | |
| 0.9% Sodium Chloride Solution | HOSPIRA Worldwide, Inc | 07983-09 | |
| 1 mL 29 G Insulin Syringe | BECTON DICKINSON | 329622 | |
| Surgical Incise Drapes | 3M | 6640EZ | |
| Dumstar Biology forceps | Roboz Surgical Instrument Co., Inc | RS-4984 | |
| Micro Dissecting Spring Scissors | Roboz Surgical Instrument Co., Inc | RS-5605 | |
| Needle Holder | MILTEX.,Inc | V98-42 | |
| 2,2,2-Tribromethanol | Sigma-Aldrich | T48402 | |
| 2-Methyl-2-Butanol | Sigma-Aldrich | 152463 | For dissolve the 2,2,2-Tribromethanol |
| Diphtheria Toxin Powder | Sigma-Aldrich | D0564 | Dissolve in 0.9% sodium chloride solution at 1 mg/mL as the stock solution in -80 °C |
| Multicap Blood Collection Capillary tubes | Siemens Healthcare Diagnostics Ltd | 855578 | For collecting blood in iCa2+ analysis using RapidLab 348 Ca2+/pH analyzer |
| RapidLab 348 Ca2+/pH analyzer | Siemens Healthcare | For iCa2+ analysis |
Riferimenti
- Brandi, M. L., Brown, E. M. Hypoparathyroidism. , Springer. (2015).
- van Abel, M. Coordinated control of renal Ca(2+) transport proteins by parathyroid hormone. Kidney Int. 68, 1708-1721 (2005).
- Sebastian, E. M., Suva, L. J., Friedman, P. A. Differential effects of intermittent PTH(1-34) and PTH(7-34) on bone microarchitecture and aortic calcification in experimental renal failure. Bone. 43, 1022-1030 (2008).
- Rodriguez-Ortiz, M. E. Calcium deficiency reduces circulating levels of FGF23. J Am Soc Nephrol. 23, 1190-1197 (2012).
- Liao, H. W. Relationship between Fibroblast Growth Factor 23 and Biochemical and Bone Histomorphometric Alterations in a Chronic Kidney Disease Rat Model Undergoing Parathyroidectomy. PloS one. 10, e0133278(2015).
- Fox, J., Care, A. D. Effect of low calcium and low phosphorus diets on the intestinal absorption of water in intact and parathyroidectomized pigs. Calcif Tissue Int. 31, 253-255 (1980).
- Finco, D. R., Brown, S. A., Ferguson, D. C., Crowell, W. A. Selective parathyroidectomy of the dog. Can J Vet Res. 57, 288-292 (1993).
- Can, I. Parathyroid allotransplantation in rabbits without cultivation. Int J Clin Exp Med. 7, 280-284 (2014).
- Dunn, T. B. Melanoblasts in the stroma of the parathyroid glands of strain C58 mice. j Natl Cancer Inst. 10, 725-733 (1949).
- CRIVER. , Available from: http://www.criver.com/products-services/basic-research/rodent-surgery/soft-tissue-procedures (2010).
- Sakai, A. Osteoclast development in immobilized bone is suppressed by parathyroidectomy in mice. J Bone Miner Metab. 23, 8-14 (2005).
- Miao, D. Skeletal abnormalities in Pth-null mice are influenced by dietary calcium. Endocrinology. 145, 2046-2053 (2004).
- Gunther, T. Genetic ablation of parathyroid glands reveals another source of parathyroid hormone. Nature. 406, 199-203 (2000).
- Hough, T. A. Activating calcium-sensing receptor mutation in the mouse is associated with cataracts and ectopic calcification. Proc Natl Acad Sci U S A. 101, 13566-13571 (2004).
- Hannan, F. M. The Calcilytic Agent NPS 2143 Rectifies Hypocalcemia in a Mouse Model With an Activating Calcium-Sensing Receptor (CaSR) Mutation: Relevance to Autosomal Dominant Hypocalcemia Type 1 (ADH1). Endocrinology. 156, 3114-3121 (2015).
- Libutti, S. K. Parathyroid gland-specific deletion of the mouse Men1 gene results in parathyroid neoplasia and hypercalcemic hyperparathyroidism. Cancer Res. 63, 8022-8028 (2003).
- Bi, R. Diphtheria Toxin- and GFP-Based Mouse Models of Acquired Hypoparathyroidism and Treatment with a Long-Acting Parathyroid Hormone Analog. J Bone Miner Res. , (2015).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45, 593-605 (2007).
- Buch, T. A Cre-inducible diphtheria toxin receptor mediates cell lineage ablation after toxin administration. Nat Methods. 2, 419-426 (2005).
- Dunn, T. B. Melanoblasts in the stroma of the parathyroid glands of strain C58 mice. J Natl Cancer Inst. 10, 725-733 (1949).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.
