Method Article
Определение жирных кислот и окисления Липогенез в первичных гепатоцитов мышей
В этой статье
Резюме
De Novo липогенез и окисление β-жирных кислот представляют собой ключевые метаболические пути в гепатоцитах, пути, которые возмущенные в нескольких метаболических расстройств, в том числе жировой болезни печени. Здесь мы показываем, изоляции первичных гепатоцитов мыши и описать количественную окисления кислоты бета-жирных и липогенеза.
Аннотация
Lipid metabolism in liver is complex. In addition to importing and exporting lipid via lipoproteins, hepatocytes can oxidize lipid via fatty acid oxidation, or alternatively, synthesize new lipid via de novo lipogenesis. The net sum of these pathways is dictated by a number of factors, which in certain disease states leads to fatty liver disease. Excess hepatic lipid accumulation is associated with whole body insulin resistance and coronary heart disease. Tools to study lipid metabolism in hepatocytes are useful to understand the role of hepatic lipid metabolism in certain metabolic disorders.
In the liver, hepatocytes regulate the breakdown and synthesis of fatty acids via β-fatty oxidation and de novo lipogenesis, respectively. Quantifying metabolism in these pathways provides insight into hepatic lipid handling. Unlike in vitro quantification, using primary hepatocytes, making measurements in vivo is technically challenging and resource intensive. Hence, quantifying β-fatty acid oxidation and de novo lipogenesis in cultured mouse hepatocytes provides a straight forward method to assess hepatocyte lipid handling.
Here we describe a method for the isolation of primary mouse hepatocytes, and we demonstrate quantification of β-fatty acid oxidation and de novo lipogenesis, using radiolabeled substrates.
Введение
Non-alcoholic fatty liver disease is one of the leading causes of liver disease in Westernized cultures1,2. Lipid accumulation within the liver is associated with cell death, fibrosis, and liver failure via yet unknown mechanisms3-6. In fatty liver disease, hepatocyte-mediated β-fatty acid oxidation and de novo lipogenesis are important determinants of net lipid accumulation7,8. This article will, therefore, focus on hepatocyte isolation, followed by quantification of β-fatty acid oxidation and de novo lipogenesis.
Numerous methodologies have been developed to interrogate hepatocyte lipid metabolism. Though it is possible to measure metabolism of fat in vivo using stable isotopes9,10, these methods are costly, and require large numbers of animals. Additionally, the ability to investigate the effect of exogenous chemicals is limited due to the nature of in vivo experimentation. In contrast, the isolation of primary hepatocytes from mouse liver provides an affordable avenue to pursue11. Furthermore, studying hepatocytes in culture allows investigators to study the effects of varying chemicals on lipid processing while circumventing the difficulties of in vivo experimentation. Finally, isolated hepatocytes avoid any confounding from varying genetics since they are derived from the liver of a single animal.
Here we isolate and culture of hepatocytes, and we measure β-fatty acid oxidation and de novo lipogenesis, using radiolabeled palmitate. The protocol detailed below is straight forward, effective, and reproducible.
протокол
Все эксперименты на животных должны проводиться в соответствии с местными и федеральными нормами и с одобрения институциональной IACUC и радиационной безопасности администрации.
1. Подготовка
- За несколько дней до анализа, растопить 500 мл бутылку печени Digest Medium (ЛДМ) и замораживать ~ 35 мл аликвоты в 50 мл конические пробирки. Хранить при -20 ° С до использования.
- За день до анализа, предварительно простерилизовать чистые инструменты рассечение в автоклаве.
- В день анализа, лечения необходимого количества культуральных планшетах с 24 лунками с коллагеном.
- Смешайте 1 часть 3 мг / мл коллагена хвоста крысы с 50 частями PBS. Добавить приблизительно 500 мкл в каждую лунку 24-луночного планшета и инкубировать в течение 3-5 мин при комнатной температуре (RT). Удалить коллагена и позволяют пластины высохнуть на воздухе в капот. Повторите по крайней мере один дополнительное время.
Примечание: Коллаген покрытие может быть выполнено в течение одной недели в объявленииВэнс и планшеты хранили при 4 ° С закрытой полиэтиленовой пленкой.
- Смешайте 1 часть 3 мг / мл коллагена хвоста крысы с 50 частями PBS. Добавить приблизительно 500 мкл в каждую лунку 24-луночного планшета и инкубировать в течение 3-5 мин при комнатной температуре (RT). Удалить коллагена и позволяют пластины высохнуть на воздухе в капот. Повторите по крайней мере один дополнительное время.
- Подготовка LDM для анализа: Оттепель LDM и тепло до 37 ° С и доведения рН до 7,4 с использованием 1 N КОН. Фильтр с помощью шприц-фильтр и места 0,2 мкм в рециркуляции 42 ° С на водяной бане.
- Теплые 25 мл печени перфузии среды до 42 ° С в циркуляционной водяной бане.
- Подготовка 90% коллоидного диоксида кремния, покрытого раствором поливинилпирролидона: Добавить 1 мл 10Х DPBS до 9 мл коллоидного диоксида кремния, покрытого поливинилпирролидона. Отрегулируйте рН до 7,4, используя 0,1 N HCl. Фильтры стерильной шприцевой фильтр 0,2 мкм. Хранить при комнатной температуре.
- Теплый покрытие от среднего до 37 ° C.
2. Выделение первичной Mouse гепатоцитов
- Настройка перистальтического насоса, трубы и рассечение таблицу: стерилизовать трубки путем промывки 5 мл 70% этанола в дистиллированной воде, а затем 10 мл стерильной воды. Поместите трубку в печени перфузии среды и запустите насос для заполнениявся длина трубки.
- Жертвоприношение мышь, институционально утвержденного метода.
- Проанализируйте открыт в брюшную полость: Спрей живота мыши либерально 70% этанола. Использование тупым концом ножниц, сделать срединный разрез через дерму длину живота и боков отражают. Сделать подобный разрез в брюшине, чтобы выставить внутренние органы.
- Использование тупым инструментом, мягко сместить кишечник, чтобы разоблачить брюшной сосудистая Найдите брюшной нижнюю полую вену (IVC) и поместите нить под кровеносного сосуда, дистальнее почечной вены
- Дистальнее шва, поместите иглу и катетер в НПВ, продвижение его за пределы уровня шва. С иглой-прежнему на месте, связать нить вокруг катетера, чтобы держать это в месте. Осторожно извлеките иглу. Если все сделано правильно, кровь потоком через катетер.
- С помощью пипетки, заполните оставшуюся область в катетер с перфузии среды, обеспечениячто воздух не присутствует. С большой осторожностью, прикрепите трубки к катетеру.
- Проанализируйте открыта полость легких: мягко отражают превосходные доли печени подвергать диафрагму. Осторожно проколоть мембрану с острыми ножницами кончик, а затем сделать боковой надрез, чтобы разоблачить плевральную полость, заботясь, чтобы избежать желчного пузыря и плевральной сосудистую. Поставьте бульдог зажим вокруг грудной нижней полой вены просто проксимального к печеночной вены.
- Вырезать в портальную вену и включить насос на 3 - 4 мл / мин. Заливать печени с печеночной перфузии среды в течение 5 мин с помощью примерно 20 мл перфузии среды.
Примечание: печень должна немедленно изменится с красного на серый / коричневый. Если части печени остаются красный, это, вероятно, указывает на плохую перфузию, и вероятность успешного изоляции значительно уменьшается. Во время перфузии, будьте осторожны, чтобы обеспечить среду не работать, и что не было пузырей ввести трубку. - После 5 мин инкубации, остановитьнасос и передать трубку к печени Digest Medium. Перезагрузите насос и заливать печень еще 10 - 15 мин (до среднего не будет исчерпан).
- В конце перфузии, остановить насос. Печень должна иметь розоватый оттенок и выглядят несколько увеличены. Акцизный печень благодаря тщательной диссекции. Удалить желчный пузырь и передавать печень 10 см блюдо культуры ткани.
- В кабинете биологической безопасности, добавляют 10 мл Покрытие Medium (Таблица 1) в печень. Аккуратно очистить печень, используя либо щипцов или скальпель, чтобы удалить гепатоциты. Суспензию фильтруют, используя фильтр клеток 100 мкм и трансфер в 50 мл коническую трубку. Промыть пластины с дополнительными 10 мл Покрытие Medium и бассейн в 50 мл коническую трубку.
- Гранул клетки центрифугированием в течение 5 мин при 350 х г, 4 ° С.
- Аспирируйте средних и ресуспендируют осадок в 10 мл Покрытие Medium и добавить 10 мл 90% коллоидного диоксида кремния покрыты роlyvinylpyrrolidone. Осторожно перемешать и центрифуги, как в шаге 2.11. После центрифугирования слой мертвых клеток будет плавать на верхней части смеси, в то время как живые клетки будут осаждения на дно.
- Аспирируйте мертвые клетки и среду. Вымойте 2 раза с 20 мл Покрытие Medium, центрифуги, как в 2.11.
- Ресуспендируют клеток в 10 мл среды. Покрытие Граф клеток с гемоцитометра и поместите 9 х 10 4 клеток / лунку в коллаген-лечение блюд культуры 24-а. Инкубируют в C инкубаторе тканевых культур 37 ° в течение 2 ч. Каждая пластина может быть использована как для анализа жирных кислот окислением или в липогенеза анализа.
- При желании, изменить скважин в поддерживающую среду (Таблица 1) и культуры при 37 ° С. Клетки можно культивировать в течение 2 - 3 дней, не затрагивая результаты анализа.
3. Окисление жирных кислот Анализ
Внимание: Использование радиоактивности может быть опасным. Все закупки, хранения, обработки и диsposal радиоактивного материала должна осуществляться в соответствии с институциональными, государства и федеральных правил и руководств.
- 16 - 20 ч до анализа, промыть клетки 2 раза теплой PBS. Изменение клетки без сыворотки сывороточного голодания среды (таблица 1) с 20 нМ глюкагона и инкубировать в течение ночи при 37 ° С.
Примечание: Из-за эмбриональной бычьей сыворотки содержит неизвестной концентрации метаболических гормонов (например, инсулина, глюкагона), сыворотка голодать клетки, чтобы удалить любые смешанные эффекты это может отразиться на анализе. Клетки являются жизнеспособными в условиях сывороточного голодания среда для> 24 часов. Лечение Глюкагон используется для стимуляции окисления жирных кислот в гепатоцитах. - Утром анализа, подготовки предварительной инкубации среда: Ресуспендируют соответствующее количество натрия пальмитат в сверхчистой воде для получения раствора 100 мМ и нагревают до 70 ° С в течение 10 мин. В то же время, подготовить необходимое количество (0,5 мл на лунку 24-луночного планшета)из DMEM с 25 мМ HEPES, 1% БСА фракции V, и 20 нМ глюкагона. Нагревают до 37 ° С.
- После солюбилизации добавляют пальмитат до конечной концентрации 250 мкм в среде. Изменить гепатоциты в предварительной инкубации Medium и инкубировать при температуре 37 ° С в течение 2 ч. Резервируют Предварительно инкубационной среде при 37 ° С для последующего использования.
- Во время инкубации, сухой соответствующее количество 14 С-пальмитат (0,5 мкКи / лунку) выпариванием при газообразного азота.
- Например, для измерения 24 образцов в 24-луночный планшет, передавать 120 мкл 0,1 мкКи / мл 14 С-пальмитат в 1,5 мл пробирку. Медленно выпарить растворитель этанол путем продувки газообразного азота над раствором на расстоянии 3-5 см в вытяжном шкафу. Растворитель должен испариться примерно 30 - 40 мин, в результате чего сухую 14-пальмитат C в нижней части трубы.
- Приблизительно за 15 мин до конца инкубации, ресуспендируют 14С-пальмитат в 0,1 N NaOH (12,5 мкл / мкКи). Инкубируют при 70 ° С в течение 10 мин. Добавить три тома теплой Прединкубационная Medium и перемешать с помощью пипетки вверх и вниз.
- Спайк каждую лунку 25 мкл разбавленного 14 C-пальмитат. Смешайте осторожно качалки пластины и инкубировать при 37 ° С в течение 90 мин. Это аналитический планшет.
- Во время инкубации, подготовить пластину фильтровальной бумаги (рис 1).
- Снимите крышку с стерильную чашку 24-а. Разместите один 2 см х 2 см кусок фильтровальной бумаги на дне каждой из лунок. Перекрытие пластины с частью 4 "х 7" парафильмом.
- Использование большой прямоугольный объект, такой как наконечник коробки микропипетки, протереть парафильмом на скважинах перфорировать парафильмом в отверстия а и создать уплотнение в течение оставшейся части пластины. Удалить перфорированные круги парафильмом в настоящее время охватывает скважин. Пластина должна теперь быть плотно покрыты парафином во всех областях, за исключением а Openings.
- 10 мин до конца инкубации, добавьте 200 мкл 3 N NaOH в каждую лунку бумаги пластинчатом фильтре, убедившись, что бумага фильтр поглощает всю жидкость.
- При желании перед замораживанием, передавать среды в свежей 24-луночного планшета. После промывания один раз PBS, лизировать оставшиеся клетки в 0,1 N HCl и рассчитать содержание белка ВСА анализа.
- В конце инкубации, оснастку заморозить аналитического планшета в жидком азоте. Будьте осторожны, чтобы убедиться, что каждый хорошо полностью заморожены, прежде чем приступить.
- Добавить 100 мкл 70% перхлорной кислоты в каждую лунку аналитического планшета. Сразу накрыть плиты фильтровальной бумаги. Место пластин на орбитальном шейкере и рок в орбитальной скоростью 80 оборотов в минуту при комнатной температуре в течение 2 часов.
- После инкубации, обрабатывать образцы:
- Для измерения СО 2 фракции, передать фильтровальной бумаги квадраты 4 мл сцинтилляционной жидкости жидкости в сцинтилляционныхФлакон и мера 14 С сигнала.
- Для измерения кислотного растворимый материал, передавать 400 мкл среды к 1,5 мл пробирке. Центрифуга на максимальной скорости в течение 10 мин. Добавить 100 мкл полученного супернатанта до 500 мкл 2: 1 хлороформ-метанол (объем / объем), и вихрь кратко.
- Добавить 250 мкл воды к смеси, и вихрь снова. Центрифуга образцов в течение 10 мин при 3000 х г в. Передача 200 мкл верхней фазы к 4 мл жидкой сцинтилл ционной жидкости в сцинтилляционный флакон и измерения 14 С сигнала.
4. Анализ Липогенез
- Вечером накануне начала анализа, промыть клетки 2 раза теплой PBS. Изменить гепатоцитов в условиях сывороточного голодания среде с 100 нМ инсулина. Инкубируют в течение ночи при 37 ° С.
Примечание: Из-за эмбриональной бычьей сыворотки содержит неизвестной концентрации метаболических гормонов (например, инсулин, глюкагон), В сыворотке крови голодать клетки, чтобы удалить любые смешанные эффекты это может отразиться на анализе. Клетки являются жизнеспособными в условиях сывороточного голодания среда для> 24 часов. Инсулин В этом анализе использовали, чтобы стимулировать липогенез. - Сделать Липогенез Medium: сывороточного голодания среде с 100 нМ инсулина, 10 мкМ холодного ацетата и 0,5 мкКи 3 Н-ацетат на лунку. Изменение клетки к липогенеза среды и инкубируют при 37 ° С в течение 2 ч. Включите любые соединения, представляющие интерес для тестирования.
- После инкубационного периода, промыть клетки 2 раза PBS. Lyse клетки, очищая в 120 мкл 0,1 N HCl. Резервный 10 мкл для анализа белка (BCA оценки по анализа), и передача 100 мкл до 1,5 мл пробирке.
- Экстракт липидов добавлением 500 мкл 2: 1 хлороформ-метанол (объем / объем). Вихревой кратко и инкубируют при комнатной температуре в течение 5 мин. Добавить 250 мкл воды, вихрь и инкубируют при комнатной температуре в течение еще 5 мин. Центрифуга образцов 10 мин при 3000 мкг в РТ. Внимательнопередать нижнюю фазу до 4 мл сцинтилляционной жидкости жидкости в сцинтилляционный флакон и измерения 3 H деятельность.
Результаты
Гепатоцитов изоляция, как правило, приводят в 1 - 3 х 10 7 клеток всего. После инкубации в течение ночи клетки будут появляться шестиугольной, многие из которых будут двуядерных (рисунок 2). Здоровые клетки должен быть лишен грануляций или пузырьков, которые свидетельствуют о гибели клеток.
В общем, жирных кислот Окисление анализа выполняется в три-четыре дубликатов на тест соединения. Графы для СО 2 образцов примерно одна пятая часть, полученные из кислоты растворимого материала. Как правило, мы вычислить отношение СО 2 в кислой растворимого материала в качестве меры полного окисления (то есть, количество окисленного через цикл лимонной кислоты). Вещества, способствующие клеточное дыхание, такие как карбонилцианид-4- (трифторметокси) фенилгидразона (FCCP) сместится это соотношение к CO 2, с указанием больше окисление через ЦТК. Ингибиторы дыхательной цепи будет уменьшаться окисление в целом(Рисунок 3). При пилотировании этого анализа, то лучше включить контроль не-клеток, чтобы проверить процедура получения активность клеток-специфичны.
Липогенез анализа наиболее часто по сравнению с контролем нулевого временной точке (клетки, обработанные подложки непосредственно перед заготовки). Анализ должна быть линейной зависимости от времени, по меньшей мере четырех часов инкубации. Соединения, которые усиливают окисление жирных кислот, таких как FCCP или уменьшают синтез АТФ, такие как олигомицина, снизит активность липогенных (рисунок 4).
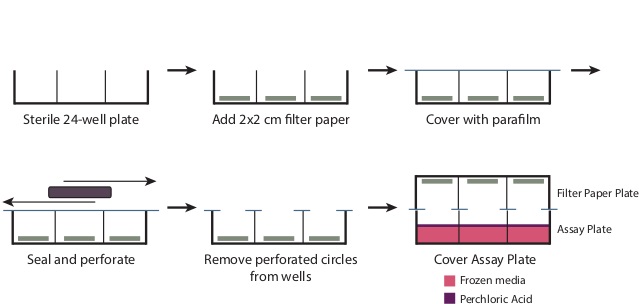
Рисунок 1: Получение фильтровальной пластины для приготовления фильтр пластину, как описано в шаге 3.6, снять крышку с стерильную чашку 24-луночного. Поместите 2 см х 2 см кусок фильтровальной бумаги на базе каждую лунку. Overlay весь пластину с 7 "х 4" кусок пунктФильм, и протрите пластину плотно запечатать верхнюю часть скважины. Это создаст перфорированные круги парафильмом над скважиной отверстиями, которые должны быть удалены. После добавления хлорной кислоты в шаге 3.9, поместить пластину фильтровальной бумаги плотно над аналитического планшета, чтобы произвести уплотнение.
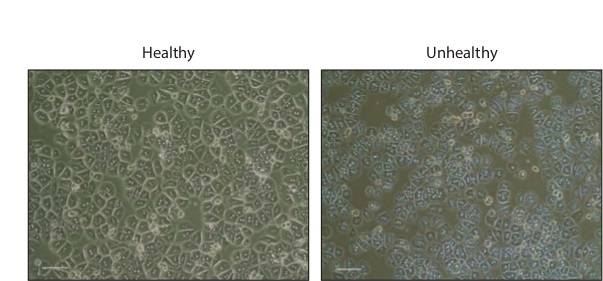
Рисунок 2: первичных гепатоцитов в культуре фазового контраста изображения здоровых и нездоровых гепатоцитов первичного мыши 16 ч после посева в коллагеновых покрытием 24-луночных планшетах. Масштаб бар, 200 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
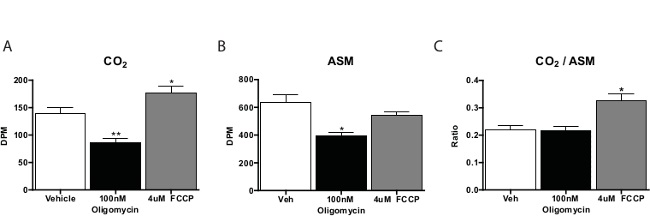
Рисунок 3: Жирная кислота Окисление первичного Мышь гепатоцитов в культуре 14 окисления С-пальмитат (а) CO 2, (б) растворимы в кислоте материала, и (C) отношение СО 2 в кислой растворимого материала из первичных гепатоцитов, инкубированных с транспортного средства, FCCP или олигомицином. Данные представлены как среднее ± SEM. * р <0,05, ** р <0,01 по сравнению с автомобиля Т-теста один Стьюдента. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: Липогенез в культивируемых Первичный мышь гепатоцитов (А) липогенных активность в зависимости от времени в первичных гепатоцитов, получавших 3 H-ацетата и (б) липогенных активности в присутствии транспортного средства, олигомицином или FCCP. Данные представлены как среднее ± SEM. *** р <0,001 по сравнению с транспортного средства одним Стьюдента-тест Стьюдента.
| Таблица 1 | |
| Культура Медиа | |
| Покрытие Средний | |
| DMEM, | 500 мл |
| ФБС | 10% |
| Пирувата натрия | 2 мм |
| Ручка / Strep | 2% |
| Дексаметазон | 1 мкМ |
| Инсулин | 0,1 мкм |
| Обслуживание среднего | |
| DMEM, | 500 мл |
| БСА доля V | 0,2% |
| Пирувата натрия | 2 мм |
| Ручка / Strep | 2% |
| Дексаметазон | 0,1 мкм |
| Инсулин | 1 нМ |
| Голодание среднего | |
| DMEM, | 500 мл |
| БСА доля V | 0,2% |
| Пирувата натрия | 2 мм |
| Ручка / Strep | 2% |
Обсуждение
Время от жертву перфузии должна быть не менее 3 мин для идеального перфузии коллагеназой и переваривания печени. После перфузии с перфузионной средой инициируется, печень должна немедленно изменить внешний вид от красного до бледно. После примерно 10 мин инкубации с LDM, печень появится распухли и розовый. В том случае, перфузии недостаточно, печень не должна демонстрировать эти изменения, и это обычно приводит к снижению выхода гепатоцитов.
После стадий промывки, изолированных гепатоцитах могут быть сохранены в течение нескольких часов в виде суспензии на льду до посева. После покрытием, культивируемые гепатоциты потребоваться несколько часов, чтобы придерживаться и распространяться. После 2 ч инкубации в среде Покрытие, гепатоциты останется маленький и круглый. После инкубации в течение ночи, гепатоциты будет взять на себя более характерным гексагональной внешний вид, многие из которых будут двуядерных. Если препарат является нездоровым, Слоктей будет демонстрировать многочисленные грануляции и иногда блеббинг, указывающие гибели клеток. Для того, чтобы лучше поддерживать жизнеспособность культуры, средства массовой информации должны быть изменены каждые 24 ч и уход для сведения к минимуму воздействия на открытый воздух.
Пальмитат натрия нерастворим в воде при комнатной температуре, однако, после инкубации при 70 ° С она должна полного растворения. Воздействие РТ вызовет липида быстро затвердевают, таким образом, крайне важно работать быстро. После пальмитат был растворяли в предварительной инкубации среды, важно, чтобы поддерживать среду при 37 ° С в целях сохранения растворимости липидов.
Как упоминалось выше, чтобы обеспечить точные результаты анализа жирных кислот к окислению, среда должна быть полностью замораживали в жидком азоте. Это предотвращает утечку CO 2 во время добавления хлорной кислоты в лунки. Сразу же после добавления к хлорной кислоты в замороженных образцах, Аналитический планшет должен быть плотно Cподготавливаемом в бумажную тарелку фильтр, убедившись, что для выравнивания пластин для передачи газа между ямами. Поскольку фильтровальная бумага пропитана с избытком NaOH, то стехиометрия реакции способна захватывать высвобожденный СО 2 в NaHCO 3. Эксперименты следующие этот протокол породили воспроизводимые результаты, с типичными повторов, имеющего% CV ≤ 10. При необходимости, растворимого в кислоте материала, из жирной кислоты окисления анализа или клеточного лизата от липогенеза анализа способны храниться при -80 ° С и обработаны позже без заметного влияния на результаты. Анализы, описанные выше, обеспечивают относительно простой и эффективный механизм времени, чтобы оценить липидный обмен в первичных гепатоцитов, выделенных из печени мыши. Благодаря использованию экс виво культуры, эти методы позволяют проверить воздействие нескольких условий на окисление жирных кислот и липогенеза. Этот протокол может быть адаптирован для оценки роли генетических изменений на этих процеГСЭС, однако, изоляция гепатоцитов время ограничения и, таким образом, в естественных условиях анализов может быть более подходящим для исследования некоторых трансгенных животных моделей. Если анализ нескольких препаратов гепатоцитов необходимо, нормализация значений для анализа до уровня белка может быть выполнена, как описано в необязательной стадии 3.7.1 и используется для нормализации. Мы рекомендуем анализы, проведенные в нескольких препаратов можно сравнить как относительные изменения по сравнению с подходящим контролем.
Наконец, мы не исследовали возможность более длительных периодов культуры, однако, гепатоциты могут проявлять аналогичные характеристики метаболические после нескольких дней в культуре. С небольшими изменениями этот протокол может быть адаптирован для обеспечения нескольких дней лечения, предшествующих оценки влияния соединений на метаболизм липидов.
Раскрытие информации
The authors indicate they have no conflicts of interest.
Благодарности
We would like to acknowledge Susan Gray and Umadevi Chalasani for their help with technical aspects of the hepatocyte isolation protocol. This work was supported by NIDDK grant 5R01DK089185 (to M.P. Cooper) and the DERC Pilot and Feasibility Program at UMMS (to M.P. Cooper).
Материалы
| Name | Company | Catalog Number | Comments |
| Liver Perfusion Medium | Life Technologies | 17701038 | |
| Liver Digest Medium | Life Technologies | 17703034 | Aliquot and store at -20 °C |
| PBS | Corning | 21-040-CV | |
| 10X DPBS | Corning | 46-013-CM | |
| DMEM | Corning | 10-017-CV | |
| FBS | Life Technologies | 26140079 | |
| Collagen | Life Technologies | A1048301 | |
| Colloidal silica coated with polyvinylpyrrolidone | GE Life Sciences | 17-0891-01 | |
| Sodium Pyruvate | Cellgro | 25-000-CI | |
| Penicillin / Streptomycin | Cellgro | 30-001-CI | |
| Insulin | Sigma | I0516-5ML | |
| Dexamethasone | Sigma | D2915-100MG | |
| Albumin (BSA), Fraction V | MP Biomedicals | 103703 | |
| 24-Well Culture Dish | Corning Falcon | 353047 | |
| Tygon S3 Tubing | Cole Parmer | 06460-34 | |
| Male Leur Lock to 200 Barb Connectors | Cole Parmer | 45518-00 | |
| 24 G x 3/4" Catheter | SurFlo | SROX2419CA | |
| Perma-Hand Silk Suture | Ethicon | 683G | |
| Cell Strainer | Corning Falcon | 08-771-2 | |
| IsoTemp 3013HD Recirculating Water Bath | Fisher | 13-874-3 | |
| MasterFlex C/L Peristaltic Pump | MasterFlex | HV-77122-24 | |
| Microclamp | Roboz | RS-7438 | Pre-sterilize in autoclave |
| 5” Straight, Blunt-Blunt Operating Scissors | Roboz | RS-6810 | Pre-sterilize in autoclave |
| 24 mm Blade Straight, Sharp-point Microdissecting Scissors | Roboz | RS-5912 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Microdissecting Forceps | Roboz | RS-5130 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Full Curve Microdissecting Forceps | Roboz | RS-5137 | Pre-sterilize in autoclave |
| 60 ml Syringe | Becton Dickinson | 309653 | |
| 50 ml conical tubes | Corning Falcon | 352070 | |
| BCA Protein Assay | Thermo Scientific | 23225 | |
| Biosafety Cabinet | |||
| CO2 Incubator | |||
| Serological pipets | |||
| 1,000, 200, 20 μl pipet and tips |
Ссылки
- Clark, J. M., Brancati, F. L., Diehl, A. M. The prevalence and etiology of elevated aminotransferase levels in the United States. The American journal of gastroenterology. 98, 960-967 (2003).
- Lazo, M., et al. Prevalence of nonalcoholic Fatty liver disease in the United States: the third national health and nutrition examination survey, 1988-1994. American journal of epidemiology. 178, 38-45 (2013).
- Angulo, P. Nonalcoholic fatty liver disease. The New England journal of medicine. 346, 1221-1231 (2002).
- Adams, L. A., et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 129, 113-121 (2005).
- Feldstein, A. E., et al. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 125, 437-443 (2003).
- Day, C. P., James, O. F. Steatohepatitis: a tale of two 'hits'. Gastroenterology. 114, 842-845 (1998).
- Donnelly, K. L., et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. The Journal of clinical investigation. 115, 1343-1351 (2005).
- Lambert, J. E., Ramos-Roman, M. A., Browning, J. D., Parks, E. J. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 146, 726-735 (2014).
- Parks, E. J., Hellerstein, M. K. Thematic review series: patient-oriented research. Recent advances in liver triacylglycerol and fatty acid metabolism using stable isotope labeling techniques. Journal of lipid research. 47, 1651-1660 (2006).
- Befroy, D. E., et al. Direct assessment of hepatic mitochondrial oxidative and anaplerotic fluxes in humans using dynamic 13C magnetic resonance spectroscopy. Nature medicine. 20, 98-102 (2014).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malaria journal. 6, 169 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены