Method Article
Determinação da oxidação de ácidos gordos e Lipogênese em Rato Os hepatócitos primária
Neste Artigo
Resumo
De novo a lipogênese e oxidação do ácido β-gordo constituem vias metabólicas importantes em hepatócitos, caminhos que são perturbados em vários distúrbios metabólicos, incluindo a doença de fígado gordo. Aqui demonstramos isolamento de hepatócitos primários de rato e descrever quantificação da oxidação de ácidos graxos e β-lipogênese.
Resumo
Lipid metabolism in liver is complex. In addition to importing and exporting lipid via lipoproteins, hepatocytes can oxidize lipid via fatty acid oxidation, or alternatively, synthesize new lipid via de novo lipogenesis. The net sum of these pathways is dictated by a number of factors, which in certain disease states leads to fatty liver disease. Excess hepatic lipid accumulation is associated with whole body insulin resistance and coronary heart disease. Tools to study lipid metabolism in hepatocytes are useful to understand the role of hepatic lipid metabolism in certain metabolic disorders.
In the liver, hepatocytes regulate the breakdown and synthesis of fatty acids via β-fatty oxidation and de novo lipogenesis, respectively. Quantifying metabolism in these pathways provides insight into hepatic lipid handling. Unlike in vitro quantification, using primary hepatocytes, making measurements in vivo is technically challenging and resource intensive. Hence, quantifying β-fatty acid oxidation and de novo lipogenesis in cultured mouse hepatocytes provides a straight forward method to assess hepatocyte lipid handling.
Here we describe a method for the isolation of primary mouse hepatocytes, and we demonstrate quantification of β-fatty acid oxidation and de novo lipogenesis, using radiolabeled substrates.
Introdução
Non-alcoholic fatty liver disease is one of the leading causes of liver disease in Westernized cultures1,2. Lipid accumulation within the liver is associated with cell death, fibrosis, and liver failure via yet unknown mechanisms3-6. In fatty liver disease, hepatocyte-mediated β-fatty acid oxidation and de novo lipogenesis are important determinants of net lipid accumulation7,8. This article will, therefore, focus on hepatocyte isolation, followed by quantification of β-fatty acid oxidation and de novo lipogenesis.
Numerous methodologies have been developed to interrogate hepatocyte lipid metabolism. Though it is possible to measure metabolism of fat in vivo using stable isotopes9,10, these methods are costly, and require large numbers of animals. Additionally, the ability to investigate the effect of exogenous chemicals is limited due to the nature of in vivo experimentation. In contrast, the isolation of primary hepatocytes from mouse liver provides an affordable avenue to pursue11. Furthermore, studying hepatocytes in culture allows investigators to study the effects of varying chemicals on lipid processing while circumventing the difficulties of in vivo experimentation. Finally, isolated hepatocytes avoid any confounding from varying genetics since they are derived from the liver of a single animal.
Here we isolate and culture of hepatocytes, and we measure β-fatty acid oxidation and de novo lipogenesis, using radiolabeled palmitate. The protocol detailed below is straight forward, effective, and reproducible.
Protocolo
Todos experimentação animal deve ser realizado em conformidade com os regulamentos locais e federais e com a aprovação de uma IACUC e segurança de radiação administração institucional.
1. Preparação
- Vários dias antes do ensaio, descongelar a garrafa de 500 ml de fígado Digest Médio (LDM) e recongelar ~ 35 ml de partes alíquotas em tubos cónicos de 50 ml. Armazenar a -20 ° C até serem necessárias.
- Um dia antes do ensaio, pré-limpas esterilizar instrumentos de dissecação por autoclave.
- No dia do ensaio, tratar a quantidade necessária de placas de cultura de 24 poços com colagénio.
- Misturar 1 parte de 3 mg / mL de colagénio de cauda de rato com 50 partes de PBS. Adicionar cerca de 500 uL a cada poço de uma placa de 24 poços e incuba-se durante 3-5 minutos à temperatura ambiente (TA). Remova a placa de colágeno e permitir ao ar seco na capa. Repetir pelo menos uma vez adicional.
Nota: revestimento de colágeno pode ser realizada até uma semana em anúncioVance e as placas armazenadas a 4 ° C em filme plástico selado.
- Misturar 1 parte de 3 mg / mL de colagénio de cauda de rato com 50 partes de PBS. Adicionar cerca de 500 uL a cada poço de uma placa de 24 poços e incuba-se durante 3-5 minutos à temperatura ambiente (TA). Remova a placa de colágeno e permitir ao ar seco na capa. Repetir pelo menos uma vez adicional.
- Prepare LDM para ensaio: LDM Descongelar e aquecer a 37 ° C e ajustar o pH a 7,4 utilizando KOH 1N. Filtrar usando filtro de seringa de 0,2 um e coloque em um 42 ° C banho de água de recirculação.
- Aqueça 25 ml de fígado Perfusão Médio a 42 ° C em banho de recirculação de água.
- Prepare a 90% de sílica coloidal revestido com uma solução de polivinilpirrolidona: Adicione 1 ml de DPBS 10x a 9 ml de sílica coloidal revestida com polivinilpirrolidona. Ajustar o pH para 7,4 utilizando HCl 0,1 N. Filtrar com um filtro de seringa estéril de 0,2 um. Armazenar à temperatura ambiente.
- Quente meio de plaqueamento de 37 ° C.
2. Isolamento de principal do mouse hepatócitos
- Configure bomba peristáltica, tubulação, e mesa de dissecção: Esterilizar tubulação por lavagem com etanol a 5 ml de 70% em água destilada, seguido por 10 ml de água estéril. Coloque tubulação no fígado Perfusão Médio e executar bomba para enchertodo o comprimento do tubo.
- Sacrifique rato pelo método aprovado institucionalmente.
- Dissecar aberto a cavidade abdominal: Pulverizar o abdômen do rato generosamente com etanol 70%. Com uma tesoura de extremidade romba, fazer uma incisão na linha média através da derme do comprimento do abdómen e reflectir lateralmente. Adicione uma incisão semelhante no peritoneu para expor as vísceras.
- Utilizando um instrumento rombo, deslocar os intestinos suavemente para expor a vasculatura abdominal Localizar a veia cava inferior abdominal (IVC) e colocar uma sutura por baixo do vaso sanguíneo, distai em relação à veia renal
- Distalmente à sutura, colocar uma agulha e cateter na veia cava inferior, avançando para além do nível da sutura. Com a agulha ainda no lugar, amarrar a sutura ao redor do cateter para segurá-la no lugar. Remova cuidadosamente a agulha. Se isso for feito correctamente, o sangue com fluxo através do cateter.
- Usando uma pipeta, encher o restante da área no meio de perfusão com cateter, assegurandoque nem o ar está presente. Com muito cuidado, coloque a tubulação para o cateter.
- Dissecar aberto da cavidade pulmonar: refletir suavemente os lóbulos superiores do fígado para expor o diafragma. Perfurar cuidadosamente o diafragma com uma tesoura ponta afiada, em seguida, fazer uma incisão lateral para expor a cavidade pleural, tendo o cuidado de evitar a vesícula biliar e vasculatura pleural. Coloque um grampo de bulldog em torno da veia cava inferior torácica apenas proximal à veia hepática.
- Corte a veia porta e ligar a bomba a 3 - 4 ml / min. Perfundir com o fígado Fígado Perfusão médio durante 5 min, utilizando aproximadamente 20 ml de meio de perfusão.
Nota: O fígado deve mudar imediatamente de vermelho para cinza / tan. Se porções do fígado permanecer vermelho, isso provavelmente indica má perfusão, ea probabilidade de isolamento bem sucedido é muito reduzido. Durante a perfusão, tenha cuidado para garantir o meio não correr para fora e que não há bolhas de entrar na tubulação. - Após a 5 min de incubação, parara bomba e tubo para transferir o fígado Digest Médio. Reiniciar a bomba e perfundir o fígado por mais 10 - 15 minutos (até que o meio é esgotada).
- No final da perfusão, parar a bomba. O fígado deve ter um tom rosado e aparecer um pouco alargada. Extirpar o fígado por dissecção cuidadosa. Remover a vesícula biliar e transferir o fígado a 10 cm prato de cultura de tecidos.
- Em uma cabine de segurança biológica, adicionar 10 ml de chapeamento Médio (Tabela 1) para o fígado. Raspe o fígado utilizando quer uma pinça ou um escalpelo para remover os hepatócitos. Filtra-se a suspensão através de um filtro de células de 100 mm e transferência para um tubo de 50 ml. Lave a placa com um adicional de 10 ml de Galvanização Médio e piscina no tubo de 50 ml.
- Agregar as células por centrifugação durante 5 min a 350 xg, 4 ° C.
- Aspirar médio e pellet ressuspender em 10 ml de Galvanização Médio e adicionar 10 ml de 90% de sílica coloidal revestido com polyvinylpyrrolidone. Misture delicadamente e centrifugar como na etapa 2.11. Após centrifugação, uma camada de células mortas vai ser flutuante na parte superior da mistura, enquanto que as células vivas irá sedimentar para o fundo.
- Aspirar as células mortas e meio. Lavar 2 vezes com 20 ml de chapeamento Médio, centrifugar como em 2.11.
- Ressuspender as células em 10 ml de chapeamento meio. Contar as células com um hemocitómetro e colocar 9 x 10 4 células / poço em pratos de 24 poços de cultura tratados com colagénio. Incubar em 37 ° C de cultura de tecidos incubadora durante 2 horas. Cada placa pode ser usado tanto para o ensaio de oxidação de ácido gordo ou o ensaio Lipogênese.
- Opcionalmente, para alterar poços Meio de Manutenção (Tabela 1) e a cultura a 37 ° C. As células podem ser cultivadas durante 2 - 3 dias, sem afectar os resultados do ensaio.
3. Ácidos Graxos Oxidação Assay
Aviso: O uso de radioactividade pode ser perigoso. Todas as compras, armazenamento, manipulação, e disposal de material radioativo deve ser realizado em conformidade com, estado, e regulamentos e diretrizes federais institucionais.
- 16 - 20 h antes do ensaio, células de lavar 2 vezes com PBS quente. Mudar as células ao soro inanição meio isento de soro (Tabela 1) com 20 nM de glucagon e incubar durante a noite a 37 ° C.
Nota: Por causa de soro fetal bovino contém uma concentração desconhecida de hormônios metabólicos (por exemplo, insulina, glucagon), soro de morrer de fome as células para remover quaisquer efeitos de confusão que isso pode ter sobre o ensaio. As células são viáveis em soro fome Médio para> 24 hr. Tratamento glucagon é utilizado para estimular a oxidação do ácido gordo no interior dos hepatócitos. - Na manhã do dia do ensaio, preparar a pré-incubação Médio: Ressuspender uma quantidade apropriada de palmitato de sódio em água ultrapura para fazer uma solução 100 mM e aquecimento a 70 ° C durante 10 min. Entretanto, a quantidade necessária preparar (0,5 ml por poço de uma placa de 24 poços)de DMEM com 25 mM de HEPES, 1% de BSA Fracção V, e 20 nM de glucagon. Aquece-se a 37 ° C.
- Uma vez solubilizado, Palmitato de adicionar a uma concentração final de 250 uM para a forma. Mudar hepatócitos para a pré-incubação médio e incubar a 37 ° C durante 2 horas. Reservar alguns A pré-incubação do meio no 37 ° C, para utilização posterior.
- Durante a incubação, seco, uma quantidade adequada de 14 C-palmitato (0,5 uCi / poço) por evaporação sob atmosfera de azoto.
- Por exemplo, para medir 24 amostras numa placa de 24 poços, 120 ul de transferir 0,1 uCi / ml de C-14 Palmitato de um tubo de 1,5 ml. Lentamente, evapora-se o solvente etanol por sopragem de azoto gasoso através da solução a partir de uma distância de 3-5 cm numa hotte. O solvente deverá evaporar-se em cerca de 30 - 40 min, deixando a seco C-14 Palmitato no fundo do tubo.
- Aproximadamente 15 minutos antes do final da incubação, ressuspender o 14C-Palmitato em NaOH 0,1 N (12,5 mL / uCi). Incubar a 70 ° C durante 10 min. Adicione três volumes de quente Pré-Incubação Médio e misture pipetando cima e para baixo.
- Pico de cada poço com 25 uL de 14 C diluída-palmitato. Misturar agitando suavemente a placa e incubar a 37 ° C durante 90 min. Esta é a placa de ensaio.
- Durante a incubação, preparar a Placa de filtro de papel (Figura 1).
- Remova a tampa de uma estéril placa de 24 poços. Coloque um 2 cm x 2 cm pedaço de papel de filtro na parte inferior de cada um dos poços. Sobrepor a placa com um pedaço de 4 "x 7" parafilme.
- Usando um grande objecto rectangular, tal como uma caixa de ponta de micropipeta, esfregue o parafilme nos poços para perfurar o parafilme as aberturas de poços e criar uma vedação ao longo do resto da placa. Remova os círculos perfuradas de parafilm agora cobre as cavidades. A placa deve agora ser firmemente coberto com filme plástico em todas as áreas, exceto o bem openings.
- 10 minutos antes do final da incubação, adicionar 200 uL de NaOH 3 N a cada poço da placa de papel de filtro, certificando-se o papel de filtro absorve o líquido todo.
- Opcionalmente antes da congelação, a transferência do médio para uma nova placa de 24 poços. Após lavagem uma vez com PBS, lisar as células remanescentes em HCl 0,1 N e calcular o teor de proteína por ensaio BCA.
- No final da incubação, snap-congelar a placa de ensaio em azoto líquido. Tenha cuidado para garantir que cada poço está completamente congelado antes de prosseguir.
- Adicionar 100 ul de ácido perclórico a 70% a cada poço da placa de ensaio. Cubra imediatamente com a Placa de filtro de papel. Coloque as placas num agitador orbital e rock na velocidade orbital de 80 rpm à temperatura ambiente durante 2 horas.
- Após a incubação, processar as amostras:
- Para medir a fracção de CO 2, transferir os quadrados de papel de filtro para 4 ml de fluido de cintilação líquida num cintilaçãofrasco e medida 14 do sinal C.
- Para medir o material solúvel em ácido, transferir 400 ul de meio para um tubo de microcentrífuga de 1,5 ml. Centrifugar a velocidade máxima para 10 min. Adiciona-se 100 ul do sobrenadante resultante a 500 mL de 2: 1 de clorofórmio-metanol (v / v), e agitar com vortex brevemente.
- Adicionar 250 mL de água à mistura, e novamente vórtice. Centrifugar as amostras durante 10 min a 3.000 x g. Transferir 200 ul da fase superior a 4 ml de fluido de cintilação líquida num frasco de cintilação de 14 e medir o sinal C.
4. Lipogênese Assay
- A noite antes de iniciar o ensaio, lavar as células 2 vezes com PBS quente. Alterar os hepatócitos ao soro fome Médio com 100 nM de insulina. Incubar durante a noite a 37 ° C.
Nota: Por causa de soro fetal bovino contém uma concentração desconhecida de hormônios metabólicos (por exemplo, insulina, glucagon), Soro de morrer de fome as células para remover quaisquer efeitos de confusão que isso pode ter sobre o ensaio. As células são viáveis em soro fome Médio para> 24 hr. A insulina é usada neste ensaio para estimular a lipogénese. - Faça Lipogênese Médio: Soro Fome médio com 100 nM de insulina, 10 � de etilo frio e 0,5 uCi de 3 H-Acetato por poço. Mudar para células Lipogênese Médio e incubar a 37 ° C durante 2 horas. Inclui quaisquer compostos de interesse a ser testado.
- Após o período de incubação, lavar as células 2 vezes com PBS. Lisar as células por raspagem em 120 ul de 0,1 N de HCl. Reserva de 10 uL para o ensaio de proteína (por avaliar ensaio BCA), e transferência de 100 uL para tubos de microcentrífuga de 1,5 ml.
- Extrair lípidos pela adição de 500 ul de 2: 1 de clorofórmio-metanol (v / v). Vortex brevemente e incubar à TA durante 5 min. Adicionar 250 uL de água, vortex e incubar à temperatura ambiente durante um adicional de 5 min. Centrifugar as amostras 10 min a 3000 xg, RT. Cuidadosamentetransferência de fase inferior a 4 ml de fluido de cintilação líquida num frasco de cintilação e medir a actividade de 3 h.
Resultados
Isolamentos de hepatócitos normalmente resultam em 1 - 3 x 10 7 células totais. Após incubação durante a noite, as células aparece hexagonal, muitos dos quais serão binucleadas (Figura 2). As células saudáveis deve ser desprovido de granulações ou bolhas, que são indicativas de morte celular.
Em geral, o ensaio de oxidação de ácido gordo é executado em três a quatro réplicas por composto de teste. Conta para o CO 2 amostras são aproximadamente um quinto das pessoas derivado do material solúvel em ácido. Nós normalmente calcular a proporção de CO 2 para material solúvel em ácido, como uma medida da oxidação completa (isto é, a quantidade oxidado através do ciclo do ácido cítrico). Substâncias que promovem a respiração celular, tais como cianeto de carbonilo-4- (trifluorometoxi) fenil-hidrazona (FCCP) vai deslocar esta relação para com CO 2, o que indica mais de oxidação através do ciclo do TCA. Os inibidores da cadeia respiratória diminuirá oxidação no seu conjunto(Figura 3). Quando pilotagem neste ensaio, é melhor incluir um controlo sem células para verificar o procedimento é produzir actividade específica da célula.
O Lipogênese ensaio é na maioria das vezes em comparação com um controle de zero ponto temporal (células tratadas com o substrato imediatamente antes da colheita). O ensaio deve ser linear em função do tempo através de, pelo menos, quatro horas de incubação. Os compostos que aumentam a oxidação de ácidos gordos, tais como FCCP, ou diminuem a síntese de ATP, tais como a oligomicina, irá reduzir a actividade lipogénica (Figura 4).
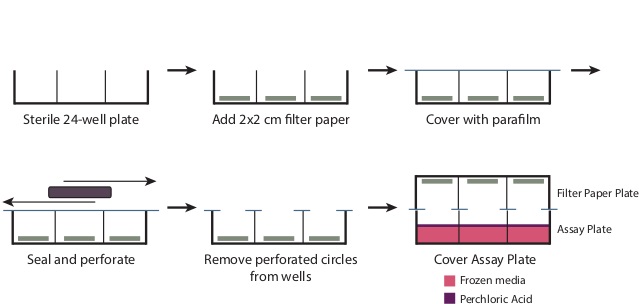
Figura 1: Preparação da Placa de filtro Para preparar a placa de filtro, tal como descrito na etapa 3.6, remover a tampa de uma solução estéril de 24 poços. Coloque um 2 cm x 2 cm pedaço de papel de filtro na base de cada poço. Overlay toda a placa com um 7 "x 4" pedaço do Parápelícula, e de esfregar a placa para vedar firmemente o topo dos poços. Isto irá gerar perfurados círculos de parafilme sobre as aberturas de poços, os quais devem ser removidos. Após a adição do ácido perclórico na etapa 3.9, Colocar a placa de filtro de papel firmemente sobre a placa de ensaio para produzir uma vedação.
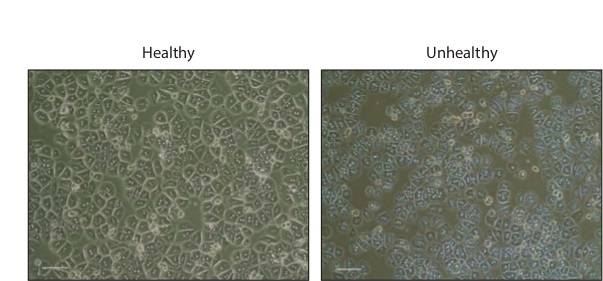
Figura 2: Os hepatócitos na fase primária contraste cultura de hepatócitos imagens saudáveis e doentes rato primário 16 horas após o plaqueamento em colagénio revestidas placas de 24 poços. Barra de escala, de 200 mm. Por favor clique aqui para ver uma versão maior desta figura.
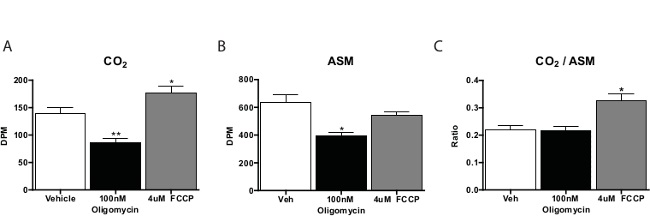
Figura 3: Oxidação dos Ácidos Graxos por Primary Rato Os hepatócitos em cultura com 14 C-Palmitato de oxidação (A) CO 2, o material solúvel (B) ácido, e (C) a proporção de CO 2 a partir de material solúvel em ácido hepatócitos primários incubadas com veículo, FCCP, ou oligomicina. Os dados são média ± SEM. * p <0,05, ** p <0,01 versus veículo por t-teste unilateral de Student. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: Lipogênese em cultura primária de hepatócitos do rato (a) Actividade contra o tempo lipogenic em hepatócitos primários tratados com 3 H-acetato de metilo e (B) a actividade lipogénica na presença de veículo, oligomicina, ou FCCP. Os dados são média ± SEM. *** p <0,001 comparativamente com o veículo por unicaudal teste t de Student.
| Tabela 1 | |
| Mídia cultural | |
| Galvanização Médio | |
| DMEM | 500 ml |
| FBS | 10% |
| Piruvato de sódio | 2 mM |
| Pen / Strep | 2% |
| Dexametasona | 1 uM |
| Insulina | 0,1 uM |
| Meio de Manutenção | |
| DMEM | 500 ml |
| BSA Fracção V | 0,2% |
| Piruvato de sódio | 2 mM |
| Pen / Strep | 2% |
| Dexametasona | 0,1 uM |
| Insulina | 1 nM |
| Inanição Médio | |
| DMEM | 500 ml |
| BSA Fracção V | 0,2% |
| Piruvato de sódio | 2 mM |
| Pen / Strep | 2% |
Discussão
O tempo de sacrifício para perfusão deve ser inferior a 3 minutos para perfusão ideal e digestão com colagenase do fígado. Uma vez que a perfusão com Perfusão Médio é iniciada, o fígado deve imediatamente alterar a aparência do vermelho ao pálido. Após aproximadamente 10 minutos de incubação com LDM, o fígado aparece inchado e rosa. No caso em que a perfusão é insuficiente, o fígado podem não exibir estas mudanças, e este será normalmente resultam num rendimento mais baixa de hepatócitos.
Após os passos de lavagem, os hepatócitos isolados podem ser armazenadas durante várias horas em suspensão em gelo antes do plaqueamento. Uma vez chapeado, hepatócitos cultivados requerem várias horas para aderir e se espalhar. Seguindo 2 horas de incubação em Galvanização Médio, os hepatócitos permanecerá pequena e redonda. Depois de uma incubação durante a noite, os hepatócitos terá uma aparência mais característica hexagonal, muitos dos quais serão binucleadas. Se a preparação não é saudável, o cells vai expor numerosas granulações e blebbing ocasional, indicativo de morte celular. A fim de melhor manter a viabilidade da cultura, meios de comunicação social deve ser trocado a cada 24 horas e cuidados tomados para minimizar a exposição ao ar livre.
Palmitato de sódio é insolúvel em água à TA, no entanto, após incubação a 70 ° C deve dissolver-se completamente. A exposição à temperatura ambiente irão fazer com que o lípido para solidificar rapidamente, assim que é imperativo para trabalhar rapidamente. Uma vez palmitato foi dissolvido em Pré-incubação médio, é crítica para manter o meio a 37 ° C, a fim de manter a solubilidade dos lípidos.
Como mencionado acima, para garantir resultados precisos do ensaio de oxidação de ácido gordo, a forma deve ser completamente congelada em azoto líquido. Isto impede qualquer fuga de CO 2 durante a adição de ácido perclórico aos poços. Imediatamente após a adição do ácido perclórico para as amostras congeladas, a placa de ensaio deve ser firmemente Covered pelo filtro de placa de papel, certificando-se de alinhar as placas para a transferência de gás entre os poços. Uma vez que o papel de filtro embebido com um excesso de NaOH, a estequiometria da reacção é capaz de capturar o CO2 libertado como NaHCO3. As experiências seguintes têm este protocolo gerou resultados reprodutíveis, com repetições típicos tendo CV% ≤ 10. Se necessário, o material solúvel em ácido a partir da oxidação de ácido gordo ou o ensaio de ligado de células a partir do ensaio Lipogênese são capazes de serem armazenadas a -80 ° C e processada mais tarde, sem qualquer efeito significativo sobre o resultado. Os ensaios descritos acima para permitir que um mecanismo relativamente simples e eficiente tempo para avaliar o metabolismo lipídico em hepatócitos primários isolados de fígado de rato. Através da utilização de cultura ex vivo, estes métodos permitem testar os efeitos de várias condições de oxidação de ácidos gordos e lipogénese. Este protocolo pode ser adaptado para avaliar o papel de alterações genéticas sobre estes processes, no entanto, o isolamento de hepatócitos é limitante tempo e, assim, as análises in vivo pode ser mais adequado para investigar certos modelos animais transgénicos. Se a análise de várias preparações de hepatócitos é necessário, a normalização dos valores de ensaio para os níveis de proteína pode ser realizada tal como descrito no passo 3.7.1 opcional e utilizado para normalização. Recomendamos ensaios realizados em várias preparações ser comparado como mudanças relativas versus um controlo adequado.
Finalmente, não temos explorado a opção de mais longos períodos de cultura, no entanto, os hepatócitos podem exibir características metabólicas equivalentes após vários dias em cultura. Com ligeira modificação, este protocolo pode ser adaptado para permitir a vários tratamentos dia antes do avaliar os efeitos dos compostos sobre o metabolismo lipídico.
Divulgações
The authors indicate they have no conflicts of interest.
Agradecimentos
We would like to acknowledge Susan Gray and Umadevi Chalasani for their help with technical aspects of the hepatocyte isolation protocol. This work was supported by NIDDK grant 5R01DK089185 (to M.P. Cooper) and the DERC Pilot and Feasibility Program at UMMS (to M.P. Cooper).
Materiais
| Name | Company | Catalog Number | Comments |
| Liver Perfusion Medium | Life Technologies | 17701038 | |
| Liver Digest Medium | Life Technologies | 17703034 | Aliquot and store at -20 °C |
| PBS | Corning | 21-040-CV | |
| 10X DPBS | Corning | 46-013-CM | |
| DMEM | Corning | 10-017-CV | |
| FBS | Life Technologies | 26140079 | |
| Collagen | Life Technologies | A1048301 | |
| Colloidal silica coated with polyvinylpyrrolidone | GE Life Sciences | 17-0891-01 | |
| Sodium Pyruvate | Cellgro | 25-000-CI | |
| Penicillin / Streptomycin | Cellgro | 30-001-CI | |
| Insulin | Sigma | I0516-5ML | |
| Dexamethasone | Sigma | D2915-100MG | |
| Albumin (BSA), Fraction V | MP Biomedicals | 103703 | |
| 24-Well Culture Dish | Corning Falcon | 353047 | |
| Tygon S3 Tubing | Cole Parmer | 06460-34 | |
| Male Leur Lock to 200 Barb Connectors | Cole Parmer | 45518-00 | |
| 24 G x 3/4" Catheter | SurFlo | SROX2419CA | |
| Perma-Hand Silk Suture | Ethicon | 683G | |
| Cell Strainer | Corning Falcon | 08-771-2 | |
| IsoTemp 3013HD Recirculating Water Bath | Fisher | 13-874-3 | |
| MasterFlex C/L Peristaltic Pump | MasterFlex | HV-77122-24 | |
| Microclamp | Roboz | RS-7438 | Pre-sterilize in autoclave |
| 5” Straight, Blunt-Blunt Operating Scissors | Roboz | RS-6810 | Pre-sterilize in autoclave |
| 24 mm Blade Straight, Sharp-point Microdissecting Scissors | Roboz | RS-5912 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Microdissecting Forceps | Roboz | RS-5130 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Full Curve Microdissecting Forceps | Roboz | RS-5137 | Pre-sterilize in autoclave |
| 60 ml Syringe | Becton Dickinson | 309653 | |
| 50 ml conical tubes | Corning Falcon | 352070 | |
| BCA Protein Assay | Thermo Scientific | 23225 | |
| Biosafety Cabinet | |||
| CO2 Incubator | |||
| Serological pipets | |||
| 1,000, 200, 20 μl pipet and tips |
Referências
- Clark, J. M., Brancati, F. L., Diehl, A. M. The prevalence and etiology of elevated aminotransferase levels in the United States. The American journal of gastroenterology. 98, 960-967 (2003).
- Lazo, M., et al. Prevalence of nonalcoholic Fatty liver disease in the United States: the third national health and nutrition examination survey, 1988-1994. American journal of epidemiology. 178, 38-45 (2013).
- Angulo, P. Nonalcoholic fatty liver disease. The New England journal of medicine. 346, 1221-1231 (2002).
- Adams, L. A., et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 129, 113-121 (2005).
- Feldstein, A. E., et al. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 125, 437-443 (2003).
- Day, C. P., James, O. F. Steatohepatitis: a tale of two 'hits'. Gastroenterology. 114, 842-845 (1998).
- Donnelly, K. L., et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. The Journal of clinical investigation. 115, 1343-1351 (2005).
- Lambert, J. E., Ramos-Roman, M. A., Browning, J. D., Parks, E. J. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 146, 726-735 (2014).
- Parks, E. J., Hellerstein, M. K. Thematic review series: patient-oriented research. Recent advances in liver triacylglycerol and fatty acid metabolism using stable isotope labeling techniques. Journal of lipid research. 47, 1651-1660 (2006).
- Befroy, D. E., et al. Direct assessment of hepatic mitochondrial oxidative and anaplerotic fluxes in humans using dynamic 13C magnetic resonance spectroscopy. Nature medicine. 20, 98-102 (2014).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malaria journal. 6, 169 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados