Method Article
Determinación de la oxidación de ácidos grasos y la lipogénesis en el ratón hepatocitos primarios
En este artículo
Resumen
De la lipogénesis de novo y la oxidación de ácidos grasos β-constituyen vías metabólicas claves en los hepatocitos, las vías que son perturbados en varios trastornos metabólicos, incluyendo la enfermedad de hígado graso. Aquí se demuestra el aislamiento de hepatocitos primarios de ratón y describimos cuantificación de la oxidación de ácidos grasos β-y la lipogénesis.
Resumen
Lipid metabolism in liver is complex. In addition to importing and exporting lipid via lipoproteins, hepatocytes can oxidize lipid via fatty acid oxidation, or alternatively, synthesize new lipid via de novo lipogenesis. The net sum of these pathways is dictated by a number of factors, which in certain disease states leads to fatty liver disease. Excess hepatic lipid accumulation is associated with whole body insulin resistance and coronary heart disease. Tools to study lipid metabolism in hepatocytes are useful to understand the role of hepatic lipid metabolism in certain metabolic disorders.
In the liver, hepatocytes regulate the breakdown and synthesis of fatty acids via β-fatty oxidation and de novo lipogenesis, respectively. Quantifying metabolism in these pathways provides insight into hepatic lipid handling. Unlike in vitro quantification, using primary hepatocytes, making measurements in vivo is technically challenging and resource intensive. Hence, quantifying β-fatty acid oxidation and de novo lipogenesis in cultured mouse hepatocytes provides a straight forward method to assess hepatocyte lipid handling.
Here we describe a method for the isolation of primary mouse hepatocytes, and we demonstrate quantification of β-fatty acid oxidation and de novo lipogenesis, using radiolabeled substrates.
Introducción
Non-alcoholic fatty liver disease is one of the leading causes of liver disease in Westernized cultures1,2. Lipid accumulation within the liver is associated with cell death, fibrosis, and liver failure via yet unknown mechanisms3-6. In fatty liver disease, hepatocyte-mediated β-fatty acid oxidation and de novo lipogenesis are important determinants of net lipid accumulation7,8. This article will, therefore, focus on hepatocyte isolation, followed by quantification of β-fatty acid oxidation and de novo lipogenesis.
Numerous methodologies have been developed to interrogate hepatocyte lipid metabolism. Though it is possible to measure metabolism of fat in vivo using stable isotopes9,10, these methods are costly, and require large numbers of animals. Additionally, the ability to investigate the effect of exogenous chemicals is limited due to the nature of in vivo experimentation. In contrast, the isolation of primary hepatocytes from mouse liver provides an affordable avenue to pursue11. Furthermore, studying hepatocytes in culture allows investigators to study the effects of varying chemicals on lipid processing while circumventing the difficulties of in vivo experimentation. Finally, isolated hepatocytes avoid any confounding from varying genetics since they are derived from the liver of a single animal.
Here we isolate and culture of hepatocytes, and we measure β-fatty acid oxidation and de novo lipogenesis, using radiolabeled palmitate. The protocol detailed below is straight forward, effective, and reproducible.
Protocolo
Toda la experimentación con animales debe llevarse a cabo de acuerdo con las regulaciones locales y federales y con la aprobación de una administración institucional IACUC y seguridad radiológica.
1. Preparación
- Varios días antes del ensayo, descongelar la botella 500 ml de hígado Recopilación Medio (LDM) y vuelva a congelar ~ 35 ml alícuotas en tubos de 50 ml cónicos. Almacenar a -20 ° C hasta que se necesite.
- Un día antes del ensayo, pre-esterilizar herramientas de disección limpia por autoclave.
- En el día del ensayo, el tratamiento de la cantidad necesaria de placas de cultivo de 24 pocillos con colágeno.
- Mezclar 1 parte de 3 mg / ml de colágeno de cola de rata con 50 partes de PBS. Añadir aproximadamente 500 l a cada pocillo de una placa de 24 pocillos y se incuba durante 3-5 min a temperatura ambiente (RT). Retire el colágeno y permitir que la platina se seque al aire en el capó. Repetir al menos una vez adicional.
Nota: recubrimiento de colágeno se puede realizar hasta una semana en anuncioVance y placas almacenadas a 4 ° C sellado en una envoltura de plástico.
- Mezclar 1 parte de 3 mg / ml de colágeno de cola de rata con 50 partes de PBS. Añadir aproximadamente 500 l a cada pocillo de una placa de 24 pocillos y se incuba durante 3-5 min a temperatura ambiente (RT). Retire el colágeno y permitir que la platina se seque al aire en el capó. Repetir al menos una vez adicional.
- Preparar LDM para el ensayo: LDM Descongelar y calentar a 37 ° C y ajustar el pH a 7,4 utilizando 1 N de KOH. Filtrar utilizando filtro de jeringa de 0,2 micras y el lugar en una recirculación de 42 ° C baño de agua.
- Caliente 25 ml de hígado de perfusión del medio a 42 ° C en baño de agua de recirculación.
- Preparar 90% de sílice coloidal recubierto con una solución de polivinilpirrolidona: Añadir 1 ml de 10x DPBS a 9 ml de sílice coloidal recubierto con polivinilpirrolidona. Ajustar el pH a 7,4 usando HCl 0,1 N. Filtro con un filtro de jeringa de 0,2 micras estéril. Guarde a temperatura ambiente.
- Cálido Medio Chapado a 37 ° C.
2. El aislamiento de hepatocitos primarios de ratón
- Configurar bomba peristáltica, tubos, y mesa de disección: Esterilizar tubo por el lavado con etanol 5 ml 70% en agua destilada, seguido de 10 ml de agua estéril. Coloque la tubería en el hígado de perfusión del medio y de la bomba funcionar para llenartoda la longitud del tubo.
- Sacrificio del ratón por el método institucionalmente aprobado.
- Diseccionar abierta la cavidad abdominal: Rocíe el abdomen del ratón liberalmente con etanol al 70%. Con unas tijeras sin filo, hacer una incisión en la línea media a través de la dermis de la longitud del abdomen y reflejar lateralmente. Haga una incisión similar en el peritoneo para exponer las vísceras.
- El uso de un instrumento romo, desplazar suavemente los intestinos para exponer la vasculatura abdominal Localizar la vena cava inferior abdominal (IVC) y colocar una sutura por debajo de la de los vasos sanguíneos, distal a la vena renal
- Distal a la sutura, colocar una aguja y catéter en la vena cava inferior, avanzando más allá del nivel de la sutura. Con la aguja todavía en su lugar, ate la sutura alrededor del catéter para mantenerlo en su lugar. Retire con cuidado la aguja. Si se hace correctamente, la sangre con el flujo a través del catéter.
- Usando una pipeta, llenar el área restante en el catéter con medio de perfusión, asegurandoque el aire no está presente. Con mucho cuidado, coloque el tubo al catéter.
- Diseccionar abierta la cavidad pulmonar: reflejar suavemente los lóbulos hepáticos superiores para exponer el diafragma. Perfore cuidadosamente el diafragma con tijeras afiladas de punta, a continuación, hacer una incisión lateral para exponer la cavidad pleural, teniendo cuidado de evitar la vesícula biliar y la vasculatura pleural. Coloque una pinza bulldog alrededor de la vena cava inferior torácica proximal a la vena hepática.
- Cortar la vena porta y encienda la bomba a los 3 - 4 ml / min. Perfundir el hígado con hígado de perfusión del medio durante 5 minutos utilizando aproximadamente 20 ml de medio de perfusión.
Nota: El hígado debe cambiar inmediatamente de rojo a gris / marrón. Si las porciones del hígado siguen siendo rojo, esto probablemente indica mala perfusión, y la probabilidad de éxito en el aislamiento está muy disminuido. Durante la perfusión, tenga cuidado para asegurar el medio no se ejecuta y que no queden burbujas entran en el tubo. - Después de la incubación de 5 min, se detienela bomba y la transferencia de la tubería al hígado Digesto Medio. Reinicie la bomba y la perfusión del hígado durante otros 10 - 15 min (hasta que el medio se ha agotado).
- Al final de la perfusión, parar la bomba. El hígado debe tener un tono rosado y parecen algo ampliada. Extirpar el hígado por disección cuidadosa. Eliminar la vesícula biliar y el hígado para transferir 10 cm placa de cultivo tisular.
- En un gabinete de bioseguridad, añadir 10 ml de Revestimiento del Medio (Tabla 1) para el hígado. Raspar suavemente el hígado utilizando fórceps o un bisturí para eliminar los hepatocitos. Filtrar la suspensión utilizando un filtro de células de 100 micras y la transferencia a un tubo cónico de 50 ml. Lavar la placa con un adicional de 10 ml de Revestimiento del Medio y piscina en el tubo cónico de 50 ml.
- Sedimentar las células por centrifugación durante 5 min a 350 xg, 4 ° C.
- Medio Aspirar y pellet se resuspende en 10 ml de Revestimiento del medio y agregar 10 ml de 90% de sílice coloidal recubiertas con polyvinylpyrrolidone. Mezclar suavemente y centrifugar como en el paso 2.11. Después de la centrifugación, una capa de células muertas estará flotando en la parte superior de la mezcla, mientras que las células vivas se sedimenten en el fondo.
- Aspirar las células muertas y medio. Lavar 2 veces con 20 ml de Revestimiento del Medio, centrífuga como en 2.11.
- Resuspender las células en 10 ml de Revestimiento del Medio. Contar las células con un hemocitómetro y coloque 9 x 10 4 células / pocillo en 24 y placas de cultivo de colágeno tratados. Incubar en un 37 ° C incubadora de cultivo de tejidos durante 2 h. Cada placa se puede utilizar ya sea para el ensayo de oxidación de ácidos grasos o en el ensayo lipogénesis.
- Opcionalmente, cambie pozos para Mantenimiento Medio (Tabla 1) y la cultura a 37 ° C. Las células pueden ser cultivadas durante 2 - 3 días sin afectar a los resultados del ensayo.
3. Ensayo de oxidación de ácidos grasos
Advertencia: El uso de la radiactividad puede ser peligroso. Todas las compras, el almacenamiento, la manipulación, y dishecho de material radiactivo debe llevarse a cabo de acuerdo con, estatales y las regulaciones y directrices federales institucionales.
- 16 a 20 hr antes del ensayo, lavar las células 2 veces con PBS caliente. Cambiar las células a suero libre de suero inanición Medio (Tabla 1) con 20 nM de glucagón e incubar durante la noche a 37 ° C.
Nota: Debido a que el suero fetal bovino contiene una concentración desconocida de hormonas metabólicas (por ejemplo, insulina, glucagón), suero de hambre las células para eliminar cualquier efecto de confusión que esto puede tener en el ensayo. Las células son viables en suero inanición Medio durante> 24 h. Tratamiento con glucagón se utiliza para estimular la oxidación de ácidos grasos dentro de los hepatocitos. - En la mañana del ensayo, preparar la pre-incubación Medio: Resuspender una cantidad apropiada de palmitato de sodio en agua ultrapura para preparar una solución 100 mM y se calienta a 70 ° C durante 10 min. Mientras tanto, preparar la cantidad requerida (0,5 ml por pocillo de una placa de 24 pocillos)de DMEM con 25 mM HEPES, 1% BSA Fracción V, y 20 nM de glucagón. Calentar a 37 ° C.
- Una vez solubilizado, palmitato de añadir a una concentración final de 250 mM al medio. Cambie los hepatocitos de pre-incubación medio y se incuba a 37 ° C durante 2 horas. Reserve algún Pre-Incubación Medio a 37 ° C para su uso posterior.
- Durante la incubación, se seca una cantidad apropiada de 14 C-palmitato (0,5 Ci / pocillo) por evaporación bajo gas nitrógeno.
- Por ejemplo, para medir 24 muestras en una placa de 24 pocillos, transferir 120 l de 0,1 Ci / ml 14 C-palmitato a un tubo de 1,5 ml. Poco a poco se evapora el disolvente etanol soplando gas nitrógeno sobre la solución desde una distancia de 3-5 cm en una campana de humos. El disolvente debe evaporarse en aproximadamente 30 - 40 min, dejando seco 14 C-palmitato en la parte inferior del tubo.
- Aproximadamente 15 minutos antes del final de la incubación, resuspender el 14C-Palmitato en NaOH 0,1 N (12,5 l / Ci). Incubar a 70 ° C durante 10 min. Añadir tres volúmenes de tibia Pre-Incubación Medio y mezclar pipeteando arriba y abajo.
- Pico cada pocillo con 25 l de diluirse 14 C-palmitato. Mezclar agitando suavemente la placa e incubar a 37 ° C durante 90 minutos. Esta es la placa de ensayo.
- Durante la incubación, preparar la placa de papel de filtro (Figura 1).
- Retire la tapa de una placa de 24 pocillos estéril. Coloque un 2 cm x 2 cm trozo de papel de filtro en la parte inferior de cada uno de los pozos. Superposición de la placa con una pieza de 4 "x 7" parafina.
- El uso de un objeto rectangular grande, tal como una caja punta de micropipeta, frotar la parafina en los pozos para perforar la parafina en las aberturas y así crear un sello sobre el resto de la placa. Retire los círculos perforados de parafina ahora cubren los pozos. La placa debe ahora estar bien cubierto con parafilm en todas las áreas, excepto el o bienpenings.
- 10 min antes del final de la incubación, añadir 200 l de NaOH 3 N a cada pocillo de la placa de papel de filtro, asegurándose de que el papel de filtro absorbe todo el líquido.
- Opcionalmente antes de la congelación, transferir el medio de una placa de 24 pocillos fresco. Después de lavar una vez con PBS, lisar las células restantes en HCl 0,1 N y calcular el contenido de proteína mediante ensayo BCA.
- Al final de la incubación, complemento congelar la placa de ensayo en nitrógeno líquido. Tenga cuidado para asegurar así cada uno está completamente congelado antes de proceder.
- Añadir 100 l de 70% ácido perclórico a cada pocillo de la placa de ensayo. Inmediatamente cubrir con el plato de papel de filtro. Coloque las placas en un agitador orbital y el rock a la velocidad orbital de 80 rpm a temperatura ambiente durante 2 horas.
- Después de la incubación, procesar las muestras:
- Para medir la fracción de CO 2, la transferencia de los cuadrados de papel de filtro a 4 ml de fluido de centelleo líquido en un centelleovial y la medida 14 de la señal C.
- Para medir el material soluble ácido, transferir 400 l de medio a un tubo de microcentrífuga de 1,5 ml. Centrifugar a máxima velocidad durante 10 min. Añadir 100 l del sobrenadante resultante a 500 l de 2: 1 cloroformo-metanol (v / v), y agitar brevemente.
- Añadir 250 l de agua a la mezcla, y agitar de nuevo. Centrifugar las muestras durante 10 min a 3000 x g. Transferencia de 200 l de la fase superior a 4 ml de fluido de centelleo líquido en un vial de centelleo y medir 14 la señal C.
4. lipogénesis Ensayo
- La noche antes de comenzar el ensayo, se lavan las células 2 veces con PBS caliente. Cambie los hepatocitos a suero inanición Medio con 100 nM de insulina. Incubar durante la noche a 37 ° C.
Nota: Debido a que el suero fetal bovino contiene una concentración desconocida de hormonas metabólicas (por ejemplo, insulina, glucagón), Suero de comer a las células para eliminar cualquier efecto de confusión que esto puede tener en el ensayo. Las células son viables en suero inanición Medio durante> 24 h. La insulina se usa en este ensayo para estimular la lipogénesis. - Hacer lipogénesis Medio: Suero inanición medio con 100 nM de insulina, 10 mM de acetato de frío y 0,5 Ci 3 H-Acetato por pocillo. Cambie células a lipogénesis Medium y se incuba a 37 ° C durante 2 hr. Incluir todos los compuestos de interés para ser probados.
- Después de que el período de incubación, lavar las células 2 veces con PBS. Células Lyse por raspado en 120 l de HCl 0,1 N. Reserva 10 l para el ensayo de proteínas (evaluar por ensayo BCA), y la transferencia de 100 l a tubo de microcentrífuga de 1,5 ml.
- Lípidos extracto por adición de 500 l de 2: 1 cloroformo-metanol (v / v). Vortex brevemente e incubar a temperatura ambiente durante 5 min. Añadir 250 l de agua, vortex e incubar a temperatura ambiente durante 5 min. Centrifugar las muestras 10 min a 3.000 xg, RT. Cuidadosamentetransferencia de fase inferior a 4 ml de fluido de centelleo líquido en un vial de centelleo y medir la actividad 3 H.
Resultados
Aislamientos de hepatocitos suelen dar en 1 - 3 x 10 7 células totales. Después de la incubación durante la noche, las células van a aparecer hexagonal, muchos de los cuales se binucleadas (Figura 2). Las células sanas deben estar desprovisto de granulaciones o vesículas, que son indicativos de la muerte celular.
En general, el ensayo de oxidación de ácidos grasos se ejecuta en tres o cuatro repeticiones por compuesto de ensayo. Condes de las CO 2 muestras son de aproximadamente una quinta parte de los derivados del material soluble en ácido. Por lo general calculamos la proporción de CO 2 al material soluble ácido como una medida de la oxidación completa (es decir, la cantidad oxidado a través del ciclo del ácido cítrico). Las sustancias que promueven la respiración celular, tales como carbonilo cianuro-4- (trifluorometoxi) fenilhidrazona (FCCP) cambiarán esta relación hacia CO 2, lo que indica mayor oxidación a través del ciclo de Krebs. Los inhibidores de la cadena respiratoria disminuirán la oxidación en general(Figura 3). Cuando pilotando este ensayo, lo mejor es incluir un control sin células para verificar el procedimiento es la producción de la actividad específica de la célula.
El ensayo de lipogénesis es más a menudo comparado con un control de punto de tiempo cero (células tratadas con sustrato inmediatamente antes de la cosecha). El ensayo debe ser lineal frente al tiempo a través de al menos cuatro horas de incubación. Los compuestos que aumentan la oxidación de ácidos grasos, tales como FCCP, o disminuyen la síntesis de ATP, tales como oligomicina, reducirá la actividad lipogénica (Figura 4).
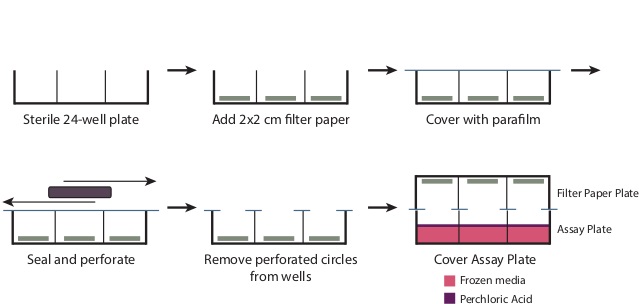
Figura 1: Preparación de la placa de filtro Para preparar la placa de filtro tal como se describe en el paso 3.6, retire la tapa de una placa de 24 pocillos estéril. Colocar un 2 cm x 2 cm trozo de papel de filtro en la base de cada pocillo. Superposición de toda la placa con un 7 "x 4" pedazo de párrafopelícula, y frote la placa para sellar herméticamente la parte superior de los pozos. Esto generará círculos perforados de parafina sobre las aberturas así, que deben ser eliminadas. Después de la adición del ácido perclórico en el paso 3.9, coloque la placa de papel de filtro con fuerza sobre la placa de ensayo para producir un sello.
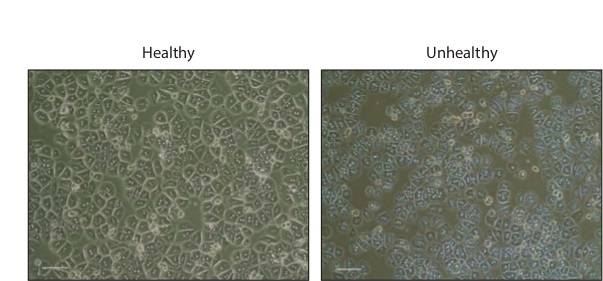
Figura 2: hepatocitos primarios de Cultura Fase contrastan imágenes de hepatocitos de ratón primaria saludables y no saludables de 16 horas después de la siembra en placas de 24 pocillos recubiertos de colágeno. Barra de escala, 200 micras. Haga clic aquí para ver una versión más grande de esta figura.
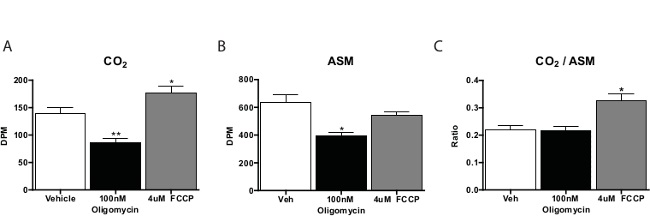
Figura 3: oxidación de ácidos grasos por primaria Los hepatocitos de ratón en Cultura 14 C-Palmitato de oxidación para (A) CO 2, material soluble ácido (B) y (C) la relación de CO 2 al material soluble ácido a partir de hepatocitos primarios incubadas con vehículo, FCCP, o oligomicina. Los datos son la media ± SEM. * p <0,05, ** p <0,01 vs. vehículo mediante la prueba t de una cola de Student. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: la lipogénesis en hepatocitos de cultivo primario de ratón (A) la actividad lipogénica frente al tiempo en hepatocitos primarios tratados con 3 H-etilo y (B) la actividad lipogénica en presencia de vehículo, oligomicina, o FCCP. Los datos son la media ± SEM. *** p <0.001 vs. vehículo mediante una cola la prueba t de Student.
| Mesa 1 | |
| Medios de Cultivo | |
| Revestimiento del Medio | |
| DMEM | 500 ml |
| FBS | 10% |
| Piruvato de sodio | 2 mM |
| Pen / Strep | 2% |
| Dexametasona | 1 M |
| La insulina | 0.1 M |
| Medio de Mantenimiento | |
| DMEM | 500 ml |
| Fracción V BSA | 0,2% |
| Piruvato de sodio | 2 mM |
| Pen / Strep | 2% |
| Dexametasona | 0.1 M |
| La insulina | 1 nM |
| El hambre Medio | |
| DMEM | 500 ml |
| Fracción V BSA | 0,2% |
| Piruvato de sodio | 2 mM |
| Pen / Strep | 2% |
Discusión
El tiempo desde el sacrificio a la perfusión debe ser inferior a 3 min para la perfusión ideal y digestión con colagenasa del hígado. Una vez que se inicia la perfusión con perfusión del medio, el hígado debe cambiar inmediatamente la apariencia de de rojo a pálido. Después de aproximadamente 10 minutos de incubación con LDM, el hígado aparecerá hinchada y de color rosa. En el caso de que la perfusión es insuficiente, el hígado no puede exhibir estos cambios, y esto normalmente dará como resultado un rendimiento de hepatocitos inferior.
Después de las etapas de lavado, hepatocitos aislados se pueden almacenar durante varias horas en suspensión en hielo antes de chapado. Una vez plateado, hepatocitos cultivados requieren varias horas para adherirse y extendidas. Después de 2 h de incubación en Revestimiento del Medio, los hepatocitos se mantendrán pequeños y redondos. Después de una incubación durante la noche, los hepatocitos se enfrentará a una apariencia hexagonal más características, muchas de las cuales se binucleadas. Si la preparación no es saludable, la cells exhibirá numerosas granulaciones y blebbing ocasional, indicativo de la muerte celular. A fin de mantener mejor la viabilidad del cultivo, los medios de comunicación deben cambiarse cada 24 horas y cuidado para minimizar la exposición al aire libre.
Palmitato de sodio es insoluble en agua a RT, sin embargo, después de incubación a 70 ° C debe disolver completamente. La exposición a RT hará que el lípido se solidifique rápidamente, por lo que es imperativo trabajar rápidamente. Una vez palmitato ha sido disuelto en la pre-incubación Medium, es fundamental para mantener el medio a 37 ° C con el fin de mantener la solubilidad de los lípidos.
Como se mencionó anteriormente, para asegurar resultados precisos del ensayo oxidación de ácidos grasos, el medio debe estar completamente congelado en nitrógeno líquido. Esto evita cualquier escape de CO 2 durante la adición de ácido perclórico a los pocillos. Inmediatamente después de la adición del ácido perclórico a las muestras congeladas, la placa de ensayo debe ser firmemente covered por la placa de papel de filtro, asegurándose de alinear las placas de transferencia de gas entre los pozos. Dado que el papel de filtro se empapa con un exceso de NaOH, la estequiometría de la reacción es capaz de capturar el CO 2 liberado como NaHCO 3. Los experimentos siguientes de este protocolo han generado resultados reproducibles, con repeticiones típicas tener% CV ≤ 10. Si es necesario, material soluble ácido de la oxidación de ácidos grasos de ensayo o el lisado celular a partir del ensayo lipogénesis son capaces de ser almacenado a -80 ° C y procesada más tarde sin ningún efecto apreciable en los resultados. Los ensayos descritos anteriormente permiten un mecanismo eficiente relativamente simple y tiempo para evaluar el metabolismo de lípidos en los hepatocitos primarios aislados a partir de hígado de ratón. A través del uso de la cultura ex vivo, estos métodos permiten probar los efectos de varias condiciones de oxidación de ácidos grasos y la lipogénesis. Este protocolo puede ser adaptado para evaluar el papel de las alteraciones genéticas en estos proceEPE, sin embargo, el aislamiento de los hepatocitos es el tiempo de limitación y por lo tanto in vivo analiza puede ser más adecuado para la investigación de ciertos modelos de animales transgénicos. Si es necesario análisis de múltiples preparaciones de hepatocitos, la normalización de los valores de ensayo para los niveles de proteína se puede realizar como se describe en el paso opcional 3.7.1 y se utiliza para la normalización. Recomendamos ensayos realizados en múltiples preparaciones pueden comparar los cambios relativos en comparación con un control adecuado.
Por último, no hemos explorado la opción de períodos de cultivo más largas, sin embargo, los hepatocitos pueden exhibir características metabólicas equivalentes después de varios días de cultivo. Con una ligera modificación, este protocolo puede ser adaptado para permitir varios tratamientos día antes de la evaluación de los efectos de los compuestos sobre el metabolismo lipídico.
Divulgaciones
The authors indicate they have no conflicts of interest.
Agradecimientos
We would like to acknowledge Susan Gray and Umadevi Chalasani for their help with technical aspects of the hepatocyte isolation protocol. This work was supported by NIDDK grant 5R01DK089185 (to M.P. Cooper) and the DERC Pilot and Feasibility Program at UMMS (to M.P. Cooper).
Materiales
| Name | Company | Catalog Number | Comments |
| Liver Perfusion Medium | Life Technologies | 17701038 | |
| Liver Digest Medium | Life Technologies | 17703034 | Aliquot and store at -20 °C |
| PBS | Corning | 21-040-CV | |
| 10X DPBS | Corning | 46-013-CM | |
| DMEM | Corning | 10-017-CV | |
| FBS | Life Technologies | 26140079 | |
| Collagen | Life Technologies | A1048301 | |
| Colloidal silica coated with polyvinylpyrrolidone | GE Life Sciences | 17-0891-01 | |
| Sodium Pyruvate | Cellgro | 25-000-CI | |
| Penicillin / Streptomycin | Cellgro | 30-001-CI | |
| Insulin | Sigma | I0516-5ML | |
| Dexamethasone | Sigma | D2915-100MG | |
| Albumin (BSA), Fraction V | MP Biomedicals | 103703 | |
| 24-Well Culture Dish | Corning Falcon | 353047 | |
| Tygon S3 Tubing | Cole Parmer | 06460-34 | |
| Male Leur Lock to 200 Barb Connectors | Cole Parmer | 45518-00 | |
| 24 G x 3/4" Catheter | SurFlo | SROX2419CA | |
| Perma-Hand Silk Suture | Ethicon | 683G | |
| Cell Strainer | Corning Falcon | 08-771-2 | |
| IsoTemp 3013HD Recirculating Water Bath | Fisher | 13-874-3 | |
| MasterFlex C/L Peristaltic Pump | MasterFlex | HV-77122-24 | |
| Microclamp | Roboz | RS-7438 | Pre-sterilize in autoclave |
| 5” Straight, Blunt-Blunt Operating Scissors | Roboz | RS-6810 | Pre-sterilize in autoclave |
| 24 mm Blade Straight, Sharp-point Microdissecting Scissors | Roboz | RS-5912 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Microdissecting Forceps | Roboz | RS-5130 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Full Curve Microdissecting Forceps | Roboz | RS-5137 | Pre-sterilize in autoclave |
| 60 ml Syringe | Becton Dickinson | 309653 | |
| 50 ml conical tubes | Corning Falcon | 352070 | |
| BCA Protein Assay | Thermo Scientific | 23225 | |
| Biosafety Cabinet | |||
| CO2 Incubator | |||
| Serological pipets | |||
| 1,000, 200, 20 μl pipet and tips |
Referencias
- Clark, J. M., Brancati, F. L., Diehl, A. M. The prevalence and etiology of elevated aminotransferase levels in the United States. The American journal of gastroenterology. 98, 960-967 (2003).
- Lazo, M., et al. Prevalence of nonalcoholic Fatty liver disease in the United States: the third national health and nutrition examination survey, 1988-1994. American journal of epidemiology. 178, 38-45 (2013).
- Angulo, P. Nonalcoholic fatty liver disease. The New England journal of medicine. 346, 1221-1231 (2002).
- Adams, L. A., et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 129, 113-121 (2005).
- Feldstein, A. E., et al. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 125, 437-443 (2003).
- Day, C. P., James, O. F. Steatohepatitis: a tale of two 'hits'. Gastroenterology. 114, 842-845 (1998).
- Donnelly, K. L., et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. The Journal of clinical investigation. 115, 1343-1351 (2005).
- Lambert, J. E., Ramos-Roman, M. A., Browning, J. D., Parks, E. J. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 146, 726-735 (2014).
- Parks, E. J., Hellerstein, M. K. Thematic review series: patient-oriented research. Recent advances in liver triacylglycerol and fatty acid metabolism using stable isotope labeling techniques. Journal of lipid research. 47, 1651-1660 (2006).
- Befroy, D. E., et al. Direct assessment of hepatic mitochondrial oxidative and anaplerotic fluxes in humans using dynamic 13C magnetic resonance spectroscopy. Nature medicine. 20, 98-102 (2014).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malaria journal. 6, 169 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados