Method Article
Determinazione della ossidazione degli acidi grassi e la lipogenesi nel topo primaria Epatociti
In questo articolo
Riepilogo
De novo lipogenesi e acido ossidazione β-grassi costituiscono importanti vie metaboliche in epatociti, percorsi che sono perturbate in diversi disordini metabolici, tra cui malattia del fegato grasso. Qui mostriamo isolamento di epatociti primari di topo e descriviamo la quantificazione di ossidazione degli acidi β-grassi e lipogenesi.
Abstract
Lipid metabolism in liver is complex. In addition to importing and exporting lipid via lipoproteins, hepatocytes can oxidize lipid via fatty acid oxidation, or alternatively, synthesize new lipid via de novo lipogenesis. The net sum of these pathways is dictated by a number of factors, which in certain disease states leads to fatty liver disease. Excess hepatic lipid accumulation is associated with whole body insulin resistance and coronary heart disease. Tools to study lipid metabolism in hepatocytes are useful to understand the role of hepatic lipid metabolism in certain metabolic disorders.
In the liver, hepatocytes regulate the breakdown and synthesis of fatty acids via β-fatty oxidation and de novo lipogenesis, respectively. Quantifying metabolism in these pathways provides insight into hepatic lipid handling. Unlike in vitro quantification, using primary hepatocytes, making measurements in vivo is technically challenging and resource intensive. Hence, quantifying β-fatty acid oxidation and de novo lipogenesis in cultured mouse hepatocytes provides a straight forward method to assess hepatocyte lipid handling.
Here we describe a method for the isolation of primary mouse hepatocytes, and we demonstrate quantification of β-fatty acid oxidation and de novo lipogenesis, using radiolabeled substrates.
Introduzione
Non-alcoholic fatty liver disease is one of the leading causes of liver disease in Westernized cultures1,2. Lipid accumulation within the liver is associated with cell death, fibrosis, and liver failure via yet unknown mechanisms3-6. In fatty liver disease, hepatocyte-mediated β-fatty acid oxidation and de novo lipogenesis are important determinants of net lipid accumulation7,8. This article will, therefore, focus on hepatocyte isolation, followed by quantification of β-fatty acid oxidation and de novo lipogenesis.
Numerous methodologies have been developed to interrogate hepatocyte lipid metabolism. Though it is possible to measure metabolism of fat in vivo using stable isotopes9,10, these methods are costly, and require large numbers of animals. Additionally, the ability to investigate the effect of exogenous chemicals is limited due to the nature of in vivo experimentation. In contrast, the isolation of primary hepatocytes from mouse liver provides an affordable avenue to pursue11. Furthermore, studying hepatocytes in culture allows investigators to study the effects of varying chemicals on lipid processing while circumventing the difficulties of in vivo experimentation. Finally, isolated hepatocytes avoid any confounding from varying genetics since they are derived from the liver of a single animal.
Here we isolate and culture of hepatocytes, and we measure β-fatty acid oxidation and de novo lipogenesis, using radiolabeled palmitate. The protocol detailed below is straight forward, effective, and reproducible.
Protocollo
Tutti sperimentazione animale deve essere effettuata in conformità con le normative locali e federali e con l'approvazione di un IACUC e radioprotezione amministrazione istituzionale.
1. Preparazione
- Alcuni giorni prima del test, scongelare il flacone da 500 ml di fegato Digest Medium (LDM) e ricongelare ~ 35 ml aliquote in 50 ml provette coniche. Conservare a -20 ° C fino al momento dell'uso.
- Un giorno prima del test, pre-sterilizzare strumenti di dissezione puliti in autoclave.
- Il giorno del test, trattare la quantità necessaria di piastre di coltura a 24 pozzetti con collagene.
- Mescolare 1 parte di 3 mg / ml di collagene coda di ratto con 50 parti di PBS. Aggiungere circa 500 ml in ciascun pozzetto di una piastra da 24 pozzetti e incubare per 3-5 minuti a temperatura ambiente (RT). Rimuovere il collagene e lasciare asciugare la piastra all'aria in cappuccio. Ripetere almeno una volta in più.
Nota: Rivestimento collagene può essere effettuata fino a una settimana a annuncioVance e piatti conservati a 4 ° C sigillato in involucro di plastica.
- Mescolare 1 parte di 3 mg / ml di collagene coda di ratto con 50 parti di PBS. Aggiungere circa 500 ml in ciascun pozzetto di una piastra da 24 pozzetti e incubare per 3-5 minuti a temperatura ambiente (RT). Rimuovere il collagene e lasciare asciugare la piastra all'aria in cappuccio. Ripetere almeno una volta in più.
- Preparare LDM per l'analisi: Scongelare LDM e caldo a 37 ° C e aggiustare il pH a 7,4 con 1 N KOH. Filtro utilizzando 0,2 micron siringa filtro e posto in un ricircolo 42 ° C bagnomaria.
- Caldo 25 ml di fegato di perfusione medio a 42 ° C a bagnomaria. Ricircolo
- Preparare 90% di silice colloidale con una soluzione di polivinilpirrolidone rivestita: Aggiungere 1 ml di DPBS 10x a 9 ml di silice colloidale rivestite con polivinilpirrolidone. Regolare il pH a 7,4 con 0,1 N HCl. Filtrare con un filtro a siringa da 0,2 micron sterile. Conservare a temperatura ambiente.
- Caldo placcatura medio a 37 ° C.
2. Isolamento di mouse primario Epatociti
- Impostare pompa peristaltica, tubi, e la tabella dissezione: Sterilizzare tubi da vampate di calore con 5 ml etanolo al 70% in acqua distillata, seguita da 10 ml di acqua sterile. Mettere il tubo in fegato perfusione Medium e pompa eseguire per riempireintera lunghezza del tubo.
- Sacrifica il mouse con il metodo istituzionalmente approvato.
- Sezionare aperto della cavità addominale: Spruzzare l'addome del mouse liberamente con il 70% di etanolo. Utilizzando le forbici blunt-end, fare una incisione mediana attraverso il derma la lunghezza dell'addome e riflettono lateralmente. Eseguire un'incisione simile nel peritoneo per esporre le viscere.
- Utilizzando un corpo contundente, spostare dolcemente gli intestini per esporre la vascolarizzazione addominale Individuare il addominale vena cava inferiore (IVC) e posizionare una sutura sotto il vaso sanguigno, distale alla vena renale
- Distale alla sutura, posizionare un ago e catetere nel IVC, farlo avanzare oltre il livello della sutura. Con l'ago ancora nel luogo, cravatta la sutura intorno al catetere per tenerlo in posizione. Rimuovere con cautela l'ago. Se fatto correttamente, il sangue con flusso attraverso il catetere.
- Usando una pipetta, riempire l'area rimanente nel catetere con mezzo di perfusione, assicurandoche l'aria non sia presente. Con grande cura, collegare il tubo al catetere.
- Sezionare aperto la cavità polmonare: riflettere delicatamente i lobi del fegato superiori per esporre il diaframma. Forare con attenzione il diaframma con le forbici affilate punte, poi fare una incisione laterale per esporre la cavità pleurica, avendo cura di evitare la cistifellea e vascolare pleurico. Posizionare un morsetto bulldog intorno al torace vena cava inferiore solo prossimale alla vena epatica.
- Tagliare la vena porta e accendere la pompa a 3 - 4 ml / min. Profumato fegato con fegato di perfusione medio per 5 minuti con circa 20 ml di terreno di perfusione.
Nota: Il fegato deve cambiare immediatamente dal rosso al grigio / marrone chiaro. Se porzioni di fegato rimangono rossa, questo probabilmente indica scarsa perfusione, e la probabilità di isolamento di successo è notevolmente diminuita. Durante la perfusione, essere attenti a garantire il supporto non si esaurisce e che bolle entrano nel tubo. - Dopo la 5 min di incubazione, fermatala pompa e il tubo di trasferimento Fegato Digest Medium. Riavviare la pompa e perfusione del fegato per altri 10 - 15 minuti (finché il terreno è esaurito).
- Al termine della perfusione, fermare la pompa. Il fegato dovrebbe avere un colore rosato e apparire in qualche modo allargata. Asportare il fegato da un'attenta dissezione. Rimuovere la cistifellea e trasferire il fegato a 10 centimetri piatto di coltura di tessuti.
- In un armadio biosicurezza, aggiungere 10 ml di placcatura medio (Tabella 1) al fegato. Raschiare delicatamente il fegato utilizzando sia pinze o un bisturi per rimuovere le epatociti. Filtrare la sospensione con un colino cella di 100 micron e trasferimento in una provetta da 50 ml. Lavare la piastra con altri 10 ml di placcatura medio e piscina in tubo conico da 50 ml.
- Agglomerare le cellule per centrifugazione per 5 minuti a 350 xg, a 4 ° C.
- Aspirare a medio e risospendere pellet in 10 ml di placcatura medio e aggiungere 10 ml di 90% di silice colloidale rivestito con Polyvinylpyrrolidone. Mescolare delicatamente e centrifugare come al punto 2.11. Dopo centrifugazione, uno strato di cellule morte sarà galleggiano sulla superficie della miscela, mentre le cellule vive si sedimentare sul fondo.
- Aspirare le cellule morte e le medie. Lavare 2 volte con 20 ml di placcatura Medium, centrifuga come a 2.11.
- Risospendere le cellule in 10 ml di placcatura Media. Contare le celle con un emocitometro e posizionare 9 x 10 4 cellule / pozzetto in 24 pozzetti piatti collagene trattati cultura. Incubare a 37 ° C tessuto cultura incubatore per 2 ore. Ogni piastra può essere utilizzata sia per il saggio Fatty Acid ossidazione o il dosaggio Lipogenesi.
- Facoltativamente, modificare pozzetti Manutenzione Medium (Tabella 1) e cultura a 37 ° C. Le celle possono essere coltivate per 2 - 3 giorni senza influenzare i risultati del test.
3. acidi grassi ossidazione Assay
Attenzione: L'uso di radioattività può essere pericoloso. Tutti gli acquisti, lo stoccaggio, la movimentazione, e disposal di materiale radioattivo deve essere effettuata nel rispetto, statali e regolamenti e linee guida federali istituzionali.
- 16 - 20 ore prima del dosaggio, lavare le cellule 2 volte con PBS caldo. Modificare le cellule di siero Starvation mezzo privo di siero (Tabella 1) con 20 nM glucagone e incubare una notte a 37 ° C.
Nota: Poiché siero fetale bovino contiene una concentrazione sconosciuta di ormoni metabolici (per esempio insulina, glucagone), siero morire di fame le cellule per rimuovere eventuali effetti confondenti questa può avere sul dosaggio. Le cellule sono vitali nel siero fame medio per> 24 ore. Trattamento glucagone è usato per stimolare ossidazione degli acidi grassi all'interno epatociti. - La mattina del saggio, preparare preincubazione medio: Risospendere una quantità appropriata di sodio palmitato in acqua ultrapura per ottenere una soluzione 100 mM e si riscalda a 70 ° C per 10 min. Nel frattempo, preparare la quantità necessaria (0,5 ml per pozzetto di una piastra da 24 pozzetti)di DMEM con 25 mM HEPES, 1% BSA Frazione V, e 20 nM glucagone. Riscaldare a 37 ° C.
- Una volta solubilizzato, palmitato aggiungere ad una concentrazione finale di 250 mM al mezzo. Cambiare epatociti di pre-incubazione medio e incubare a 37 ° C per 2 ore. Prenota alcuni pre-incubazione medio a 37 ° C per un uso successivo.
- Durante l'incubazione, asciugare una quantità appropriata di 14 C-palmitato (0,5 pCi / pozzetto) per evaporazione sotto azoto.
- Ad esempio, per misurare 24 campioni in una piastra a 24 pozzetti, trasferire 120 ml di 0,1 pCi / ml 14 C-palmitato in una provetta da 1,5 ml. Lentamente si evapora il solvente etanolo soffiando gas azoto sulla soluzione da una distanza di 3-5 cm in una cappa aspirante. Il solvente deve evaporare in circa 30 - 40 min, lasciando asciutta 14 C-palmitato nel fondo della provetta.
- Circa 15 minuti prima della fine dell'incubazione, risospendere il 14C-palmitato in NaOH 0,1 N (12.5 ml / uCi). Incubare a 70 ° C per 10 min. Aggiungere tre volumi di caldo pre-incubazione medio e mescolare pipettando su e giù.
- Spike ogni pozzetto con 25 ml di diluito 14 C-palmitato. Mescolare scuotendo delicatamente la piastra e incubare a 37 ° C per 90 min. Questa è la piastra saggio.
- Durante l'incubazione, preparare la piastra di filtraggio di carta (Figura 1).
- Togliere il coperchio da un 24-pozzetti sterili. Posizionare un 2 cm x 2 cm pezzo di carta da filtro sul fondo di ciascun pozzetto. Sovrapporre il piatto con un pezzo di 4 "x 7" parafilm.
- Utilizzando un grande oggetto rettangolare, ad esempio una casella punta della micropipetta, strofinare la parafilm sui pozzetti per perforare la parafilm le aperture oltre e creare una tenuta sul resto della piastra. Rimuovere i cerchi forati di parafilm ora coprono i pozzetti. La piastra dovrebbe essere ben coperto con parafilm in tutte le zone tranne il bene openings.
- 10 min prima della fine dell'incubazione, aggiungere 200 ml di NaOH N 3 a ciascun pozzetto della piastra Filter Paper, assicurandosi che la carta da filtro assorbe tutto il liquido.
- Facoltativamente prima del congelamento, trasferire il mezzo di una piastra da 24 pozzetti fresco. Dopo aver lavato una volta con PBS, la lisi dei rimanenti cellule in 0,1 N HCl e calcolare il contenuto proteico mediante test BCA.
- Al termine dell'incubazione, snap-congelare la piastra di dosaggio in azoto liquido. Fare attenzione a garantire che ogni bene è completamente congelato prima di procedere.
- Aggiungere 100 ml di 70% di acido perclorico in ogni pozzetto della piastra saggio. Coprire immediatamente con la piastra di carta da filtro. Posizionare le piastre su un agitatore orbitale e roccia alla velocità orbitale di 80 rpm a temperatura ambiente per 2 ore.
- In seguito l'incubazione, processare i campioni:
- Per misurare la frazione di CO 2, trasferire i quadrati di carta filtro a 4 ml di fluido di scintillazione liquida in un scintillazionefiala e misura 14 Segnale C.
- Per misurare il materiale solubile acido, trasferire 400 ml di mezzo in una provetta da 1,5 ml microcentrifuga. Centrifugare alla massima velocità per 10 min. Aggiungere 100 pl del supernatante risultante a 500 ml di 2: 1 cloroformio-metanolo (v / v) e miscelare brevemente.
- Aggiungere 250 ml di acqua alla miscela, e di nuovo vortice. Campioni di centrifugazione per 10 min a 3000 x g. Trasferimento 200 ml di fase superiore a 4 ml di liquido di scintillazione liquido in un flaconcino scintillazione e misura 14 Segnale C.
4. Lipogenesi Assay
- La sera prima di iniziare il test, lavare le cellule 2 volte con il caldo PBS. Modificare le epatociti a Serum fame media con 100 nM insulina. Incubare una notte a 37 ° C.
Nota: Poiché siero fetale bovino contiene una concentrazione sconosciuta di ormoni metabolici (per esempio insulina, glucagone), Il siero morire di fame le cellule per rimuovere eventuali effetti confondenti questa può avere sul dosaggio. Le cellule sono vitali nel siero fame medio per> 24 ore. L'insulina è usato in questo test per stimolare la lipogenesi. - Fai Lipogenesi Media: Siero fame medio con 100 nM insulina, 10 micron acetato freddo e 0,5 uCi 3 H-acetato per pozzetto. Modificare le celle a Lipogenesi media e incubare a 37 ° C per 2 ore. Includere eventuali composti di interesse da testare.
- Dopo il periodo di incubazione, lavare le cellule 2 volte con PBS. Lisare le cellule raschiando in 120 ml di 0,1 N HCl. Riserva 10 microlitri per l'analisi delle proteine (valutare mediante test BCA), e il trasferimento di 100 l per provetta da 1,5 ml microcentrifuga.
- Estratto lipidi per aggiunta di 500 ml di 2: 1 cloroformio-metanolo (v / v). Vortex brevemente e incubare a temperatura ambiente per 5 min. Aggiungere 250 ml di acqua, vortice e incubare a temperatura ambiente per un ulteriore 5 min. Centrifugare i campioni 10 min a 3000 x g, RT. Accuratamentetrasferire fase inferiore a 4 ml liquido di scintillazione liquido in un flaconcino scintillazione e misurare l'attività 3 H.
Risultati
Isolamenti epatociti tipicamente risultato in 1 - 3 x 10 7 cellule totali. Dopo incubazione per una notte, le cellule appariranno esagonale, molti dei quali saranno binucleate (Figura 2). Le cellule sane dovrebbero essere privi di granulazioni o vesciche, indicativi della morte cellulare.
In generale, dosaggio di acidi grassi ossidazione viene eseguito in tre o quattro repliche per composto in esame. Conti per le CO 2 campioni sono circa un quinto di quelli ottenuti con il materiale solubile dell'acido. Tipicamente calcolare il rapporto tra CO 2 al materiale solubile acido come misura di completa ossidazione (cioè, la quantità ossidato tramite il ciclo dell'acido citrico). Sostanze che favoriscono la respirazione cellulare, come il cianuro di carbonile-4- (trifluorometossi) fenilidrazone (FCCP) si sposterà verso questo rapporto di CO 2, che indica più ossidazione attraverso il ciclo TCA. Inibitori della catena respiratoria diminuirà ossidazione sulla intera(Figura 3). Nel pilotare questo saggio, è preferibile includere un controllo non-cell per verificare la procedura produce attività specifica delle cellule.
Il Lipogenesi test è spesso paragonato a un controllo a zero timepoint (cellule trattate con substrato immediatamente prima della raccolta). Il dosaggio deve essere lineare in funzione del tempo attraverso almeno quattro ore di incubazione. Composti che migliorano ossidazione degli acidi grassi, quali FCCP, o diminuiscono la sintesi di ATP, come oligomicina, ridurranno lipogenico (Figura 4).
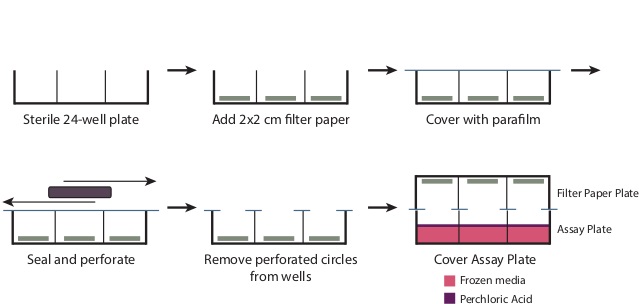
Figura 1: Preparazione della piastra di filtraggio Per preparare il piatto filtro come descritto al punto 3.6, rimuovere il coperchio da un 24-pozzetti sterili. Inserire un 2 cm x 2 cm pezzo di carta da filtro alla base di ogni pozzetto. Sovrapporre l'intera piastra con un 7 "x 4" pezzo di parafilm, e strofinare la piastra per sigillare ermeticamente la sommità dei pozzetti. Questo genererà cerchi forati di parafilm sopra le aperture così, che dovrebbero essere eliminati. Dopo aggiunta di acido perclorico al passo 3.9, posizionare la piastra di filtraggio carta strettamente sopra la piastra di dosaggio per produrre una tenuta.
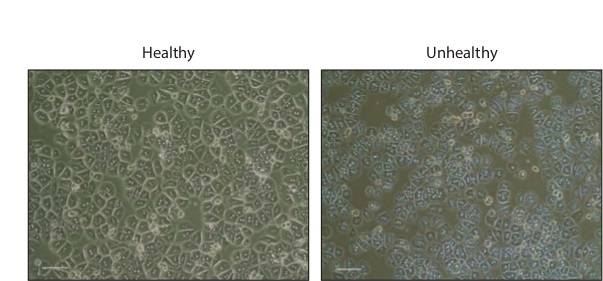
Figura 2: primaria epatociti in Cultura contrasto di fase le immagini di epatociti sani e non sani del mouse primario 16 ore dopo la placcatura in collagene rivestito piastre da 24 pozzetti. Barra della scala, 200 micron. Cliccate qui per vedere una versione più grande di questa figura.
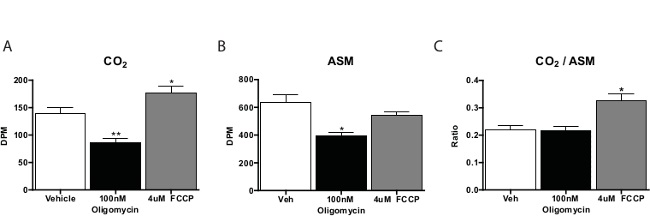
Figura 3: acidi grassi ossidazione da primaria Mouse epatociti in Cultura 14 C-palmitato di ossidazione per (A) CO 2, materiale solubile (B) l'acido, e (C) il rapporto di CO 2 di materiale solubile acido da epatociti primari incubate con veicolo, FCCP, o oligomicina. I dati sono media ± SEM. * p <0.05, ** p <0.01 vs veicolo da t-test ad una coda di Student. Cliccate qui per vedere una versione più grande di questa figura.

Figura 4: Lipogenesi in colture primarie mouse epatociti (A) lipogenici attività in funzione del tempo in epatociti primari trattati con 3 H-acetato e (B) l'attività lipogenic in presenza di veicolo, oligomicina o FCCP. I dati sono media ± SEM. *** p <0,001 vs veicolo da una coda test t.
| Tabella 1 | |
| Media Cultura | |
| Placcatura media | |
| DMEM | 500 ml |
| FBS | 10% |
| Piruvato di sodio | 2 mm |
| Pen / Strep | 2% |
| Desametasone | 1 pM |
| Insulina | 0,1 micron |
| Manutenzione Media | |
| DMEM | 500 ml |
| BSA Fraction V | 0,2% |
| Piruvato di sodio | 2 mm |
| Pen / Strep | 2% |
| Desametasone | 0,1 micron |
| Insulina | 1 nM |
| Starvation media | |
| DMEM | 500 ml |
| BSA Fraction V | 0,2% |
| Piruvato di sodio | 2 mm |
| Pen / Strep | 2% |
Discussione
Il tempo dal sacrificio perfusione deve essere inferiore a 3 minuti per perfusione ideale e collagenasi digestione del fegato. Una volta iniziata la perfusione con perfusione Media, il fegato dovrebbe cambiare immediatamente aspetto a dal rosso al pallido. Dopo circa 10 minuti di incubazione con LDM, il fegato apparirà gonfio e rosa. Nel caso in cui perfusione è insufficiente, il fegato non può presentare tali modifiche, e ciò avrà come risultato una resa minore epatociti.
Dopo le fasi di lavaggio, epatociti isolati possono essere conservati per diverse ore in sospensione su ghiaccio prima placcatura. Una volta placcato, epatociti in coltura richiedono diverse ore per aderire e sparsi. A seguito di 2 ore di incubazione in placcatura Media, epatociti rimarranno piccoli e rotondi. Dopo una notte di incubazione, epatociti assumeranno una più caratteristico aspetto esagonale, molti dei quali saranno binucleate. Se la preparazione è sano, la cells esporrà numerose granulazioni e blebbing occasionale, indicative di morte cellulare. Al fine di mantenere meglio la vitalità della cultura, dei media dovrebbe essere cambiato ogni 24 ore e cura per minimizzare l'esposizione all'aria aperta.
Palmitato di sodio è insolubile in acqua a temperatura ambiente, tuttavia, dopo incubazione a 70 ° C dovrebbe sciogliere completamente. L'esposizione a RT causerà lipide solidificare rapidamente, quindi è imperativo lavorare rapidamente. Una volta palmitato è stato sciolto in Pre-incubazione medio, è fondamentale per mantenere il mezzo a 37 ° C per mantenere la solubilità dei lipidi.
Come accennato in precedenza, per garantire risultati accurati del dosaggio Fatty Acid ossidazione, il mezzo deve essere completamente congelato in azoto liquido. Questo impedisce qualsiasi fuoriuscita di CO 2 durante l'aggiunta di acido perclorico ai pozzetti. Immediatamente dopo l'aggiunta dell'acido perclorico ai campioni congelati, la piastra di dosaggio deve essere strettamente covered dal filtro Piatto di carta, avendo cura di allineare le piastre per il trasferimento del gas tra i pozzi. Poiché la carta da filtro è impregnato con un eccesso di NaOH, la stechiometria della reazione è in grado di catturare il rilasciato CO 2 come NaHCO3. Esperimenti seguono questo protocollo hanno generato risultati riproducibili, con repliche tipici avente% CV ≤ 10. Se necessario, il materiale solubile in acido dallo Fatty Acid ossidazione o assay lisato cellulare dal saggio Lipogenesi, possano essere conservati a -80 ° C e trattati poi senza alcun effetto apprezzabile sui risultati. I saggi sopra descritti consentono un meccanismo relativamente semplice e tempo efficiente per valutare metabolismo lipidico in epatociti primari isolati da fegato di topo. Attraverso l'uso di coltura ex vivo, questi metodi consentono di testare gli effetti delle diverse condizioni di ossidazione degli acidi grassi e lipogenesi. Questo protocollo può essere adattato per valutare il ruolo di alterazioni genetiche su questi proceSSES, tuttavia, l'isolamento di epatociti è limitativo tempo e quindi in vivo analisi può essere più adatto per indagare alcuni modelli animali transgenici. Se è necessario analizzare più preparazioni epatociti, normalizzazione dei valori di analisi a livelli di proteina può essere eseguita come descritto nel passaggio facoltativo 3.7.1 e utilizzato per la normalizzazione. Si consiglia di esperimenti eseguiti in diverse preparazioni essere confrontati i cambiamenti relativi rispetto a un controllo adeguato.
Infine, non abbiamo esplorato la possibilità di periodi più lunghi di cultura, però, gli epatociti possono presentare caratteristiche metaboliche equivalenti dopo diversi giorni di coltura. Con lieve modifica, questo protocollo può essere adattato per consentire diversi trattamenti giorno prima di valutare gli effetti dei composti sul metabolismo lipidico.
Divulgazioni
The authors indicate they have no conflicts of interest.
Riconoscimenti
We would like to acknowledge Susan Gray and Umadevi Chalasani for their help with technical aspects of the hepatocyte isolation protocol. This work was supported by NIDDK grant 5R01DK089185 (to M.P. Cooper) and the DERC Pilot and Feasibility Program at UMMS (to M.P. Cooper).
Materiali
| Name | Company | Catalog Number | Comments |
| Liver Perfusion Medium | Life Technologies | 17701038 | |
| Liver Digest Medium | Life Technologies | 17703034 | Aliquot and store at -20 °C |
| PBS | Corning | 21-040-CV | |
| 10X DPBS | Corning | 46-013-CM | |
| DMEM | Corning | 10-017-CV | |
| FBS | Life Technologies | 26140079 | |
| Collagen | Life Technologies | A1048301 | |
| Colloidal silica coated with polyvinylpyrrolidone | GE Life Sciences | 17-0891-01 | |
| Sodium Pyruvate | Cellgro | 25-000-CI | |
| Penicillin / Streptomycin | Cellgro | 30-001-CI | |
| Insulin | Sigma | I0516-5ML | |
| Dexamethasone | Sigma | D2915-100MG | |
| Albumin (BSA), Fraction V | MP Biomedicals | 103703 | |
| 24-Well Culture Dish | Corning Falcon | 353047 | |
| Tygon S3 Tubing | Cole Parmer | 06460-34 | |
| Male Leur Lock to 200 Barb Connectors | Cole Parmer | 45518-00 | |
| 24G x 3/4" Catheter | SurFlo | SROX2419CA | |
| Perma-Hand Silk Suture | Ethicon | 683G | |
| Cell Strainer | Corning Falcon | 08-771-2 | |
| IsoTemp 3013HD Recirculating Water Bath | Fisher | 13-874-3 | |
| MasterFlex C/L Peristaltic Pump | MasterFlex | HV-77122-24 | |
| Microclamp | Roboz | RS-7438 | Pre-sterilize in autoclave |
| 5” Straight, Blunt-Blunt Operating Scissors | Roboz | RS-6810 | Pre-sterilize in autoclave |
| 24mm Blade Straight, Sharp-point Microdissecting Scissors | Roboz | RS-5912 | Pre-sterilize in autoclave |
| 4” 0.8mm Tip Microdissecting Forceps | Roboz | RS-5130 | Pre-sterilize in autoclave |
| 4” 0.8mm Tip Full Curve Microdissecting Forceps | Roboz | RS-5137 | Pre-sterilize in autoclave |
| 60 mL Syringe | Becton Dickinson | 309653 | |
| 50 mL conical tubes | Corning Falcon | 352070 | |
| BCA Protein Assay | Thermo Scientific | 23225 | |
| Biosafety Cabinet | |||
| CO2 Incubator | |||
| Serological pipets | |||
| 1000, 200, 20 μL pipet and tips |
Riferimenti
- Clark, J. M., Brancati, F. L., Diehl, A. M. The prevalence and etiology of elevated aminotransferase levels in the United States. The American journal of gastroenterology. 98, 960-967 (2003).
- Lazo, M., et al. Prevalence of nonalcoholic Fatty liver disease in the United States: the third national health and nutrition examination survey, 1988-1994. American journal of epidemiology. 178, 38-45 (2013).
- Angulo, P. Nonalcoholic fatty liver disease. The New England journal of medicine. 346, 1221-1231 (2002).
- Adams, L. A., et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 129, 113-121 (2005).
- Feldstein, A. E., et al. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 125, 437-443 (2003).
- Day, C. P., James, O. F. Steatohepatitis: a tale of two 'hits'. Gastroenterology. 114, 842-845 (1998).
- Donnelly, K. L., et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. The Journal of clinical investigation. 115, 1343-1351 (2005).
- Lambert, J. E., Ramos-Roman, M. A., Browning, J. D., Parks, E. J. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 146, 726-735 (2014).
- Parks, E. J., Hellerstein, M. K. Thematic review series: patient-oriented research. Recent advances in liver triacylglycerol and fatty acid metabolism using stable isotope labeling techniques. Journal of lipid research. 47, 1651-1660 (2006).
- Befroy, D. E., et al. Direct assessment of hepatic mitochondrial oxidative and anaplerotic fluxes in humans using dynamic 13C magnetic resonance spectroscopy. Nature medicine. 20, 98-102 (2014).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malaria journal. 6, 169 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon