Method Article
Détermination de oxydation des acides gras et de la lipogenèse dans les hépatocytes primaires de souris
Dans cet article
Résumé
Et la lipogenèse de novo d'acides β oxydation gras constituent des voies métaboliques clés dans des hépatocytes, des voies qui sont perturbées dans plusieurs troubles métaboliques, y compris la maladie du foie gras. Ici, nous démontrons l'isolement des hépatocytes primaires de souris et de décrire la quantification de l'oxydation et de la lipogenèse acide β-gras.
Résumé
Lipid metabolism in liver is complex. In addition to importing and exporting lipid via lipoproteins, hepatocytes can oxidize lipid via fatty acid oxidation, or alternatively, synthesize new lipid via de novo lipogenesis. The net sum of these pathways is dictated by a number of factors, which in certain disease states leads to fatty liver disease. Excess hepatic lipid accumulation is associated with whole body insulin resistance and coronary heart disease. Tools to study lipid metabolism in hepatocytes are useful to understand the role of hepatic lipid metabolism in certain metabolic disorders.
In the liver, hepatocytes regulate the breakdown and synthesis of fatty acids via β-fatty oxidation and de novo lipogenesis, respectively. Quantifying metabolism in these pathways provides insight into hepatic lipid handling. Unlike in vitro quantification, using primary hepatocytes, making measurements in vivo is technically challenging and resource intensive. Hence, quantifying β-fatty acid oxidation and de novo lipogenesis in cultured mouse hepatocytes provides a straight forward method to assess hepatocyte lipid handling.
Here we describe a method for the isolation of primary mouse hepatocytes, and we demonstrate quantification of β-fatty acid oxidation and de novo lipogenesis, using radiolabeled substrates.
Introduction
Non-alcoholic fatty liver disease is one of the leading causes of liver disease in Westernized cultures1,2. Lipid accumulation within the liver is associated with cell death, fibrosis, and liver failure via yet unknown mechanisms3-6. In fatty liver disease, hepatocyte-mediated β-fatty acid oxidation and de novo lipogenesis are important determinants of net lipid accumulation7,8. This article will, therefore, focus on hepatocyte isolation, followed by quantification of β-fatty acid oxidation and de novo lipogenesis.
Numerous methodologies have been developed to interrogate hepatocyte lipid metabolism. Though it is possible to measure metabolism of fat in vivo using stable isotopes9,10, these methods are costly, and require large numbers of animals. Additionally, the ability to investigate the effect of exogenous chemicals is limited due to the nature of in vivo experimentation. In contrast, the isolation of primary hepatocytes from mouse liver provides an affordable avenue to pursue11. Furthermore, studying hepatocytes in culture allows investigators to study the effects of varying chemicals on lipid processing while circumventing the difficulties of in vivo experimentation. Finally, isolated hepatocytes avoid any confounding from varying genetics since they are derived from the liver of a single animal.
Here we isolate and culture of hepatocytes, and we measure β-fatty acid oxidation and de novo lipogenesis, using radiolabeled palmitate. The protocol detailed below is straight forward, effective, and reproducible.
Protocole
Tout l'expérimentation animale doit être effectuée conformément aux réglementations locales et fédérales et avec l'approbation d'une administration institutionnelle IACUC et de sûreté radiologique.
1. Préparation
- Plusieurs jours avant l'essai, décongeler la bouteille de foie Digest moyenne (LDM) de 500 ml et de recongeler ~ 35 ml aliquotes dans 50 ml tubes coniques. Conserver à -20 ° C jusqu'à ce que nécessaire.
- Un jour avant le test, pré-stérilisation des outils de dissection propres en autoclave.
- Le jour du dosage, la quantité nécessaire de traiter des plaques de culture à 24 puits avec du collagène.
- Mélanger une partie de 3 mg / ml de collagène de queue de rat avec 50 parties de PBS. Ajouter environ 500 ul à chaque puits d'une plaque de 24 puits et incuber pendant 3-5 min à température ambiante (RT). Retirez le collagène et laisser la plaque sécher à l'air dans le capot. Répétez au moins une fois supplémentaire.
Remarque: Un revêtement de collagène peut être effectuée jusqu'à une semaine à l'annonceVance et plaques conservées à 4 ° C scellée dans une pellicule plastique.
- Mélanger une partie de 3 mg / ml de collagène de queue de rat avec 50 parties de PBS. Ajouter environ 500 ul à chaque puits d'une plaque de 24 puits et incuber pendant 3-5 min à température ambiante (RT). Retirez le collagène et laisser la plaque sécher à l'air dans le capot. Répétez au moins une fois supplémentaire.
- Préparer LDM de dosage: Dégel LDM et chaude à 37 ° C et ajuster le pH à 7,4 en utilisant 1 N KOH. Filtre utilisant le filtre de seringue de 0,2 um et placer dans un 42 ° C bain d'eau de recirculation.
- Chaud 25 ml de Foie perfusion du milieu à 42 ° C en recirculation bain d'eau.
- Préparer 90% de silice colloïdale revêtue avec une solution de polyvinylpyrrolidone: Ajouter 1 ml de DPBS 10x à 9 ml de la silice colloïdale revêtue de polyvinylpyrrolidone. Ajuster le pH à 7,4 en utilisant du HCl 0,1N. Filtrer avec un filtre à seringue de 0,2 um stérile. Stocker à température ambiante.
- Chaud Placage moyenne à 37 ° C.
2. Isolement des hépatocytes primaires de souris
- Mettre en place une pompe péristaltique, les tubes et table de dissection: Stériliser tube par rinçage avec de l'éthanol 5 ml de 70% dans l'eau distillée, puis 10 ml d'eau stérile. Placez les tubes dans le foie perfusion du milieu et de faire fonctionner la pompe à comblertoute la longueur du tube.
- Sacrifiez la souris par la méthode institutionnellement approuvé.
- Disséquer ouvert la cavité abdominale: Vaporiser l'abdomen de souris généreusement avec 70% d'éthanol. Avec des ciseaux extrémités franches, faire une incision médiane à travers le derme de la longueur de l'abdomen et de réfléchir latéralement. Faire une incision similaire dans le péritoine pour exposer les viscères.
- L'utilisation d'un instrument contondant, déplacer doucement les intestins pour exposer le système vasculaire abdominale Localiser la veine cave inférieure abdominale (IVC) et placer une suture sous le vaisseau sanguin, distale de la veine rénale
- Distale par rapport à la suture, placer une aiguille et le cathéter dans la veine cave inférieure, avançant au-delà du niveau de la suture. Avec l'aiguille toujours en place, attachez le fil de suture autour du cathéter pour le maintenir en place. Retirez délicatement l'aiguille. Si fait correctement, le sang avec un débit à travers le cathéter.
- En utilisant une pipette, remplir l'espace restant dans le cathéter avec milieu de perfusion, assurantque l'air est présent. Avec grand soin, fixer le tuyau au cathéter.
- Disséquer la cavité ouverte du poumon: refléter doucement les lobes du foie supérieurs à exposer le diaphragme. Percer délicatement la membrane avec des ciseaux à bout pointu, puis faire une incision latérale pour exposer la cavité pleurale, en prenant soin d'éviter la vésicule biliaire et le système vasculaire pleural. Placez une pince bulldog autour de la veine cave inférieure thoracique juste en amont de la veine hépatique.
- Couper la veine porte et tourner sur la pompe à 3 - 4 ml / min. Perfuser le foie foie avec perfusion du milieu pendant 5 min en utilisant environ 20 ml de milieu de perfusion.
Remarque: Le foie doit immédiatement changer du rouge au gris / beige. Si des parties du foie restent en rouge, cela indique probablement une mauvaise perfusion, et la probabilité d'isolement réussi est fortement diminuée. Au cours de la perfusion, soyez prudent pour assurer le support ne fonctionne pas et qu'il n'y a pas de bulles entrent dans le tube. - Suite à l'incubation 5 min, arrêtla pompe et le transfert de la tubulure à foie Digest moyenne. Redémarrez la pompe et perfuser le foie pendant 10 - 15 min (jusqu'à ce que le milieu est épuisé).
- A la fin de la perfusion, arrêter la pompe. Le foie doit avoir une teinte rosée et semblent quelque peu élargie. Exciser le foie par dissection minutieuse. Retirer la vésicule biliaire et de transférer le foie à 10 cm boîte de culture de tissu.
- Dans une enceinte de sécurité biologique, ajouter 10 ml de placage moyenne (tableau 1) pour le foie. Gratter délicatement le foie en utilisant soit des forceps ou un scalpel pour enlever les hépatocytes. On filtre la suspension en utilisant un tamis cellulaire 100 um et transférer dans un tube conique de 50 ml. Laver la plaque avec 10 ml supplémentaires de milieu d'étalement et la piscine dans le tube conique de 50 ml.
- Pellet les cellules par centrifugation pendant 5 minutes à 350 xg, 4 ° C.
- Milieu de Aspirer et remettre le culot dans 10 ml de milieu d'étalement et ajouter 10 ml de 90% de silice colloïdale revêtue d'polyvinylpyrrolidone. Mélanger délicatement et centrifuger comme dans l'étape 2.11. Après centrifugation, une couche de cellules mortes sera flottant sur le dessus du mélange, tandis que les cellules vivantes se sédimenter au fond.
- Aspirer Les cellules mortes et moyen. Laver 2 fois avec 20 ml de milieu d'étalement, centrifugeuse que dans 2.11.
- Resuspendre les cellules dans 10 ml de milieu d'étalement. Compter les cellules avec un hémocytomètre et placer 9 x 10 4 cellules / puits dans 24 puits des boîtes de culture de collagène traitée. Incuber à 37 ° C une culture tissulaire incubateur pendant 2 heures. Chaque plaque peut être utilisé soit pour le dosage des acides gras oxydation ou l'essai de la lipogénèse.
- Eventuellement, changer puits de milieu d'entretien (tableau 1) et de la culture à 37 ° C. Les cellules peuvent être cultivées pour 2 - 3 jours sans affecter les résultats d'analyse.
3. oxydation des acides gras Assay
Avertissement: l'utilisation de la radioactivité peut être dangereux. Tout achat, l'entreposage, la manipulation, et disposal de matières radioactives doit être réalisée en conformité avec, l'état et les règlements et les lignes directrices fédérales institutionnels.
- 16 - 20 h avant l'essai, laver les cellules 2 fois avec du PBS chaud. Changer les cellules à Sérum famine du milieu sans sérum (tableau 1) avec 20 nM de glucagon et incuber une nuit à 37 ° C.
Remarque: En raison sérum fœtal bovin contient une concentration inconnue d'hormones métaboliques (par exemple de l'insuline, le glucagon), le sérum affamer les cellules pour enlever les effets de confusion que cela peut avoir sur le dosage. Les cellules sont viables dans le sérum famine moyen pour> 24 heures. Traitement de glucagon est utilisé pour stimuler l'oxydation des acides gras dans les hépatocytes. - Le matin de l'essai, préparer la pré-incubation moyenne: Reprendre une quantité appropriée de sodium palmitate dans l'eau ultra pure pour faire une solution 100 mM et de la chaleur à 70 ° C pendant 10 min. Dans le même temps, préparer la quantité requise (0,5 ml par puits d'une plaque de 24 puits)de DMEM avec 25 mM de HEPES, 1% de BSA Fraction V, et 20 nM de glucagon. Chauffer à 37 ° C.
- Une fois solubilisé, palmitate d'ajouter à une concentration finale de 250 uM dans le milieu. Changer hépatocytes de pré-incubation moyenne et incuber à 37 ° C pendant 2 heures. Réserver une partie de pré-incubation moyenne à 37 ° C pour une utilisation ultérieure.
- Au cours de l'incubation, on sèche une quantité appropriée de 14 C-palmitate (0,5 uCi / puits) par evaporation sous azote gazeux.
- Par exemple, pour mesurer 24 échantillons dans une plaque de 24 puits, transférer 120 ul de 0,1 pCi / ml 14 C-palmitate à un tube de 1,5 ml. Évaporer lentement le solvant par soufflage d'azote gazeux sur la solution à une distance de 3-5 cm dans une hotte éthanol. Le solvant doit s'évaporer à environ 30 - 40 min, en laissant sécher 14 C-palmitate dans le fond du tube.
- A environ 15 min avant la fin de l'incubation, le 14 remettre en suspensionC-palmitate dans NaOH 0,1 N (12,5 ul / uCi). Incuber à 70 ° C pendant 10 min. Ajouter trois volumes de chaleur pré-incubation moyenne et mélanger par pipetage de haut en bas.
- De Spike chaque puits avec 25 pi de dilution 14 C-palmitate. Mélanger en secouant délicatement la plaque et incuber à 37 ° C pendant 90 min. Ceci est la plaque d'essai.
- Au cours de l'incubation, préparer la plaque de filtre en papier (Figure 1).
- Retirez le couvercle d'une plaque de 24 puits stérile. Placer une 2 cm x 2 cm morceau de papier-filtre dans le fond de chacun des puits. Superposez la plaque avec un morceau de 4 "x 7" parafilm.
- En utilisant un grand objet rectangulaire, comme une boîte de pointe de micropipette, frotter le parafilm sur les puits de perforer le parafilm au niveau des ouvertures de puits et de créer un joint sur le reste de la plaque. Retirez les cercles perforés de parafilm couvrant désormais les puits. La plaque devrait maintenant être bien couvert avec du parafilm dans tous les domaines, sauf le bien openings.
- 10 min avant la fin de l'incubation, ajouter 200 pi de NaOH 3 N à chaque puits de la plaque de papier filtre, assurant que le papier filtre absorbe la totalité du liquide.
- Eventuellement avant la congélation, transférer le support à une plaque de 24 puits fraîche. Après avoir lavé une fois avec PBS, la lyse des cellules restantes dans HCl 0,1 N et de calculer la teneur en protéines par dosage BCA.
- À la fin de l'incubation, composant logiciel enfichable geler la plaque de dosage dans l'azote liquide. Soyez prudent pour assurer chaque puits est complètement gelé avant de poursuivre.
- Ajouter 100 ul d'acide perchlorique à 70% à chaque puits de la plaque de dosage. Couvrir immédiatement avec la plaque de filtre en papier. Placez les plaques sur un agitateur orbital et de la roche à la vitesse orbitale de 80 min à température ambiante pendant 2 h.
- Après l'incubation, traiter les échantillons:
- Pour mesurer la fraction de CO 2, le transfert des carrés de papier filtre à 4 ml de fluide de scintillation liquide dans un compteur à scintillationflacon et mesure 14 C signal.
- Pour mesurer la matière soluble dans l'acide, transférer 400 pi de milieu dans un tube de 1,5 ml. Centrifuger à vitesse maximale pendant 10 min. Ajouter 100 ul de surnageant résultant à 500 ul de 2: 1 de chloroforme-méthanol (v / v), et vortex brièvement.
- Ajouter 250 ul d'eau au mélange, et de nouveau vortex. Centrifuger les échantillons pendant 10 min à 3000 x g. Transfert 200 ul de la phase supérieure à 4 ml de fluide de scintillation liquide dans un flacon à scintillation et la mesure 14 signal C.
4. lipogenèse Assay
- Le soir avant de commencer l'essai, se laver les cellules 2 fois avec du PBS chaud. Modifiez les hépatocytes au sérum famine moyenne avec 100 nM d'insuline. Incuber une nuit à 37 ° C.
Remarque: En raison sérum fœtal bovin contient une concentration inconnue d'hormones métaboliques (par exemple l'insuline, le glucagon), Le sérum affamer les cellules pour enlever les effets de confusion que cela peut avoir sur le dosage. Les cellules sont viables dans le sérum famine moyen pour> 24 heures. L'insuline est utilisé dans cet essai à stimuler la lipogenèse. - Faire la lipogénèse moyenne: Sérum famine moyenne avec 100 nM d'insuline, 10 pm acétate froid et 0,5 uCi 3 H-acétate par puits. Changer cellules à la lipogénèse moyen et incuber à 37 ° C pendant 2 heures. Comprennent des composés d'intérêt à être testés.
- Après la période d'incubation, les cellules laver 2 fois avec du PBS. Lyse cellules par grattage dans 120 ul de HCl 0,1. Reserve 10 pi pour le dosage de la protéine (évaluer par dosage BCA), et le transfert de 100 pi à tube de 1,5 ml.
- Extraction des lipides par l'addition de 500 ul de 2: 1 de chloroforme et de methanol (v / v). Vortex brièvement et incuber à température ambiante pendant 5 min. Ajouter 250 ul d'eau, vortex et incuber à température ambiante pendant 5 min de plus. Centrifuger les échantillons 10 min à 3000 xg, RT. Soigneusementtransférer phase inférieure à 4 ml de fluide de scintillation liquide dans un flacon à scintillation et mesurer l'activité de H 3.
Résultats
Isolements d'hépatocytes entraînent généralement en 1 - 3 x 10 7 cellules totales. Après une nuit d'incubation, les cellules apparaissent hexagonal, dont la plupart seront binucléées (figure 2). Les cellules saines devraient être dépourvu de granulations ou des bulles, qui sont indicatifs de la mort cellulaire.
En général, le dosage oxydation des acides gras est exécuté dans trois à quatre répétitions par composé d'essai. Compte pour les CO 2 échantillons sont environ un cinquième de ceux provenant de la matière soluble dans l'acide. On calcule typiquement le rapport de CO 2 à la matière soluble dans l'acide en tant que mesure de l'oxydation complète (à savoir, la quantité oxydé par l'intermédiaire du cycle de l'acide citrique). Les substances qui favorisent la respiration cellulaire, tels que le cyanure de carbonyle-4- (trifluorométhoxy) phénylhydrazone (FCCP) se déplacera vers ce ratio CO 2, ce qui indique une oxydation plus via le cycle de Krebs. Les inhibiteurs de la chaîne respiratoire diminueront oxydation dans l'ensemble(Figure 3). Lorsque ce dosage de pilotage, il est préférable d'inclure un contrôle sans cellule pour vérifier la procédure est la production de l'activité spécifique de la cellule.
La lipogenèse dosage est le plus souvent comparé à un contrôle de timepoint zéro (des cellules traitées avec le substrat immédiatement avant la récolte). Le dosage devrait être linéaire en fonction du temps par le biais d'au moins quatre heures d'incubation. Les composés qui favorisent l'oxydation des acides gras, tels que FCCP, ou diminuent la synthèse de l'ATP, tels que oligomycine, réduisent l'activité lipogène (figure 4).
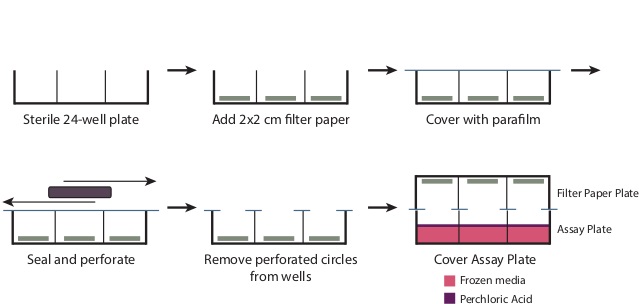
Figure 1: Préparation de la plaque de filtration Pour préparer la plaque de filtre tel que décrit dans l'étape 3.6, retirez le couvercle d'une plaque de 24 puits stérile. Placez un 2 cm x 2 cm morceau de papier filtre à la base de chaque puits. Superposer l'ensemble de la plaque avec un 7 "x 4" morceau de parale film, et frotter la plaque pour sceller hermétiquement le haut du puits. Cela va générer des cercles perforés de parafilm sur les ouvertures et qui devraient être supprimés. Après addition de l'acide perchlorique à l'étape 3.9, placez la plaque filtre en papier serré sur la plaque d'essai pour produire un joint.
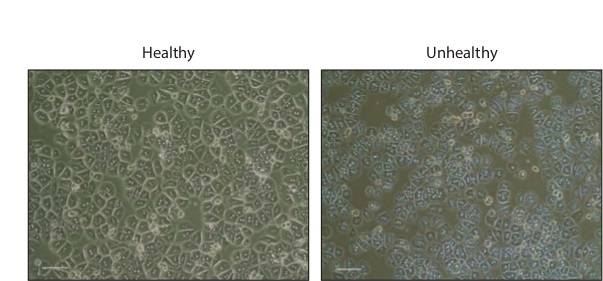
Figure 2: Les hépatocytes primaires en culture contraste de phase images d'hépatocytes de souris saines et malsaines primaire 16 h après étalement dans revêtues de collagène plaques à 24 puits. La barre d'échelle, 200 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
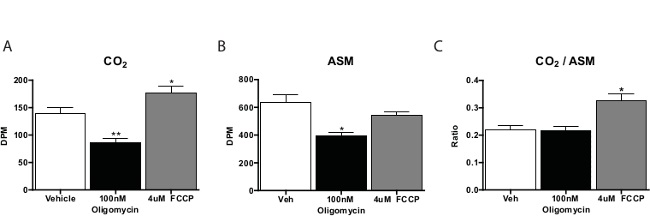
Figure 3: oxydation des acides gras par Primary Souris Les hépatocytes en culture 14 d'oxydation C-Palmitate de (A) CO 2, la matière soluble (B) de l'acide, et (C) le rapport de CO 2 à la matière soluble dans l'acide à partir des hépatocytes primaires incubés avec le véhicule, FCCP, ou oligomycine. Les données sont la moyenne ± SEM. * p <0,05, ** p <0,01 par rapport au véhicule par le test t de Student unilatéral. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: la lipogenèse dans les hépatocytes de souris en culture primaire (A) de l'activité en fonction du temps lipogénique dans les hépatocytes primaires traités avec 3 H-acétate et (B) l'activité lipogénique en présence du véhicule, oligomycine ou FCCP. Les données sont la moyenne ± SEM. *** p <0,001 vs véhicule par le test t de Student unilatéral.
| Tableau 1 | |
| Culture Media | |
| Placage moyen | |
| DMEM | 500 ml |
| FBS | 10% |
| Pyruvate de sodium | 2 mM |
| Pen / Strep | 2% |
| Dexaméthasone | 1 pM |
| L'insuline | 0,1 pM |
| Maintenance Medium | |
| DMEM | 500 ml |
| BSA Fraction V | 0,2% |
| Pyruvate de sodium | 2 mM |
| Pen / Strep | 2% |
| Dexaméthasone | 0,1 pM |
| L'insuline | 1 nM |
| La famine moyen | |
| DMEM | 500 ml |
| BSA Fraction V | 0,2% |
| Pyruvate de sodium | 2 mM |
| Pen / Strep | 2% |
Discussion
Le temps de sacrifice de perfusion doit être inférieur à 3 min pour la perfusion de collagénase et idéal digestion du foie. Une fois la perfusion avec perfusion du milieu est initiée, le foie doit immédiatement changer d'apparence à du rouge à jaune pâle. Après environ 10 minutes d'incubation avec LDM, le foie apparaît enflée et rose. Dans le cas où la perfusion est insuffisante, le foie ne peut pas présenter ces changements, et ce sera typiquement conduire à un rendement plus faible des hépatocytes.
Après les étapes de lavage, des hépatocytes isolés peuvent être stockés pendant plusieurs heures en suspension sur de la glace avant le placage. Une fois plaqué, hépatocytes cultivés nécessitent plusieurs heures pour adhérer et étalés. Après 2 heures d'incubation en milieu d'étalement, les hépatocytes resteront petites et rondes. Après une nuit d'incubation, les hépatocytes vont prendre un aspect plus caractéristique hexagonale, dont beaucoup seront binucléées. Si la préparation est malsain, la caunes exposera de nombreuses granulations et blebbing occasionnelle, indicatifs de la mort cellulaire. Afin de maintenir la meilleure viabilité de la culture, les médias doivent être changés tous les 24 h et pris soin de minimiser l'exposition à l'air libre.
Palmitate de sodium est insoluble dans l'eau à la température ambiante, cependant, après incubation à 70 ° C il convient de dissoudre complètement. L'exposition à la RT va provoquer le lipide se solidifier rapidement, il est donc impératif de travailler rapidement. Une fois que le palmitate a été dissous dans de pré-incubation moyen, il est essentiel de maintenir le milieu à 37 ° C afin de maintenir la solubilité des lipides.
Comme mentionné ci-dessus, pour garantir des résultats précis à partir de l'essai oxydation des acides gras, le milieu doit être complètement congelée dans de l'azote liquide. Ceci permet d'éviter toute fuite de CO 2 au cours de l'addition d'acide perchlorique dans les puits. Immédiatement après l'addition de l'acide perchlorique pour les échantillons congelés, la plaque de dosage doit être étroitement covered par le papier filtre Plate, en veillant à aligner les plaques pour le transfert de gaz entre les puits. Etant donné que le papier filtre est imprégné avec un excès de NaOH, la stoechiométrie de la réaction est capable de capturer le CO 2 libéré en NaHCO 3. Les expériences ci-après ce protocole ont généré des résultats reproductibles, avec des répétitions typiques possédant% CV ≤ 10. Si nécessaire, la matière soluble dans l'acide à partir de l'oxydation des acides gras essai ou le lysat cellulaire à partir de l'analyse de la lipogénèse sont susceptibles d'être conservés à -80 ° C et traité plus tard, sans aucun effet notable sur les résultats. Les essais décrits ci-dessus permettent un mécanisme efficace relativement simple et le temps d'évaluer le métabolisme des lipides dans les hépatocytes primaires isolées de foie de souris. Grâce à l'utilisation de la culture ex vivo, ces procédés permettent de tester les effets de diverses conditions sur l'oxydation des acides gras et la lipogenèse de. Ce protocole peut être adapté pour évaluer le rôle de ces altérations génétiques sur procépetites entreprises, cependant, l'isolement des hépatocytes est temps de limitation et ainsi les analyses in vivo peut être plus approprié pour étudier certains des modèles animaux transgéniques. Si l'analyse de multiples préparations d'hépatocytes est nécessaire, la normalisation des valeurs de dosage à des taux de protéines peut être effectuée comme décrit dans l'étape facultative 3.7.1 et utilisée pour la normalisation. Nous recommandons essais effectués dans de multiples préparations être comparés que les changements relatifs par rapport à un contrôle approprié.
Enfin, nous avons pas exploré la possibilité de périodes de culture plus longues, cependant, les hépatocytes peuvent présenter des caractéristiques métaboliques équivalentes après plusieurs jours de culture. Avec une légère modification, ce protocole peut être adapté pour permettre plusieurs traitements de jour avant d'évaluer les effets des composés sur le métabolisme lipidique.
Déclarations de divulgation
The authors indicate they have no conflicts of interest.
Remerciements
We would like to acknowledge Susan Gray and Umadevi Chalasani for their help with technical aspects of the hepatocyte isolation protocol. This work was supported by NIDDK grant 5R01DK089185 (to M.P. Cooper) and the DERC Pilot and Feasibility Program at UMMS (to M.P. Cooper).
matériels
| Name | Company | Catalog Number | Comments |
| Liver Perfusion Medium | Life Technologies | 17701038 | |
| Liver Digest Medium | Life Technologies | 17703034 | Aliquot and store at -20 °C |
| PBS | Corning | 21-040-CV | |
| 10X DPBS | Corning | 46-013-CM | |
| DMEM | Corning | 10-017-CV | |
| FBS | Life Technologies | 26140079 | |
| Collagen | Life Technologies | A1048301 | |
| Colloidal silica coated with polyvinylpyrrolidone | GE Life Sciences | 17-0891-01 | |
| Sodium Pyruvate | Cellgro | 25-000-CI | |
| Penicillin / Streptomycin | Cellgro | 30-001-CI | |
| Insulin | Sigma | I0516-5ML | |
| Dexamethasone | Sigma | D2915-100MG | |
| Albumin (BSA), Fraction V | MP Biomedicals | 103703 | |
| 24-Well Culture Dish | Corning Falcon | 353047 | |
| Tygon S3 Tubing | Cole Parmer | 06460-34 | |
| Male Leur Lock to 200 Barb Connectors | Cole Parmer | 45518-00 | |
| 24 G x 3/4" Catheter | SurFlo | SROX2419CA | |
| Perma-Hand Silk Suture | Ethicon | 683G | |
| Cell Strainer | Corning Falcon | 08-771-2 | |
| IsoTemp 3013HD Recirculating Water Bath | Fisher | 13-874-3 | |
| MasterFlex C/L Peristaltic Pump | MasterFlex | HV-77122-24 | |
| Microclamp | Roboz | RS-7438 | Pre-sterilize in autoclave |
| 5” Straight, Blunt-Blunt Operating Scissors | Roboz | RS-6810 | Pre-sterilize in autoclave |
| 24 mm Blade Straight, Sharp-point Microdissecting Scissors | Roboz | RS-5912 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Microdissecting Forceps | Roboz | RS-5130 | Pre-sterilize in autoclave |
| 4” 0.8 mm Tip Full Curve Microdissecting Forceps | Roboz | RS-5137 | Pre-sterilize in autoclave |
| 60 ml Syringe | Becton Dickinson | 309653 | |
| 50 ml conical tubes | Corning Falcon | 352070 | |
| BCA Protein Assay | Thermo Scientific | 23225 | |
| Biosafety Cabinet | |||
| CO2 Incubator | |||
| Serological pipets | |||
| 1,000, 200, 20 μl pipet and tips |
Références
- Clark, J. M., Brancati, F. L., Diehl, A. M. The prevalence and etiology of elevated aminotransferase levels in the United States. The American journal of gastroenterology. 98, 960-967 (2003).
- Lazo, M., et al. Prevalence of nonalcoholic Fatty liver disease in the United States: the third national health and nutrition examination survey, 1988-1994. American journal of epidemiology. 178, 38-45 (2013).
- Angulo, P. Nonalcoholic fatty liver disease. The New England journal of medicine. 346, 1221-1231 (2002).
- Adams, L. A., et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 129, 113-121 (2005).
- Feldstein, A. E., et al. Hepatocyte apoptosis and fas expression are prominent features of human nonalcoholic steatohepatitis. Gastroenterology. 125, 437-443 (2003).
- Day, C. P., James, O. F. Steatohepatitis: a tale of two 'hits'. Gastroenterology. 114, 842-845 (1998).
- Donnelly, K. L., et al. Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease. The Journal of clinical investigation. 115, 1343-1351 (2005).
- Lambert, J. E., Ramos-Roman, M. A., Browning, J. D., Parks, E. J. Increased de novo lipogenesis is a distinct characteristic of individuals with nonalcoholic fatty liver disease. Gastroenterology. 146, 726-735 (2014).
- Parks, E. J., Hellerstein, M. K. Thematic review series: patient-oriented research. Recent advances in liver triacylglycerol and fatty acid metabolism using stable isotope labeling techniques. Journal of lipid research. 47, 1651-1660 (2006).
- Befroy, D. E., et al. Direct assessment of hepatic mitochondrial oxidative and anaplerotic fluxes in humans using dynamic 13C magnetic resonance spectroscopy. Nature medicine. 20, 98-102 (2014).
- Goncalves, L. A., Vigario, A. M., Penha-Goncalves, C. Improved isolation of murine hepatocytes for in vitro malaria liver stage studies. Malaria journal. 6, 169 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon